Beruflich Dokumente
Kultur Dokumente
Salting in, efecto de las sales sobre solubilidad proteínas
Hochgeladen von
Dianitha Gutiérrez GutiérrezOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Salting in, efecto de las sales sobre solubilidad proteínas
Hochgeladen von
Dianitha Gutiérrez GutiérrezCopyright:
Verfügbare Formate
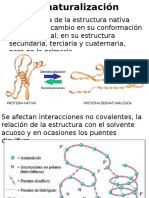
Efecto de las sales sobre la solubilidad de las protenas Las sales neutras como el cloruro de sodio, el cloruro de calcio,
el sulfato de amonio y los fosfatos tienen una influencia marcada en la solubilidad de las protenas, especialmente las globulares. Su efecto para modificar la solubilidad de la protena depende de la concentracin y numero de cargas que aporte (cationes y aniones) lo que se conoce generalmente por fuerza inica. Las sales modifican la estructura del agua e influyen tambin en la conformacin de las protenas mediante interacciones electrostticas. Esto hace que, en funcin de la fuerza inica, las sales puedan solubilizar o precipitar a las protenas. Cuando a un sistema proteico se le adicionan sales neutras en concentraciones menores a 1.0 M, las protenas incrementan su solubilidad, esto se conoce como salting in. A concentraciones mayores que 1.0 M, tienden a precipitar esto se conoce como salting out.
Salting in El salting in es el fenmeno por el cual la concentracin de sal aumenta la solubilidad de la protena. Desde la teora de Debye-Hckel, el aumento de la concentracin de contraiones reduce las interacciones electrostticas entre macroiones, protegindolos de los dems. Hasta cierto punto, la adicin de ms contraiones (es decir, el aumento de la fuerza inica, I) ayuda a disolver una protena. Esta tcnica se conoce como salting in. Debido a que las protenas de diferentes responden de manera diferente a la misma concentracin de sal, tanto salting in y salting out se pueden usar para purificar protenas. El efecto salting in se da cuando se le adiciona a un sistema proteica concentraciones menores a 1.0 M de sales neutras. Los cationes y aniones de estas sales reaccionan con los grupos ionizables de las protenas y de esta manera evita que se establezcan interacciones entre las cadenas laterales o extremos terminales cargados de las protenas.
Ejemplo: La adicin de cloruro de sodio en la elaboracin de embutido crnicos, tiene su efecto sobre las protenas de la carne; se basa en que la actiomisina es una protena insoluble en agua, pero relativamente soluble en soluciones de alta fuerza inica. El efecto salting in es el siguiente:
Los iones salinos tienen la capacidad de hidratacin y provocan un aumento de la cantidad de agua retenida por la protena, aumentando asi la capa de solvatacin.
En la elaboracin de embutidos crnicos, operaciones como el picado, causan ruptura fsica al tejido miofibrilar, mas una adicin de NaCl a una fuerza inica mayor de 0.6, provoca que en el picado se cause la exposicin de grupos polares y la disminucin de interacciones protena-protena y la retencin de mas molculas de agua.
Salting out Tambin conocido como cristalizacin antidisolvente, la cristalizacin de la precipitacin, o ahogando, es un mtodo de separacin de protenas basado en el principio de que las protenas son menos solubles en altas concentraciones de sal. Es la manera ms comn de precipitar protenas. La concentracin de sal necesaria para que la protena se precipite de la solucin es diferente para cada protena. Este proceso tambin se utiliza para concentrar soluciones diluidas de protenas. La dilisis puede ser usada para remover la sal si es necesario. Principio
Hay aminocidos hidrofbicos y aminocidos hidroflicos en las molculas de las protenas. Despus del plegamiento de las protenas en solucin acuosa, los aminocidos hidrofbicos forman generalmente las reas protegidas, mientras que aminocidos hidroflicos interactan con las molculas de solvatacin y permiten que las protenas formen enlaces de hidrgeno con las molculas de agua circundantes. Si una cantidad suficiente de la superficie de la protena es hidroflico, la protena puede ser disuelta en agua. Cuando la concentracin de sal es mayor, algunas de las molculas de agua son atradas por los iones de sal, lo que disminuye el nmero de molculas de agua disponibles para interactuar con la parte de carga de la protena. Como resultado de la creciente demanda de las molculas del disolvente, las interacciones protena-protena son ms fuertes que las interacciones disolvente-soluto, las molculas de protenas se coagulan, formando las interacciones hidrofbicas entre s. Este proceso se conoce como la salting out. Aplicacin
Como las protenas tienen diferentes composiciones de aminocidos, las molculas de protenas diferentes precipitan a diferentes concentraciones de solucin salina. Las protenas no deseadas se pueden eliminar de una mezcla de solucin de protena mediante el salting out siempre y cuando la solubilidad de la protena en diferentes concentraciones de solucin salina se conozca. Despus de eliminar el precipitado
por filtracin o centrifugacin , la protena deseada puede ser desencadenada por una alteracin de la concentracin de sal en el nivel en el que la protena deseada se convierte en insoluble. Ciertos iones puede aumentar la solubilidad de una protena, cuando la concentracin de los iones aumenta, en lugar de disminuir la solubilidad de la protena. Tambin algunos iones pueden desnaturalizar ciertas protenas por lo que si en los ensayos de la funcin de las protenas tienen la intencin y despus un in diferente o un mtodo de purificacin alternativa debe ser utilizado. En un intento de retirar un producto del agua, el NaCl se utiliza a menudo para aumentar la fuerza inica del agua, aumentando as su polaridad, y despus el producto se mueve a la capa orgnica que se puede extraer. A altas fuerzas inicas, la solubilidad de las protenas disminuye, este fenmeno es conocido como salting out.
Das könnte Ihnen auch gefallen
- Salting in/out proteínasDokument4 SeitenSalting in/out proteínasMaria Sanchez100% (7)
- EFECTO SALTING FisicoDokument3 SeitenEFECTO SALTING FisicoEsmeralda AcostaNoch keine Bewertungen
- Efecto de Las Sales Sobre LaDokument1 SeiteEfecto de Las Sales Sobre LaReyes OdraNoch keine Bewertungen
- Salting in - OutDokument2 SeitenSalting in - OutJuan Lopez67% (3)
- Efectos de La Adición de Sal (Salting-In) yDokument11 SeitenEfectos de La Adición de Sal (Salting-In) yMoy GPNoch keine Bewertungen
- Clasificación de Las ProteínasDokument3 SeitenClasificación de Las ProteínasZulyNoch keine Bewertungen
- Métodos Analíticos de Solubilidad y Precipitación de Las ProteínasDokument8 SeitenMétodos Analíticos de Solubilidad y Precipitación de Las ProteínasAnyi CamilaNoch keine Bewertungen
- Resultados y Discusion de ResultadosDokument4 SeitenResultados y Discusion de ResultadosCésar Fernando Melquiades BravoNoch keine Bewertungen
- Solubilización AlcalinaDokument6 SeitenSolubilización AlcalinaVictor Alfredo Tupac Yupanqui CarlottoNoch keine Bewertungen
- Qa Informe 2 FinalDokument21 SeitenQa Informe 2 FinalJoselinOreNoch keine Bewertungen
- Fraccionamiento de Proteinas Por Precipitacion SalinaDokument2 SeitenFraccionamiento de Proteinas Por Precipitacion Salinajomalop71% (7)
- Salting in Salting Out Precipitacion Solventes PDFDokument5 SeitenSalting in Salting Out Precipitacion Solventes PDFveronicaNoch keine Bewertungen
- Salting in Salting Out Precipitacion Solventes PDFDokument5 SeitenSalting in Salting Out Precipitacion Solventes PDFjonatan mvNoch keine Bewertungen
- Problemario Que Afectan La Solubilidad de Las Proteinas 2Dokument5 SeitenProblemario Que Afectan La Solubilidad de Las Proteinas 2alonso vargas SuárezNoch keine Bewertungen
- Determinación de La Acidez Total de Un VinagreDokument8 SeitenDeterminación de La Acidez Total de Un VinagreHanz Pichilingue CruzNoch keine Bewertungen
- Propiedades Generales de La ProteínasDokument7 SeitenPropiedades Generales de La ProteínasJulian VillanuevaNoch keine Bewertungen
- Informe AlimentosDokument9 SeitenInforme AlimentosJorgePedrozoCalderonNoch keine Bewertungen
- Aislamiento de ProteínasDokument5 SeitenAislamiento de ProteínasCarlos AONoch keine Bewertungen
- Técnica de salting out: separación de proteínasDokument10 SeitenTécnica de salting out: separación de proteínasVic LightYear100% (2)
- Solubilidad proteínas laboratorioDokument12 SeitenSolubilidad proteínas laboratorioCristian Velásquez0% (1)
- Propiedades Funcionale de Las Proteinas PDFDokument7 SeitenPropiedades Funcionale de Las Proteinas PDFBrian Guillermo Bustamante86% (7)
- Práctica 4 Precipitación Separación y Punto Isoeléctrico de ProteínasDokument3 SeitenPráctica 4 Precipitación Separación y Punto Isoeléctrico de ProteínasPablo Mármol67% (6)
- 1 MergedDokument131 Seiten1 MergedRoendy Omar Cano HernándezNoch keine Bewertungen
- Aislamiento caseína lecheDokument9 SeitenAislamiento caseína lecheDiana Estefania Gabriel0% (1)
- Propiedades Generales de Las Proteinas 1Dokument10 SeitenPropiedades Generales de Las Proteinas 1JoseNoch keine Bewertungen
- Informe Unidad 1 ProteínasDokument27 SeitenInforme Unidad 1 ProteínasMariana MuriaNoch keine Bewertungen
- Seminario Propiedades de HidratacionDokument8 SeitenSeminario Propiedades de HidratacionNatalia Carabajal LangeNoch keine Bewertungen
- 3 Precipitacion OKDokument68 Seiten3 Precipitacion OKRuberth Rivera Pérez100% (1)
- Propiedades proteínasDokument6 SeitenPropiedades proteínasJoicy AlejandroNoch keine Bewertungen
- Alteraciones o Mejoras de Las Propiedades FuncionalesDokument13 SeitenAlteraciones o Mejoras de Las Propiedades FuncionalesDiana Laura Trasviña GonzalezNoch keine Bewertungen
- Propiedades Funcionales de Las ProteinasDokument14 SeitenPropiedades Funcionales de Las ProteinasVictor Santa Cruz QuirozNoch keine Bewertungen
- Proteínas: estructura, propiedades y factores que afectan su solubilidadDokument11 SeitenProteínas: estructura, propiedades y factores que afectan su solubilidadEmmanuel CasteloNoch keine Bewertungen
- Proteina Trabajo EscritoDokument2 SeitenProteina Trabajo EscritoPatricia Valencia100% (1)
- DesnaturalizaciónDokument28 SeitenDesnaturalizaciónErnesto GallegoNoch keine Bewertungen
- PURIFICACIONDokument10 SeitenPURIFICACIONNAYELI CASTRO GAMARRANoch keine Bewertungen
- Deber ProteínasDokument8 SeitenDeber ProteínasNyno GezzNoch keine Bewertungen
- Guía Trabajos Prácticos 2018 BQ AlimentosDokument13 SeitenGuía Trabajos Prácticos 2018 BQ AlimentosMaríaJoséCorreaNoch keine Bewertungen
- TraducidoDokument6 SeitenTraducidoJHON ALFREDO QUISPE ORTIZNoch keine Bewertungen
- Practica n3 Solubilidad de ProteinasDokument12 SeitenPractica n3 Solubilidad de ProteinasgustavoNoch keine Bewertungen
- Meětodos de Separacio RICARDODokument6 SeitenMeětodos de Separacio RICARDOVicTor ValenciaNoch keine Bewertungen
- Practica de Solubilidad de ProteinasDokument13 SeitenPractica de Solubilidad de ProteinasalondraNoch keine Bewertungen
- Efecto de SaltingDokument8 SeitenEfecto de SaltingDaniel Del AngelNoch keine Bewertungen
- Factores que afectan la desnaturalización y estabilidad de proteínasDokument3 SeitenFactores que afectan la desnaturalización y estabilidad de proteínasJuan GabrielNoch keine Bewertungen
- Propiedades funcionales proteínasDokument5 SeitenPropiedades funcionales proteínasWendy Julieth LosadaNoch keine Bewertungen
- 15 Purificacion de ProteinasDokument102 Seiten15 Purificacion de ProteinasJesus Garcia PatiñoNoch keine Bewertungen
- Informe 2 - Química de AlimentosDokument13 SeitenInforme 2 - Química de AlimentosDaiana ZumaetaNoch keine Bewertungen
- 08.1 Prot 2 Parte 2018-I-Fusionado PDFDokument119 Seiten08.1 Prot 2 Parte 2018-I-Fusionado PDFJhonatan A OrzNoch keine Bewertungen
- Importancia solubilidad proteínasDokument3 SeitenImportancia solubilidad proteínasAndrea ChavezNoch keine Bewertungen
- Solubilidad de ProteinasDokument10 SeitenSolubilidad de ProteinasJeisonNoch keine Bewertungen
- Practica 01Dokument3 SeitenPractica 01Andy Yosifer Chirinos GonzalesNoch keine Bewertungen
- Bitacora BioquimicaDokument5 SeitenBitacora BioquimicaAnahi CarrascoNoch keine Bewertungen
- Práctica 3Dokument1 SeitePráctica 3Bren Gatito100% (2)
- Propiedades Químicas de Las ProteínasDokument3 SeitenPropiedades Químicas de Las ProteínasCarolina Malebrán FigueroaNoch keine Bewertungen
- Cuantificacion de ProteinasDokument9 SeitenCuantificacion de ProteinasluisxngelxDNoch keine Bewertungen
- Tecnicas de Purificacion de Enzimas ExistentesDokument5 SeitenTecnicas de Purificacion de Enzimas ExistentesNidia Elizabeth M. DroustNoch keine Bewertungen
- Solubilidad de ProteinasDokument12 SeitenSolubilidad de ProteinasginoNoch keine Bewertungen
- Informe de Laboratorio N. 9Dokument16 SeitenInforme de Laboratorio N. 9Miyey Gutierrez Orduz0% (1)
- PROTEINASDokument14 SeitenPROTEINASRíos Enríquez Itzel AbigailNoch keine Bewertungen
- Cuando Te Quitan La Vesicula - Basado En Las Enseñanzas De Frank Suarez: Tu Viaje De Bienestar Despues De La Extirpación De La VesiculaVon EverandCuando Te Quitan La Vesicula - Basado En Las Enseñanzas De Frank Suarez: Tu Viaje De Bienestar Despues De La Extirpación De La VesiculaNoch keine Bewertungen
- La Gallina Que Cruzo La Carretera (Popeya)Dokument60 SeitenLa Gallina Que Cruzo La Carretera (Popeya)Dianitha Gutiérrez Gutiérrez100% (2)
- TincionesDokument41 SeitenTincionesDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Separación Del BioetanolDokument2 SeitenSeparación Del BioetanolDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Ciclo Celular FinalDokument8 SeitenCiclo Celular FinalDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Cirrosis Hepatica ArtDokument1 SeiteCirrosis Hepatica ArtDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Atlas de Bacteriología PDFDokument50 SeitenAtlas de Bacteriología PDFpascoperu80% (10)
- Introducción A Lípidos y FosfolípidosDokument16 SeitenIntroducción A Lípidos y FosfolípidosDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Casio FX-82ES ManualDokument56 SeitenCasio FX-82ES ManualerikbdNoch keine Bewertungen
- Bacterio Log I ADokument108 SeitenBacterio Log I ADianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Ley General de SaludDokument234 SeitenLey General de SaludAlejandro EspinosaNoch keine Bewertungen
- Reglamento de Insumos para La Salud CofeprisDokument82 SeitenReglamento de Insumos para La Salud Cofeprisaralysalgado1Noch keine Bewertungen
- Practica 1Dokument1 SeitePractica 1Dianitha Gutiérrez GutiérrezNoch keine Bewertungen
- T2 - Diagramas - Equilibrio Del Hierro CarbonoDokument12 SeitenT2 - Diagramas - Equilibrio Del Hierro Carbonojose2277Noch keine Bewertungen
- Proteinas (Desnatiralizacion) PDFDokument4 SeitenProteinas (Desnatiralizacion) PDFDaniel Pablo Carrillo ParadaNoch keine Bewertungen
- Estructura de Las Proteinas PDFDokument34 SeitenEstructura de Las Proteinas PDFcarlos74190% (1)
- Biodisponibilidad de hierro en humanosDokument12 SeitenBiodisponibilidad de hierro en humanosDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Reporte 5Dokument10 SeitenReporte 5Dianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Reporte 5Dokument10 SeitenReporte 5Dianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Reencarnación ContenidoDokument27 SeitenReencarnación ContenidoDianitha Gutiérrez GutiérrezNoch keine Bewertungen
- Comparación Del Ciclo Rankine Ideal Con Otros CiclosDokument12 SeitenComparación Del Ciclo Rankine Ideal Con Otros CiclosJ Carlos ArreolaNoch keine Bewertungen
- Guia 4 - Actividad 2Dokument19 SeitenGuia 4 - Actividad 2FedericoNoch keine Bewertungen
- Ciclo RankineDokument6 SeitenCiclo RankineDaniela CarrilloNoch keine Bewertungen
- Tetrafluoroborato - de - 1 Butil 3 MetilimidazolioDokument3 SeitenTetrafluoroborato - de - 1 Butil 3 MetilimidazolioJhanierEulerGetialDiazNoch keine Bewertungen
- Monografia BalanceDokument31 SeitenMonografia BalanceArnolNoch keine Bewertungen
- Modelos AtomicosDokument10 SeitenModelos AtomicosAyelen Domínguez GómezNoch keine Bewertungen
- Tema 4.1 Maquinado No Tradicional PDFDokument15 SeitenTema 4.1 Maquinado No Tradicional PDFMarwin BenavidesNoch keine Bewertungen
- Estudio de Materiales Por Emisión de Rayos X. Método PIXEDokument8 SeitenEstudio de Materiales Por Emisión de Rayos X. Método PIXEballtakerNoch keine Bewertungen
- TermofluidosDokument13 SeitenTermofluidosWalter AndresNoch keine Bewertungen
- Sustancia Química 1Dokument4 SeitenSustancia Química 1wil lopNoch keine Bewertungen
- Tema 1 - Fundamentos TPCDokument34 SeitenTema 1 - Fundamentos TPCLidia SantanaNoch keine Bewertungen
- Humidificación - DeshumidificaciónDokument27 SeitenHumidificación - DeshumidificaciónFreddy Ortiz Espinoza100% (1)
- Segundo TallerDokument12 SeitenSegundo TallerJuan MonterrozaNoch keine Bewertungen
- Exa AireDokument2 SeitenExa AireLeonardo Daniel NogalesNoch keine Bewertungen
- Velocidad de ReaccionDokument6 SeitenVelocidad de Reacciondiego gutierrez 3BNoch keine Bewertungen
- Refracción de la luzDokument12 SeitenRefracción de la luzPaula L Garcia CamachoNoch keine Bewertungen
- Practica 8 Equivalente-GramoDokument23 SeitenPractica 8 Equivalente-GramoLuis Fernando BaqueNoch keine Bewertungen
- Segundo Examen Parcial de Fisica GeneralDokument6 SeitenSegundo Examen Parcial de Fisica GeneralJuan José Aldana CarranzaNoch keine Bewertungen
- Auditoria Ambiental y Auditoria Energetica 2019Dokument22 SeitenAuditoria Ambiental y Auditoria Energetica 2019Daniela ChicaizaNoch keine Bewertungen
- Reacciones de aldehídos y cetonasDokument46 SeitenReacciones de aldehídos y cetonasSantiago Medina GómezNoch keine Bewertungen
- 5° Grado - Actividad Del Dia 22 de MarzoDokument48 Seiten5° Grado - Actividad Del Dia 22 de MarzoWilliam Vásquez RosalesNoch keine Bewertungen
- 7.equilibrio IonicoDokument8 Seiten7.equilibrio IonicoMarcelo TorresNoch keine Bewertungen
- Práctica Calificada N°2Dokument5 SeitenPráctica Calificada N°2josue flores mendozaNoch keine Bewertungen
- RAER Resumen de La Polimerización Por Radicales LibresDokument11 SeitenRAER Resumen de La Polimerización Por Radicales LibresERIK RAMIREZNoch keine Bewertungen
- Guía Pedagógica ESTADOS DE LA MATERIADokument8 SeitenGuía Pedagógica ESTADOS DE LA MATERIAjuan esteban alvarez henao100% (1)
- EnlacesQuímicosLabDokument4 SeitenEnlacesQuímicosLabDhariana Sarahi Lope AnccoNoch keine Bewertungen
- Muebles químicas 40cDokument2 SeitenMuebles químicas 40cCristina Ivette K Chuquisuta HerreraNoch keine Bewertungen
- Ilovepdf MergedDokument24 SeitenIlovepdf MergedChristianNoch keine Bewertungen
- Manual de la aplicación Química: guía paso a pasoDokument12 SeitenManual de la aplicación Química: guía paso a pasoRoberto Jair Arteaga ValenzuelaNoch keine Bewertungen
- Manual Enero 2019 PDFDokument151 SeitenManual Enero 2019 PDFbenjamin zavaletaNoch keine Bewertungen