Beruflich Dokumente
Kultur Dokumente
Metalurgia Del Aluminio
Hochgeladen von
Santiagozeta100%(5)100% fanden dieses Dokument nützlich (5 Abstimmungen)
19K Ansichten13 SeitenCopyright
© Attribution Non-Commercial (BY-NC)
Verfügbare Formate
PPT, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Attribution Non-Commercial (BY-NC)
Verfügbare Formate
Als PPT, PDF, TXT herunterladen oder online auf Scribd lesen
100%(5)100% fanden dieses Dokument nützlich (5 Abstimmungen)
19K Ansichten13 SeitenMetalurgia Del Aluminio
Hochgeladen von
SantiagozetaCopyright:
Attribution Non-Commercial (BY-NC)
Verfügbare Formate
Als PPT, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 13
Metalurgia Del Aluminio
1 - Minerales Del Aluminio
• Su mineral mas importante es la bauxita
• Existe tambien en los silicatos
( feldespato, mica, hornblenda, arcilla y
caolin, ) sulfatos (alumbres), oxidos
(corindicion ) y flujruros de aluminio y de
sodio (criolita)
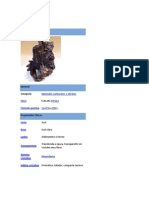
Bauxita
• Detalle General
• Composicion Quimica
• Lugares Donde Se Encuentra
• Caracteristicas Fisicas
Detalle General
• La bauxita es una roca
sedimentaria de origen
químico compuesta
mayoritariamente por alúmina
(Al2O3) y, en menor medida,
óxido de hierro y sílice. Es la
principal fuente de aluminio
utilizada por la industria.
• Es un residuo producido por
la meteorización de las rocas
ígneas en condiciones
geomorfológicas y climáticas
favorables.
Composicion Quimica
• Su composicion es: FeO (OH) y Al2O3
2H20
• Se presenta generalmente en forma de
mezcla de gibsita Al(OH)3 y caolinita
Al2Si2O5 (OH)4, y que se conoce
también como boehmita
Lugares donde se encuentra
• Actualmente, la mayor parte de la minería de bauxita está situada
en el Caribe, Australia, Brasil y África, que producen bauxitas más
fáciles de disgregar que las europeas
Caracteristicas Fisicas
• Tipo de roca: ignea
• Sistema cristalino: ortorrómbica
• Dureza: varía entre 1 y 3
• Textura: escamoso, áspero
• Densidad: entre 2 y 2.55
• Color: entre rojo, amarillo y blanco
• Brillo: metalico
• Tamaño: de un guisante
2 - Obtencion Del Aluminio
• Constan en 2
etapas:
• En la 1ra se
produce la alúmina
• En la 2da se
obtiene el aluminio
metalico
5 – Proceso Bayer
• El proceso Bayer es el principal método
industrial para producir alúmina a partir
de bauxita
• Inventado por el austriaco Karl Bayer en
1889 y basado en la disolución de la
bauxita con hidróxido sódico
Detalles del proceso (Paso 1)
• Se tritura la bauxita y luego se lava con una
solución caliente de hidróxido sódico (sosa),
NaOH. La sosa disuelve los minerales de
aluminio pero no los otros componentes de la
bauxita, que permanecen sólidos. Las
reacciones químicas que ocurren en esta etapa,
llamada "digestión" son las siguientes:
• Al(OH)3 + OH- + Na* → Al(OH)4- + Na*
• AlO(OH)2 + OH- + H2O + Na* → Al(OH)4- + Na*
Paso 2
• Se retiran de la solución los sólidos no
disueltos en un decantador seguido de
unos filtros para eliminar los últimos
restos. Los sólidos recogidos en el
decantador, llamados "lodo rojo", se tratan
para recuperar la sosa no reaccionada,
que se recicla al proceso.
Paso 3
• La solución de Al(OH)4-, ya libre de impurezas,
se precipita de forma controlada para formar
hidróxido de aluminio puro. Para favorecer la
cristalización se opera a baja temperatura y se
"siembra" la solución con partículas de hidróxido
de aluminio: 2
• Al(OH)4- + Na* → Al(OH)3 + OH- + Na*
• La solución de sosa libre de aluminio se
concentra en unos evaporadores y se recicla al
comienzo del proceso.3
Paso 4
• El hidróxido se calienta a unos 1050°C, en
una operación llamada "calcinación", para
convertirlo en alúmina, liberando vapor de
agua al mismo tiempo: 2
• 2 Al(OH)3 → Al2O3 + 3 H2O
• La alúmina obtenida se utiliza
principalmente para producir aluminio
mediante electrólisis.
Das könnte Ihnen auch gefallen
- Aluminio ObtencionDokument9 SeitenAluminio ObtencionDiegoDazarolaNoch keine Bewertungen
- Obtención de Hidróxido de AluminioDokument3 SeitenObtención de Hidróxido de Aluminiomario alexisNoch keine Bewertungen
- Electrolisis AluminaDokument24 SeitenElectrolisis AluminaJeffrey FernandezNoch keine Bewertungen
- Recuperacion y Reciclado Del Plomo (PB)Dokument17 SeitenRecuperacion y Reciclado Del Plomo (PB)Miguel Angel LòpezNoch keine Bewertungen
- Obtención Del MagnesioDokument4 SeitenObtención Del MagnesioAzul OrtizNoch keine Bewertungen
- Metalurgia Del PlomoDokument30 SeitenMetalurgia Del PlomoAnonymous uAFIm0Noch keine Bewertungen
- Metalurgia Del Aluminio PDFDokument94 SeitenMetalurgia Del Aluminio PDFMarita M. OrbegosoNoch keine Bewertungen
- Introducción Papel Elaboración Pasta PapelDokument58 SeitenIntroducción Papel Elaboración Pasta PapelPoloca AmoedoNoch keine Bewertungen
- Obtención Del MagnesioDokument13 SeitenObtención Del MagnesioGisse TolabaNoch keine Bewertungen
- Refinación química de la plata: procesos y etapasDokument7 SeitenRefinación química de la plata: procesos y etapasMarco C. PumaNoch keine Bewertungen
- La Niquelina o NicolitaDokument2 SeitenLa Niquelina o NicolitaFernando Mantari MartinezNoch keine Bewertungen
- Met 3398 Quispe Alex Planificacion Reporte-Separacion Electrostatica de CasiteritaDokument18 SeitenMet 3398 Quispe Alex Planificacion Reporte-Separacion Electrostatica de CasiteritaAntonio Salas Casado100% (1)
- LixiviacionDokument29 SeitenLixiviacionHugomanNoch keine Bewertungen
- Separata Derivados Del AmoniacoDokument31 SeitenSeparata Derivados Del AmoniacoBrayan Castañeda LopezNoch keine Bewertungen
- Metalurgia Extractiva Del Aluminio 1Dokument23 SeitenMetalurgia Extractiva Del Aluminio 1JimmyVargas100% (1)
- Aspectos Básicos de La Pirometalurgia Del Plomo y MolibdenoDokument37 SeitenAspectos Básicos de La Pirometalurgia Del Plomo y MolibdenoOscar Cristian Caro Bahamondes100% (1)
- Estructura de Los Solidos CristalinosDokument6 SeitenEstructura de Los Solidos CristalinosLuis Espinoza TaboadaNoch keine Bewertungen
- Plata, Aleaciones y AplicacionesDokument9 SeitenPlata, Aleaciones y AplicacionesRONALD YONATHAN ALARCON ROMANI100% (1)
- DETERMINACIONES TERMOGRAVIMÉTRICAS Y DE CALOR ESPECÍFICO DE UN CONCENTRADO COMERCIAL DE ULEXITADokument5 SeitenDETERMINACIONES TERMOGRAVIMÉTRICAS Y DE CALOR ESPECÍFICO DE UN CONCENTRADO COMERCIAL DE ULEXITAs_q_d100% (1)
- AsufreDokument21 SeitenAsufreMelina Cornejo CatacoraNoch keine Bewertungen
- 38 37 1 PBDokument5 Seiten38 37 1 PBscribdheinzNoch keine Bewertungen
- Tarea 4 - PirometalurgiaDokument16 SeitenTarea 4 - PirometalurgiaMaría Argomedo ReyesNoch keine Bewertungen
- Proceso Del Litio Desde EspomudenoDokument16 SeitenProceso Del Litio Desde Espomudenocoreano63Noch keine Bewertungen
- 4 EquilibrioQ Solubilidad ProblemasDokument49 Seiten4 EquilibrioQ Solubilidad ProblemasFrancisco Martínez Navarro50% (2)
- Corrosión Del HierroDokument7 SeitenCorrosión Del HierroSamuel Fernando DelgadoNoch keine Bewertungen
- Casiterita InformeDokument9 SeitenCasiterita InformeJasmin De La Torre CabreraNoch keine Bewertungen
- Hidrometalurgia TiO2Dokument31 SeitenHidrometalurgia TiO2Miguel Angel LòpezNoch keine Bewertungen
- Periodo 5Dokument26 SeitenPeriodo 5cristina aybNoch keine Bewertungen
- Acido SulfuricoDokument13 SeitenAcido SulfuricoRoxana Ethel FriasNoch keine Bewertungen
- Lab 6 - Precipitation of Antimony from Sulfides Using IronDokument7 SeitenLab 6 - Precipitation of Antimony from Sulfides Using IronJheny Calcina100% (1)
- Lavadores de GasesDokument3 SeitenLavadores de GasesYiris V. Gómez BastidasNoch keine Bewertungen
- Introducción y Fabricación de CementoDokument27 SeitenIntroducción y Fabricación de Cementomarion100% (1)
- Cianuracion Por AgitacionDokument18 SeitenCianuracion Por AgitacionA Crispin AnibalNoch keine Bewertungen
- Cobre en JoyeríaDokument14 SeitenCobre en JoyeríaLA Wera LKNoch keine Bewertungen
- INFORME CorrosionDokument12 SeitenINFORME CorrosionHugo SolanoNoch keine Bewertungen
- Procesamiento de oro: etapas claveDokument37 SeitenProcesamiento de oro: etapas clavedavidnavarrete1991Noch keine Bewertungen
- AzuritaDokument5 SeitenAzuritaErin WintersNoch keine Bewertungen
- Pirometalurgia - Pellasfinal-2-1Dokument55 SeitenPirometalurgia - Pellasfinal-2-1Kleyjarh CorreaNoch keine Bewertungen
- Proceso BayerDokument5 SeitenProceso BayerRoberto AuzNoch keine Bewertungen
- Guia de Laboratorio de AmalgamacionDokument3 SeitenGuia de Laboratorio de AmalgamacionAnonymous mrPC08u100% (1)
- Proceso Mond níquel CODokument5 SeitenProceso Mond níquel COcristty15Noch keine Bewertungen
- LIXIVIACIÓN W-VDokument18 SeitenLIXIVIACIÓN W-V72455805Noch keine Bewertungen
- Sesion N°12 - Fundamentos Quimicos Del Proceso de Conversion de Matas de CobreDokument23 SeitenSesion N°12 - Fundamentos Quimicos Del Proceso de Conversion de Matas de CobreElvis Bonifacio GilianNoch keine Bewertungen
- Refinacion Electrolitica Del OroDokument5 SeitenRefinacion Electrolitica Del OroKleber BarriosNoch keine Bewertungen
- Cal - p24Dokument6 SeitenCal - p24Jairo AnguloNoch keine Bewertungen
- Índice de basicidad escorias pirometalurgiaDokument6 SeitenÍndice de basicidad escorias pirometalurgiaVanesa Alfaro TasaycoNoch keine Bewertungen
- Disolucion de CelulosaDokument4 SeitenDisolucion de CelulosaMario CorralNoch keine Bewertungen
- Sulfato de CobreDokument6 SeitenSulfato de CobreChristianYapuNoch keine Bewertungen
- El Uso Del Cristalizador Electrotermico Desde El Punto de VistaDokument7 SeitenEl Uso Del Cristalizador Electrotermico Desde El Punto de Vistajorjais123Noch keine Bewertungen
- Quimica Analitica Determinacion Del CalcioDokument12 SeitenQuimica Analitica Determinacion Del CalciojoellNoch keine Bewertungen
- Obtencion Aluminio ElectroDokument30 SeitenObtencion Aluminio ElectroRoy Chucos QuispeNoch keine Bewertungen
- Historia del espesamiento desde la antigüedad hasta la invención del espesador DorrDokument7 SeitenHistoria del espesamiento desde la antigüedad hasta la invención del espesador DorrJohnn RedzargoNoch keine Bewertungen
- Metalurgia Del AluminioDokument13 SeitenMetalurgia Del Aluminiopaco herediaNoch keine Bewertungen
- Metalurgia Del Aluminio PDFDokument13 SeitenMetalurgia Del Aluminio PDFBiancaLirioGarciaNoch keine Bewertungen
- Proceso Del AluminioDokument44 SeitenProceso Del AluminioThalia QuispeNoch keine Bewertungen
- Obtencion de Álumina y AluminioDokument39 SeitenObtencion de Álumina y Aluminiovictor bastardoNoch keine Bewertungen
- ALUMINIODokument31 SeitenALUMINIOGabriel Alfonso Carbajal MattaNoch keine Bewertungen
- Bauxita mineral roca aluminio proceso Bayer alúminaDokument17 SeitenBauxita mineral roca aluminio proceso Bayer alúminaAngel Eniel BarretoNoch keine Bewertungen
- Extracción y Refinación Del AluminioDokument53 SeitenExtracción y Refinación Del AluminioElias Ortega100% (2)
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAVon EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANoch keine Bewertungen
- Alumina 3Dokument22 SeitenAlumina 3SantiagozetaNoch keine Bewertungen
- JajajDokument10 SeitenJajajSantiagozetaNoch keine Bewertungen
- Tram atDokument15 SeitenTram atSantiagozetaNoch keine Bewertungen
- Alumina 1Dokument3 SeitenAlumina 1SantiagozetaNoch keine Bewertungen
- El Uso de Las Redes Sociales y Sus Efectos en El Rendimiento Académico de Los Estudiantes de La Escuela Rafael Díaz Niese Del Municipio de Loma de Cabrera en El Año Escolar 2018Dokument20 SeitenEl Uso de Las Redes Sociales y Sus Efectos en El Rendimiento Académico de Los Estudiantes de La Escuela Rafael Díaz Niese Del Municipio de Loma de Cabrera en El Año Escolar 2018Buenos NetNoch keine Bewertungen
- Requisitos Comipems 2010-2011Dokument12 SeitenRequisitos Comipems 2010-2011Rosalba Garcia SalasNoch keine Bewertungen
- El Presupuesto de La Propiedad HorizontalDokument4 SeitenEl Presupuesto de La Propiedad HorizontalDaniel Mendoza PerezNoch keine Bewertungen
- Brand Essence Wheel - Estrella DamnDokument12 SeitenBrand Essence Wheel - Estrella DamnTinder ConvNoch keine Bewertungen
- 3 Seminario ParasitologiaDokument22 Seiten3 Seminario ParasitologiaAndreaNoch keine Bewertungen
- Evolución Mineralógica Del Cemento Portland Durante La HidrataciónDokument15 SeitenEvolución Mineralógica Del Cemento Portland Durante La HidrataciónAlberto Núñez CardezoNoch keine Bewertungen
- Warhammer Ancient Battles - SHIELDWALLDokument27 SeitenWarhammer Ancient Battles - SHIELDWALLblackbird413Noch keine Bewertungen
- Guía impermeabilización tanques PVCDokument9 SeitenGuía impermeabilización tanques PVCAngela VillamilNoch keine Bewertungen
- Esfuerzos en Vigas - Sección Transformada y Flexión AsimétricaDokument37 SeitenEsfuerzos en Vigas - Sección Transformada y Flexión AsimétricaAlejandro Blancarte100% (6)
- La caída de Madrid durante la cuarentenaDokument589 SeitenLa caída de Madrid durante la cuarentenaCesar ArellanoNoch keine Bewertungen
- Malla IMDokument1 SeiteMalla IMAshley JacksonNoch keine Bewertungen
- Peticiones Consejo Academico Derecho 2020Dokument1 SeitePeticiones Consejo Academico Derecho 2020MaRia JOse AcOsta IINoch keine Bewertungen
- Sesion 12.1 Irrigación - DISEÑO DE SIFONESDokument62 SeitenSesion 12.1 Irrigación - DISEÑO DE SIFONEShnyramirezNoch keine Bewertungen
- Práctica 3. Técnicas CromatográficasDokument5 SeitenPráctica 3. Técnicas CromatográficasSERGIO LIZARAZO BERNALNoch keine Bewertungen
- Perforadora MicropiloteadoraDokument2 SeitenPerforadora MicropiloteadoraJoel Alvarado0% (1)
- CS 2do Estudiante Ubicacion EspacialDokument8 SeitenCS 2do Estudiante Ubicacion EspacialVentas CoquimboNoch keine Bewertungen
- Planificacion de La Seceuncia 5 La Noticia.Dokument5 SeitenPlanificacion de La Seceuncia 5 La Noticia.DORKELINANoch keine Bewertungen
- Operador de motoniveladora mineríaDokument2 SeitenOperador de motoniveladora mineríaErnesto AllenNoch keine Bewertungen
- Estudio Fermandois - Informe Constitucionalidad de Apuestas en Línea Firmado - 8 de Mayo de 2023 - RepairedDokument57 SeitenEstudio Fermandois - Informe Constitucionalidad de Apuestas en Línea Firmado - 8 de Mayo de 2023 - RepairedContacto Ex-AnteNoch keine Bewertungen
- Agrotodo PDFDokument1 SeiteAgrotodo PDFfredy muñozNoch keine Bewertungen
- Tabla de Valencias OkkkkkDokument2 SeitenTabla de Valencias OkkkkkIbe Valeria PvNoch keine Bewertungen
- Responsabilidad de La DirecciónDokument10 SeitenResponsabilidad de La DirecciónA.Noch keine Bewertungen
- Mina Incahuasi Final 1 3Dokument21 SeitenMina Incahuasi Final 1 3daniel quiroga0% (1)
- Extraccion Liquido-Solido (Lixiviacion)Dokument14 SeitenExtraccion Liquido-Solido (Lixiviacion)Jhon Francísco Hernández JiménezNoch keine Bewertungen
- Fase 2 Estructura AbanicoDokument10 SeitenFase 2 Estructura Abanicoconstain1989Noch keine Bewertungen
- Asis Nuevo Pucará 2017Dokument78 SeitenAsis Nuevo Pucará 2017Laura VillafuerteNoch keine Bewertungen
- Preinforme 4Dokument5 SeitenPreinforme 4Ariana Chanta Rodas100% (1)
- Ensayo RCMDokument3 SeitenEnsayo RCMMargarita Cardnas OrozcoNoch keine Bewertungen
- Microbiología Final - Cat1Dokument220 SeitenMicrobiología Final - Cat1Bárbara MaiaNoch keine Bewertungen
- Proyecto Atacocha..Dokument43 SeitenProyecto Atacocha..Jose Luis Tomas Avila LopezNoch keine Bewertungen