Beruflich Dokumente
Kultur Dokumente
E. Sustancias Puras
Hochgeladen von
n94a3tjo_9Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
E. Sustancias Puras
Hochgeladen von
n94a3tjo_9Copyright:
Verfügbare Formate
UNIVERSIDAD NACIONAL EXPERIMENTAL
FRANCISCO DE MIRANDA
REA DE TECNLOGIA
COMPLEJO DOCENTE EL SABINO
Unidad Curricular: Termodinmica
PROBLEMAS COMPLEMENTARIOS RESUELTOS Y
PROPUESTOS
(Primer Corte)
Ing. Frank Bello Castillo
J unio 2008
PROBLEMAS RESUELTOS (TERMODINAMICA)
PRIMER PARCIAL
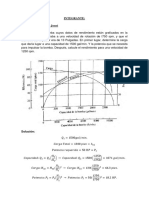
1) Vapor saturado a 120 Psi est contenido en un arreglo cilindro-pistn, el cual tiene inicialmente un volumen de 1
pie
3
. El vapor es enfriado por medio de un proceso isomtrico hasta que la temperatura alcanza 300 F. El sistema
es luego expandido isotrmicamente hasta que el volumen en el estado 3 es dos veces el inicial. Determinar : a) La
masa de vapor en el estado 1. b) La calidad en el estado 2. c)La presin en estado 2. d) La masa de lquido y vapor en
el estado 2. e) La presin en el estado 3. f) Represente el proceso en un diagrama Presinvolumen especfico(p-v) y
Temperatura-volumen especfico ( T-v)
Solucin:
Esquema:
Seguidamente, hay que clasificar la informacin por estados:
Edo. 1 Edo. 2 Edo. 3
P
1
=120 psia V
2
=V
1
=1 pie
3
T
3
=T
2
=300 F
V
1
=1 pie
3
T
2
=300 F V
3
=2V
1
(expansin)
Vapor saturado
a) Masa de vapor en el estado 1:
Este estado inicial est definido, porque se dice que es vapor saturado y nos especifican su presin, as que como
conocemos el volumen del sistema, lo nico que nos hara falta para calcular la masa del sistema sera el volumen especfico
del sistema, para posteriormente sustituirlo en la siguiente ecuacin:
m
sis1
=V
sis1
/
sis1
Recurdese, que el estado de vapor saturado es aquel donde el vapor est en equilibrio con una cantidad insignificante de
lquido. En otras palabras en el estado inicial todo el sistema, en el sentido prctico, es vapor, as que al calcular la masa del
sistema estamos calculando la masa del vapor:
sis1
=
g @ 120 psia
=3.73 pie
3
/Lbm
Sustituyendo:
m
sis1
=1pie
3
/3.73 pie
3
/Lbm =0.268 Lbm ( m
vapor1
)
Tngase presente, que por ser este un sistema cerrado esta masa (total) calculada para este primer estado es la misma para
los restantes, as que:
m
sis1
= m
sis2
= m
sis3
b)Calidad en estado 2:
Aunque, se pide que se calcule la calidad lo cual sugiere que el estado es mezcla, lo primero que se har es determinar el
estado, para lo cual es necesario conocer 2 propiedades intensivas independientes.
Hasta este punto, la nica propiedad intensiva que se conoce del estado 2, es la temperatura: (T
2
=300 F), sin embargo
tngase presente que el volumen del sistema tambin se conoce (V
2
=1 pie
3
) y la masa del sistema es comn para todos los
estados, por ser un sistema cerrado(m
sis2
= 0.268 Lbm). Con estos dos ltimos datos podemos calcular la segunda propiedad
intensiva necesaria, que sera el volumen especifico del sistema:
sis2
=V
sis2
/ m
sis2
As que:
sis2
=1 pie
3
/ 0.2680 Lbm =3.73 pie
3
/Lbm
Obsrvese que este valor de volumen especifico del estado 2 , es igual al del estado 1. Esto ser as cada vez , que el
volumen y la masa permanezcan constantes:
S V
sis1
=V
sis2
y m
sis1
=m
sis2
entonces:
sis1
=
sis2
Agua
(Sist)
Esta ltima premisa debe tenerse muy presente, porque es bastante frecuente en los problemas que tratan de Sistemas
Cerrados.
En definitiva, se conocen 2 propiedades intensivas independientes del estado 2:
T
2
=300 F y
sis2
=3.73 pie
3
/Lbm
Si entramos con esta temperatura en la Tabla de Saturacin del agua, se lee:
f
=0.017448 pie
3
/Lbm y
g
=6.472 pie
3
/Lbm
Si se compara estos valores de saturacin con el valor del sistema, se tendr que:
sis2
>
f
y
sis2
<
g
que es equivalente a escribir:
f
<
sis2
<
g
El cumplimiento de esta relacin significa que el estado es MEZCLA (como se esperaba). As que ahora si vamos a
proceder a calcular la calidad.
La calidad de este segundo estado, tendra, en teora, dos formas bsicas para calcularse:
1) A partir de masas:
X
2
=m
vapor2
/m
sis2
2) A partir de propiedades intensivas, como los volmenes especficos:
X
2
=(
sis2
-
f2
) / (
g2
-
f2
)
La forma #1, no es viable para calcular la calidad en este caso, ya que la informacin es insuficiente. As que se utilizar la
segunda frmula.
Entonces:
X
2
=(3.73 0.017448) pie
3
/Lbm / (6.472-0.017448) pie
3
/Lbm =0,575
c) Presin en estado 2:
En la parte anterior se determin que el estado 2 era mezcla o sea un estado de saturacin, as la presin que le corresponde
ser la que se lee directamente en la Tabla de Saturacin:
P
2
= P
saturacin
= 66.98 psia ( a 300 F )
d) La masa de vapor y lquido en el estado 2:
Tengamos presente que la masa de vapor est relacionada estrechamente con el concepto de calidad, as que:
X
2
=m
vapor2
/m
sis2
Como la calidad, ya lo conocimos anteriormente, podemos despejar la masa de vapor de la anterior frmula:
m
vapor2
=X
2*
m
sis2
m
vapor2
=0.575
*
0.268 Lbm =0.154 Lbm
Por otro lado hay que tener presente que :
m
sis2
=m
vap2
+ m
Liq2
Entonces:
m
Liq2
=m
sis2
- m
vap2
=(0.268 - 0.154)Lbm =0.114 Lbm
e) La Presin en el estado 3:
Para poder conocer la presin de este estado se necesita previamente determinar el estado, y para poder hacer esto se
necesita conocer 2 propiedades intensivas independientes.
Por los momentos la nica propiedad intensiva que conocemos es la T
3
=300 F, pero si analizamos la informacin adicional
que se tiene de este estado podemos calcular otra propiedad intensiva, que sera el volumen especfico, de la siguiente
forma:
sis3
=V
sis3
/ m
sis3
As que:
sis3
=2 pie
3
/ 0.268 Lbm=7.46 pie
3
/Lbm
Ahora se conocen 2 propiedades intensivas independientes del estado 3:
T
3
=300 F y
sis3
=7.46 pie
3
/Lbm
Si entramos con esta temperatura en la Tabla de Saturacin del agua, se lee :
f
=0.017448 pie
3
/Lbm y
g
=6.472 pie
3
/Lbm
Si se compara estos valores de saturacin con el valor del sistema, se tendr que:
sis3
>
f
y
sis3
>
g
El cumplimiento de la primera relacin no aporta nada en la determinacin del estado, pero el cumplimiento de la segunda
significa que el estado es VAPOR SOBRECALENTADO. As que la presin se tendr que buscar en la Tabla de Vapor
Sobrecalentado, en donde debemos ubicar a una temperatura de 300 F un volumen especfico de 7.46 pie
3
/Lbm.
Resolviendo, por interpolacin (ver anexo ), el valor solicitado es: P
3
= 59 psia
f) Representacin en diagramas P-v y T-v
2)El recipiente rgido que muestra la figura contiene agua como mezcla a 101.35 kPascal. Determinar las
proporciones en volumen de lquido y vapor (a 101.35 kPascal) necesarias para hacer que el agua pase por el estado
crtico al calentarla.
Solucin:
Esquema:
Sistema
Clasifiquemos la informacin por estados:
Edo. 1 Edo. 2
P
1
=101.35 kPa Estado o punto crtico
Mezcla
Lquido-
vapor
Temp.
(F)
(pie
3
/Lbm)
59
Liq.
comprim.
Vapor
Sobrec.
Punto
Crtico
T
1
=341.27 F
120
66.98
2
3
1
T
2
=T
3
=300 F
Presin
(Psia)
3.73 7.46
(pie
3
/Lbm)
3.73
7.46
Liq.
comprim.
Vapor
Sobrec.
Punto
Crtico
P
1
=120 psia
.
341.2
2
3
1
300
P
2
=66.98 psia
.
P
3
=59 psia
Mezcla
Fraccin Vol. Vapor =(V
vapor1
/ V
sis1
) =?
Fraccin Vol. Lq =(V
Liq1
/ V
sis1
) =?
Anlisis
Cualquier parmetro que tenga que ver con las fases vapor y lquida, est relacionado directa o indirectamente, con la
calidad(X), as que analicemos su frmula para ver que se puede obtener:
X
1
=( m
vapor1
/m
sis1
)
Pero :
m
vapor1
=V
vapor1
/
g1
y m
sis1
=V
sis1
/
sis1
Sustituyendo:
X
1
=(V
vapor1
/
g1
) / (V
sis1
/
sis1
)
Aplicando la doble C:
X
1
=(V
vapor1
*
sis1
) / (V
sis1*
g1
)
Despejando:
(V
vapor1
/ V
sis1
) =X
1*
(
g1
/
sis1
)
La calidad se puede calcular de la siguiente frmula:
X
1
=(
sis1
-
f1
) / (
g1
-
f1
)
Los volmenes especficos se buscan a 101.35 Kpa (Tabla de saturacin):
g1
=1.6729 m
3
/Kg y
f1
=0.001044 m
3
/Kg
Tngase presente, que este sistema es rgido y adems Cerrado, lo cual se traduce en que el volumen especfico del sistema
permanezca constante:
sis1
=
sis2
Si hacemos un diagrama p-v, se podr visualizar fcilmente el problema:
El Punto Crtico
es un estado de notable importancia para toda sustancia, en donde las propiedades de la fase vapor son
idnticas a las propiedades de la fase lquida. Los valores asociados, para el agua, se pueden leer en la ltima lnea de la
Tabla de Saturacin:
P
crt
=22.09 Mpa y
f
=
g
=0.003155 m
3
/Kg
Ahora bien, si consideramos este estado crtico como un estado de Saturacin , podramos intentar calcular el volumen
especifico del sistema a partir de la siguiente frmula:
sis2
=
f2
+x
2
(
g2
-
f2
)
pero recordando que para este caso
f
=
g
, el segundo sumando se anula y por lo tanto queda que:
sis2
=
f2
=0.003155 m
3
/Kg
Bajo estas circunstancias, ahora se conocen el volumen especfico del estado inicial y por lo tanto podemos calcular la
calidad:
X
1
=(0.00315 0.001044) /(1.6729-0.001044) =0.0126
101.35 Kpa
1
2
T
1
=100 C
Presin
sis1
=
sis2
Sustituyendo en la frmula que se haba deducido:
(V
vapor1
/ V
sis1
) =X
1*
(
g1
/
sis1
) =0.00126
*
(1.6729 m
3
/Kg /0.003155 m
3
/Kg) =0.67
Esto representa la fraccin de vapor en volumen, que es lo mismo que decir que el vapor ocupa el 67% del volumen del
recipiente, por lo tanto la diferencia con respecto al 100%, representara el porcentaje de lquido o sea 33%, que es
equivalente a decir que, la fraccin de lquido es:
(V
Lq
/ V
sis1
) =0.33
3) Dos recipientes A y B, estn conectados a travs de una tubera con su respectiva vlvula. Inicialmente, el
recipiente B est vaco y el A cuyo volumen es 1 pie
3
contiene Fren-12 en una proporcin de 90% vapor y 10%
lquido en volumen, a 80 F. Se abre la vlvula y fluye Fren-12 desde A hacia B, hasta que la presin en ambos
recipientes se equilibra en 30 Psia. Simultneamente se le suministra calor al Fren a fin de mantener la temperatura
constante a 80 F. Determine el volumen del recipiente B.
SOLUCIN:
Esquema:
Seguidamente, hay que clasificar la informacin por estados:
EDO 1 EDO 2
Recipiente A Recipiente B Recipiente A Recipiente B
T
1A
=80 F V
1B
=V
B
=?
P
2A
=30 Psia P
2B
=30 Psia
VL
1A
=0.1V
A
VACO
T
2A
=80 F T
2B
=80 F
Vv
1A
=0.9V
A
V
2A
=V
A
=1 pie
3
V
2B
=V
B
=?
V
1A
=V
A
=1 pie
3
El volumen del recipiente B, se puede obtener aplicando la frmula de volumen especfico del sistema,
considerando como tal la masa final en ese recipiente:
V
B
=m
2B*
2B
El
2B
se obtendr una vez determinado el estado final en B, con 80 F y 30 Psia. Al hacer esto se establece que
es Vapor Sobrecalentado , por lo que:
2B
=1.5306 pie
3
/Lbm
As, lo nico que hace falta ahora es obtener la masa final en B (m
2B
). Para hacer esto hay que tener presente que la masa
final en B, no es otra cosa que la masa que sale del recipiente A(m
Asal
):
m
2B
=m
Asal
A su vez la masa que sale de A(m
Asal
), es simplemente la diferencia entre la masa inicial(m
1A
) y masa final(m
2A
) dentro
de ese recipiente:
m
Asal
=m
1A
- m
2A
Clculo de la masa inicial en A:
Por ser mezcla, la masa total del sistema es la sumatoria de la masa del lquido(m
L1A
) y la masa del vapor(m
v1A
):
m
A1
=m
L1A
+ m
v1A
A B
Los porcentajes en volumen permiten establecer que:
VL
1A
=0.1V
A
=0.1
*
1 pie
3
=0.1 pie
3
Vv
1A
=0.9V
A
=0.9
*
1 pie
3
=0.9 pie
3
Con la frmula de volumen especfico, aplicada a la fase lquida y a la fase vapor individualmente, se puede obtener las
masas respectivas:
m
v1A
=V
v1A
/
v1A
= 0.9 pie
3
/0.4114 pie
3
/Lbm =2.19 Lbm
m
L1A
=V
L1A
/
f1A
= 0.1 pie
3
/0.01228 pie
3
/Lbm =8.14 Lbm
Entonces:
m
A1
=2.19 Lbm + 8.14 Lbm=10.33 Lbm
Clculo de la masa Final en A:
Tengamos presente que el estado final en los 2 recipientes es el mismo, as que:
2A
=
2B
=1.5306 pie
3
/Lbm
Entonces, aplicando la frmula de volumen especfico al sistema conformado por la masa final en el recipiente A:
m
2A
=V
2A
/
sis2A
= 1 pie
3
/1.5306 pie
3
/Lbm =0.65 Lbm
As que:
m
Asal
=m
1A
- m
2A
= 10.33 Lbm - 0.65 Lbm =9.68 Lbm
Finalmente:
V
B
=m
2B*
2B
==9.68 Lbm
*
1.5306 pie
3
/Lbm =14.82 pie
3
(Resp.)
4) Encuntrese la presin necesaria para comprimir 300 litros de aire a 7 C y 1 bar de presin hasta 1 litro y 115
C. Suponga que este proceso tiene lugar en un arreglo cilindro-pistn. (Informacin adicional: T
crit
= 132 K y p
crit
=
37.7 bar)
Solucin:
Anlisis:
El aire originalmente (estado 1) est a una presin suficientemente baja (1 bar 1 Atm) para ser considerado como gas
ideal, as que se puede asumir un factor de compresibilidad z
1
=1. Sin embargo, se presume que la presin del estado 2 es
relativamente alta (debido a la gran disminucin en el volumen) y por lo tanto el comportamiento debe desviarse del Ideal.
Clasificando la informacin por estados:
Estado 1 Estado 2
p
1
=1 bar T
2
=-115 C =158 K
T
1
=7 C =280 K p
2
=?
z
1
=1 z
2
1
V
1
=300 litros V
2
=1 litro
Si escribimos la ecuacin de gas ideal para un sistema cerrado, modificada con el factor de compresibilidad (z), para ser
usada con gases reales, tendremos:
z
2
p
1
V
1
/ T
1
=z
1
p
2
V
2
/T
2
Si se sustituyen los valores conocidos:
z
2
x1barx300L/ 280 K =1xp
2
x1 L / 158 K
Simplificando:
p
2
= 169.3z
2
bar
( 1)
Tngase en cuenta que el factor z
2
es funcin de la presin reducida y de la temperatura reducida del estado 2:
T
r2
=T
2
/T
cri
y p
r2
=p
2
/p
cri
As que podemos calcular Tr
2
; pero no pr
2
, ya que p
2
es precisamente la incgnita, sin embargo, podemos tomar la ecuacin
1 y dividirla entre la p
cri
, obtenindose una ecuacin equivalente pero en trminos de la presin reducida:
p
2
/p
crit
=169.3z
2
/ p
crit,
equivalente a:
pr
2
=169.3z
2
/37.7 bar pr
2
/z
2
= 4.5
( 1.a)
Esta ltima expresin se puede resolver, por iteraciones sucesivas o tanteo, suponiendo pr
2
y leyendo el valor del factor
z
2
del Diagrama de Compresibilidad Generalizado, hasta que se cumpla la igualdad, pero antes se necesita calcular la
temperatura reducida:
Tr
2
=158 K / 132 K=1.2
Hagamos una tabla para el tanteo:
Dada
Tr
2
Suponga
pr
2
Del Diagrama
z
2
pr
2
/z
2
1.2 2 0.57 3.5
1.2 1 0.80 1.25
1.2 2.2 0.55 4.5
(valor correcto)
Por lo tanto:
p
2
=p
r2
xp
crit
=2.2 x 37.7 bar =82.94 bar
Si se hubiera supuesto comportamiento de gas ideal se encontrara una p
2
=169 bar, que es un valor bastante diferente.
ANEXO
INTERPOLACION DE LA PRESION FINAL: P
3
(Doble interpolacion) (Problema # 1 )
Para obtener el valor de la presin solicitada iremos en principio a buscar en la tabla de vapor Sobrecalentado,
volmenes especficos que estn en el orden de 7.46 pie
3
/Lbm. Los mismos aparecen en el bloque de la presin de 60
Psia. Sin embargo la temperatura de 300 F no aparece, por lo cual debemos interpolar para obtener el volumen especfico a
esa temperatura:
A 60 Psia:
T ( F) (pie
3
/Lbm)
292.73 7.177
300 X
320 7.485
Resolviendo:
@ 60 Psia, 300F
=7.259 pie
3
/Lbm
Este valor es inferior a 7.46 pie
3
/Lbm., as ahora se necesita obtener un valor superior para poder hacer la interpolacin
final. En este caso para la presin de 40 Psia, se observan volmenes especficos superiores al que tenemos. Interpolando
para una temperatura de 300 F , se tiene:
A 40 Psia:
T ( F) (pie
3
/Lbm)
280 10.711
300 X
320 11.360
Resolviendo:
@ 40 Psia, 300 F
=11.0355 pie
3
/Lbm
Ahora como ya tenemos 2 volmenes especficos a 300 F si podemos interpolar para obtener la presin:
A 300 F
(pie
3
/Lbm) P (Psia)
11.0355 40
7.46 X
7.259 60
Resolviendo:
P=58.94 Psia 59 Psia
Das könnte Ihnen auch gefallen
- HISTORIA DEL TIEMPO - La Teoría Del Desdoblamiento - Jean-Pierre Garnier-MaletDokument9 SeitenHISTORIA DEL TIEMPO - La Teoría Del Desdoblamiento - Jean-Pierre Garnier-Maletsofia serranoNoch keine Bewertungen
- Prueba Ignición TercelDokument13 SeitenPrueba Ignición Tercelakiralxr100% (1)
- Practica 5 Lab. EstaticaDokument12 SeitenPractica 5 Lab. Estatican94a3tjo_9Noch keine Bewertungen
- Satucesa Big BagsDokument16 SeitenSatucesa Big BagsDavid Fernando Tirado Ariza100% (1)
- Polimeros y Materiales CompuestosDokument21 SeitenPolimeros y Materiales CompuestosAlanGalvez50% (2)
- Practica 6 Lab. EstaticaDokument14 SeitenPractica 6 Lab. Estatican94a3tjo_9Noch keine Bewertungen
- Fabricación de ResortesDokument3 SeitenFabricación de Resortesn94a3tjo_9Noch keine Bewertungen
- Practica Identificacion de PlasticosDokument11 SeitenPractica Identificacion de Plasticosn94a3tjo_9Noch keine Bewertungen
- ResortesDokument3 SeitenResortesn94a3tjo_9Noch keine Bewertungen
- Practica 3 Analisis de CircuitosDokument6 SeitenPractica 3 Analisis de Circuitosn94a3tjo_9Noch keine Bewertungen
- Lectura 8 Franz KafkaDokument4 SeitenLectura 8 Franz Kafkan94a3tjo_9Noch keine Bewertungen
- Practica 1Dokument2 SeitenPractica 1n94a3tjo_9Noch keine Bewertungen
- ACE Práctica 3Dokument2 SeitenACE Práctica 3n94a3tjo_9Noch keine Bewertungen
- (Rodriguez) Dinámica de Sistemas FísicosDokument676 Seiten(Rodriguez) Dinámica de Sistemas FísicosAlfonso Armando Pérez CerdaNoch keine Bewertungen
- Practica 8 Perdidas en AccesoriosDokument11 SeitenPractica 8 Perdidas en Accesoriosn94a3tjo_9Noch keine Bewertungen
- Modelado de Sistemas Fa SicosDokument17 SeitenModelado de Sistemas Fa Sicosn94a3tjo_9Noch keine Bewertungen
- ACE Práctica 2Dokument2 SeitenACE Práctica 2n94a3tjo_9Noch keine Bewertungen
- Practica Pérdidas en AccesoriosDokument6 SeitenPractica Pérdidas en Accesoriosn94a3tjo_9Noch keine Bewertungen
- Jorge Luis Sanchez A1Dokument2 SeitenJorge Luis Sanchez A1n94a3tjo_9Noch keine Bewertungen
- Apuntes-Mecanica de Fluidos 2011Dokument101 SeitenApuntes-Mecanica de Fluidos 2011Julio Miguel Fernández PradoNoch keine Bewertungen
- Manual de Lab. de Ingeniería de ManufacturaDokument204 SeitenManual de Lab. de Ingeniería de Manufacturan94a3tjo_9Noch keine Bewertungen
- Temario Analisis de CircuitosDokument6 SeitenTemario Analisis de Circuitosn94a3tjo_9Noch keine Bewertungen
- Practiac 6 Mecanica de FluidosDokument49 SeitenPractiac 6 Mecanica de Fluidosn94a3tjo_9Noch keine Bewertungen
- Lectura 6 - I. MaterialesDokument2 SeitenLectura 6 - I. Materialesn94a3tjo_9Noch keine Bewertungen
- Fragilizacion Por HidrogenoDokument1 SeiteFragilizacion Por Hidrogenon94a3tjo_9Noch keine Bewertungen
- Practica (Lab. Mecanica de Fluidos) Medidores de FlujoDokument10 SeitenPractica (Lab. Mecanica de Fluidos) Medidores de Flujon94a3tjo_9Noch keine Bewertungen
- Ética Profesional-Mito SisifoDokument2 SeitenÉtica Profesional-Mito Sisifon94a3tjo_9Noch keine Bewertungen
- Reporte Practica 7 Perdidas en TuberiasDokument9 SeitenReporte Practica 7 Perdidas en Tuberiasn94a3tjo_9Noch keine Bewertungen
- Practica 3 Cinematica-1Dokument10 SeitenPractica 3 Cinematica-1n94a3tjo_9Noch keine Bewertungen
- Cuestionario 1 Lab. MaterialesDokument1 SeiteCuestionario 1 Lab. Materialesn94a3tjo_9Noch keine Bewertungen
- Reporte T. SauzDokument9 SeitenReporte T. Sauzn94a3tjo_9Noch keine Bewertungen
- Cuento MaterialesDokument2 SeitenCuento Materialesn94a3tjo_9Noch keine Bewertungen
- Practica 4 Lab. EstaticaDokument8 SeitenPractica 4 Lab. Estatican94a3tjo_9Noch keine Bewertungen
- Practica 2 Lab. EstaticaDokument8 SeitenPractica 2 Lab. Estatican94a3tjo_9Noch keine Bewertungen
- Química Computacional I PDFDokument3 SeitenQuímica Computacional I PDFwilliam negretteNoch keine Bewertungen
- Nube ElectronicaDokument2 SeitenNube ElectronicaKiara Pamela Sanchez AliagaNoch keine Bewertungen
- Ciencia y Amb.Dokument71 SeitenCiencia y Amb.andres_c4145061Noch keine Bewertungen
- Ejercicios Resueltosenviar2Dokument18 SeitenEjercicios Resueltosenviar2Gustavo Bedolla YonesNoch keine Bewertungen
- Determinación Del Punto de EbulliciónDokument9 SeitenDeterminación Del Punto de EbulliciónJhordy Maycol Rodas QuirozNoch keine Bewertungen
- Practica 2 - Pared DelgadaDokument5 SeitenPractica 2 - Pared DelgadaClaudia OntiverosNoch keine Bewertungen
- Bobina de TeslaDokument7 SeitenBobina de TeslaAarón Amador Núñez RascónNoch keine Bewertungen
- 2°#fuerzas ElásticasDokument6 Seiten2°#fuerzas Elásticasteradata05912967% (3)
- Principios de La Técnica NIRSDokument3 SeitenPrincipios de La Técnica NIRSDaniel SaniNoch keine Bewertungen
- Catalogo de AntiderivadasDokument1 SeiteCatalogo de AntiderivadasChuy ArriagaNoch keine Bewertungen
- Cuadernillo de DatosDokument18 SeitenCuadernillo de DatosMaría José López ThienelNoch keine Bewertungen
- Ejemplo Calculo Paso A Paso de IluminacionDokument3 SeitenEjemplo Calculo Paso A Paso de IluminacionNestor Daniel Puyen MateoNoch keine Bewertungen
- CaidasDokument2 SeitenCaidasAgustin Valencia RequeNoch keine Bewertungen
- Coeficiente de Permeabilidad y Conductividad Hidraulica Del SueloDokument14 SeitenCoeficiente de Permeabilidad y Conductividad Hidraulica Del SueloVictorDavidPinoEspinozaNoch keine Bewertungen
- Ejercicios Vectores 4ºDokument4 SeitenEjercicios Vectores 4ºusuario1983Noch keine Bewertungen
- SEMINARIO N°2 Campo ElectricoDokument2 SeitenSEMINARIO N°2 Campo ElectricoJohn BMNoch keine Bewertungen
- Fallas SimetricasDokument7 SeitenFallas SimetricasCristian Olguin CornejoNoch keine Bewertungen
- Reporte 4.Dokument12 SeitenReporte 4.Kevin CalzadaNoch keine Bewertungen
- Guía La LuzDokument12 SeitenGuía La LuzCartas Myl Chillan CartasNoch keine Bewertungen
- Sensor UltrasonicoDokument4 SeitenSensor UltrasonicoelzytacogelonaNoch keine Bewertungen
- Instrumentos de laboratorio para medición y análisis de muestrasDokument15 SeitenInstrumentos de laboratorio para medición y análisis de muestrasVanessa MarisolNoch keine Bewertungen
- Resistencia Térmica por ContactoDokument6 SeitenResistencia Térmica por Contactoalfredoreymer100% (1)
- Solidos Platonicos Genesis PDFDokument22 SeitenSolidos Platonicos Genesis PDFGreivanNoch keine Bewertungen
- Trabajo de Mecánica de Fluidos. 2017-I PDFDokument7 SeitenTrabajo de Mecánica de Fluidos. 2017-I PDFJoseNoch keine Bewertungen
- Practica RefractometriaDokument2 SeitenPractica RefractometriaIgnacio Jiménez García-HirschfeldNoch keine Bewertungen
- 3 Estructuras de Solidificacion de Los Metales2Dokument4 Seiten3 Estructuras de Solidificacion de Los Metales2fany pmNoch keine Bewertungen