Beruflich Dokumente
Kultur Dokumente
Físico Solucionarios
Hochgeladen von
Jhon TurnerCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Físico Solucionarios
Hochgeladen von
Jhon TurnerCopyright:
Verfügbare Formate
INDICE
INTRODUCCION ................................................................................................................................. - 1 -
PROBLEMAS DE APLICACIN, GASES REALES E IDEALES ............................................... - 2 -
FISICOQUIMICA FARRINGTON DANIELS .............................................................................. - 2 -
FISICOQUIMICA GILBERT CASTELLAN ................................................................................................. - 48 -
GASES REALES ................................................................................................................................ - 76 -
PROBLEMAS DE APLICACIN PRIMERA LEY DE LA TERMODINMICA .............................................. - 89 -
FISICOQUIMICA FARRINGTON DANIELS ............................................................................................. - 89 -
FISICO QUIMICA GILBERT CASTELLAN .............................................................................................. - 131 -
TERMOQUMICA ............................................................................................................................ - 157 -
FISICOQUIMICA GILBERT CASTELLAN ............................................................................................... - 157 -
FISICOQUIMICA FARRINGTON DANIELS ........................................................................................... - 180 -
SEGUNDA LEY DE LA TERMODINMICA ........................................................................... - 218 -
FISICOQUIMICA FARRINGTON DANIELS ........................................................................... - 218 -
FISICOQUIMICA GILBERT CASTELLAN ............................................................................................... - 252 -
ENERGIAS LIBRES ........................................................................................................................... - 282 -
FISICOQUIMICA FARRINGTON DANIELS ........................................................................................... - 282 -
TRATADO DE FISICOQUIMICA LUIS ROMO ....................................................................................... - 307 -
ESPONTANIEDAD Y EQUILIBRIO ..................................................................................................... - 316 -
FISICOQUIMICA GILBERT CASTELLAN ............................................................................................... - 316 -
ANEXOS ......................................................................................................................................... - 333 -
INTEGRANTES ................................................................................................................................ - 335 -
- 1 -
INTRODUCCION
Con el fin de entender de manera fenomenolgica y terica los procesos de la
Fisicoqumica se realiz este compendio de ejercicios resueltos analizando su
comportamiento.
Desde la antigedad se ha estudiado los gases ideales y reales, que hoy con ese
conocimiento hemos aplicado en el desarrollo de los ejercicios ya que en la mayora de
las aplicaciones de la ingeniera estn inversos.
La primera ley de la termodinmica tiene una importancia trascendental en el desarrollo
de la humanidad, ya que esta expres que al igual que con la masa, la energa no se crea
ni se destruye, solo se transforma. En el campo de la fisicoqumica esto es de vital
importancia, debido a que para tener un claro entendimiento de lo que pasa en un
proceso, se debe entender que para que algo realice un trabajo sobre el mismo, se debe
ganar o perder energa.
La termoqumica hemos aplicado conocimientos previos de qumica lo cual es
fundamental en la fisicoqumica para el entendimiento del fenmeno relacionado en las
reacciones qumicas para saber si es que una reaccin qumica es espontnea o
inverosmil.
La segunda ley de igual manera trata que una reaccin qumica espontnea hace que la
entropa aumente, se procedi a aplicar los conocimientos y se trat la entropa y el
comportamiento emprico del funcionamiento de una mquina desde el punto de vista
fisicoqumico.
Por esta razn fue necesaria otra funcin termodinmica, las Energas libres, es capaz de
realizar trabajo a medida que el sistema tiende al equilibrio.
De esta forma se puede explicar mejor los fenmenos que suceden en la naturaleza, en
el laboratorio y en la industria. Como en el caso de nuestro estudio, compresiones,
expansiones de gases, reacciones qumicas, mquinas, que pueden ser ideales o reales,
licuefaccin de gases, que es un proceso de mucha utilidad en la industria moderna,
entre otros procesos, lo cual indica la gran vala de estos postulados y la necesidad del
estudiante de aprender estos conceptos.
- 2 -
PROBLEMAS DE APLICACIN, GASES REALES E IDEALES
FISICOQUIMICA FARRINGTON DANIELS
1.1. Calcular el volumen ocupado por 20g de bixido de carbono a una presin de
740 mm Hg y a 30
0
C, tomando en cuenta que se obedece la ley de los gases
ideales.
Datos:
m = 2u g
t = Su C
P= 740 mm Hg
Solucin:
I = Su C +27S,1S
I = SuS,1S K
P = 74u mmEg -
1utm
760mmHg
P = u,97 otm
Al ser gas ideal tenemos:
I =
nRI
P
I =
m
H
-
RI
P
I =
2ug - u,u82uS
otm - I
mol - K
- SuS,1S K
44
g
mol
- u,97otm
1.2. En un aparato de Vctor Meyer la evaporacin de 0,110 g de un hidrocarburo
puro, H-(CH
2
) n-H, desplaza 27ml de aire medidos en una bureta de mercurio
a 26,1
0
C y 743 mm Hg Cul es el peso molecular del hidrocarburo y el valor
de n?
Datos:
Fig: 1.1-1
V= 11, 65 L
- 3 -
m = u,11u g
t = 26,1 C
I = 27 mI
P = 74S mm Eg
Solucin:
I = t, C +27S,1S
I = 26,1 C +27S,1S
I = 299,17 K
P = 74S mmEg -
1otm
76ummEg
P = u,977 otm
Volumen ser igual al volumen del aire que ha desplazado
I = u,u27 I
PI = nRI
Calculo del peso molecular del hidrocarburo.
H =
mRI
PI
H =
u,11ug - u,u82uS
otm- I
mol - K
- 299,1K
u,977otm - u,u27I
Calculo del nmero de moles, mediante la ecuacin de Vctor Meyer
H = 14 - n +2
1u2,27 = 14 - n + 2
Respuesta:
Fig: 1.3.2-1
M= 102, 27
g
moI
n = 7 mol
- 4 -
1.3. Calcular el peso molecular promedio del aire saturado con vapor de agua, a
25
0
C y a una presin total de 1 atm. La presin de vapor del agua a esta
temperatura es de 23,7 mm Hg. Considrese al aire como formado por 80% de
nitrgeno y 20% de oxgeno en volumen.
Datos:
t = 2S
P = 1 otm
P
,H
2
0
= 2S,7 mmEg
Aire:
N
2
= 80%
O
2
= 20%
Solucin:
Peso molecular del aire:
H = XiHi
H = u,8 - 28 +u,2 - S2
H = 28,8
g
mol
Anlisis del aire Hmedo:
Al ser aire saturado la presin que aporta el agua ser el mismo valor de la presin
de vapor de agua a 25
0
C, ya que tenemos una humedad del 100%
P
,H20
= 2S,7mmEg -
1otm
76ummEg
P
,H20
= u,uS1 otm
Calculo de la presin del aire
P
uc
= P
1
-P
,H20
P
uc
= (1 -u,uS1)otm
P
uc
= u,969 otm
Fig: 1.3.3-1
- 5 -
Tabla: 1.3.3-1
Componentes de la mezcla
Componente Pi, atm Xi Mi, g/mol Xi*Mi
Aire 0,969 0,969 28,8 27,9
Agua(v) 0,031 0,031 18 0,558
H
mczcIu
= XiHi
H
mczcIu
= u,969 - 28,8 +u,uS1 - 18
1.4. Calcular el nmero de toneladas de bixido de carbono, sobre una superficie
de una milla cuadrada, si la presin atmosfrica es de 760 mm Hg y el aire
contiene 0,046 % en peso de CO
2.
Datos:
P = 760 mm Hg
% Aire = 0,046
Solucin:
Conociendo la altura desde el nivel del mar hasta la tropsfera, lugar en donde se
encuentra el aire podemos calcular el volumen ocupado por este.
b = 16Km-
1uuu m
1 km
b = 16uuum
I = A - b
I = 1millo
2
- 16uuum -
(16u9,S)
2
m
2
1millo
2
-
1uuuI
1m
3
I = 4,14x1u
13
I
Considerando la temperatura ambiente: I = 298 K
M
mezc|a
= 28, 4
g
mu|
- 6 -
n
uc
=
PI
RI
n
uc
=
1 - 4,14x1u
13
u,u82 - 298
n
uc
= 1,7x1u
12
molcs
m
uc
= n - H
m
uc
= 1,7x1u
12
- 28,8
m
uc
= 4,9x1u
13
g
m
C02
= 4,9x1u
13
- u,u46 = 2,2Sx1u
12
g
m
C02
= 2,2Sx1u
12
g -
1ton
1u
6
g
1.5. Se llenan los matraces A y B con oxgeno y nitrgeno, respectivamente, a 25
0
C
y se conectan por medio de una llave.
Tabla: 1.3.5-1
Datos
Gas Gas Volumen,
ml
Presin, atm
A O
2
500 1
B N
2
1500
Calcular (a) la presin total, (b) la presin parcial de cada gas y (c) la fraccin
molar del oxgeno en la mezcla final.
Fig: 1.3.5-1
m
C02
= 2,2Sx1u
6
IonJcC02
- 7 -
Solucin:
Al no existir variacin de temperatura, el proceso es isotrmico.
Calculo de la presin final del O
2
P
2
=
P
1
I
1
I
2
P
2
=
(1otm) - (u,SI)
(2I)
Presin final del N2
P
2
=
P
1
I
1
I
2
P
2
=
[
1
2
otm - (1,S I)
(2 I)
Presin total del sistema
P
1
= P
02
+P
N2
P
1
= u,2S +u,S7S
Fraccin molar en la mezcla final
X
02
=
P
02
P
1
X
02
=
u,2S
u,62S
X
02
= u,4
P
1
= u,62S otm
P
2
= u,2S otm
P
2
= u,S7S otm
- 8 -
1.6. A 55
0
C y 1 atm el N
2
O
4
se disocia un 50,3% en NO
2
de acuerdo con la reaccin
N
2
O
4
=NO
2
Cul es la densidad del gas? (b) Cul es el peso
molecular promedio del gas?
Solucin:
El gas se refiere a la mezcla de N
2
O
4
+ NO
2
, luego de la disociacin
I = SSC = S28 K
Peso molecular del gas
Base de clculo 100g de la mezcla
Tabla: 1.3.6-1
Datos
Gas Mi, g/mol masa, g ni=m/M Xi XiMi
NO2 46 50,3 1,09 0,67 30,82
N2O4 92 49,7 0,54 0,33 30,36
H
mczcIu
= XiHi = Su,82 +Su,S6 = 61,18
g
mol
Si se asume como un gas ideal se tiene:
H
mczcIu
=
PH
RI
=
1 - 61,18
u,u82 - S28
= 2,27
g
I
Respuesta:
H
mczcIu
=
2,27g
I
; H
mczcIu
=
61,18g
mol
Fig: 1.3.6-1
- 9 -
P, atm
1
1/3
2/3
1/2
/P, g/atm-L
1.7. La densidad del amoniaco, fue determinada a distintas presiones pesando el
gas contenido en grandes bulbos de vidrio. Los valores obtenidos a 0
0
C, en
gramos por litro, fueron los siguientes: 0,77159 a 1 atm, 0,51185 a 2/3 de atm,
0,38293 a de atm, 0,25461 a 1/3 de atm. (a) Cul es el peso molecular del
amoniaco? (b) considerando que el peso atmico del hidrgeno es igual a
1,008, Cul ser el peso atmico del nitrgeno?
Tabla: 1.3.7-1
Datos
,( g/L) 0,77169 0,51185 0,38293 0,25461
P, (atm) 1 2/3 1/2 1/3
/P, (g/atmL) 0,77169 0,76777 0,76586 0,76383
Diagrama: /P=f(P)
(a)
o
P
= (
o
P
)
0
+ mP
m =
A[
o
P
AP
m =
u,77169 -u,76S8S
1 -1S
m = u,u1179
g
otm
2
I
u,77169 = _
o
P
]
0
+ u,u1179 - 1
Fig: 1.3.7-1
- 10 -
_
o
P
]
0
= u,7S99
g
otmI
H = _
o
P
]
0
RI = u,7S99 - u,u82 - 27S,1S
H = u,7S99 - u,u82 - 27S,1S
(b)
H
N
= 17,u11 -S - 1,uu8
1.8. La temperatura crtica del tetracloruro de carbono es de 283,1
0
C. Las
densidades en gramo por mililitro, del lquido l y del vapor v a diferentes
temperaturas son las siguientes.
Tabla: 1.3.8-1
Datos
t (
0
C) 100 150 200 250 270 280
l (g/ml) 1,4343 1,3215 1,1888 0,9980 0,8666 0,7634
v (g/ml) 0,0103 0,0304 0,0742 0,1754 0,2710 0,3597
Cul ser el volumen molar crtico del CCl
4
?
Mediante extrapolacin del grafico se obtiene la densidad crtica.
l
v
H
N
= 1S,98 g mol
H = 17,u11
g
mol
Fig: 1.3.8-1
- 11 -
pc = u.S6S9
g
ml
Peso molecular tetracloruro de carbono:
H = 12 +4 - SS.S
H = 1S4
g
mol
Por lo tanto:
Ic =
H
pc
Ic =
1S4gmol
u.S6S9gml
Ic = 27S.1
ml
mol
Ic = 27S.1
ml
mol
-
1I
1uuuml
1.9. Utilizando la ecuacin de Van der Waals, calcular la presin ejercida por una
mol de bixido de carbono a 0
0
C en un volumen de (a) 1 litro, (b) 0,05 litros,
(c) Repetir los clculos a 100
0
C, en 0,05 litros.
Datos:
Constantes de Van der Waals para el CO2 son:
o = S,S92 otmI
2
- mol
-2
b = u,u4267 Imol
-1
Fuente: Tratado de fisicoqumica, Luis A. Romo
Fig: 1.3.9-1
Ic = u.27S1
I
mol
- 12 -
Solucin:
(a)
V1= 1 litro
P1 =
RI
I1 -b
-
o
I1
2
P1 =
[u,u82uS
otmI
mol
- (27S,1SK)
(1I) -(u,u4267
I
mol
)
-
(S,S92
otmI
2
mol
2
)
(1I)
2
(b)
V2=0,05 litros
P2 =
RI
I2 -b
-
o
I2
2
P1 =
[u,u82uS
otmI
mol
- (27S,1SK)
(u.uSI) - (u,u4267
I
mol
)
-
(S,S92
otmI
2
mol
2
)
(u.uSI)
2
(c)
V3=0,05 litros y T3=373,15
PS =
RIS
IS -b
-
o
IS
2
P1 =
[u,u82uS
otmI
mol
- (S7S,1SK)
(u.uSI) - (u,u4267
I
mol
)
-
(S,S92
otmI
2
mol
2
)
(u.uSI)
2
P1 = 19,81 otm
P1 = 1619,1 otm
P1 = 27u4u,1 otm
- 13 -
1.10. Calcular el volumen que ocupa una mol de metano a 0
0
C y 50 atm utilizando
(a) la ley de los gases ideales y (b) la ecuacin de Van der Waals. En los
clculos de la parte (b) la solucin cbica se puede evitar usando el mtodo de
aproximaciones sucesivas. La ecuacin de Van der Waals se puede escribir del
mtodo siguiente.
V=
RT
P+[
a
F
2
+ h
El valor de V obtenido con le ecuacin de los gases ideales, se sustituye en el
lado derecho de esta ecuacin, calculando un valor aproximado de V. Este
valor se sustituye nuevamente en el lado derecho de la ecuacin para obtener
un valor de V aun ms exacto. Este proceso se contina hasta que el valor
calculado de V sea esencialmente el mismo que el utilizado en la sustitucin en
el lado derecho de la ecuacin.
Solucin:
(a)
I =
nRI
P
=
1 - u,u82 - 27S
Su
= u,448 I
I =
(1mol) - [u,u82uS
otmI
molK
- (27S,1SK)
(Suotm)
(b)
Primera sustitucin:
V=
R1
P+[
c
v
2
+ b
I =
[u,u82uS
otmI
molK
- (27S,1SK)
(Suotm) +
(2,2SS
otmI
2
mol
2
)
(u,448I)
2
+(u,u4278
I
mol
)
I = u,448 I
I = u,4u I
- 14 -
Segunda sustitucin:
I =
RI
P +[
o
I
2
+ b
I =
[u,u82uS
otmI
molK
- (27S,1SK)
(Suotm) +
(2,2SS
otmI
2
mol
2
)
(u,4uI)
2
+(u,u4278
I
mol
)
1.11. Calcular el volumen ocupado por un kilogramo de bixido de carbono a 100
0
C y 50 atm empleando (a) la ecuacin de los gases ideales y (b) la grfica de
Hougen-Watson-Ragatz
Solucin:
(a)
I =
nRI
P
I =
(1uuug)
(44
g
mol
)
- [u,u82uS
otmI
molK
- (S7S,1SK)
(Suotm)
(b)
Factor de compresibilidad y las respectivas constantes crticas.
Fig: 1.3.11-1
I = u,S9I
I = 1S,91 I
- 15 -
Ic = Su4,16 K
Pc = 72,8S otm
Ir =
I
Ic
=
S7S,1SK
Su4,16K
= 1,2S
Ir =
S7S,1SK
Su4,16K
Pr =
P
Pc
Pr =
Suotm
72,8Sotm
Z = u,82 obtcniJo cn cl Jiogromo Bougen -Watson -Ragatz
I =
znRI
P
I =
(u.82)
(1uuug)
(44
g
mol
)
- [u,u82uS
otmI
molK
- (S7S,1SK)
(Suotm)
Ir = 1,22
Pr = u,68
I = 11,4 I
- 16 -
1.12. Calcular el segundo coeficiente virial para el hidrgeno a 0
0
C partiendo del
hecho que los volmenes molares a 50, 100, 200 y 300 atm son 0,4624;
0,2386; 0,1271 y 0,09004 litro mol
-1.
Respectivamente.
Solucin:
Conociendo que el segundo coeficiente virial es la extrapolacin hasta
1
v
= u de
la grfica
V ((PV/RT)-1) = f (
1
v
= u ), entonces:
Datos:
I = 27S K
Tabla: 1.12-1
Datos
P, otm 50 100 200 300
o,
I
mol
0,4624 0,2386 0,1271 0,09004
__
P
RI
] -1_ , Imol
0,01516 0,01571 0,01723 0,01861
1
o
,
mol
I
2,16 4,19 7.86 11,11
Diagrama: j[
P
R1
-1[=f (
1
6
)
Fig: 1.3.12-1
- 17 -
Calculo de la pendiente:
m =
Aj[
P
RI
-1[
A
1
o
m =
(u,u1S71 -u,u1S16)Imol
(4,19 - 2,16)
mol
I
m = 2,7x1u
-4
I
2
mol
2
Ecuacin de tendencia:
__
P
RI
] -1_ = 2.7x1u
-4
1
o
+__
P
RI
] -1_
0
j[
P
R1
-1[
0
= [u,u1S16
L
moI
-[2,7x1u
-4
L
2
moI
2
- (2,16
moI
L
)
1.13. Se hizo el vaco en un bulbo de vidrio provisto de una llave y se encuentra que
su peso era 46,8542 g sin tomar en cuenta el empuje del aire. Al abrir la llave
y llenar el bulbo con aire, el peso aument a 47,0465 g. La presin
baromtrica fue de 745 mm y la temperatura de 27 . (a) Calcular el volumen
total del bulbo sabiendo que el peso molecular promedio del aire es de 28,8.
(b) Calcular el peso del bulbo si se llenara con hidrgeno seco a las mismas
condiciones de temperatura y presin.
Datos:
m1 sin aire = 46,8542 g
m2 con aire = 47,0465
t= 27 C = 300 K
P = 745 mm Hg= 0.98atm
Solucin:
__
Pv
RI
_ -1_
0
= u,u14S
I
mol
- 18 -
Maire = 28,8 g mol
-1
maire = m2-m1
maire = 0,1923g
a)
PI = nRI
PI =
mRI
H
I =
mRI
PH
I =
(u.192Sg) [u.u82uS
otmI
molK
(Suu,1SK)
(1otm)(28,8
g
mol
)
b)
PI =
mRI
H
m =
PIH
RI
m =
(1otm)(u,164I)(2
g
mol
)
[u.u82uS
otmI
molK
(Suu,1SK)
m = 1S.S1 - 1u
-3
g E2
Calculo de la masa del bulbo total:
mbulbo = m1 + mE2
mbulbo = 46,8S42g +1S.S1 - 1u
-3
g
mbulbo = 46,867Sg
I = u,164I
- 19 -
1.14. Qu masa puede soportar un globo que contenga 1000 litros de helio a 25 y
presin de 1 atm? Puede tomarse el peso molecular promedio de aire como
28,8.
Datos:
V He = 1000 L
M He = 4 gmol
-1
M aire = 28,8 gmol
-1
T= 298 K
P= 1 atm
Solucin:
PI = nRI
PI =
mRI
H
m =
PIH
RI
m =
(1otm)(1uuuI)(4
g
mol
)
[u.u82uS
otmI
molK
(298,1SK)
1.15. El coeficiente de expansin trmica se define como
Y el de compresibilidad se define como
[ = -
1
v
_
oI
oP
]
T
Calcular estas cantidades para el gas ideal.
m = 16S,S1g
1000L He
Fig: 1.3.14-1
- 20 -
Solucin:
Para
(1)
GAS IDEAL
PV = nRT
I =
nR1
P
(2)
(
dv
d1
)
P
=
nR
P
(3)
(1) y (3) en (1)
o =
P
nRI
(
nR
P
)
Para
= -
1
V
[
6v
6P
T
(1)
GAS IDEAL
PV = nRT
I =
nR1
P
(2)
(
dv
dP
)
1
= -
nR1
P
2
(3)
(2) y (3) en (1)
= -
P
nRI
(-
nRI
P
2
)
o =
1
I
=
1
P
- 21 -
1.16. La temperatura puede definirse como una funcin lineal de alguna propiedad
M. Si esta propiedad tiene el valor Mi en el punto de congelacin y la
propiedad Ms en el punto de evaporacin, dervese la ecuacin para expresar
la temperatura en la escala centgrada.
El astrnomo sueco Anders CELSIUS, habiendo verificado la constancia de la
temperatura de fusin y ebullicin del agua a una presin dada, decide emplear
estas temperaturas como puntos fijos de referencia, para la construccin de una
escala termomtrica fcilmente reproducible.
Diagrama V = f(t)
Diagrama, Punto triple del agua
Solucin:
T (K) = t (C)
Fig: 1.3.16-1
Fig: 1.3.16-2
- 22 -
(T T
0
) K = (t- t
0
) C
T = t + 273.15
T
0
= t
0
+ 273.15
(t + 273.15 (t
0
+ 273.15)) K = (t- t
0
) C
(t t
0
)K = (t t
0
) C
1 K = 1 C
1.17. Suponiendo que el aire se comporta como un gas ideal, calcular la densidad
del aire de 25 y 1 atm si la humedad relativa del aire es de 70%. La presin
del vapor del agua a 25 es de 23.7 mm. La composicin del aire seco, en
volumen es de 80% de nitrgeno y 20% de oxgeno.
Datos:
T= 25 C
PV aire = 23.7 mm Hg
P = 1 atm
HR = 70%
Solucin:
T= 25 C + 273.15 K
T= 298.15 K
t,C= T,K 273,15
Fig: 1.3.17-1
- 23 -
Tabla 1.3.17-1
Datos
MEZCLA PM , gmol
-1
Xi aire seco Xi, mezcla Pi, mm Hg a nivel del
mar
N2 28 0.80 0.78 594.73
O2 32 0.20 0.20 148.68
H2O 18 ------- 0.02 16.59
TOTAL M= XiMi=
28,60
1.00 1.00 760
HR =
|PVaIrc]HR
PVaIrc
1uu
PVaire =
HR
100
(PVaire)
PVaire = [
70
100
2S.7 mm Bg
25C, 1atm
PVaire = 16.59 mm Hg
PV = nRT
PM = mezcla RT
mezcla =
PM
R1
mezcla =
1atm (28.60
g
moI
)
0.08205
atm L
moI K
(298.15K)
mezcla =1.69
g
L
- 24 -
1.18. (a) Cuntos gramos de aire habr en la atmsfera que rodea a la tierra
suponiendo que es una esfera con un dimetro de 12 millones de metros y la
presin atmosfrica es de 760 mm sobre cualquier punto? (b) Cuntas moles
de aire habr en la atmsfera suponiendo que el peso molecular promedio del
aire es de 28.8? (c) Cuntas molculas de oxgeno habr en la atmsfera
terrestre si un quinto del volumen total del aire est formado por oxgeno?
Datos:
D = 12 10
6
m
P = 760 mm Hg
T ideal = 273 K
M aire= 28.84 g/mol
Solucin:
P=
760 mm dc Hg
760 mm dc Hg
1otm
P= 1 atm
Solucin:
Vesfera =
1
6
n
3
Vesfera =
1
6
n(12 1u
6
m)
3
Vesfera = 9.u477 1u
20
m
3
1000L
m
3
a) PV = nRT
PV =
g
Muc
RI
g aire =
PvMuc
R1
Vesfera = 9.0477 10
23
L
Fig: 1.3.18-1
- 25 -
g aiie =
1 atm (9.u477 1u
23
L)(28.84
g
mol
)
u.u82uS
atm L
mol K
(T)
b) n aire =
g uc
Muc
n aiie =
S.18u 1u
26
g
T
28.84
g
mol
c)
1
5
V aire = V O
2
1
5
V aire =
1
5
(9.0477 10
23
L)
PV = nRT
n =
Pv
R1
=
1 atm (1,809 10
23
L)
0,08205
atm L
moI K
(T))
Molculas de O
2
= n O
2
f(T) N
0
Molculas de O
2
= 2,204 10
24
moI
1
6.023 10
23
moIccuIus
moI
g aire f(T) = 3.180 10
26
g
n aire f(T)= 1.10310
25
moI
1
V O
2
= 1.809 10
23
L de O
2
n O
2
f(T)= 2,204 10
24
moI
1
Molculas de O
2
= 1.328 10
48
moIccuIus
moI
- 26 -
1.19. Una mezcla compuesta por 0.1 g de hidrgeno y 0.2 g de nitrgeno se va a
almacenar a 760 mm de presin y a 26. (a) Cul ser el volumen del
recipiente? (b) Cul ser la fraccin molar del hidrgeno en la mezcla? (c)
Cul ser la presin parcial del H
2
?
Datos:
P = 760 mm Hg
T = 26 C
Solucin:
T= 26 C + 273.15 K
T= 299.15 K
P=
760 mmdcHg
760 mmdcHg
1otm
P= 1 atm
Tabla 1.3.19-1
Datos
MEZCLA gi
Mi ,
g
mu|
ni =
g|
M|
, mol Xi =
n|
n
Pi = Xi P,
atm
H2 0.1 2 0.05 0.88 0.88
N2 0.2 28 0.0071 0.12 0.12
TOTAL 0.3 M = XiMi =
5.12
0.0571 1.00 1
a) PV = nRT
Fig: 1.3.19-1
- 27 -
V =
nR1
P
V =
0.0571moI(0.08205
atm L
moI K
) (299.15 K)
1 utm
b) P
T
= X
H2
P
H2
+ X
N2
P
N2
PH2 = XH2 PT
1.20. La relacin entre la densidad del cloruro de etilo y la presin en atmsferas, a
diferentes presiones, a 0, es la siguiente: 2.9002 g litro
-1
atm
-1
a 760 mm,
2.8919 a 475 mm, 2.8863 a 285 mm. Calcular el peso molecular del cloruro de
etilo y el peso atmico del cloro usando el mtodo de la fig. 1.3 conociendo los
pesos atmicos del carbono y del hidrgeno.
Tabla 1.3.20-1
Datos
/P ,
g
L atm
P ,atm
2.9002 1.000
2.8919 0.601
2.8863 0.375
Datos:
T = 0 C
Desarrollo:
T = 0 C + 273.15 K
T = 273.15
V= 1.401 L
PH2= 0,88 atm
- 28 -
Diagrama: /P =f(P)
Fig. 1.3.20-1: Densidad limite del cloruro de etilo
lim
P-0
(
o
P
) = (
o
P
)
0
PV = nRT
PI =
g
H
RI
H =
oRI
P
H = (
o
P
)
0
RI
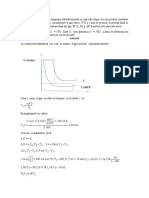
(
o
P
)
0
= u,u22P + 2,878
Si P = 0 atm (/P)
0
= 2.878
M = 2.878
g
moI
(0.08205
utm L
moI K
)(273.15 K)
M = 64,47
g
moI
- 29 -
1.21. Las densidades en gramos por centmetro cbico del ter metlico lquido y
gaseoso, a distintas temperaturas, son las siguientes:
Tabla 1.3.21-1
Densidad del ter metlico lquido y gaseoso a diferentes temperaturas
C 30 50 70 100 120
l 0,6455 0,6116 0,5735 0,4950 0,4040
v 0,0142 0,0241 0,0385 0,0810 0,1465
Calcular la densidad y la temperatura crtica.
Solucin:
Las constantes crticas Tc y Pc, se pueden evaluar partiendo en principio de la
isoterma crtica o mediante la aplicacin de la Regla de Cailletet y Mathias que se
las conoce con el nombre de la Ley de los dimetros rectilneos. La bisectriz del
rea comprendida dentro de la curva T del lquido y vapor es una recta que
indica que densidad media del gas disminuye linealmente con la temperatura, esta
lnea por extrapolacin permite obtener tanto la temperatura crtica, como la
densidad crtica.
Diagrama: =f(t)
Fig: 1.3.21-1
- 30 -
6,30 cm | 120 C = 126 C
| 6 cm
1,75 cm | 0,4 g/cm
3
= 0,175 g/cm
3
| 4 cm
1.22. Basndose en las constantes crticas del helio expresadas en la tabla 1.1,
calcular las constantes de Van der Waals.
Datos:
Tabla 1.3.22-1
Constantes crticas del Helio
GAS Tc, K
c, L mol
-1
Pc, atm PcVc / RTc
Helio (He) 5,3 0,0578 2,26 0,300
Solucin:
b = 1 c
3
b = 1 0,0578
3
a = 3 Pc
2
c
a = 3 (2,26)( 0,0578)
2
T
c
= 126 C
c= 0,175g/cm
3
b = 1,927 .10
-2
L mol
-1
a = 0,0227 atm L
2
mol
-2
- 31 -
1.23. La correccin tomando en cuentas las imperfecciones de los gases, mediante
la ecuacin de Berthelot
Permite calcular pesos moleculares ms exactos que los obtenidos con la
ecuacin de los gases ideales. Calcular el peso atmico del nitrgeno
considerando que la densidad del xido de ntrico, NO, a 0 y 760 mm es de
1,3402 g litro
-1
. Las constantes crticas del NO son: 177,1 K y 64 atm. El peso
atmico aceptado del nitrgeno es de 14,007.
Datos:
T = 273K Tc = 177,1 K
P = 760 mm = 1 atm Pc = 64 atm
= 1,3402 g litro
-1
Solucin:
H =
gRI
PI
(1 +
9
128
-
P
P
C
-
I
C
I
_1 -6 -
I
C
2
I
2
_)
H =
oRI
P
(1 +
9
128
-
P
P
C
-
I
C
I
_1 -6 -
I
C
2
I
2
_)
H =
1,S4u2 gI -1(u,u82uS otmI - mol
-1
K
-1
)(27S,1SK)
1 otm
(1 +
9
128
-
1 otm
64 otm
-
177,1 K
27S,1SK
_1 -6 -
177,1 K
2
27S,1SK
2
_)
Peso Molecular de NO:
M = 29,9874 g-mol
-1
- 32 -
Tabla 1.3.23-1
Peso atmico de la mezcla
No PA , gmol
-1
Xi PA calculado, gmol
-1
Oxigeno, O
2
32 0,53 15,8933
Nitrgeno, N
2
28 0,47 14,0941
TOTAL M= 30 1,00 M= 29,9874
Peso atmico del NITRGENO = 14,0941 g
1.24. Calcular el nmero de gramos de hidrgeno contenidos en un recipiente de
500 ml de capacidad cuando se introduce hidrgeno a 200 y 100 atm,
utilizando (a) la ecuacin general de los gases, (b) la ecuacin de Van der
Waals, (c) la grfica de Hougen-Watson Ragatz.
Datos:
V = 500 ml
M
H2
= 2 gmol
-1
T = 200 C = 473 K
P = 100 atm
Solucin:
a) Ecuacin general de los gases: PV = nRT
PV = g RT
M
g = PVM
H2
RT
g =
100 atm (0,5 L) 2 gmoI
0,08205 atm L moI-1 K-1 (473 K)
g = 2,577 g de Hidrgeno
- 33 -
b) Van der Waals : P = nRT _ n
2
a
V b V
2
a = 0,2444 atm L
2
mol
-2
b = 0,02661 L mol
-1
P =
gRI
H(I -b)
-
g
2
o
H
2
I
2
P =
g
2
(u,244atmL
2
mol
-2
4g
2
(u,SL)
2
-
g(u,u82uSatmLmol
-1
K
-1
)(47SK
2gmol
-1
(u,SL -u,u266Lmol
-1
)
+ 1uu atm
= u
c) Hougen-Watson Ragatz
Tabla 1.3.24-1
Datos
GAS Pc,
atm
Tc, K = P / Pc = T / Tc Z g
H2 12,8 33,3 7,813 14,204 1,05 2,100
PI = nRI
I = z
RI
P
z =
PI
RI
z = 1,uS
g= 2,476 g de hidrogeno
- 34 -
n =
PI
RI
= 1,uS
n =
g
H
g = n - H
g = 1,uS - 2
1.25. Las bombas de difusin de aceite pueden usarse para obtener presiones de
10
-6
mm de mercurio, bastante rpidamente. Si el gas presente es nitrgeno y
la temperatura 25, calcular la densidad en gramos por litro.
Datos: Solucin:
N
2
=28 g/mol p =
P-M
R-1
T=298 K p =
1.32-10
-8
utm-28
g
mcl
0.08205
ctm-L
mcl-K
-298K
P= 1.32 x 10
-8
atm
1.26. Un matraz de cristal de 200 ml se llena con una mezcla de oxgeno y
nitrgeno a 25 y 1 atm. Si la mezcla pesa 0.244 g cul es el porcentaje de
oxgeno en peso?
Tabla 1.3.26-1
Datos
Gas M(g/mol) n(moles) m(g) X
m
=m
i
/m
T
%m
O
2
32 0.00374 0.120 0.492 49.2
N
2
28 0.00444 0.124 0.508 50.8
Total 0.00818 0.244 1.000 100.0
g = 2,100 g de hidrgeno
= 1.S1 - 1u
-8
g
L
- 35 -
Datos:
P= 1atm
I = 298K
m
T
= 0,244 g
V=0,2L
Solucin:
PI = nRI
1otm - u.2I = n - u.u82uS
otm- I
K - mol
- 298K
n = u.uu818 molcs
n
1
= n
02
+n
N2
u.uu818 = n
02
+ n
N2
(1)
m
1
= m
02
+m
N2
u.244 = m
02
+ m
N2
Pero m=M*n
u.244 = S2 - n
02
+28 - n
N2
(2)
Despejando n
O2
en 2
n
02
=
u.244 -28 - n
N2
S2
Reemplazando n
O2
en 1
u.uu818 =
u.244 -28 - n
N2
S2
+ n
N2
Fig: 1.3.26-1
- 36 -
n
N2
= u.uu444 molcs
Reemplazando n
N2
en 1
u.uu818 = n
02
+ u.uu444
m=M*n
m
O2
= S2
g
mol
- u.uuS74 moles
m
02
= u.12u g
1.27. A partir de las leyes de Boyle y de Gay-Lussac, dedzcase la forma de la
ecuacin de los gases ideales utilizando la ecuacin fundamental de clculo
diferencial ( Ec. A.39; Pg. 754).
Diagrama: P=f(V) V=f(T)
Fig: 1.3.27-1
n
02
= u.uuS74 molcs
m
N2
= u.124 g
- 37 -
I = I(P, I)
JI = [
v
P
1
JP + [
v
1
P
JI (1)
Ecuacin de estado de la Ley de Boyle
PI = k
1
_
oI
oP
]
1
= -
k
1
P
2
= -
PI
P
2
= -
I
P
Ecuacin de estado de la Ley de Gay-Lussac
I = k
2
I
_
oI
oI
]
P
= k
2
=
I
I
Entonces en (1):
JI = -
I
P
JP +
I
I
JI
JI = I -
I
P
JP +
I
I
JI
JI = I _-
JP
P
+
JI
I
]
JI
I
+
JP
P
=
JI
I
ln I +lnP = ln I +lnC
PI = CI
C = R
PI = RI
- 38 -
1.28. Calcular la densidad del aire a 30 C, 735 mm de presin, y una humedad
relativa de 70%: Puede suponerse que el aire seco contiene 20% de oxgeno y
80% de nitrgeno por volumen. La presin de vapor del agua a 30 es 31.8
mm.
Datos:
T=30
o
C = 303,15
o
K
P=735mmHg = 0,967atm
HR=70%
Aire seco (O
2
=20% ; N
2
=80%)
P H
2
O
(v)
= 31,8mmHg = 0,0418atm
Formulas y Solucin:
Tabla1.3.28-1
Datos
Aire
Seco
%V Xi M(g/mol) Mi*Xi
O
2
20 0.20 32 6.4
N
2
80 0.80 28 22.4
Total 100 1.00 --------- M=28.8
ER =
|P
(E20
)]
MH
P
o
(E20
)
u.7u =
|P
(E20
)]
MH
S1.8 mmEg
|P
(E20
)]
MH
= 22.26 mmEg
Fig: 1.3.28-1
- 39 -
Tabla: 1.3.28-2
Resultados
Composicin Pi(mmHg) Xi=Pi/P M(g/mol) Xi*Mi
Aire Seco 712.74 0.97 28.8 27.93
Agua (v) 22.26 0.03 18 0.55
Pi= 735 1.00 --------
H
= Xi - Hi
H
= u.97 - 28.8 +u.uS - 18
H
= 28.47 gmol
p =
P - H
R - I
p =
u.9671otm- 28.47gmol
u.u82uS
otm- I
mol - K
- SuSK
1.29. Si la presin atmosfrica es de 740 mm, cuntos kilogramos de oxgeno hay
sobre un metro cuadrado de tierra? El porcentaje en peso de oxgeno en el
aire es de 22.8.
Datos:
Patm= 740mmHg = 0,974atm
m O
2
= Kg?
A= 1m
2
p = 1.11 gI
- 40 -
Tabla: 1.3.29-1
Datos
Aire %m m(g) M(g/mol) n(mol) Xi Pi=Xi*P
(atm)
O
2
22.8 22.8 32 0.7125 0.2054 0,200
N
2
77.2 77.2 28 2.7571 0.7946 0,774
100.0 100.0 -------- 3.4696 1.0000 O,974
B.C.=100 g Aire
P =
F
A
F = 2u2S9.8 Po - 1m
2
F = 2u2S9.8 N
F = m- o
m =
2u2S9.8 N
9.8 ms
2
1.30. Calcular la temperatura crtica y el volumen de hidrgeno partiendo de las
siguientes densidades (en gramos por centmetro cbico) del lquido
l
y del
vapor
v:
Datos:
Tc=?
V H
2
=?
m= 2067, 33 Kg
- 41 -
Tabla: 1.3.30-1
Datos
C -246 -244 -242 -241
l
0,061 0,057 0,051 0,047
v
0,0065 0,0095 0,014 0,017
Diagrama: = f(T)
= 0.03214 g/cm
3
vc
=
N
p
c
vc
=
2gmol
u.uS214gcm
3
Fig: 1.3.30-1
T
c
= -240,4 K
Ic
= 62.2S cm
3
mol
- 42 -
1.31. Calcular la presin ejercida por 1 mol de bixido de carbono en litro a 25 ,
utilizando (a) la ley de los gases ideales y (b) la ecuacin de Van der Waals.
Datos:
P=?
n= 1mol CO
2
V=0,5L
T=25
o
C = 298,15
o
K
a=3,592
utm-dm
6
moI
2
b=0,04267
dm
2
moI
Desarrollo:
a)
PI = nRI
P =
nRT
v
P =
1mol - 298,1SK - u,u82u6
atm-L
mol -K
0, S L
b)
P =
R - I
I
-b
-
o
I
2
P =
u.u82uS
otm - I
mol - K
- 298K
u.S
I
mol
-u.u4267
I
mol
-
S.S92
otm- I
2
mol
2
u.S
I
2
mol
2
P = 48,9Sotm
P = S9.1u otm
- 43 -
Esta ecuacin de estado propuesta por Van der Waals relaciona la presin, el
volumen y la temperatura de un gas real de tal modo que a presiones moderadas
concuerda con los datos experimentales. Este logro se debe al hecho de que
adems de la correccin aplicada para el volumen se reconoce que la existencia de
energa de atraccin entre las molculas impone la necesidad de introducir una
correccin para presin.
1.32. (a) Utilizando la grfica de Hougen-Watson-Ragatz, calcular el volumen que
debe tener un recipiente para contener 1000 g de n-octano, C8H18 a 354 a
una presin de 50 atm. (b) Cmo debera interpretarse esta grfica si se
colocaran 1000 g de octano en este recipiente a una presin de 50 atm a 183?
Datos:
m
n-octano
= 1000g
T= 354
o
C 627,15
o
K
P= 50 atm
M= 114
g
moI
Tc= 570
o
K
Pc= 24,7 atm
V=?
Formulas y Solucin:
a)
n =
P
Pc
0 =
T
Tc
n =
m
N
n =
Su
24,7
0 =
627,1S
S7u
n =
1uuug
114gmol
n = 2,u20 = 1,1n = 8,77 mol
Para demostrar la aplicacin de este principio, se parte del corolario que firma
que todos los gases el factor de compresibilidad, Zv es una funcin singular de
variables correspondientes.
- 44 -
Mediante la grfica de Hougen-Watson-Ragatz, Zc=0,4
Z =
P - v
n - R - T
v =
u,4 - 8,77mol - u,u82u6
atm-L
mol -K
- 627,1SK
Suatm
b)
T=183
o
C = 456,15
o
K
Z =
P - v
n - R - T
Z =
Suatm- S,61 L
8,77mol - u,u82u6
atm-L
mol -K
- 4S6,1SK
v = S,61 L
Z = u,S49
Fig.1.3.32: Diagrama de Hougen-Watson-Ragatz
- 45 -
1.33. Demuestre que la ecuacin de Van der Waals se puede escribir en funcin de
la temperatura reducida Tr, de la presin reducida Pr, y del volumen
reducido Vr, como:
_P
r
+
3
F
r
2
_(3F
r
-1) = 8T
r
Si a, b y R tambin se expresan en funcin de las constantes crticas. Se puede
observar que todas las constantes relacionadas con la naturaleza individual del
gas, no se han tomado en cuenta.
P =
R - I
I
-b
-
o
I
2
Pero si:
b =
1
S
- I
c
o = S - P
c
- I
c
2
R =
8 - P
c
- I
c
S - I
c
Entonces:
P =
8 - P
c
- I
c
S - I
c
- I
I
-
1
S
- I
c
-
S - P
c
- I
c
2
I
2
P =
8 - P
c
- I
c
S - I
c
- I
S - I
-I
c
S
-
S - P
c
- I
c
2
I
2
P =
8 - P
c
- I
c
- I
(S - I
-I
c
) - I
c
-
S - P
c
- I
c
2
I
2
P = P
c
- _
8 - I
c
- I
(S - I
-I
c
) - I
c
-
S - I
c
2
I
2
_
- 46 -
P
P
c
=
8 -
I
I
c
S - I
-I
c
I
c
-
S
I
2
I
c
2
SI:
P
=
P
P
c
; I
=
I
I
c
; I
=
I
I
c
Entonces:
P
=
8 - I
S - I
-1
-
S
I
2
Despejando:
1.34. La ecuacin de Van der Waals puede ordenarse en forma de series como la
ecuacin virial. Demostrar que el segundo coeficiente virial para un gas de
Van der Waals lo da:
B = h -
a
RT
P - v = A +BP + CP
2
+BP
3
(1)
Pv = f(P) cuanuo P - u; Pv = cte
A partir de la ecuacin cbica de Van der Waals
v
3
-_b +
R - T
P
] - v
2
+
a - v
P
-
a - b
P
= u
I
3
-_b +
R - T
P
] - v
2
+
a - v
P
= u
_P
+
S
I
2
_(SI
-1) = 8I
- 47 -
1
v
2
_v
3
-_b +
R - T
P
] - v
2
+
a - v
P
_ = u
v
-_b +
R - T
P
] +
a
P - v
= u
P - _v
-_b +
R - T
P
] +
a
P - v
_ = u
P - v
-_b +
R - T
P
] - P +
a
v
= u
P - v
= _b +
R - T
P
] - P -
a
v
Pero si: v
=
R-T
P
Entonces
P - v
= (P - b + R - T) -
a
R - T
P
P - v
= (P - b + R - T) -
P - a
R - T
P - v
= R - T +P - [b -
a
R - T
P - v
= A +P - B
B = b -
a
R - T
- 48 -
PROPIEDADES EMPRICAS DE LOS GASES.
FISICOQUIMICA GILBERT CASTELLAN
2.1. Cinco gramos de etano se encuentran dentro de un bulbo de un litro de ca-
pacidad. El bulbo es tan dbil que se romper si la presin sobrepasa las 10
atmsferas. A qu temperatura alcanzar la presin del gas el valor de
rompimiento?
Datos:
Masa Etano = 5g
Si P>10 atm. El bulbo se romper
Solucin:
PV = nRT Ec.2.1- 1
n =
m
M
Ec.2.1-2
- Despejamos n de la Ec.2.1-2, sustituimos en la Ec.2.1-1 y despejamos T
T =
NPv
Rm
T =
(30gmoI)( 10 atm) (1It)
(0.082057It atmmoIK)(5 g)
T = 7S1.2SK
2.2. Un gran cilindro para almacenar gases comprimidos tiene un volumen apro-
ximado de 1.5 pies
3
. Si el gas se almacena a un presin de 150 atm a 300K,
cuntos moles de gas contiene el cilindro? Cul sera el peso del oxgeno en
un cilindro de esta naturaleza?
Datos:
V = 1.5 pies
3
P = 150 atm
T = 300 K
Solucin:
a) Cuntos moles de gas contiene el cilindro?
n =
Pv
RT
n =
(1Su atm)(1.S ft
3
)(28.S16 lt 1ft
3
)
(u.u82uS7 lt atmmolK)(SuuK)
n = 2S8.84 moles
- 49 -
b) Cul sera el peso del oxgeno en un cilindro de esta naturaleza?
- Despejamos m de la Ec.2.1-2que representa la masa del gas oxgeno.
m = nM
m = (258.84 moles) (32 g/mol)
m= (258.84 moles) (32 g/mol)
m= 8282.88g
2.3. En el sistema ilustrado en la fig. 2-13 se halla contenido helio a 30.2C. El
bulbo de nivelacin L se puede levantar para llenar el bulbo inferior con
mercurio y forzar la entrada del gas a la parte superior del dispositivo. El
volumen del bulbo 1 hasta la marca b es de 100.5 cm
3
y el del bulbo 2 entre
las marcas a y b es de 110.0 cm
3
. La presin del helio se mide por la diferen-
cia entre los niveles del mercurio en el dispositivo y en el brazo evacuado del
manmetro. Cuando el nivel del mercurio est en a la presin es 20.14 mm de
Hg. Cul es la masa de helio en el recipiente?
Datos:
mHe = 4g/mol
T = 30.2C = 303.35K
V
1
= 100.5 cm
3
V
2
= 110.0 cm
3
P
a
= 20.14mm Hg = 0.0265 atm
Figura 2.13: Equipo de Bulbos combinados de Helio y Mercurio
Fuente: Fisicoqumica de Castelln, captulo 2 Propiedades Empricas de los
gases, pg. 24
- 50 -
Solucin:
V
T
=Volumen total de He
V
T
=V
1
+ V
2
V
T
=(100.5 + 110.0) cm
3
V
T
= 210.5 cm
3
= 0.2105L
- Despejamos m de la Ec.2.1-2 y reemplazamos en la Ec.2.1-1 que representa la
masa total del sistema.
m =
PvN
RT
m =
(0,0265 atm)(0,2105 L)[4
g
moI
[0,082057
atmL
moIK
(303,35K)
m = 8,964 - 1u
-4
g
2.4. Se emplea el mismo tipo de aparato usado en el problema anterior. En este
caso no se conoce el volumen V
1
, el volumen en el bulbo 2, V
2
, es 110.0 cm
3
.
Cuando el nivel del mercurio est en a la presin es 15.42 mm de Hg. Cuando
el nivel del mercurio se eleva a b la presin del gas es 27.35 mm Hg. La tem-
peratura es 30.2C.
a) Cul es la masa de helio en el sistema?
b) Cul es el volumen del bulbo 1?
Datos:
V
2
= 110.0 cm
3
= 0,11 L
P
a
= 15.42 mm de Hg = 0,020 atm
P
b
= 27.35 mm de Hg = 0,036 atm
T = 30.2 C = 303,35 K
Solucin:
a) Despejo m de la Ec.2.1-2 y sustituyo en la Ec.2.1-1
m =
PvN
RT
m =
(0,036 atm)(0,1422 L)(4 gmoI)
(0,082057 atm LmoIk)(303,35K)
m = 8,226 - 1u
-4
g
b) Volumen del bulbo 1
P
a
V
a
= nRT Ec.2.4 - 1
- 51 -
P
a
(V
1
+ V
2
) = PbV
1
0,020 (V
1
+ 0,11 L) = 0,036 V
1
0,020 V
1
+ 2,23 10
3
= 0,036 V
1
V
1
= 0,142 L
2.5. Supongamos que al establecer las escalas de los pesos atmicos las condi-
ciones de referencia escogidas hayan sido Po. = 1 atm, Vo. = 30.000 litros y To
=300.00 K. Calcular la "constante del gas", el "nmero de Avogadro" y las
masas de un "nmero de Avogadro" de tomos de hidrgeno y de oxgeno.
Datos:
P
0
= 1 atm
V
o
= 30.000 L
T
o
= 300.00 K
Solucin:
- Hallamos el valor de R con los valores dados en el ejercicio.
0
0 0
T
V P
R = Ec.2.5-1
K 300
lt/mol) (30 ) atm 1 (
= R
K mol
atm lt
100 . 0 = R
- Determinamos el nmero de moles y lo relacionamos con el valor de la
constante R
g
de los gases.
g g
R
R
T R
V P
n = =
0
0 0
Ec.2.5-2
082057 . 0
100 . 0
= n
2187 . 1 = n
- Determinamos el nmero de molculas por mol con el nmero de Avogadro y el
nmero de moles hallados anteriormente.
N
1
= N
(avo)
* n Ec.2.5-3
N
1
= (6.023 10
23
)(1.2187)
N
1
= 7.34 10
23
molculas/mol
- Determinamos el peso molecular del Hidrgeno
6.02310
23
0
H
M = 1 g/mol
- 52 -
2.6. El coeficiente de expansin trmica est definido por u = (1/V)( 6V/6T)
P
Aplicando la ecuacin de estado calcular el valor de u para un gas ideal.
- Partimos de la ecuacin general de los gases Ec.2.1-1y despejamos el volumen
V
p
nRT
V =
Ec.2.6-1
- Derivamos la Ec.2.6-1 con respecto a la temperatura Pa presin constante.
[
8V
8T
P
=
nR
P
Ec.2.6-2
u = [
1
V
[
8V
8T
P
Ec.2.6-3
- Reemplazamos la derivada de la Ec.2.6-2 y remplazamos en la ecuacin de
compresin isobrica Ec.2.6-3.
p
nR
V
1
= o
Ec.2.6-4
- De la ecuacin general de los gases despejamos n R y T para relacionar con la
Ec.2.6-4 y determinar el valor final de
T
V
p
nR
=
Ec.2.6- 5
T
1
= o
Ec.2.6 - 6
2.7. El coeficiente de compresibilidad est definido por ( )( )
T
P V V c c = / / 1 |
Calcular el valor de | para un gas ideal.
- Partimos de la ecuacin general de los gases Ec.2.1-1y despejamos el volumen
V
p
nRT
V =
Ec.2.7-1
- Derivamos la Ec.2.7-1 con respecto a la presin P a temperatura constante.
[
8V
8P
T
= -
nRT
P
2
Ec.2.7-2
= -[
1
V
[
8V
8P
T
Ec.2.7-3
- 53 -
- Reemplazamos la derivada de la Ec.2.7-2 y remplazamos en la ecuacin de
expansin isotrmica Ec.2.7-3.
) (
1
2
p
nRT
V
= |
Ec.2.7-4
- De la ecuacin general de los gases despejamos n R y P para relacionar con la
Ec.2.7-4 y determinar el valor final de
1 =
pV
nRT
Ec.2.7-5
P
1
= |
Ec.2.7 - 6
2.8. Expresar la derivada (6p/6T)
V
de un gas en funcin de oy | .
V=V(P,T)Ec.2.8-1
dT
T
V
dP
P
V
V
P T
|
.
|
\
|
+
|
.
|
\
|
=
o
o
o
o
o
Ec.2.8-2
V=cte. dV=0
dT
T
V
dP
P
V
P T
|
.
|
\
|
+
|
.
|
\
|
=
o
o
o
o
0
Ec.2.8-3
_
ov
oT
]
P
= uv _
ov
oP
]
T
= -v
VdT VdP o | + = 0
V
V
T
P
V
|
o
o
o
=
|
.
|
\
|
|
o
o
o
=
|
.
|
\
|
V
T
P
2.9. Un gramo de N
2
y 1 g de O
2
se colocan en un frasco de 2 litros a 27C. Calcular
la presin parcial de cada gas, la presin total y la composicin de la mezcla
en moles por ciento.
Datos:
mN
2
= 1 g
mO
2
= 1 g
V = 2 L
- 54 -
T = 27C = 300,15 K
- Partimos de la ecuacin general de los gases Ec.2.1-1y despejamos el volumen P
V
RT
n p
i i
=
Ec.2.9-1 pr x p
i i
= Ec.2.9-2
r
i
i
n
n
x = Ec.2.9-3
- De la Ec.2.9-1 hallamos la presin del N
2
lt 2
) 15 , 300 (
K mol
atm lt
082057 . 0
gr/mol 28
gr 1
2
K
P
N
|
|
.
|
\
|
=
atm 4398 , 0
2
=
N
P
- De la Ec.2.9-1 hallamos la presin del O
2
2
) 15 , 300 27 )( 082057 . 0 (
32
1
2
+
|
.
|
\
|
=
O
p
atm 3848 , 0
2
=
O
p
- Determinamos la presin total
P
T
= PN
2
+ Po
2
P
T
= 0,4398 + 0,3848
P
T
= 0,8246 atm
- Determinamos el moles totales
32
1
28
1
+ =
T
n
06696 , 0 =
T
n
- De acuerdo con el valor total realizamos un balance y las fracciones molares con
relacin a la presin.
( )
466 . 0
06696 . 0
32 / 1
2
= =
o
x
( )
533 . 0
06696 . 0
28 / 1
2
= =
N
x
- Por lo tanto se tiene la composicin molar del oxgeno y nitrgeno.
% 6 . 46 100 %
2 2
= =
o o
x n
% 3 . 53 100 %
2 2
= =
N N
x n
- 55 -
2.10. Un gramo de H
2
y 1 g de 0
2
se colocan en una botella de dos litros a 27C.
Calcular la presin parcial de cada gas y la presin total al igual que la com-
posicin de la mezcla en moles por ciento. Comparar estos resultados con los
del problema 2-9.
Datos:
mN
2
= 1 g
mO
2
= 1 g
V = 2 L
T = 27C = 300.15 K
- Realizamos el mismo procedimiento que el ejercicio anterior determinando las
presiones parciales, la presin total, nmero de moles totales y las fracciones
molares de la mezcla.
atm p
N
15 . 6
2
) 15 . 300 )( 082054 . 0 (
2
= =
atm p
o
3848 . 0
2
) 15 . 300 )( 082054 . 0 (
2
= =
atm p p p
o N T
534 . 6
2 2
= + =
5313 . 0
32
1
2
1
= + =
r
n
941 . 0
5313 . 0
) 2 / 1 (
2
= =
H
x 0588 . 0
5313 . 0
) 2 / 1 (
2
= =
o
x
% 1 . 94 100 %
2 2
= =
H H
x n
% 88 . 5 100 %
2 2
= =
o o
x n
Comparacin:
La diferencia con los resultados del problema anterior se debe a que tenemos las
mismas masas pero diferentes pesos moleculares, lo que hace que haya muchas
ms moles de H
2
que de O
2
ya que es bastante ms ligero. Entre N
2
y O
2
la dife-
rencia no es tan fuerte.
2.11. Se agrega una mezcla de nitrgeno y vapor de agua a un recipiente que
contiene un agente secante slido. Inmediatamente despus, la presin en el
recipiente es de 760 mm Hg. Luego de algunas horas, la presin alcanza un
valor constante de 745 mm Hg.
- 56 -
a) Calcular la composicin de la mezcla original en moles por ciento.
b) Si el experimento se realiza a 20
o
C y el agente secante aumenta su peso en
0.150 g, Cul es el volumen del frasco? (Se puede despreciar el volumen
ocupado por el agente secante).
Datos:
P
i
= 760 mm Hg.
P
f
= 745 mm Hg.
t = 20
o
C. T = 293.15 K.
m = 0.150 g.
Solucin:
a) El agente secante absorbe el vapor de agua y por eso es que, al cabo de
un tiempo, la presin total disminuye pues la presin del agua desaparece. As, la
presin total inicial es:
P
i
= PN
2
+ PH
2
O Ec.2.11-1
- Por lo tanto la presin final es:
P
f
= PN
2
Ec.2.11-2 98 . 0
760
745
2
2
= = = =
i
f
T
N
N
p
p
p
p
x
02 . 0
760
745 760
2
2
=
= =
i
f i
T
O H
O H
p
p p
p
p
x
- Por lo tanto la composicin en moles por ciento es:
100 %
2 2
=
N N
x n
% 98 100 98 . 0 %
2
= =
N
n
% 98 %
2
=
N
n
100 %
2 2
=
O H O H
x n
% 2 100 02 . 0 %
2
= =
O H
n
% 2 %
2
=
O H
n
b) El aumento en peso del agente se debe al agua absorbida, por lo tanto, la masa
de vapor de agua es 0.150 g y as, el volumen del frasco ser:
L
p
RT
M
m
V
O H O H
O H
156 . 10
) 760 / 15 (
) 15 . 293 )( 082054 . 0 (
18
150 . 0
2 2
2
=
|
.
|
\
|
=
|
|
.
|
\
|
=
L V 156 . 10 =
- 57 -
2.12. Se analiza una mezcla de oxgeno e hidrgeno pasndola sobre xido de cobre
caliente y por un tubo secante. El hidrgeno reduce el CuO segn la
ecuacin:
CuO + H
2
Cu + H
2
OEc.2.12-1
El oxgeno reoxidiza el cobre formando:
Cu + O
2
CuOEc.2.12-2
100 cm
3
de la mezcla, medidos a 25
o
C y 750 mm Hg producen 84.5 cm
3
de
oxgeno seco, medidos a una temperatura de 25
o
C y 750 mm Hg despus de
su paso sobre el CuO y el agente secante. Cul es la composicin original de
la mezcla?
Datos:
V
T
= 100 cm
3
. V
T
= 0.1 L.
t
T
= 25
o
C. T
T
= 298.15 K.
P
T
= 750 mm Hg. P
T
= 0.9868 atm.
VO
2(SECO)
= 84.5 cm
3
. VO
2(SECO)
= 0.0845 L.
tO
2(SECO)
= 25
o
C. T = 298.15 K.
PO
2(SECO)
= 750 mm Hg. PO
2(SECO)
= 0.9868 atm.
Solucin:
- Segn la Ley de Hess tenemos que:
CuO + H
2
Cu + H
2
O
Cu + O
2
CuO
H
2
+ O
2
H
2
O
- Los moles totales
T
n y
f
O
n
2
los podemos evaluar a partir de la ecuacin de
estado ya que:
T
T T
T
RT
V P
n =
Ec.2.12-3
( )( )
( )( )
moles n
T
3
10 034 . 4
15 . 298 082054 . 0
1 . 0 9868 . 0
= =
f
f f
f
O
O O
O
RT
V P
n
2
2 2
2
=
( )( )
( )( )
moles n
f
O
3
10 408 . 3
15 . 298 082054 . 0
0845 . 0 9868 . 0
2
= =
- El nmero total de moles en la mezcla est dado por la relacin:
=
i T
n n
Ec.2.12-4
2 2
H O T
n n n
i
+ =
- 58 -
- Donde nO
2
es el nmero de moles de oxgeno antes de la reaccin y est dado
por la relacin:
reaccionan i f
O O O
n n n
2 2 2
=
Ec.2.12-5
reaccionan f i
O O O
n n n
2 2 2
+ = Ec.2.12-6
-
Donde
reaccionan
O
n
2
son las moles de O
2
que reaccionan y
f
O
n
2
son las moles de O
2
que quedan sin reaccionar. Si todo el H
2
reaccion, tendremos, a partir de la
reaccin qumica, que:
reaccionan
O H
n n
2 2
2 =
Ec.2.12-7
2 2
2
1
H O
n n
reaccionan
= Ec.2.12-8
- Combinando estas tres ecuaciones encontramos que:
2 2 2
H O O T
n n n n
reaccionan f
+ + =
Ec.2.12-9
2 2 2
2
1
H H O T
n n n n
f
+ + =
2 2
2
3
H O T
n n n
f
+ =
( )
f
O T H
n n n
2 2
3
2
= Ec.2.12-10
( ) moles n
H
4 3 3
10 173 . 4 10 408 . 3 10 034 . 4
3
2
2
= =
2 2
H T O
n n n
i
=
( ) ( ) moles n
i
O
3 4 3
10 617 . 3 10 173 . 4 10 034 . 4
2
= =
- La composicin en moles por ciento de la mezcla original es:
100 %
2
2
=
T
H
H
n
n
n
( )
( )
% 34 . 10 100
10 034 . 4
10 173 . 4
%
3
4
2
=
H
n
% 34 . 10 %
2
=
H
n
100 %
2
2
=
T
O
O
n
n
n
- 59 -
( )
( )
% 66 . 89 100
10 034 . 4
10 617 . 3
%
3
3
2
=
O
n
% 66 . 89 %
2
=
O
n
2.13. Demostrar que x
i
=(y
i
/M
i
) / [(y
1
/M
1
) +(y
2
/M
2
) + ], en donde x
i
, y
i
y M
i
son la
fraccin molar, el porcentaje del peso y el peso molecular del componente i
respectivamente.
- El nmero de moles, la fraccin molar y el porcentaje en peso estn dados por
las relaciones:
i
i
i
M
m
n =
T
i
i
n
n
x =
100 =
T
i
i
m
m
y
- Combinando estas relaciones tendremos:
n
T
= n
1
+ n
2
+
i
i T
i
M
y m
n
100
=
...
100 100
2
2 1
+ + =
M
y m
M
y m
n
T
i
T
T
...
...
100
100
...
100 100
100
2
2
1
1
2
2
1
1
2
2
1
1
+ +
=
|
|
.
|
\
|
+ +
=
+
= =
M
y
M
y
M
y
M
y
M
y m
M
y m
M
y m
M
y m
M
y m
n
n
x
i
i
T
i
i T
T T
i
i T
T
i
i
2.14. Una mezcla de gases est compuesta de etano y butano. Se llena un bulbo de
200 cm
3
de capacidad con la mezcla a una presin de 750 mm Hg y 20
o
C. Si
el peso del gas en el bulbo es 0.3846 g, Cul es el porcentaje molar de butano
en la mezcla?
Datos:
V = 200 cm
3
. V = 0.2 L.
P = 750 mm Hg. P = 0.9868 atm.
t = 20
o
C. T = 293.15 K.
m
T
= 0.3846 g.
- 60 -
MC
2
H
6
= 30 g/mol.
MC
4
H
10
= 58 g/mol.
Solucin:
- La masa total en el tubo es:
m
T
= m
i
Ec.2.14-1
m
T
= n
i
M
i
m
T
= n
ETANO
M
ETANO
+ n
BUTANO
M
BUTANO
m
T
= 30n
ETANO
+ 58n
BUTANO
Ec.2.14-2
- El nmero total de moles en el tubo es:
n
T
= n
i
Ec.2.14-3
n
T
= n
ETANO
+ n
BUTANO
n
ETANO
= n
T
- n
BUTANO
Ec.2.14-4
- Reemplazamos la ecuacin 2.14-4 en la ecuacin 2.14-2, as obtenemos:
m
T
= 30(n
T
- n
BUTANO
) + 58n
BUTANO
0.3846 = 30n
T
- 30n
BUTANO
+ 58n
BUTANO
0.3846 = 30n
T
+ 28n
BUTANO
28
30 3846 . 0
T
BUTANO
n
n
=
Ec.2.14-5
- El nmero total de moles lo podemos calcular a partir de la relacin:
RT
PV
n
T
=
moles n
T
3
10 2 . 8
) 15 . 293 )( 082054 . 0 (
) 2 . 0 )( 9868 . 0 (
= =
moles n
T
3
10 2 . 8
=
- Reemplazamos el valor de n
T
en la ecuacin 2.14 - 5, as se obtiene:
moles n
BUTANO
3
3
10 95 . 4
28
) 10 2 . 8 ( 30 3846 . 0
=
=
- Reemplazamos el valor de n
T
y n
BUTANO
en la ecuacin 2.14 - 4, as obtenemos:
( ) ( ) moles n
ETANO
3 3 3
10 25 . 3 10 95 . 4 10 2 . 8
= =
- El porcentaje molar del etano y del butano respectivamente son:
100 % =
T
ETANO
ETANO
n
n
n
- 61 -
( )
( )
% 63 . 39 100
10 2 . 8
10 25 . 3
%
3
3
=
ETANO
n
% 63 . 39 % =
ETANO
n
100 % =
T
BUTANO
BUTANO
n
n
n
( )
( )
% 37 . 60 100
10 2 . 8
10 95 . 4
%
3
3
=
BUTANO
n
% 37 . 60 % =
BUTANO
n
2.15. Un bulbo de 138.2 ml contiene 0.6946 g de gas a 756,2 mm Hg y 100
o
C.
Cul es el peso molecular del gas?
Datos:
V = 138.2 ml. V = 0.1382 L.
m = 0.6946 g.
P = 756.2 mm Hg. P = 0.995 atm.
t = 100
o
C. T = 373.15 K.
Solucin:
- El nmero total de moles est dado por la relacin:
RT
PV
n =
Ec.2.15-1
- Y por la relacin:
M
m
n =
Ec.2.15-2
- Igualando estas dos expresiones y despejando el peso molecular obtenemos:
PV
mRT
M =
( )( )( )
( )( )
mol g M / 66 . 154
1382 . 0 995 . 0
15 . 373 082054 . 0 6946 . 0
= =
mol g M / 66 . 154 =
- 62 -
2.16. Suponiendo que el aire tiene un peso molecular promedio de 28.8 y que la
atmsfera es isotrmica a 25
o
C, calcular la presin baromtrica en
Guadalajara (Mxico), ciudad que se encuentra a 1567 m sobre el nivel del
mar; calcular la presin baromtrica en Cerro de Pasco (Per), 4259 m sobre
el nivel del mar. La presin a nivel del mar es de 760 mm Hg.
Datos:
M
AIRE
= 28.8 g/mol.
t = 25
o
C. T = 298.15 K.
z
Guadalajara
= 1567 m.
z
Cerro de Pasco
= 4259 m.
Po
(NIVEL DEL MAR)
= 760 mm Hg.
Solucin:
- Haciendo uso de la ley de distribucin baromtrica, tendremos:
RT Mgz
o
e p p
/
=
(p
o
Presin a Nivel del Suelo)
- As:
mmHg e p
a Guadalajar
81 . 635 760
) 15 . 298 10 3144 . 8 /( ) 10 1567 )( 980 )( 8 . 28 (
7 2
= =
mmHg p
a Guadalajar
81 . 635 =
mmHg e p
co CerrodePas
97 . 467 760
) 15 . 298 10 3144 . 8 /( ) 10 4259 )( 980 )( 8 . 28 (
7 2
= =
mmHg p
co CerrodePas
97 . 467 =
- 63 -
2.17. La composicin aproximada de la atmsfera a nivel del mar est dada por la
siguiente tabla.
Tabla 2.17-1
Composicin aproximada de la Atmsfera a Nivel del Mar
GAS PORCENTAJE EN MOLES
Nitrgeno 78.09
Oxgeno 20.93
Argn 0.93
Dixido de Carbono 0.03
Nen 0.0018
Helio 0.0005
Criptn 0.0001
Hidrgeno 5 10
-5
Xenn 8 10
-6
Ozono 5 10
-5
Fuente: Fisicoqumica de Castelln, captulo 2 Propiedades Empricas de los
Gases, pg. 25
Despreciando los cuatro ltimos componentes, calcular las presiones
parciales del resto, la presin total y la composicin de la atmsfera en moles
por ciento a alturas de 50 y 100 Km (t =25
o
C).
Datos:
z = 50 Km.
z = 100 Km.
t = 25
o
C. T = 298.15 K.
Solucin:
- La presin parcial de cada componente la podemos calcular a partir de la
siguiente ecuacin:
RT Mgz
io i
e p p
/
=
Ec.2.17-1
- Donde:
o io i
p x p =
Ec.2.17-2
- La composicin en por ciento la podemos determinar por la relacin:
( )
( )
( ) z p
z p
z x
T
i
i
=
- 64 -
( ) z x n
i i
100 % =
- As:
50 Km
Tabla 2.17-2
Valores y Clculos a 50Km
M
i
x
io
p
io
p
i
x
i
N
2
28 0.7809 0.7809 3.1 10
-3
89.08
O
2
32 0.2093 0.2093 3.74 10
-4
10.75
Ar 40 0.0093 0.0093 3.42 10
-6
0.10
CO
2
44 0.0003 0.0003 5.0 10
-8
0.0014
Ne 20 0.000018 0.000018 3.45 10
-7
0.0099
He 4 0.000005 0.000005 2.27 10
-6
0.652
p
T
= 3.1 10
-3
100 Km
Tabla 2.17-3
Valores y Clculos a 100Km
M
i
x
io
p
io
p
i
x
i
N
2
28 0.7809 0.7809 1.22 10
-5
87.71
O
2
32 0.2093 0.2093 6.71 10
-7
4.82
Ar 40 0.0093 0.0093 1.26 10
-9
0.0091
CO
2
44 0.0003 0.0003 8.38 10
-12
0.0001
Ne 20 0.000018 0.000018 6.63 10
-9
0.0477
He 4 0.000005 0.000005 1.03 10
-6
7.4047
p
T
=
1.391
10
-5
2.18. Cul debe ser el peso molecular de un gas para que la presin del gas
disminuya la mitad de su valor en una distancia vertical de un metro? (t =25
o
C). Qu tipos de molculas tienen pesos moleculares de esta magnitud?
Datos:
z = 1 m.
t = 25
o
C. T = 298.15 K.
- 65 -
Solucin:
- A partir de la ley de distribucin baromtrica tenemos que:
RT Mgz
p
p
o
/ ln =
Ec.2.18-1
- Por lo tanto:
p
p
gz
RT
M
o
ln =
Ec.2.18-2
- Que la presin del gas disminuye a la mitad, significa que:
2
o
p
p =
2 =
p
p
o
- De esta manera se llega a tener que:
2 ln
gz
RT
M =
( )( )
( )( )
mol g M / 59 . 175333 2 ln
100 980
15 . 298 10 3144 . 8
7
=
=
mol g M / 59 . 175333 =
El peso molecular tan alto corresponde a las molculas conocidas por el nombre
de polmeros.
2.19. Considerar un gas ideal de papas que tiene las siguientes propiedades:
obedece la ley del gas ideal, las partculas individuales pesan 100 g pero no
ocupan volumen; es decir, son masas puntuales.
a) A 25
o
C, calcular la altura a la cual el nmero de papas por centmetro
cbico disminuye a una millonsima parte de su valor a nivel del suelo.
b) Sabiendo que las papas reales ocupan volumen, hay alguna correlacin
entre el resultado del clculo en (a) y la distribucin espacial observable
de las papas en una bolsa de papel?
Datos:
m = 100 g.
t = 25
o
C. T = 298.15 K.
Solucin:
a) La ley de distribucin baromtrica establece que:
- 66 -
RT Mgz
o
z
e
N
N
/
=
Ec.2.19-1
- Si despejamos z de esta ecuacin, obtenemos:
z
o
N
N
Mg
RT
z ln =
Ec.2.19-2
- Ya que:
6
10 =
o
z
N
N
Ec.2.19-3
- Y el peso molecular de una papa es igual a su masa por el nmero de
Avogadro:
( )( )
( )( )( )
cm z
18 6
23
7
10 8 . 5 10 ln
980 10 023 . 6 100
15 . 298 10 3144 . 8
=
=
cm z
18
10 8 . 5
=
b) Si existe correlacin ya que la altura obtenida en a) [z = 5.8 10
-18
cm] es
despreciable, lo que implica que todas las papas estn en el suelo y esto es lo
que observamos.
2.20. Un globo de 10000 m
3
de capacidad se llena con helio a 20
o
C y a 1 atm de
presin. Si el globo se carga con un 80 % de la carga que puede levantar a
nivel del suelo, a qu altura alcanzar el estado de reposo?. Supngase que
el volumen del globo es constante, la atmsfera isotrmica, 20
o
C, el peso
molecular del aire 28.8 y la presin a nivel del suelo 1 atm. La masa del globo
es 1.3 10
6
g.
Datos:
V = 10000 m
3
. V = 10 10
6
L.
t = 20
o
C. T = 273.15 K.
P = 1 atm.
M
CARGA
= 80 %.
t = 20
o
C. T = 273.15 K.
M
AIRE
= 28.8 g/mol.
P
NIVEL DEL SUELO
= 1 atm.
m = 1.3 10
6
g.
Solucin:
- 67 -
- El globo asciende debido a que es ms ligero que el aire. Sin embargo, en el
momento en que el peso de la masa de aire que desaloja es igual al peso total del
globo, ste permanecer esttico. Es decir, la condicin de equilibrio est dada
por la siguiente relacin:
a c globo H aire
M M M M
e
arg
+ + =
Ec.2.20-1
- M
AIRE
es el peso de la masa de aire desalojado y variar con la altura de acuerdo
a la ley de distribucin baromtrica.
RT Mgz
o
o o aire RT Mgz
o o aire aire
e
RT
V p m
g ge V Vg g m M
/ /
= = = = o o
- Ya que la densidad es:
RT
Mp
V
m
= = o
Ec.2.20-2
- En forma similar el peso del helio M
AIRE
est dado por la relacin:
RT gz M
o
o o H
H
e
H e
e
e
RT
V p M
g Vg M
/
= =o
Ec.2.20-3
- El peso del globo no vara con la altura.
g m M
globo globo
=
Ec.2.20-4
- Para establecer el peso de la carga (M
CARGA
) sabemos que a nivel del suelo la
carga mxima sera aquella que sumada al peso del globo y del helio igualar el
peso del volumen de aire desalojado, es decir:
o
o o H
globo
o
o o aire Max
a c
RT
V p M
g g m
RT
V p M
g M
e
=
arg
- Como slo se carga 80 % de este valor tenemos que:
Max
a c a c
M M
arg arg
8 . 0 =
- Por lo tanto, el globo alcanzar el estado de reposo cuando:
(
+ + =
o
o o H
globo
o
o o aire
globo
RT gz M
o
o o H RT gz M
o
o o aire
RT
V p M
g g m
RT
V p M
g g m e
RT
V p M
g e
RT
V p M
g
e e
H e aire
8 . 0
/
/
-
Reordenando esta ecuacin se obtiene que:
( ) 8 . 0 2 . 0
/
/
e
e
H
e
aire
H aire
o o
o
RT gz M
H
RT gz M
aire
M M
V p
RT
e M e M + =
- 68 -
- Como no podemos despejar z de esta ecuacin, le damos diferentes valores hasta
que el resultado del lado izquierdo de la ecuacin sea igual al del lado derecho
( )( )( ) ( )( )( )
( )( )
( ) 8 . 0 0026 . 4 8 . 28 2 . 0
10 10 1
) 15 . 293 10 3144 . 8 (
0026 . 4 8 . 28
6
7
) 15 . 293 10 3144 . 8 /( 41 . 1 980 0026 . 4 ) 15 . 293 10 3144 . 8 /( 41 . 1 980 8 . 28
7 7
+
=
e e
Se encuentra que para z = 1.41 Km se cumple la igualdad.
z = 1.41 Km
2.21. Expresar las presiones parciales en una mezcla de gases (a) en funcin de las
concentraciones molares C
i
(b) en funcin de las razones molares r
i
.
Solucin:
a) Las concentraciones molares se definen como:
P
n
n
P X P
T
i
i i
= =
Ec. 2.21 - 1
- De la ecuacin de estado se tiene:
V
RT
n
P
T
=
Ec. 2.21-2
- Reemplazo de la Ec. 2.21-2 en la Ec. 2.21-1
RT
V
n
P
i
i
=
Ec. 2.21-3
- La concentracin se define como:
V
n
C
i
i
=
Ec.2.21 - 4
- Reemplazo de la Ec. 2.21-4 en la Ec. 2.21-3
RT C P
i i
=
b) Las razones molares se definen como:
1
n
n
r
i
i
=
Ec. 2.21 - 5
- Se tiene
1 1
1
n
n
n
n
r
T
i
i
= = +
Ec. 2.21 - 6
+ =
i
i
i T
r
n
r n
1
- 69 -
( )
i
T
i
i
i
X
n
n
r
r
= =
+
1
( )
+
= =
i
i
i i
r
P X P
1
Pr
2.22. Si a una altura h dada, la presin de un gas es P
h
y la presin a z=0 es P
o
,
demostrar que a cualquier altura, z, P=P
o
f
h/Z
donde f=P
z
/ P
o
Datos:
z = 0
0
P
P
f
z
=
Demostrar:
z
h
o
f P P =
Solucin:
- De acuerdo con la ley de distribucin baromtrica,
h
RT
Mg
RT
Mgh
h
e P e P P ) (
0 0
= =
Ec. 2.22-1
o bien a una altura Z dada
Z
RT
Mg
z
e P P ) (
0
=
Ec. 2.22-2
- De esta ecuacin tenemos que
Z
z
RT
Mg
P
P
e
1
0
|
|
.
|
\
|
=
Ec. 2.22-3
- Reemplazo la Ec. 2.22-3 en la Ec. 2.22-2
Z
h
z
z
P
P
P P
|
|
.
|
\
|
=
0
0
- 70 -
2.23. Al morir Julio Csar, su ltima exhalacin tena un volumen de 500
cm
3
aproximadamente. Esta cantidad tena 1 mol % de argn. Supngase que
la temperatura era de 300
o
K y que la presin a nivel del suelo era 1 atm.
Supngase que la temperatura y la presin son uniformes sobre la superficie
y an tienen esos valores. Si las molculas exhaladas por Csar han
permanecido todas en la atmosfera terrquea y se han esparcido
completamente a travs de ella, cuntas inhalaciones de 500 cm
3
cada una
debemos realizar en promedio para inhalar una de las molculas de
argn de Csar?
Datos:
V = 500 cm
3
T = 300K
P = 1atm
JC
n = 0.01
Solucin:
V
atm
= rea de la superficie terrestre x altura = z r
2
4t
Ec. 2.23-1
dz r e n n
RT
Mgz
JC JC
2
0
0
4t
}
=
Ec. 2.23-2
2 0
4 r
Mg
RT
n n
JC JC
t =
Ec. 2.23-3
- Despejando
0
JC
n tenemos
2
0
4 r RT
Mgn
n
JC
JC
t
=
Ec. 2.23-4
RT
PV
n
JC
01 . 0 =
Ec. 2.23-5
4
10 * 031 . 2
) 300 )( 082 . 0 (
) 5 . 0 )( 1 (
01 . 0
= =
JC
n
0
0 0
N n N
JC JC
=
Ec. 2.23-6
- Sustituyo la Ec.2.23-6 en la Ec.2.23-5
- 71 -
0
2
0
4
N
r RT
Mgn
N
JC
JC
t
=
Ec.2.23-7
) 300 )( 10 * 314 . 8 )( 10 * 37 . 6 ( 4
) 10 * 023 . 6 )( 980 )( 948 . 39 (
7 8
23
0
t
=
JC
N
inhalacin
moleculas
inhalacin
cm
cm
molculas
N
JC
0188 . 0 500 *
3
3
0
=
- Nmero de inhalaciones necesarias para aspirar una molcula de Julio Cesar, es
decir
molcula
es inhalacion
inhalacin
moleculas
31 . 53
0188 . 0
1
=
2.24. a) Demostrar que si calculamos el nmero total de molculas de un gas en la
atmosfera aplicandola formula baromtrica obtendramos el mismo
resultado que al suponer que el gas tiene una presin a nivel del suelo
hasta una altura z=RT/Mg y que la presin es cero por encima de este
nivel.
b) Demostrar que la masa total de la atmosfera terrestre est dada por Ap
0
/g,
donde p
o
es la presin total a nivel del suelo y A es el rea de la superficie
terrestre. Ntese que este resultado no depende de la composicin de la
atmsfera. (Resolver este problema calculando primero la masa de cada
constituyente, fraccin molar Xi, peso molecular Mi, y sumar. Luego,
examinando el resultado, resolverlo de la manera ms fcil.)
c) Si el radio promedio de la tierra es 6.37 10
8
cm, g=980 cm/seg
2
, y P
o
=
1atm, calcular la masa de la atmosfera en gramos.
Datos:
a) Z = RT/Mg
b) M
T
= AP
0
/g
c) r = 6.37*10
8
cm
g = 980 cm/seg
2
Po = 1atm
Solucin:
- 72 -
a) Adz n dn
1
0
=
Ec.2.24-1
Mg
RT
A n Az n Adz n n
Z
1
0
1
0
0
1
0
= = =
}
Ec.2.24-2
dz Ae n dn
RT
MgZ
=
1
0
Ec.2.24-3
- El nmero total de molculas en la atmsfera ser
}
=
0
1
0
dz e A n n
RT
MgZ
Ec.2.24-4
Mg
RT
A n n
1
0
=
b) De acuerdo con la ley de distribucin baromtrica, la masa del componente i
de la atmosfera en una fraccin diferencial ser
Adz e dm
RT
Mgz
oi i
=
Ec.2.24-5
g M
RT
A Adz e m
i
oi
RT
Mgz
oi i
}
= =
0
Ec.2.24-6
- De la ecuacin de estado sabemos que
RT
P M
oi i
oi
=
Ec.2.24-7
- Reemplazo la Ec.2.24-7 en la Ec.2.24-6
g
A P
m
oi
i
=
Ec.2.24-8
= = = =
o oi
oi
i T
P
g
A
P
g
A
g
A P
m m
Ec.2.24-9
c) La superficie de la tierra es 4r
2
, por lo tanto,
g
seg cm
cm
cm
dinas
m
T
21
2
2 2 8
2
6
10 * 27 . 5
/ 980
) 10 * 37 . 6 ( 4 ) 10 * 01325 . 1 (
= =
t
- 73 -
2.25. Puesto que los gases atmosfricos se distribuyen diferentemente segn sus
pesos moleculares, el porcentaje promedio de cada gas es diferente del
porcentaje a nivel del suelo; los valores, Xi, de las fracciones molares a nivel
del suelo se suministran a continuacin.
a) Deducir una relacin entre la fraccin molar promedio del gas en la
atmosfera y las fracciones molares a nivel del suelo
b) Si las fracciones molares de N2, O2 y Ar a nivel del suelo son 0.78 ; 0.21 y
0.01 respectivamente, calcular las fracciones molares promedio de N2, O2
y A en la atmosfera.
c) Demostrar que la fraccin de peso promedio de cualquier gas en la
atmosfera es igual a su fraccin molar a nivel del suelo.
Datos:
b) X
N2
= 0.78
X
O2
= 0.21
X
Ar
= 0.01
Solucin:
a)
nT
ni
Xi =
Ec.2.25-1
Adz e n dn
RT
MgZ
i i
=
0
Ec.2.25-2
g M
RTA
n n
i
i i
0
=
Ec.2.25-3
= = =
i
i
i
i i i
M
n
g
ART
g M
RTA
n n n
0
0 0
Ec.2.25-4
- Reemplazo la Ec2.25-3 y Ec.2.25.4 en la Ec.2.25.1
g
ART
M
n
g
ART
M
n
X
i
i
i
i
i
=
Ec.2.25-5
- 74 -
= =
i
i
i
i
i
T i
i
T i
i
M
X
M
X
M
n X
M
n X
X
0
0
0 0
0 0
0
0
T
i
n
n
Xi =
c) Aplicando la Ec.2.25-7
= + + = 03468 . 0
40
01 . 0
32
21 . 0
28
78 . 0
0
i
i
M
X
804 . 0
03468 . 0
28
78 . 0
2
= =
N
X
189 . 0
03468 . 0
32
21 . 0
2
= =
O
X
007 . 0
03468 . 0
40
01 . 0
= =
Ar
X
c) La fraccin de peso promedio
atmosfera la en total masa atmosfera/ la en i de total Masa = =
T
iT
i
W
W
f
- De los resultados obtenidos en el inciso a), tenemos que,
0 0
i i
i
i iT iT
n
g
ART
M n
gM
ART
M n W = = =
Ec.2.25-8
0 0 0
T i i iT T
n
g
ART
n
g
ART
n
g
ART
W W
= = = =
Ec.2.25-9
- Por lo tanto:
0
0
0
i
T
i
i
X
n
g
ART
n
g
ART
f = =
Ec.2.2510
- 75 -
Z
0
2.26. Considrese una columna de gas en un campo gravitatorio. Calcular la altura
Z determinada por la condicin de que la masa de la columna est situada
debajo de Z.
Solucin:
- Consideremos un rea transversal de 1cm
2
. La masa total en la seccin
diferencial dz ser
dz e m dm
RT
MgZ
=
0
Ec.2.26-1
- Integrando hasta una altura Z, tenemos
m(Z)= -m
0
RT MgZ
e
Mg
RT
/
0
Ec. 2.26 - 2
m(Z) = -m
0
| |
RT MgZ
e
Mg
RT
/
1
Ec. 2.26 - 3
- La masa total la obtendremos integrando hasta infinito,
mT= m(Z=) = m
0
Mg
RT
Ec. 2.26 - 4
| |
RT MgZ
e
mT
Z m
/
1
) (
=
Ec. 2.26 - 5
M(Z) = mT/2
Ec. 2.26 - 6
RT MgZ
e
/
1
2
1
=
Ec. 2.26 - 7
Z= 2 ln
Mg
RT
- 76 -
GASES REALES
3.1. Para la disociacin N
2
O
4
= 2NO
2,
la constante de equilibrio a 25 C e K =
0.115, est relacionada con el grado de disociacin y la presin en
atmsferas segn la ecuacin K = 4
2
p=/(1-
2
). Si n es el nmero de
molculas de N
2
O
4
que estaran presentes si no se produjo disociacin,
calcular V/n.a.p = 2 atm y 0.5 atm, suponiendo que la mezcla en equilibrio se
comporta idealmente. Comparar los resultados con los volmenes en caso de
que no se produjese disociacin.
Datos:
T = 25 C = 298 k
K = 0.115
K = 4
2
p=/(1-
2
)
P
1
= 2atm
P
2
= 0.5atm
Solucin:
Pv = n(1+)R. T
Ec.3.1-1
V
n
=
(1+)R.T
p
Ec.3.1-2
Para P
1
= 2atm
u.11S =
4
2
(2)
(1-
2
)
Ec.3.1-3
8.11S
2
= u.11S
= u.119
v
n
=
(1 +u.119) [u.u821
atm
K
mol (298.1S K)
2 atm
= 1S.678 lmol
v
n
=
RT
P
Ec.3.1-4
v
n
=
R. T
p
=
(u.u82)(298.1S)
2
= 12.224 lmol
Para P
2
= 0.5atm
u.11S = 2
2
(1 -
2
)
2.11S
2
= u.11S
= u.2SS1
- 77 -
v
n
=
(1.2SS1)(u.u82)(298.1S)
u,S
= 6u.294 lmol
V
n
=
(0.082)(298.15)
0.5
= 48.896 lmol
3.2. Para la mezcla descrita en el problema 3-1 demostrar que en la medida que
p se aproxima a cero el factor de compresibilidad Z = pV/nRT se aproxima a
2 en lugar de a su valor normal, la unidad. Por qu acontece este
fenmeno?
Solucin:
PV
nRT
= (1+)
Ec.3.2-1
Z = 1+
Ec.3.2-2
K =
4
2
p
1-
2
Ec.3.2-3
K(1 -
2
) = 4
2
p
Ec.3.2-4
P 0K(1-
2
) 0 1
2
1
Z 2
p 0
n
T
= n(1+) = 2n
Ec.3.2-5
pv = 2nRT
Ec.3.2-6
Z =
pv
nRT
= 2
El hecho de que tengamos el doble de molculas que al principio hace que Z2
en lugar de hacerlo a su valor normal que es la unidad.
- 78 -
3.3. Cierto gas a 0 C y a 1 atm de presin tiene un valor de Z =1.00054. Calcular
el valor de b para este gas.
Datos:
T = 0 C = 273.15 K
Z =1.00054
Solucin:
Z = 1 +
b
RT
p
Ec.3.3-1
b = (Z -1)
RT
p
b =
(1.uuuS4 - 1)(u.u821 atmKmol)(27S.1SK)
1atm
= 12 mlmol
3.4. Si Z =1.00054 a 0 C y 1 atm y la temperatura de Boyle del gas es 107 K,
calcular los valores de a y b (solo se necesitan los dos primeros trminos de la
expresin de Z).
Datos:
Z =1.00054
T = 0 C = 273.15 K
P = 1 atm
T
Boyle
= 107 K
Solucin:
Z = 1 +
1
RT
[b -
a
RT
p
Ec.3.4-1
T
u
= aRb
Ec.3.4-2
a
b
= T
u
R = 1u7K_u.u82
1 atm
K mol
] = 8.774
1 atm
mol
a = 8.774b
Z = 1 +
1
RT
_b -
8.774b
RT
] p = 1 +
bp
RT
-
8.774bp
R
2
T
2
(1.uuuS4 -1) =
1 atm(b)
u.u82
1 atm
Kmol
(27S.1Sk)
=
8.7741 atmmol(1atm)b
(u.u82)
2
1
2
atm
2
K
2
mol
2
(27S.1S)
2
K
2
u.uuuS4 = u.u4464b -u.u1748b
b = u.u1988
l
mol
= 19.88mlmol
- 79 -
a = 8.774
1atm
moI
[u.u1988
1
moI
= u.1744
1
2
atm
moI
2
= 1.744x1u
5
cm
6
atm
moI
2
3.5. Las constantes crticas para el agua son 374 C, 218 atm y 0.0566 litros/mol.
Calcular los valores de a, b y R; comparar el valor de R con el valor correcto
y observar la discrepancia. Valorar solo las constantes a y b a partir de p, y
T
c
Empleando estos valores y el valor correcto de R calcular el volumen
crtico. Comparando con el valor correcto.
Datos:
T = 374 C
P = 218 atm
v
c
= 0.0566 litros/mol
Solucin:
a = Sp
c
v
c
2
= S(218 atm)(u.uS66)
2
l
2
mol
2
- b = u.u1886lmol
b =
v
c
S
=
u.uSS6
S
lmol - b = u.u1886lmol
R =
8p
c
v
c
ST
c
=
8(218 atm)(u.uS66 lmol)
S(647.1S K)
- R = u.uSu8S
1atm
K mol
% eiioi =
u.uSu8S -u.u82uS
u.uSu8S
x1uu = 61.SS%
a =
27(RT
c
)
2
64p
c
=
27(u.u82
2
1
2
atm
2
K
2
mol
2
x647.1S
2
K
2
)
64(218 atm)
= S.4496
1
2
atm
mol
2
b =
RT
c
8p
c
=
u.u82 1atmKmol(647.1SK)
8(218 atm)
= u.uSu42 lmol
v
= Sb = S [u.uSu42
I
moI
= u.u9126 lmol
% eiioi =
u.u9126 -u.uS66
u.u9126
x1uu = S7.97%
3.6. Determinar la relacin de las constantes a y b de la ecuacin de Berthelot
con las constantes crticas.
Solucin:
P =
RT
V-b
-
a
TV
2
Ec.3.6-1
v
3
-v
2
[b +
RT
p
+ v
[
a
pT
-
ab
pT
= u
Ec.3.6-2
- 80 -
Sv
c
2
= b +
RT
c
pc
Ec.3.6-3
Sv
c
2
=
a
p
c
T
c
;
Ec.3.6-4
v
c
3
=
ab
p
c
T
c
Ec.3.6-5
a = Sv
c
2
p
c
T
c
Ec.3.6-6
b =
V
c
3
p
c
T
c
a
- b =
V
c
3
Ec.3.6-7
R =
Sv
c
p
c
-bp
c
T
c
- R =
8v
C
P
C
ST
C
3.7. Determinar la relacin de las constantes a y b de la ecuacin de Dieterici con
las constantes crticas (Ntese que esto no se puede resolver igualando unas
con otras las tres races de la ecuacin).
Solucin:
P = RTe
-
e
VRT
(v
-b)
Ec.3.7-1
_
op
ov
]
T
= u _
o
2
p
ov
2
_
T
= u
_
o
2
p
ov
2
_
T
=
ae
-cVRT
v
2
(v
-b)
-
RTe
-cVRT
(v
-b)
2
_
o
2
p
ov
2
_
T
=
ae
-cVRT
v
4
RT(v
-b)
-
2ae
-cVRT
v
3
(v
-b)
-
2ae
-cVRT
v
2
(v
-b)
3
-
RTe
-cVRT
(v
-b)
3
e
-aVRT
a(v
c
-b) -v
c
2
RT
c
v
C
2
(v
C
-b)
2
= u
e
-aVRT
(v
c
-b)
2
a
2
-2aRTv
c
(v
c
-b)
2
- 2aRTv
c
(v
c
-b) +2R
2
T
2
v
C
4
RTv
c
4
(v
c
- b)
3
a(v
c
-b) -v
c
2
RT = u
a
2
(v
C
-b)
2
-2aRTv
C
(v
C
-b)
2
-2aRT
c
2
(v
c
2
-b) +2R
2
T
c
2
v
c
4
= u
v
c
4
R
2
T
c
2
-2v
c
3
R
2
T
c
2
(v
c
-b) = u
b =
v
c
2
- 81 -
a =
v
c
2
RT
v
c
-v
c
2
- a = 2v
c
RT
R =
p
c
v
c
e
oV
c
RT
2T
C
R =
p
c
v
c
e
2
2T
C
a = e
2
v
c
2
p
3.8. La temperatura crtica del etano es 32.3C, la presin crtica es 48.2 atm.
Calcular el volumen crtico empleando:
a) La ley del gas ideal,
b) La ecuacin de Van der Waals, comprobando que para el gas de Van der
Waals.
p
V
RT
=
3
8
c) La ecuacin modificada de Berthelot.
d) Comparar los resultados con el valor experimental 0.139 litros/mol.
Datos:
T = 32.3C = 305.3 K
P = 48.2 atm
Solucin:
a) Ley del gas ideal
v
c
=
RT
c
P
c
=
u.u82 l
atm
k mol
(SuS.4Sk)
48.2 atm
= u.S196 lmol
b) Ecuacin de Van der Waals
v
= b +
b
2
RT
a
Ec. 3.8 - 1
p
c V
c
RT
c
=
3
8
Ec. 3.8 - 2
v
c
=
SRT
c
8p
c
=
S [u.u82 l
atm
k mol
(SuS.4Sk)
8(48.2 atm)
= u.1948 lmol
c) Ecuacin modificada de Berthelot
a = 8.774 b Ec. 3.8 - 3
- 82 -
RT
c
p
c
V
c
= S.S6Ec. 3.8 4
v
c
=
RT
c
S.S6 p
c
=
[u.u82 l
atm
k mol
(SuS.4Sk)
S.S6(48.2 atm)
= u.14S9 lmol
d) Comparar los resultados con el valor experimental 0.139 litros/mol
gas iueal %eiioi =
u.S196 -u.1S9
u.S196
= < X 1uu = 7S.24%
van Bei Waals %eiioi =
u.1948 -u.1S9
u.1948
X 1uu = 28.64%
mouificaua ue Beithelot % eiioi =
u.14S9 -u.1S9
u.14S9
X 1uu = 4.7S%
3.9. La presin de vapor de agua en estado lquido a 25C es 23.8 mmHg y a
100C es de 760 mmHg. Aplicando la ecuacin de Van der Waals como gua,
en una forma u otra, demostrar que el vapor de agua saturado se asemeja
ms al comportamiento de un gas ideal a 25C que a 100C.
Datos:
T
1
= 25C = 298.1S K
P
1
= 23.8 mmHg
T
2
= 100C = 373.15 K
P
2
= 760 mmHg = 1 atm
Solucin:
v
25
=
RT
p
=
[u.u82 l
atm
k mol
(298.1SK)
[
2S.87
76u
atm
= 78u.7
l
mol
v
100
= 1 +
nx
1!
+
n(n -1)x
2
2!
+ =
RT
p
=
[u.u82 l
atm
k mol
(S7S.1Sk)
(1) atm
= Su.61
l
mol
P -
RT
V-b
+
a
V
2
= u Ec.3.9-1
f(v) = u.uS1S2 -
24.448S
v -u.uS1u
+
S.72
v
2
= u
f(v
) =
24.44.8S
(v
- u.uS19)
2
-
11.44
v
3
- 83 -
v
1
= v
o
-
f (v
o
)
f(v
o
)
= 78u.7 -
1.22S x 1u
-5
4.u1 x 1u
-5
= 78u.4
f(78u.4) = 2.uS x 1u
-7
E = 1uu x
V
vdv
- V
Ec.3.9-2
E
25
= 1uu X =
78u.4 -78u.7
78u.7
= u.uS8%
f(v
) = 1 -
Su.S98S
v
- u.uS19
+
S.72
v
2
= u
v
1
= Su.6 -
f(Su.6)
f(Su.6)
= Su.6 -
S.121 x 1u
-S
S.2SS x 1u
-2
= Su.44
f(Su.44) = -8.18 x 1u
-5
= u
E = 1uu x
v
vdw
- v
I
v
I
E
100
= 1uu x
Su.44 -Su.6
Su.6
= u.S2%
3.10. El factor de compresibilidad para el metano est dado por Z = 1 + Bp +Cp
2
+Dp
3
.Si pest dada en atm los valores de las constantes son los siguientes:
Datos:
Tabla 3.10-1
Valores de las Constantes
T(K) B C D
200
1000
-S.74 x 1u
-3
u.189 x 1u
-3
6.86 x 1u
-6
u.27S x 1u
-6
18.u x 1u
-9
u.144 x 1u
-9
Fuente: Fisicoqumica de Castelln, captulo 2 Propiedades Empricas de los
Gases, pg. 47.
Representar grficamente los valores de Z en funcin de p a estas dos tem-
peraturas en un intervalo de 0 a 1000 atm.
y(30.44) = 8.18 x 10-
5
= 0
Solucin:
Z = 1 S.74 X1u
-3
p + 6.86 X 1u
-6
p
2
+ 18.u X1u
-9
p
3
Ec. 3.10 - 1
- 84 -
Para: 1000 K
Z = 1. + u.189 X 1
-3
p + u.27S X1u
-6
p
2
+ u.144 x 1u
-9
p
3
Figura 3.10-1
Representacin Grfica de los Valores de Z en funcin de p a estas dos
temperaturas en un intervalo de 0 a 1000 atm
- 85 -
3.11. Si el factor de compresibilidad de un gas es Z(P,T), la ecuacin de estado
puede expresarse pV
/RT =Z. Demostrar cmo afecta esto a la ecuacin para
la distribucin del gas en un campo gravitatorio. A partir de la ecuacin
diferencial para la distribucin demostrar que si Z es mayor que la unidad la
distribucin es ms amplia para un gas real que para uno ideal y que lo
contrario es verdadero si Z es menor que la unidad. Si Z = 1 + Bp, donde B es
una funcin de la temperatura, integrar la ecuacin para obtener la forma
explcita de la funcin de distribucin.
Solucin:
Jp = -gJzEc. 3.11 - 1Z =
pV
RT
v
=
V
n
=
ZRT
p
n =
w
M
p =
w
V
N
p
=
ZRT
p
p =
pN
ZRT
-
up
p
=
Ng
ZRT
uz
p = p
o
e
-A
1
A
I
=
Ngz
RT
p = p
o
e
-A
1
A
I
=
Ngz
RT
Figura: 3.11-1
Factor de Compresibilidad
-
up
p
=
Ng
ZRT
uz
- 86 -
X
i
-
up
p
=
Ng
(1 + Bp)RT
uz
up
p
+ Bup =
-Ng
RT
uz
lnp + Bp =
-Ngz
RT
uz
a z = u p = p
o
lnp
o
+ Bp
o
= C
lnp - lnp
o
+ Bp - Bp
o
=
-Mgz
RT
ln _
p
p
o
] + B(p -p
o
) =
-Ngz
RT
3.12. A Presiones altas (volmenes pequeos) la ecuacin de Van der Waals,
ecuacinE = 1 x
V
vdw
- V
t
V
t
, puede reordenarse en la siguiente forma:
V
= b +
p
a
_b +
RT
p
] V
2
-[
p
a
V
3
Si se eliminan los trminos cuadrticos y cbicos V
u
=b como una primera
aproximacin de la raz ms pequea de la ecuacin. Esto representa el vo-
lumen del lquido. Empleando este valor aproximado de V
en los trminos
mayores demostrar que la siguiente aproximacin para el volumen del
lquido es p = h +h
2
RTa.A partir de esta expresin, demostrar que la
primera aproximacin para el coeficiente de expansin trmica de un lquido
de Van der Walls es a = bR/a
Solucin:
v
= b +
p
a
[b +
RT
p
b
2
- [
p
a
b
3
Ec. 3.12 - 1
v
= b +
b
2
RT
a
u =
I
V
[
0V
0T
p
ov
oT
=
o
oT
_b +
b
2
RT
a
_ =
b
2
R
a
=> u =
b
2
R
ba
;
bR
a
- 87 -
3.13. Empleando el mismo mtodo que se emple para obtener la ecuacin
[
dp
dV
T
= [
d
2
p
dV
2
T
= demostrar la relacin dada en la Tabla 3-4 entre
y' y ypara la ecuacin de Beatti-Bridgeman, a saber: y ' (RT)
2
=y - B
2
/RT.
De la Tabla 3-4 para la ecuacin de Beatti-Bridgeman puede expresarse Z
como:
Solucin:
Z =
pV
RT
= 1 +
RTV
+
y
RTV
2
+
8
RTV
3
Ec. 3.13 - 1
Z = 1 + _
RT
]
l
v
+ [
y
RT
_
l
v
2
] + _
o
RT
] _
l
v
3
]
Z = l + A
1
p + A
2
p
2
+ A
3
p
3
1 +A
1
p +A
2
p
2
+A
3
p
3
= 1 +_
[
RI
]
p
RIZ
+ [
y
RI
_
p
2
R
2
I
2
Z
2
_ + _
o
RI
] _
p
3
R
3
I
3
Z
3
_
A
1
+A
2
p +A
3
p
2
= 1 +_
[
RI
]
1
RIZ
+ [
y
RI
[
p
R
2
I
2
Z
2
+ _
o
RI
] _
p
2
R
3
I
3
Z
3
_
A
1
=
R
2
T
2
Ec. 3.13 - 2
A
1
+A
2
p +A
3
p
2
= A
1
_
1
Z
] + [
y
R
3
I
3
[
p
Z
2
+ _
o
R
4
I
4
] _
p
2
Z
3
_
A
2
+A
3
p =
A
1
p
_
1
Z
] -
A
1
p
[
y
R
3
I
3
_
1
Z
2
] + _
o
R
4
I
4
] [
p
Z
3
A
2
+
A
1
p
_
Z -1
Z
] + A
3
p [
y
R
3
I
3
_
1
Z
2
] + _
o
R
4
I
4
] [
p
Z
3
A
2
=
y
R
3
T
3
- A
1
2
A
2
= [
y
R
3
I
3
-_
[
R
2
I
2
]
2
=
y
R
3
I
3
-
[
R
4
I
4
Z = 1 +
p
R
2
I
2
+ _
y
R
3
I
3
-
[
2
R
4
I
4
_p
2
+ A
3
p
3
ZRT
p
= v
=
RT
p
+
RT
+[
y
R
2
I
2
+ _
y
R
3
I
3
-
[
2
R
4
I
4
_p +A
3
RIp
3
v
=
RT
p
+
RT
yp +op
2
y =
y
R
2
I
2
-
[
2
R
3
I
3
- 88 -
y [R
2
I
2
= y -
[
2
RT
3.14. A qu temperatura tiene la pendiente de la curva Z contra p (p = 0) un
mximo valor para el gas de Van Der Waals? Cul es el valor de la
pendiente mxima?
Datos:
p = 0
Solucin:
[
oz
op
T =
I
RT
[ b -
u
RT
Ec.3.14-1
o
op
_
b
RT
-
u
R
2
T
2
_ =
-b
R
2
T
2
+
2u
R
2
T
2
-b
R
2
T
2
+
2u
R
2
T
2
= u; -bRT +2u = u; T =
2u
bR
_
oz
op
] y =
l
R(
2u
bR
)
_ b -
u
R[
2u
bR
_ Z max(
oZ
op
)
T
=
b
2
4a
- 89 -
L= 35 atm-l
L=SS4S.8S }
L = 848,29cal
L=S.SS - 1u
10
PROBLEMAS DE APLICACIN PRIMERA LEY DE LA TERMODINMICA
FISICOQUIMICA FARRINGTON DANIELS
4.1. Se producen treinta y cinco litros de hidrogeno por la accin de un cido
sobre un metal a una presin total de 1 atm. Calcular el trabajo efectuado
por el gas al hacer retroceder la atmsfera, expresado en (a) atmsferas-litro,
(b) en caloras, (c) en julios y (d) en ergios.
SOLUCIN:
Aplicamos la frmula:
L=PAv
L=1atm (35-0)l
Conversin de Unidades:
L= 35 atm-l *
101,31]
1atm-I
L= SS4S.8S } *
1caI
4.18 ]
.
L= SS4S.8S } *
1-10
crg
1 ]
4.2. Un peso de 900 gramos cae desde una altura de 120 metros, (a) Cuntos
ergios de calor se liberan cuando golpea el suelo? (b) Cuntos julios? (c)
Cuntas caloras? (d) Cuntas atmosferas-litro?
SOLUCIN:
900g-
1Kg
1000g
= u,9Kg
E
potcncIaI
= mgh = Q
.Q = u,9Kg - 9.81[
m
s
2
- 12um
- 90 -
Q = 2SS.S cal
Q = 1u.46 atm
-l
.Q = 1.uS9 - 1u
10
eig
.AT =43.0
6 C
Q =1059,5 J
Conversin de unidades:
1059,5 J-
1 caI
4.18]
1059,5 J-
1 atm-I
101.31]
. 1059,5 J-
1-10
crg
1]
4.3. Un calentador elctrico de 500 vatios, Cuntos grados de temperatura
podr elevar a 10 litros de agua durante 1 hora, suponiendo que no haya
prdida de calor? El calor especfico del agua puede tomarse como 1 cal/grad
g y la densidad como 1g/cm
3,
independientemente de la temperatura.
SOLUCIN:
P= 500w
Aplicamos la definicin de potencia
.P =
Q
T
.Q = PT
.Q = Suuw - S6uus
.Q = 1.8 - 1u
6
}
.Q = mCpAT
.AT =
Q
mCp
.AT =
1.8-10
6
]
(10-10
3
)g(
1caI
gC
)
-
1caI
4,18]
- 91 -
.L
rcv
= 899.1S cal
.Q =9440 cal
4.4. Cien gramos de benceno se vaporizan en su punto de ebullicin de 80.2 y a
760 mmHg. El calor de vaporizacin es de 94.4 cal/g. Calcular (a) L
Rev
(b) Q,
(c) H, (d) E.
SOLUCIN:
T =353.35K
P= 1 atm
Calculamos las moles de benceno
.1uug C
6
B
6
-
1moI dc C
6
H
6
78g dc C
6
H
6
= 1.28 mol de C
6
B
6
PARTE A:
A presin constante, L
rev
= PV = P(V
lquido
V
vapor
) Despreciando el volumen del
lquido en comparacin con el volumen del vapor:
.L
rcv
= -P - v
vapor
= -nRT
.L
rcv
=
1.28 moI dc C
6
H
6
-1.987caI-353.53K
K moI
PARTE B:
.Q = AB
vap
*100g
.Q = 94.4
caI
g
- 1uug
PARTE C:
.Q = AB
V
2
V
1
P
2
P
1
P
V
Proceso
- 92 -
.E
2
= 8S4u.8S cal
.AB = 944u cal
PARTE D:
.AE = E
2
E
1
.E
2
= Q -L
rcv
.E
2
=9440 cal -899.1S cal
4.5. Cien gramos de nitrgeno a 25 y 760mmHg, se expanden reversiblemente e
isotrmicamente a una presin de 100mmHg. (a) Cul el trabajo mximo en
caloras que se puede obtener de esta expansin? Cul es el trabajo mximo
que se puede obtener si la temperatura es de 100?
SOLUCIN:
PARTE A:
Utilizamos la frmula del gas ideal y calculamos V
1
y V
2
.Pv = nRT
.v
1
=
nRT
1
P
1
.V
1
=
3.571 moI - 0.082atmL-298.15K.
KmoI- 1atm
.V
1
= 87.305 L
- 93 -
L
rcv
=4230 cal
.v
2
=
nRT
2
P
2
.V
2
=
3.571 moI - 0.082atmL-298.15K
KmoI- 0.132atm
.V
2
= 666.401L
Utilizamos la frmula :
.L
rcv
= nRT ln
V
2
V
1
L
rcv
=
3.571 moI - 1.987caI -298.15K
KmoI
ln
666.401
87.305
PARTE B:
Utilizamos la frmula del gas ideal y calculamos V
1
y V
2
.Pv = nRT
.v
1
=
nRT
1
P
1
.V
1
=
3.571 moI - 0.082atmL-373.15K
KmoI- 1atm
V
1
= 109,267 L
.v
2
=
nRT
2
P
2
.V
2
=
3.571 moI - 0.082atmL-373.15K
KmoI- 0.132atm
V
P
1
P
2
I
1
I
2
1
2
T=373.15K
P
Diagrama P V
- 94 -
L
rcv
=5361,466
cal
L
rcv
= 1S7S,26 cal
V
2
= 827,777 L
.L
rcv
= nRT ln
V
2
V
1
.L
rcv
=
3.571 moI - 1.987caI -373.15K
KmoI
ln
827.777
109,267
4.6. (a) Calcular el trabajo realizado en caloras, cuando una mol de bixido de
azufre se expande isotrmicamente y reversiblemente a 27 de 2.46 a 24.6
litros, suponiendo que el gas es ideal. (b) Tendra una fuerza de atraccin
entre las molculas del gas facultad para hacer el trabajo fuera ms grande o
ms pequeo?
SOLUCIN:
K= 27C +273.15= 300.15K
PARTE A:
Utilizamos la frmula :
.L
rcv
= nRT ln
V
2
V
1
.L
rcv
=
1 moI - 1.987caI -300.15K
KmoI
ln
24.6
2.46
.
PARTE B:
- 95 -
Ms pequeo pues se podra expandir menos.
4.7. (a) Demuestre que para una expansin reversible isotrmica de V
1
a V
2
de una mol de gas que obedece a la ecuacin de van der Waals, el trabajo
efectuado por el gas est dado por:
L
rcv
== RT ln (
V
2-b
V
1-b
) + a (
1
V
2
-
1
V
1
)
SOLUCIN:
PARTE A:
Ec. de van der Waals :
P=
RT
V-b
-
a
V
2
(1)
L
rcv
= P
2
1
uv (2)
(1)en (2)
.
L
rcv
= RT
dv
V-b
V2
V1
-a
dv
V
2
V2
V1
L
rcv
= RT ln (
V
2-b
V
1-b
) + a (
1
V
2
-
1
V
1
)
4.8. Calcular el trabajo que se puede obtener de una expansin reversible
isotrmica de un mol de cloro de 1 a 50 litros a 0 . (b) Suponiendo que se
comportar como un gas ideal y (c) suponiendo que se siguiera la ecuacin de
van der Waals.
PARTE B:
K= 0C +273.15= 273.15K
Diagrama P V
- 96 -
.L
rcv
= RT ln
V
2
V
1
L
rcv
=
0.082atm-I -273.15K
KmoI
ln
50
1
L
rcv
= 87,62 atm- l/ mol
PARTE C:
a= 6.493
atm-I
2
moI
b= 0.05622
I
moI
L
rcv
=RT ln (
V
2-b
V
1-b
) + a (
1
V
2
-
1
V
1
)
L
rcv
=
0.082atm-I -273.15K
KmoI
ln (
50- 0.05622
1-0.05622
) + 6.493
atm-I
2
moI
(
1
50
-
1
1
)
.L
rcv
= 82.SS
atm-I
moI
Diagrama P V
- 97 -
Cp
= 33.57
caI
moIK
4.9. Calcular la capacidad de calor molar del glicol, (CH
2
OH)
2
a 2, con los
siguientes datos. Se pesaron cien gramos de glicol dentro de un recipiente de
cobre equipado con un calentador elctrico y un termmetro resistente
sensible. El recipiente de cobre o calormetro se suspendi por medio de finas
cuerdas dentro de otro recipiente exterior, al cual se le poda extraer el aire.
El recipiente protector llevaba calentador y pilas termoelctricas por medio
de los cuales su temperatura se conservaba muy cercana a la del calormetro,
de modo que el calor desprendido por este era despreciable. El aparato fue
sometido en un bao de hielo; y despus de que se enfri cerca de 0, se
extrajo el aire del recipiente exterior. Con el recipiente protector mantenido
a la misma temperatura que el calormetro se necesitaron 955 julios para
calentar el calormetro de 0.500 a 3.500. La capacidad de calor del
calormetro se encontr ser de 20.00 cal/grad a 2.
SOLUCIN:
Q
GANADO
= Q
PERDIDO
n
glicol
Cp
AT + Cp
AT = 228.15 cal
.Cp
=
228.14 caI-(20
caI
C
)-(3.5 C)
1.57 moI (3 C)
= 33.57
caI
moIK
4.9. Cunto calor se necesita para aumentar la temperatura de 10 gramos de
argn (un gas monoatmico) de 0 hasta 10 (a) a volumen constante, (b) a
presin constante?
SOLUCIN:
Calculamos las moles de argn
1ug Ai -
1moI dc Ar
40g dc Ar
= 0.25 moles de Ar
Realizamos las conversiones de unidades
K= 0 +273.15= 273.15K
K= 10 +273.15= 283.15K
- 98 -
.A0 = 7,4S cal
PARTE A
Por ser un gas monoatmico Cv =
3
2
R
.A0 = nCvAT
.A0 = u.2S moles -
3
2
-
1.987caI
KmoI
- (28S.1S - 27S.1S)K
PARTE B:
Por ser un gas monoatmico Cp =
5
2
R
I
2
I
1
I
2
I
1
1
2
V
T
V=kT
P
2
P
1
I
2
I
1
1
2
P
T
P=kT
- 99 -
.AB = 12.4S cal
.AB = nCpAT
.AB = u.2S moles -
5
2
-
1.987caI
KmoI
- (28S.1S - 27S.1S)K
4.10.A un mol de argn a 25 y 1 atm de presin, se le hace expandirse
reversiblemente hasta un volumen de 50 litros (a) isotrmicamente y (b)
adiabticamente. Calcular la presin final en cada caso, suponiendo que el
gas es ideal.
SOLUCIN:
T = 298,15
PARTE A:
.v =
nRT
P
v
1
=
1 moI - 0.082atmL-298.15K
KmoI- 1atm
V
1
= 24.45 L
Por ser un proceso isotrmico se puede aplicar la Ley de Boyle:
P
1
V
1
= P
2
V
2
.P
2
=
P
1
V
1
V
2
V(L)
P
1
P
2
I
1
I
2
1
2
P(atm)
T=298.15K
Diagrama P V
- 100 -
.P
2
= u.Su4 L
.P
2
=
1atm-24.45I
50I
P
2
= u.489 L
PARTE B:
.y =
Cp
Cv
.y =
5
3
.P
1
v
1
y
= P
2
v
2
y
.P
2
=
P
1
V
1
V
2
.P
2
= 1atm- [
24.45
50
S
3
4.11. Diez litros de nitrgeno a 1atm y 25 se les hace expandirse reversible y
adiabticamente hasta 20 litros. Cules son la temperatura y presin
finales?
SOLUCIN:
K= 25 +273.15= 298.15K
P
1
F
1
F
2
I
]
F (L)
P(atm)
P
2
Diagrama P V
I
o
- 101 -
.T
2
= 22S.96K
Aplicamos las relaciones de Poisson
Por ser un gas diatmico Cp =
7
2
R y Cv =
5
2
R
.y =
Cp
Cv
.y =
7
5
R
.P
1
v
1
y
= P
2
v
2
y
.P
2
=
P
1
V
1
V
2
.P
2
= 1atm- [
10
20
S
.P
2
= u.S79 L
.T
1
v
1
y-1
= T
2
v
2
y-1
.T
2
=
T
1
V
1
-1
V
2
-1
.T
2
= 298.1SK - [
10
20
S
-1
P
1
F
1
F
2
I
]
= 22S.96K
F (L)
P(atm)
P
2
Diagrama P V
I
o
=298.15K
- 102 -
4.12. (a) Calcular el trabajo mximo de la expansin isotrmica de 10 gramos de
helio de un volumen de 10 litros a otro de 50 litros a 25. (b) Calcular el
trabajo mximo de una expansin adiabtica, partiendo de las mismas
condiciones y permitiendo al gas expandirse hasta 50 litros.
SOLUCIN:
Calculamos las moles de helio
1ug Be -
1moI dc Hc
4g dc Hc
= 2.5 moles de He
Realizamos las conversiones de unidades
K= 25C +273.15= 298.15K
PARTE A
.L
rcv
= nRT ln
V
2
V
1
L
rcv
=
2.5moIcs-1.987caI -298.15K
KmoI
ln
50
10
L
rcv
= 2383.67 cal
V(L)
P
1
P
2
I
1
I
2
1
2
P(atm)
T=298.15K
Diagrama P V
- 103 -
L
ad rcv
= 1454.6 cal
PARTE B:
Por ser un gas monoatmico Cp =
5
2
R y Cv =
3
2
R
.y =
Cp
Cv
.y =
5
3
R
Aplicamos las relaciones de Poisson:
.T
1
v
1
y-1
= T
2
v
2
y-1
.T
2
=
T
1
V
1
-1
V
2
-1
.T
2
= 298.1SK - [
10
50
S
3
-1
.T
2
= 1u1.97K
.L
ad rcv
= -
nRAT
y-1
.L
ad rcv
= -
2.5 moIcs-1.987caI-(101.97K-298.15K)
moIcs K(1,67-1 )
- 104 -
4.13. Por el anlisis se ha encontrado que el cloruro de plomo contiene 74.5% de
plomo y 25.5% de cloro por peso. El peso atmico del cloro es 35.45 .El calor
especifico del plomo es aproximadamente de 0.0309 cal/g. Utilizando estos
datos Cules de las siguientes frmulas son posibles: Pb
2
Cl, PbCl, PbCl
2
,
PbCl
3
, PB
2
Cl
2
, Pb
2
Cl
4
? Calcular el peso atmico posible del plomo.
SOLUCION
Base de clculo: 100g de cloruro de plomo
Cp = u.uSu9calg
-1
M
Cl2
= 35.45 g
.N
- Cp = 6.4calgiau
-1
atomos -g
-1
.N
=
6.4caIgrad
-1
atomos-g
-1
0.00309caIg
-1
.N
= 2u7.12atomos -g
-1
ELEMENTO m(g) M(g/mol) n
=
m
M
X
i
Cl
2
25.5 35.45 0.72 0.67
. 7
. 33
= 2
Pb 74.5 207.12 0.36 0.33
.33
.33
=
1
1.08 1.00
Frmula del cloruro de plomo: PbCl
2
4.15. De la relacin de Dulog y Petit, deducir el calor especfico del hierro a la
temperatura ambiente.
SOLUCIN:
Peso atmico del hierro = SS.847
g
atomos-g
Aplicando la relacin de Dulog y Petit
Peso atmico* Cp = 6.4
caI
grad - atomos-g
- 105 -
Cp = u,11S
caI
grad -g
E
c
= 929u.Su}
E
c
= 222u.4Scal
E
s
= u.u72
}
m
2
Cp =
6.4caI
55.847
g
atomos-g
grad - atomos-g
4.15. Una bala de 50 gramos, se desplaza a una velocidad de 2000 pies-seg
-1
.
Calcular su energa cintica en (a) julios y (b) en caloras.
m = Sug -
1Kg
1uuug
= Sux1u
-3
kg
v = 2uuu
pies
s
- 1
s
pie
-
u.Su48m
s
= 6u9.6u
m
s
SOLUCIN:
PARTE A
E
c
=
1
2
- m- v
2
E
c
=
1
2
(Sux1u
-3
kg)(6u9.6u
m
s
)
2
PARTE B
E
c
= 929u.Su} -
1cal
4.184}
4.16. La tensin superficial del agua es de 72 dinas cm
-1
(72 ergios cm
-2
) a 25C;
calcular la energa superficial en caloras de una mol de agua dispersada en
forma de roco, teniendo las gotitas 1 micra ( 10
-4
cm) de radio. La densidad
del agua puede tomarse como 1g. cm
-3
.
y = 72uinas. cm
-1
= 72eig. cm
-2
T=25C= 298K
r= 10
-4
cm
p = 1
g
cm
3
E
s
= 72
crg
cm
2
-
1]
10
crg
-
(100cm)
2
1m
2
- 106 -
4.17. Qu corriente debe pasar a travs de un calentador de 100 ohmios para
calentar un termostato de agua de 10 litros 0.1 grad
-1
min
-1
? El calor
especfico del agua puede tomarse como de 1 cal grad
-1
g
-1
y la densidad
como de 1g. cm
-3
V=10L=10000 cm
3
p = 1
g
cm
3
R= 100
Q = mCpAT
p =
m
v
m = 1uuuucm
3
- 1
g
cm
3
= 1uuuu g
Q = 1uuuug -
1cal
giau. g
-
u.1giau
min
-
1min
6us
Q = 16.67
cal
seg
-
4.184}
1cal
= 69.7SW
I
2
=
P
R
I =
69.7S
1uu
I = u.8SSA
4.18. Una mol de gas monoatmico es condensado en su punto de ebullicin
estndar de -33.4C, sometindola a una presin infinitesimal mayor que
una 1 atm. Para evaporar un gramo de amoniaco en su punto de ebullicin se
requiere la absorcin de 327 cal. Calcular (a) L
rev
, (b) q, (c) H, (d) E.
T = - 33.4C = 239.60K
P = 1 atm
H
vap
= 327 cal/g
- 107 -
L
rcv
= 1.99
K}
mol
A0 = -2S.2S
K}
mol
SOLUCIN
PARTE A
A presin constante, L
rev
= PV = P(V
lquido
V
vapor
)
Despreciando el volumen del lquido en comparacin con el volumen del vapor:
L
rcv
= -P - v
vapor
= -nRT = 1 - 8.S12 - 2S9.6u = 1991.S6
}
mol
PARTE B y C
A P= constante ; Q
p
=H. El proceso tambin ocurre a T=constante pero U no es
cero, porque hay un cambio de fase de gas(vapor) a lquido. Por dato:
H = - Hvap = - 327 cal/g
AB =
-S27cal
1g
-
17g
1mol
-
4.184}
1cal
= -2S2S8.86
}
mol
= -2S.26
K}
mol
AB = 2S.26
K]
moI
PARTE D
A0 = Q -W = -2S.26 -1.99
V
2
V
1
P
2
P
1
P
V
Proceso
- 108 -
L
rcv
= 7S,24atm. L
4.19. Un mol de gas ideal a 25 C y 100 atm, se hace expandir reversiblemente e
isotrmicamente hasta 5 atm. Calcular (a) el trabajo efectuado por el gas en
atmsferas-litro, (b) el calor absorbido en caloras, (c) E y (d) H.
n= 1
T= 25C= 298K
P
o
= 100 atm
P
f
= 5atm
SOLUCIN
Clculo de los volmenes
Pv = nRT
v =
nRT
P
v
o
=
1(u.u82)(298)
1uu
= u.244L
v
I
=
1(u.u82)(298)
S
= 4.887L
PARTE A
L
rcv
= n - R - T - ln
v
I
v
o
L
rcv
= (1mol) _u.u82
atm. L
mol. K
] (298K)ln
4.887
u.244
PARTE C
U= 0, debido a que es un proceso a temperatura constante
PARTE B
U= Q-L
Q=L
rev
= 73.24 atm.L
T= cte= 298K
P
1
V
2
P
V
1
V
- 109 -
Q = 177S.67cal
AB = u
L = 98.S2atm. L
Q = 7S.24atm. L -
1u1.S2S}
1atm. L
-
1cal
4.184}
PARTE D
H=U+ PV
H=PV= P
f
V
f
P
o
V
o=
100(0.244) -5(4.887)
4.20. Calcular el trabajo mximo obtenido en una expansin isotrmica de 10
gramos de helio, de 10 a 50 litros a 25C, suponiendo un comportamiento de
gas ideal. Exprese la respuesta en (a) caloras, (b) ergios y (c) atmosferas-
litro.
m= 10g
N
= 4 g/mol
V
o
= 10 L
V
f
= 50 L
T= 25C= 298K
SOLUCIN
n =
m
N
n =
1ug
4gmol
= 2.Smol
PARTE C
L = n - R - T - ln
v
I
v
o
L = (2.Smol) _u.u82
atm. L
mol. K
] (298K)ln
Su
1u
P
2
P
1
V
2
V
1
P
V
T= cte= 298K
- 110 -
L = 9.96x1u
10
eig
L = 2S81.u4cal
L=57011.52 J
PARTE B
L = 98.S2atm. L -
1u1.S2S}
1atm. L
-
1u
7
eig
1}
PARTE A
L = 98.S2atm. L -
1u1.S2S}
1atm. L
-
1cal
4.184}
4.21. Diez moles de bixido de carbono contenidas en un volumen de 20 litros, se
las expande a un volumen de 200 litros a 25C. Calcular el trabajo mximo
que se puede efectuar si (a) se supone que el gas es ideal y (b) si se utiliza la
ecuacin de van der Waals.
n= 10
V
o
= 20 L
V
f
= 200 L
T= 25C= 298K
SOLUCIN
PARTE A
I = n - R - I - ln
I
]
I
o
I = (1umol) _u.u82
otm. I
mol. K
] (298K)ln
2uu
2u
I = S62.66otm. I
I = S62.66otm. I -
101.325]
1utm.L
= S7u11.S2[
V
2
V
1
P
2
P
1
P
V
T= cte= 298K
- 111 -
I = S7u22.4u[
PARTE B
I = nRI ln(
v
2
-b
v
1
-b
) +on
2
(
1
v
2
-
1
v
1
)
Para el helio b=0.02370 L.mol
-1
a= 0.03412 atm.L
2
.mol
-2
L =
(1umol) [u.u82
utm.L
moI.K
(298K) ln(
200-0.02370
20-0.02370
) +
(u.uS412
utm.L
2
moI
2
)(1umol)
2
(
1
200
-
1
20
)
I = S62.77otm. I
I = S62.77otm. I -
1u1.S2S[
1otm. I
4.22. Cien litros de helio a 0C y 1 atm, se calientan en un vaso cerrado a 800C. (a)
Calcular el cambio de la energa interna en kilocaloras (b) Qu tanto ms
calor se requerira si el gas fuera calentado a una presin constante de 1 atm?
V
o
= 100 L
T
o
= 0C= 273K
P
o
= atm
T
f
=800C=1073K
SOLUCIN
PI = nRI
n =
PI
RI
V
2
V
1
P
2
P
1
P
V
T= cte= 298K
b
- 112 -
Au = 1u.66kcol
n =
1otm- 1uuI
u.u82
otm. I
mol . K
- 27SK
n = 4.47mol
Como el helio es un gas monoatmico: C:
=
3
2
R y Cp
=
5
2
R
PARTE A
Au = nC:
AI
Au = 4.47mol -
S
2
_
1.9872col
mol. K
] (1u7S -27S)
Au = 1u6S9.S4col -
1kcol
1uuucol
PARTE B
= nCp
AI
= 4.47mol -
S
2
_
1.9872col
mol. K
] (1u7S -27S)
P
o
F
u
F
I
]
= 192.uSK
F
P
P
]
I
o
= 298K
- 113 -
Au = 17.77kcol
Au = 1776S.S7 -
1kcol
1uuucol
4.23. Diez pies cbicos de oxigeno bajo presin y a 25C se hacen expandir
reversiblemente y adiabticamente hasta un volumen de 30 pies
3
.
Considerando al oxgeno a un gas ideal con la capacidad de calor dada en la
tabla II, calcular la temperatura final.
I
o
= 1upics
3
-
28.S2I
1pics
3
= 28S.2uI
T
o
=25C= 298K
I
]
= Supics
3
-
28.S2I
1pics
3
= 849.6uI
y = 1.4u
SOLUCIN
I
o
- v
o
y-1
= I
]
- I
]
y-1
I
]
=
I
o
- I
o
y-1
I
]
y-1
I
]
=
298 - (28S.2u)
1.4-1
849.6u
1.4-1
I
]
= 192.uSK
4.24. Un mol de hidrgeno a 25Cy a 1 atm, se comprime adiabticamente y
reversiblemente a un volumen de 5 litros. Calcular (a) la temperatura final,
(b) la presin final, y (c) el trabajo efectuado por el gas.
n= 1
T
o
=25C= 298K
P
o
= 1 atm
V
f
=5L
SOLUCIN
- 114 -
PI = nRI
I
o
=
nRI
o
P
o
I
o
=
1(u.u82)(298)
1
= 24.44I
PARTE A
I
o
- I
o
y-1
= I
]
- I
]
y-1
I
]
=
I
o
- I
o
y-1
I
]
y-1
Como el hidrogeno es un gas diatmico C:
=
5
2
R y Cp
=
7
2
R
y =
Cp
C:
= 1.4u
I
]
=
298 - 24.44
1.40-1
S
1.40-1
I
]
= S62.17K
P
o
F
u
F
I
]
= S62.17K
F
P
P
]
I
o
= 298K
- 115 -
PARTE B
P
o
- I
o
y
= P
]
- I
]
y
P
]
=
P
o
- I
o
y
I
]
y
P
]
=
1 - (24.44)
1.40
S
1.40
P
]
= 9.22otm
PARTE C
I =
nR(I
]
-I
o
)
y -1
I =
1mol - 8.S14
[
mol. K
(S62.17 -298)K
1.4u -1
I = S49u.77[
4.25. Derivar la ecuacin para la expansin adiabtica de un gas que obedece la
ecuacin de estado P(F
b) = RT.
dQ=0
Derivamos la relacin de Poisson
PI
y
= ctc Ec. 1
PyJI
y-1
+I
y
JP = u I
y-1
Ec.2
IJP +yPJI = u Ec. 3
Derivamos la ecuacin de estado dada
PI
-Pb = RI Ec. 4
PJI
+IJP -bJP = RJI Ec. 5
Despejando VdP de la Ec .5,
IJP = RJI +bJP -PJI
Ec. 6
Introducimos la ec. 6 en la ec. 3
RJI +bJP -PJI
+yPJI = u Ec. 7
yPJI -PJI
= -RJI -bJP Ec. 8
- 116 -
Despejando PdV de la ec. 8,
PJI =
-RJI -bJP
y -1
PJI =
RJI +bJP
1 -y
I
c
= PJI =
RJI +bJP
1 -y
I
c
=
1
1 -y
(RJI +bJP)
I
c
=
1
1 -y
_R JI
1
2
1
1
+b JP
P
2
P
1
_
Integrando,
I
c
=
1
1 -y
|R(I
2
-I
1
) +b(P
2
-P
1
)]
26. Derivar la relacin para p - v para un gas que obedece la ecuacin de van
der Waals.
Cp
-C:
para Gas que obedece la ecuacin de van der Waals.
Cp
-C:
= [
6H
61
P
-[
60
61
v
Ec. 1
u = u(I, I)
Derivando,
Ju = [
60
61
v
JI + [
60
6v
1
JI JI Ec. 2
[
60
61
P
= [
60
61
v
+ [
60
6v
1
[
6v
61
P
Ec. 3
Segn la primera y segunda ley de la Termodinmica,
Ju = IJS -PJI JI Ec. 24
[
60
6v
1
= I [
6S
6v
1
-P Ec. 5
- 117 -
Mediante las relaciones de Maxwell,
[
6S
6v
1
= [
6P
61
v
Ec. 6
Ec. 6 en Ec. 5
[
60
6v
1
= I [
6P
61
v
-P Ec. 7
Ec. 7 en Ec. 3
[
60
61
P
= [
60
61
v
+ [I [
6P
61
v
-P [
6v
61
P
Ec. 8
[
60
61
P
= C:
+[I [
6P
61
v
-P [
6v
61
P
Ec. 9
Si, E = u +PI
Derivando,
[
6H
61
P
= [
60
61
P
+ P [
6v
61
P
+I [
6P
61
P
Ec. 10
[
6H
61
P
= [
60
61
P
+ P [
6v
61
P
Ec. 11
[
60
61
P
= [
6H
61
P
- P [
6v
61
P
Ec. 12
[
60
61
P
= Cp
-P [
6v
61
P
Ec. 13
Igualando la Ec. 9 con la Ec. 13
C:
+_I _
oP
oI
]
v
- P] _
oI
oI
]
P
= Cp
-P _
oI
oI
]
P
Cp
-C:
= _I _
oP
oI
]
v
-P] _
oI
oI
]
P
+P _
oI
oI
]
P
Cp
-C:
= _
oI
oI
]
P
_I _
oP
oI
]
v
-P +P_
Al operando la ec. 13 se tiene
Cp
-C:
= [
6v
61
P
jI [
6P
61
v
[ Ec. 14
Coeficientes termoelsticos y su relacin
0
- 118 -
o =
1
v
[
6v
61
P
Ec.15
[
6P
61
v
=
u
[
Ec. 16
Ec. 15 y Ec. 16 en Ec. 14
Cp
-C:
= I
o _I _
o
[
]_
Cp
-C:
=
u
2
v
1
[
4.27. El calor especfico del cinc es de 0.0978 cal grad
-1
g
-1,
y se ha establecido que
10.00gramos de este metal se combinan con 10.85 gramos de cloro para
formar el cloruro de cinc estable. Cul es el peso atmico del cinc y cul es
la frmula para el cloruro de cinc, si la valencia del cloro es 1 y su peso
atmico es 35.45?
Cp = u.u978colgroJ
-1
g
-1
m
Zn
= 10 g
m
Cl
= 10.85 g
SOLUCION
H
- Cp = 6.4colgroJ
-1
otomos -g
-1
H
=
6.4colgroJ
-1
otomos -g
-1
u.u978colgroJ
-1
g
-1
H
= 6S.44otomos -g
-1
ELEM
ENTO
M
(atumux -
g
-1
)
m(g) n(moles) X
mol
Zn 65.44 10 0.15 0.33 0.33\0.33=
1
Cl 35.45 10.85 0.31 0.67 0.67\0.33=
2
0.46 1
Frmula del cloruro de cinc: ZnCl
2
- 119 -
L= 29.72 Kcal
4.28. Cunto trabajo desarrolla un hombre que pesa 75 kg (165 lb) cuando sube el
monumento Washington de 555 pies de alto? Cuntas kilocaloras debe
suministrar para hacer este trabajo muscular, suponiendo que el 25% de la
energa producida por la oxidacin de los alimentos en el cuerpo, pueden
convertirse en trabajo mecnico muscular?
w=75 kg.
h=555ft *
3.5cm
1t
*
1m
1cm
= 164.28 m
SOLUCIN
PARTE A:
Hay un cambio de altura por ende tenemos una energa potencial, expresada por la
siguiente ecuacin:
L=mgh= 75Kg*9. 81
m
x
2
*(169.28m) = 124.42x10
3
J
L= 124.4x10
3
J*
1ca|
4.18]
*
1kca|
1ca|
= 29.72 Kcal
PARTE B:
Como se transforma solo el 25% de los alimentos en energa tenemos la siguiente
relacin
29, 72 Kcal*
1
25
= 118.9 Kcal
Se debe consumir 118.9 Kcal de energa producida por los alimentos para realizar
dicho trabajo.
4.29. A que distancia llegar una pelota de 100 gramos con una velocidad de 100
pies seg
-1
, subiendo verticalmente y haciendo caso omiso de la friccin de
aire?
m= 100g*
1Kg
1g
= 0.1 Kg
v= 100
t
xeg
*
3.5cm
1t
= 3.05
m
x
g= 9.8
m
x
2
SOLUCIN
- 120 -
I= 0.37
A
h= 0.47 m
Debido a que es un problema de cada libre aplicamos
v= 2gh
h=
u
2
2g
=
(3.5)
2
2(9.8)
= 0.47 m
4.30. La perdida de calor de un horno es de 100 cal min
-1
Qu corriente debe
pasar a travs de un calentador de 50 ohmios, para compensar esta perdida
de calor?
P= 100
ca|
m|n
*
4.18]
1ca|
*
1m|n
xeg
= 6.98 W
R= 50
SOLUCIN
Aplicando las ecuaciones de la electricidad
P= I
2
R
I=
P
R
=
.98W
5u
= 0.37 A
4.31. Cien litros de vapor de agua a 100
o
C y 0.5 atm, se comprimen
isotrmicamente y reversiblemente a 1 atm y aun mas, hasta que el volumen
es de 10 litros. Despreciando el volumen de agua condensada en comparacin
con el volumen del vapor y suponiendo la conducta de este es como la de un
gas ideal, calcular el trabajo requerido para la compresin y el calor
producido.
V
1
=100 L
T= 100
o
C = 373.15 K
P
1
= 0.5 atm
V
2
= 10 L
SOLUCIN
Como el vapor se comporta como gas ideal:
T= 373.15K
P
1
P
2
V
1
P
(
a
t
m
)
V
2
V
L
- 121 -
Q = L = -1.16 J
AU = 0
L= -1.16 J
Aplicando Ley de Boyle
P
1
V
1
=P
2
V
2
P
2
=
P
1F
1
F
2
=
(.5atm)-(1L)
(1L)
= 50 atm
P
2
= 50 atm.
Calculo de las moles de vapor
PV= nRT
n=
PF
RT
=
(.5atm)-(1L)
.82
atmL
Kmu|
- (373.15K)
=1.63x10
-4
moles
n=1.63x10
-4
moles
Aplicando la ecuacin del trabajo isotrmico reversible
L= nRT ln(
F
2
F
1
) = (1.63x10
-4
moles)*(8.31
]
Kmu|
)*(373.15 K)*(-2.30) = -1.16 J
Como no hay variacin de temperatura tenemos que
Aplicando la primera ley de la termodinmica
AU = Q-L
0 = Q-L
4.32. Demuestre que para una expansin isotrmica de un gas ideal AH = 0
SOLUCIN
T= cte
P
2
P
1
V
2
P
V
1
V
2
1
- 122 -
L= -632.35 cal
Para calcular la entalpia en el estado 2
AH= n C
P
AT
Como es un proceso isotrmico AT= 0
as tenemos que AH es igual a cero para
la expansin isotrmica de un gas ideal.
4.33. Cul es la cantidad mnima de caloras de trabajo necesaria para comprimir
isotrmicamente 1 mol de amoniaco a 1 atm y 150
o
C, a un volumen de 10
litros: (a) suponiendo q obedece la ley de los gases ideales, (b) suponiendo que
tambin obedece la ecuacin de Van der Waals con a= 4.170 atmosferas-litro
-
2
y b= 0.03707 litros mol
-1
?
SOLUCION
PARTE A
n= 1 mol NH
3
P
1
= 1 atm
T= 150
o
C = 323.15 K
Aplicando la ecuacin del gas ideal tenemos
P
1
V
1
=nRT
V
1
=
nRT
P1
=
.82
atmL
Kmu|
-(323,15K)
1atm
= 26.5 L
V
1
= 26.1 L
P
2
V
2
=nRT
P
2
=
nRT
F2
=
.82
atmL
Kmu|
-(323,15K)
2.5L
= 2.65 atm
P
2
= 2.64 atm
L=nRT ln(
F2
F1
) = (1 mol)*(1,98
ca|
Kmu|
)*(323.15 K)*(-0.98)
P
2
P
1
V
2
P
V
1
V
- 123 -
L = -629.7 cal
PARTE B
Si es un gas de van der Waals podemos aplicar la siguiente expresin:
P=
nR1
(v-b)
-
un
v
2
Despejando el volumen tenemos
V
3
(
nR1
P
+nb )I
2
-
un
P
-
ubn
2
P
= 0
Resolviendo para encontrar el volumen 1 tenemos
V
3
((
(1moI)-[0.082
ctmL
Kmcl
-(323.15K)
1utm
) +(1mol) - (u.uS7u7
utm
L
))I
2
-
(1moI)-(4.170
ctmL
2
mcl
2
)
1utm
-
_4.170
ctmL
2
mcl
2
]-[0.03707
ctm
L
-(1moI)
1utm
= 0
V
1
= 26.7 L
Realizamos el calculo del trabajo de expansin isotrmico para un gas de van der
Waals
L= nRIln
(v2-b)
(v1-b)
+on [
1
v2
1
v1
L=(1mol) - [1.98
cuI
moIK
- (S2S.1SK)ln
[10L-0.03707
atm
L
[26.7L-0.03707
ctm
L
+[4.17u
utmL
2
moI
2
-
(1mol) - (
1
10
-
1
26.7
)
4.34. Un mol de gas ideal se expande isotrmicamente y reversiblemente de un
estado de P
1
y V
1
a otro estado de P
2
y V
2.
Calcular el trabajo efectuado por
el gas. Un gas verdadero obedece a la relacin P (F
-b)=RT, donde b es una
constante, se expande isotrmicamente y reversiblemente de un estado P
1
y
F
1
a otro estado de P
2
y F
2
. Calcular el trabajo efectuado por el gas. Qu
conclusiones generales se pueden deducir de estos resultados?
SOLUCIN
T= cte
P
2
P
1
V
2
P
V
1
V
- 124 -
AU =22.56 Kcal
L = nRT Ln (
F
2
-h
F
1
-h
)
PARTE A
Para la expansin de un gas ideal:
0L = P6F
0L
2
1
=
nRT
F
6F
F
1
F
1
L= nRT ln
F
2
F
1
PARTE B
Para la expansin de un gas verdadero:
0L = P6F
0L
2
1
=
nRT
(F - nh)
6F
F
1
F
1
4.35. (a) Calcular el cambio en la energa interna del oxigeno cuando se calienta de
0 a 100
o
C a volumen constante. (b) Calcular el cambio de la entalpia en este
proceso.
SOLUCIN
PARTE A
AU = n C
P
AT = (1mol)*(7.05
ca|
gK
)*(373.15-273.15) = 22.56 Kcal
PARTE B
T= cteT= cte
P
2
P
1
V
2
P
V
1
P
2
V
- 125 -
AH = 22.56 Kcal
Debido a que es un proceso a volumen constante, AU = AH
4.36. Un mol de oxigeno a 5 atm y contenido en un volumen de 4 litros se hace
expandir reversible y adiabticamente hasta una presin final hasta una
presin final de 1 atm Cul es (a) el volumen final y (b) la temperatura
final?
P
1
= 5 atm
V
1
= 4 L
P
2
= 1 atm
C
P
=
7
2
R
C
v
=
S
2
R
SOLUCIN
PARTE A
Utilizando la relacin de Poisson que relaciona la presin y el volumen,
encontramos V
2
:
y=
C
P
C
v
2
R
S
2
R
= 1.4
P
1
I
1
y
=
P
2
I
2
y
- 126 -
V
2
= 12.67
L
V
2
= (
P1v
1
y
P2
)
1
y
= (
(5utm)-(4L )
1.4
1utm
)
1
1.4
= 12.67 L
PARTE B
Utilizando la ecuacin del gas ideal obtenemos T
1
:
P
1
V
1
= nRT
1
T
1
=
P1v1
nR
=
(5utm)-(4L)
(1moI)-(0.082
ctmL
Kmcl
)
= 243.9 K
T
1
= 243.9 K
Utilizando la relacin de Poisson que relaciona la temperatura con el volumen
encontramos T
2
:
T
1
I
1
y-1
=
T
2
I
2
y-1
T
2
= (
11v
1
y-1
v2
)
1
y-1
= (
(243.9K)-(4L )
0.4
12.67L
)
1
0.4
= 153.8 K
T
2
= 153.8 K
4.37. Un tanque contiene 20 litros de nitrgeno comprimido a 10 atm y 25
o
C.
Calcular el trabajo mximo (en caloras) que se puede obtener cuando el gas
se hace expandir a 1 atm de presin (a) isotrmicamente (b) adiabticamente.
P
1
= 10 atm
T
1
= 25
o
C = 298.15 K
V
1
= 20 L
P
2
= 1 atm
SOLUCIN
PARTE A
Para realizar los clculos asumimos que se trata de un gas ideal por lo cual
podemos aplicar:
P
1
V
1
= nRT
T= 298.15 K
P
2
P
1
V
2
P
V
1
V
- 127 -
n =
P1v1
R1
=
(10utm)-( 20L)
[0.082
ctmL
Kmcl
-(298.15K )
= 8.18 moles N
2
P
2
V
2
= nRT
V
2
=
nR1
P2
=
(8.18moIcs)-[0.082
ctmL
Kmcl
-(298.15K)
1utm
= 200 L
Aplicando la ecuacin del trabajo de expansinisotrmico tenemos:
L= nRT ln(
F
2
F
1
) = (8.18 moles)*(1.98
ca|
mu|K
)*(298.15 K)*(2.30) =11.10 Kcal
PARTE B
Como es un gas
diatmico
C
v
=
S
2
R
C
P
=
7
2
R
Como es un proceso
adiabtico podemos aplicar la relacin de Poisson que relaciona presin y
volumen:
y=
C
P
C
v
2
R
S
2
R
= 1.4
P
1
I
1
y
=
P
2
I
2
y
V
2
= (
P1F
1
y
P2
)
1
y
= (
(1atm)-(2L )
1.4
1atm
)
1
1.4
= 103. 6L
V
2
= 103.6 L
Utilizando la relacin de Poisson que relaciona la temperatura con el volumen
encontramos T
2
:
T
1
I
1
y-1
=
T
2
I
2
y-1
T
2
= (
T1v
1
y-1
v2
)
1
y-1
= (
(298.15 K)-(20 L )
0.4
103.6 L
)
1
0.4
= 281 K
T
2
= 281 K
L= 11.10 Kcal
- 128 -
Con esto podemos aplicar la ecuacin del trabajo de expansin para un proceso
adiabtico, dada por:
L= -
nRA1
y-1
= -
(8.18 moIcs)-[1.98
ccl
Kmcl
-( 281K-298.15K)
1.4-1
= 694.42 cal
4.38. Una molcula de un gas ideal se comprime en un cilindro por medio de un
pistn. La presin es P, el volumen V y el cilindro esta sumergido en un
termostato a una temperatura T. El siguiente ciclo se lleva a cabo (1) la
temperatura del termostato se eleva 1
o
C, conservndose la presin constante;
(2) la presin se eleva gradualmente hasta que el volumen decrece a su valor
original V, sin modificar la temperatura; y la (3) la temperatura del
termostato se disminuye en 1
o
C, conservndose el volumen constante. Haga
una tabla mostrando las presiones inicial y final, las temperaturas y q, w y
AE, para cada paso.
Etapa 1-2: Expansin Isobrica
Etapa 2-3: Compresin Isotrmica
Etapa 3-1: Expansin Isomtrica
SOLUCION
ESTADO P, atm T, K V, L
1 P
1
T
1
V
1
2 P
2
= P
1
T
2
V
2
3 P
3
T
3
= T
2
V
3
= V
1
PARTE A
Etapa 1-2
Q= nC
P
(T
2
- T
1
)
L= P
1
(V
2
- V
1
)
AU= nC
v
(T
2
- T
1
)
PARTE B
Etapa 2-3
AU= 0
P
2
P
1
V
2
P
V
1
V
2
3
L = 694.42 cal
- 129 -
L =Q= nRT ln(
v
3
v
2
)
PARTE C
ETAPA 3-1
L = 0
AU=Q= nC
V
(T
1
T
3
)
ETAPA AU Q L
1-2 nC
V
(T
2
- T
1
) nC
P
(T
2
- T
1
)
P
1
(V
2
- V
1
)
2-3 0
nRT ln(
V
3
V
2
) nRT ln(
V
3
V
2
)
3-1 nC
V
(T
1
T
3
) nC
V
(T
1
T
3
)
0
4.39. Calcule la elevacin mxima de temperatura de una pieza de hierro de 500 kg
cuando la superficie al caer de una altura de 500 metros (despreciar la
resistencia del aire y suponer que la mitad del calor va adentro de la pieza de
hierro). El peso atmico del hierro es 55.85 g mol
-1
.
Cp hierro = 2S
]
moI K
SOLUCION
En este caso, tenemos una variacin de altura por tanto tenemos una energa
potencial, expresada por:
E= mgh= (500kg)*(9.8
m
s
2
)*(500 m) = 2.45x10
6
J
Asumiendo que la presin es constante en dicho proceso tenemos que la ecuacin
del calor esta expresada por:
Q=
m
M
C
P
AT
AT =
QM
mC
P
=
(2.45x10
6
])-(55.85
g
moI
)
2(500x10
3
g)-(25
J
moI K
)
= 5.47 K
4.40. Calcular cuantas caloras mas se requeran para calentar 100 gramos de
aluminio de 25 a 300
o
C que se necesitan para calentar el mismo peso de plata
y al mismo intervalo de temperatura.
Cp aluminio = 0.897
]
gC
Cp plata= 0.237
]
g C
AT= 5.47 K
- 130 -
SOLUCION
Calculamos la cantidad de calor requerida para calentar los 100 g de aluminio
Q
Al
= mC
p
AT
Q
Al
= (100g)*(0.897
]
gC
)*(300
o
C-25
o
C) =24,66x10
3
J *
1 caI
4.186 ]
= 5.9 Kcal
Q
Al
= 5.9 Kcal
Calculamos la cantidad de calor requerida para calendar los 100 g de plata
Q
Ag
= mC
p
AT
Q
Ag
= (100g)*(0.237
]
gC
)*(300
o
C-25
o
C) =6.52x10
3
J *
1 caI
4.186 ]
= 1.55Kcal
Q
Ag
= 1.55Kcal
4.41. Se calientan diez moles de helio 25 a 125
o
C a una presin constante
introduciendo algo de metal plata a 200
o
C y dejando que el sistema recobre
su equilibrio trmico. Cuntos gramos de plata se necesitaran emplear?
Cp helio = 5.193
]
gC
Cp plata= 0.237
]
g C
SOLUCION
Se aplica el principio de conservacin del calor que propone:
Q
ganado
= Q
perdido
nMC
P
AT = m C
P
AT
(10 moles He)*(4
g
moI
)*(5.193
]
gC
)*(125
o
C-25
o
C) = m* 200
o
C -125
o
C)
m= 1168,27 g
Se necesitan 1168,27 g de plata para poder calentar helio de 25
o
C a 125
o
C
Se necesitan 1168,27 g de plata para poder calentar helio de 25
o
C a 125
o
C
Se necesitan 4.35 Kcal mas el calor utilizado en calendar 100g de plata para
poder calendar 100g de aluminio.
- 131 -
ENERGA Y PRIMERA LEY DE LA TERMODINMICA
FISICO QUIMICA GILBERT CASTELLAN
5.1. Un gas experimenta una expansin en una sola etapa, contra una presin
opuesta constante, desde T, P
1
, V
1
hasta T, P
2
, V
2
. Cul es la masa mxima M
que se puede levantar hasta una altura h en esta expansin?
b) El sistema de a) vuelve a su estado inicial mediante una compresin en una
etapa: Cul es la mnima masa M que debe caer desde una altura h para
restablecer el sistema a su estado inicial?
c) Cul es la masa neta que baja a travs de la altura h con la transformacin
cclica (a) y (b)?
d) si h = 10cm, P
1
= 10 atm, P
2
= 5 atm y T = 300K, y se trata de un mol de
gas, calcular los valores numricos pedidos en (a) y (b)
Solucin:
a)
W = Mgh
De donde:
N =
W
gh
L
exp
= P
op
(V
2
V
1
)
P
op
= P
2
L
exp
= P
2
(V
2
V
1
)
V
P
V
2
V
1
P
op
=P
2
=5 atm
P
1
=10 atm
T=300 K
- 132 -
L
cxp
= P
2
nRT(
1
P
2
-
1
P
1
) = nRT( 1 -
P
2
P
1
)
N =
nRT
gh
_1 -
P
2
P
1
]
b)
N =
L
gh
L
comp
= P
1
(V
2
V
1
)
P
op
= P
1
L
comp
= P
1
nRT_
1
P
2
-
1
P
1
] = nRT_
P
1
P
2
- 1]
N =
nRT
gh
_
P
1
P
2
- 1]
c)
N -N =
nRT
gh
_
P
1
P
2
- 1] -
nRT
gh
_1 -
P
2
P
1
]
N-N =
nRT
gh
_
P
1
P
2
+
P
2
P
1
- 2_ =
nRT
gh
_
P
1
2
+ P
2
2
- 2P
1
P
2
P
1
P
2
_
N-N =
nRT
gh
(P
1
-P
2
)
2
P
1
P
2
d)
P = u.u82
otmI
molK
-
1.u1S2 - 1u
6
Jino
cm
2
1 otm
= 8.Su86 - 1u
4
IJino
Kmolcm
2
N =
1mol _8.Su86 - 1u
7
gcm
2
Kmols
2
] Suu.1S K
98u.66S
cm
s
2
_1 -
S atm
1u atm
]
P = 8.Su86 - 1u
7
g cm
2
K moI s
2
- 133 -
N = 1.271 - 1u
6
g = 1.271 - 1u
3
Kg
H =
(1)(8.Su86 - 1u
7
)(Suu.1S)
(98u.66S)(1u)
_
1u
S
- 1]
H = 2.S42 - 1u
6
g
5.2. Un mol de un gas ideal se expande de T, P
1
, V
1
a T, P
2
, V
2
en dos etapas
Presin de oposicin Variacin de volumen
Primera etapa
Segunda etapa
P(constante)
P
2
(constante)
V
1
a V
V a V
2
Especificamos que el punto P, V, est sobre la isoterma a la temperatura T.
a) Formular la expresin para el trabajo producido en esta expansin en
trminos de T, P
1
, P
2
y P.
b) Para qu valor de P tiene el trabajo un valor mximo en esta expansin
en dos etapas? Cul es el valor mximo del trabajo producido?
Solucin:
L = L
1a etapa
+ L
2a etapa
H = 2.S42 - 1u
3
Kg
V
P
V
2
V
1
P
op
=P
2
=5 atm
P
1
=10 atm
T=300 K
- 134 -
L = P
op
(V- V
1
) + P
op
(V
2
V
1
) + P
op
(V
2
V)
L = P(V- V
1
) + P
2
(V
2
V)
PV=nRT
v =
nRT
P
v
1
=
nRT
P
1
v
2
=
nRT
P
2
L = P _
nRT
P
-
nRT
P
1
] + P
2
_
nRT
P
2
-
nRT
P
]
L = nRT -nRT
P
P
1
+ nRT -nRT
P
2
P
1
n = 1 mol
L = RT_ 2 -_
P
P
1
] - _
P
2
P
]_
b)
uL
uP
= -
1
P
1
+
P
2
P
2
= u
P = (P
1
P
2
)
1/2
L = RT_2 -
(P
1
P
2
)
12
P
1
-
P
2
(P
1
P
2
)
12
_
L = RT_2 -
P
2
12
P
1
12
-
P
2
12
P
1
12
_
I = 2RI _1 -_
P
2
P
1
]
12
_
2 - 1u
3
Kg
- 135 -
5.3. Tres moles de un gas ideal se expanden isotrmicamente contra una presin
constante de oposicin de 1 atm desde 20 hasta 60 litros. Calcular L, Q, U y
H.
Solucin:
T = cte
H = 0
U = 0
L = P V
L = P (V
2
V
1
)
L = 1atm (60L 20L)
Q = L
4. Tres moles de un gas ideal a 27C se expanden isotrmicamente y
reversiblemente desde 20 hasta 60 litros. Calcular L, Q, U y H
Solucin:
L = 40 atmL
Q = 40 atmL
V
P
V
2
=60 L V
1
=20 L
P
op
=P
2
=1 atm
P
1
T=cte.
V
P
V
2
=60 L V
1
=20L
T=300,15 K
- 136 -
T = cte
U = 0
H = 0
PV=nRT
L = Puv
V
2
V
1
L =
nRT
v
V
2
V
1
uv
L = nRT
uv
v
V
2
V
1
L = nRTln
v
2
v
1
L = S mol _u.u82
atmL
molK
] (Suu.1S K) ln _
6uL
2uL
]
Q = U + L
Q = L
5.5. Un mol de gas de Van der Waals a 27C se expande isotrmicamente y
reversiblemente desde 10 hasta 30 litros. Calcular el trabajo producido: a = 5.49
litros
2
. Atm. Mol
-1
, b = 0.064 litros/mol
Solucin:
P(-b)=RT
L = Puv
V
2
V
1
L = _
RT
v
-b
-
a
v
2
]
V
2
V
1
uv
I = 81.12 otm I
= 81.12 otm I
- 137 -
L = RT
uv
-b
V
2
V
1
- a
uv
2
V
2
V
1
L = RTln
v
2
-b
v
1
-b
+
a
v
2
-
a
v
1
L
L = [u.u82
atmL
moIK
(Suu.1SK)ln_
30
L
moI
- 0.064
L
moI
10
L
moI
- 0.064
L
moI
_ +
5.49
L
2
atm
moI
30
L
moI
-
5.49
L
2
atm
moI
10
L
moI
5. 6. Un mol de un gas ideal est encerrado a una presin constante Pop= p=2 atm.
La temperatura vara desde 100 C hasta 25 C
a) Cul es el valor de W?
b) Si Cv= 3 cal/ k mol, calcular Q, AE, y AH
Solucin
DATOS:
P
1
= 2atm y T
1
=373,15 K
P
2
= 2 atm y T
2
= 298,15 K
L = 26.944 atmL
1
1
1
T R
P
n
V =
V
P
V
1
V
2
P
op
=P=2 atm
T
1
=300,15 K
T
2
=298,15 K
- 138 -
atm 2
K) (373,15 K) mol atm/ l (0,082 mol 1
1
= V
2
2
2
T R
P
n
V =
atm 2
K) (298,15 K) mol atm/ l (0,082 mol 1
2
= V
atm - l 1
cal 24,218
atm - l 6,188 - l) 15,392 - l (12,298 atm 2 L
V P L
= =
A =
b)
T C
V
A = AU
K 373,15) - (298,15 ) mol (1
mol k
cal
3 |
.
|
\
|
= AU
cal 149,86 - cal 225 - L U Q = + A =
Proceso a presin constante
Q A = AH
V
2
=12.29L
V
1
=15.3921L
L= -149.86 cal
U= -225 cal
Q= -374.86
cal
H= -374.86 cal
- 139 -
5.7. Si un gas ideal se somete a una expansin politrpica reversible, se cumple que
C p =
n
v , donde C y n son constantes y n>1.
a) Calcular el trabajo para esta expansin, si un mol de gas se expande de V1
a V2 y si T1= 300 C, t2= 200C y n=2
b) Si mol K cal/ 5 = Cv calcular Q, AE, AH
Solucin:
a) El trabajo para una expansin politrpica reversible es:
}
=
2
1
V
dV p
V
L
Sustituyendo en esta expresin la condicin pV
n
= C con n=2, tenemos:
} }
= =
2
1
2
1
2 2
V
dV
C dV
C
L
V
V
V
V
V
2
2
2 2
1
2
1 1
V
V p
-
V
V p
= L
2 2 1 1
V p V p L =
K) (573,15
K mol
atm - l
0,082 mol) (1
1 1
1 1 1
|
.
|
\
|
=
=
V p
nRT V p
K) (473,15
K mol
atm - l
0,082 mol) (1
2 2
2 2 2
|
.
|
\
|
=
=
V p
nRT V p
P
1
V
1
= 46.991 atmL
P
2
V
2
= 38.79 atmL
V
P
V
1
V
2
T
1
=300C= 573.15 K
T
2
=200C= 473,15 K
- 140 -
atm l
cal 24,218
atm) l 38,79 - atm l (46,99 = L
b)
T C n U
V
A = A
K 573,15) - (473,15
mol K
cal
5 mol) (1
|
.
|
\
|
= AU
cal 198,59 cal 500 - Q + =
T Cp H A = A
mol K / cal 1,987 mol K cal/ 5 + =
+ =
p
v p
C
R C C
K = ) 15 , 513 5 Kmol(473,1 cal/ 6,987 H
L U Q + A =
L= 198.59 cal
L= -500 cal
Q= -301.41 cal
Cp
= 6.987 cal/molK
H= -698.7 cal
- 141 -
5.8. a) El coeficiente de expansin trmica del agua lquida es 2,1 x 10
-4
grad
-1
y la
densidad es 1 g/cm
3.
Si se calientan 200 cm
3
de agua, de 25C a 50 C bajo
presin constante de 1 atmsfera, calcular W.
b) Si
p
C = 18 cal7K mol, calcular Q y AH
Solucin:
a) El coeficiente de expansin trmica o est definido con la expresin como:
p
T
V
V
|
.
|
\
|
c
c
=
1
o
Que puede escribirse en la forma:
VdT dV o =
Sustituyendo esta expresin para la diferencial del volumen dV en la ecuacin de
trabajo:
) (
1 2
2
1
T T pV L
dT pV L
dT V p L
dV p L
pdV L
T
T
=
=
} =
} =
} =
}
o
o
o
atm - l 10 1,05 L
) 25 50 )(
C
1
10 (2,1 l) atm)(0,2 1 (
3 -
4 -
=
= C L
atm l 1
cal 24,218
atm l 10 1,05
3 -
= L
Conociendo la densidad y el volumen, la masa es:
cm 200 g/cm 1 m
V
3 3
=
= m
moles 11,11
g/mol 18
g 200
=
L=0.0254 cal
m=200g
- 142 -
K 298,15) - (323,15
K mol
cal
18 mol 11,11
T C n
P
= A
A = A
H
H
Q= H A
5.9. Un mol de gas ideal se comprime adiabticamente en una sola etapa con una
presin constante de oposicin igual a 10 atm. Inicialmente el gas est a 27C y 1
atm de presin; la presin final es de 10 atm. Calcular la temperatua final del
gas, W, Q . Resolver esto para dos casos:
Caso I: Gas monotmico, . 2 / 3R C
v
= Caso II: gas diatmico . 2 / 5R C
v
= Cmo
se afectara los resultados si se utilizan n moles en vez de un mol?
La compresin adiabtica a la cual se somete el gas queda descrita
esquemticamente por la figura:
Solucin:
Caso I: como el gas es ideal, el volumen es el estado 1 es:
atm 1
K) (300,15 K) atm/mol - l 0,082 ( mol) (1
1
1
1
=
=
V
P
nRT
V
P
(atm)
(atm)
P2 = 10
P1 = 1
T2
T1= 300 K
V2 V1
V
H=5000cal
Q=5000cal
- 143 -
Proceso es adibtico Q=0
L U = A
) V - V ( Pop - L
) ( C n
1 2
1 2 v
=
= A T T U
) V - V ( Pop - ) ( C n
1 2 1 2 v
= T T
atm - l
cal
24,218 l 24,61) - (V atm 10 - K 300,15) - K)(T cal/mol (1,987
2
3
mol) 1 (
2 2
=
|
.
|
\
|
24,61) - (V 242,18 300,15) - (T 98 , 2
2 2
=
2 2 2
nRT V p =
2 2
T 0,082 V 10 =
6854,5 T 4.966
596,05 ) T (0,0082 242,18 - 894,45 - T 98 , 2
2
2 2
=
+ =
)
atm - l
cal
(24,218 L 24,61) - (11,32 atm) (10 L
v p L
=
A =
L - = AU
El H A para un gas monoatmico
V
1
=24.61 L
V
2
=11.32 L
T
2
=1380.32K
L=3218.6 cal
L= -3218.6 cal
- 144 -
R
H
2
5
Cp
C R Cp
T C
v
p
=
+ =
A = A
K 300,15) - (1380,32
K mol
cal
1,987
2
5
|
.
|
\
|
= AH
T 0,082 V 10
5960,05 V 242,18 - 300,15) - T ( 97 , 4
2 2
2 2
=
+ =
7451,79 T 95 , 6
2
=
24,218 24,61) - (8,78 10 L =
300,15) - 29 , 1071 )( 987 , 1 (
2
7
= AH
H= 5365.74 cal
T
2
= 1071.29K
V
2
= 8.78 L
U=L=3833.71 cal
H=5362.89 cal
- 145 -
5.10. Una mol de gas ideal a 27C y 1 atm de presin se comprime adiabticamente
y reversiblemente hasta una presin final de 10 atm. Calcular la temperatura
final, Q, L, U y H para los mismos casos del problema 7-9.
Datos:
n= 1mol P(atm)
t= 27C=300K
P
1
= 1atm
P
2
= 10atm
T(K)
Para gas ideal monoatmico
T1
P1
y-1
y
=
T2
P2
y-1
y
T2= [
P2
P1
y-1
y
(I1)
y=
Cp
C
y=
S
2
3
2
=
5
3
T2=[
10
1
S
3
-1
S
3
(Suu.1S)
U=Q-L
Q=0
U=-L
U= nC
V
T
U=(1mol)(3/2)(8.31J/molK)(753.94-300.15K)
U=-L
T
2
1
at
m
Z
T
1
P
1
1P
1
=
1a
t
m
P
2
P
1
=
1a
t
m
V
1
1a
tm
Z
V
2
1a
tm
Z
2
1
a
t
m
Z
1
1
a
t
m
Z
T2= 753.94K
U=5656.49 J
- 146 -
H= nC
P
T
H=(1mol)(5/2)(8.31J/molK)(753.94-300.15K)
Para gas ideal diatmico
T1
P1
y-1
y
=
T2
P2
y-1
y
T2= [
P2
P1
y-1
y
(I1)
y=
Cp
Cu
y=
2
S
2
=
7
5
T2=[
10
1
S
-1
(Suu.1S)
U=Q-L
Q=0
U=-L
U= nC
V
T
U=(1mol)(5/2)(8.31J/molK)(579.21-300.15K)
U=-L
H= nC
P
T
L=-5656.49 J
H=9427.48 J
T2= 579.21K
U=5797.47 J
L=-5797.47 J
- 147 -
H= (1mol)(7/2)(8.31J/molK)(579.21-300.15K)
5.11. Un mol de gas ideal a 27C y 10 atm de presin se expande adiabticamente
hasta una presin constante opositora de 1atm. Calcular la temperatura final,
Q, L, U y H para los dos casos del problema Cv=3R/2 y Cp=5R/2.
Datos:
n= 1mol P(atm)
t= 27C=300K
P
1
= 10atm
P
2
= 1atm
Para gas monoatmico
U=Q-L
Q=0
U=-L
U= nC
V
T
L=-P
op
V
P
1
V
1
=nRT
1
V
1
=
nRT1
P1
V
1=
(1moI)[
0.0820SamtL
moIK
(300.15)K
10atm
P
1
P
1
=
1a
t
m
P
2
2P
1
=
1a
t
m
1
1
a
t
m
Z
2
1
a
t
m
Z
T
1
1
at
m
Z
T
2
V
2
1a
tm
Z
V
1
1a
tm
Z
H=8116.46 J
V
1
=2.46 L
- 148 -
nC
V
T= -P
op
(V
2
-V
1
)
(1mol)(3/2)(1.987cal)(T
2
-300.15)=(-1atm)(V
2
-2.46L)(24.218cal/atmL)
2.98T
2
- 894.59=-24.218 V
2
+ 59.58
P
2
V
2
=nRT
2
V
2
=
nRT2
P2
V
2=
(1moI)[
0.0820SamtL
moIK
(T2)K
1atm
V
2
=0.08205 T
2
Reemplazando V
2
2.98T
2
- 894.59=-24.218 (0.08205 T
2
)+ 59.58
4.96 T
2
=954.17
Reemplazando T
2
en V
2
V
2
=0.08205 (192.14)
U=-L
L=(-1amt)(15.75-2.46)L
L=-13.29atmL(24.218cal/atmL)
H= nC
P
T
H=(1mol)(5/2)(1.987cal/molK)(192.14-300.15)
T
2
=192.14K
V
2
=15.75L
L=-321.8 cal
U=321.8 cal
H= -536.5 cal
- 149 -
Para gas diatmico
U=Q-L
Q=0
U=-L
U= nC
V
T
L=-P
op
V
P
1
V
1
=nRT
1
V
1
=
nRT1
P1
V
1=
(1moI)[
0.0820SamtL
moIK
(300.15)K
10atm
nC
V
T= -P
op
(V
2
-V
1
)
(1mol)(5/2)(1.987cal)(T
2
-300.15)=(-1atm)(V
2
-2.46L)(24.218cal/atmL)
4.97T
2
1491.75=-24.218 V
2
+ 59.58
P
2
V
2
=nRT
2
V
2
=
nRT2
P2
V
2=
(1moI)[
0.0820SamtL
moIK
(T2)K
1atm
V
2
=0.08205 T
2
Reemplazando V
2
4.97T
2
1491.75=-24.218 (0.08205 T
2
)+ 59.58
6.96 T
2
=1551.33
Reemplazando T
2
en V
2
V
1
=2.46 L
T
2
=223.02K
- 150 -
V
2
=0.08205 (223.02)
U=-L
L=(-1amt)(18.3-2.46)L
L=-15.84atmL(24.218cal/atmL)
H= nC
P
T
H=(1mol)(7/2)(1.987cal/molK)(223.03-300.15)
5.12. Repetir el problema 11 suponiendo que la expansin es reversible.
Datos:
n= 1mol P(atm)
t= 27C=300K
P
1
= 10atm
P
2
= 1atm
Para gas ideal monoatmico
T1
P1
y-1
y
=
T2
P2
y-1
y
T2= [
P2
P1
y-1
y
(I1)
y=
Cp
Cu
V
2
=18.3L
L= -383.6 cal
U=383.6 cal
H= -536.40 cal
T
1
1
at
m
Z
T
2
P
2
P
1
=
1a
t
m
P
1
P
1
=
1a
t
m
1
1
a
t
m
Z
2
1
a
t
m
Z
- 151 -
y=
S
2
3
2
=
5
3
T2=[
1
10
S
3
-1
S
3
(Suu.1S)
U=Q-L
Q=0
U=-L
U= nC
V
T
U=(1mol)(3/2)(1.987cal/molK)(119.5-300.15K)
U=-L
H= nC
P
T
H=(1mol)(5/2)(1.987cal/molK)(119.5-300.15K)
Para gas ideal diatmico
T1
P1
y-1
y
=
T2
P2
y-1
y
T2= [
P2
P1
-1
(T1)
y=
Cp
Cv
y=
2
S
2
=
7
5
T2= 119.5K
U= -538.4 cal
L=538.4 cal
H=-897.4 cal
- 152 -
T2=[
1
10
S
-1
(Suu.1S)
U=Q-L
Q=0
U=-L
U= nC
V
T
U=(1mol)(5/2)(1.987cal/molK)(155.5-300.15K)
U=-L
H= nC
P
T
H=(1mol)(7/2)(1.987cal/molK)(155.5-300.15K)
5.13. El coeficiente de Joule-Thomson para un gas de Van de Waals est dado por:
JT
=[
2aRT-h
Cp
]
Calcular H (caloras) para la compresin isotrmica a 300K de 1 mol de
nitrgeno desde 1 hasta 500 atm; a=1.34 L
2
atm/mol
2
y b= 0.039L/mol
Solucin:
_
dH
dP
] = -Cp}T = -|_
2a
RT
] -b]
uB = (-
2a
RT
+b)uP
P2
P1
H2
H1
(H
2
-H
1
)=(-
2u
R1
+b) JP
P2
P1
T2= 155.5K
U=-718.5 cal
L=718.5 cal
H=-1005.9 cal
- 153 -
H=[-
2u
R1
+b (P2 -P1)
H=[
-2_
1.34L
2
ctm
mcl
]
[
0.0820SctmL
mclK
(300K)
+
0.039L
moI
][(500atm)(24.218cal/molK)]
5.14. La temperatura de ebullicin del nitrgeno es de -196C y Cp=5cal/K. Las
constantes de Van der Waals y
JT
se dan en el problema 13.Cul ser la
presin inicial si la temperatura del nitrgeno desciende desde 25C hasta la
temperatura de ebullicin en una expansin Joule-Thomson de una sola
etapa?(La presin final debe ser 1atm).
Solucin:
_
0T
0P
] = JT = |
2aRT -h
Cp
]
_
oT
oP
] =
2(1.S4 L
2
atmmol
2
[
u.u82uSatmL
molK
T
+u.uS9Lmol
ScalmolK
24.218calatmL
[
0T
0P
=
158.18
T
0.1888
uT =
158.18
T
0.1888 uP
158.18
T
u.1888
T2
T1
uT= uP
P2
P1
-
T
u.1888
-
1S8.18
(-u.1888)
2
ln(1S8.18 -u.1888T) |
298.15
77.15
= 1 -P
1 -P=-
77.15
0.1888
-
158.18
(-0.1888)
2
ln(1S8.18 -u.1888(77.1S)) +
298.15
0.1888
+
158.18
0.0356
ln (1S8.18 -u.1888(298.1S))
H=846.94cal
P = SS4.33atm
- 154 -
5.15. Repetir el clculo del problema anterior para el amoniaco: la temperatura
de ebullicin=-34C, Cp=8.5cal/molK, a=4.17 L
2
atm/mol
2
y b= 0.037L/mol.
Solucin:
_
0T
0P
] = JT = |
2aRT -h
Cp
]
_
oT
oP
] =
2(4.17 L
2
atmmol
2
[
u.u82uSatmL
molK
T
+u.uS7Lmol
8.ScalmolK
24.218calatmL
[
0T
0P
=
289.56
T
0.1053
uT =
289.56
T
0.1053uP
298.56
T
u.1uSS
T2
T1
uT= uP
P2
P1
-
T
u.1uSS
-
289.S6
(-u.1uSS)
2
ln(289.S6 -u.1uSST) |
298.15
239.15
= 1 -P
1 -P=-
239.15
0.1053
-
289.56
(-0.1053)
2
ln(289.S6 -u.1uSS(2S9.1S)) +
298.15
0.1053
+
289.56
0.0110
ln (289.S6 -u.1uSS(298.1S))
5.16. A partir del valor de Cp dado en la tabla 7-2 para el oxgeno, Calcular Q, L,
U y H para el cambio de estado:
a) p= constante, 100C a 300C
b) v= constante, 100C a 300C
Solucin:
Cp
u2 = . 954 + 3. 2533x1
-2
T -1. 171x1
-7
T
2
[
0H
0T
p
= Cp
dH = Cp dT
Q
P
=nCpdT
H=Q
P = 61.u4atm
- 155 -
uB = nCp uT
T2
T1
H2
H1
H= 6.0954(T
2
-T
1
) +
3.2533x10
-2
2
(I2
2
-I1
2
) -
10.171x10
-
3
(I2
3
-I1
3
)
H= 6.0954(573.15 - 373.15) +
3.2533x10
-2
2
(S7S.1S
2
-S7S.1S
2
) -
10.171x10
-
3
(S7S.1S
3
-
S7S.1S
3
)
Suponiendo que el oxgeno es gas ideal a estas condiciones de temperatura y presin:
H=U-PV
H=U-P(V
2
-V
1
)
PV=nRT
V
1
=
nRT1
P1
V
2
=
nRT2
P2
H=U + R(T
2
-T
1
)
U=H - R(T
2
-T
1
)
U=(1480.72) - (1.987cal/molK)(573.15-373.15K)
L=Q U
L=1480.72 1083.32
H=1480.12 cal=Q
H=6192.82 J
U= 1083.32cal
L=397.4 cal
- 156 -
b) Si el volumen permanece constante el trabajo L=0, y por la primera ley
U=Q. Como el cambio de la temperatura es el mismo que en inicio (a) el valor
de H ser para este caso el mismo que calculamos antes, es decir H=
1480.72cal.
Cp
u2 = . 954 + 3. 2533x1
-2
T -1. 171x1
-7
T
2
[
0H
0T
p
= Cp
JE = CpJI
Q
P
=nCpdT
H=Q
uB = nCp uT
T2
T1
H2
H1
H= 6.0954(T
2
-T
1
) +
3.2533x10
-2
2
(I2
2
-I1
2
) -
10.171x10
-
3
(I2
3
-I1
3
)
H= 6.0954(573.15 - 373.15) +
3.2533x10
-2
2
(S7S.1S
2
-S7S.1S
2
) -
10.171x10
-
3
(S7S.1S
3
-
S7S.1S
3
)
H=U + PV
dH=dU + pdV + VdP
H=U + pV
U=H - pV
U=H + R(T
2
T
1
)
U=(1480.72) - (1.987)(573.15 373.15)
U=1083.32cal
H=1480.12 cal
U= 1083.32cal = Q
- 157 -
TERMOQUMICA
FISICOQUIMICA GILBERT CASTELLAN
6.1. Segn los datos de la tabla 7-1, calcular los valores de H
268
para las siguientes
reacciones:
a) 2O
2(g)
3O
2g)
b) H
2
S
(g)
+ 3/2O
2g)
H
2
O
(L)
+ SO
2g)
c) TiO
2(S)
+ 2Cl
2g)
TiCl
4(l)
+ O
2g)
d) C
(grafito)
+ CO
2(g)
2CO
g)
e) CO
(g)
+ 2H
2(g)
CH
3
OH
(l)
f) FeO
3(S)
+ 2Al
(s
Al
2
O
3(S)
+ 2Fe
(s)
g) NaOH
(s)
+ HCl
g)
NaCl
(s)
+ H
2
O
(L)
h) CaC
2(S)
+ H
2
O
(l)
Ca(OH)
2(g)
+ C
2
H
2(g)
i) CaCO
3(g)
CaO
(s)
+ CO
2(g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
a) 2O
2(g)
3O
2g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= -2mol x S4Kcalmol
b) H
2
S
(g)
+ 3/2O
2g)
H
2
O
(l)
+ SO
2g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
AB
298.15
0
= -68.S174 -7u.96 -( -4.81S)
AH
298.15
= -8 Kca|
AH
298.15
= -134. 424 Kca|
- 158 -
c) TiO
2(S)
+ 2Cl
2g)
TiCl
4(l)
+ O
2g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= -179.S -(-218.u)
d) C
(grafito)
+ CO
2(g)
2CO
g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= 2(-26.41S7) - (-94.uS18)
e) CO
(g)
+ 2H
2(g)
CH
3
OH
(L)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= -S7.u2 -(-26.41S7)
f) FeO
3(S)
+ 2Al
(s)
Al
2
O
3(S)
+ 2Fe
(s)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= -S99.u9 -(-196.S)
g) NaOH
(s)
+ HCl
g)
NaCl
(s)
+ H
2
O
(l)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
AH
298.15
= 38. 7 Kca|
AH
298.15
= 41. 224 Kca| AH
298.15
= 41. 224 Kca|
AH
298.15
= -3. 43 Kca|
AH
298.15
= -22. 59Kal
- 159 -
B
298.15
0
= -68.S174 -98.2S2 -(-1u1.99 -22.u6S)
h) CaC
2(S)
+ H
2
O
(L)
Ca(OH)
2(g)
+ C
2
H
2(g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= S4.194 -2SS.8 -(-1S.u +2(-68.S174))
i) CaCO
3(g)
CaO
(s)
+ CO
2(g)
B
298.15
0
= B
I
0
piouuctos -B
I
0
ieactivos
B
298.15
0
= -94.uS18 -1S1.9 -(-288.4S)
6.2. Suponiendo que los gases son ideales, calcular AU
298.15
para cada una de las
reacciones del problema anterior.
H=U + nRT
U=H - nRT
n= n
pruductux
-n
react|uux
a) 2O
2(g)
3O
2g)
AU
298
=H - nRT
n= n
poductos
-n
cuctos
n= S - 2
Au
298
=(-68Kcal) (1)(1.987cal/molk)(298k)(1Kcal/1000cal)
AH
298.15
= -42. 494 Kca|
AH
298.15
= -29. 9712 Kca|
AH
298.15
= -42. 4982 Kca|
Au
298
=-68.59 Kcal
- 160 -
b) H
2
S
(g)
+ 3/2O
2g)
H
2
O
(l)
+ SO
2g)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
n= 1 - S2
Au
298
=(-134.4624Kcal) (- 3/2)(1.987cal/molk)(298k)(1Kcal/1000cal)
c) TiO
2(S)
+ 2Cl
2g)
TiCl
4(l)
+ O
2g)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
n= 1 - 2
Au
298
=(38.7Kcal) (-1)(1.987cal/molk)(298k)(1Kcal/1000cal)
d) C
(grafito)
+ CO
2(g)
2CO
g)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
n= 2 - 1
Au
298
=(41.22Kcal) (1)(1.987cal/molk)(298k)(1Kcal/1000cal)
e) CO
(g)
+ 2H
2(g)
CH
3
OH
(L)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
n= u - S
Au
298
= - 133.57 Kcal
Au
298
= 40.62 Kcal
Au
298
= 39.29 Kcal
- 161 -
Au
298
=(- 30.6043Kcal) (-3)(1.987cal/molk)(298k)(1Kcal/1000cal)
f) FeO
3(S)
+ 2Al
(s)
Al
2
O
3(S)
+ 2Fe
(s)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
n= S -S
Au
298
=(-202.59Kcal) (0)(1.987cal/molk)(298k)(1Kcal/1000cal)
g) NaOH
(s)
+ HCl
g)
NaCl
(s)
+ H
2
O
(l)
Au
298
=H - nRT
n= n
poductos
-n
cuctos
n= u - 1
Au
298
=(-42.496Kcal) (-1)(1.987cal/molk)(298k)(1Kcal/1000cal)
h) CaC
2(S)
+ H
2
O
(l)
Ca(OH)
2(g)
+ C
2
H
2(g)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
n= 1 - u
Au
298
=(-29.9712Kcal) (1)(1.987cal/molk)(298k)(1Kcal/1000cal)
i) CaCO
3(g)
CaO
(s)
+ CO
2(g)
Au
298
=H - nRT
n= n
poductos
- n
cuctos
A0
298
=-41.9 Kcal
Au
298
=-30.56 Kcal
Au
298
=-202.59 Kcal
Au
298
=-28.82 Kcal
- 162 -
n= 1 - u
Au
298
=(42.498Kcal) (1)(1.987cal/molk)(298k)(1Kcal/1000cal)
6.3.Para la reaccin C
(graIttu)
+H
2
D
(g)
- CD
(g)
+ H
2(g)
H
298
=31.3822Kcal.
Los valores de Cp (cal/mol K) son: grafito, 2.066; H
2
O
(g)
, 8.025; CO
(g),
6.965; y
H
2(g)
6.892. Calcular el valor de Ha 125C
DATOS:
Cp C
(grafito)
= 2.066 cal/molK
Cp H
2
O
(g)
= 8.025 cal/molK
Cp CO
(g)
= 6.892 cal/molK
Cp H
2(g)
= 6.892cal/molK
H
298
=31.3822Kcal
T=125C+273= 398K
B
T
= B
298
+ CpT
T
298
Cp = Cp(piouuctos) -Cp(ieactivos)
Cp = (6.96S +6.892) -(2.u66 +8.u2S)
ABS98 = S1.S822Kcal +
S.766calK
1uuucalK
AT
398
298
6.4 Con base en los datos a 25C:
Fe
2
0
3(s)
+SC
(graIIto)
- 2Fe
(s)
+ S C0
(g)
AB
= 117.SKcal EC. (1)
Fe0
(s)
+C
(graIIto)
- Fe
(s)
+ C0
(g)
AB
= S7.SKcal EC. (2)
C
(graIIto)
+0
2(g)
- C0
2(g)
AB
= -94.uSKcal EC. (3)
C0
(g)
+12 0
2(g)
- C0
2(g)
AB
= -67.6SKcal EC. (4)
ACp = S.766cal/K
AB
398
= S1.76Kcal
Au
298
= 41.9 Kcal
- 163 -
6.5 Calcular los calores estndar de formacin de del FeD
(s)
y del Fe
2
D
3(s)
a) ParaelFeD
(s)
Fe0
(s)
+C
(graIIto)
- Fe
(s)
+ C0
(g)
(2) -1
Fe
(s)
+ C0
(g)
- Fe0
(s)
+C
(graIIto)
(5)
(5) +(3)
Fe
(s)
+ C0
(g)
- Fe0
(s)
+C
(graIIto)
(5)
C
(graIIto)
+0
2(g)
- C0
2(g)
(S)
Fe
(s)
+ C0
(g)
+0
2(g)
- Fe0
(s)
+C0
2(g)
()
C0
(g)
+12 0
2(g)
- C0
2(g)
(4) -1
C0
2(g)
- C0
(g)
+ 12 0
2(g)
(7)
(6) + (7)
Fe
(s)
+ C0
(g)
+0
2(g)
- Fe0
(s)
+C0
2(g)
()
C0
2(g)
- C0
(g)
+ 12 0
2(g)
(7)
Fe
(s)
+12 0
2(g)
- Fe0
(s)
(2) -1 = (5) = -37.3 Kal
(5) +(3) = () = -131.35 Kal
(4) -1 = (7) = 7. 3Kal
AH
FcO
(s)
= (6) + (7) = -63.72Kal
b) ParaelFe
2
D
3(s)
Fe
2
0
3(s)
+SC
(graIIto)
- 2Fe
(s)
+ S C0
(g)
(1) -1
2Fe
(s)
+ S C0
(g)
- Fe
2
0
3(s)
+SC
(graIIto)
(8)
C
(graIIto)
+0
2(g)
- C0
2(g)
(3) 3
SC
(graIIto)
+S0
2(g)
- SC0
2(g)
(9)
AE
FcO
(s)
= -63.72Kcal
- 164 -
(8) +(9)
2Fe
(s)
+ S C0
(g)
- Fe
2
0
3(s)
+SC
(graIIto)
(8)
SC
(graIIto)
+S0
2(g)
- SC0
2(g)
(9)
2Fe
(s)
+ S C0
(g)
+ S0
2(g)
- Fe
2
0
3(s)
+SC0
2(g)
(1)
C0
(g)
+12 0
2(g)
- C0
2(g)
(4) -3
SC0
2(g)
- SC0
(g)
+S2 0
2(g)
(11)
(1) +(11)
2Fe
(s)
+ S C0
(g)
+ S0
2(g)
- Fe
2
0
3(s)
+SC0
2(g)
(1)
SC0
2(g)
- SC0
(g)
+ S2 0
2(g)
(11)
2Fe
(s)
+S20
2(g)
- Fe
2
0
3(s)
(1) -1 = (8) = -117. 3hal
(S) 3 = (9) = -282. 15hal
(8) +(9) = (1) = -399. 45hal
(4) -3 = (11) = 22. 89hal
AH
Fc
2
O
3(s)
= (10) + (11) = -196.56Kal
6.6 Con base en los datos a 25C:
D
2(g)
- 2D
(g)
AH
= 118. 318Kal EC. (1)
Fe
(s)
- Fe
(g)
AH
= 9. 8Kal EC. (2)
El calor de formacin del FeD
(s)
es -63.kcal/mol
a) Calcular AH
a 25C para la reaccin:
Fe
(g)
+D
(g)
- FeD
(s)
b) Suponiendo que los gases son ideales, calcular E para esta reaccin (el
negativo de esta cantidad, +218.4 kcal, es la energa cohesiva del cristal).
a) AB
rcacc298K
= AE
FcO
(s)
-(AE
Fc
+AE
O
)
AB
rcacc298K
= -6S.7 - (69.68 +
118.S18
2
)
AE
Fc
2
O
3(s)
= -196.56Kcal
AB
rcacc298K
= -219.S4Kcal
- 165 -
b) AU = AH-AnRT
A0 = -219.S4Kcal -(u -2)
1.987cal
1uuukcal
kcal
molK
(298K)
6.7 Con base en los datos a 25C:
12H
2(g)
+ 12D
2(g)
- DH
(g)
AH
= 1. Kal Ec.(1)
H
2(g)
+ 12D
2(g)
- H
2
D
(g)
AH
= -57. 8Kal E(2)
H
2(g)
- 2H
(g)
AH
= 14. 178Kal E. (3)
D
2(g)
- 2D
(g)
AH
= 118. 318Kal E. (4)
Calcular H para:
a) DH
(g)
- H
(g)
+ D
(g)
b) H
2
D
(g)
- 2H
(g)
+D
(g)
c) H
2
D
(g)
- H
(g)
+DH
(g)
d) Suponiendo que los gases son ideales, calcular E para estas tres reacciones
Solucin:
a) 12B
2(g)
+ 120
2(g)
- 0B
(g)
(1) -1
0B
(g)
- 12B
2(g)
+ 120
2(g)
(5)
B
2(g)
- 2B
(g)
(3) 12
12B
2(g)
- B
(g)
()
0
2(g)
- 20
(g)
(4) 12
120
2(g)
- 0
(g)
(7)
(5) +() +(7)
0B
(g)
- 12B
2(g)
+ 120
2(g)
(5)
12B
2(g)
- B
(g)
()
120
2(g)
- 0
(g)
(7)
0B
(g)
- B
(g)
+0
(g)
(S) = (1) -1 = -1u.u6kcol
(6) = (S) 12 = S2.u89kcol
(7) = (4) 12 = S9.1S9kcol
A0 = -218.SSKcal
- 166 -
AE = (S) +(6) +(7) = 1u1.188kcol
b) B
2(g)
+ 120
2(g)
- B
2
0
(g)
(2) -1
B
2
0
(g)
- B
2(g)
+ 120
2(g)
(8)
(8) +(3) +(7)
B
2
0
(g)
- B
2(g)
+ 120
2(g)
(8)
B
2(g)
- 2B
(g)
(3)
120
2(g)
- 0
(g)
(7)
B
2
0
(g)
- 2B
(g)
+ 0
(g)
(8) = (2) -1 = S7.8kcol
AE = (8) +(S) +(7) = 221.S7kcol
c) (8) +() +(1)
B
2
0
(g)
- B
2(g)
+ 120
2(g)
(8)
12B
2(g)
- B
(g)
()
12B
2(g)
+ 120
2(g)
- 0B
(g)
(1)
B
2
0
(g)
- B
(g)
+0B
(g)
AE = (8) +(6) +(1) = 119.949kcol
d) AE = AE -AnRI
Para a)
AE = 1u1.188kcol -(2 -1)
1.987cuI
1000kcuI
kcuI
moIK
(298K)= 100.6kcal
Para b)
AE = 221.1S7kcol -(S -1)
1.987cuI
1000kcuI
kcuI
moIK
(298K)= 219.95kcal
Para c)
AE = 119.949kcol -(2 -1)
1.987cuI
1000kcuI
kcuI
moIK
(298K)= 119.35kcal
AB = 1u1.188kcal
AB = 221.S7kcal
AB = 119.949kcal
- 167 -
6.8 a) Segn los datos de la tabla 7.1, calcular el calor de vaporizacin del agua a
25C
b) Calcular el trabajo producido en la vaporizacin de 1 mol de H
2
O a 25C
bajo una presin constante de 1 atm.
c) Calcular E de vaporizacin del AGUA A 25C
d) Los valores de Cp(cal/Kmol): vapor de agua 8.025; agua lquida, 17.996.
Calcular el calor de vaporizacin a 100 C
Solucin:
a) B
2
0
(I)
- B
2
0
(g)
TABLA 7.1 Calores estndar a 25C
Compuesto fH Kcal/mol
H2O(g) -57.7979
H2O(l) -68.3174
AE
up298K
= AB
(v)
-AB
(I)
AE
up298K
= -S7.7979kcol -(-68.S174)kcal
L a P=cte
I = PAI
I = P(I
gus
-I
Iqudo
)
v
gas
> v
IIquIdo
I = PI
gus
v
gas
=
nRT
P
=
1mol[u.u82
atmL
Kmol
(298K)
1atm
= 24.448L
I = (1otm)(24.448l) _
u.u24218kcol
otml
] = u.S92kcol
b) AB
vap373
= B
298
+ CpT
373
298
AB
vap298K
= 1u.S19Skcal
L = u.S92kcal
- 168 -
AB
vap373
= 1u.S19S +
8.u2S -17.996
1uuu
373
298
kcal
K mol
(1mol) (S7S.1S -298.1S)K
6.9 Segn los valores dados en la tabla 7.2para Cp como funcin de la
temperatura, y a base de los datos:
12H
2(g)
+12Br
2(l)
- HBr
(g)
AH
298
= -8. KalE. (1)
Br
2(|)
- Br
2(g)
AH
298
= 7. 34Kca|Fc. (2)
Calcular AH
1
para la reaccin:
12H
2(g)
+12Br
2(l)
- HBr
(g)
Solucin:
Bi
2(I)
- Bi
2(g)
(2) -12
12Bi
2(g)
- 12Bi
2(I)
(3)
(1) +(3)
12B
2(g)
+12Bi
2(I)
- BBi
(g)
(1)
12Bi
2(g)
- 12Bi
2(I)
(3)
12E
2(g)
+12Br
2(I)
- EBr
(g)
(S) = (2) -
1
2
= -S.67kcol
AB
rcac
= (1) + (3) = -12.33kcal
ACp
= Cp
HBr
-(
1
2
Cp
H
2
+
1
2
Cp
Br
2
)
TABLA 7.2 Capacidad calorfica de gases en funcin de la
temperaturaCp
= a +hT +cT
2
+dT
3
GAS a h 1
3
c 1
7
H
2
6.9496 -0.1999 4.808
Br
2
8.4228 0.9739 -3.555
HBr 6.5776 0.9549 1.581
_
1
2
Cp
H
2
+
1
2
Cp
Br
2
] = (7.6862 -u.S87 1u
-3
T +u.626S 1u
-7
T
2
)
AB
vap373
= 9.771kcal
AH
rcac
= -12.33 Kal
- 169 -
ACp
= |(6.S776 +u.9S49 1u
-3
I +1.S81 1u
-7
I
2
) -(7.6862 - u.S87
1u
-3
I +u.626S 1u
-7
I
2
)]
ACp
= -1.1u86 +u.S679 1u
-3
I +u.9S4S 1u
-7
I
2
B
1000
= B
298
+ CpT
1
298
B
1000
= -12SSu -1.1u86 T
1000
298
+u.S679 1u
-3
IT
1000
298
+ u.9S4S
1u
-7
T
2
T
1000
298
B
1000
= -12SSu -1.1u86(1uuu -298) +u.S679 1u
-3
(1uuu
2
- 298
2
)
+
u.9S4S 1u
-7
2
(1uuu
3
-298
3
)
6.10 Segn los datos de las tabla 7.1 y 7.2 calcular AH
1
para la reaccin
2C
(graIIto)
+0
2(g)
- 2C0
(g)
AB
298
= 2AfB
CO
(g)
+AfB
O
2(g)
AB
298
= 2(-26.41S7) +(2(u) +u)
TABLA 7.2 Capacidad calorfica de gases en funcin de la temperaturaCp
=
o +bI +cI
2
+JI
3
GAS a h 1
3
c 1
7
d 1
9
O
2
6.0954 3.2533 -10.171
C
(grafito)
-1.265 14.008 -103.31 2.751
CO
2
6.369 10.10 -34.05
ACp
= 2Cp
CO
- (2Cp
C
+Cp
O
2
)
ACp
= 9.1194 -2.7S967 1u
-2
T +2.11189 1u
-5
T
2
)
B
1000
= -S2.8S14 + 9.1194(1uuu -298) -2.7S967
1u
-2
_
1uuu
2
2
-
298
2
2
_ +2.11189 1u
-5
_
1uuu
3
S
-
298
3
S
_
AH
298
= -52. 8314kca|
AH
1
= -1237hal
AH
1
= -52149. kca|
- 170 -
6.11 Una muestra de sacarosa C12H22O11 que pesa 0.1265g se quema en una
bomba calorimtrica. Luego de efectuarse la reaccin se encuentra que para
producir elctricamente un aumento igual de temperatura se necesitan
2082.3 joule.
a) Calcular el calor de combustin de la sacarosa
b) Con base en el calor de combustin y los datos apropiados de la tabla 7.1,
calcular el calor de formacin de sacarosa.
c) Si el aumento de temperatura en el experimento es 1.743C, Cul es la
capacidad calorfica del calormetro y su contenido?
a) 1cal = 4.184 J
2082.3 ]ouIcs
4.184]ouIcscaI
= 497.681cal =0.497681 Kcal
N
sacarosa
= S42gmol
u.126Sg
S42gmol
= S.6988 1u
-4
mol
AB
comb
=
u.497681Kcal
S.6988 1u
-4
mol
b) La reaccin de combustin de la sacarosa es:
C
12
B
22
0
11(s)
+ 120
2(g)
- 12C0
2(g)+
+ 11B
2
0
(I)
AB
comb(298)
= 12AfB
CO
2(g)
+11AfB
H
2
O
(I)
-(12AfB
O
2(I)
+AfB
C
12
H
22
O
11(s)
)
AB
comb(298)
= 12(-94.uS) +11(-69.S1) +1S46 = -SS4Kcalmol
c) Para el calormetro
AB = CpAT
Cp =
AB
AT
=
497.681cal
1.74S
AH
cumh
= -134kca|
mu|
AH
cumh(298)
= -534Kca|mu|
Cp = 285. 53ca|
- 171 -
6.12 A partir de los calores de solucin a 25C:
Reaccin 1: HCl
(g)
+ 100Aq HCl. 100 Aq AH= -17.65 Kcal
Reaccin 2: NaOH
(s)
+ 100Aq NaOH. 100 Aq AH= -10.12 Kcal
Reaccin 3: NaCl
(s)
+ 200Aq NaCl.200 Aq AH= 1.106 Kcal
Y de los calores de formacin de HCl
(g)
, NaOH
(s)
, NaCl
(s)
y H
2
O
(l)
de la
formacin de la tabla 7-1, calcular AH para la reaccin:
HCl .100Aq + NaOH.100Aq NaCl .200Aq + H
2
O (l)
Tabla 7-1: Calores estndar de formacin a 25 C
Compuesto AH
f
, Kcal / mol
HCl
(g)
- 22,063
NaOH
(s)
-101,99
NaCl
(s)
- 98,232
H
2
O
(l)
- 68,3174
Utilizando las reacciones 1. y 2. Establecidas en el enunciado:
HCl. 100Aq HCl
(g)
+ 100Aq AH= 17.65 Kcal
+ NaOH.100Aq NaOH
(s)
+ 100Aq AH= 10.12 Kcal
HCl.100Aq + NaOH .100Aq 200Aq + HCl
(g)
+ NaOH (
s)
AH= 27.77 Kcal
Si a esta nueva reaccin le agregamos la reaccin 3 obtenemos:
HCl.100Aq + NaOH .100Aq 200Aq + HCl
(g)
+ NaOH
(s)
AH= 27.77 Kcal
+ 200Aq + NaCl
(s)
NaCl.200Aq AH= 1.106 Kcal
Reaccin 4: NaCl (s) + HCl.100Aq + NaOH.100Aq NaCl. 200Aq + HCl (g) +
NaOH (s) AH= 8.76 Kcal
- 172 -
De la tabla 7-1, el AH para la reaccin:
Reaccin 5: H
2
O
(l)
+ NaCl
(s)
HCl
(g)
+ NaOH
(s)
Es igual a:
AH= -22.063 101.99-(-68.3174 98.232)= 42.4964 Kcal
Multiplicando la reaccin5 por -1 y sumndole la reaccin 4 obtenemos:
HCl
(g)
+ NaOH
(s)
H
2
O
(l)
+ NaCl
(s)
+ AH= -42.4964 Kcal
NaCl (s) + HCl.100Aq + NaOH .100Aq NaCl.200Aq + HCl
(g)
+ NaOH
(s)
AH= 28.786 Kcal
HCl .100Aq + NaOH.100Aq NaCl .200Aq + H
2
O
(l)
AH= -13.71 Kcal
6.13 A partir de los calores de formacin a 25C:
Solucin H
2
SO
4
.600Aq KOH.200Aq KHSO
4
.800Aq K
2
SO
4
.1000Aq
AH, Kcal -212.35 -114.82 -274.3 -336.75
Calcular AH para las reacciones:
H
2
SO
4
.600Aq + KOH.200Aq KHSO
4
.800Aq + H
2
O
(l)
KHSO
4
.800Aq + KOH.200Aq K
2
SO
4
.1000Aq + H
2
O
(l)
Tabla 7-1: Calor estndar de formacin a 25 C
Compuesto AH
f
, Kcal / mol
H
2
O
(l)
- 68,3174
Solucin:
Para la primera reaccin, usando los datos de tabla del enunciado:
AH
reaccin
= -274.3-68.3174-(-212.35 114.82)
AH
reaccin
= -15.44 kcal
- 173 -
Para la segunda reaccin:
AH
reaccin
= -336.75-68.3174-(274.3-114.82)
6.14 A partir de los calores de formacin a 25C:
Solucin H
2
SO
4
(l) H
2
SO
4
.1Aq H
2
SO
4
.2Aq H
2
SO
4
.4Aq
AH, Kcal -193.91 -200.62 -203.93 -206.83
Solucin H
2
SO
4
.10Aq H
2
SO
4
.20Aq
H
2
SO
4
.100Aq
H
2
SO
4
.
Aq
AH, Kcal -209.93 -211.00 -211.59 -216.90
Calcular el calor de solucin del cido sulfrico para estas soluciones y
representar grficamente AH, contra la fraccin molar del agua en la
solucin
El calor de solucin es la variacin de entalpa relacionada con la adicin de una
cantidad determinada de soluto a una cantidad determinada de solvente a T y P
constantes. As el primer calor de solucin para el cido sulfrico que podemos
calcular es el de la ecuacin:
H
2
SO
4 (l)
+ 1Aq H
2
SO
4
.1Aq
Que usando los datos de la tabla es:
AH
s
= -200.62+193.91= -6.71 Kcal
Ya que AH
aq
=0
De igual forma, los dems calores de solucin sern:
H
2
SO
4 (l)
+ 2Aq H
2
SO
4
. 2Aq AH
s
= -203.93 + 193.91= - 10.12 kcal
H
2
SO
4 (l)
+ 4Aq H
2
SO
4
. 4Aq AH
s
= -206.83 + 193.91=-12.92 kcal
H
2
SO
4 (l)
+ 10Aq H
2
SO
4
. 10Aq AH
s
= -16.02 kcal
H
2
SO
4 (l)
+ 20Aq H
2
SO
4
. 20Aq AH
s
= -17.09 kcal
H
2
SO
4 (l)
+ 100Aq H
2
SO
4
. 100Aq AH
s
= -17.68 kcal
H
2
SO
4 (l)
+ Aq H
2
SO
4
. Aq AH
s
= -22.69 kcal
AH
reaccin
= -15.94 kcal
- 174 -
Si graficamos los calores de solucin AH
S
, contra la fraccin molar del agua X
H2O
,
obtenemos la figura:
AH
s
-6.71 -10.12 -12.92 -16.02 -17.09 -17.68
X
H2O
0.5 0.66 0.8 0.909 0.952 0.99
Hs= f(XH
2
O)
-25
-20
-15
-10
-5
0
0 0,2 0,4 0,6 0,8 1 1,2
XH
2
O
H
s
6.15 Utilizando la ecuacin (7-45) y la ley de Joule, demostrar que para un gas
ideal (cH/cP)
T
=0
La ecuacin (7-45) del texto de Castellan es:
V
P
V
V
E
P
P
H
T T T
+
|
.
|
\
|
c
c
(
|
.
|
\
|
c
c
+ =
|
.
|
\
|
c
c
Ec: 7-45
Si el gas es ideal, entonces:
2
P
nRT
P
V
T
=
|
.
|
\
|
c
c
Y la ecuacin 7-45 puede escribirse como:
V
P
nRT
V
E
P
P
H
T T
+
|
.
|
\
|
(
|
.
|
\
|
c
c
+ =
|
.
|
\
|
c
c
2
- 175 -
La ley de Joule establece que: (cE/cV)
T
=0 entonces tenemos:
0 = +
= +
|
.
|
\
|
=
|
.
|
\
|
c
c
P
nRT
P
nRT
V
P
nRT
P
H
T
6.16 A partir de la ley del gas ideal y la ecuacin (7-57) deducir las ecuaciones
(7-58) y (7-59)
La ecuacin (7-45) del texto de Castellan es:
1
2 2
1
1 1
=
V T V T
Mientras que las ecuaciones (7-58) y (7-59) son:
1
2 2
1
1 1
=
P T P T y
2 2 1 1
V P V P =
Si el gas es ideal toma la forma:
1
2
2
2
1
1
1
1
|
|
.
|
\
|
=
|
|
.
|
\
|
P
nRT
T
P
nRT
T
De donde:
( ) ( )
1
2
1
2
1
2
1
1
1
1
1
1
P
T
nR T
P
T
nR T
1
2
2
1
1
1
=
P
T
P
T
1
2 2
1
1 1
=
P T P T
Si en lugar de sustituir en la ecuacin (7-45) el volumen por su expresin para un
gas ideal, lo hacemos con la temperatura T tenemos que:
1
2
2 2
1
1
1 1
=
V
nR
V P
V
nR
V P
1
2 2 2
1
1 1 1
=
V V P V V P
De donde:
2 2 1 1
V P V P =
- 176 -
6.17 Aplicando la ecuacin (7-44) para una transformacin a volumen constante,
demostrar que:
V T
V P
T
P
P
H
V C C
|
.
|
\
|
c
c
(
|
.
|
\
|
c
c
=
Si el volumen es constante entonces dV=0, entonces tenemos:
Vdp dt C
P
H
dT C
V
T
P
+ =
|
.
|
\
|
c
c
+
V
V
V T
P
T
P
V C
T
P
P
H
C
|
.
|
\
|
c
c
+ =
|
.
|
\
|
c
c
|
.
|
\
|
c
c
+
De donde:
V T
V P
T
P
P
H
V C C
|
.
|
\
|
c
c
(
|
.
|
\
|
c
c
=
6.18 Segn los datos de la tabla 7-3 y los calores de formacin (kcal/mol) de los
compuestos gaseosos:
Compuesto SiF
4
SiCl
4
CF
4
NF
3
OF
2
HF
AH
f
-370 -145.7 -162.5 -27.2 5.5 -64.2
Calcular la energas de enlace simple: Si-F; Si-Cl; C-F; N-F; O-F, H-F
Tabla 7-3: Calores de formacin de tomos a 25 C (kcal/mol)
Compuesto AH
f
, Kcal / mol
Si 88,04
F 18,3
Cl 29,012
C 171,698
N 85,565
O 59,159
H 52,089
Vdp dV P
V
E
dt C
P
H
dT C
T
V
T
P
+
(
+
|
.
|
\
|
c
c
+ =
|
.
|
\
|
c
c
+
- 177 -
- Para el enlace Si-F, podemos utilizar la reaccin:
SiF
4
Si + 4F
Cuyo AH es usando la tabla 7-3 del texto:
AH
reaccin
= 88.04 + 4(18.3) - (-370) = 531.24 kcal
Como el SiF
4
tiene cuatro enlaces Si-F, la energa del enlace simple Si-F ser
531.24 (kcal)/4= 132.81 kcal
- De igual forma para el enlace SiCl:
SiCl
4
Si + 4Cl
AH
reaccin
= 88.04 + 4(29.012) - (-145.7) = 349.788 kcal
Y como el SiCl
4
tiene cuatro enlaces Si-Cl, la cantidad 349.788/4=87.447 kcal es
la energa del enlace simple Si-Cl
- Para el enlace C-F
CF
4
C + 4F
AH
reaccin
= 171.698 + 4(18.3) (-162.5) = 407.398 kcal
407.398 kcal /4 = 101.84 kcal (enlace C-F)
- Para el enlace N-F
NF
3
N + 3F
AH
reaccin
= 85.565 + 3(18.3) (-27.2) = 167.6665 kcal
167.6665 kcal / 3 =55.88 kcal (enlace N-F)
- Para el enlace O-F
OF
2
O + 2F
AH
reaccin
= 59.159 + 2(18.3) 5.5 = 90.259 kcal
90.259 kcal / 2 =45.129 kcal (enlace O-F)
- 178 -
- Para el enlace H-F
HF H + F
AH
reaccin
= 52.089 + 18.3 (-64.2)= 134.58 kcal (enlace H-F)
6.19 Con los datos de la tabla 7-3 y los calores de formacin (kcal/mol) a 25 C de
los compuestos gaseosos:
Compuesto CH
4
C
2
H
6
C
2
H
4
C
2
H
2
AH
f
-17.889 -20.236 12.496 54.194
Calcular la energa de enlace de:
a) el enlace simple C-C en C
2
H
6
b) en enlace doble C=C en C
2
H
4
c) el enlace triple CC en C
2
H
2
Tabla 7-3: Calores de formacin de tomos a 25 C (kcal/mol)
Compuesto AH
f
, Kcal / mol
C 171,698
H 52,089
a) El AH de la reaccin:
C
2
H
6
2C +6H
Es utilizando la tabla 7-3 y los datos del enunciado:
AH
reaccin
= 2(171.698) + 6(52.089) - (-20.236) = 676.166 kcal
Por otra parte, el AH de la reaccin:
CH
4
C +4H
Es con la tabla 7-3 y los datos del enunciado:
AH
reaccin
= 171.698 + 4(52.089) (-17.889) = 397.943 kcal
La energa 397.943 kcal es la energa que poseen los cuatro enlaces C-H del CH4;
de aqu que 397.943 / 4 =99.485 kcal es la energa de un enlace C-H. Como el
C
2
H
6
tiene seis enlaces C-H y un solo enlace C-C, si restamos a 676.166 kcal, que
es la energa de seis enlaces C-H y uno C-C, la cantidad 6(99.485) tendremos la
energa de un enlace C-C en el C
2
H
6
. Realizando las operaciones encontramos:
- 179 -
AH
C2H6
- 6AH
C-H
= 676.166 6(99.485) = 79.25 kcal (enlace C C en C
2
H
6
)
a. En la reaccin
C
2
H
4
2C +4H
AH
reaccin
= 2(171.698) + 4(52.089) 12.496 = 539.256 kcal
Como el C
2
H
4
tiene cuatro enlaces CH, si restamos a 539.256 kcal la energa
que esto representa tendremos:
539.256 4(99.485) = 141.316 kcal
Que es la energa de un enlace doble C=C en el C
2
H
4
b) De igual manera en la reaccin:
C
2
H
2
2C +2H
AH
reaccin
= 2(171.698) + 2(52.089) 54.194 = 393.38 kcal
393.38 2(99.485) = 194.41 kcal (enlace CC en C
2
H
2
)
- 180 -
TERMOQUIMICA
FISICOQUIMICA FARRINGTON DANIELS
7.1. En un calormetro adiabtico la oxidacin de 0.4362 gramos de naftalina produce un
aumento de temperatura de 1.707
0
. La capacidad calorfica del calormetro y del
agua fue de 2460 cal gra
-1
. Despreciando las correcciones de oxidacin del cable y por
el nitrgeno residual. cual cera la entalpia por mol de la combustin del naftaleno?.
DATOS
m=0.4362 gramos
M= 128gra/mol
SOLUCION.
C
10
E
8(I)
+ 120
2(u)
- 1uC0
2(u)
(0) + 4E
2
0
(L)
u.4S62 giamos
1mol
128gromos
= u.uuS41mol
246ucol
c
1kcol
1uuucol
= 2.46kcol
AE =
Cp
n
AI
AE =
2.4kcolC
u.uuS41mol
= -1231. 4kca|mu|
7.2. Las siguientes reacciones se pueden utilizar para impulsar cohete:
(1) H
2(g)
+
1
2
D
2(g)
- H
2
D
(l)
(2) CH
3
OH
(|)
+
3
2
O
2(6)
- CO
2(6)
+ 2H
2
O
(L)
(3) H
2(g)
+F
2(g)
- 2HF
(l)
AE == -1231. 4kca|mu|
- 181 -
(a) calcular los cambios de entalpia a 25
o
para cada una de las reacciones por
kilogramo de combustible ms la cantidad necesaria del agente oxidante. (Para el HF
H
o
f
=64.2kcal).
(b) puesto que el impulso es mayor cuando la fuerza molecular de los gases de salida
es menor, divisase el calor por kilogramo entre el peso molecular del producto y
ordnese las reacciones segn su efectividad basndose en el impulso inicial.
Datos.
HF H
o
f
=64.2kcal
H
2
O
(l)
H
o
f
=-68.3174kcal/mol
CO
2(g)
H
o
f
=-94.0518kcal/mol
CH
3
OH
(l)
H
o
f
=-57.02kcal
SOLUCION
(a) (1) H
2(g)
+
1
2
D
2(g)
- H
2
D
(l)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= -S7.7979 +u
AB
I
o
= -S7.7979
kcal
mol
1mol B20
18giamos B20
1uuugB20
1kgB20
= -321
hal
hg
(2) CH
3
OH
(|)
+
3
2
O
2(6)
- CO
2(6)
+ 2H
2
O
(L)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |2(-S7.7979) +(-94.uS18)] -|-S7.u2]
AB
I
o
= -266.6676
kcaI
moI
1moI CH3OH
80gCH3OH
1000gCH3OH
1kgCH3OH
= -198
hal
hg
AH
u
= -321
kca|
mu|
AH
u
= -198
kca|
mu|
- 182 -
(3) H
2(g)
+F
2(g)
- 2HF
(l)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |2(-64.2)] -u
AB
I
o
= -128.4
kcal
mol
1mol B2
S9.996gB2
1uuugB2
1kgB2
= -321
hal
hg
b) (1) AB
I
o
=
-321
hal
hg
18
hg
hmul
= -178. 3
hal
hmul
(2) AB
I
o
=
-198
hal
hg
31
hg
hmul
= -1. 54
hal
hmul
(3) AB
I
o
=
-321
hal
hg
2
hg
hmul
= -1. 5
hal
hmul
Orden de las reacciones segn su efectividad.
(1)>(2)>(3)
7.3. calcular el calcular desprendido durante la explosin de un gramo de etileno
(a) a presin constante a 25 grados con exceso de aire.
(b) con exceso de oxigeno puro a 20 atm de presin en una bomba cerrada.
Datos
H
2
O
(l)
H
o
f
=-68.3174kcal/mol
CO
2(g)
H
o
f
=-94.0518kcal/mol
C
2
H4
(l)
H
o
f
=12.496kcal
SOLUCION
C
2
H
4(g)
+ 3O
2(g)
- 2CO
2(g)
+ 2H
2
O
(L)
AH
u
= -321
kca|
mu|
- 183 -
A 100% de exceso de aire
C
2
H
4(g)
+ 3(O
2(g)
+3. 7N
2(g)
) - 2CO
2(g)
+ 2H
2
O
(g)
+11. 28N
2(g)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |2(-S7.7979) +(-94.uS18)] -(-12.496)
AB
I
o
= -S16.19S
kcal
mol
u.u4mol = -12. hal
(b) con exceso de oxigeno puro
C
2
H
4(g)
+ 4O
2(g)
- 2CO
2(g)
+ 2H
2
O
(g)
+O
2(g)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |2(-S7.7979) +(-94.uS18) +u] -(-12.496 +4xu)
AB
I
o
= -S16.19S
kcal
mol
u.u4mol = -12. hal
7.4. Calcular la entalpia de formacin del PCl5
(s)
basndose en los calores delas siguientes
reacciones.
2P
(s)
+3Cl
2(g)
- 2PCl
(l)
AH = -151. 8al Fc: 4 -1
PCl
3(l)
+Cl
2(g)
- PCl
5(l)
AH = -32. 81al E: 4 -2
SOLUCION
EC.4.1 divido para 2
P
(s)
+
3
2
Cl
2(g)
- PCl
(l)
AH = -75. 9al
PCl
3(l)
+Cl
2(g)
- PCl
5(l)
AH = -32. 81al
AH
u
= -12. kca|
AH
u
= -12. kca|
P
(s)
+
5
2
Cl
2(g)
- PCl
5(l)
AH = -18. 7al
- 184 -
7.5. Usando los valores de las entalpias de formacin que aparecen en la tabla II, calcular
las entalpias de combustin a 25 grados de las siguientes sustancias obteniendo CO
2
(G)
yH2O
(L)
: a) n-butano, b)metanol, c) acido actico.
Datos.
H
2
O
(l)
H
o
f
=-68.3174kcal/mol
CO
2(g)
H
o
f
=-94.0518kcal/mol
C
4
H
10(g)
H
o
f
=-29.812kcal/mol
CH
3
OH
(l)
H
o
f
=-57.02kcal
CH
3
COOH
(L))
H
o
f
=-116.4kcal
SOLUCION.
(a) C
4
H
1(g)
+
13
2
O
2(g)
- 4CO
2(g)
+ 5H
2
O
(g)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |(S)(-68.7174) +(4)(-94.uS18)] -(-29.812)
(h) CH
3
OH
|
+
3
2
O
2(g)
- CO
2(g)
+ 2H
2
O
(g)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivosAB
I
o
= |2(-68.S174) +(-94.uS18)] -(-S7.u2)
(c) CH
3
COOH
|
+ 2O
2(g)
- 2CO
2(g)
+ 2H
2
O
(g)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |(2)(-68.7174) +(2)(-94.uS18)] -(-116.4)
AB
I
o
= -87. 982
hal
mul
AB
I
o
= -173. 7
hal
mul
- 185 -
7.6. Para la acetona (CH3)
2
COAH
I
u
es de -61.4kcal /mol a 25
o
. (a) calcular el calor de
combustin dela (CH3)
2
CO a presin constante.(b) calcular el calor desprendido al
quemar dos gramos de (CH3)
2
CO a presin en una bomba cerrada a 25
o
.
Datos.
H
2
O
(l)
H
o
f
=-68.3174kcal/mol
CO
2(g)
H
o
f
=-94.0518kcal/mol
(CH
3
)
2
CO
(l)
H
o
f
=-61.4kcal/mol
SOLUCION.
(a) (CH
3
)
2
CO
(|)
+ 4O
2(g)
- 3CO
2(g)
+ 3H
2
O
(g)
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |(S)(-68.7174) +(S)(-94.uS18)] -(-61.4)
b) 1mol--------------------- -425.70 kcal
0.03448mol------------ X= -14.68kcal
7.7. Calcular H
298
para la siguiente reaccin:
CdSO
4(x)
+ H
2
O
(g)
- CdSO
4
. H
2
O
(x)
Sabiendo que:
CdSO
4(x)
+ 4H
2
O
(|)
- CdSO
4
. |n4H
2
O
(x)
AH = -1. 977al E: 7 -2
CdSO
4
. H
2
O
(x)
+ 399H
2
O
(|)
- CdSO
4
. |n4H
2
O AH = -. 95al E: 7 -3
H
2
O
(g)
- H
2
O
(|)
AH = -9. 717al Fc: 7 -4
AB
I
o
= -28. 98
hal
mul
AB
I
o
= -425. 7
hal
mul
- 186 -
SOLUCION.
A la Ec 7-3 la multiplicamos por (-1)
CJS0
4(s)
+ 4uuE
2
0
(I)
- CJS0
4
. in4uuE
2
0
(s)
AH = -1. 977al
CJS0
4
. in4uuE
2
0 - CJS0
4
. E
2
0
(s)
+ S99E
2
0
(I)
AH = . 95al
E
2
0
(g)
- E
2
0
(I)
AH = -9. 717 al
7.8. Usando los valores de la tabla III calcular los cambios de entalpia al diluir una
solucin de 1 mol de acido clorhdrico en 5 moles de agua con un gran exceso de agua.
SOLUCION.
ECl
(g)
+ E
2
0
(I)
- ECl cn E
2
0
(I)
AH = -17.96cal
ECl cn SE
2
0 - ECl
(g)
+ SE
2
0
(I)
AH = 15. 31 al
7.9. Calcular las entalpias de reaccin a 25
o
de las siguientes reacciones en soluciones
acuosas.
Las siguientes reacciones se pueden utilizar para impulsar cohete:
(1) HCl
(aq)
+NaBr
(aq)
- HCl
(aq)
+NaCl
(aq)
(2) Lt
(s)
+
1
2
Cl
2(g)
+aq - Lt
(aq)
+
+Cl
(aq)
-
Datos.
Li
(aq)
+
H
o
f
=-66.544kcal/mol
Cl
(aq)
-
H
o
f
=-40.0233kcal/mol
CdSO
4(x)
+ H
2
O
(g)
- CdSO
4
. H
2
O
(x)
AH = -14. 59 almul
HC| en 5H
2
O+(-1)H
2
O
(|)
- HC| en H
2
O
(|)
AH = -2. 5 almul
- 187 -
SOLUCION.
(1) HCl
(aq)
+NaBr
(aq)
- HCl
(aq)
+NaCl
(aq)
Al tratarse de un acido fuerte con una base fuerte la reaccin se disocia en sus respectivos
iones con un H=0 ya que aparentemente no se produce ninguna reaccin.
(2) Lt
(s)
+
1
2
Cl
2(g)
+aq - Lt
(aq)
+
+Cl
(aq)
-
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |(-66.S44) +(-4u.u2SS)] -(u)
7.10. El calor de la reaccin.
C
(g)
+H
-C
H
(g)
(g)
Se va a determinar (a) basndose en las energas de enlace de la tabla VI suponiendo
que el benceno C6H6tiene tres C=C, tres C-C y seis C-H. (b) a partir de los calores de
formacin del C6H6
(G)
,C
(G)
y H
(G)
de la tabla II.
Datos.
C=C = -145kcal/mol
C-C = -80.5 kcal/mol
C-H = -92.2kcal/mol
C
6
H
6(g)
H
o
f
=19.820kcal/mol
SOLUCION.
(a) basndose en las energas de enlace.
AE = S(C = C) +S(C -C) +6(C -E)
AE = S(-14S) +S(-8u.S) +6(-98.2)
AH
I
u
= -1. 577
hal
mul
AH = -125. 7
kca|
mu|
- 188 -
(b) a partir de los calores de formacin.
AB
I
o
= AB
I
o
piouuctos -AB
I
o
ieactivos
AB
I
o
= |(19.82u)] -(u)
7.11. La ecuacin de la capacidad calorfica molar del n-butano es:
Cp=4.64+0.0558T
Calcular el calor necesario para elevar la temperatura de una mol desde 25
hasta 300, a presin constante.
DATOS:
n=1 mol
T
1
=25C=298K
T
2
=300C=573K
P= cte
SOLUCIN:
= n Cp JI
1
2
1
1
= 1mol (4.64 +u.uSS8T) JI
573K
298K
= 1mol(4.64I +u.uSS8
1
2
2
)
AH
I
u
= 19. 82
hal
mul
Q = 79S8.74 cal
- 189 -
7.12. Calcular H a 1000 K para la reaccin.
CH
4 (g)
+ 2O
2 (g)
- CO
2 (g)
+2H
2
O
(g)
DATOS:
C
p Tabulados a 298.15K
C
p
CH4
=3.422 +17.84510
-3
T-41.6510
-7
T
2
C
p
O2
=2(6.0954+3.253310
-3
T-10.17110
-7
T
2
)
C
p
CO2
=6.3957+10.193310
-3
T-35.33310
-7
T
2
C
p
H2O
= 2(7.1873+2.373310
-3
T+2.08410
-7
T
2
)
SOLUCIN:
C
p =_(C
p proJuctos) -_(C
p rcoti:os)
C
p =5.1568-9.411710
-3
T+4.082710
-6
T
2
AE = n C
p JI
1
2
1
1
AE = 1mol (S.1S68 -9.4117 1u
-3
I +4.u827 1u
-6
I
2
) JI
1000K
298.15K
AE = 1mol _S.1S68I -
9.4117 1u
-3
I
2
2
+
4.u827 1u
-6
I
3
S
_
AE =
1mol [S.1S68I -
9.411710
-3
|(1000)
2
-(298.15)
2
]
2
+
4.082710
-6
|(1000)
3
-(298.15)
3
]
3
AB = -212.44kcal
- 190 -
7.13. Aproximadamente la capacidad calorfica molar de un slido es igual a la
suma de las capacidades calorficas atmicas de los elementos slidos que
forman el compuesto. Qu relacin general expresara la influencia de la
temperatura sobre el calor de la reaccin entre slidos, dando productos
slidos; como por ejemplo, la reaccin Fe
(s)
+S
(s)
FeS
(s)
?
DATOS:
C
p
Fc
s
=
4Su[
kgK
C
p
S
5
=
77u[
kgK
C
p
FcS
=
122u[
kgK
AE = E
FeS
s
-B
Fe
s
-B
S
S
j
d(AH)
d1
[
P
=j
d(H
FcS)
d1
-
d(H
Fc)
d1
-
d(H
S)
d1
[
P
Como j
d(AH)
d1
[
P
=C
p
j
d(AH)
d1
[
P
=C
p
FcS
-C
p
Fc
-C
p
S
7.14. En una bomba calorimtrica, la combustin de 1.753 gramos de sacarosa
produce un aumento de temperatura de 2.907. el cambio de entalpia para la
combustin de la sacarosa es de 1349.7 kcal/mol (a) Cul ser la capacidad
calorfica total del agua y del calormetro? (b) si el calormetro contiene 1850
gramos de agua (calor especifico igual 1.0 cal/grad g), Cul ser la
capacidad calorfica del calormetro ? en este problema no se toman en
cuenta las correcciones por la oxidacin del alambre ni el nitrgeno residual.
DATOS:
m=1.753 g C
12
H
22
O
11
j
d(AH)
dT
[
P
=
122]
kgK
-
45]
kgK
-
77]
kgK
- 191 -
T=2.907
H=1349.7 kcal/mol
SOLUCIN:
M=342 g/mol C
12
H
22
O
11
n =
m
H
n =
1.753g
342 gmoI
= S.1S mol C
12
H
22
O
11
= nAB
= S.1S mol
1S49.7kcal
mol
= 692S.96kcal
a) Cp
(H20+cuIo)
=
AT
Cp
(H20+cuIo)
=
6923.96kcuI
2.907Grad
b) Cp
(H20)
= m
H20
Cp
Cp
(H20)
= 18Su g
1.u col
g uiau
Cp
(H20)
= 18Su coluiau
Cp
(cuIomcto)
= Cp
(H20+cuIo)
-Cp
(H20)
Cp
(cuIomcto)
= 2S81.82
kcuI
Grad
- 1.8Su kcoluiau
Cp
(cuIomcto)
= 2S79.97
kcol
uiau
Cp
(H20+cuIo)
= 2S81.82
kcol
uiau
- 192 -
5.15. Cuantos gramos de azcar de caa C
12
H
22
O
11,
se deben oxidar para obtener
el mismo nmero de caloras de calor, que en el trabajo efectuado por un
hombre de 160 lb.(72.7 kg) al escalar una montaa de 1 milla (1.609km) de
alto. El calor de combustin del C
12
H
22
O
11
es de 1349.7 kcal/mol. Se a
determinado empricamente que solo se aprovecha el 25% del valor
calorfico de los alimentos para convertirlo en trabajo aprovechable por el
hombre o por los animales, y, por consiguiente, los gramos calculados de
C
12
H
22
O
11
se deben multiplicar por 4 aproximadamente para obtener la
cantidad oxidada realmente.
DATOS:
m=? g C
12
H
22
O
11
m
(hombc)
= 72.7kg
d=1.609km
J = 1.6u9km
1uuum
1km
= 16u9m
M=342 g/mol C
12
H
22
O
11
SOLUCIN:
Calculo de la fuerza del hombre
F = m. g
F = 72.7kg 9.8 ms
2
F=712.46 kg.m/s
2
Calculo del trabajo del hombre
w = F. J
w = 712.46 kg.
m
s
2
16u9m
w =1146.348J
w = 712.46 }
1 cal
4.186 }
= 27S8S2.84 cal
W = 27S.8S kcal
Cantiuau oxiuaua = 27S.8S kcol 4 = 1u9S.4 kcol
Cantiuau oxiuaua = 1u9S.4 kcol
- 193 -
m = 1u9S.4 kcol
1mol
1S49.7kcol
S42 g
1 mol
7.16. La combustin del acido oxlico en una bomba calorimtrica proporciona
673 cal/g a 25C. Calcular (a) E y (b) H para la combustin de una mol de
acido oxlico HO
2
CCO
2
H (M-90).
DATOS:
Q=673 cal/g
T=25C
M=90 g/mol
SOLUCIN:
a) E= -I
E=Q=673 cal/g
b) AE =Q. H
AE = 67S
col
g
9ug
mol
AB = 6uS7u
cal
mol
AE = 6uS7u
cuI
moI
4.186]
1cuI
1k]
1000]
0
m = 277.6g C
12
H
22
O
11
AB = 2SS.S4
k}
mol
- 194 -
7.17. El cambio de entalpia en la combustin del tolueno para formar H
2
O (l) y
CO
2
(g) es de -934.50 kcal/mol a 25. Calcular la entalpia de formacin del
tolueno.
DATOS:
AE = -9S4.Su kcalmol
T=25C
SOLUCIN:
C
7
B
8
+
S
2
0
2
-
7
2
C0
2
(g) +4B
2
0 (l)
AE = -9S4.Su
kcal
mol
4.186k}
1kcal
= -S911.817
k}
mol
AB
combustIon
=
7
2
A B
I
C0
2
+4A B
I
B
2
0- A B
I
C
7
B
8
-S911.817
k]
moI
=
7
2
(-S9S.S
k]
moI
) +4(-28S.84
k]
moI
)- A B
I
C
7
B
8
7.18. A 25, el cambio de entalpia para la combustin del bisulfuro de carbono,
CS
2
, liquido en CO
2
Y SO
2
es de -256.97 kcal/mol. Calcular la entalpia de
formacin A H
del CS
2
lquido.
DATOS:
AE = -2S6.97 kcalmol
T=25C
AE
combuston
= -2S6.97
kcal
mol
4.186k}
1kcal
= -1u7S.67
k}
mol
SOLUCIN:
CS
2
(l) +
6
2
0
2(g)
- C0
2(g)
+2S0
2(g)
AE
combuston
= -2S6.97 kcalmol
A B
I
C
7
B
8
= 1S91.21
k[
mol
- 195 -
AE
combuston
= 1A E
]
C0
2(g)
+ 2A E
]
S0
2(g)
- A E
]
CS
2
(l)
-1u7S.67
k]
moI
= 1 [-S9S.S
k]
moI
+ 2 [-296.8
k]
moI
- A E
]
CS
2
(l)
7.19. Calcular el calor desprendido a 25 durante la reaccin.
3Mg(x) +Fe
2
O
3
(x) - 3MgO(x) +2Fe(x)
La entalpia de formacin del MgO (s) es A H
,298
= -1457
ca|
mu|
SOLUCIN:
A E
],298
= -14S7uu
col
mol
4.186}
1cal
1k}
1uuu}
= -6u9.9
k}
mol
A E
298
= SA E
],298
Hg0(s) + 2A E
],298
Fc(s)- (A E
],298
Fc
2
0
3
(s)
+ SA E
],298
Hg(s))
A E
298
= S _-6u9.9
k}
mol
] - _-82S.S
k}
mol
]
A H
= -14. 2
hJ
mul
7.20. Los siguientes calores de solucin se obtienen a 18 cuando se utiliza un gran
exceso de agua.
CaCl
2(s)
+aq - CaCl
2(aq)
AH = -18. hal
CaCl
2.
H
2
D
2
+aq - CaCl
2(aq)
AH = +4. 5 hal
Calcular el calor de hidratacin del CaCl
2
hasta dar CaCl
2
.6H
2
O por a) H
2
O(l)
y b)H
2
O(v). El calor de vaporizacin del agua a esta temperatura es de 586
cal/g.
SOLUCIN:
CaCl
2(s)
+aq - CaCl
2(aq)
AB
1
= -18.u kcal
CaCl
2.
6B
2
0
2(s)
+aq - CaCl
2(aq)
AB
2
= +4.Su kcal
A E
]
CS
2
(l) =88.57
k]
moI
- 196 -
CaCl
2(s)
- CaCl
2.
6B
2
0
2(s)
+aq
a) AB
(3)
= AB
1
- AB
2
AB
(3)
= -18.u kcal -4.Su kcal= -22.5 kcal.
AB
(3)
= -22.S kcal Procesoexotrmico
b) M
H2O
=18g/mol
m = 18
g
mol
6mol = 1u8g B
2
0
AB
(v)
= m. Cp
AB
(v)
= 1u8g S86 colg = 6S288col
AB
(v)
= 6S288col
1kcuI
1000cuI
= 63.288kcal
AB
(v)
= 6S.288kcal
AB = AB
3
+AB
v
AB = -22.S kcal +6S.288kcal
7.21. Usando estos valores para el calor integral de la solucin de nitrato de cadmio
en agua, dibujar una grafica de H con respecto a la molalidad m y
determinar el calor diferencial de la solucin del nitrato de cadmio en
solucin 4 molal:
m(molalidad) 1,063 1,799 4,251 6,372 9,949
H (J/mol) -34,2 -65.7 -126,0 -174,4 -228,5
AB = 4u.79kcal
- 197 -
AE = -11u,89 k[
Figura5.21: Diagrama de entalpia en funcin de la molalidad
SOLUCIN:
Utilizando una regresin lineal
AE = -21,6u (m) -24,49
AE = -21,6u (4 molol) -24,49
7.22. Usando las entalpias de formacin del Na(DH)
(ensul)
y del NaND
3(ensul)
en
solucin a dilucin infinita (Tabla IV) y los valores de H
I,H
"
demostrar
cmo se obtuvo el valor H
I,ND
"
de la tabla (II)
DATOS:
AB
I 298 OH
-
= -S4,9S7
kcal
mol
AB
I 298 NaNO3
= -1u6,6S1
kcal
mol
AB
I 298 NaOH
= -112,2S6
kcal
mol
y = -21.608x - 24.49
R = 0.9782
-300
-250
-200
-150
-100
-50
0
0 2 4 6 8 10 12
E
n
t
a
l
p
i
a
(
J
/
m
o
l
)
e
s
c
a
l
a
:
1
c
m
=
-
5
0
(
J
/
m
o
l
9
molalidad (m)
escala: 1cm=2(m)
H=f(m)
- 198 -
AB
I 298 NO3
-
= -49,S72
kcal
mol
2BCl
(g)
= B
2(g)
+ Cl
2(g)
AB = 44,126 Kcal
SOLUCIN:
NoN0
3 uc
+0E
uc
-
- No0E
uc
+ N0
3 uc
-
AB = Xi. AB
I 298 Productos
-Xi. AB
I 298 RcactIvos
u = _-112,2S6
kcol
mol
+AE
] 298 N03
-
] -_-1u6,6S1
kcol
mol
-S4,9S7
kcol
mol
]
7.23. (a) Calcular, basndose en las entalpias de formacin y en las energas de
enlace, el calor de disociacin del HCl
(g)
en tomos. (b) Calcular los valores
de reaccin a presin constante de las siguientes reacciones
e1) C
2
H
4(g)
+ Cl
2(g)
= C
2
H
4
Cl
2(g)
e2) C
2
H
(g)
+ 2Cl
2(g)
= C
2
H
4
Cl
2(g)
+ 2HCl
(g)
DATOS:
B
I,
0
C
2
B
6(g)
= (-2u,2S6)
Kcal
mol
B
I,HCI
(g)
0
= -22,u6S
Kcal
mol
SOLUCIN:
ec2. a) C
2
B
4(g)
+ B
2(g)
+ 2Cl
2(g)
= C
2
B
4
Cl
2(g)
+ 2BCl
(g)
Ec (1)+ (ec (2.a)*(-1))
C
2
B
4(g)
+ Cl
2(g)
= C
2
B
4
Cl
2(g)
AB = -S7,S68 Kcal
C
2
B
4
Cl
2(g)
+ 2BCl
(g)
= C
2
B
4(g)
+B
2(g)
+ 2Cl
2(g)
AB = 81,694 Kcal
- 199 -
b)AB = Xi. AB
I 298 Productos
-Xi. AB
I 298 RcactIvos
b. 1)AB = [B
I,C
2
H
4
CI
2(g)
0
-(B
I,C
2
H
4(g)
0
+B
I,
0
Cl
2(g)
)
AB = (-2S,u72) -(12,496) = -S7,S68
Kcal
mol
AB = -S7,S68
KcaI
moI
b. 2)AB = [2B
I,HCI
(g)
0
+B
I,C
2
H
4
CI
2
(g)
0
- (2B
I,
0
Cl
2(g)
+B
I,
0
C
2
B
6(g)
)
AB = ((2 - -22,u6S ) +(-2S,u72)) -((u) +(-2u,2S6))
Kcal
mol
AB = -48,962
KcaI
moI
7.24. Una mol de metano (considrese como gas ideal), inicialmente a 25C y una
atm de presin, se calienta a presin constante hasta duplicar su volumen. La
variacin de la capacidad calorfica molar con la temperatura absoluta esta
dad por Cp = 5. 34 +11. 5x1
-3
T .Calcular (a) H y (b) E
DATOS:
T= 25:C
P= 1atm
V
2
= 2V
1
Cp = S.S4 +11.S x 1u
-3
I
SOLUCIN:
Diagrama 5.24: Presin en funcin del volumen
- 200 -
AB = S,62 kcal
AE = S,uS kcal
P1v1 = nRT1
v1 =
1mol - u.u82uS
atm. l
K. mol
- 298K
1 atm
= 24,4S l
v2 = 2v1 = 48,9u l
T2 =
P2. v2
nR
=
1atm- 48,9u l
1mol - u.u82uS
atm. l
K. mol
= S9S,97K
(a)AB = n Cp uT
T2
T1
AB = n (S.S4 +11.S x 1u
-3
T) uT
T2
T1
AB = n _S,S4(T2 -T1) +
11,Sx1u
-3
(T2
2
-T1
2
)
2
_
AB = 1mol [S,S4(S9S,97 -298) +
11,5x10
-3
(595,97
2
-298
2
)
2
= S,62 kcal
(b)AE = Q -L
L = Puv
L = 1atm(48,9u -24,4S)l = 24,4S atm. l -
1u1,S }
1 atm. l
-
1 cal
4,18 }
-
1 kcal
1uuu cal
= u,S9 Kcal
AE = Q -L = S,62 Kcal -u,S9 kcal = S,uS kcal
7.25. Calcular el calor molar de combustin del monxido de carbono a presin
constante y a 1327
DATOS:
P= 1atm
T=1327:C
- 201 -
AB = -26869,u2
cal
mol
B
I,CO
"
= -2641S,7
cal
mol
SOLUCIN:
C0
(g)
+
1
2
0
2(g)
- C0
2(g)
AB = B
I,CO
"
+ ACp uT
T2
T1
ACp = iCp(PR0BC) - iCp(REACT)
Cp
CO
2(g)
= 6,S9S7 +1u,19SSx1u
-3
T -SS,SSSx1u
-7
T
2
Cp
O
2(g)
=
1
2
(6,u9S4 + S,2SSSx1u
-3
T -1u,171x1u
-7
T
2
)
Cp
CO
(g)
= (6,S424 +1,8S6Sx1u
-3
T -2,8u1x1u
-7
T
2
)
ACp = -2,9944 +6,7Su4x1u
-3
T -27,177x1u
-7
T
2
AB = -2641S,7
cal
mol
+ (-2,9944 + 6,7Su4x1u
-3
T - 27,177x1u
-7
T
2
) uT
1327K
298K
cal
Kmol
AB = -46,41S7 + (-2,994(T2 - T1) +
6,7Su4x1u
-3
2
(T2
2
- T1
2
) -
27,177x1u
-7
S
(T2
3
-T1
3
)
AB = -2641S,7 -4SS,S2 = -26869,u2
caI
moI
7.26. Conocindose la entalpia de formacin del H
2
O
2(g)
a 298 como -31.8 kcal y
la entalpia de formacin del OH
(g)
a 298 como 8 kcal, calcular H para la
reaccin:
H
2
D
2(g)
- 2DH
(g)
DATOS:
T=298C
- 202 -
AB = 47,8 kcal
AE = SuS
cal
mol
B
I,H2O2
"
= -S1,8 Kcal
B
I,OH
"
= 8 kcal
SOLUCIN:
AB = Xi. AB
I 298 productos
-Xi. AB
I 298 rcactIvos
AB = 2mol [8,u
kcaI
moI
-1mol [-S1,8
kcaI
moI
= 47,8 kcal
7.27. (a) Calcular el cambio en la energa interna del oxgeno cuando se calienta de
0 a 100a volumen constante. (b) Calcular el cambio de entalpia en este
proceso.
DATOS:
T
1
= 0C
T
2
=100C
Cp
O
2(g)
= (6,u9S4 +S,2SSSx1u
-3
T -1u,171x1u
-7
T
2
)
SOLUCIN:
AE = nCvAT
a)AE = S,uS
cal
K. mol
(S7S -27S)K = SuS
cal
mol
b)AB = (6,u9S4 +S,2SSSx1u
-3
T - 1u,171x1u
-7
T
2
) uT
373K
273K
AB = 6,u9S4(T2 -T1) +
S,2SSSx1u
-3
2
(T2
2
-T1
2
) -
1u,171x1u
-7
S
(T2
3
-T1
3
)
- 203 -
ABc = -6124,S
Kcal
mol
ABc = -11S1,27
Kcal
mol
AB = 7uS,92 calmol
7.28. Calcular la entalpia de combustin del n-nonano,C
9
H
2
basndose en los
datos de la tabla I sobre el n-heptano, el n-hexano y el n-octano.
DATOS:
B
c,C9H20(I)
0
= -6124,S
Kcal
mol
a) C
9
B
20(I)
+ 140
2(g)
= 9C0
2(g)
+ 1u B
2
0
(I)
b) C
7
B
16(I)
+ 110
2(g)
= 7C0
2(g)
+ 8B
2
0
(I)
SOLUCIN:
ABc = Xi. AB
I 298 Productos
-Xi. AB
I 298 RcactIvos
a)ABc = (1u B
c,H2O(I)
0
+9B
c,CO2(g)
0
) - (14B
c,O2(g)
0
+B
c,C9H20(I)
0
)
ABc = (1u (u) + 9(u)) -(14(o) +(-6124,S))
Kcal
mol
b)ABc = (8 B
c,H2O(I)
0
+7B
c,CO2(g)
0
) -(11B
c,O2(g)
0
+B
c,C7H16(I)
0
)
ABc = (8 (u) + 7(u)) -(11(u) +(-11S1,27))
Kcal
mol
7.29. Calcular la cantidad de calor requerido para elevar la temperatura de una
mol de oxigeno de 300 a 1000K a presin constante.
DATOS:
n= 1mol de O
2
- 204 -
T1= 300:C
T2 = 1000:C
Cp
O
2(g)
= (6,u9S4 +S,2SSSx1u
-3
T -1u,171x1u
-7
T
2
)
SOLUCIN:
AE = n CpJI
12
11
AE = n (6,u9S4 +S,2SSSx1u
-3
I -1u,171x1u
-7
I
2
) JI
12=1000K
11=300K
AE = n _(6,u9S4(I2 -I1) +
S,2SSSx1u
-3
(I2
2
- I1
2
)
2
-
1u,171x1u
-7
(I2
3
- I1
3
)
S
_
AE = S417,1S col = S,417 kcol.
AE = S,417 kcol.
7.30. Calcular la entalpia de formacin para una mol de Hl
(g)
segn los valores
siguientes
(a) H
2(g)
+ Cl
2(g)
= 2HCl
(g)
AH = -42. 12 Kal
(b) HCl
(g)
+ agua = HCl
(ensul)
AH = -17. 9 Kal
(c) HI
(g)
+ agua = Hl
(ensul)
AH = -19. 21 Kal
(d) KDH
(ensul)
+ HCl
(ensul)
= KCl
(ensul)
AH = -13. 74 Kal
(e) KDH
(ensul)
+ Hl
(ensul)
= Kl
(ensul)
AH = -13. 7 Kal
(f) Cl
2(g)
+ 2Kl
(ensul)
= 2KCl
(ensul)
+ I
2(g)
AH = -52. 42Kal
SOLUCIN:
Aplicamos la ley de Hess para la solucin de este problema:
Ec (b)+ (ec(c)*(-1))
BCl
(g)
+ agua = BCl
(cn soI)
AB = -17.96 Kcal
- 205 -
1
2
I
2(s)
+
1
2
B
2(g)
= BI
(g)
AB = S,SSKcal
Bl
(cn soI)
= BI
(g)
+ agua AB = 19.21 Kcal
e1) BI
(cn soI)
+ BCl
(g)
= BCl
(cn soI)
+ BI
(g)
AB = 1,2S Kcal
Ec (d)+ (ec (e)*(-1))
K0B
(cn soI)
+ BCl
(cn soI)
= KCl
(cn soI)
AB = -1S.74 Kcal
Kl
(cn soI)
= K0B
(cn soI)
+ Bl
(cn soI)
AB = 1S.67 Kcal
e2) KI
(cn soI)
+ BCl
(cn soI)
= KCl
(cn soI)
+ Bl
(cn soI)
AB = u,u7 Kcal
Ec (1)+ec (2)
BI
(cn soI)
+ BCl
(g)
= BCl
(cn soI)
+ BI
(g)
AB = 1,2S Kcal
KI
(cn soI)
+ BCl
(cn soI)
= KCl
(cn soI)
+ Bl
(cn soI)
AB = u,u7 Kcal
e3) BCl
(g)
+ Kl
(cnsoI)
= KCl
(cnsoI)
+ BI
(g)
AB = 1,18 Kcal
Ec (a)*(1/2)+ (ec(f)*(-1/2))
1
2
B
2(g)
+
1
2
Cl
(g)
= KCl
(g)
AB = -22,u6Kcal
1
2
I
2(s)
+ KCl
(cnsoI)
= KI
(cnsoI)
+
1
2
Cl
2(g)
AB = 26,21 Kcal
e4)
1
2
B
(g)
+
1
2
I
( s)
+KCl
(cn soI)
= BCl
(g)
+ Kl
(cn soI)
AB = 4,1S Kcal
Ec (3)+ec (4)
BCl
(g)
+ Kl
(cnsoI)
= KCl
(cnsoI)
+ BI
(g)
AB = 1,18 Kcal
1
2
B
(g)
+
1
2
I
( s)
+KCl
(cn soI)
= BCl
(g)
+ Kl
(cn soI)
AB = 4,1S Kcal
- 206 -
7.31. Utilizando las entalpias de formacin de la tabla 2.3 calcular los calores de
combustin, a presin constante, a 25C de (a) CO, (b) H
2
, (c) C
2
H
y (d)
C
2
H
5
OH.
DATOS:
Entalpias de formacin tomadas de la Tabla II. (Ver en anexos)
SOLUCION:
(a) CO
C0
(g)
+
1
2
0
2(g)
- C0
2(g)
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = 1mol [-94,uS18
kcuI
moI
-|1mol [-26,41S7
kcuI
moI
]
(b) H
2
E
2(g)
+
1
2
0
2(g)
- E
2
0
(g)
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = 1mol _-S7,7979
kcol
mol
]
(c) C
2
H
C
2
E
6(g)
+
7
2
0
2(g)
- 2C0
2(g)
+SE
2
0
(g)
AH = -7, kca|.
AH = -57, 8kca|
- 207 -
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = |2mol _-94,uS18
kcol
mol
] +Smol _-S7,7979
kcol
mol
]]
-|1mol _-2u,2S6
kcol
mol
]]
AH = -341, 213kca|
(d) C
2
H
5
OH.
C
2
E
5
0E
(I)
+S0
2(g)
- 2C0
2(g)
+SE
2
0
(g)
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = |2mol _-94,uS18
kcol
mol
] +Smol _-S7,7979
kcol
mol
]]
-|1mol _-66,SS6
kcol
mol
]]
7.32. El calor integral de solucin de una mol H
2
SO
4
en n moles de agua, en
caloras, se obtiene segn la ecuacin
AH
=
-187n
n +1. 798
Calcular AH
para las siguientes reacciones: (a) solucin de 1 mol de H
2
SO
4
en 5 moles de agua; (b) solucin de una mol de H
2
SO
4
en 10 moles de agua;
(c) solucin de una mol de H
2
SO
4
en un gran exceso de agua, 100000 moles
por ejemplo; (d) adicin de un gran exceso de agua a la solucin en 10 moles
AH-295, 1kca|
- 208 -
de agua; (e) adicin de 5 moles mas de agua a la solucin que contiene 5
moles de agua.
DATOS:
AE
=
-18u7un
n +1.798
SOLUCION:
(a) Solucin de 1 mol de H
2
SO
4
en 5 moles de agua
E
2
S0
4(I)
+SE
2
0
(I)
- E
2
S0
4(I)
cnSE
2
0
(I)
AE
=
-18u7un
n +1.798
AE
=
-18u7u(S)
S +1.798
(b) Solucin de una mol de H
2
SO
4
en 10 moles de agua
E
2
S0
4(I)
+1uE
2
0
(I)
- E
2
S0
4(I)
cn1uE
2
0
(I)
AE
=
-18u7un
n +1.798
AE
=
-18u7u(1u)
1u +1.798
(c) Solucin de una mol de H
2
SO
4
en un gran exceso de agua, 100000 moles por
ejemplo
E
2
S0
4(I)
+1uuuuuE
2
0
(I)
- E
2
S0
4(I)
cn1uuuuuE
2
0
(I)
AE
=
-18u7un
n +1.798
AE
= -1S291kcol
mol
AE
= -1SS16kcol
mol
mol
- 209 -
AE
=
-18u7u(1uuuuu)
1uuuuu +1.798
(d) Adicin de un gran exceso de agua a la solucin en 10 moles de agua
1uE
2
0
(I)
+E
2
0
(I)
- E
2
0
(I)
cnE
2
0
(I)
AE
=
-18u7un
n +1.798
AE
=
-18u7u()
+1.798
(e) 5 moles de agua a la solucin que contiene 5 moles de agua
SE
2
0
(I)
+SE
2
0
(I)
- SE
2
0
(I)
cnSE
2
0
(I)
AE
=
-18u7un
n +1.798
AE
=
-18u7u(1u)
1u +1.798
7.33. Utilizando los valores de la tabla III, calcular el cambio de entalpia cuando se
diluye una solucin de 1 mol de NaOH en 5 moles de agua mediante la
adicin de 195 moles ms de agua.
DATOS:
Calores integrales de solucin acuosa tomados de la Tabla III (Ver en Anexos)
SOLUCION:
Na0B
(s)
+2uuE
2
0
(I)
- Na0B
(s)
cn2uuE
2
0
(I)
AE = -1u.11kcol
Na0B
(s)
cnSE
2
0
(I)
- Na0B
(s)
+SE
2
0
(I)
AE = 9.uSkcol
AE
= -18.u7 - 1u
3
kcolmol
molmol
AE
= -S4,9S7kcolmol
molmol
AE
= -1SS16kcolmol
molmol
- 210 -
7.34. Calcular las entalpias de reaccin a 25C, en soluciones acuosas diluidas, de
las siguientes reacciones:
DATOS:
Entalpias de reaccin tomados de la Tabla I (Ver en Anexos)
SOLUCION:
(1) AgNO
3
(en xu|) +KC|(en xu|) = AgC|(x) +KNO
3
(en xu|)
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = |1mol _-Su.S62
kcol
mol
]] -|1mol _-1u4.17S
kcol
mol
]]
(2)Zn(x) +2HC|(en xu|) = ZnC|
2
(en xu|) +H
2
(g)
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = -|2mol _-22.u6S
kcol
mol
]]
7.35. Calcular la cantidad de calor necesario para elevar la temperatura de una
mol de CO
2
desde 0C hasta 300C (a) a presin constante y (b) a volumen
constante.
Cp
en caloras por gramo mol se obtiene mediante.
Cp
= . 4 +1. 2x1
-3
T -35x1
-7
T
2
molmol
Na0B
(s)
cn SE
2
0
(I)
+19SE
2
0
(I)
- Na0B
(s)
cn2uuE
2
0
(I)
AE = -1.u8kcol
AH = 7S.81Skca|
molmol
AH = 44kca|
molmol
- 211 -
DATOS:
Entalpias de formacin tomados de la Tabla I (Ver en Anexos)
Capacidades calorficas a presin constante tomados de la Tabla VI (Ver en
anexos)
SOLUCION:
(a) A presin constante
AE = n Cp oI
12
11
AE = n (6.4u +1u.2x1u
-3
I - SSx1u
-7
I
2
) oI
12=573.15K
11=273.15K
AE = n _(6.4u(I2 -I1) +
1u.2x1u
-3
(I2
2
-I1
2
)
2
-
SSx1u
-7
(I2
3
-I1
3
)
S
_
AE = 1 _(6.4u(S7S.1S -27S.1S) +
1u.2x1u
-3
(S7S.1S
2
-27S.1S
2
)
2
-
SSx1u
-7
(S7S.1S
3
-27S.1S
3
)
S
_
(b) A volumen constante
Cp -C: = R
Cp -R = C:
C: = 6.4u +1u.2x1u
-3
I -SSx1u
-7
I
2
- 1.987colgroJ
-1
mol
-1
C: = 4.41S +1u.2x1u
-3
I -SSx1u
-7
I
2
- 1.987
Au = nC:JI
AE = n _(4.41S(I2 -I1) +
1u.2x1u
-3
(I2
2
-I1
2
)
2
-
SSx1u
-7
(I2
3
-I1
3
)
S
_
AH = 319 ca|mu|
-1
molmol
- 212 -
Au = 1 _(4.41S(S7S.1S -27S.1S) +
1u.2x1u
-3
(S7S.1S
2
-27S.1S
2
)
2
-
SSx1u
-7
(S7S.1S
3
-27S.1S
3
)
S
_
7.36. Calcular el calor desprendido durante la reaccin H
2
(g) + C|
2
(g) =
2HC|(g) a 1023C y a presin constante.
DATOS:
Entalpias de formacin tomados de la Tabla I (Ver en Anexos)
Capacidades calorficas a presin constante tomados de la Tabla VI (Ver en
anexos)
SOLUCION:
H
2
(g) +C|
2
(g) = 2HC|(g)
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = 2mol _-22.u6S
kcol
mol
] -|u]
AE = -44,126kcol.
ACp = _iC
P poductos
- _iC
P cuctos
Cp
HCl
= 2 (6.7319 + 0.4325*10
-3
T +3.697*10
-7
T
2
)
Cp
Cl2
= - (7.5755 + 2.4244*10
-3
T 9.650 *10
-7
T
2
)
Cp
H2
= -(6.9469 - 0.1999*10
-3
T + 4.808*10
-7
T
2
)
Cp
H2
= - 1.0586 - 1.3595*10
-3
T +12.236*10
-7
T
2
)
AU = 2422. 8 ca|mu|
-1
molmol
- 213 -
AE
1296.15
= AE
1o
+ ACpJI
1
1o
AE
1296.15
= -44126 col
+ (- 1.uS86 - 1.SS9Sx1u
-3
I +12.2S6x1u
-7
I
2
1296.15
298.15
)JI
AE
1296.15
= -44126
+_(- 1.uS86(I2 -I1) +
- 1.SS9Sx1u
-3
(I2
2
-I1
2
)
2
+
12.2S6x1u
-7
(I2
3
-I1
3
)
S
_
AE
1296.15
= -44126
+_(- 1.uS86(1296.1S -298.1S)
-
1.SS9Sx1u
-3
(1296.1S
2
-298.1S
2
)
2
+
12.2S6x1u
-7
(1296.1S
3
-298.1S
3
)
S
_
7.37. Utilizando los datos de este captulo y el Cp
del grafito
Cp
= 2. 73 +. 217T -1. 19x1
5
T
-2
Calcular AH
para la siguiente reaccin a 600 K.
H
2
O(g) +C(x) = CO(g) +H
2
(g)
DATOS:
Entalpias de formacin tomados de la Tabla I (Ver en Anexos)
AE = -4S.S9kcolmol
-1
molmol
- 214 -
Capacidades calorficas a presin constante tomados de la Tabla VI (Ver en
anexos)
SOLUCION:
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = 1mol _-26.41S7
kcol
mol
] -1mol _-S7.7979
kcol
mol
]
AE = S1,S822kcol.
ACp = _iC
P poductos
- _iC
P cuctos
AE
600
= AE
1o
+ ACpJI
1
1o
AE
600
= S1S82.2col + (S.429 + 6.6197x1u
-3
I +4.u91x1u
-7
I
2
600
298.15
- 1.1691x1u
5
I
-2
)JI
AE
600
= S1S82.2
+ _(S.429(I2 -I1) +
6.6197x1u
-3
(I2
2
-I1
2
)
2
+
4.u91x1u
-7
(I2
3
-I1
3
)
S
+1.169x1u
5
(
1
I2
-
1
I1
)_
AE
600
= S1S82.2
+ _(S.429(6uu -298.1S) -
6.6197x1u
-3
(6uu
2
-298.1S
2
)
2
+
4.u91x1u
-7
(6uu
3
- 298.1S
3
)
S
+ 1.169x1u
5
(
1
Suu
-
1
298.1S
)_
Cp
C
= -(2.67S +u.uu2617I -1.169x1u
5
I
-2
)
Cp
CO
= (6.3424 +1.8363*10
-3
T - 2.801*10
-7
T
2
)
Cp
H2
= (6.9469 - 0.1999*10
-3
T + 4.808*10
-7
T
2
)
Cp
H2O
= - (7.1873 + 2.3733*10
-3
T + 2.084 *10
-7
T
2
)
Cp = 3.429+ 6.6197*10
-3
T +4.091*10
-7
T
2
-1.169*10
5
T-
2
- 215 -
7.38. Calcular la temperatura terica de la flama durante la combustin del etano
con una cantidad estequiometria de oxgeno. El calor desprendido en la
reaccin, se utiliza para calentar productos, a la temperatura de la flama,
suponiendo que la reaccin es completa y no se pierde calor por radiacin. La
temperatura de la flama obtenida experimentalmente ser menor que este
valor terico porque va temperaturas tan elevadas, la reaccin es incompleta,
efectundose una disociacin de los productos en tomos y radicales libres,
con la absorcin del calor subsiguiente.
C
2
H
(g)
+
7
2
O
2(g)
= 2CO
2(g)
+3H
2
O
(g)
DATOS:
Entalpias de formacin tomados de la Tabla I (Ver en Anexos)
Capacidades calorficas a presin constante tomados de la Tabla VI (Ver en anexos)
SOLUCION:
I
]
= 298 +
-AE
298 cuccon
Cp
poductos
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AE = _2mol _-94.uS18
kcol
mol
] +2mol _-S7.7979
kcol
mol
]_ -1mol _-2u.2S6
kcol
mol
]
AE = -28S.4kcol
Cp
poductos
Cp
C02
= 2(6.S9S7 + 1u.19SSx1u
-3
I -SS.SSSx1u
-7
I
2
) =
18.24colgroJ
-1
mol
-1
Cp
H20
= S(7.187S +2.S7SSx1u
-3
I +2.u84x1u
-7
I
2
) = 23.74colgroJ
-1
mol
-1
Cp
poductos
= Cp
C02
+Cp
H20
= 41.98colgroJ
-1
mol
-1
AE
600
= S1.S4kcol
molmol
- 216 -
I
]
= 298 +
-(-28S.4)
41.98
7.39. Calcular el cambio de entalpia para la disociacin del N
2
(g) a 25C
utilizando los valores de la tabla II Explicar por que es diferente este
resultado del indicado en la tabla V
N
2(g)
- N
(g)
+ N
(g)
DATOS:
De la Tabla II. Entalpia de formacin a 25C
AE
]
= (8S.S6S)kcolmol
-1
De la Tabla V.AH de |a d|xuc|ac|un de en|acex (energ|ax de en|acex)
AE
N-N
= S7kcolmol
-1
SOLUCION:
A menudo, se encuentran discrepancias muy notables entre los valores de la
Entalpia de formacin a 25C y H de la disociacin de enlaces, esto es debido a
variaciones de configuracin, geomtrica y electrnica
7.40. Calcular el cambio de entalpia a 25C para la reaccin, en solucin acuosa
diluida, entre el AgNO
3
y el NaCl.
DATOS:
Entalpias de formacin tomados de la Tabla I (Ver en Anexos)
SOLUCION:
AgNO
3
(en xu|) +NaC|(en xu|) = AgC|(x) +NaNO
3
(en xu|)
I
]
= Su4.8K
molmol
- 217 -
AE = i. AE
] 298 poductos
-i. AE
] 298 cuctos
AH = _1mol _-Su.S62
kcol
mol
]_ -1mol _-98.2S2
kcol
mol
]
AH = 7. 87kca|
molmol
- 218 -
SEGUNDA LEY DE LA TERMODINMICA
FISICOQUIMICA FARRINGTON DANIELS
8. 1. Calcular los cambios de entropa para los siguientes procesos: a) fusin de una
mol de aluminio en su punto de fusin, 660 (H
fus=
191Kcal g mol
-1
); b)
evaporacin de 2 moles de oxgeno lquido en su punto de ebullicin,-182,92
(H
evap
=1,630
Kcal g mol
-1
); c) calentamiento de 10 gramos de sulfuro de hidrgeno de 50 a
100.(Cp=7,15+0,00332T)
a) AS = n
AH
1
AS =
191
9SS
- 1uuu
b) 202(l) = 202(g)
AS = n
AE
I
AS = 2 -
1,6Su
9u,uS
- 1uuu
c) E2S = E2S
AS =
AE
I
= nCp
JI
I
AS =
1u
S4
- (
7,1S
I
+ u,uuSS2)JI
373
323
AS =
1u
S4
- _7,1S - ln _
S7S
S2S
] +u,uuSS2(S7S -S2S)_
AS = 2u4,74
col
K
AS = S2,2
col
K
AS = u,SS1
col
K
- 219 -
8.2. Se condensa una mol de vapor estando a 100, el agua se enfra a 0 y se
convierte en hielo. Cul es el cambio de entropa del agua? Considerar que
el promedio del calor especifico del agua es de 1.0 cal grad
-1
g
-1
. El calor de
vaporizacin en su punto de ebullicin y el calor de fusin en su punto de
congelacin son de 539,7 y de 79.7cal g
-1
respectivamente
Se puede representar el proceso en las siguientes etapas:
E
2
0
()
(1uuC) - E
2
0
(I)
(1uuC) - E
2
0
(I)
(uC) - E
2
0
(s)
(uC)
Cp =
1col
gC
-
18g -E
2
0
1mol
-
4.186[
1mol
=
7S.SS[
molK
a) Entropa del cambio de estado mediante la variacin de temperatura:
AS1 = nCpln
I2
I1
AS1 = 1mol -
7S.SS[
molK
ln
27S
S7S
AS1 = -2S.S1
[
mol K
-
1col
4.186[
b) Entropa de vaporizacin:
AS
=
b
AS
=
-SS9.7 colg
S7SK
= -1.44
col
gK
-
18g
1mol
AS = -S.61
col
mol K
AS = -2S.92
col
mol K
- 220 -
c) Entropa de fusin del agua:
AS
]
=
b
]
I
]
AS
]
=
-79.7colg
27SK
= -u.291
col
gK
-
18g
1mol
= -S.24
col
mol K
AS = AS1 + AS
+AS
]
AS = (-S.61 -2S.92 -S.24)
col
molK
8.3. Calcular el cambio de entropa si 350 gramos de agua a 5 se mezclan con
500 gramos de agua a 70 , suponiendo que el calor especfico es de 1.00 cal/
g.grad
Datos:
m1 = 350 g
T1 = 5 C = 278,15 K
m2 = 500 g
T2 = 70 C = 343,15 K
C = 1 cal/ g.grad
S = ?
Fig.3-1 Diagrama del problema
gunudo
=
pcddo
m
1
- C - (I
cq
-I
1
) = m
2
- C - (I
2
-I
cq
)
(SSug) _
1col
] (I
cq
-S) = (Suug) _
1col
] (7u-I
cq
)
SSuI
cq
-17Su = SSuuu -SuuI
cq
AS = -S6.77
col
mol K
- 221 -
I
cq
= 4S,24 = S16,S9 K
AS = m
1
- C - ln _
T
cq
T
1
] +m
2
- C - ln_
T
cq
T
2
]
AS = (SSug) _
1col
g
] ln(
S16,S9K
278,1SK
) +(Suug)(
1col
g
) ln(
S16,S9K
S4S,1SK
)
8.4. Calcular el cambio de entropa de la cntupla expansin de una mol de gas
ideal
Datos:
n = 1 mol
V1 = V
V2 = 100V
T = cte
S = ?
AS = R - ln (
v2
v1
)
AS =
1,987col
mol K
ln (
1uuI
1I)
8.5. En la expansin isotrmica reversible de un gas ideal a 300 K de 1 a 10 litros,
cuando tiene una presin inicial de 20 atm, calcular (a) cambio de entropa
para el gas y (b) cambio de entropa para todos los procesos involucrados en
la expansin
Datos:
Expansin reversible
V1 = 1 L
V2 = 10 L
AS = 9,1S colK
AS = 4,49 colK
Fig.4-1 Diagrama P-V
- 222 -
P1 = 20 atm
T = cte = 300 K
(a) S= ? para el gas
(b) S= ? para todos los procesos
(a)
P1 - I1 = P2I2
P2 = (P1 - I1)I2
P2 = ((2uotm)(1I))1uI
PI = nRI
n =
PI
RI
n =
(20utm)(1L)
[0,082utm-
L
mcl-K
(300K)
n = u,81 mol
AS = n - R - ln(
I2
I1
)
Para una mol
AS = (1mol) _
1,987col
mol - K
] - ln(
1uI
1I
)
Para 0,81 mol
AS = (u,81mol) _
1,987col
mol - K
] - ln(
1uI
1I
)
(b)
AS = n - R - ln _
I
2
I
1
] -n - R - ln _
P
2
P
1
]
AS = (u,81mol) _
1,987col
mol - K
] - ln _
1uI
1I
] -(u,81mol) _
1,987col
mol - K
] - ln(
2otm
2uotm
)
AS = S,71colK
AS = u colK
Fig. 5-1 Diagrama P-V
AS = 4,S7colK
- 223 -
8.6. Se conserva un termostato a una temperatura de 96,9 . La temperatura del
aire en el cuarto es de 26,9 . Durante cierto tiempo, 1000 cal de calor se
transmitieron a travs del aislamiento del termostato al cuarto. (a) Cul es el
cambio de entropa del material del termostato? (b) cul es el cambio de
entropa del aire en el cuarto? Es el proceso reversible?
Datos:
T
termostato
= 96,9 = 370,05 K
T
aire en el cuarto
= 26,9 = 300,05 K
Q
termostato
= - 1000 cal
Q
cuarto
= 1000 cal
(a) S
termostato
= ?
(b) S
aire
= ?
(a)
AS =
tcmostuto
I
tcmostuto
AS = -1uuucolS7u,uSK
(b)
AS =
cuuto
I
uc cn cI cuuto
AS = 1uuucolSuu,uSK
Para determinar si el proceso es reversible se debe calcular el cambio de entropa
total:
AS
1otuI
= AS
cuuto
+AS
tcmostuto
AS
1otuI
=
S,SScol
K
-
2,7ucol
K
Como se trata de una entropa positiva, se confirma que se trata de un proceso
irreversible
AS = -2,7ucolK
AS = S,SScolK
AS
1otuI
= u,6S colK
Fig. 6-1 Diagrama Del Equipo
- 224 -
8.7. Calcular el cambio de entropa para la formacin de una cantidad de aire
conteniendo 1 mol de gas, mezclando nitrgeno y oxgeno. El aire puede
tomarse como constituido del 80% de nitrgeno y 20% de oxgeno por
volumen
Datos:
n
aire
= 1 mol
80% N2
20 % O2
S = ?
Fig. 7-1 Diagrama del Problema
Tabla 7-1 Datos Obtenidos
GAS V,L n X
N
2
0,8 0,8 0,8
O
2
0,2 0,2 0,2
AS = n
N2
- R - ln _
I
1
I
N2
] +n
02
- R - ln_
I
1
I
02
]
AS = (u,2mol) _
1,987col
mol - K
] - ln_
1I
u,2I
] +(u,8mol) _
1,987col
mol - K
] - ln_
1I
u,8I
]
AS =
u,99Scol
K
- 225 -
8.8. Tericamente, A qu altura puede levantar un galn de gasolina a un
automvil que pesa 2800 libras contra la fuerza de gravedad, si se supone que
la temperatura del cilindro es de 2200 K y la temperatura que se desperdicia
es de 1200 K (Densidad de la gasolina = 0,80 g/cm
3
; 1 lb = 0,2642 gal. Calor
de combustin de la gasolina = 11200 cal/ g)
Datos:
h = ?
V = 1 gal
m
c
= 2800 lb
TH = 2200 K
g= 9,8 m/s
2
TL = 1200 K
gasolina
= 0,8 g/cm
3
PC
gasolina
= 11200 cal /Gb Fig. 8-1 Diagrama del Problema
1 lb = 453,6 g
1 pie = 30,8 cm
1 L = 0,2642 gal
28uulb -
4SS,6g
1lb
-
1Kg
1uuug
= 127u,u8Kg
u,8g
cm
3
-
(1uucm)
3
1I
-
1uuuI
1m
3
-
1Kg
1uuug
= 8uu
Kg
m
3
1gol -
1I
u,2642gol
-
m
3
1uuuI
= S,79x1u
-3
m
3
m = p - I
m = _8uu
Kg
m
3
] (S,79x1u
-3
m
3
)
m = S,uS2 Kg
- 226 -
112uucol
g
-
4,184[
1col
-
1uuug
1Kg
=
4686u8uu[
Kg
E = m- PC
E = (S,uS2Kg)(
4686u8uu[
Kg
)
E = 142u8194S,6[ = 142,u8x1u
6
[
=
IE -II
IE
=
22uuK -12uuK
22uuK
= u,4S4S
=
I
mux
E
I
mux
= - E
I
mux
= (u,4S4S)(142,u8x1u
6
)
I
mux
= 64S81818,18 [
F = m- g
F = (127uKg) _
9,8m
s
2
]
F = 12446,78N
I = F - b
b =
I
F
b =
64S81818,18[
12446,78N
b = S188,64m
S188,64m-
1uucm
1m
-
1pic
Su,48cm
= 17u2S,u9pics
b = 17u2S,u9pics
- 227 -
8.9. Empleando las entropas atmica y molecular de la tabla II, calcular S para
las siguientes reacciones a 25:
a) E2(g) +
1
2
02(g) = E20
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |16.716] - |S1,211 -(u,S - 49,uuS)]
b) E2(g) + Cl2(g) = 2ECl
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |2 - 44,617] -|S1,211 +SS,286]
c) propono(g) + ctono (g) = N -pcntono(g) + E2(g)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |8S,27 +S1,211] -|64,S1 +S4,8S]
d) mctono(g) +
1
2
02(g) = mctonol (l)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |Su,S] -|44,4u +(u,S - 49,uuS)]
AS = -S8,996
cal
Kmol
AS = -4,88
cal
Kmol
AS = 4,7S7
cal
Kmol
AS = -S8,7
cal
Kmol
- 228 -
_
oS
oI
]
1
=
1
I
__
oE
oI
]
1
-_
_
oS
oI
]
L
=
1
I
_
oE
oI
]
L
8.10. Cuando se contrae el hule, el trabajo mecnico que se obtienen es igual a la
fuerza q regula el desplazamiento en la direccin por la fuerza y esta dado
por dw-dL, en donde f es la fuerza y L es la longitud de la pieza de hule.
Si la contraccin se lleva a cabo reversiblemente, la primera ley puede
escribirse
dF = [
0F
0T
L
dT + [
0F
0L
T
dL = TdS +dL
Si se desprecia el trabajo volumen-presin. Demostrar que
(a) [
0S
0T
L
=
1
T
[
0F
0T
L
(b) [
0S
0L
T
=
1
T
j[
0F
0L
T
-[
(a)
_
oE
oI
]
L
JI +_
oE
oI
]
1
JI = IJS +JI
Proceso L=cte y JI
[
L
1
L
= I [
S
1
L
(b)
JE = IJS +JI Ec: 1
Ec: 1 JI o I = ctc
[
L
L
1
= I [
S
L
1
+
8.11. Un litro de un gas ideal a 300K tiene una presin inicial de 15 atm y se le
hace expandir isotrmicamente hasta un volumen de 10 litros. Calcular (a) el
trabajo mximo que se puede obtener de esta expansin, (b) U, (c) H.
- 229 -
Fig. 11.1: Diagrama P-V
Estado
V,L P,atm T,K
1 1 15 300
2 10 1.5 300
P1v1 = P2v2
P1I1 = nRI1
P2 = [
1
10
1S n =
(1)(15)
(0.082)(300)
= u.61molcs
P2 = 1.Sotm
Etapa L,cal U,cal H,cal
1 a 2 836 0 0
Imx = nRI ln
I2
I1
Imx = (u.61)(1.987)(Suu) ln
1u
1
Imx = 8S6.8 col
Ju = nCvJI Si I = ctc, JI = u
Ju = u
T=300K
V,L
P,atm
15
1
1
2
P
2
10
Lmx
(PV=K
1
)
t
- 230 -
JE = nCpJI Si I = ctc, JI = u
JE = u
8.12. Un mol de amoniaco (considerando que fuera un gas ideal) inicialmente a 25
C y 1 atm de presin, se calienta a una presin constante hasta que el
volumen se ha triplicado. Calcular(a) Q, (b) U, (c) H, (d)L, (e) S. Vase la
Tabla VI Cap. 4.
Cp
NH3
=6.189+7.88710
-3
T-7.2810
-7
T
2
(calmol
-1
grad
-1
)
Fig. 12.1: Diagrama V-T
Estado V,L P,atm T,K
1 V
1
1 298.15
2 3V
1
1 894.45
I1
I1
=
I2
I2
I2 = _
SI1
I1
] 298.1S
I2 = 894.4SK
Etapa Q,cal L,cal U,cal H,cal S,calmol
-
1
K
-1
1 a 2 6323 1185 5138 6323 11.24
(a) Si P = ctc, = AE
V,L
P=cte
T, K
2
1
3V
1
298.15
V
1
T
2
- 231 -
Au = S1S8col
AE = 6S2S col
JE = nCpJI
JE
H2
H1
= (6.189 +7.887 1u
-3
T -7.28 1u
-7
T
2
)JI
894.45
298.15
AE = 6.189(894.4S - 298.1S) +
7.887 1u
-3
2
(894.4S
2
-298.1S
2
)
-
7.28 1u
-7
S
(894.4S
3-
298.1S
3
)
AE = S688.64 + 28u2.28 -166.97
(b)
Ju = nCvJI Si Cp - C: = R
Ju = n(Cp -R)JI
Ju
02
01
= n_ CpJI
894.45
298.15
-R JI
894.45
298.15
_
Au = 6S2S -1.987(894.4S -298.1S)
(c) Ju = J -JI
JI
2
1
= J
2
1
- Ju
02
01
I = -Au
I = 6S2S -S1S8 = 118Scol
(e) JS =
d
1
- 232 -
AS = 11.24colmol
-1
K
-1
JS
S2
S1
= _
6.189 +7.887 1u
-3
T -7.28 1u
-7
T
2
T
_JI
894.45
298.15
AS = 6.189 ln
894.4S
298.1S
+7.887 1u
-3
(894.4S - 298.1S)
-
7.28 1u
-7
2
(894.4S
2
-298.1S
2
)
AS = 6.799 +4.7uS -u.2S88
8.13. Calcular el aumento en la entropa del nitrgeno cuando se calienta de 25 a
1000, (a) a una presin constante y (b) a un volumen constante
a) AS a volumen constante
AS
v
= Cp ln
1
2
1
1
AS
v
=
S
2
R ln
I
2
I
1
AS
v
=
S
2
_8.S14
[
mol K
] ln
127S
298
b) AS a presin constante
AS
P
= Cp ln
I
2
I
1
AS
P
=
7
2
R ln
I
2
I
1
AS
P
=
7
2
_8.S14
[
mol K
] ln
127S
298
AS
P
= 42.2S
[
mol K
AS
P
= 42.2S
[
mol K
- 233 -
AS = 1.67
col
gK
8.14. Calcular la diferencia de entropa entre un mol de agua lquida a 25 C y un
mol de vapor de agua a 100 C y 1 atm. El calor especifico promedio del
agua lquida puede tomarse como 1 cal grad
-1
g
-1
, y el calor de vaporizacin de
540 cal g
-1
.
E
2
0
(I)
, 2SC - E
2
0
()
, 1uuC
S = S
1
+S
2
S = Cp ln
T
vap
T
1
+
AB
vap
T
vap
S = 1 ln
S7S.1S
298.1S
+
S4u
S7S.1S
AS = u.224 +1.447
8.15. Se aaden 150 gramos de helio a un kilogramo de agua a 25 y en un sistema
aislado. Calcular el cambio de entropa si el calor de fusin es de 1435 cal
mol
-1
y Cp= 18 cal mol
-1
grad
-1
para el agua lquida.
color gonoJo (biclo) + color pcrJiJo (oguo) = u
nAE(usin) + nCcE20(l)AI +nCcE20(l)AI = u
1Su
18
- 14SS +
1Su
18
- 18 - (I -27S) +
1uuu
18
- 18 - (I -298) = u
119S8,SS +1SuI -4u9Su +1uuuI - 298uuu = u
11SuI = S26991,67
AS = XAS
AS1 = n
Cp
I
=
1Su
18
-
14SS
27S
= 4S,8uS4
col
K
I = 284,S4K
- 234 -
AS2 = nCcln
I
I
=
1Su
18
- 18 - ln
284,S4
27S
=6,1u48
col
K
ASS = nCcln
I
I
=
1uuu
18
- 18 - ln
284,S4
298
= -46,9228
col
K
AS = 4S,8uS4 + 6,1u48 -46,9228
8.16. Calcular el cambio de entropa de una mol de helio que experimenta una
expansin adiabtica reversible de 25 a 1 atm a una presin final de atm
a) Clculo de y:
y =
Cp
C:
y =
S
2
R
S
2
R
b) Clculo de la temperatura final:
I
P
y-1
y
= ctc
I
1
P
1
y-1
y
=
I
2
P
2
y-1
y
I
2
=
I
1
P
2
y-1
y
P
1
y-1
y
I
2
= 298 _
1
2
1
_
1.666-1
1.666
y = 1.666
I
2
= 22S.84 K
AS = 2,99
col
K
- 235 -
c) Calculo de AS
AS = Cp
ln
I
2
I
1
- R ln
P
2
P
1
AS =
S
2
R ln
I
2
I
1
- R ln
P
2
P
1
AS
1
=
S
2
_8.S14
[
mol K
] ln
22S.84
298
-__8.S14
[
mol K
] ln _
1
2
1
__
AS = -u.uuu1
[
mol
Con el valor de la variacin de entropa se afirma que en un proceso adiabtico
reversible el valor de la misma es cero.
8.17. Un bulbo de 1 litro de capacidad que contiene nitrgeno a 1 atm de presin y
a 25C, est conectado a otro bulbo de 3 litro que contiene bixido de carbono
a 2 atm de presin por medio de un tubo con una espita. Se abre sta y los
gases se mezclan hasta que se alcanza el equilibrio. Suponiendo que ambos
gases son iguales, Cul es el cambio de entropa para este cambio
espontneo?
Datos:
V1= 1 L
P1= 1 atm
T = cte = 298,15 K
V2 = 3 L
P2 = 2 atm
n
1
=
P
1
-v
1
R-1
n
1
=
(1otm)(1I)
[u,u82otm.
l
mol - K
(298,1SK)
Fig.17-1 Diagrama del Proceso
AS = u
[
mol
- 236 -
n1 = u,u41mol N
2
n
2
=
P
2
- I
2
R - I
n
2
=
(2otm)(SI)
[u,u82otm.
l
mol - K
(298,1SK)
n
2
= u,24Smol C0
2
Tabla 17-1 Datos Obtenidos
GAS V,L n X P
N2 1 0,041 0,14 0,245
CO2 3 0,245 0,86 1,505
4 0,286 1,00 1,75
P
1
=
n - R - I
I
1
P
1
=
(u,286mol) [u,u82otm -
I
mol - K
(298,1SK)
4I
P
1
= 1,7Sotm
AS = n - R - ln _
I
1
I
1
] +n - R - ln_
I
1
I
2
]
AS = (u,u41 mol) _
8,S14[
mol - K
] - ln_
4I
1I
] + (u,24Smol) _
8,S14[
mol - K
] - ln _
4I
SI
]
8.18. Calcular la eficiencia terica mxima con la cual el calor puede convertirse en
trabajo en las siguientes turbinas hipotticas: (a) vapor a 100 con salida a
140; (b) vapor de mercurio a 360 con salida a 140; (c) vapor a 400 y salida
a 150; (d) aire a 800 y salida a 400; (e) aire a 1000 y salida a 400,
emplendose aleaciones especiales; (f) helio a 1500 y salida a 400
utilizndose el calor de la energa atmica
AS = 1,uS86[K
- 237 -
p =
I
H
-I
L
I
H
a) I
H
= S7SK
I
L
= S1SK
p =
S7SK -S1SK
S7SK
b) I
H
= 6SSK
I
L
= 41SK
p =
633K-413K
633K
c) I
H
= 67SK
I
L
= 42SK
p =
67SK -42SK
67SK
d) I
H
= 1u7SK
I
L
= 67SK
p =
1u7SK -67SK
1u7SK
p = u.16u
p = u.S47
p = u.S72
p = u.S71
- 238 -
e) I
H
= 127SK
I
L
= 67SK
p =
127SK -67SK
127SK
f) I
H
= 177SK
I
L
= 67SK
p =
177SK -67SK
177SK
8.19. Calcular los cambios de entropa para las siguientes reacciones a 25:
a) S(rmbico) = S(monoclnico)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |7,78] -|7,62]
b)Etonol(l) +
1
2
02(g) = occtolJcbJo(g) +E20(l)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |6S,S +16,716] -|S8,4 +(u,S - 49,uuS)]
c) n -bcxono(g) = bcnccno(g) +4E2(g)
AS = XiAS (piouuctos) -XiAS (ieactivos)
p = u.62u
p = u.471
AS = u,16
cal
Kmol
AS = 17,S1S
cal
Kmol
- 239 -
AS = |64,S4 +(4 - S1,211)] -|92,4S]
8.20. Empleando las leyes primera y segunda combinadas, de la termodinmica,
demostrar que PF
= RT implica a (0F
0F
)
T
= 0 (a) demostrar que para el
proceso reversible a temperatura constante
_
0F
0F
_
T
= T_
0S
0F
_
T
- P
(b) Complete la prueba usando una de las relaciones de Maxwell [
0S
0F
T
=
[
0P
0T
F
oE = o -PoI (1)
o = IoS (2)
Reemplazo (2) en (1)
ou = toS -PoI
Dividimos para oI y tenemos:
[
L
v
1
= I [
S
v
1
- P (3)
(b) Por relacin de Maxwell tenemos:
PI
= RI
P =
RI
I
Derivando tenemos:
_
oE
oI
]
1
= I _
oP
oI
]
v
- P
AS = 96,7S4
cal
Kmol
- 240 -
_
oP
oI
]
v
=
R
I
Reemplazando en la Ecuacin (3) tenemos:
_
oE
oI
_
1
= I _
R
I
] - P
[
L
1
= P -P
8.21. La mitad de un mol de un gas ideal monoatmico inicialmente a 25C y
ocupando un volumen de 2lt, se le hace expandir adiabticamente y
reversiblemente a una presin de 1 atm. El gas es luego comprimido
isotrmicamente y reversiblemente hasta que su volumen es de 2lt a la ms
baja temperatura. Calcular: a)L b) Q, c) H, d) G, e) S.
Fig. 21-1 Ciclo adiabtico reversible
_
oE
oI
_
1
= u
T
2
P
V
1
2
T
1
=2
98K
P
2
=1at
m
V
1
=
2L
V
2
=
5.93L
P
1
3
- 241 -
Tabla 21-1. Respectivas ecuaciones que intervienen en los procesos
Etapas Proceso L(J) Q(J) H(J) U(J) S(J/K)
1-
2
Expansin
adiabtica
reversible
P1I1 -P2I2
- 1
0 nCpJI nC:JI 0
2-
3
Compresin
isotrmico
reversible
nRI ln _
I2
I1
] L 0 0
c
I
Etapa 1-2
I
udc
=
P1I1 - P2I2
- 1
= SS
P1I1
= P2I2
I2 =
(6,11 - 2
53)
S
3
1
S
3
PI = nRI
P1 =
u,Smol - u,u82IotmKmol - 298K
2I
Trabajando con la ecuacin del Ladrev tenemos:
IoJrc: =
(6,11 - 2) -(1 - S,9S)
S
S
-1
IoJrc: = 9,44otm- I
8,S14[
u,u82otmI
IoJrc: = 9S6,71 [
I2 = S,9SI
P1 = 6,11otm
- 242 -
I1I1
-1
= I2I2
-1
I2 = 144, S8K
Trabajando con las ecuaciones de la variacin de entalpa y energa interna, ya
conocidas tenemos que:
E = u,Smol -
S
2
- 8,S14
[
molK
- (144, S8K -298K)
u = u,Smol -
S
2
- 8,S14
[
molK
- (144,S8K -298K)
Etapa 2-3
I = nRI ln _
I2
I1
]
I = u,Smol - 8,S14
[
Kmol
- (144,S8K) - ln _
2
S.9S
]
cs ncgoti:o porquc cs uno comprcsin
u = u
u = -I
proccso cxotrmico picrJc color, comprcsin
S =
rc:
I
S =
-6S2,SS[
144,S8K
Jisminuyc lo cntropo yo quc cs uno comprcsin
u = -9S7,89 [
E = -1S96,41 [
= I = -6S2,SS [
S = -4,S2
[
K
I = -6S2,SS [
- 243 -
8.22. Si el volumen especfico parcial V en mililitros por gramo es independiente de
la concentracin, entonces es igual al volumen de la solucin menos el
volumen del solvente puro que contiene, dividido por el soluto:
u =
1 -(
1px -g
p
)
g
Donde g es la cantidad del soluto en 100 ml de solucin, px es la densidad de
la solucin y p es la densidad del solvente. La densidad de una solucin de
seroalbmina conteniendo 1,54 gramos de protenas por 100 ml, es de 1,0004
gcm
-3
a 25.( p = , 9977gm-3 ). Calcular el volumen especfico
aparente
: =
1uu -_
1uu - (1,uuu4 -1,S4
u,997u7
]
1,S4
8.23. Una solucin de cloruro de magnesio, MgCl
2
, en agua, conteniendo 41,24 g/L,
tiene una densidad de 1,0311 g/cm
3
a 20 . La densidad del agua a esta
temperatura es de 0,99823 g/cm
3
. Calcular (a) el volumen especfico parcial,
utilizando la ecuacin del ejercicio anterior y (b) el volumen molal parcial del
MgCl
2
Datos:
MgCl
2
g = 41,24 g/L
s
= 1,031 g/cm
3
T = 20 C
o
= 0,99823 g/cm
3
(a) v = ?
: = u,786
ml
g
- 244 -
(b) v
molal parcial
= ?
41,24g
I
-
1uuuI
1m
3
-
1m
3
(1uucm)
3
= u,u4124
g
cm
3
: =
1uu -(
1uu - p
s
-g
p
o
)
g
: =
1uu -(
(1uu) [
1,uS1g
cm
3
-(
u,u4124g
cm
3
)
(
u,9982Sg
cm
3
)
(
u,u4124g
cm
3
)
2SuS,4Scm
3
g
-
1m
3
(1uucm)
3
= 2,Sx1u
-3
m
3
: = : - H
: = _
2SuS,4Scm
3
g
_(9S,211
g
mol
)
: = 2S8SS4,u7cm
3
-
1m
3
(1uucm)
3
= u,2S8
m
3
mol
8.24. Cul es el cambio de la entropa cuando 1 mol de vapor de agua se calienta
de 300C a 600C a presin constante?
S=? a P=cte
Cp
H2O
=7.1873+2.373310
-3
T+2.08410
-7
T
2
(calmol
-1
grad
-1
)
Q=JE = Cp JI
S=
Q
T
S=
Cpd1
T
; S =
Cpd1
1
12
11
: = 2SuS,4Scm
3
g
: = u,2S8
m
3
mol
- 245 -
S=3.82 calmol
-1
K
-1
S= (
7.1873
T
873.15
573.15
+2.373310
-3
+2.08410
-7
T)JI
S=7.1873ln
873.15
573.15
+2.373310
-3
(873.15-573.15)+ 2.08410
-7
(873.15
2
-573.15
2
)
S=3.025+0.712+0.0904
_AS = Cp ln _
I
2
I
1
]_
P
AS = 18g - 1.99
[
g
- ln _
6uu
Suu
]
8.25. Calcular el cambio en la entropa de un mol de aluminio que se calienta de
600 C a 700 C. El punto de fusin del aluminio es de 660C, el calor de
fusin es de 94 cal g
-1
y las capacidades trmicas del aluminio slido y del
liquido pueden tomarse como 7.6 y 8.2 cal grad
-1
, respectivamente.
Al
(s)
, 6uuC - Al
(I)
, 7uuC
otos
I
]us
= 66uC
B
]us
= 94colg
-1
Cp
sIIdo
= 7.6
col
g groJ
-1
Cp
IIquIdo
= 8.2
col
g groJ
-1
i) Al
s
(6uuC, 1otm) - Al
I
(66uC, 1otm)
ii) Al
I
(66uC, 1otm) - Al
I
(7uuC, 1otm)
AS = 24.82 [
- 246 -
S = u.949colg
-1
K
-1
AS = nRln
I
2
-nb
I
1
-nb
-n
2
o _
1
I
2
-
1
I
1
]
S = S
1
+S
2
+S
3
S = nCp ln
T
2
I
]us
+
B
]us
I
]us
+nCp ln
I
3
I
]us
S = 7.6ln
9SS.1S
87S.1S
+
94
9SS.1S
+8.2 ln
97S.1S
9SS.1S
S = u.SuS +u.1 +u.S44
8.26. Deduzca la expresin para el cambio de entropa de un gas que obedece la
ecuacin de van der Waals y que se expande de un volumen V
1
A V
2
a
temperatura constante.
S=? , para Van der Waals
V1V2 a T=cte
Hoxwcll
_
oS
oI
]
1
= _
oP
oI
]
v
Ec: 1
_P +
n
2
o
I
2
_(I - nb) = nRI Ec: 2
P =
nRI
I -nb
-
n
2
o
I
2
Ec: 2.1
_
oP
oI
]
v
=
nR
I -nb
-
n
2
o
I
2
Ec: S
Ec: S cn Ec: 1
_
oS
oI
]
1
=
nR
I -nb
-
n
2
o
I
2
JS =
S
2
S
1
nR
1
I -nb
JI -n
2
o
1
I
2
JI
v
2
v
1
v
2
v
1
- 247 -
8.27. Dos bloques del mismo metal tienen igual tamao pero se encuentran a
diferentes temperaturas, T1 y T2. Estos bloques se juntan y se deja que
adquieran la misma temperatura. Demostrar que el cambio de entropa esta
dado por:
( )
(
= A 1
2 1 4
2 1
ln * *
2
T T
T T
Cp m S
Solucin:
Se considera: T1 > T2
= 0
i
Q (1)
) 1 3 ( *
1 1 1
T T Cp m Q = (2)
) 2 3 ( *
2 2 2
T T Cp m Q = (3)
(2) y (3) en (1)
0 ) 2 3 ( * ) 1 3 ( *
2 2 1 1
= + T T Cp m T T Cp m
2 2 1 1
* * Cp m Cp m = (por tratarse del mismo metal)
0 ) 1 3 2 3 ( * = + T T T T Cp m
2 1 3 2 T T T + =
2
2 1
3
T T
T
+
= (4)
2 1 dS dS dS + = (5)
} }
+ = A
3
2
2 2
3
1
1 1
* *
T
T
T
T
T
dT
Cp m
T
dT
Cp m S
- 248 -
2
3
ln * *
1
3
ln * *
2 2 1 1
T
T
Cp m
T
T
Cp m S + = A
2 2
2 1
ln * *
1 2
2 1
ln * *
2 2 1 1
T
T T
Cp m
T
T T
Cp m S
+
+
+
= A
(
|
.
|
\
| +
|
.
|
\
| +
= A
2 2
2 1
1 2
2 1
ln * *
T
T T
T
T T
Cp m S
( )
(
+
= A
2 1 4
2 1
ln * *
2
T T
T T
Cp m S
(
(
(
(
(
|
.
|
\
| +
= A
2 1
2
2 1
ln * *
2
T T
T T
Cp m S
( )
(
+
= A
2 1 4
2 1 4 2 1
ln * *
2
T T
T T T T
Cp m S
T1 debe ser mayor a T2 para que el proceso sea espontaneo y exista una
transferencia de calor en el sistema
( )
(
= A 1
2 1 4
2 1
ln * *
2
T T
T T
Cp m S
- 249 -
8.28. a) Calcular el menor trabajo que se tiene que hacer para extraer 100 cal de
calor de un bao de hielo a 0, cuando los alrededores se encuentran a 25. b)
Qu cantidad de calor a 25 se podra obtener del bao de hielo al gastar 10
cal de trabajo en un proceso reversible?
a)
[R -=
II
IE -II
[R -=
27S
298 -27S
= 1u,92
n =
[R
[R -
; [R = n[R -
Asumimos una eficiencia del 100%
[R = 1 - 1u,92 = 1u,92
[R =
I
In
; In =
I
[R
In =
1uu
1u,92
b)
[R -=
II
IE -II
[R -=
27S
298 -27S
= 1u,92
n =
[R
[R-
; [R = n[R -
Asumimos una eficiencia del 100%
[R = 1 - 1u,92 = 1u,92
[R =
I
In
; I = [R - In
I = 1u,92 - 1u = 1u9,2 col
In = 9,16 col
Fig. 28-1 Diagrama del Proceso
Fig. 28-2 Diagrama del Proceso
- 250 -
E = I +In
E = 1u9,2 +1u
8.29. Calcular los cambios de entropa para las siguientes reacciones a 25:
a) E(cn sol) + 0E(cn sol) = E20(l)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |16,716] - |u +(-2,S19)]
b) Ag(cn sol) + Cl(cn sol) = AgCl(s)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |22,97] -|17,67 +1S,17]
c) ES(en sol) = B(en sol) +S(en sol)
AS = XiAS (piouuctos) -XiAS (ieactivos)
AS = |u +S,S] - |14,6]
E = 119,2 col
AS = 19,2SS
cal
Kmol
AS = -9,S
cal
Kmol
AS = -7,87
cal
Kmol
- 251 -
8.30. Un recipiente de 2 litros a 0 contiene sulfuro de hidrgeno (suponiendo que
es un gas de ideal) a 1 atm de presin. Se calienta el gas a 100,
permaneciendo la presin externa de 1 atm. Calcular a) el calor absorbido,
b)el trabajo efectuado, c) U, d) H, e) S Para el sulfuro de hidrogeno,
Cp=7.15+0.00332T cal/( K)
d) AE = n CpJI
373
273
AE = n
(7,1S +u,uuSS2I)JI
373
273
AE = u,u89|7,1S(S7S -27S) +
u,uuSS2
2
- (S7S -27S)
a) AE = p
e) AS =
Cp
1
JI
373
273
AS = (
7,1S
I
+u,uuSS2)JI
373
273
AS = 7,1S - ln
S7S
27S
+u,uuSS2(S7S -27S)
b) I = PopAI
I = 1 - (2,72 -2) = u,72 -
1,987
u,u82
c) Au = AE -I
Au = 7S,18 -17,49
AE = 7S,18
col
K
I = 17,49 col
p = 7S,18
col
K
Au = SS,69 col
AS = 2,S64
col
molK
- 252 -
INTRODUCCION A LA SEGUNDA LEY DE LA TERMODINAMICA
FISICOQUIMICA GILBERT CASTELLAN
9-1. a) Considere una mquina imposible, que conectada a una nica fuente de
calor, produce trabajo neto en el medio ambiente. Acoplar esta mquina
imposible a una ordinaria de Carnot para obtener el horno refrigerador.
b) Acoplar el horno refrigerador a una de Carnot ordinaria de tal manera
que se produzca trabajo en un ciclo isotrmico.
SOLUCION:
(KP) Kelvin-Plank; toda transformacin cclica, cuyo nico resultado final sea el
de absorber calor de una sola fuente trmica a una temperatura dada y convertirlo
ntegramente en trabajo, es imposible.
Clausius; toda transformacin cclica, cuyo nico resultado final sea el de extraer
calor de un cuerpo frio para transferirlo a uno caliente, es imposible.
KP - C
a) La maquina viola en principio de Kelvin-Plank, es posible y se pide acoplar a una
de Carnot para crear el horno refrigerador, que viola el enunciado de Clausius.
1
= w
1
T
1
~K
P
Q
1
W
1
- 253 -
Representamos el refrigerador de Carnot, con una entrada de trabajo igual a W
1
1
>
2
w
1
+
2
=
1
Acoplando las dos maquinas tenemos:
Que se puede simplificar como:
T
1
~C
Q
1
W=0
T
2
Q
2
T
1
~KP
Q
*
1
R
Q
1
W
1
T
2
Q
2
T
1
R
Q
1
W
1
T
2
Q
2
- 254 -
Donde se puede observar que el sistema con frontera puenteada tiene W=0
1
-
+
2
=
1
I
1
> I
2
horno-refrigerador
b) Partiendo de la hiptesis de que una maquina que viola el principio de Clausius
existe, se nos pide acoplarla a una maquina de Carnot (M) para obtener una
maquina isotrmica que produzca trabajo.
La maquina rodeada por la frontera punteada es entonces una donde se toma calor
(Q
1
-Q
2
) de una sola fuente a T
1
para producir nicamente trabajo en un ciclo
isotrmico.
Se comprueba que:
9-2. Cul es la mxima eficiencia de una maquina trmica que tiene como fuente
caliente agua bajo presin en ebullicin a 125C y una fuente fra a 25C.?
T
1
~C
Q
1
M
Q
1
W
T
2
Q
2
Q
2
a) (~KP - ~C) h) (~C - ~KP) - (KP -C)
- 255 -
Datos:
T
H
=125C => (125 + 273.15) = 398.15 K
T
L
=25C=> (25 +273.15) = 298.15 K
e =
I
H
-I
L
I
H
Se sustituye las temperaturas absolutas.
e =
398.15-298.15
398.15
e = u.2S12 x 1uu
La eficiencia no depende del material utilizado en el ciclo sino solo de la
diferencia de temperaturas de las fuentes.
9-3. Un refrigerador es acondicionado a un motor de de Hp (1Hp= 10.688
Kcal/min). Si el interior de la caja debe estar a -20C, encontrar de una
temperatura exterior mxima de 35C Cul es la mxima perdida de calor
en la caja (cal/min que se puede tolerar si el motor funciona continuamente?
Supngase que el coeficiente de rendimiento es el 75% del valor para una
maquina reversible.
Datos
E=75
T
H
=35C = 308.15K
T
L
=-20C=253.15K
w =
1
4
Ep x 1u.688
kcol
min
= 2.67
kcol
min
T
H
= 308.15K
R
Q
H
W=2.67
T
L
=253.15
Q
L
=?
e = 2S.12 %
- 256 -
[
-
=
I
L
I
H
-I
L
[
-
=
2SS.1S
Su8.1S -2SS.1S
= 4.6u
e =
r
-
r
= e
r
-
[
= u.7S 4.6u
[
= S.4S
r
=
Q
L
W
Q
L
=
r
W
L
= S.4S 2.67
kcol
min
9-4. a) Supongamos que se escoge la eficiencia de una maquina reversible como
propiedad termomtrica para una escala termodinmica de temperatura. La
Q
L
= 92115
kca|
m|n
- 257 -
fuente fra tiene una temperatura fija. Medir la eficiencia de la maquina con
la fuente caliente a 0C, temperatura de hielo, y con la fuente caliente a
temperatura de vapor 100C Cual es la relacin entre las temperaturas, t en
esta escala y las temperaturas termodinmicas comunes T?
b) Supngase que la fuente caliente tiene una temperatura fija y que
definimos la escala de temperatura midiendo la eficiencia con la fuente fra a
la temperatura de vapor y a la temperatura de hielo. Hallar la relacin entre
t y T para este caso. ( Escoge 100 entre temperaturas de vapor y hielo).
a)
e = 1 +
e = 1 -
I
0
I
=
I -I
0
I
t =
e
100
-e
0
t
100
-t
0
1uu
t =
_[
I -I
o
I
- _
27S.1S -I
o
27S.1S
]_ 1uu
_
S7S.1S -I
o
S7S.1S
] -[
I
o
27S.1S
t =
27S.1S(I -I
o
) -I(27S.1S -I
o
)
I
1uu
27S.1S(S7S.1S -I
o
) -S7S7.1S(27S.1S -I
o
)
S7S.1S
=
I
o
(I -27S.1S) S7S.1S(1uu)
I
o
(S7S.1S -27S.1S)I
b) Ahora la temperatura fija es la de la fuente caliente, que llamaremos t1(T1 en
escala absoluta), y la variable ser t, la de la fuente fra(T en escala absoluta).
t = S7S.1S _1 -
27S.1S
I
]
- 258 -
La ecuacin para la eficiencia ser:
e = 1 -
I
I
1
=
I
1
-I
I
1
e
o
=
I
1
-27S.1S
I
1
e
100
=
I
1
-S7S.1S
I
1
t =
j[
I
1
-I
I
1
- [
I
1
-27S.1S
I
1
[ 1uu
[
I
1
-S7S.1S
I
1
-[
I
1
-27S.1S
I
1
=
(27S.1S -I) 1uu
(-1uu)
9-5. a) El helio liquido hierve a 4K y el hidrogeno liquido a 20K. Cul es la
eficiencia de una maquina trmica reversible que opera entre fuentes de
calor a estas temperaturas?
b) Si queremos obtener la misma eficiencia de (a) para una maquina trmica
con fuente fra a temperatura ambiente, 300 , Cul debe ser la temperatura
de la fuente caliente?
SOLUCION
a) Datos:
T
H
= 20K
T
L
=4K
SOLUCION
e =
I
H
-I
L
I
H
e =
2u -4
2u
= u.8u
t = T -273. 15
- 259 -
b)
I
H
=
I
L
1 -e
9-6 Considere el siguiente ciclo, utilizando un mol de gas ideal, inicialmente a 25C
y 1atm de presin.
Etapa 1. Expansin isotrmica contra la presin de cero hasta duplicar el
volumen (expansin de Joule)
Etapa2. Compresin isotrmica reversible a atm a 1 atm.
a) Calcular el valor de
dQ
L
, obsrvese que el signo concuerda con (8-40).
b) Calcular S para la etapa 2
c) Sabiendo que en el siclo S
ciclo
= 0, hallar S para la etapa 1.
d) demostrar S para la etapa 1 es igual a Que para la etapa 1 dividida por T.
SOLUCION
a) La integral
d
L
puede escribirse como:
V
1
V
2
=2V
1
P
2
=
0
P
3
=1/
2
P
1
=
1
P, atm
V
e = 8%
I
H
=
Suu
1 -u.8u
= 1SuuK
- 260 -
J
I
=
J
I
2
1
+
J
c
I
1
2
Para la etapa 1, es un proceso isotrmico.
Delate =0
Como es contra una presin de oposicin de cero el trabajo W = 0
J
I
=
1
2
Jw
I
=
1
2
PJI
I
=
1
2
RIJI
II
1
2
= R
JI
I
=
1
2
RIn
I
1
I
2
= RIn
I
1
2I
1
= -RIn2
Es negativo por lo que el ciclo es ireversible.
b) Usando la ecuacin:
JS =
J
c
I
En el literal (a) se comprueba:
AS
2
= -RIn2
c) Si el S
ciclo
= 0, entonces:
AS
ccIo
= u = AS
1
+AS
2
AS
1
= -AS
2
d) Sabemos que para la etapa 1:
AS
1
= RIn2
Y el cociente Q/T=0 ya que Q=0 entonces como:
RIn2 = u
J
I
= -RIn2
AS
1
= RIn2
- 261 -
Resulta que S para la etapa 1 no es igual a Q (etapa 1)/T.
9-7. Cul es la variacin de entropa si la temperatura de un mol de gas ideal
aumenta de 100k a 300k, Cv= (3/2)R.
a) Si el volumen es constante?
b) Si la presin es constante?
c) Cul sera la variacin de entropa si se utiliza tres moles en vez de uno?
SOLUCION.
a) Utilizamos la ecuacin de entropa para una mol de gas ideal.
JS =
C:
I
JI +
P
I
JI
I = ctc ; JI = u
AS = C: In
I
2
I
1
b) Para una mol de sustancia utilizamos la ecuacin:
JS =
Cp
I
JI -
I
I
JP
Si la presin es constante la ecuacin es:
AS =
Cp
I
In
I
2
I
1
Para un gas ideal.
Cp -C: = R
AS =
S
2
_1.987
col
K mol
] In
Suu
1uu
= S.274
col
K mol
- 262 -
Cp = C: +R = _
S
2
] R
c) La entropa es una propiedad extensiva de los sistemas, as que si el nmero
de moles se triplica esta debe triplicarse. Para los casos de los incisos (a) y (b)
tendramos entonces:
V=cte.
P=cte.
9-8. Un slido monoatmico tiene una capacidad calorfica Cp=6.2 cal K
-1
mol
-
1
.Calcular el aumento de entropa de un mol de este slido si la temperatura
aumente, a presin constante de 300 K a 500 K.
AS = _6.2
col
K mol
] In
Suu
Suu
9-9. Un mol de un gas ideal, Cv=(3/2)R, se lleva desde 0C y 2atm a -40C y 0.4
atm. Calcular S para este cambio de estado.
AS =
S
2
_1.987
col
K mol
] In
Suu
1uu
= S.4S7
col
K mol
AS = SAS = 9.82
AS = SAS = 16.S7
AS = S.167
u. c.
mol
- 263 -
JS =
C:
I
JI +
R
P
JP
AS = C: In
I
2
I
1
- RIn
P
2
P
1
AS =
S
2
_1.987
col
K mol
] In
2SS.1S
27S.1S
-_1.987
col
K mol
] In
u.4
2
9-10. Un mol de un gas ideal se expande isotrmicamente hasta duplicar su
volumen inicial.
a) Calcular S.
b) Cul sera el valor de S si se duplicaran isotrmicamente cinco moles de
un gas ideal?
SOLUCION
JS =
C:
I
JI +
P
I
JI
AS = R In _
I
2
I
1
]
I
2
= 2I
1
Para n= 5, puesto que S es una variable extensiva.
9-11 Cul es la variacin de entropa si un mol de agua se calienta a presin
constante desde 0C hasta 100C; Cp = 18 cal/K.mol?
Datos:
AS = -u.786 + S.198 = 2.42 [
u. c.
mol
AS = _1.987
col
K mol
] (In2) = 1.S77
u. c.
mol
AS = SAS = 6.886 u. c.
- 264 -
n= 1mol; Cp=18 cal/Kmol
P=cte. ; Qp=H
T
1
=273K
T
2
=373K
AS = Cp|n[
T2
T1
+R|n[
P2
P1
Ec. 9.5-1
Si la presin es constante, entonces
AS = Cpln _
I2
I1
]
AS = 18
cuI
K.moI
ln [
373
273
b) La temperatura de fusin es 0C y el calor de fusin es 1,4363 kcal/mol. La
temperatura de ebullicin es 100C y el calor de vaporizacin 9,7171
AS = S,62
col
molK
- 265 -
kcal/mol. Calcular S para la transformacin hielo (0C, 1 atm) vapor
(100C, 1 atm).
Se realiza en tres etapas que son:
1) Hielo(0C)---lquido(0C)
AS1 =
AH
T
Ec. 9.5-2
AS1 =
1,4363 kcuImoI
273K
AS1 = u,uuS261
kcuI
moIk
.
1000cuI
1kcuI
= S,261
cuI
moIk
2) lquido(0C)---lquido(100C)
AS2 = Cp|n[
T2
T1
-R|n[
P2
P1
Ec. 9.5-3
A presin constante, entonces
AS2 = Cpln_
I2
I1
]
AS2 = 18
cuI
K.moI
ln [
373
273
3) lquido(100C)---vapor(100C)
AS3 =
AHuap
Teh
Ec. 9.5-4
AS1 = S,261
col
molk
AS2 = S,62
col
molK
- 266 -
ASS =
9,7171 kcuImoI
373K
ASS = u,u26
kcuI
moIk
.
1000cuI
1kcuI
= 26,uS
cuI
moIk
Entonces la S para toda la transformacin es:
S= S1 + S2+ S3 Ec.
9.5-5
S= S,261
cuI
moIk
+ S,62
cuI
moIK
+ 26,uS
cuI
moIk
9-12. Si en la temperatura de ebullicin, 35C, el calor de vaporizacin del MoF
6
es
6 Kcal/mol, calcular S
vap.
T= 35C + 273 = 308K
AS =
AHuap
Teh
Ec.
9.6-1
AS =
6,u kcolmol
Su8K
AS = u,u19S
kcuI
moIk
.
1000cuI
1kcuI
= 19,S
cuI
moIk
9-13. a) A la temperatura de transicin 95.4C, el calor de transicin de azufre
rmbico a monoclnico es 0,09 kcal/mol. Cul es la entropa de transicin?
ASS = 26,uS
col
molk
S= 36,92
cuI
moIk
AS = 19,S
col
molk
- 267 -
S
0
(rmbico-monoclnico)
T= 95.4C + 273.15 = 368.5K
T=Te= 308K
AS(t) =
AHuap(t)
Te
Ec. 9.7-1
AS(t) =
u,u9 kcolmol
S68,SK
AS(t) = u,244 - 1u
-3
kcol
molk
.
1uuucol
1kcol
= u,24
col
molk
b) En la temperatura de fusin, 119C, el calor de fusin del azufre monoclnico
es 0,293 kcal/mol. Calcular la entropa de fusin.
Tf= 119C= 392K
H
f
= 0,293 kcal/mol
AS =
AH
T
Ec. 9.7-2
AS =
u,29S kcolmol
S92K
AS = u,747 - 1u
-3
kcol
molk
.
1uuucol
1kcol
= u,747
col
molk
c) Los valores dados en a) y b) son para un mol de S, o sea para 32g; sin
embargo la molcula en el azufre cristalino y lquido es S
8.
Calcular los
valores correspondientes dados para S
8
. Los valores resultantes son ms
AS(t) = u,24
col
molk
AS = u,7S
col
molk
- 268 -
representativos que las magnitudes comunes para las entropas de fusin y
transicin.
S Y S
f
para S
8
, entonces:
S=32g = 1mol
S
8
= 8 mol de S
AS(t) = u,24
col
k. mol S
.
8 mol S
8
1mol S
= 1,92
col
mol S
8
. K
AS(t) = 1,92
col
mol S
8
. K
AS = u,747
col
mol S. K
.
8 mol S
8
1mol S
= S,97
col
mol S
8
. K
9-14. Un mol de hidrogeno gaseoso es calentado a presin constante desde 300K
hasta 500K. Calcular la variacin de entropa para esta transformacin,
basado en los datos de las capacidades calorficas de la tabla.
Cp= 6,9469 -u,1999 - 1u
-3
I +4,8u8 - 1u
-7
I
2
cal/mol.k
n= 1mol H
2 (g)
P=cte.
T1=300K
T2=500K
dS =
Cp
T
dT Ec. 9.8-1
uS =
Cp
1
12
11
JI
S2
S1
uS
S2
S1
=
6,9469-0,1999-10
-3
1+4,808-10
-
1
2
1
500
300
JI
AS = S,97
col
mol S
8
. K
- 269 -
uS
S2
S1
= (
6,9469
1
-u,1999 - 1u
-3
+
500
300
4,8u8 - 1u
-7
I ) JI
S= 6, 9469 ln[
12
11
-u,1999 - 1u
-3
(I2 - I1) +
4,808-10
-
2
(I2
2
-I1
2
)
S= 6, 9469 ln[
500
300
-u,1999 - 1u
-3
(Suu - Suu) +
4,808-10
-
2
(Suu
2
-Suu
2
)
9-15. Un mol de gas ideal, inicialmente a 25C, se expande:
Calcular U, S, Q Y L para a) y b). Obsrvese la relacin entre S y Q en a)
y en b).
a) Isotrmica y reversiblemente desde 20 a 40 l/mol
b)
T1= 25C=298K
U=Q-L Ec.9.9-
1
Por ser una expansin isotrmica
U=0
Q=L
L=nRT ln[
V2
V1
Ec.9.9-
2
S= 3,547 cal/mol.K
- 270 -
L=1mol (8, 314
]
moIK
)(298,1SK)ln[
40
20
AS = Cvln[
T2
T1
+Rln[
V2
V1
Ec. 9.9-3
Por ser una expansin isotrmica
AS = Rln[
V2
V1
AS = 8,S14
]
moIK
ln [
40
20
c) Isotrmica e irreversiblemente, contra una presin de oposicin cero
(expansin de Joule), desde 20 a 40 l/mol.
Pop= 0 (expansin Joule)
Por ser una expansin isotrmica irreversible
U=0
L=1718 J
L= Q=1718 J
AS =5,76
]
moIK
- 271 -
L=Pop. V; donde Pop= 0 Ec.9.9-
3
Entonces, L= 0
U=Q-L
Por lo tanto, Q=0
S>
1
Por ser proceso irreversible satisface la desigualdad de Clausius
9-16. a) Un mol de gas ideal, Cv=3/2R, se expande adiabtica y reversiblemente;
estado inicial 300K, 1 atm; estado final 0,5 atm. Calcular U, S, Q Y L.
Para clculo de T2 por proceso adiabtico reversible-Relaciones de Poisson
T1
P1
y-1
y
=
T2
P2
y-1
y
Ec.9.10-1
Donde y =
Cp
C
=
5
3
; entonces
S> u
- 272 -
T2=T1[
P2
P1
y.1
y
T2=300K[
0,5
1
1,66-1
1,66
U =Q-L
Por ser proceso adiabtico
Q=0
U= -L
U= nCvT
U= 1mol*(
3
2
- (8,S14
]
moIK
))*(227,7-300)K
Por lo tanto
S=
Qrcv
1
Donde Q=0 por ser adiabtico, entonces
S= 0
T
2
= 227.7 K
U= -901,65 J
L= 901,65J
- 273 -
b) El mismo gas, inicialmente a 300K y 1 atm. Se expande adiabticamente
contra una presin de oposicin constante igual a la presin final, 0.5 atm.
Calcular Q, L, U Y S.
T1= 300K
P1= 1atm
Por ser un proceso adiabtico irreversible
T2=
11(P2R+P1C)
P1(C+R)
Ec.9.10-4
T2=
300|(0,5-0,082)+(1-32-0,082)]
1((
3
2
-0,082)+(0,082))
U= Q- L
Si Q=0, entonces
U=-L
L= Pop.V Ec.9.10-5
T2= 240K
- 274 -
L=P2 (V2-V1)
L=P2nR[
12
P2
-
11
P1
L=0,5atm*1mol*8,314
]
moIK
*[
240
0,5
-
300
1
Para un proceso adiabtico donde dQ= 0
S=
Q
T
Ec.9.10-6
S=0
9-17. Del os datos del grafito: S
298
= 1, 3609 cal/mol.K
Cp = -1,265 + 14,008*10
-3
T 103, 31*10
-7
T2
+
2,751*10
-9
T
3
. Cal/mol.K
Calcular la entropa molar del grafito a 1500K.
H a P constante=Qp
Donde dQ= CpdT
dS
S2
S1
=
dQ
T
T2
T1
Ec.9.11-1
uS
S2
S1
=
Cpd1
1
12
11
uS
S2
S1
=
(-1,265 + 14,008-10-3 T 103,31-10-7T
2
+ 2,751-10-9 T
3
)d1
1
1500
298
L=748,26 J
U=-748,26 J
- 275 -
S=-1,265ln [
12
11
+14,uu8 - 1u
-3
(I2 -I1) -
103,31-10-7
2
(I2
2
-I1
2
) +
2,751-10-9
3
( I2
3
-
I1
3
)
S= -1,265 ln[
1500
298
+14,uu8 - 1u -S(1Suu -298) -
103,31-10
-
2
(1Suu
2
-298
2
) +
2,751-10-9
3
(1Suu
3
-298
3
)
S
1500K
= S
298K
+ S Ec. 9.11-2
S
1500K
= 1,3609 cal/mol.K + 6,69 cal/mol.K
9-18. En el lmite, T= 0K, se sabe empricamente que el coeficiente de expansin
trmica de los slidos, 0. Demostrar que, como consecuencia, la entropa
es independiente de la presin a 0K, de tal manera que no son necesarias las
especificaciones relativas a la presin en la formulacin de la tercera ley.
=
1
v
[
v
1
P
_
oI
oI
]
P
= v
Mediante la relacin de Maxwell tenemos:
_
oI
oI
]
P
= -_
oS
oP
]
1
Entonces podemos demostrar que
_
oS
oP
]
1
= -v
Como 0 cuando T0K, entonces
S= 6,69 cal/mol.K
S
1500K
= 8,06 cal/mol.K
_
oS
oP
]
1-0
= u
- 276 -
9-19. Para agua lquida a 25 C, =2.0 *10
-4
grad
-1
,se puede tomar la densidad
como un gramo/ cc. Se comprime isotrmicamente un mol de agua a 25 C
desde 1 atm hasta 1000 atm, Calcular S.
a) Suponiendo que el agua es incompresible, esto es =0.
b) Suponiendo que =4.53 *10
-5
atm
-1
.
Resolucin de a)
=
1
v
[
v
1
p
si [
S
P
T
= -[
v
1
P
= -
1
v
[
S
P
T
V=-[
S
P
T
V JP
P2
P1
=- JS
S2
S1
VP=-S
S=-V (P
2
-P
1
)
Como:
H2O
=
1g
cc
y V=
m
6
V=
18 gmoI
1 gcc
=18 cc/mol
S=-V (P
2
-P
1
)
- 277 -
S=-(0.018L/mol)*(2.0 *10
-4
K
-1
)*(1000-1) atm =-3.59*10
-3
utmL
moIK
=-0.3643
]
moIK
Resolucin de b
Si:
u
[
= [
P
1
V
Y [
P
1
V
=[
S
v
T
u
[
= [
S
v
T
o
[
JI
v2
v1
= JS
S2
S1
V
u
[
=S
S= (V
2
-V
1
)
u
[
=-
1
v
[
v
P
T
V=-[
v
P
T
JP
P2
P1
=-
dv
v
2
1
-P=Ln
v2
v1
Ln V
2
=Ln V
1
- P
Ln V
2
=Ln V
1
- (P
2
-P
1
)
Ln V
2
= Ln 18
cc
moI
((4.53*10
-5
) atm
-1
*(1000-1) atm)
Ln V
2
=2.845
cc
moI
V
2
=c
2.845
cc
moI
V
2
=17.20
cc
moI
AS = -u.u87
col
molK
- 278 -
S= (V
2
-V
1
)
u
[
9-20.Para el cobre a 25 C,=0.492 *10
-4
grad
-1
y =0.78 *10
-6
atm
-1
. La densidad es
8.92 g/cc. Calcular para la compresin isotrmica de un mol de cobre desde 1
atm hasta 1000atm bajo las dos mismas condiciones del problema anterior.
Resolucin a
Como:
cu
=
8.92g
cc
y V=
m
6
V=
63.54 gmoI
8.42gcc
=7.123 cc/mol
=
1
v
[
v
1
p
si [
S
P
T
= -[
v
1
P
= -
1
v
[
S
P
T
V=-[
v
1
p
V JP
P2
P1
=- JS
S2
S1
c=-S
S= (17.20-18)
cc
moI
*(2.0*10
-4
/4.53*10
-5
) = -3.53*10
-3
utm L
moI K
=-0.3578
]
moI K
=-0.0856
cuI
moI K
- 279 -
S=-V (P
2
-P
1
)
Resolucin de b
=-
1
v
[
v
P
T
V=-[
v
P
T
JP
P2
P1
=-
dv
v
2
1
-P=Ln
v2
v1
Ln V
2
=Ln V
1
- P
Ln V
2
=Ln V
1 -
(P
2
-P
1
)
Ln V
2
= Ln 7.12
cc
moI
((0.78*10
-6
) atm
-1
*(1000-1) atm)
Ln V
2
=1.962
cc
moI
V
2
=c
1.962
cc
moI
V
2
=7.117
cc
moI
Si:
u
[
= [
P
1
V
Y [
P
1
V
=[
S
v
T
u
[
= [
S
v
T
o
[
JI
v2
v1
= JS
S2
S1
V
u
[
=S
S= (V
2
-V
1
)
u
[
S=-(7.123*10
-3
L/mol)*(0.492 *10
-4
K
-1
)*(1000-1)atm =-0.35*10
-3
utm L
moI K
=-0.3
]
moI K
=-8.48*10
-3
cuI
moI K
S= (7.117-7.123)
cc
moI
*(0.492*10
-4
/0.78*10
-6
) =-0.3784*10
-3
utmL
moIK
=-0.038
]
moIK
=-9.1727*10
-3
cuI
moIK
- 280 -
9-21. Demostrar que
[
0u
0P
T
=-[
0
0T
P
=
1
v
[
v
1
p
Ecuacin 1
PI = nRI
[
v
1
p
=
nR
P
Ecuacin 2
Ecuacin 2 en Ecuacin 1
=-
nR
vP
[
u
P
T
=-nR/P
2
V Ecuacin 3
=-
1
v
[
v
P
T
Ecuacin 4
PI = nRI
I =
nRI
P
[
v
P
T
=- nRT/P
2
V
Ecuacin 5
Ecuacin 5 en Ecuacin 4
=nRT/VP
2
[
[
1
P
=nR/P
2
Ecuacin 6
Igualando la ecuacin 6 con la ecuacin 3 tenemos que:
[
0u
0P
T
=-[
0
0T
P
- 281 -
9-22. Considere la expresin dS =
Cp
T
dT - VdP
Supngase que para el agua =4.53 *10
-5
atm
-1
, V=18cc /mol C
P
= 18 caloras/
k mol y =2.0 *10
-4
grad
-1
, calcular la disminucin de temperatura que ocurre
si el agua a 25C y 1000 atm de presin es llevada reversible y
adiabticamente a 1 atm de presin
Por ser adiabtico el dS es igual a cero
dS =
d
1
y Q= (CONSTANTE) dQ=0
Por lo que la expresin nos queda
Cp
1
dT= VdP
Calculamos T
2
Cp
d1
1
12
11
=V JP
P2
P1
CpIn
12
11
=VP
LnT
2
=VP/Cp + LnT
1
LnT
2
=
(0.018LmoI)-(2.0-10-4 K-1)-(1-1000)utm
18cuIKmoI
+In 298.1S k
LnT
2
=5.69K
T
2
=c
5.69
T
2
=296, 56 K
T=T
2
T
1
T= (298.15-296.56) K
T=1.588k
- 282 -
ENERGIAS LIBRES
FISICOQUIMICA FARRINGTON DANIELS
10-1. Calcular los cambios de energa libre de Gibbs a 25, para las reacciones del
problema 10, cuando las sustancias reaccionantes se encuentran en su estado normal,
usando los datos de formacin de la entalpa de la tabla II
Datos:
(S, en ca|K)
Elementos y compuestos
H
2
(g) 31. 211
O
2
(g) 49. 3
H
2
O (|) 1. 71
C|
2
(g) 53. 28
HC| (|) 44. 17
Prupanu(g) 4. 51
etanu(g) 54. 85
n -pentanu(g) 83. 27
Metanu(g) 44. 5
metanu| (|) 3. 3
Fuente: Daniels
(H, en Kca|)
Elementos y compuestos
H
2
O (|) -8. 3174
HC| (|) -22. 3
Prupanu(g) -24. 82
etanu(g) -2. 23
n -pentanu(g) -35.
Metanu(g) -17. 889
metanu| (|) -57. 2
Fuente: Daniels
(a)H
2
(g) +
1
2
O
2
(g) - H
2
O (|)
AS = _F| ASpuductux -_F|ASreact|uux (Ec. 1-1)
AS = 1. 71 -[
1
2
49. 3 +31. 211 ca|K
AS = -39. 25ca|k
-1
1kca|
1ca|
- 283 -
AH = _F| AHpuductux -_F|AHreact|uux(Ec. 1-2)
AH = -8. 3174 - Kca|
A6 = AH-TAS (Ec. 1-3)
A6 = -8. 3174kca| -298. 15K(-39. 25 - 1
-3
kca|K
-1
)
(h)H
2
(g) + C|
2
(g) - 2HC| (|)
AS = _F| ASpuductux -_F|ASreact|uux (Ec. 1-4)
AS = (2 - 44. 17) -(53. 28 +31. 211)ca|K
AS = 4. 737ca|k
-1
1kca|
1ca|
AH = _F| AHpuductux -_F|AHreact|uux (Ec. 1-5)
AH = 2(-22. 3)Kca
A6 = AH-TAS (Ec. 1-6)
A6 = -44. 12kca| -298. 15K (4. 7373 - 1
-3
kca|K
-1
)
(c)Prupanu(g) + etanu(g) - n -pentanu(g) + H
2
(g)
AS = _F| ASpuductux -_F|ASreact|uux (Ec. 1-7)
S=-39.0025*10
-3
KcalK
-1
H= -68.317Kcal
G= -56.69 Kcal
S= 4.7373*10
-3
KcalK
-1
G= -44.01Kcal
G= -45.425 Kcal
- 284 -
AS = (83. 27 +31. 211) -(4. 51 +54. 85)ca|K
AS = -4. 879ca|k
-1
1kca|
1ca|
AH = _F| AHpuductux -_F|AHreact|uux (Ec. 1-8)
AH = (-35. ) - (-24. 82 -2. 23)Kca|
A6 = AH-TAS
(Ec. 1-9)
A6 = 1. 5kca| -298. 15K (4. 879 - 1
-3
kca|K
-1
)
d)Metanu(g) +
1
2
O
2
(g) - metanu| (|)
AS = _F| ASpuductux -_F|ASreact|uux
(Ec. 1-10)
AS = (3. 3) -[44. 5 +
1
2
17. 889 ca|
AS = -38. 7ca|k
-1
1kca|
1ca|
= -38. 7 - 1
-3
kca|K
-1
AH = _F| AHpuductux -_F|AHreact|uux
(Ec. 1-11)
AH = (-57. 2) - (-17. 889 )Kca|
A6 = AH-TAS
(Ec. 1-12)
S= -4.879*10
-3
kcalk
-1
H= 10.05 Kcal
G= 11.51 Kcal
G= -38.7*10
-3
KcalK
-1
H= -39.131 Kcal
- 285 -
A6 = -39. 131kca| -298. 15K (-38. 71
-3
kca|K
-1
)
10-2. Cuando se contrae hule, el trabajo mecnico que se obtiene es igual a la
fuerza que regula el desplazamiento en la direccin de la fuerza y est dado por
6L = -6|, donde P es la fuerza y | es la longitud de la pieza de hule. Si la
contraccin se lleva a cabo reversiblemente, la primera ley puede escribirse:
ou = [
0
1
I
oI +[
0
L
I
ol = T oS +ol (Ec. 2-1)
Si se desprecia el trabajo volumen presin (a) demostrar que:
[
s
1
I
=
1
1
[
0
1
I
[
s
L
1
=
1
1
j[
0
L
1
-[
(Ec. 2.2)
[
0
1
I
oI +[
0
L
I
ol = T oS +ol(1)
T = cteoI = u(2)
(2) en (1)
[
0
L
1
ol = T oS + ol( ol) (3)
[
0
L
1
= T [
S
L
1
+ (4)
(b) Utilizando el principio de que el orden de diferenciacin empleado para obtener
0
2
S
0L
0Tes inmaterial, demostrar que
[
0
L
1
= -T[
]
1
v
(Ec. 2-3)
[
0
L
1
= T [
S
L
1
+ (1)
Relacin de Maxwell
[
0U
0L
T
= -[
0
0L
T
(2)
_
0x
0L
]
T
=
1
T
__
0U
0L
]
T
- _
G= -27.59 Kcal
- 286 -
(2) en (1)
10-3. Se hace expandir una mol de un gas ideal reversible e isotrmicamente (25)
de una presin de 1 atm a otra de 0.1 atm (a) Cul es el cambio en la energa
libre de Gibbs? (b) Cul sera el cambio en energa libre de Gibbs si el proceso
ocurriese irreversiblemente?
Datos:
P
1
= 1atm
P
2
= 0.1 atm
T= 298.15 K
o0 = -soI +IoP (Ec. 3-
1)
o0 = IoP (1)
PV= nRI
(Ec. 3-2)
V= (nRT) / P (2)
(2) en (1)
o0 = nRI
oP
p
[
0U
0L
T
= - T[
0
0T
F
P
1
0.1
1
2
V
Grfico 3-1: Diagrama P-V
V1 V2
T=cte.
- 287 -
z 0 = nRIln _
P
2
P
1
]
z 0 = 1mol - 1.986colK
-1
mol
-1
- 298.1SK - ln [
0.1
1
(b)
z 0 = zE -I z S (Ec. 3-3)
z 0 = -I z S (1)
z S = nRI [
P
1
P
2
(2) (Ec. 3-4)
(2) en (1)
z 0 = -InRln [
P
1
P
2
(3)
z 0 = -1mol - 1.986colK
-1
mol
-1
- 298.1SK - ln _
1
u.1
]
G= -1363 cal
G= -1363 cal
V
P
1
0.1
V1 V2
1
2
Grfico 3-2: Diagrama P-V
-2
T=cte.
Irreversible
- 288 -
10-4. Las presiones de vapor del agua y del hielo a 5 son de 3.163 y 3.013 mm ,
respectivamente. Calcular z6para la transformacin del agua en hielo a -5.
Datos:
P
1
= 3.163mm
1utm
760mm
= 4.16 - 1u
-3
atm
P
2
=3.013mm
1utm
760mm
= S.96 - 1u
-3
atm
Grfico 4- 1: Diagrama P-V
o0 = -soI +IoP (Ec. 4-1)
o0 = IoP (1)
PV= nRI
V= (nRT) / P (2)
(2) en (1)
o0 = nRI
oP
p
z u = nRTln _
P
2
P
1
]
z u = 1mol - 1.986calK
-1
mol
-1
- 268.1SK - ln _
S.96 - 1u
-3
4.16 - 1u
-3
_
G= -26.24 cal
- 289 -
10-5. (a) Calcular el trabajo efectuado contra la atmsfera, cuando 1 mol de
tolueno se evapora en su punto de ebullicin, 111. El calor de evaporizacin de
1 mol, calcule (b) q , (c) zH, (d) z U, (e) z 6, (f) z S
Datos:
T= 384.15
n= 1mol
(a) L= nRT (Ec. 5-1)
L = 1 mol (1.986 cal K
-1
mol
-1
) (384.15) K
L =763 cal
(b) y (c) z E = p (Ec. 5-2)
z E = 86.S
cuI
g
- 1mol
92g
1moI
(d) z u = -I (Ec. 5-3)
z u = 79S8 -76S
(e) z 0 = zE -I z S (Ec. 5-4)
z u = zB -Q
z u = 79S8cal -79S8cal
(f) z S =
zH-zG
T
(Ec. 5-5)
z S =
79S8 -u
S84.1S
H= 7958 cal
U= 7196 calmol
-1
G= 0
S= 20.7 calk
-1
mol
-1
- 290 -
n = 0.61mol
10-6. Un litro de un gas ideal a 300 K tiene una presin inicial de 15atm y se le
hace expandir isotrmicamente hasta un volumen de 10 litros. Calcular (a) el
trabajo mximo que se puede obtener de esta expansin, (b) , (c) H
, (d) 6
,
(e) A
DatosProceso isotrmico
V
1
=1 L = 1 1u
-3
m
3
T= 300 K U= Q L
(Ec. 6-1)
P
1
=15 atm = 1519875 PaU= 0 Q = L
V
2
=10 L = 1u
-3
m
3
R = 0.082
utmL
moIK
= 8.314
Pum3
moIK
(a) PV = nRT (Ec. 6-2)
n =
PI
RI
n =
15-1
0.082-300
L = nRTln
V2
V1
(Ec. 6-3)
Grfico 6-1: Diagrama P-V expansin isoterma
1
2
- 291 -
L = 836.61 cal.
= 0
E
=0
0
= - 836.61 cal.
A
= - 836.61 cal.
L = (u.61) (8.S14) (Suu) ln
10
1
L = 3502.9 J
(b) U= = nC
v
T (Ec. 6-4)
T= 0
(c) E
= nC
p
T
(Ec. 6-5)
T= 0
(d)
V2
V1
=
P1
P2
P2
P1
=
1
10
0
= nRTln
P2
P1
(Ec. 6-6)
0
= (0.61) (8.314) (300)ln
1
10
0
= - 3502.9 J
(e) A
= - L
max
(Ec. 6-7)
- 292 -
V
2
= 73.32 L
10-7.- Un mol de amoniaco (considerando que fuera un gas ideal) inicialmente a
25 C y 1 atm de presin, se calienta hasta que el volumen se ha triplicado.
Calcular (a) q, (b) L, (c) H
, (d) , (e) S
.
DatosProceso isobrico
n = 1mol NH
3
V
1
= V
1
U= Q L (Ec. 7-1)
V
2
= 3 V
1
nC
v
T = nCpT - PV
T
1
= 298 K
P
1
=1 atm = 101325 Pa
Tabla 7-1: C
p
= 3
(X)
Ecuacion:
:
C
p =
(a + b 1
-3
T + c 1
5
T
-2
) JK
-1
mu|
-1
Sustancia a, JK
-1
mu|
-1
b 1
-3
, JK
-1
mu|
-1
c 1
5
,
JK
-1
mu|
-1
NH
3
29,75 25,10 -1,55
(a) V
1
=
nR1
P1
(Ec. 7-2)
V
1
=
1-0.082-298
1
V
1
= 24.44 L
Grafico 7-1: Diagrama P-V expansin isobrica
- 293 -
T
2
= 894 K
Q
p
= 6283 cal.
E
= 6283 cal
L = 1183.23 cal.
= 5100 cal.
T
2
=
P2V2
nR
(Ec. 7-3)
T
2
=
1-73.32
0.082-1
Q
p
= nC
p
JT (Ec. 7-4)
NH
3:
C
p =
29.75 + 25.10 1u
-3
T - 1.55 1u
5
I
-2
Q
p
= (29.7S + 2S.1u 1u
-3
T -1.SS 1u
5
I
-2
)JT
894
298
Q
p
= 26300 J
(b) L = PV (Ec. 7-5)
L = (101325) (73.32 - 24.44) 1u
-3
L = 4952.77 J
(c) E
= Q
p
(Ec. 7-6)
.
(d) = U= Q L (Ec. 7-7)
= 6283 - 1183.23
(e) S
=
CpdT
T
(Ec. 7-8)
S
=
(29.75 + 25.1010
-3
T-1.5510
S
1
-2
)dT
1
894
298
- 294 -
S
= 11.20 cal.
% p = 35 %
% p = 16 %
S
= 29.75
dT
1
894
298
+ 25.10 1u
-3
JT
894
298
- 1.55 1u
5
I
-3
JT
894
298
S
= 46.87 J
10-8.- Calcular la eficiencia terica mxima con la cual el calor puede convertirse
en trabajo en las siguientes turbinas hipotticas: (a) vapor a 100 C con salida a
40 C; (b) vapor de mercurio a 360 C con salida a 140 C; (c) vapor a 400 C
y salida a150 C; (d) aire a 800 C y salida a 400 C; (e) aire a 1000 C y salida a
400 C, emplendose aleaciones especiales; (f) helio a 1500 C y salida a 400 C
utilizndose el calor de la energa atmica.
Segn el principio de Carnot una mquina perfecta que trabaja reversiblemente
dentro de los limites de temperatura T
2
y T
1
tiene la misma eficiencia termodinmica
sin que importe la naturaleza de la sustancia que realice trabajo
% p = [1 -
T2
T1
- 1uu % p = [1 -
TL
TH
- 1uu (Ec. 8-1)
(a) T
H
= 373 K
T
L
= 313 K
% p = [1 -
313
373
- 1uu
(b) T
H
= 633 K
T
L
= 413 K
% p = [1 -
413
633
- 1uu
(c) T
H
= 673 K
T
L
= 423 K
- 295 -
% p = 62 %
% p = 47 %
% p = 37 %
% p = 37 %
% p = [1 -
423
673
- 1uu
(d) T
H
= 1073 K
T
L
= 673 K
% p = _1 -
67S
1u7S
] - 1uu
(e) T
H
= 1273 K
T
L
= 673 K
% p = [1 -
673
1273
- 1uu
(f) T
H
= 1773 K
T
L
= 673 K
% p = [1 -
673
1773
- 1uu
9.- Empleando las leyes de la primera y segunda combinadas, de la termodinmica,
demostrar, PF
= RT implica a _
6
6F
_
T
= 0.
(a) demostrar que para el proceso reversible a temperatura constante
[
6
6F
T
= T [
6S
6F
T
P
(b) complete la prueba usando una de las relaciones de Maxwell
[
6P
6T
V
= [
6S
6F
T.
- 296 -
[
6
6v
T
= P P = 0
[
6
6v
T
= T [
6S
6v
T
P
La derivada _
6
6F
_
T
se denomina presin interna que es de magnitud apreciable
para los lquidos y slidos porque la energa de cohesin entre las molculas es alta.
En cambio, para los gases tiene un valor nfimo, entonces para un gas ideal que sus
partculas tienen nula interaccin, se sigue que _
o
oI
_
T
= 0.
(a) J = TJS
PJI
(Ec. 9-1)
(J = TJS
PJI
)* (
1
6v
)
(b) PI
= RT (Ec. 9-2)
[
6P
61
V
= [
6S
6v
T.
[
6P
61
V
= [
6S
6v
T
=
R
v
Sustituyendo tenemos
[
6
6v
T
= T
R
v
P
Pero;
R1
v
= P
Entonces;
10.- Demostrar que
(a) [
6E
6S
V
= [
6H
6S
P
(b) [
6H
6P
S
= [
6u
6P
T
(a) J = TJS
PJI
(Ec. 10-1)
- 297 -
[
6H
6P
S
= [
66
6P
T
[
6E
6S
V
= [
6H
6S
P
(J = TJS
PJI
)*(
1
6S
)
V
[
6E
6S
V
= T
JB = TJS
+ VJP (Ec. 10-2)
( = TJS
+ VJP)*(
1
6S
)
P
[
6H
6S
P
= T
T = T
(a) JB = TJS
+ VJP (Ec. 10-3)
(JB = TJS
+ VJP)*(
1
6P
)
S
[
6H
6P
S
= V
Ju = -SJI + VJP (Ec. 10-4)
(Ju = -SJI + VJP)*(
1
6P
)
T
[
66
6P
T
= V
V = V
- 298 -
10-11.- Dos moles de un gas ideal se comprime isotrmicamente de 1 a 5 atm a
100. (a) Cul es el cambio de energa libre de Gibbs? (b) Cul hubiera sido el
cambio de la energa libre de Gibbs si la compresin se hubiera efectuado a 0?
Datos
n= 2moles
P
1
= 1 atm
P
2
= 5 atm
a) T= 100C=373.15= cte.
A0 = nRIIn
P
2
P
1
(Ec. 11-1)
A0 = (2mol) [8.S14
]
KmoI
(S7S.1SK)In j
5utm
1utm
[
b) T=0C=273.15
A0 = nRIIn
P
2
P
1
(Ec. 11-2)
A0 = (2mol) [8.S14
]
KmoI
(27S.1SK)Inj
5atm
1atm
[
G= 9986.14 J
G= 7369.96 J
V
P
T=cte.
V
1
V
2
P
1
P
2
Grafico 11-1: Diagrama P-V de compresin isotrmica.
- 299 -
10-12.- A 50, la presin parcial de H
2
O
(g)
en e l CuSO
4
.
H
2
O
(s)
es de 4.5 mmHg y
en el CuSO
4
.
5H
2
O
(s)
es de 47 mmHg. Calcular el cambio de la energa libre de
Gibbs para la reaccin:
CuSO
4
.
5H
2
O
(s)=
CuSO
4
.
H
2
O
(s)
+ 4H
2
O
(g)
Datos
T= 50C = 323.15 K = cte.
P
agua
=4.5 mmHg
P
CuSO4. 5H2O
= 47 mmHg
AS = CpIn j
T
T
[ -RIn _
P
Cu5O4.SH2O
P
agua
_ (Ec. 12-1)
Como t=cte.
AS = RIn _
P
Cu5O4.SH2O
P
cguc
_
AS = -_8.S14
[
Kmol
] In _
47mmEg
4.SmmEg
_
AS = -u.S6[K
A0 = AE -IAS (Ec. 12-2)
Comot = cte. AB = u
Au = -TAS
Au = -(S2S.1SK)(-u.S6})
10-13.- El calor de vaporizacin de oxigeno liquido a 1 atm es de 1630 cal
.
mol
-1
en
su punto de ebullicin, -1831 C. para la evaporacin reversible de 1 mol, de
oxigeno liquido calcular (a) Q, (b) AE, (c)AC, y (d)AS.
Datos
P= 1 atm
Hv= 1630 cal
.
mol
-1
T eb= -183 C=90.15 K
= nE: (Ec. 13-1)
= (1mol)(16Sucalmol
-1
)
Au = 116.28}
- 300 -
Como t= cte.
AS =
1
(Ec. 13-2)
AS =
16Sucol
9u.1S
A0 = AE -IAS (Ec. 13-3)
Como T=cte.
A0 = -IAS
A0 = -(9u.1SK)(18.u8col)
10-14.-Una mol de un gas ideal en 22.4 L, se hace expandir isotrmica y
reversiblemente a 0 a un volumen de 224 L y 1/10 de atm. Calcular (a) L, (b)
Q, (c) AH, (d)A6, (d)AS para l gas.
Datos
n= 1 mol
V
1
= 22.4 L
V
2
= 224 L
T= 0C= 273.15 K
P
1
= 1/10 atm= 0.1 atm
Q= 1630 cal
S= 18.08 calK
-1
U=0
G= -1630 cal
V
P
T=cte.
V
2
V
1
P
2
P
1
Grafico 14-1: Diagrama P-V de expansin
isotrmica.
- 301 -
P =
nR1
v
1
(Ec. 14-1)
P =
(1mol)(u.u82uSotmlmol
-1
K
-1
)(27S.1SK)
22.4I
P = 1otm
I = nRIIn
v
2
v
1
(Ec. 14-2)
I = (1mol)(8.S14[mol
-1
K
-1
)(27S.1SK) In
224L
2.2.4L
Como T= 273.15 K= cte.
AS = CpIn j
1
1
[ + RIn j
v
2
v
1
[ (Ec. 14-3)
Como T= cte.
AS = RIn _
I
2
I
1
_
AS = (8.S14)In _
224I
22.4I
_
10-15. Calcular A6 a 25 C para las siguientes reacciones:
(a) SO
3 (g)
=SO
2 (g)
+ O
2 (g)
Au = _X
I
Afu
I
(piouuctos) -_X
I
Afu
I
(ieacctivos)
Au = (Auso2 +Auu2) -(AusoS)
Au = (-Suu.4 +u) -(-S7u.4)
L= 5226J
H= 0
U=0
9986.14
J
S= 19.14 JK
-1
A0 = 7uk[mol
-1
(Ec. 15-1)
- 302 -
(b) CaO
(s)
+ CO
2 (g)
= CaCO
3(s)
Au = X
I
Afu
I
(piouuctos) -X
I
Afu
I
(ieacctivos)
Au = (AuCaC0
3
) - (AuCa0
(s)
+C0
2
)
Au = (-1128.8) -(-6u4.2 +-S94.S8)
10-16. Puede derivarse fcilmente una ecuacin para la presin P en funcin de la
altura h en la atmosfera, si se supone que la temperatura T, la aceleracin de la
gravedad g y el peso molecular del aire M son constantes, la energa libre molar
de Gibbs del gas es una funcin de la presin y de la altura y debe ser la misma
en toda la atmsfera de modo que:
Demostrar que Entonces que:
0 = |
.
|
\
|
c
c
+ |
.
|
\
|
c
c
= dh
h
G
dP
P
G
dG
P h
e P
P
RT Mgh
O
/
=
Mg
h
G
P
= |
.
|
\
|
c
c
(Ec. 16-1)
(Ec.16-2)
Au = -1Su.2K}mol
-1
(Ec. 15-2)
- 303 -
10- 17. Calcular G para la siguiente reaccin:
) 25 , ( ) 25 , (
2 2
C l O H C g O H
Si la presin de vapor del agua a 25C es de 23,76mmHg
K mol J G
G
V
P nRT G
P
dP
nRT dG
emplazo
P
nRT
V
nRT PV
Sabemos
VdP dG
VdP
dT
S dG
dT cte T si
VdP SdT dG
Partimos
. / 8578
)
2
10 13 , 3 ln( * 298 * 31 , 8 * 1
ln
Re
0
0
:
=
= A
= A
=
=
=
=
+ =
= =
+ =
A
(Ec. 17 -1)
(Ec. 17 -2)
(Ec. 17 -S)
- 304 -
10-18.Calcular L y G cuando un mol de agua al estado lquido se evapora en su
punto de ebullicin de 100C a 1 atm y luego se expande en su estado de vapor
hasta 50 litros a 100C.
Grafica 18-1: Diagrama PV para la expansin del agua a las condiciones dadas
molK
J
G
G
P
dP
nRT G
J L
L
V
V
nRT L
V
dV
nRT L
atm P
P
V
V P
P
L V
V
P
nRT
V
nRT V P
P
P
V
V
1532
1
61 , 0
ln * 373 * 31 , 8 * 1
1523
6 , 30
50
ln * 373 * 31 , 8 * 1
1
2
ln
61 . 0
50
6 , 30 * 1
*
6 . 30
1
373 * 082 , 0 * 1
2
1
2
1
2
2
2
1 1
2
1
1
1
1
1 1
= A
|
.
|
\
|
= A
= A
=
|
|
.
|
\
|
=
|
.
|
\
|
=
=
=
=
=
=
=
=
=
}
}
(Fc. 18 -1)
(Fc. 18 -2)
(Fc. 18 -3)
(Fc. 18 -4)
- 305 -
10-19. Diez gramos de helio se comprimen isotrmicamente y reversiblemente a
100C de una presin de 2 atm a 10 atm. Calcular: Q, L, G, A, H, U, S.
Grafico 19-1: Diagrama P-V para la compresin isotrmica del helio
S T
H
G
K mol J S
S
T
Q
S
J L Q
L Q
V
V
nRT L Q
L Q
U
cero son H y U isotermi procesos Para
L V
V
L V
V
P
nRT
V
moles n
n
M
m
n
A
A
= A
= A
= A
= A
= =
|
|
.
|
\
|
= =
|
.
|
\
|
= =
=
A
A A
=
- -
=
=
=
=
=
=
=
0
. 42 , 33
373
6 , 12467
6 , 12467
2 , 38
6 , 7
ln * 373 * 31 , 8 * 5 , 2
ln
cos
6 , 7
10
373 082 , 0 5 . 2
2 , 38
2
373 * 082 , 0 * 5 , 2
5 . 2
4
10
1 1
1
2
0
2
2
1
1
o
(Fc. 19 -1)
(Fc. 19 -2)
(Fc. 19 -3)
(Fc. 19 -4)
(Fc. 19 -5)
- 306 -
K mol
J
A
S T A
U S T U A
K mol
J
G
G
.
6 , 12467
0 ;
.
6 , 12467
) 42 , 33 ( * 373
= A
A = A
= A A A = A
= A
= A
10-20. Calcular la presin de equilibrio para la conversin del grafito en diamante
a 25 C. Las densidades del grafito y del diamante pueden tomarse como 2.55 y
31.5 g/cm
3
, si la variacin en la energa de Gibbs durante el cambio de grafito a
diamante a 25 C es de -126cal.
C
(grafito
) C
(diamante)
atm P
e P
e P
VRT
G M
P
V m
mRT
G M
P
M
m
n
nRT
G
P
P nRT G
L g
L
cm
cm
g
VT V V equilibrio el En
J
cal
J
cal G
VRT
G M
T
T
T
1
ln
ln
ln
ln
/ 5640
1
1000
* 05 . 534
5 . 31 55 . 2
2 1 :
436 . 527
1
186 , 4
* 128
298 * 31 , 8 * 34050
436 . 527 * 12
3
3
2 1
=
=
=
A
=
=
A
=
=
A
=
= A
= =
+ =
+ =
= =
= = A
A
(Fc. 19 -)
- 307 -
ENERGIAS LIBRES
TRATADO DE FISICOQUIMICA LUIS ROMO
11-1 mol de gas ideal se comprime isotrmicamente de 1 a 5 atmosferas a 360 K.
Calcular G.
Datos
n= 1 mol
P
1
= 1atm
P
2
= 5 atm
T= 360 K
R = 0.082
utmL
moIK
= 8.314
Pum3
moIK
0
= nRTln
P2
P1
0
= (1) (8.314) (360)ln
S
1
0
= 4817.39 J
0
= 1150.88 cal.
11-2Asumiendo que el agua es un liquido incomprensible, calcular G para 50 cm
3
de
agua a 25 C cuando la presin varia de 1 atmosfera a 100 atmosferas.
Datos
V
1
=50 cm
3 =
50 1u
-3
L = 50 1u
-6
m
3
T= 298 K
P
1
=1 atm = 101325 Pa
P
2
=100 atm = 10132500 Pa
Ju = -SJI + VJP
G = -SAI + VAP
T= 0
T = cte.
V
P
P
2
P
1
V
1
V
2
Grafico : Diagrama P-V Compresin isoterma
- 308 -
G = VAP
G = (50 1u
-6
)( 10132500 101325)
G = 501.56 J
G = 119.824 cal.
11-3 Para la reaccin: H
2
O
(l,-10C)
= H
2
O la presin del vapor del H
2
O
(l)
a -10C es 286,5 Pa
y la del H
2
O
(s)
es 260,0 Pa. Calcular G.
a) Una mol de agua se trnsforma a -10 C de liquido a vapor saturado (286,5 Pa).
G = 0 ya que las dos fases estn en equilibrio.
b) El vapor de agua puede expandirse desde 286,5 Pa hasta 260,0 Pa a -10 C
G = RTln
P2
P1
G = (8.314) (263)ln
260
286.S
0
= -212.235 Jmol
-1
0
= - 51 cal.mol
-1
11-3. La entropa del O
2
A 25C es 205.14 JK
-1
mol
-1
siendo Gf= 0, Calcular G
f
y S
f
a 100 atmosferas.
Datos
Sf
O2
= 205.14 Jmol
-1
Gf = 0
P= 100 atm
Gf= ?
Sf=?
ACI = ACI +RTln P (Ec. 4-1)
AC = +8. 314 - 298. 15 ln (1)
u = B -TS
(Ec. 24-2)
Gf= 11415.38 Jmol
-1
- 309 -
S = -
(u -B)
T
S = -
(1141S.S8 -u)
298.1S
11-4. Dada la reaccin: 2SO
2 (g)
+ O
2 (g)
= 2SO
3 (g)
calcular G y A y determinar
la reaccin espontnea.
Tabla 25-1: Energas libres y entalpas de formacin (KJmol
-1
)
Gf Hf
SO
3 (g)
-370.4 -395.8
O
2 (g)
0 0
SO
2 (g
-300.4 -296.8
Au = _Au piouuctos -_Au ieactivos (Ec.
25-1)
u = |2(u S0
3
)] -|(2u +u0
2
)]
u = 2 (-S7u.4) - (2(Suu.4) + u )
Au < u REACI0N ESP0NTANEA
AB = _ piouuctos -_AB ieactivos (Ec. 5-2)
B = |2(B S0
3
)] -|(2B +B0
2
)]
AB = 2(S9S.8) - 2 (296.8)
AS =
AH
T
(Ec. 5-3)
S =
-1S8S.2
298.1S
Sf= -3829 JK
-1
mol
-1
G = -140 KJmol
-1
H= -1385.2 KJmol
-1
- 310 -
A0 = AB -nRT (Ec. 25-4)
A0 = -1S8S.2 -2(2 -(2 +1)) - 8.S14 - 298.1S
0 = -1S8S.2 +2478.8
AA = A0 -TAS (Ec. 5-5)
A = 1u9S.6 -298.1S - -4.6S
11-5. Derivar las ecuaciones de Gibbs y Helmholtz
a) Ecuacin de Gibbs G= G (T, P); (G=G (T))
P
( )
( )
( )
( )
( ) | |
2
2
2 2 2
2
1
2
1
2
T
H
T
G
dT
d
P
T
H
T
G
dT
d
T
G
T
H
T
G
T
G
P
dT
d
T
H G
T
G
P
T
H G
S TS H siG
S
T
G
P
T
G
T
G
P
T T
G
dT
d
dT
T
G
dG
T
T
GdT TdG
T
G
d
A
=
A
=
(
|
.
|
\
|
=
=
c
c
= =
=
c
c
c
c
= |
.
|
\
|
=
= |
.
|
\
|
S= -165 KJ mol
-1
U= 1093.6 KJmol
-1
A= 2479.9 Kmol
-1
(Ec.6-1)
(Ec. 6-2)
- 311 -
b) Ecuacin de Helmholtz
( )
( )
( )
( )
( )
( ) | |
2
2
2 2 2
2
1
2
1
2
T
U
T
A
dT
d
P
T
U
T
A
dT
d
T
A
T
U
T
A
T
A
P
dT
d
T
U A
T
A
V
T
U A
S TS U siA
S
T
A
V
T
A
T
A
P
T T
A
dT
d
dT
T
A
dA
T
T
AdT TdA
T
A
d
V
A
=
A
=
(
|
.
|
\
|
=
=
c
c
= =
=
c
c
c
c
= |
.
|
\
|
=
=
PODEMOS ESCRIBIR QUE:
| |
)
`
= |
.
|
\
|
|
.
|
\
|
=
(
= |
.
|
\
|
= = |
.
|
\
|
=
|
.
|
\
|
)
1
(
1 1
1
2
2
2
1
2
T
d H
T
G
d
T
dT
H
T
G
d
T T dT
d
T
dT
T d
T
d Si
T
H
dT
T
G
d
(Ec. 6-4)
(Ec. 6-5)
(Ec. 6-6)
(Ec. 6-7)
- 312 -
H=178.3 KJ
U
T
d
T
A
d
Helmholtz
para
amente An
H
T
d
T
G
d
H
t
d
T
G
d
T
Hd
T
G
d
A =
|
.
|
\
|
|
.
|
\
| A
A =
|
.
|
\
|
|
.
|
\
| A
=
|
.
|
\
|
|
.
|
\
|
|
.
|
\
|
= |
.
|
\
|
1
log
1
1
1
11-6. Para la reaccin:
CaCO
3
(x) - CaO(g) + CO
2
(g)
Calcular: H; U; A y G
A, enKJ / mul
CO
2
(g) -393. 5
CaO(g) + -35. 1
CaCO
3
(x) -12. 9
Fuente: Tratado de Fisicoqumica
AC, enKJ / mul
CO
2
(g) -394. 38
CaO(g) + -4. 2
CaCO
3
(x) -1128. 8
Fuente: Tratado de Fisicoqumica
AB = _vi ABpouuctos -_viABieactivos (Ec. 7.1)
H= -635.1 + (-693.5)-(-1206.9)
Au = _vi Aupouuctos -_viAuieactivos (Ec. 7.2)
(Ec. 6-8)
(Ec. 6-9)
- 313 -
AA = -229.9 KJ
A0 = -17S.82K}
AS = u.16K}
A0 = 1Su.22 KJ mol
-1
Au = -6u4.2 -S94.S8 -(-1128.8)
AC = AB -TAS (Ec. 7.3)
AS =
AB -Au
T
AS =
178.3-130.22
298.15
AA = A0 -TAS ( Ec.
7.4)
A0 = AB -PAv (Ec. 7.5
A0 = AB -AnRT (Ec. 7.6)
A0 = 178.S -2.4788
AA = -17S.82 -48.u8
11-7. Para la reaccin:
1
2
C|
2
(g) - C| (g), se tienen los siguientes datos:
T, K G , K cal mol -1
100
1000
3000
27.53
15.55
-13.49
- 314 -
H= 28.87
Calcular H y S a cada temperatura
AH = [
0AC T
01/T
p
(Ec.8.1)
1T 0.01 0.001 0.003
GT 0.2753 0.0155 -4.496- 1
-3
AS =
AH-Au
1
(Ec.8.2)
AS =
28.87 -27.SS
1uu
AS = 1S.4col mol
AS =
28.87 -1S.SS
1uuu
AS = 1S.S2col mol
AS =
28.87 -(-1S.49)
Suuu
AS = 14.12col mol
GT
1T
H= 28.87
- 315 -
AA = -14S.72 K}
Au = -1Su.6u2 K}
11-8. Para la reaccin: CO(g) + 3H
2
(g) - CH
4
(g) + H
2
O(g) , Calcular G y A a
25C
AC, en KJ / mul
H
2
O(g) -237. 192
CH
4
(g) -5. 79
CO(g) -137. 27
Fuente: Tratado de Fisicoqumica
AH, en KJ / mul
H
2
O(g) -241. 82
CH
4
(g) -74. 9
CO(g) -11. 5
Fuente: Tratado de Fisicoqumica
Au = _vi Au pouuctos -_vi Au ieactivos Ec 28.1
Au = -2S7.192 +(-Su.79) -(-1S7.S8))
AA = A0 -TAS Ec 28.2
AA = A0 -An RT
AB = _vi AB pouuctos -_vi AB ieactivos Ec 28.3
AB = -74.9 +(-241.82) -(-11u.S)
AB = -2u6.2K}
Au = AB -TAS Ec 28.4
AS =
AB -Au
T
AS =
-206.2+150.602
298.15
}
AS = -u.18 K} / K
A0 = AB -AnRT Ec 28.5
A0 = -2u6.2 +4.96
A0 = -2u1.S K}
AA = -2u1.S +(298.1S)(u.18)
- 316 -
ESPONTANIEDAD Y EQUILIBRIO
FISICOQUIMICA GILBERT CASTELLAN
12-1.Usando la ecuacin de Van der Waals y la ecuacin termodinmica de estado
calcular [
0U
0u
T
= [
0P
0T
F
-P para un gas un Van der Waals.
Aplicando la ecuacin termodinmica de estado:
[
0
v
1
= I [
P
1
v
-P (1)
Y la ecuacin de Van der Waals:
P =
RI
I -b
-
o
I
2
(2)
Si se deriva con respecto a la temperatura la ecuacin (2) queda:
_
op
oI
]
v
=
R
I -b
Sustituyendo en (1)
_
ou
oI
]
1
=
IR
I -b
- P
Y remplazando P segn Van der Waals finalmente se obtiene
_
ou
oI
]
1
=
IR
I -b
-
IR
I -b
+
o
I
2
12-2. Por las propiedades puramente matemticas de la diferencial exacta
dU = CudT +_
0U
0F
]
T
dF
Demostrar que si [
0U
0F
T
es funcin solo de volumen, entonces Cv solo es
funcin de la temperatura.
_
ou
oI
]
1
=
o
I
2
- 317 -
Tenemos la diferencial exacta:
Ju = C:JI +g(I)JI (1)
Aplicando la regla de derivadas cruzadas en (1)
[
C
v
1
= [
g(v)
1
v
(2)
Dado que g(V) esta en funcin solamente del volumen tenemos que:
_
og(I)
oI
]
v
= u
Por lo tanto:
Con lo cual se evidencia que Cv no es funcin del volumen, solo de la
temperatura.
12-3. Mediante integracin de la diferencial total dU para un gas de Van der
Waals, demostrar que si C, es una constante U
= U +CT -
a
F
, donde U es
una constante de integracin (es necesaria la respuesta del problema 10-1.)
Sabemos que la diferencial de U es:
dU= CdT + [
0
v
1
dV (1)
Utilizando la ecuacin:
_
ou
oI
]
1
=
o
I
2
(2)
Remplazando la ecuacin (2) en la ecuacin (1)
dU= CdT +
u
v
2
dV
Al integrar
J0 = CJT +
u
v
2
Jv
_
oC:
oI
]
1
= u
- 318 -
12-4. Calcular U para la expansin isotrmica de un mol de gas de Van der Waals
desde 20 lt/mol hasta 80 lt/mol; si a = 1,39 lt
2
atm.mol
-2
(heptano).
Del ejercicio (10-1) obtenemos la ecuacin:
ou
oI
=
o
2
(1)
Ju
2
1
=
o
2
v2
v1
JI
Au = o _
1
2
-
1
1
_
Sustituyendo datos para el Nitrgeno:
Au = 1,S9
lt
2
otm
mol
2
_
1
2u
-
1
8u
_
mol
lt
Au =0,05212
It utm
moI
Sustituyendo datos para el heptano:
Au = S1,S
lt
2
otm
mol
2
_
1
2u
-
1
8u
_
mol
lt
12-5. Integrando la ecuacin [
0A
0F
T
= - P deducir una expresin para la funcin
trabajo de un gas ideal.
La ecuacin
[
0A
0F
T
= - P (1)
U = CT -
u
v
+ U
Au =1,1812
It utm
moI
- 319 -
Sabiendo que la ecuacin para el gas ideal es:
P =
RI
I
(2)
Remplazando (2) en (1)
[
0A
0F
T
= -
R1
v
dA =
-R1
v
dV
JA
A
A
0
= A - A
0
=
dV
v
v
v
0
dV
v
v
v
0
= - RT (ln V- ln RT)
= - RT ln V + RT ln RT
Sabemos que:
A = A
0
- RT ln V + RT ln RT
A = f (T) RT ln V
Tomando en la ecuacin (10-23) el reciproco de ambos miembros, obtenemos
Con esta ecuacin y la relacin cclica entre V, T y S demostrar que
(oSoI)
v
12-6. a)Hallar el valor de [
dS
dV
T
para el gas de Van der Waals.
b) Deducir una expresin para la variacin de entropa en la expansin
isotrmico de un mol de gas de Van der Waals desde V
1
hasta V
2.
a) De la ecuacin fundamental Ju = IJS - pJI
_
ou
oI
]
1
= I _
oS
oI
]
1
-p (1)
(oSoI)
v
= - (oIoI)
s
- 320 -
_
oS
oI
]
1
=
1
I
_
ou
oI
]
1
+
p
I
(2)
_
oS
oI
]
1
=
o
I
2
+
p
I
(S)
_
oS
oI
]
1
=
R
I -b
(4)
b) Para hallar la variacin de entropa integrare la ecuacin (4)
JS
2
1
=
R
I - b
J:
v
2
v
1
AS = RIn(I -b)
v1
v2
Esta ecuacin nos dar la variacin de entropa para una expansin isotrmica de
un gas de Van der Waals.
12-7. Tomando en la ecuacin (10-23) el reciproco de ambos miembros, obtenemos
[
0S
0p
u
= -[
0F
0T
x
.
Con esta ecuacin y la relacin cclica entre V,T y S demostrar que [
0S
0p
u
=
Cu
uT
.
Con la relacin cclica de V,T y S tenemos:
_
oI
oI
]
S
_
oI
oS
]
v
_
oS
oI
]
1
= -1
Despejando [
v
1
S
tenemos:
AS = RIn
I
2
-b
I
1
-b
- 321 -
_
oI
oI
]
S
=
-1
[
oI
oS
v
[
oS
oI
1
Hallamos [
1
S
v
y [
S
v
1
para poder sustituir:
De la ecuacin (9-44) hallamos [
1
S
v
:
_
oS
oI
]
v
=
C:
I
_
oI
oS
]
v
=
I
C:
Por las relaciones de Maxwell tenemos:
_
oS
oI
]
1
=
o
[
Reemplazando tenemos:
_
oI
oI
]
S
=
-1
I
C:
x
o
[
=
[C:
I
Por las relaciones de Maxwell tenemos:
12-8. a) Expresar la ecuacin termodinmica de estado para una sustancia que
cumple con la ley de Joule.
Para que una sustancia cumpla la ley de Joule tiene que cumplirse:
_
ou
oI
] = u
Utilizando la ecuacin (10-27) tenemos
_
oS
op
]
v
=
[C:
I
- 322 -
_
ou
oI
] = I _
oS
oI
]
1
-p = u
I _
oS
oI
]
1
= p
Con las relaciones de Maxwell
_
oS
oI
]
1
= _
op
oI
]
v
Reemplazando:
12-9 En una primera aproximacin el factor de compresibilidad del gas de Van
der Waals est dado por
PF
RT
= 1 +[h -
a
RT
_
P
RT
]
Calcular la fugacidad de Van der Waals
In = InP +
(Z -1)
P
P
0
JP
In = InP +
PIRI -oPRIRI
P
P
0
JP
In = InP +
I
RI
P
0
JP -
o
RIRI
JP
P
0
I [
p
1
v
= p
In = InP +[b -
o
RI
_
P
RI
]
- 323 -
12-10. Por la definicin de fugacidad y la ecuacin de Gibbs-Helmholtz, demostrar
que la entalpia molar para un gas real est relacionada con la entalpia
molar de un gas ideal mediante:
= -RT
2
_
dLnI
dT
]
p
(1)
La ecuacin de Gibbs-Helmholtz es:
_
o(
0
I
)
oI
_
p
= -
E
I
2
(2)
Para un gas real tenemos:
p = p +RIIn (S)
np = np +nRIIn (4)
np=G (5)
0 = 0 +nRIIn (6)
0
I
=
0
I
+nRIn (7)
Hallando la derivada de G/T con respecto a T tenemos:
_
o(
0
I
)
oI
_
p
= -
0
I
2
+nR _
oIn
oI
]
p
(8)
Reemplazando (2) en (8):
-
E
I
2
= -
0
I
2
+nR _
oIn
oI
]
p
(9)
Entalpia molar para un gas real.
E = 0 -nRI
2
_
oIn
oI
]
p
(1u)
- 324 -
Para un gas ideal tenemos:
p = p +RIInp (11)
0 = 0 +nRIInp (12)
0
I
=
0
I
+nRInp (1S)
Derivando:
_
o(
0
I
)
oI
_
p
= -
0
I
2
+nR _
oIn
oI
]
p
(14)
_
oIn
oI
]
p
= u (1S)
-
E
I
2
= -
0
I
2
E = 0 (16)
Sustituyendo (16) en (10)
12-11. Combinando los resultados de los problemas 10-9 y 10-10 demostrar que la
entalpia de un gas de Van der Waals es:
H = H
u
+_h -
2a
RT
]
P
Del problema 10-9 tenemos:
In = Inp +[b -
o
RI
[
p
RI
Derivamos con respecto a T es:
E = E - RT
2
_
oLnf
oT
]
p
- 325 -
_
oIn
oI
]
P
=
-bp
RI
2
+
2op
R
2
I
3
Sustituyendo esta expresin en el resultado del problema 10-10 alcanzamos:
E = E
o
-RI
2
_
-bp
RI
2
+
2op
R
2
I
3
_
12-12. a) Demostrar que la ecuacin (10-28) p = T[
0p
0T
u
-[
0U
0F
T
(1)
Se puede expresar en la forma [
0U
0F
T
= T
2
j
0(pT)
0T
[
F
= -j
0(pT)
0(1T)
[
F
_
ou
oI
]
1
= I _
op
oI
]
-p (1)
Jcri:oJo Jc
P
I
o I = ctc _
o
oI
[
p
I
_
v
=
-p
I
2
+
1
I
_
op
oI
]
v
(2o)
I
2
_
o(pI)
oI
_
v
= -p +I _
op
oI
]
v
(2b)
iguolo (1)con (2b) _
ou
oI
]
1
= I
2
_
o [
p
I
oI
_
v
(S)
J _
1
I
] =
-1
I
2
JI (4o)
JI = -I
2
J _
1
I
] (4b)
(4b)cn (S) [
0
v
1
= I
2
j
(p1)
1
[
v
=
1
2
1
2
j
(p1)
(11)
[
E = E
o
+_b -
2op
RI
_
P
_
ou
oI
]
1
= I
2
_
o(pI)
oI
_
v
= -_
o(pI)
o(1I)
_
v
- 326 -
b) Demostrar que la ecuacin (10-30) F = T[
0F
0T
P
+[
0H
0p
T
(1)
Se puede expresar en la forma [
0H
0p
T
= -T
2
j
0(FT)
0T
[
P
= j
0(FT)
0(1T)
[
P
_
oE
op
]
1
= I -I _
oI
oI
]
P
(1)
Jcri:oJo Jc
I
I
o P = ctc _
o
oI
_
I
I
]_
P
=
-I
I
2
+
1
I
_
oI
oI
]
P
(2o)
-I
2
_
o(II)
oI
_
P
= I -I _
oI
oI
]
P
= _
oE
op
]
1
(2b)
JI = -I
2
J _
1
I
] (S)
(S)cn (2b) [
H
p
1
= -I
2
j
(v1)
1
[
P
=
-1
2
-1
2
j
(v1)
(11)
[
P
12.15. Dado dU = C
u
dT +j
(uT-p)
[ dF(1),
Demostrar que dU = |C
u
+(TFu
2
) -pFu]dT +F(p -Tu)dp
V=V(T,P)
JI = _
oI
oI
]
P
JI +_
oI
oP
]
1
JP(2)
o =
1
I
_
oI
oI
]
P
(S)
[ = -
1
I
_
oI
oP
]
1
(4)
(S) y (4)cn (2) JI = oI JI -[I JP(S)
_
oE
op
]
1
= -I
2
_
o(II)
oI
_
P
= _
o(II)
o(1I)
_
P
- 327 -
(S)cn (1) Ju = C
JI +_
(oI -[p)
[
_ (oI JI -[I JP) (6)
rcsol:icnJo (6)
12-17. Usando los valores aproximados del factor de compresibilidad dados en el
problema 10-9, demostrar que para un gas de van der Waals:
a) C
p
-C
u
= R +2aPRT
2
Z =
p v
RI
= 1 +jb -
o
RI
[
RI
p
(1)
C
p
-C
= _P +_
ou
oI
]
1
_ _
oI
oI
]
P
(2)
Ju = C
JI +_
(oI -[p)
[
_ JI(S)
(S) I = ctc, Jt = u _
Ju
JI
]
1
=
oI
[
-P(So)
_P +_
Ju
JI
]
1
_ =
o
[
I(Sb)
o =
1
I
_
oI
oI
]
P
(4)
Rcsol:icnJo (1)
v=
RI
P
+b -
o
RI
(So)
(So)Jcri:o con rcspccto o oI y P = ctc _
o v
oI
]
P
=
R
P
+
o
RI
2
(Sb)
(Sb) cn (4) o =
R
PI
+
o
RII
2
(6)
Ju = _C
+_
IIo
2
[
_ -pIo_ JI +I(p[ -Io)Jp
- 328 -
[ = -
1
I
_
oI
oP
]
1
(7)
(So) Jcri:o con rcspccto oP o I = ctc _
oI
oP
]
1
=
-RI
P
2
(Sc)
(Sc)cn (7)[ =
RI
P
2
I
(8)
(6)y (8) cn (Sb)
o
[
I =
(R
2
I
2
+oP)PRI
2
I
RIP
2
I
= P +
oP
2
R
2
I
2
(9)
(9)y (Sb)cn (2)C
p
-C
= _P +
oP
2
R
2
I
2
__
R
P
+
o
RI
2
] (1u)
b) (0U0P)
T
= -aRT
JE = _C
+_
IIo
2
[
_ -pIo_ JI +I(p[ - Io)Jp(1o)
A T=cte
[
d0
dP
1
= I(p[ -Io)(1b)
o =
R
PI
+
o
RII
2
(2)
[ =
RI
P
2
I
(S)
(2)y(S)cn (1b) _
Ju
JP
]
1
= I _
PRI
P
2
I
-
RI
PI
-
oI
RI
2
I
] (4)
C
p
-C
= R +
2oP
RI
2
_
Ju
JP
]
1
=
-o
RI
- 329 -
c) (0U0T)
P
= C
u
+aPRT
2
Ju = _C
+_
IIo
2
[
_ -pIo_ JI +I(p[ - Io)Jp (1o)
(1a) A P=cte
Ju = _C
+_
IIo
2
[
_ -pIo_ JI(1b)
o =
R
PI
+
o
RII
2
(2)
[ =
RI
P
2
I
(S)
rcsol:icnJo (2)y (S)
o
2
[
=
R
II
+
2oP
RI
3
I
+
o
2
P
2
R
3
I
5
I
(4o)
IIo
2
[
= R +
2oP
RI
2
+
o
2
P
2
R
3
I
4
(4b)
-PIo = -R -
oP
RI
2
(4c)
(4b)y (4c)cn (1b) _
ou
oI
]
P
= C
+R +
2oP
RI
2
+
o
2
P
2
R
3
I
4
-R -
oP
RI
2
12-18. Sabiendo que dS = (C
P
T) dT -FudP(1), demostrar que:
a) (0S0P)
F
= C
u
Tu
T=T(V,P)
JI = _
oI
oI
]
P
JI +_
oI
oP
]
v
JP(2o)
(1) A V=cte
_
ou
oI
]
P
= C
+
oP
RI
2
- 330 -
JI = _
oI
oP
]
v
JP(2b)
(2b)cn (1) JS =
C
P
I
_
oI
oP
]
v
JP -IoJP(So)
Jcri:o con rcspccto oS o I = ctc _
oS
oP
]
v
=
C
P
I
_
oI
oP
]
v
-Io(Sb)
_
oI
oP
]
v
=
[
(4)
(4)cn (Sb) _
oS
oP
]
v
=
C
P
[
I
-v (S)
C
P
[ = C
v
[ +IIo
2
(6)
(6)cn (S) _
oS
oP
]
v
=
C
v
[ +IIo
2
I
-v
b) (0S0F)
P
= C
P
TFu
JS =
C
P
I
JI(1)
T=T(V,P)
JI = _
oI
oI
]
P
JI +_
oI
oP
]
v
JP(2o)
P=cte
JI = _
oI
oI
]
P
JI(2b)
(2b)cn (1) JS =
C
P
I
_
oI
oI
]
P
JI(So)
_
oS
oI
]
P
=
C
P
I
_
oI
oI
]
P
(Sb)
_
oS
oP
]
v
=
C
v
[
I
- 331 -
moxwcll - _
oS
oP
]
1
= _
oI
oI
]
P
_
oS
oP
]
1
=
1
I
_
oE
oP
]
1
-
I
I
(4)
_
oE
oP
]
1
= I(1- I)(S)
(S)cn (4) _
oS
oP
]
1
=
I
I
(1- I) -
I
I
= -I (6)
c) -[
1
F
[
0F
0P
S
= y
JonJc y =
C
P
C
(1)
S=cte. JS = u
C
P
I
JI -IoJP = u(2o)
C
P
I
JI = IoJP(2b)
T=T (V, P)
JI = [
1
v
P
JI +[
1
P
v
JP(S)
(2b) en (3)
C
P
I
_
oI
oI
]
P
JI +
C
P
I
_
oI
oP
]
v
JP = IoJP(4)
(4)oP _
oI
oP
]
S
=
[Io -
C
P
I
[
oI
oP
C
P
I
[
oI
oI
P
(S)
_
oI
oP
]
v
=
[
(6)
_
oS
oI
]
P
=
C
P
II
- 332 -
_
oI
oI
]
P
=
1
I
(7)
(6) (7)cn (S) _
oI
oP
]
S
=
I -C
P
[Io
C
P
II
=
I
2
Io
2
C
P
-[I(8)
IIo
2
= [C
P
-[C
v
(9)
(9)cn (8) _
oI
oP
]
S
=
I([C
P
-[C
v
)
C
P
-[I = -I[
C
v
C
P
(1u)
(1)en (10)
-_
1
I
] _
oI
oP
]
S
= [y
- 333 -
ANEXOS
CAPACIDADES CALORFICAS A PRESIN CONSTANTE EN FUNCIN DE
TEMPERATURA
Fuente: http://aplicaciones.virtual.unal.edu.co/drupal/files/capacidad.pdf
BIBLIOGRAFA:
- 334 -
DANIELS F. ALBERTY R., Fisicoqumica, Traduccin de la Segunda Edicin en
Ingls, Compaa Editorial Continental,S.A., Mxico 22, D.F., 1965
- 335 -
INTEGRANTES
Das könnte Ihnen auch gefallen
- Ejercicios Catellan TERMINADODokument96 SeitenEjercicios Catellan TERMINADOgeova83% (6)
- Tarea 01 Parte 1 Unidad 03 - Estela - Castellan Cap 10 Resuelto PDFDokument23 SeitenTarea 01 Parte 1 Unidad 03 - Estela - Castellan Cap 10 Resuelto PDFEdgard Estela AlencastreNoch keine Bewertungen
- Tarea 4 Presión de Vapor de Sustancias Puras (Asiv)Dokument22 SeitenTarea 4 Presión de Vapor de Sustancias Puras (Asiv)Andrea Sarahi Izquiy V83% (6)
- Problemas BuenossDokument10 SeitenProblemas BuenossMoyCoral67% (6)
- Un Mol de Gas Ideal Se Comprime Adiabáticamente en Una Sola Etapa Con Una Presión Constante de Oposición Igual A 10 AtmDokument4 SeitenUn Mol de Gas Ideal Se Comprime Adiabáticamente en Una Sola Etapa Con Una Presión Constante de Oposición Igual A 10 AtmMarbel Zures86% (7)
- Capitulo IIIDokument5 SeitenCapitulo IIIBrian Antonio Cornelio Trejo100% (1)
- Fisico SolucionariosDokument337 SeitenFisico SolucionariosEnedina100% (1)
- 3er Parcial Fisicoquimica FinalDokument43 Seiten3er Parcial Fisicoquimica FinalGraciela Ticona Luque67% (3)
- Solucionario Ejercicios de FisicoQuimicaDokument508 SeitenSolucionario Ejercicios de FisicoQuimicaAlvaro Calderon50% (2)
- Solucionario Ejercicios de FisicoQuimica PDFDokument336 SeitenSolucionario Ejercicios de FisicoQuimica PDFMaria100% (3)
- Fisicoquimica EjerciciosDokument13 SeitenFisicoquimica Ejerciciosangel71% (7)
- Ejercicios de Gases Resueltos CastellanDokument71 SeitenEjercicios de Gases Resueltos CastellanAlejandro Sanchez100% (1)
- Ejercicios Resueltos de Equilibrio de FasesDokument12 SeitenEjercicios Resueltos de Equilibrio de FasesCristhianPalaciosNoch keine Bewertungen
- Una Mezcla de Gases Consiste en 320 MG de MetanoDokument3 SeitenUna Mezcla de Gases Consiste en 320 MG de MetanoJuan Carlos Rios Santa100% (1)
- Asiv Tarea 1Dokument9 SeitenAsiv Tarea 1Andrea Sarahi Izquiy VNoch keine Bewertungen
- Termodinamica Problemas 9.20-9.23Dokument6 SeitenTermodinamica Problemas 9.20-9.23Daniela Solorio ValenciaNoch keine Bewertungen
- Solucionario de Castellan Segunda EdicionDokument336 SeitenSolucionario de Castellan Segunda EdicionJulio Cesar Contreras0% (2)
- Densidades LímitesDokument10 SeitenDensidades LímitesXimena Olvera100% (2)
- PROBLEMAS Primera Ley ResueltosDokument5 SeitenPROBLEMAS Primera Ley ResueltosWilder F Huayta VelasquezNoch keine Bewertungen
- Problemas de La Ecuacion de Van Der WaalsDokument2 SeitenProblemas de La Ecuacion de Van Der WaalsEduardo Mariscal0% (1)
- Gasessolucionario de GasesDokument19 SeitenGasessolucionario de GasesCarlos Delafuente100% (1)
- Capitulo II CastellanDokument24 SeitenCapitulo II CastellanLéo AyolNoch keine Bewertungen
- Problemas de Gases Ideales y RealesDokument22 SeitenProblemas de Gases Ideales y RealesMayeli Vasquez RivasNoch keine Bewertungen
- 5 y 6 de FisicoquimicaDokument3 Seiten5 y 6 de FisicoquimicaShirley María Solórzano Pérez100% (1)
- 7.6 Punto Triple So2Dokument3 Seiten7.6 Punto Triple So2Rive Rosky33% (3)
- Resumen CastellanDokument25 SeitenResumen CastellanCinthia Quisbert Reza100% (1)
- Determinación Del Peso Molecular Del Etanol Por El Metodo de DumasDokument19 SeitenDeterminación Del Peso Molecular Del Etanol Por El Metodo de DumasDemi EstralarNoch keine Bewertungen
- Fisicoquimica Libro PDFDokument336 SeitenFisicoquimica Libro PDFMiguel Huarac100% (1)
- Tablas TermodinamicaDokument26 SeitenTablas TermodinamicaDayker Romero100% (1)
- Metales - Propiedades Quimicas y ToxicidadDokument76 SeitenMetales - Propiedades Quimicas y Toxicidadelias667Noch keine Bewertungen
- Biotecnología Ambiental de Francisco CastilloDokument616 SeitenBiotecnología Ambiental de Francisco Castilloelisa_marie0183% (6)
- Clases Del Curso de Química FísicaDokument43 SeitenClases Del Curso de Química FísicaRobert Cazar100% (4)
- Tarea3 ResoluciónPDFDokument10 SeitenTarea3 ResoluciónPDFDeysi M. Montoya100% (1)
- Ejercicios 1.15-1.16Dokument3 SeitenEjercicios 1.15-1.16Miguel Barrazueta MorilloNoch keine Bewertungen
- Aplicación de La Tercera Ley de La TermodinámicaDokument9 SeitenAplicación de La Tercera Ley de La TermodinámicaJeanette Blacknet TococosiNoch keine Bewertungen
- Tarea4 ResoluciónPDF DMMMDokument5 SeitenTarea4 ResoluciónPDF DMMMDeysi M. MontoyaNoch keine Bewertungen
- Cuertionario Del Tema #6Dokument8 SeitenCuertionario Del Tema #6Roger inturias100% (1)
- FINMALDokument13 SeitenFINMALAlexandraParedesPuertaNoch keine Bewertungen
- CALORIMETRÍA1 Prectica # 4Dokument10 SeitenCALORIMETRÍA1 Prectica # 4Aracely Sierra SoriaNoch keine Bewertungen
- Lab 9 QMC 1206Dokument17 SeitenLab 9 QMC 1206Raquel GomezNoch keine Bewertungen
- Deber Final1Dokument13 SeitenDeber Final1Wilson Guachamin0% (2)
- Cap IDokument20 SeitenCap IBRENDA NICOLE ENCINAS CONDARCO0% (2)
- Determinación Del Peso Molecular de Líquidos Volátiles: Marco Teórico. Ley de Los Gases IdealesDokument7 SeitenDeterminación Del Peso Molecular de Líquidos Volátiles: Marco Teórico. Ley de Los Gases IdealesElvis AguilarNoch keine Bewertungen
- Segunda Unidad Tarea FisicoquimicaDokument12 SeitenSegunda Unidad Tarea FisicoquimicaYoselyn Zapana100% (1)
- FISICO QUIMICA Problemas Resueltos de Gases IdealesDokument6 SeitenFISICO QUIMICA Problemas Resueltos de Gases IdealesSalvador Mantilla83% (6)
- Ejercicios II Unidad ActualizadoDokument9 SeitenEjercicios II Unidad ActualizadoJorge juniorNoch keine Bewertungen
- Deber FisicoDokument23 SeitenDeber FisicoJefferson Paúl AngosNoch keine Bewertungen
- PRACTICA 1 Determinacion de Pesos Moleculares PDFDokument15 SeitenPRACTICA 1 Determinacion de Pesos Moleculares PDFZeugirdor Yddur86% (7)
- Calor de CombustiónDokument4 SeitenCalor de CombustiónNicolás QuispealayaNoch keine Bewertungen
- Fisicoquimica TypeoDokument26 SeitenFisicoquimica TypeoKevin Peredo HidalgoNoch keine Bewertungen
- Fico Segundo DiscoDokument16 SeitenFico Segundo DiscoEstefanny Lizeth Jimenez LipaNoch keine Bewertungen
- Texto de Química I 2021Dokument85 SeitenTexto de Química I 2021Edwin100% (1)
- Problemario Termodinamica Del Equilibrio de FasesDokument9 SeitenProblemario Termodinamica Del Equilibrio de FasesManuel Sebastian Laura MamaniNoch keine Bewertungen
- Fisico SolucionariosDokument391 SeitenFisico Solucionariosnenitalistania100% (1)
- Fisico SolucionariosDokument390 SeitenFisico Solucionariosargentina-2009Noch keine Bewertungen
- Solucionario Ejercicios de FisicoQuimicaDokument507 SeitenSolucionario Ejercicios de FisicoQuimicaalexanderNoch keine Bewertungen
- Solucionario Ejercicios de FisicoQuimicaDokument338 SeitenSolucionario Ejercicios de FisicoQuimicajose perez100% (1)
- Problemas de Aplicación, Gases Reales e IdealesDokument346 SeitenProblemas de Aplicación, Gases Reales e IdealesRICHARD antoni0% (1)
- Tarea Semana 7 Termo Dinamica Marcelo 2021Dokument14 SeitenTarea Semana 7 Termo Dinamica Marcelo 2021Marcelo Martinez AlvarezNoch keine Bewertungen
- FQ Lab 1Dokument10 SeitenFQ Lab 1Aracelly rojasNoch keine Bewertungen
- Tema 18Dokument23 SeitenTema 18quique torresNoch keine Bewertungen
- Practica 3Dokument15 SeitenPractica 3ErikGeovanniNoch keine Bewertungen
- Evaporador de Tubos HorizontalesDokument7 SeitenEvaporador de Tubos HorizontalesJhon Turner86% (7)
- TermodinámicaDokument14 SeitenTermodinámicaJhon TurnerNoch keine Bewertungen
- Examen FT2Dokument1 SeiteExamen FT2Jhon TurnerNoch keine Bewertungen
- Unidad DosDokument7 SeitenUnidad DosJhon TurnerNoch keine Bewertungen
- ADokument1 SeiteAJhon TurnerNoch keine Bewertungen
- Operaciones Unitarias II-Prueba de DiagnóticoDokument6 SeitenOperaciones Unitarias II-Prueba de DiagnóticoJhon TurnerNoch keine Bewertungen
- Modelo Reológico de La SangreDokument8 SeitenModelo Reológico de La SangreJhon TurnerNoch keine Bewertungen
- Relaciones TermodinamicasDokument30 SeitenRelaciones TermodinamicaszviceNoch keine Bewertungen
- Modelo Reológico de La SangreDokument8 SeitenModelo Reológico de La SangreJhon TurnerNoch keine Bewertungen
- Evaporador de Tubos HorizontalesDokument7 SeitenEvaporador de Tubos HorizontalesJhon Turner86% (7)
- Efectos de Los Hongos AlucinògenosDokument9 SeitenEfectos de Los Hongos AlucinògenosJhon TurnerNoch keine Bewertungen
- 333 Era Un Buen NúmeroDokument1 Seite333 Era Un Buen NúmeroJhon TurnerNoch keine Bewertungen
- Exposición Generación de EnergíaDokument3 SeitenExposición Generación de EnergíaJhon TurnerNoch keine Bewertungen
- Evaporador de Tubos HorizontalesDokument7 SeitenEvaporador de Tubos HorizontalesJhon Turner86% (7)
- Reacciones de Precipitación y TitulacionesDokument6 SeitenReacciones de Precipitación y TitulacionesJhon TurnerNoch keine Bewertungen
- ParabenosDokument2 SeitenParabenosJhon Turner100% (1)
- Electroforesis ExposiciónDokument3 SeitenElectroforesis ExposiciónJhon TurnerNoch keine Bewertungen
- Examen FT2Dokument1 SeiteExamen FT2Jhon TurnerNoch keine Bewertungen
- Libro Rojo de FenomenosDokument411 SeitenLibro Rojo de FenomenosVictor De Luque100% (3)
- Apéndice IDokument23 SeitenApéndice IJhon TurnerNoch keine Bewertungen
- Gráfica de La Polinómica Del AIREDokument1 SeiteGráfica de La Polinómica Del AIREJhon TurnerNoch keine Bewertungen
- Informe DesinfectantesDokument8 SeitenInforme DesinfectantesYarlein JulioNoch keine Bewertungen
- 2.muestras Toxicologicas 2020Dokument21 Seiten2.muestras Toxicologicas 2020Saul Foronda EscaleraNoch keine Bewertungen
- Antifungicos y AntiviralesDokument18 SeitenAntifungicos y AntiviralesWilliam Oscar Lopez PerezNoch keine Bewertungen
- Lista de Reactivos LaceDokument14 SeitenLista de Reactivos LaceAldo GNoch keine Bewertungen
- Banco de Preguntas Hindara Rivas QuimicaDokument2 SeitenBanco de Preguntas Hindara Rivas QuimicaSaidimar MenesesNoch keine Bewertungen
- Examen Recuperatorio Pet 216 TeoricoDokument2 SeitenExamen Recuperatorio Pet 216 TeoricoCesar AlvarezNoch keine Bewertungen
- Antiagregantes PlaquetariosDokument18 SeitenAntiagregantes PlaquetariosmarcoNoch keine Bewertungen
- Especificaciones Técnicas Sanitarias y ElectricasDokument178 SeitenEspecificaciones Técnicas Sanitarias y Electricasfredy_huaranga100% (3)
- Alimentos ContaminadosDokument5 SeitenAlimentos ContaminadosAnonymous 9pXo6FNoch keine Bewertungen
- Practica 1. Capacidad Amortiguadora de Soluciones Buffer y Valoración Ácido Base de Un AminoácidoDokument11 SeitenPractica 1. Capacidad Amortiguadora de Soluciones Buffer y Valoración Ácido Base de Un AminoácidoFranci GuerrónNoch keine Bewertungen
- Unidad II ... q1 ActividadesDokument21 SeitenUnidad II ... q1 ActividadesDavid MontañezNoch keine Bewertungen
- Identificación de Carbohidratos, Lípidos y Proteínas (Trabajo Experimental #1)Dokument9 SeitenIdentificación de Carbohidratos, Lípidos y Proteínas (Trabajo Experimental #1)Olga ArreazaNoch keine Bewertungen
- Etapas de La Produccion de LecheDokument86 SeitenEtapas de La Produccion de LecheCintia Arroyo80% (30)
- Informe - VidriosDokument53 SeitenInforme - VidriosMIRIAN ESTHER ROJAS LOZANONoch keine Bewertungen
- Fichatecnica 7425854 Dertrase (Pomada 40 G)Dokument3 SeitenFichatecnica 7425854 Dertrase (Pomada 40 G)Miguel VegaNoch keine Bewertungen
- LACTONASDokument11 SeitenLACTONASShirley UlloaNoch keine Bewertungen
- S01.s1. MaterialDokument37 SeitenS01.s1. Materialjosue garciaNoch keine Bewertungen
- Producción de Pulpa SemiquímicaDokument14 SeitenProducción de Pulpa SemiquímicayazlyNoch keine Bewertungen
- Fundición CentrífugaDokument23 SeitenFundición CentrífugaIvan Ortiz100% (1)
- Tema 6. Ácidos NucleicosDokument12 SeitenTema 6. Ácidos NucleicosSantiNoch keine Bewertungen
- Placa de FloculcionDokument2 SeitenPlaca de FloculcionDaniela Valencia CanoNoch keine Bewertungen
- RuibarboDokument6 SeitenRuibarboStephanie MahechaNoch keine Bewertungen
- Practica Estadistica 2Dokument5 SeitenPractica Estadistica 2MARIA MARTHA VALERO YAHUITA0% (1)
- Informe 4 TermodinamicaDokument6 SeitenInforme 4 TermodinamicaYhani Daniela Parra DiazNoch keine Bewertungen
- Competencia Científica - ESO2Dokument20 SeitenCompetencia Científica - ESO2Deimer Zurita GilNoch keine Bewertungen
- CAOLINDokument18 SeitenCAOLINAndres LaraNoch keine Bewertungen
- Procedimiento de Trabajo Asfalto (Reparado)Dokument12 SeitenProcedimiento de Trabajo Asfalto (Reparado)luzclarita24Noch keine Bewertungen
- AMINA FUERTE Ficha Tecnica RevDokument2 SeitenAMINA FUERTE Ficha Tecnica RevSaul BrambilaNoch keine Bewertungen
- Métodos de Conservación de AlimentosDokument4 SeitenMétodos de Conservación de AlimentosAngel Tapia100% (1)