Beruflich Dokumente
Kultur Dokumente
Golgi
Hochgeladen von
Henry Rayme RaymeOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Golgi
Hochgeladen von
Henry Rayme RaymeCopyright:
Verfügbare Formate
MODIFICACION Y TRANSPORTE DE
LAS PROTEINAS:
2.- EL APARATO DE GOLGI
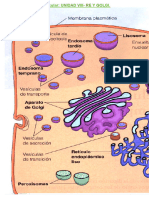
El aparato de Golgi (AG) es un orgánulo localizado cerca del núcleo, y está
formado por agrupaciones de vesículas esféricas o aplanadas, llamadas cisternas (Figura
1). Cada conjunto de cisternas con forma discoidal forma una estructura que recuerda a
un montón de platos apilados, y recibe el nombre de dictiosoma. Un dictiosoma típico
contiene unas 6 cisternas con un diámetro de alrededor de 1 µm. Según el tipo de célula,
el número de dictiosomas por célula varía desde unos pocos hasta varios cientos.
Asociadas a los dictiosomas se encuentran numerosas vesículas que emergen de sus
cisternas o que se funden con ellas.
El AG sirve de unión entre el retículo endoplásmico (RE) y la membrana
plasmática o de otros orgánulos (Figura 2). Una proteína típica recién sintetizada reside
en el RE durante unos 10 minutos. Unicamente las proteínas que están correctamente
plegadas pueden entrar en las vesículas de transporte que las llevan al AG para
completar su maduración. Las que no se han plegado correctamente permanecen en el RE
donde acaban por ser degradadas por proteínas especializadas. Las proteínas que
transportan estas vesículas se localizan en su interior (si van a ser secretadas), o
integradas en su membrana (si son proteínas de membrana). Las vesículas de transporte
se dirigen hacia el AG, donde por medio de fenómenos de fusión de membranas
descargan sus contenidos o aportan sus proteínas de membrana. Estos procesos de fusión
permiten, por un lado que las proteínas de secreción nunca estén en contacto con el
citosol, y por otro, que las proteínas de membrana conserven su topología.
Todas las células eucariotas tienen AG. Muchos tipos de moléculas atraviesan el
AG durante alguna etapa de su biosíntesis: proteínas de secreción, de membrana,
glicoproteínas, proteoglicanos, glicolípidos y en plantas, materiales de la pared celular.
Durante este recorrido, la proteína puede sufrir una o varias modificaciones como
pueden ser: alteración de las cadenas laterales de sus AA, la adición o eliminación de
azúcares, ruptura proteolítica, formación de puentes disulfuro, sulfatación, adición de
ácidos grasos o la formación de complejos con otras proteínas. El AG no sólo es
fundamental en las últimas etapas de la síntesis de muchas proteínas, sino que también
coordina el tráfico intracelular, dirigiendo las macromoléculas a su destino final. En
células secretoras el AG también sirve para concentrar y almacenar los productos en las
llamadas vesículas de secreción que sólo vaciarán sus contenidos en el exterior cuando
reciban el estímulo apropiado (Figura 3).
El AG posee tres regiones funcionales: (1) las vesículas alargadas próximas al RE
forman la cara cis del AG, (2) las vesículas de la zona intermedia constituyen la cara
media del AG y (3) las vesículas que estan en la periferia forman la cara trans y el
retículo trans-Golgi. Las vesículas de transporte que se dirigen hacia la cara cis del
aparato de Golgi descargan sus contenidos o aportan sus proteínas de membrana. Las
proteínas siguen su curso hacia la cara trans del AG, donde entran en contacto con el
complejo entramado vesicular del retículo trans-Golgi. Es en este punto donde se realiza
la distribución de cada proteína hacia su punto de destino. A partir de aquí, las proteínas
pueden (1) incorporarse a una vesícula de secreción, (2) ser enviadas hacia el lisosoma u
otros orgánulos, o (3) ser secretadas (Figura 4).
GLICOSILACION DE PROTEINAS EN EL AG
La modificación mas frecuente en el AG es la glicosilación. En eucariotas, los
oligosacáridos se clasifican en dos tipos: Los del tipo O, y los del tipo N. Ambos tipos
difieren tanto en su estructura como en su composición. Los oligosacáridos del tipo O se
unen al oxígeno del grupo hidroxilo (OH) de los AA serina, treonina o tirosina. Sus
cadenas de oligosacáridos son cortas (1-4 residuos), y contienen principalmente galactosa
y N-acetilgalactosamina. Los del tipo N se unen al nitrogeno del AA asparagina. Forman
largas cadenas de oligosácaridos (>5 residuos) y es la N-acetilglucosamina la que se une
a la asparagina, siendo además ricas en manosa. Los azúcares del tipo N forman diversos
tipos de estructuras, y su composición es variable.
Los primeros pasos de la N-glicosilación tienen lugar en el RE donde el
oligosacárido precursor se une a la proteína. Después, en el AG cada oligosacárido va
adquiriendo su forma característica. Hay dos tipos de oligosacáridos de tipo N: los de
alto contenido en manosa y los complejos (Figura 5). Los primeros sólo tienen manosa
y N-acetilglucosamina, y los complejos también tienen galactosa, ácido siálico (que les
da carga negativa) y fucosa. Ambos tipos pueden coexistir en la misma glicoproteína.
Las glicoproteínas que abandonan el RE sufren posteriores modificaciones en sus
cadenas de oligosacáridos a medida que atraviesan el AG hacia su destino final. Los
residuos de azúcar se van añadiendo de uno en uno, y se requiere energía. Cada paso está
catalizado por una glicosil-transferasa distinta. Estos enzimas son proteínas integrales de
la membrana, con el centro activo orientado hacia el interior AG. El proceso se completa
unos diez minutos antes de que la proteína alcance su destino definitivo en la célula.
La O-glicosilación es un proceso que tiene lugar exclusivamente en el AG. Este
proceso también está catalizado por una serie de glicosil-transferasas que añaden los
residuos de azúcar de uno en uno al grupo OH de serina, treonina o tirosina. En general,
el primer azúcar que se une a la proteína es la N-acetilgalactosamina. De esta forma se
sintetizan en el AG los proteoglicanos, que son las proteínas más intensamente
glicosiladas que se conocen. Los proteoglicanos pueden secretarse para fomar parte de la
matriz extracelular, o pueden aparecer en forma de proteínas integrales de la membrana.
Además, en combinación con otras proteínas altamente glicosiladas componen las
mucosas que recubren y protegen muchos epitelios. Gran parte de los residuos de azúcar
de los proteoglicanos están sulfatados, de forma que presentan gran número de cargas
negativas.
MADURACION DE PROTEINAS DE SECRECION Y DE MEMBRANA
Hemos visto que las proteínas de secreción y de membrana pierden la secuencia
señal N-terminal durante su síntesis. En muchos casos, este paso es el único necesario
para que la proteína adquiera su forma activa. Sin embargo, otras proteínas de secreción
se sintetizan en la forma proproteína o prohormona, que es un intermediario inactivo
de vida media larga. Durante las fases finales del proceso de maduración este precursor
se convierte en la forma activa por proteolisis. Este es el caso de las proteínas del suero
(albúmina) o de hormonas (insulina, glucagón). El fragmento del precursor que se corta
puede estar bien en uno de los extremos de la proteína (como en la proalbúmina), bien en
el interior de la cadena polipeptídica (como en la proinsulina o en el proglucagón). La
conversión de proinsulina en insulina tiene lugar en las vesículas de secreción recién
formadas. El pH de estas vesículas es ácido (pH=5.5). En estas condiciones la insulina
no se une a su receptor y por lo tanto no actúa sobre la célula que la está sintetizando.
En algunos casos, el enzima del lisosoma se sintetiza como una forma inactiva,
llamada proenzima. La ruptura proteolítica de la proenzima resulta en la formación de la
forma activa del enzima. Este corte tiene lugar, generalmente, en la vesícula ácida o en el
lisosoma. De esta forma la célula se protege de la actividad hidrolítica de estos enzimas
antes de que lleguen a su destino.
ENVIO DE LAS PROTEINAS A SU PUNTO DE
DESTINO
Cada uno de los orgánulos de la célula (RE, AG, membrana plasmática, lisosoma,
vesículas de secreción) tienen su propio conjunto de enzimas necesarios para su
funcionamiento correcto. Las proteínas destinadas a cada uno de estos orgánulos se
sintetizan en el RE rugoso y son transportadas a su destino mediante vesículas de
transporte. Las células eucariotas presentan gran cantidad de pequeñas vesículas
asociadas al AG, algunas de las cuales presentan un revestimiento de clatrina. El AG
parece ser el principal director del tráfico de macromoléculas en la célula. ¿Cómo son
capaces de determinar a qué orgánulo se dirigen?
ENVIO DE PROTEINAS AL LISOSOMA
Los enzimas de los lisosomas se ecumulan en el RE después de su síntesis y se
unen a un oligosacárido de tipo N, como cualquier proteína de secreción (Figura 6). En la
cara cis del AG, uno o más de los residuos de manosa del oligosacárido se fosforila.
Parece ser que el residuo de manosa fosforilado es la señal química que dirige la
proteína al lisosoma. Este proceso requiere dos enzimas. La primera es la N-
acetilglucosamina fosfotransferasa, que reconoce con gran precisión aquéllas proteínas
destinadas al lisosoma, y que transfiere un grupo N-acetilglucosamina-fosfato al carbono
6 de uno o más residuos de manosa. El segundo enzima es una fosfodiesterasa, que
elimina el grupo N-acetilglucosamina, dejando al fosfato unido a la manosa. En el
interior del retículo trans-Golgi hay un receptor de manosa-6-fosfato que se une a la
manosa-6-fosfato de las proteínas lisosomales y las dirige a su destino. Las zonas de la
membrana que contienen este receptor unido a la proteína emergen del AG en forma de
vesículas forradas de clatrina, que tras perder el revestimiento de clatrina fusionan con
unas vesículas ácidas, cuyo interior tiene un pH=5. A pH ácido, el receptor de manosa-6-
fosfato se disocia del enzima que lleva asociado, y ésta se vuelve soluble en el interior de
la vesícula ácida, donde además, por medio de la acción de las fosfatasas, pierde su grupo
fosfato, de forma que ya no puede volver a unirse al receptor. Al mismo tiempo, se
forman unas vesículas forradas que contienen el receptor, y que se desprenden de la
vesícula ácida para reciclarse (es un proceso similar al de endocitosis mediada por
receptor, donde intervenían las vesículas CURL).
El papel de la ruta de la manosa-6-fosfato en el envío de proteínas al lisosoma se
descubrió en pacientes con la enfermedad de las células I. En estas personas, un defecto
genético provoca la ausencia de muchos enzimas lisosomales en fibroblastos y
macrófagos, de forma que se acumulan en el interior de la célula gran cantidad de
residuos tóxicos. Los fibroblastos de estos enfermos contienen grandes vesículas
intracelulares repletas de glicolípidos y de componentes extracelulares que normalmente
serían degradados por los lisosomas. Las células de estas personas sintetizan enzimas
lisosomales normalmente, y en la membrana del AG hay receptores de manosa-6-fosfato.
Sin embargo, el primer enzima implicado en la fosforilación de la manosa está ausente, y
los enzimas hidrolíticos son secretados en lugar de enviados al lisosoma. Si se cultivan
estas células en un medio que contiene enzimas lisosomales con la manosa fosforilada,
estos enzimas son internalizados por endocitosis mediada por receptor, y el contenido del
lisosoma se vuelve normal.
ENVIO DE PROTEINAS A LAS VACUOLAS
Las vacuolas de plantas y de algunos microorganismos como las levaduras se
parecen al lisosoma porque contienen enzimas hidrolíticos. Los precursores de estas
enzimas se sintetizan en el RE y atraviesan el AG donde se distribuyen en vesículas
destinadas a las vacuolas. El envío de estos enzimas a las vacuolas no requiere la
modificación de sus carbohidratos. En su lugar, los precursores de estos enzimas se
seleccionan mediante el reconocimiento de una secuencia de AA de 50-100 AA de
longitud. Una vez en el interior de la vacuola esta secuencia se separa del precursor,
originando la proteína activa. Si por ingienería genética se suprime esta secuencia del
precursor de la proteína, ésta será excretada. Si a una proteína de secreción se le añade
esta secuencia, se dirigirá hacia la vacuola. Por tanto, esta secuencia contiene la
información necesaria para dirigir una proteína hacia la vacuola. En ausencia de esta
información, la proteína se excreta.
ENVIO DE PROTEINAS A LAS VESICULAS DE SECRECION
Las vesículas de transporte que van a fusionarse con la membrana plasmática
emergen de forma continuada del AG. Las proteínas de membrana y los lípidos de estas
vesículas proporcionan los nuevos materiales para la membrana, mientras que las
proteínas solubles son excretadas. Esta ruta constituye la secreción constitutiva, y tiene
lugar en todas las células eucariotas (Figura 7).
Hay, sin embargo, células especializadas donde la secreción tiene lugar en
respuesta a un estímulo extracelular. Se trata, por tanto, de una secreción regulada
(Figura 7). En ellas las proteínas de secreción se concentran y almacenan en vesículas de
secreción, de donde serán secretadas por exocitosis en respuesta a un estímulo. La señal
que dirige a las proteínas de secreción hacia las vesículas de secreción no está clara, pero
parece que está determinada por su propia secuencia. Las vesículas de secreción emergen
del retículo trans Golgi. En su formación interviene la clatrina, en un mecanismo muy
parecido al de endocitosis mediada por receptor. La superficie de las vesículas que se
están formando están revestidas de clatrina. Este revestimiento se pierde una vez formada
la vesícula. Además, en aquellos casos en que la célula está polarizada (como las células
epiteliales), las vesículas de secreción pueden dirigirse específicamente bien hacia la
membrana apical o bien hacia la membrana basolateral.
En muchos casos, las vesículas forradas , además de clatrina poseen un
polipéptido más pequeño que se asocia a otras proteínas integrales de la membrana de la
vesícula. Estas proteínas accesorias deben tener una doble función. En primer lugar,
proporcionan por el lado no citosólico de la membrana un centro de unión para la
proteína específica que vaya a transportar. En segundo lugar, dado que cada vesícula se
dirige hacia un orgánulo distinto de la célula, debe haber varias poblaciones de vesículas,
cada una con una proteína accesoria adecuada en su superficie, que posteriormente puede
ser reconocida por un receptor localizado en la superficie del orgánulo receptor. Las
vesículas forrradas pueden ser las responsables de la distribución de los componentes
celulares (Figura 8).
EL CASO DE UN VIRUS
En algunos casos, el ciclo vital de un virus se aprovecha de las diversas rutas que
dirigen el tráfico de proteínas en la célula. El virus del Semliki forest (Figura 9) está
formado por una molécula de ARN rodeada de una cápsida icosaédrica (de 20 caras)
formada por múltiples copias de una proteína llamada proteína C. El conjunto del ARN
más la cápsida de proteína C se llama nucleocápsida. La nucleocápsida, a su vez, está
rodeada de la envoltura, una bicapa lipídica en la que se insertan 3 glicoproteínas (E1,
E2 y E3). Estas glicoproteínas atraviesan la bicapa e interaccionan con la proteína C.
La infección comienza cuando el virus se une al receptor de la membrana
plasmática de la célula huésped. Esta unión dispara los mecanismos de endocitosis
mediada por receptor: se forman hendiduras forradas que se convierten en vesículas
forradas, que cuando pierden su revestimiento de clatrina forman los endosomas. En este
punto, los endosomas, en vez de fusionarse con los lisosomas, fusionan con la bicapa del
virus, de forma que el ARN del virus penetra en el citoplasma y aprovecha la maquinaria
celular para (1) sintetizar múltiplas copias del ARN y (2) sintetizar las 4 proteínas
distintas que componen el virus.
Las proteínas de la cápsida y de la envoltura siguen rutas distintas (Figura 10).
Las proteínas de la envoltura se sintetizan en ribosomas asociados a las membranas del
retículo endoplásmico (RE). Estas proteínas se insertan en la membrana del RE donde
son glicosiladas y transportadas posteriormente al AG para su posterior maduración. A
partir de aquí, son enviadas a la membrana plasmática. La proteína de la cápsida se
sintetiza en los ribosomas del citosol, y se asocian al ARN para formar nuevas
nucleocápsidas. Las nucleocápsidas interaccionan con las glicoproteínas de la envoltura
al nivel de la membrana plasmática, de manera que se forma una nueva partícula vírica
que emerge de la superficie de la célula huésped, arrastrando con ella parte de la bicapa.
RECICLADO DE LA MEMBRANA
Cuando la vesícula de secreción se funde con la membrana plasmática, no sólo se
descargan sus contenidos en el exterior, sino que la membrana de la vesícula queda
incorporada a la plasmática. Como la superficie de la membrana plasmática es más o
menos constante, algunos de sus componentes deben ser retirados (reciclados) a una
velocidad aproximadamente igual a la de exocitosis (Figura 11). Podemos considerar las
vesículas de transporte como sistemas transportadores de ida y vuelta. Por un lado
descargan sus contenidos mediante fusión con la membrana de destino, y después se
desprenden (vaciadas de su contenido) para volver a fundirse con el orgánulo de donde
proceden.
Este mecanismo se ha podido evidenciar en la llamada unión neuromuscular,
que es el lugar donde se une una terminación nerviosa a una célula muscular (Figura 12).
La zona terminal del axón nervioso contiene cientos de vesículas de unos 50 nm de
diámetro que contienen acetilcolina (un neurotransmisor). Al ser estimulado el nervio,
estas vesículas se funden con la membrana plasmática, liberando la acetilcolina
(exocitosis), y provocando la contracción del músculo adyacente. Después del estímulo,
se produce la exocitosis. La fusión de las vesículas con la membrana plasmática se
produce únicamente en las llamadas "zonas activas" de la membrana, que están limitadas
entre dos hileras de partículas intramembranosas. En los segundos posteriores a la fusión
se puede observar que las proteínas de la membrana de la vesícula se van mezclando con
las de la membrana plasmática por fenómenos de difusión lateral. Unos 10 segundos
después de la estimulación, aparecen numerosas hendiduras forradas en la membrana
plasmática, a las cuales se asocian partículas intramembranales. A los 20 segundos puede
observarse la formación de vesículas forradas a partir de las hendiduras forradas
(endocitosis), que contienen los componentes proteicos originales de la vesícula de
transporte. A continuación, la vesícula forrada pierde su revestimiento de clatrina y se
vuelven a rellenar de acetilcolina para comenzar un nuevo ciclo.
Das könnte Ihnen auch gefallen
- Aparato de GolgiDokument12 SeitenAparato de GolgiAurelia Gonzales CalleNoch keine Bewertungen
- Aparato de Golgi. LisosomasDokument37 SeitenAparato de Golgi. LisosomasAlexa RodríguezNoch keine Bewertungen
- Aparato de GolgiDokument34 SeitenAparato de GolgiMoisés J. Duran CanevaroNoch keine Bewertungen
- Aparato de GolgiDokument4 SeitenAparato de Golgipaz_saavedra_3100% (1)
- VII. Aparato de GolgiDokument12 SeitenVII. Aparato de GolgiKevin JoseNoch keine Bewertungen
- VII. Aparato de GolgiDokument12 SeitenVII. Aparato de GolgiKevin JoseNoch keine Bewertungen
- Aparato de GolgiDokument12 SeitenAparato de Golgiceciliaperez9751Noch keine Bewertungen
- Vacuolas JJJJJJJJJJJDokument8 SeitenVacuolas JJJJJJJJJJJmiguelon21Noch keine Bewertungen
- Aparato de GolgiDokument4 SeitenAparato de GolgiANDY MAURICIO YAGUANA SARITAMANoch keine Bewertungen
- El Aparato de Golgi Se Encarga de La Distribución y El Envío de Los Productos Químicos de La CélulaDokument10 SeitenEl Aparato de Golgi Se Encarga de La Distribución y El Envío de Los Productos Químicos de La CélulaN̛a͠g͞e̴r̕ M̕e͏d͠i͟na̛Noch keine Bewertungen
- Aparato de Golgi, Lisosomas y PeroxisomasDokument46 SeitenAparato de Golgi, Lisosomas y PeroxisomasYennifer Lizeth Ignación LeónNoch keine Bewertungen
- Reti CuloDokument4 SeitenReti CuloJesusNoch keine Bewertungen
- GolgiDokument8 SeitenGolgiAnnaNoch keine Bewertungen
- GUIA DE RETÍCULO Y GOLGI TerminadaDokument7 SeitenGUIA DE RETÍCULO Y GOLGI TerminadaAndrea Ramás100% (5)
- Unidad 5 BioDokument7 SeitenUnidad 5 Biomolina.ailen99Noch keine Bewertungen
- Organelos PDFDokument72 SeitenOrganelos PDFVictor CarpioNoch keine Bewertungen
- Sistema de EndomembranasDokument35 SeitenSistema de EndomembranasMaria Paula Quintero TamayoNoch keine Bewertungen
- Sistema de EndomembranasDokument4 SeitenSistema de EndomembranasJosephGabrielNoch keine Bewertungen
- Informe Re GolgiDokument7 SeitenInforme Re GolgienriqueNoch keine Bewertungen
- García 5Dokument14 SeitenGarcía 5Guadalupe GarciaNoch keine Bewertungen
- Re, Golgi, Lisosoma, Peroxisoma, MitocondriaDokument118 SeitenRe, Golgi, Lisosoma, Peroxisoma, MitocondriaJosselin Saavedra LópezNoch keine Bewertungen
- Unidad 2Dokument41 SeitenUnidad 2Matias VillagranNoch keine Bewertungen
- Taller Sistema de EndomenbranasDokument8 SeitenTaller Sistema de EndomenbranasSandra Milena Forigua CastiblancoNoch keine Bewertungen
- Tema 5Dokument9 SeitenTema 5Irene Pulido SerranoNoch keine Bewertungen
- Complejo de Golgi UsacDokument21 SeitenComplejo de Golgi UsacKatherin CanoNoch keine Bewertungen
- Seminario Lisosomas CarpetaDokument11 SeitenSeminario Lisosomas CarpetaLourdesCorreaB100% (1)
- Guia Paiep GolgiDokument11 SeitenGuia Paiep GolgiSusy FeliNoch keine Bewertungen
- LISOSOMASDokument7 SeitenLISOSOMASDIEGO FERNANDO SANCHEZ DAVANNoch keine Bewertungen
- 20.retículo Endoplasmico RugosoDokument22 Seiten20.retículo Endoplasmico RugosoNadia SanchezNoch keine Bewertungen
- Citología Parcial 2Dokument58 SeitenCitología Parcial 2Aroa SilvaNoch keine Bewertungen
- Sistema de Endomembranas 363014 Downloable 1758018Dokument9 SeitenSistema de Endomembranas 363014 Downloable 1758018Dayana BarahonaNoch keine Bewertungen
- Qué Es El Retículo Endoplasmático RugosoDokument2 SeitenQué Es El Retículo Endoplasmático RugosoLAURA MELISSA PEREZ CACERESNoch keine Bewertungen
- Taller EndomembranasDokument9 SeitenTaller EndomembranasPatty Lopez0% (1)
- Resumen Endomembranas 01Dokument3 SeitenResumen Endomembranas 01joaquinlugo47Noch keine Bewertungen
- Lección Complejo de GolgiDokument11 SeitenLección Complejo de GolgiMPaz VelaNoch keine Bewertungen
- Biología Re y GolgiDokument6 SeitenBiología Re y GolgiNabila InsfranNoch keine Bewertungen
- POLISACARIDODokument6 SeitenPOLISACARIDOGino RodriguezNoch keine Bewertungen
- SVC Biología 08Dokument7 SeitenSVC Biología 08Ptricia OliverosNoch keine Bewertungen
- 8.sistemas Membranosos de La Célula EucariotaDokument9 Seiten8.sistemas Membranosos de La Célula EucariotaAntony VillamarNoch keine Bewertungen
- Resolucion Guia 4 - Ayudantias DBIO1070Dokument11 SeitenResolucion Guia 4 - Ayudantias DBIO1070MarianaNoch keine Bewertungen
- Aparato de Golgi Lisosomas y VacuolasDokument43 SeitenAparato de Golgi Lisosomas y VacuolasscribdenesimoNoch keine Bewertungen
- Tema 6 AcabadoDokument13 SeitenTema 6 AcabadoMagdalena Oñate SerranoNoch keine Bewertungen
- Taller de BiologiaDokument10 SeitenTaller de BiologiaYuveidys Chamorro VergaraNoch keine Bewertungen
- Biologia Grupo 1Dokument34 SeitenBiologia Grupo 1ana maria galloza garciaNoch keine Bewertungen
- PeroxisomaDokument7 SeitenPeroxisomaDelia Sirpa BautistaNoch keine Bewertungen
- SEMDokument11 SeitenSEMjulissagonzalezzuritaNoch keine Bewertungen
- Vesículas de Transporte o de TransiciónDokument4 SeitenVesículas de Transporte o de TransiciónÁlex Willan Acuña SilvaNoch keine Bewertungen
- Taller 2. Biologia Celular y MolecularDokument7 SeitenTaller 2. Biologia Celular y MolecularMARIA LUCIA PIESCHACÓN CHUZCANONoch keine Bewertungen
- Biologia Celular Banco de Preguntas FinalDokument14 SeitenBiologia Celular Banco de Preguntas Finalcharit martinez ñomaNoch keine Bewertungen
- Aparato de Golgi O9Dokument7 SeitenAparato de Golgi O9Rosenildo Dariz Dos Santos100% (1)
- Cont 3Dokument3 SeitenCont 3ABIGAIL ESPINOZANoch keine Bewertungen
- Resumen BiologiaDokument4 SeitenResumen BiologiaImanol VillenazNoch keine Bewertungen
- MEMBRANA. ExposicionDokument16 SeitenMEMBRANA. ExposicionJuan PabloNoch keine Bewertungen
- Sistema de EndomenbranasDokument25 SeitenSistema de Endomenbranaselmedico2013Noch keine Bewertungen
- Capítulo IV - Adhesión Celular, Uniones Celular y Matriz ExtracelularDokument12 SeitenCapítulo IV - Adhesión Celular, Uniones Celular y Matriz ExtracelularFederico Rivadeneira CornejoNoch keine Bewertungen
- Aparato de GolgiDokument30 SeitenAparato de GolgiGeorge Robles Morales100% (1)
- Aparato de GolgiDokument9 SeitenAparato de GolgiSebastián TamayoNoch keine Bewertungen
- 7-5 Heterosacaridoscomplejos GlicoproteinasDokument26 Seiten7-5 Heterosacaridoscomplejos GlicoproteinascristhianDRBNoch keine Bewertungen
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Von EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Noch keine Bewertungen
- Acceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012Von EverandAcceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012Noch keine Bewertungen
- Bioquimica Bibliografia 2020Dokument327 SeitenBioquimica Bibliografia 2020Maximiliano Di SantoNoch keine Bewertungen
- Problemas de EnzimologíaDokument26 SeitenProblemas de EnzimologíaJoskua MalfavonNoch keine Bewertungen
- Informe Esther 2022 Enero 17Dokument8 SeitenInforme Esther 2022 Enero 17Jorge VelásquezNoch keine Bewertungen
- Secuenciación de ProteínasDokument13 SeitenSecuenciación de ProteínasManuel A. VelazNoch keine Bewertungen
- Preguntas de BiologiaDokument4 SeitenPreguntas de BiologiaWILDER ORTIZ TELLO CANTUTA PROCASENoch keine Bewertungen
- Resumen InsulinaDokument5 SeitenResumen InsulinaGenek DiazNoch keine Bewertungen
- Auno Banco 3 de OrdinarioDokument9 SeitenAuno Banco 3 de OrdinarioGustavo Huaman VilchezNoch keine Bewertungen
- Catálogo DermourityDokument68 SeitenCatálogo DermourityBotica CuidadoNoch keine Bewertungen
- Biologia Celular - Clase 03Dokument68 SeitenBiologia Celular - Clase 03api-3701781Noch keine Bewertungen
- Monografia Micronutrientes 1Dokument15 SeitenMonografia Micronutrientes 1Marcela Navarro0% (1)
- 05 ReplicacionDokument39 Seiten05 ReplicacionRafaela AcostaNoch keine Bewertungen
- Cuestionario de Repaso Acidos NucelicosDokument4 SeitenCuestionario de Repaso Acidos NucelicosYorlen VillaNoch keine Bewertungen
- Crucigrama LípidosDokument2 SeitenCrucigrama LípidosVanessa BarrantesNoch keine Bewertungen
- Fisiología Capítulo 7Dokument4 SeitenFisiología Capítulo 7yolyNoch keine Bewertungen
- Preguntas CtaDokument6 SeitenPreguntas CtaMerariAfNoch keine Bewertungen
- Absorcion NutrientesDokument19 SeitenAbsorcion Nutrientesdeybi_torresNoch keine Bewertungen
- Trabajo Vitamina CDokument8 SeitenTrabajo Vitamina CCristhian Martín pascualNoch keine Bewertungen
- Beta Oxidacion de Acidos GrasosDokument3 SeitenBeta Oxidacion de Acidos GrasosJesus Gael Lopez RamirezNoch keine Bewertungen
- PCR ResumenDokument1 SeitePCR ResumenAndy ZcNoch keine Bewertungen
- ProteinasDokument42 SeitenProteinasLiz AvalosNoch keine Bewertungen
- 15 - Transcripcion - 1Dokument1 Seite15 - Transcripcion - 1Alberto Sanchez de la Campa RodriguezNoch keine Bewertungen
- Exposicion Ciclo de KrebsDokument6 SeitenExposicion Ciclo de KrebsJesús Rafael Salazar MendozaNoch keine Bewertungen
- Resume NDokument5 SeitenResume NLeandro ChampariniNoch keine Bewertungen
- Taller Nº2 Metabolismo de CarbohidratosDokument12 SeitenTaller Nº2 Metabolismo de CarbohidratosAldair MedinaNoch keine Bewertungen
- Sintesis de ProteinasDokument6 SeitenSintesis de ProteinasLuz Michelle RiveraNoch keine Bewertungen
- Tema Fosforilación OxidativaDokument34 SeitenTema Fosforilación OxidativaMIRIAM MARTÍN SALESNoch keine Bewertungen
- Practica LaboratirioDokument5 SeitenPractica LaboratirioKristina ErazoNoch keine Bewertungen
- Bio. (04) Repaso 04 Respiración Celular - Fotosíntesis 26-10-20Dokument4 SeitenBio. (04) Repaso 04 Respiración Celular - Fotosíntesis 26-10-20Naidelin vanesa Arteaga BurgosNoch keine Bewertungen
- 1.2. Degradación de AminoácidossDokument32 Seiten1.2. Degradación de AminoácidossJesusEnrikeSerranoNoch keine Bewertungen
- REQUERIMIENTOS NUTRICIONALES-resumenDokument9 SeitenREQUERIMIENTOS NUTRICIONALES-resumenSEBASTIÁN IGNACIO OLIVARESNoch keine Bewertungen