Beruflich Dokumente
Kultur Dokumente
Propriedades Coligativas
Hochgeladen von
Maurício PaixãoCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Propriedades Coligativas
Hochgeladen von
Maurício PaixãoCopyright:
Verfügbare Formate
Prof.
Fbio Alexandre Assunto: Propriedades Coligativas Definio: Propriedades Coligativas; Presso mxima de vapor; Presso mxima de vapor e o ponto e ebulio; Diagrama de fases
PROPRIEDADES COLIGATIVAS So propriedades que independem da natureza das substncias, mas dependem do nmero de partculas presentes de um soluto no voltil na soluo. As propriedades coligativas s dependem do numero de partculas e no da sua natureza.. Quando adicionamos um soluto no voltil a um solvente, a soluo obtida apresenta propriedades diferentes do solvente puro, as quais so denominadas propriedades coligativas. So elas: 1. 2. 3. 4. Tonoscopia ou tonometria; Ebulioscopia ou ebuliometria; Crioscopia ou criometria; Presso osmtica. gua(l) gua(v) lcool(l) lcool(v) ter(l) ter(v)
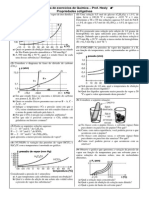
Presso Mxima Vapor (P) a 20C 17,5 mmHg 44 mmHg 442 mmHg
de
Lquidos diferentes, numa mesma temperatura, apresentam diferentes presses mximas de vapor, ento podemos concluir nesta tabela que o ter o mais voltil, pois apresenta a maior presso mxima de vapor e as suas interaes intermoleculares devem ser as mais fracas, enquanto a gua deve possuir as interaes intermoleculares mais fortes e sendo assim a substancia menos voltil. A presso mxima depende da temperatura da experincia e da natureza do liquido. Lquidos diferentes do origem a curvas diferentes; Lquidos mais volteis que a gua tero curvas acima da curva da gua. Quando se dissolve um soluto no voltil em um liquido, a presso mxima de vapores do liquido diminui, conseqentemente a soluo fica rebaixada em relao do liquido puro. A uma mesma temperatura lquido diferentes apresentam diferentes presses mximas de vapor. A presso mxima de vapor de um lquido aumenta com a elevao da temperatura. A presso mxima de vapor e o ponto de ebulio Um liquido ferve temperatura na qual a presso mxima de vapor se iguala a presso exercida sobre a sua superfcie, ou seja, a presso atmosfrica.
E-mail: fabioalexandre71@yahoo.com.br
Esses fenmenos podem ser explicados pelas interaes que ocorrem entre as partculas do soluto e as molculas do solvente, estas interaes dificultam a passagem do solvente para o estado de vapor, assim como o seu congelamento. Presso Mxima de Vapor A presso Mxima de Vapor de um lquido a presso exercida por seus vapores quando estes esto em equilbrio com a fase lquida e de vapor numa dada temperatura.
A temperatura constante, a concentrao das molculas no estado de vapor no varia com o tempo. E assim a presso exercida pelo vapor sobre o lquido permanece constante.
Observe a tabela:
www.fabioalexandre.pro.br
Ponto de ebulio normal aquele que ocorre ao nvel do mar, ou seja, presso atmosfrica de 1 atm(760mmHg). Quanto maior a altitude menor a presso atmosfrica, sendo assim em locais acima do nvel do mar a gua ferve a uma temperatura menor que 100C, uma conseqncia imediata deste fenmeno que os alimentos precisam de mais tempo para serem cozidos. Diagrama de Fases o grfico que demonstra as condies sob as quais uma fase pode ser transformada em outra. Os trs estados fsicos podem coexistir em equilbrio, em certas condies de presso e temperatura, chamada ponto triplo.
Exerccios 01. (Unicamp-SP) Observe o diagrama de fases do dixido de carbono, a baixo:. Considere uma amostra de dixido de carbono a 1 atm de presso e temperatura de 50 C e descreva o que se observa quando, mantendo a temperatura constante, a presso aumentada lentamente at
10 atm. Cada uma dessas curvas indica as condies de presso e temperatura nas quais duas fases esto em equilbrio. Diagrama de fases da gua. 02. (UFPI) O ponto de ebulio a temperatura na qual: a) a substncia comea a passar do estado lquido para o gasoso. b) a presso parcial do vapor do lquido igual do solvente. c) a presso total de vapor do lquido igual do solvente. d) a presso de vapor atinge o valor mximo. e) a presso atmosfrica igual presso de vapor do lquido. Considere o diagrama de fases do dixido de carbono (CO2):
Observe a analise de um diagrama de uma amostra de gua cuja temperatura mantida constante a 0C e a presso sobre uma variao.
Resolva as questes 3 a 7.
E-mail: fabioalexandre71@yahoo.com.br
www.fabioalexandre.pro.br
03. Em que estado fsico se encontra o dixido de carbono nos pontos I, II, III e IV? 04. Quais os estados fsicos presentes nas curvas B A, C A, D A? 05. Indique a temperatura (C) e presso (atm) em que o CO2 existe simultaneamente nos trs estados fsicos e d o nome do ponto indicado pela letra A.
07. (UFRGS-RS) Os pontos normais de ebulio da gua, do etanol e do ter etlico so, respectivamente, 100 C, 78 C e 34 C. Observe as curvas, no grfico, de variao da presso de vapor lquido (Pv) em funo da temperatura (T). As curvas I, II e III correspondem, respectivamente, aos compostos:
06. Por que o CO2 um gs nas condies ambientes? 07. Por que no possvel conservar o CO2 slido em geladeiras ou freezers comuns? 08. (Unisa-SP) A presso de vapor de um lquido puro molecular depende: a) apenas da estrutura de suas molculas. b) apenas da massa especfica do lquido. c) apenas da temperatura do lquido. d) da estrutura de suas molculas e da temperatura do lquido. e) da estrutura de suas molculas e do volume do lquido. 05. (FEI-SP) Aquecendo gua destilada, numa panela aberta e num local onde a presso ambiente 0,92 atm, a temperatura de ebulio da gua: a) ser inferior a 100 C. b) depende da rapidez do aquecimento. c) ser igual a 100 C. d) alcanada quando a presso mxima de vapor saturante for 1 atm. e) ser superior a 100 C. 06. (Fatec-SP) Quando um lquido se encontra em equilbrio com seu vapor, devem-se cumprir as condies temperatura constante: I. no h transferncia de molculas entre o lquido e o vapor. II. a presso de vapor tem um valor nico. III. os processos lquido a vapor e vapor a lquido processam-se com a mesma velocidade. IV. A concentrao do vapor depende do tempo. Quais das seguintes condies so corretas? a) II e III b) I e III c) I, II e III d) II e IV e) I e II
www.fabioalexandre.pro.br
a) ter etlico, etanol e gua. b) etanol, ter etlico e gua. c) gua, etanol e ter etlico. d) ter etlico, gua e etanol. e) gua, ter etlico e etanol. 08.(UFSC) A figura a seguir representa o diagrama de fase da gua. Atravs desse diagrama, podemos obter importantes informaes sobre o equilbrio entre as fases; as linhas presentes representam a coexistncia das fases: slido lquido, lquido vapor e slido vapor. Com base no texto, some os itens corretos.
01. A fase slida a fase mais estvel, na regio I do diagrama. 02. A fase mais estvel, na regio III do diagrama a fase vapor. 04. No ponto B do diagrama, esto em equilbrio as fases slida e vapor. 08. No ponto A, esto em equilbrio as fases slida, lquida e vapor. 16. Na regio II do diagrama, a fase mais estvel a lquida.
E-mail: fabioalexandre71@yahoo.com.br
09. (Unifei-SP) Em um laboratrio qumico, um estudante muito desastrado derrubou ao mesmo tempo dois bqueres, um contendo 5 mL de gua e outro contendo 5 mL de ter. Foi procurar um papel absorvente para enxugar os lquidos e, quando voltou, verificou que a rea onde o ter havia sido derramado estava seca, enquanto ainda havia gua espalhada pela bancada. Este aluno chegou s seguintes concluses sobre o que observou, todas corretas, exceto: a) A gua menos voltil que o ter. b) As interaes intermoleculares do ter so fracas e por isso ele evapora mais rpido. c) A presso de vapor da gua menor que a do ter. d) O ter pega fogo. 10. (Vunesp) Comparando duas panelas, simultaneamente sobre dois queimadores iguais de um mesmo fogo, observa-se que a presso dos gases sobre a gua fervente na panela de presso fechada maior que aquela sobre a gua fervente numa panela aberta. Nessa situao, e se elas contm exatamente as mesmas quantidades de todos os ingredientes, podemos afirmar que, comparando com o que ocorre na panela aberta, o tempo de cozimento na panela de presso fechada ser: a) menor, pois a temperatura de ebulio ser menor. b) menor, pois a temperatura de ebulio ser maior. c) menor, pois a temperatura de ebulio no varia com a presso. d) igual, pois a temperatura de ebulio independe da presso. e) maior, pois a presso ser maior.
www.fabioalexandre.pro.br
E-mail: fabioalexandre71@yahoo.com.br
Prof. Fbio Alexandre Assunto: Propriedades Coligativas Tonoscopia; Ebiloscopia; Crioscopia; Osmose.
A diluio de um solvente no voltil em um solvente provoca: a) Diminuio da presso de vapor do solvente; b) A elevao do ponto de ebulio do solvente; c) O abaixamento do ponto de congelao do solvente. O efeito coligativo a juno da presso osmtica com os efeitos vistos acima. Pois o efeito coligativo s depende do nmero de partculas do soluto dissolvida. Classificao de um Soluto quanto a Natureza do Solvente a) Soluo Molecular Todas partculas dissolvidas so molculas, o soluto no sofre ionizao. Ex. um mol de sacarose (C12H22O11) neste caso temos 6,02. 1023 molculas de sacarose, soluto, ou um total de 6,02. 1023 de partcula do soluto. b) Solues Inicas As partculas presentes na soluo so ons. So resultantes da dissociao de uma substncia inica ou da ionizao de ima substncia molecular.
N de Partculas em Sol. = n partculas dissolvidas . i
O fator de correo pode ser calculado pela expresso: I = 1 + .( q 1) Onde: = grau de ionizao ou dissociao; q = n total de ons liberados na ionizao ou dissociao Tonoscopia ou Tonometria o estudo da diminuio da presso mxima de vapor de um solvente, provocada pela adio de um solvente no voltil. Quanto maior for o numero de partculas do soluto no voltil na soluo, maior ser o abaixamento absoluto da presso mxima de vapor. Este fenmeno ocorre graas a presso mxima de vapor de uma soluo formada por um soluto, no voltil, ser menor que em um solvente puro, pois as interaes entre as partculas do soluto e as molculas do solvente diminuem as sadas destas ultimas. Esquematicamente, podemos representar:
O nmero de partculas de soluto existente na soluo vai depender: Do nmero de ons presentes em cada frmula do composto; Do grau de ionizao ou dissociao deste composto a uma dada temperatura. Fator de Correo de Vant Hoff Permite calcular o numero de partculas em uma soluo inica.
www.fabioalexandre.pro.br
A adio de um soluto no voltil a um dado solvente, provoca a diminuio da presso mxima de vapor. Essa variao (P) denominada abaixamento absoluto da presso mxima de vapor P = P2 P.
E-mail: fabioalexandre71@yahoo.com.br
Lei de Raoult O abaixamento absoluto da presso mxima de vapor (P) igual ao produto da presso mxima de vapor do solvente (P2) e da frao molar do soluto (X1). Matematicamente, temos: P = X1.P2 Outra maneira de calcular relacionando coma molalidade da soluo. te = Elevao da temperatura de Ebulio.
P = Kt W Po
1000m1 W= MM 1.m2
te = te te2 te2 = temperatura de ebulio do solvente puro. te = temperatura de ebulio do solvente na soluo. Crioscopia ou Criometria o estudo da diminuio da temperatura de congelamento de um solvente em uma soluo. Diminuindo a presso de vapor do solvente, devido a adio de um soluto, leva a diminuio da temperatura de congelamento tc = abaixamento congelamento tc = tc2 - tc tc2 = temperatura de congelamento do solvente puro tc = temperatura de congelamento do solvente na soluo. Graficamente, podemos representar o efeito ebulioscopico e crioscopico. da temperatura de
Po a presso mxima de vapor do liquido puro P a presso mxima de vapor da soluo Po P = P o abaixamento absoluto da presso mxima de vapor da soluo
P o abaixamento relativo da presso mxima de P
vapor da soluo Constante Tonoscopica Kt = massa molar do solvente
m2 onde M2 1000
OBS: em solues diludas podemos considerar a molalidade com a molaridade, ento temos
P = Kt Po
Para solues inicas devemos inserir o fator de correo, ento teremos:
P = X1 i P2
P = Xt . i P2
Ebulioscopia ou Ebuliometria
o estudo da ebulio da temperatura de ebulio de um liquido, ocasionada pela dissoluo de um solvente no voltil.
A diminuio da presso mxima de vapor de um solvente pela adio de um soluto, leva a um aumento da temperatura de ebulio
De modo geral, temos:
www.fabioalexandre.pro.br E-mail: fabioalexandre71@yahoo.com.br
Quanto maior o numero de partculas do soluto no voltil na soluo: Maior a elevao da temperatura de ebulio do solvente; Maior o abaixamento da temperatura de congelamento do solvente. Osmose a passagem do solvente para uma soluo ou a passagem do solvente de uma soluo diluda para outra mais concentrada, por meio de uma membrana semi-permeavel.
Presso Osmotica () a presso externa que deve ser aplicada a uma soluo para evitar sua diluio (osmose). Matematicamente, podemos relacionar a presso osmtica () com a molaridade () e a temperatura na escala kelvin. = .R.T onde R = 0,082 atm.L. mol -1.K-1 ou 62,3 mmHg L. mol 1 .K-1
www.fabioalexandre.pro.br
E-mail: fabioalexandre71@yahoo.com.br
Das könnte Ihnen auch gefallen
- Propriedades Coligativas PDFDokument22 SeitenPropriedades Coligativas PDFMichelle PradosNoch keine Bewertungen
- FQ Cap1Dokument10 SeitenFQ Cap1filipelima.graveNoch keine Bewertungen
- Gama - Módulo 43Dokument24 SeitenGama - Módulo 43Gabriel NunesNoch keine Bewertungen
- Pressão máxima de vapor: exercícios sobre dependência da temperaturaDokument24 SeitenPressão máxima de vapor: exercícios sobre dependência da temperaturaGleisonNoch keine Bewertungen
- Apostila Química 3 - Propriedades ColigativasDokument7 SeitenApostila Química 3 - Propriedades ColigativasGeilson SilvaNoch keine Bewertungen
- Propriedades Coligativas I: QuímicaDokument21 SeitenPropriedades Coligativas I: Químicapatricia primonNoch keine Bewertungen
- 1 - Propriedades Das Soluções Ou Propriedades ColigativasDokument22 Seiten1 - Propriedades Das Soluções Ou Propriedades ColigativasAdriana SilvaNoch keine Bewertungen
- Química - Pressão de vapor, diagramas de fases e propriedades coligativasDokument29 SeitenQuímica - Pressão de vapor, diagramas de fases e propriedades coligativasRicardo AlvesNoch keine Bewertungen
- Propriedades Coligativas I: QuímicaDokument21 SeitenPropriedades Coligativas I: QuímicagabrielvictorNoch keine Bewertungen
- Propriedades ColigativasDokument2 SeitenPropriedades ColigativasMayanderson Rodrigues100% (1)
- Efeitos da adição de solutos em soluçõesDokument41 SeitenEfeitos da adição de solutos em soluçõesMatheus MachadoNoch keine Bewertungen
- Pressão de vapor em substâncias e soluçõesDokument38 SeitenPressão de vapor em substâncias e soluçõesThiago Alonso Rodrigues da HoraNoch keine Bewertungen
- Propriedades ColigativasDokument11 SeitenPropriedades Coligativaszenta.angoNoch keine Bewertungen
- Propriedades ColigativasDokument23 SeitenPropriedades ColigativasLeon LuccaNoch keine Bewertungen
- Atividades Propriedades ColigativasDokument4 SeitenAtividades Propriedades ColigativasJocimara MonsaniNoch keine Bewertungen
- Exercícios Sobre Propriedades ColigativasDokument8 SeitenExercícios Sobre Propriedades ColigativasCarlos LiraNoch keine Bewertungen
- Ii Avaliação de Química Tipo (2° Ano) GabaritoDokument2 SeitenIi Avaliação de Química Tipo (2° Ano) GabaritoJoaney SouzaNoch keine Bewertungen
- Química Lista 02 - Propriedades ColigativasDokument14 SeitenQuímica Lista 02 - Propriedades ColigativasHugo CimehrioNoch keine Bewertungen
- Projetopedagogico Tudo É PossívelDokument24 SeitenProjetopedagogico Tudo É Possívelrobson serraNoch keine Bewertungen
- Capítulo 2 - Propriedades ColigativasDokument6 SeitenCapítulo 2 - Propriedades ColigativasGerson LimaNoch keine Bewertungen
- 8 Exercícios-Propriedades Coligativas PDFDokument2 Seiten8 Exercícios-Propriedades Coligativas PDFCarlos Vane0% (1)
- Destilação Fracionada de Água e AcetonaDokument5 SeitenDestilação Fracionada de Água e AcetonaEdu AntunesNoch keine Bewertungen
- Lista Propriedades ColigativasDokument4 SeitenLista Propriedades ColigativasAdriele SchaurichNoch keine Bewertungen
- Propriedades Coligativas 2 AnoDokument31 SeitenPropriedades Coligativas 2 AnoJúnior FerreiraNoch keine Bewertungen
- 41 20propriedades 20coligativas 20IDokument10 Seiten41 20propriedades 20coligativas 20IJanaina LeitinhoNoch keine Bewertungen
- Propriedades Coligativas Soluções Química GeralDokument7 SeitenPropriedades Coligativas Soluções Química GeralIsaias Silva0% (1)
- Exercicios Diagramas de FaseDokument7 SeitenExercicios Diagramas de FaseDário JuniorNoch keine Bewertungen
- Trabalho de Des ColigativasDokument10 SeitenTrabalho de Des ColigativasJorgenilson SandraNoch keine Bewertungen
- Propriedades Físicas de Substâncias e Pontos de FusãoDokument8 SeitenPropriedades Físicas de Substâncias e Pontos de FusãoJ. JúniorNoch keine Bewertungen
- Agregação Da MateriaDokument25 SeitenAgregação Da MateriaIsabela ValençaNoch keine Bewertungen
- Propriedades ColigativasDokument23 SeitenPropriedades ColigativasFábioRobertoBatistaNoch keine Bewertungen
- Propriedades coligativas de soluçõesDokument6 SeitenPropriedades coligativas de soluçõesLucas CamargoNoch keine Bewertungen
- Equilíbrio Químico ExperimentalDokument4 SeitenEquilíbrio Químico ExperimentalWelligton QueirozNoch keine Bewertungen
- Destilação: Processo de Separação por Equilíbrio Líquido-VaporDokument118 SeitenDestilação: Processo de Separação por Equilíbrio Líquido-VaporFabricio Ilidio DiasNoch keine Bewertungen
- Agregação Da MateriaDokument25 SeitenAgregação Da MateriaIsabela ValençaNoch keine Bewertungen
- 7898-2 - PROPRIEDADES COLIGATIVAS - Propriedades ColigativasDokument9 Seiten7898-2 - PROPRIEDADES COLIGATIVAS - Propriedades ColigativasMarcelo GfteamNoch keine Bewertungen
- Determinação da curva de solubilidade do nitrato de potássioDokument6 SeitenDeterminação da curva de solubilidade do nitrato de potássioAquilasNoch keine Bewertungen
- Equilibrio de FasesDokument16 SeitenEquilibrio de FasesCostasoarezNoch keine Bewertungen
- DESTILAÇÃO1Dokument10 SeitenDESTILAÇÃO1Roberta BelazNoch keine Bewertungen
- Exercícios Sobre Propriedades ColigativasDokument8 SeitenExercícios Sobre Propriedades ColigativasProf. Maych Melo QuímicaNoch keine Bewertungen
- PDF - Lista 41 - Propriedades ColigativasDokument4 SeitenPDF - Lista 41 - Propriedades ColigativasLucas AmorimjsNoch keine Bewertungen
- Propriedades coligativas e pressão de vaporDokument21 SeitenPropriedades coligativas e pressão de vaporCleiton ReisNoch keine Bewertungen
- Pressão máxima de vapor: conceito e influência da temperaturaDokument2 SeitenPressão máxima de vapor: conceito e influência da temperaturaCleilton NascimentoNoch keine Bewertungen
- Diagrama de Fases Da ÁguaDokument5 SeitenDiagrama de Fases Da ÁguaJônatan Do Couto PazNoch keine Bewertungen
- Pressão de vapor e temperatura de ebuliçãoDokument3 SeitenPressão de vapor e temperatura de ebuliçãoPEDRO WAGNER sc145955Noch keine Bewertungen
- CriosDokument5 SeitenCriosCarool88Noch keine Bewertungen
- Quimica Propriedades ColigativasDokument15 SeitenQuimica Propriedades ColigativasanaclopesNoch keine Bewertungen
- Lista - Propriedades ColigativasDokument7 SeitenLista - Propriedades ColigativasRicardo GoncalvesNoch keine Bewertungen
- Termodinâmica Substâncias PurasDokument34 SeitenTermodinâmica Substâncias Purasgeorg augustoNoch keine Bewertungen
- O calor e os fenômenos térmicosDokument12 SeitenO calor e os fenômenos térmicosRodrigo RamosNoch keine Bewertungen
- 2sm Quimica Hugo 260320Dokument8 Seiten2sm Quimica Hugo 260320Katia AraujoNoch keine Bewertungen
- Biofísica para ciências biomédicas – 4ª ediçãoVon EverandBiofísica para ciências biomédicas – 4ª ediçãoNoch keine Bewertungen
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteVon EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNoch keine Bewertungen
- Enzimas em produtos de limpezaDokument32 SeitenEnzimas em produtos de limpezaMaurício PaixãoNoch keine Bewertungen
- Roteiro de Aula Cultura MamoeiroDokument15 SeitenRoteiro de Aula Cultura MamoeiroMaurício PaixãoNoch keine Bewertungen
- Questão Discursiva DelegadoDokument1 SeiteQuestão Discursiva DelegadoMaurício PaixãoNoch keine Bewertungen
- Curso1Estatistica CorinaDokument165 SeitenCurso1Estatistica Corinaluiramos0% (1)
- Tutorial CodeblocksDokument44 SeitenTutorial CodeblocksMaurício PaixãoNoch keine Bewertungen
- Cartilha Crimes Eleitorais 2016Dokument32 SeitenCartilha Crimes Eleitorais 2016canidedantasNoch keine Bewertungen
- Questo LODFDokument11 SeitenQuesto LODFMaurício PaixãoNoch keine Bewertungen
- Aprendaprog PythonDokument49 SeitenAprendaprog PythonAilton XavierNoch keine Bewertungen
- Lista 2 - Tópicos em Estatística GenéticaDokument2 SeitenLista 2 - Tópicos em Estatística GenéticaMaurício PaixãoNoch keine Bewertungen
- Biotecnologia Farmaceutica PDFDokument7 SeitenBiotecnologia Farmaceutica PDFMaurício PaixãoNoch keine Bewertungen
- O Livro Dos JubileusDokument68 SeitenO Livro Dos JubileusRômulo SilvaNoch keine Bewertungen
- Western blot: pesquisa e diagnósticoDokument16 SeitenWestern blot: pesquisa e diagnósticoMaurício PaixãoNoch keine Bewertungen
- Distúrbios PlaquetáriosDokument118 SeitenDistúrbios PlaquetáriosMaurício PaixãoNoch keine Bewertungen
- Secretaria de Estado Da Segurança Pública E Da Paz SocialDokument15 SeitenSecretaria de Estado Da Segurança Pública E Da Paz SocialLuiz AraújoNoch keine Bewertungen
- Tradução Ate Galectina 15Dokument20 SeitenTradução Ate Galectina 15Maurício PaixãoNoch keine Bewertungen
- CinDokument1 SeiteCinMaurício PaixãoNoch keine Bewertungen
- Técnicas de análise de DNA e RNA para detecção e sequenciaçãoDokument31 SeitenTécnicas de análise de DNA e RNA para detecção e sequenciaçãoAline CunhaNoch keine Bewertungen
- Lista 1 - Tópicos em Estatística GenéticaDokument2 SeitenLista 1 - Tópicos em Estatística GenéticaMaurício PaixãoNoch keine Bewertungen
- Dinâmica Das EnergiaDokument4 SeitenDinâmica Das EnergiaMaurício PaixãoNoch keine Bewertungen
- Contagem, Probabilidade e EstatísticaDokument68 SeitenContagem, Probabilidade e EstatísticaTemudjin KhanNoch keine Bewertungen
- Provas Consultec Matemática BergDokument19 SeitenProvas Consultec Matemática BergMaurício PaixãoNoch keine Bewertungen
- Manual Brasfoot 2011Dokument7 SeitenManual Brasfoot 2011guedesanapaulaNoch keine Bewertungen
- Propriedades Coligativas - Resolução e Explicação de ExercíciosDokument9 SeitenPropriedades Coligativas - Resolução e Explicação de ExercíciosMaurício PaixãoNoch keine Bewertungen
- Gabarito Prova Amarela ENEM 2012. 1º DiaDokument1 SeiteGabarito Prova Amarela ENEM 2012. 1º DiaLucas HenriqueNoch keine Bewertungen
- Universidade Federal Do Pampa - UNIPAMPA - Equilíbrio QuímicoDokument66 SeitenUniversidade Federal Do Pampa - UNIPAMPA - Equilíbrio QuímicoMaurício PaixãoNoch keine Bewertungen
- Física - Pré-Vestibular Impacto - Resistores Elétricos - Associação em Série IDokument2 SeitenFísica - Pré-Vestibular Impacto - Resistores Elétricos - Associação em Série IFísica Qui70% (10)
- Propriedades Coligativas - Exercícios Com GabaritoDokument17 SeitenPropriedades Coligativas - Exercícios Com GabaritoMaurício Paixão75% (4)
- Química - Pré-Vestibular Impacto - Cálculo Químico GrandezasDokument2 SeitenQuímica - Pré-Vestibular Impacto - Cálculo Químico GrandezasQuímica Qui100% (1)
- Energias - Mecânicas e Leis de Conservação.Dokument4 SeitenEnergias - Mecânicas e Leis de Conservação.Maurício Paixão0% (1)
- Fatorial Educação Vou Dar Aula Amanhã O Que FazerDokument76 SeitenFatorial Educação Vou Dar Aula Amanhã O Que FazerRenatoRetzNoch keine Bewertungen
- 12 NT Scie - Sistemas Automáticos de Detecção de Incêndio - 11 - 09 - 22Dokument48 Seiten12 NT Scie - Sistemas Automáticos de Detecção de Incêndio - 11 - 09 - 22Paulo Francisco SantosNoch keine Bewertungen
- 8serie 4b AulaDokument7 Seiten8serie 4b AulaJéssica LayneNoch keine Bewertungen
- Lista Exercicios PB 1Dokument25 SeitenLista Exercicios PB 1arthurleporeNoch keine Bewertungen
- Em 04 Função Afim - Enem Fuvest Uerj UnicampDokument14 SeitenEm 04 Função Afim - Enem Fuvest Uerj UnicampALAN RONNY DA SILVA DANTASNoch keine Bewertungen
- Fisica MTDokument39 SeitenFisica MTLuiz HenriqueNoch keine Bewertungen
- Citizen Eco Drive Bj2120 07eDokument16 SeitenCitizen Eco Drive Bj2120 07eraphajonesNoch keine Bewertungen
- SI, unidades e leis de gases ideais e reaisDokument2 SeitenSI, unidades e leis de gases ideais e reaisRenato IanhezNoch keine Bewertungen
- Calorimetria Fisica 1 Ano 2020 PDFDokument1 SeiteCalorimetria Fisica 1 Ano 2020 PDFNinna Heleonisia MoreiraNoch keine Bewertungen
- Trocador de calor piscinaDokument2 SeitenTrocador de calor piscinaPedro BuenoNoch keine Bewertungen
- Atividade Remota 2 - ÁguaDokument9 SeitenAtividade Remota 2 - ÁguaRODRIGO GIRALDINoch keine Bewertungen
- Processamento de Pêssego em CaldaDokument13 SeitenProcessamento de Pêssego em CaldaDaiane de Souza Dias100% (2)
- 300 - 0645 - Rev - 13 - Manual Geladeiras v1 - 0Dokument86 Seiten300 - 0645 - Rev - 13 - Manual Geladeiras v1 - 0Jair ArmandoNoch keine Bewertungen
- Banho Ultratermostático Com CirculadorDokument12 SeitenBanho Ultratermostático Com Circuladorrodrigofacear100% (1)
- Sinais vitais e medidas antropométricasDokument46 SeitenSinais vitais e medidas antropométricasLaila RaposoNoch keine Bewertungen
- DATec 026 ADokument25 SeitenDATec 026 ASther RochaNoch keine Bewertungen
- Catálogo Itaimlc 2023Dokument71 SeitenCatálogo Itaimlc 2023tobiasNoch keine Bewertungen
- Daily Manual Uso Manutencao Ed.010Dokument380 SeitenDaily Manual Uso Manutencao Ed.010penetraNoch keine Bewertungen
- Nova linha Utopia HFC R-410A Split e AcquaDokument16 SeitenNova linha Utopia HFC R-410A Split e AcquaSergio HitcarNoch keine Bewertungen
- 2º Ano Santa Cruz - Cap 4 (Física)Dokument4 Seiten2º Ano Santa Cruz - Cap 4 (Física)wagnerNoch keine Bewertungen
- Apostila - Bagnato Fisica Moderna PDFDokument376 SeitenApostila - Bagnato Fisica Moderna PDFRafael GarciaNoch keine Bewertungen
- PROJETO para Uerj CSMDokument5 SeitenPROJETO para Uerj CSMDaviNoch keine Bewertungen
- Ai ProvaDokument3 SeitenAi Prova-roseira-Noch keine Bewertungen
- Antociâninas: Características e estabilidadeDokument7 SeitenAntociâninas: Características e estabilidadeMoisés SantosNoch keine Bewertungen
- Lista de Calorimetria (Formatada Rafael)Dokument5 SeitenLista de Calorimetria (Formatada Rafael)Rafael Trautwein SantiagoNoch keine Bewertungen
- Norma Brasileira: Abnt NBR 5626Dokument64 SeitenNorma Brasileira: Abnt NBR 5626Luciana Lira100% (6)
- Capacidade Térmica Mássica SólidoDokument15 SeitenCapacidade Térmica Mássica Sólido1111263Noch keine Bewertungen
- Laudo pericial de adicional de insalubridadeDokument48 SeitenLaudo pericial de adicional de insalubridadeJOHN CARLOS SIPPERTNoch keine Bewertungen
- Manual Adega Climatizada AC 3.1 - 0308 TocaveDokument6 SeitenManual Adega Climatizada AC 3.1 - 0308 TocaveEduardo IpanemaNoch keine Bewertungen
- Processo de produção do açúcarDokument17 SeitenProcesso de produção do açúcarJossias Philips CunaNoch keine Bewertungen