Beruflich Dokumente
Kultur Dokumente
Termodinámica-leyes-calor-trabajo
Hochgeladen von
Marisol Sanchez HernandezOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Termodinámica-leyes-calor-trabajo
Hochgeladen von
Marisol Sanchez HernandezCopyright:
Verfügbare Formate
TERMODINMICA La termodinmica es la rama de la fsica que estudia los procesos donde hay transferencia de energa en forma de calor y de trabajo.
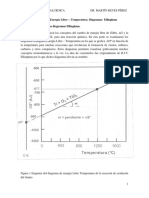
Cuando dos cuerpos a diferentes temperaturas se ponen en contacto trmico entre s, la temperatura del cuerpo ms clido disminuye y la del ms fro aumenta. Si permanecen en contacto trmico durante cierto tiempo, finalmente alcanzan una temperatura comn de equilibrio, de valor comprendido entre las temperaturas iniciales. En este proceso se produjo una transferencia de calor del cuerpo ms clido al ms fro. El calor, (smbolo Q), se define como la energa cintica total de todos los tomos o molculas de una sustancia. El conceptode calor, se usa para describir la energa que se transfiere de un lugar a otro, es decir flujo de calor es una transferencia de energa que se produce nicamente como consecuencia de las diferencias de temperatura. LAS LEYES DE LA TERMODINMICA La termodinmica es la rama de la fsica que estudia la energa y la transformacin entre sus distintas manifestaciones, como el calor, y su capacidad para producir un trabajo. La ley cero de la termodinmica establece que si dos sistemas, Ay B, estn en equilibrio termodinmico, y B est a su vez en equilibrio termodinmico con un tercer sistema C, entonces A y C se encuentran en equilibrio termodinmico. Este principio fundamental se enunci formalmente luego de haberse enunciado las otras tres leyes de la termodinmica, por eso se la llam ley cero. La primera ley de la termodinmica, tambin conocida como ley de la conservacin de la energa enuncia que la energa es indestructible, siempre que desaparece una clase de energa aparece otra (Julius von Mayer). Ms especficamente, la primera ley de la termodinmica establece que al variar la energa interna en un sistema cerrado, se produce calor y un trabajo. La energa no se pierde, sino que se transforma. La segunda ley de la termodinmica indica la direccin en que se llevan a cabo las transformaciones energticas. El flujo espontneo de calor siempre es unidireccional, desde los cuerpos de temperatura ms alta a aquellos de temperatura ms baja. En esta ley aparece el concepto de entropa, la cual se define como la magnitud fsica que mide la parte de la energa que no puede utilizarse para producir un trabajo. Esto es ms fcil de entender con el ejemplo de una mquina trmica: Una fuente de calor es usada para calentar una sustancia de trabajo (vapor de agua), provocando la expansin de la misma colocada dentro de un pistn a travs de una vlvula. La expansin mueve el pistn, y por un mecanismo de acoplamiento adecuado, se obtiene trabajo mecnico. El trabajo se da por la diferencia entre el calor final y el inicial. Es imposible la existencia de una mquina trmica que extraiga calor de una fuente y lo convierta totalmente en trabajo, sin enviar nada a la fuente fra. La entropa de un sistema es tambin un grado de desorden del mismo. La segunda ley establece que en los procesos espontneos la entropa, a la larga, tiende a aumentar. Los sistemas ordenados se desordenan espontneamente. Si se quiere restituir el orden original, hay que realizar un trabajo sobre el sistema.
T1=Temperatura inicial T2=Temperatura final W=trabajo La tercera de las leyes de la termodinmica afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un nmero finito de procesos fsicos, ya que a medida que un sistema dado se aproxima al cero absoluto, su entropa tiende a un valor constante especfico. A medida que el sistema se acerca al cero absoluto, el intercambio calrico es cada vez menor hasta llegar a ser casi nulo. Ya que el flujo espontneo de calor es unidireccional, desde los cuerpos de temperatura ms alta a los de temperatura ms baja (Segunda ley), sera necesario un cuerpo con menor temperatura que el cero absoluto; y esto es imposible.
Das könnte Ihnen auch gefallen
- Guia SecadoDokument6 SeitenGuia SecadoGabrielNoch keine Bewertungen
- Monografia Unidad V Mezclas No ReactivasDokument15 SeitenMonografia Unidad V Mezclas No ReactivasPedro TorresNoch keine Bewertungen
- TEORIA Diagramas de Energía Libre TOTAL PDFDokument33 SeitenTEORIA Diagramas de Energía Libre TOTAL PDFDiego RamirezNoch keine Bewertungen
- Examen parcial de crudos y derivados: puntos críticos, diagramas de fases, corrección de volumen y cálculo de tanquesDokument2 SeitenExamen parcial de crudos y derivados: puntos críticos, diagramas de fases, corrección de volumen y cálculo de tanquescarlos jose peckermanNoch keine Bewertungen
- Ejercicios EstadisticaDokument7 SeitenEjercicios EstadisticaValeria Bracho ParraNoch keine Bewertungen
- Nociones de Termodinámica y Sus Leyes en Profesor en LineaDokument4 SeitenNociones de Termodinámica y Sus Leyes en Profesor en LineaCarlos Andrés Díaz ValderramaNoch keine Bewertungen
- Nociones de TermodinámicaDokument4 SeitenNociones de Termodinámicapablo salinasNoch keine Bewertungen
- Definición de TermodinámicaDokument2 SeitenDefinición de TermodinámicaGunar MurilloNoch keine Bewertungen
- LeyesTermodinámicaExperimentoDokument2 SeitenLeyesTermodinámicaExperimentoAlberto perez williamNoch keine Bewertungen
- Termodinamica - InformacionDokument2 SeitenTermodinamica - InformacionGuadalupe Abel Cuadrado MachacuayNoch keine Bewertungen
- TERMODINAMICADokument4 SeitenTERMODINAMICAMercedes MendozaNoch keine Bewertungen
- Las 4 Leyes de La Termodinámica-EstudiarDokument6 SeitenLas 4 Leyes de La Termodinámica-EstudiarMaryori E Guerrra RamirezNoch keine Bewertungen
- Principios de La TermodinámicaDokument3 SeitenPrincipios de La TermodinámicaLUIS SANTIAGO GOMEZ HERNANDEZNoch keine Bewertungen
- 01 TemperaturaDokument6 Seiten01 TemperaturaSamuel PérezNoch keine Bewertungen
- Las 3 Leyes de La TermodinámicaDokument2 SeitenLas 3 Leyes de La TermodinámicaDANIELA URBINA GUTIERREZNoch keine Bewertungen
- Leyes de La TermodinámicaDokument3 SeitenLeyes de La TermodinámicaAndrés LópezNoch keine Bewertungen
- Unidad 4Dokument4 SeitenUnidad 4Juan Carlos Chipol FiscalNoch keine Bewertungen
- Leyes de La Termodinamica NoticiaDokument5 SeitenLeyes de La Termodinamica NoticiaManuel VelaNoch keine Bewertungen
- Termodinámica: U W + Q U Variación de La Energía InternaDokument5 SeitenTermodinámica: U W + Q U Variación de La Energía InternaMauricio GonzalezNoch keine Bewertungen
- 08 - Balance Termico y EntropíaDokument15 Seiten08 - Balance Termico y EntropíaAndrea Carolina MartinezNoch keine Bewertungen
- La Termodinámica Establece Cuatro Leyes FundamentalesDokument2 SeitenLa Termodinámica Establece Cuatro Leyes FundamentalesLola Margarita Casanova FerrínNoch keine Bewertungen
- Termodinámica InvestigacionDokument13 SeitenTermodinámica InvestigacionAngie ManzanaresNoch keine Bewertungen
- TermodinamicaDokument71 SeitenTermodinamicaDavid Evaristo HernandezNoch keine Bewertungen
- Guía Didáctica - Fisica Termodinamica Calor TemperaturaDokument9 SeitenGuía Didáctica - Fisica Termodinamica Calor Temperaturasara catalina martinez valenciaNoch keine Bewertungen
- Microclase de TermodinámicaDokument2 SeitenMicroclase de TermodinámicaViviana ViñaNoch keine Bewertungen
- Leyes Termodinámica Energía EntropíaDokument3 SeitenLeyes Termodinámica Energía EntropíaBlack DiamondNoch keine Bewertungen
- Leyes de La TermodinamicaDokument11 SeitenLeyes de La TermodinamicaNeilyn PradoNoch keine Bewertungen
- Qué Son Las Leyes de La TermodinámicaDokument3 SeitenQué Son Las Leyes de La TermodinámicaKevin Fernando Tadeo GonzálezNoch keine Bewertungen
- Termodinámica Material de ApoyoDokument28 SeitenTermodinámica Material de ApoyoadalidNoch keine Bewertungen
- Termo XimenaDokument5 SeitenTermo XimenaMaria Ximena MoraNoch keine Bewertungen
- Cuestionario de Transferencia de CalorDokument6 SeitenCuestionario de Transferencia de CalorLizeth KarolinaNoch keine Bewertungen
- Informe Sobre La TermodinamicaDokument12 SeitenInforme Sobre La TermodinamicaAlex Méndez Jr.Noch keine Bewertungen
- LEYES DE LA TERMODINÁMICA. Paula-Andrea - Gomez-Avirama 104718021359Dokument2 SeitenLEYES DE LA TERMODINÁMICA. Paula-Andrea - Gomez-Avirama 104718021359Paula Andrea Gomez AviramaNoch keine Bewertungen
- Leyes de La TermodinámicaDokument1 SeiteLeyes de La Termodinámicamatiasdlsb.21Noch keine Bewertungen
- Qué es la entropía termodinámicaDokument19 SeitenQué es la entropía termodinámicapincheira219Noch keine Bewertungen
- Las Leyes de La TermodinámicaDokument8 SeitenLas Leyes de La Termodinámicajose luisNoch keine Bewertungen
- Termodinámica: Estudio energía transformacionesDokument4 SeitenTermodinámica: Estudio energía transformacionesAlejandroAriasNoch keine Bewertungen
- Termodinamica Unidad 5Dokument7 SeitenTermodinamica Unidad 5Marcos Galaz CampilloNoch keine Bewertungen
- Termodinámica: leyes y aplicaciones ingenierilesDokument7 SeitenTermodinámica: leyes y aplicaciones ingenierilesMaría Rosa TomapascaNoch keine Bewertungen
- Leyes de La TermodinámicaDokument12 SeitenLeyes de La Termodinámicasebitas45100% (4)
- Termodinámica EntornoDokument10 SeitenTermodinámica Entornofijosduo2Noch keine Bewertungen
- Practica A Entregar 23 de Julio 2020Dokument6 SeitenPractica A Entregar 23 de Julio 2020Nelson GomezNoch keine Bewertungen
- Principios Basicos de TermodinamicaDokument5 SeitenPrincipios Basicos de TermodinamicaSam CastilloNoch keine Bewertungen
- Guía #2 - Grado 10 - Termodinamica - Leyes de La TermodinamicaDokument3 SeitenGuía #2 - Grado 10 - Termodinamica - Leyes de La Termodinamicaeimer mestraNoch keine Bewertungen
- Calor de neutralización: reacción exotérmica entre ácido y baseDokument24 SeitenCalor de neutralización: reacción exotérmica entre ácido y baseJadr29930% (1)
- Ley Cero de La Termodinámic1Dokument3 SeitenLey Cero de La Termodinámic1Oxan Shyb Mori VNoch keine Bewertungen
- Leyes de la TermodinámicaDokument5 SeitenLeyes de la TermodinámicaGENNESIS CAMILA ORTEGA ROPERONoch keine Bewertungen
- Reporte3 Sección1301 Grupo 4Dokument18 SeitenReporte3 Sección1301 Grupo 4joel cruzNoch keine Bewertungen
- Ley Cero de La TermodinámicaDokument12 SeitenLey Cero de La Termodinámicanatalia gutierrez herronNoch keine Bewertungen
- Leyes de La TermodinámicaDokument1 SeiteLeyes de La TermodinámicaAlfGamerNoch keine Bewertungen
- Conceptos básicos de termodinámicaDokument13 SeitenConceptos básicos de termodinámicaROnaldo' MgNoch keine Bewertungen
- Leyes de La TermodinámicaDokument3 SeitenLeyes de La TermodinámicadarioNoch keine Bewertungen
- Leyes de La Termodinamica 801Dokument13 SeitenLeyes de La Termodinamica 801Dylan mandonNoch keine Bewertungen
- TermodinámicaDokument5 SeitenTermodinámicaEDUARDO JOSIMARK FARIAS TOMALANoch keine Bewertungen
- Ley Cero de La Termodinámica - Investigacion Documental.Dokument11 SeitenLey Cero de La Termodinámica - Investigacion Documental.oscar leonnNoch keine Bewertungen
- Ley de La TermodinamicaDokument12 SeitenLey de La TermodinamicaJesus VenturaNoch keine Bewertungen
- Qué Es La TermodinámicaDokument5 SeitenQué Es La Termodinámicalana diaz talaiguaNoch keine Bewertungen
- Investigación de la termodinámicaDokument4 SeitenInvestigación de la termodinámicaJulissa AlcivarNoch keine Bewertungen
- 3introducción A La TermodináicaDokument7 Seiten3introducción A La TermodináicaRicardo CastroNoch keine Bewertungen
- Qué Son Las Leyes de La TermodinámicaDokument5 SeitenQué Son Las Leyes de La TermodinámicatamjrodriguezNoch keine Bewertungen
- Procesos TermodinámicosDokument13 SeitenProcesos TermodinámicosJosé Luis García VegaNoch keine Bewertungen
- Comunicación y Comportamiento Del ConsumidorDokument12 SeitenComunicación y Comportamiento Del ConsumidorMarisol Sanchez HernandezNoch keine Bewertungen
- Efectosfiscalesdeloscontratos 120514082938 Phpapp02Dokument35 SeitenEfectosfiscalesdeloscontratos 120514082938 Phpapp02J.B. ChampagneNoch keine Bewertungen
- Discurso GraduciónDokument1 SeiteDiscurso GraduciónMarisol Sanchez HernandezNoch keine Bewertungen
- Matriz conceptos marketingDokument5 SeitenMatriz conceptos marketingMarisol Sanchez HernandezNoch keine Bewertungen
- Salarioooos Minimos....Dokument2 SeitenSalarioooos Minimos....Marisol Sanchez HernandezNoch keine Bewertungen
- Ejercicios Tema 1-5Dokument9 SeitenEjercicios Tema 1-5friocarlos100% (1)
- Operaciones unitarias de fluidos en la Universidad Nacional Federico VillarrealDokument60 SeitenOperaciones unitarias de fluidos en la Universidad Nacional Federico VillarrealROSA ESTEFANIA RODRIGUEZ PAEZNoch keine Bewertungen
- Calorímetro hieloDokument10 SeitenCalorímetro hieloJorge Agudelo Burbano100% (1)
- Pirómetros de RadiaciónDokument4 SeitenPirómetros de RadiaciónTomas A. EncinaNoch keine Bewertungen
- 02-20-2020 120633 PM PPT 11 TERMODINAMICA CDokument12 Seiten02-20-2020 120633 PM PPT 11 TERMODINAMICA CronaldoNoch keine Bewertungen
- 4-132 Termodinamica 2013 Parte BDokument14 Seiten4-132 Termodinamica 2013 Parte BNachoBasualdoNoch keine Bewertungen
- Empaque de RefrigeradorDokument18 SeitenEmpaque de RefrigeradorVentura Ramos LuqueNoch keine Bewertungen
- Calorimetría y calor específicoDokument1 SeiteCalorimetría y calor específicomanuela PérezNoch keine Bewertungen
- Tarea 3Dokument5 SeitenTarea 3Maria SalazarNoch keine Bewertungen
- Problemas Destilacion PDFDokument22 SeitenProblemas Destilacion PDFCOSME FULANITONoch keine Bewertungen
- 10.2.1 Cálculo de Los Demás TramosDokument4 Seiten10.2.1 Cálculo de Los Demás TramosIvan Eduardo Mendoza PatiñoNoch keine Bewertungen
- Termodinámica MúltipleDokument6 SeitenTermodinámica MúltipleAngie YelaNoch keine Bewertungen
- Los Cambios de EstadoDokument2 SeitenLos Cambios de EstadoNoelia SalcedoNoch keine Bewertungen
- TP Física Calor2019Dokument9 SeitenTP Física Calor2019J.E. VillanuevaNoch keine Bewertungen
- OPERACIONES TDEC PRACTICA No 15 OPTDEC Diseño y Cálculo de Una Cámara de Enfriamiento.Dokument18 SeitenOPERACIONES TDEC PRACTICA No 15 OPTDEC Diseño y Cálculo de Una Cámara de Enfriamiento.Rafael PeraltaNoch keine Bewertungen
- Diferencias FinitasDokument13 SeitenDiferencias FinitasConsuelo HernandezNoch keine Bewertungen
- Recondicionamiento Termico Viviendas en UsoDokument115 SeitenRecondicionamiento Termico Viviendas en UsoIvan Barrios Saez100% (1)
- 2.7. Relaciones P-V-T de Los Gases IdealesDokument19 Seiten2.7. Relaciones P-V-T de Los Gases IdealesCarlosCarrilloNoch keine Bewertungen
- Taller 2 TermoDokument4 SeitenTaller 2 TermoJuan Sebastian Rodriguez EspinosaNoch keine Bewertungen
- Cinetica QDokument2 SeitenCinetica QNestor PonceNoch keine Bewertungen
- Trabajo realizado por un gas en expansiónDokument4 SeitenTrabajo realizado por un gas en expansiónastrid hernandezNoch keine Bewertungen
- Tarea - Ciclos de Refrigeracion - para EntregarDokument5 SeitenTarea - Ciclos de Refrigeracion - para EntregarSanchez JSteven100% (1)
- Informe 4 Comprobación de La Ley de Hess - Pablo AmayaDokument8 SeitenInforme 4 Comprobación de La Ley de Hess - Pablo AmayaPABLO AUGUSTO AMAYA GARCIANoch keine Bewertungen
- Guia 5 para La Experiencia Dilatacion de Liquido y Gases Virtual 202002Dokument9 SeitenGuia 5 para La Experiencia Dilatacion de Liquido y Gases Virtual 202002Dylan LagunaNoch keine Bewertungen
- Practica Intercambiadores 2.0Dokument7 SeitenPractica Intercambiadores 2.0Leipzy Beck BethancourtNoch keine Bewertungen