Beruflich Dokumente
Kultur Dokumente
Guia Estructura de La Materia de Septimo y Tabla Periodica 2013
Hochgeladen von
Jaime Hernan Cortes RestrepoCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Guia Estructura de La Materia de Septimo y Tabla Periodica 2013
Hochgeladen von
Jaime Hernan Cortes RestrepoCopyright:
Verfügbare Formate
INSTITUCION EDUCATIVA PABLO SEXTO DOSQUEBRADAS- RISARALDA UN HOMBRE CON MENTALIDAD DE CAMBIO AREA CIENCIAS NATURALES Y DEL MEDIO
AMBIENTE EJE ARTICULADOR DE MATERIA Y ENERGIA CONTENIDO:
Establece comparaciones entre los diferentes modelos atmicos. Interpreta y usa correctamente la tabla peridica. Define carcter metlico Diferencia entre metales y no metales Deduce el comportamiento qumico de los tomos con base en la distribucin electrnica. Diferencia y aplica los conceptos de nmero atmico, masa atmica e isotopo.
NUCLEO TEMATICOS: Estructura de la materia Modelos Atmicos Modelo Actual del tomo Relacin carga masa del tomo xidos cidos Mtodos de separacin de mezclas Electricidad, circuitos y magnetismo ESTANDAR CURRICULAR: Establezco relaciones entre las caractersticas macroscpicas y microscpicas de la materia y las propiedades fsica y qumicas de las sustancias que la constituyen. COMPETENCIAS A DESARROLLAR: Interpretativa: Identificar la aplicacin de diversos mtodos de separacin de mezclas. Argumentativa: Reconoce las clases de mezclas y los mtodos de separacin. Propositivas: Ejercitar habilidades para manejar tcnicas de diferenciacin y separacin de mezclas en el laboratorio. NIVELES DE COMPETENCIA: Describo el desarrollo de modelos que explican la estructura de la materia. INDICADORES DE DESEMPEO: Identifica las partculas atmicas y las relaciona con los conceptos de masa atmica y nmero atmico.
IDEAS BASICAS ESTRUCTURA DE LA MATERIA MODELOS ATMICOS LA APARICIN DEL CONCEPTO DE TOMO Ya desde la poca griega se reflexionaba sobre la materia, y hasta que punto era sta divisible. Con la idea de que la esencia de la materia deba permanecer siempre constante, aunque se pudiera observar un cambio constante en ella, Demcrito lleg a la conclusin de que las partculas que forman la materia no se podan dividir. Y las llamo tomos, que en griego significa indivisibles. Pero esta teora no estaba basada en ningn hecho cientfico, as que no trascendi. Las que si estaban fundamentadas en hechos experimentales eran las leyes clsicas de la qumica, que marcaron el nacimiento de esta ciencia. LEYES CLSICAS DE LA QUMICA Ley de la conservacin de la masa: En toda reaccin qumica la masa total de los reactivos que reaccionan es igual a la masa total de los productos de la reaccin. Propuesta por Lavoisier en 1789.
MODELO ATMICO DE DALTON Esta teora fue la base de la qumica moderna. Los principios de esta teora son: 1.- Los elementos qumicos estn formados por tomos, partculas muy pequeas e indivisibles. 2.- Todos los tomos de un elemento qumico dado son idnticos en su masa y dems propiedades. 3.- Los tomos de diferentes elementos qumicos son distintos, en particular sus masas son diferentes. 4.- En la reacciones, los tomos ni se crean ni se destruyen, nicamente de redistribuyen. 5.- Los compuestos se forman cuando los tomos se unen entre s, en una relacin constante y sencilla. Aunque fue una idea revolucionaria no encontr mucha oposicin, hasta que varios experimentos obligaron a desacreditarla: Ley de las proporciones mltiples: Cuando dos elementos se combinan entre s para formar ms de un compuesto, las masas de uno de ellos que se combinan con una misma masa del otro, para dar diferentes completos, estn en una relacin de nmeros enteros sencillos. Esta ley fue formulada por Dalton en 1803 y en concordancia con esta ley y las dos anteriores estableci el primer modelo atmico. Estudios de electricidad y electroqumica, realizados por Ampere y Faraday, sugeran una relacin entre carga y masa. El descubrimiento de la radiactividad en 1896 por Henri Becquerel, que llev al conocimiento de relacin carga/masa de stos, que era siempre igual independientemente del gas utilizado. El experimento de los rayos canales, de carga positiva que realizo Goldsteinen 1886, al utilizar el tubo del experimento de los rayos catdicos pero con el ctodo perforado. Este experimento junto al descubrimiento de partculas negativas, indujo al pensamiento de que deban existir partculas positivas, ya que la materia es elctricamente neutra. Con todos estos descubrimientos Thomson elabor un nuevo modelo atmico.
Ley de las proporciones definidas: La proporcin entre las masas en que dos o ms elementos se combinan para formar un cierto compuesto es siempre constante e independiente del procedimiento para formarlo. Redactada en 1801 por Proust.
MODELO ATMICO DE THOMSON Propuesto en 1898 Thomson presenta el tomo como una masa
esfrica y uniforme cargada positivamente, con partculas de carga negativa incrustadas de tal forma que, al final lar carga se anulasen y el tomo quedase elctricamente neutro. Con este modelo Thomson tambin explicaba la existencia de radiaciones con carga positivas, diciendo que se trataban de iones positivos, es decir, tomos que han perdido electrones.
partculas alfa, colocando una panel de Sulfuro de Zinc fluorescente detrs donde poder observar en qu medida eras las partculas dispersas. La mayora de ellas atravesaba la lmina sin cambiar de direccin. Sin embargo algunas partculas sufran desviaciones considerables y una mnima parte incluso rebotaban y volvan hacia atrs. Este resultado era incompatible con el modelo atmico macizo y de estructura homognea de la teora de Thomson. As, con los resultados de este experimento Rutherford cre su modelo atmico nuclear:
Pero ste modelo dejaba sin explicacin la existencia de otras radiaciones y al igual que paso con el modelo de Dalton, experimentos realizados posteriormente obligaron a desestimarlo: El convencimiento definitivo de la existencia de partculas subatmicas de carga positiva. ste lleg cuando Rutherford utilizo hidrogeno en el tubo de descarga y observ que, a pesar de que el tomo de hidrgeno era el mas ligero, la relacin carga/masa era la mayor obtenida hasta ahora. Su carga elctrica era del mismo valor que la de los electrones, pero su masa era casi 2000 veces mayor. Teniendo en cuenta que se podan obtener estas partculas de cualquier gas, aunque la relacin carga/masa era diferente en cada uno, se considero que estas deban componer, junto a los electrones, la estructura del tomo. Y se las denomin protones. Recopilando los nuevos avances, Rutherford redacto su teora atmica. MODELO ATMICO DE RUTHERFORD Una vez asumida la existencia de protones y electrones, Rutherford comenz a estudiar la localizacin y estructura de estos dentro del tomo.En 1911, Rutherford bombarde un fina lamina de oro con
El tomo esta formado por dos partes: El ncleo: es la parte central, de tamao muy pequeo, donde se encuentra toda la carga positiva, y prcticamente, toda la masa del tomo. Esta carga positiva es la responsable de la desviacin de las partculas alfa (tambin con carga positiva), en la experiencia de la lmina de oro. La corteza: es casi un espacio vaco, inmenso comparado con las dimensiones del ncleo. El dimetro de la corteza es de 10.000 a 100.000 veces mayor que el del ncleo. Eso explica que la mayor parte de las partculas alfa atravesaran la lmina sin cambiar su direccin. Aqu se encuentran los electrones con masa muy pequea y carga negativa. Como un diminuto sistema solar, los electrones giran alrededor del ncleo, como os planetas alrededor del Sol. Los electrones estn ligados al ncleo por la atraccin elctrica entre cargas de signo.
Por lo que haca falta un nuevo modelo que resolviese todas estas incgnitas. MODELO ATMICO DE BOHR Bohr public su modelo atmico en 1913, basndose en las ideas previas de Max Planck, El modelo atmico de Bohr coincide con el modelo atmico nuclear de Rutherford en la estructura del tomo y tambin en la teora de que los electrones giran alrededor del ncleo. Pero Bohr situ los electrones en rbitas, teniendo cada rbita un nivel de energa, aumentando sta cuanto mas alejado estuviera del ncleo, pero disminuyendo la distancia entre rbita y rbita. Bohr explicaba que a cada electrn le corresponde un nivel, y que mientras de mantenga en ese nivel ni pierde ni gana energa. La energa cintica del electrn equilibra la atraccin electroesttica de las cargas opuestas del ncleo y el electrn. Los saltos de los electrones de un nivel a otro suponen una emisin o absorcin, dependiendo si sube o baja de nivel, de energa electromagntica (fotones de luz). Los niveles permitidos para cada electrn son aquellos en los que su momento angular es un mltiplo entero de h / (2 ), donde h es la constante de Planck. Bohr explic la existencia de los espectros atmicos como la luz, cifrada, que desprende un electrn cuando cambia de nivel. El espectro es el resultado de descomponer esa radiacin electromagntica compleja en todas sus radiaciones sencillas caracterizadas por una longitud de onda. El conjunto de las lneas que aparecen en los espectros atmicos corresponden a cada una de las longitudes de onda. Estudiando los espectros, que son caractersticos en cada elemento, podemos analizar la
El tomo es estable debido a que los electrones mantienen un giro alrededor del ncleo, que ejerce una fuerza centrfuga que es igualada por la fuerza elctrica de atraccin ejercida por el ncleo, y que permite que el electrn se mantenga en su rbita. La carga del ncleo y de los electrones se equilibra, confiriendo al tomo su neutralidad. Pero vez ms, el nuevo modelo atmico propuesto tena contradicciones: En primer lugar contradeca las leyes de electromagnetismo de Maxwell. stas afirmaban que una carga elctrica en movimiento (como el electrn en este caso) emite energa continuamente en forma de radiacin, con lo cual, al perder energa, terminara cayendo sobre el ncleo, y la materia de destruira. En segundo lugar, el modelo atmico de Rutherford no explicaba los espectros atmicos. Y por ltimo, aunque Rutherford sugiri la posible existencia una tercera partcula (sin carga, por lo que la denomin neutrones) en el tomo al comprobar que, el peso total de los elementos era mucho mayor que el calculado con los protones; fue Chadwick el que, en 1932, los descubri. Esta vez, Chadwick bombarde con partculas alfa una lmina de Berilio, e identific esas partculas con los neutrones que ya predijo Rutherford. una
radiacin que elemento.
absorbe
o emite
este
Sin embargo, el modelo de Bohr tuvo que ser abandonado, ya que explicaba los espectros atmicos de los elementos simples, pero no de los complejos. Adems, la idea de que los electrones se mueven alrededor del ncleo en orbitas definidas tuvo que ser tambin desechada. Pero aun as, Bohr contribuyo mucho en el desarrollo de las nuevas ideas, que vendran de la mano de a mecnica cuntica.
Istopos La suma del nmero de protones y el nmero de neutrone nmero msico y se representa con la letra A. Aunque elemento se caracterizan por tener el mismo nmero atm de Llamamos istopos a las formas atmicas de un mismo nmero msico. Para representar un istopo, hay que indicar el n istopo y el nmero atmico (Z), colocados respectivamente, a la izquierda del smbolo del el Actividad atmica 1. sobre la estructura
Los tomos de un mismo elemento qumico tienen todos en su ncleo el mismo nmero de Un tomo tiene 12 protones, 13 neutrones y 12 electrones. Cul es su nmero atmico? 1. 12 2. 13 3. 24 4. 25 Los istopos oxgeno-16, oxgeno17 y oxgeno-18, se diferencian en: 1. El nmero de protones 2. El nmero atmico 3. El nmero de neutrones 4. El nmero de electrones Un tomo de volframio (W) tiene 74 protones y 108 neutrones. Cul es su representacin adecuada?
. 2.
Estructura del tomo En el tomo distinguimos dos partes: el ncleo y la corteza. El ncleo es la parte central del tomo y contiene partculas con carga positiva, los protones, y partculas que no poseen carga elctrica, es decir son neutras, los neutrones. La masa de un protn es aproximadamente igual a la de un neutrn. Todos los tomos de un elemento qumico tienen en el ncleo el mismo nmero de protones. Este nmero, que caracteriza a cada elemento y lo distingue de los dems, es el nmero atmico y se representa con la letra Z. La corteza es la parte exterior del tomo. En ella se encuentran los electrones, con carga negativa. stos, ordenados en distintos niveles, giran alrededor del ncleo. La masa de un electrn es unas 2000 veces menor que la de un protn. Los tomos son elctricamente neutros, debido a que tienen igual nmero de protones que de electrones. As, el nmero atmico tambin coincide con el nmero de electrones.
3.
4.
4. 1. 2. 3. 5. Seala las afirmaciones correctas: 1. El nmero msico de un tomo es la suma del nmero de protones, neutrones y electrones 2. Todos los tomos de un mismo elemento qumico tienen el mismo nmero de neutrones 3. Los istopos de un elemento qumico tienen el mismo nmero atmico
4. Los istopos de un elemento qumico tienen el mismo nmero msico 5. Los istopos de un elemento qumico tienen distinto nmero de neutrones ATIVIDADES ATOMICOS SOBRE MODELOS
1. Realiza una resea histrica sobre los distintos modelos atmicos. 2. Cual fue la conclusin a la que llego Demcrito sobre la materia y por que no trascendi. 3. escriba las tres leyes clsicas de la qumica y de ejemplos. 4. Quienes realizaron estudios sobre la electricidad. 5. Que cientfico descubri la radiactividad. 6. Por que se dice que la materia es elctricamente neutra. 7. Explique cules fueron las distintas contradicciones encontradas en los modelos atmicos. 8. Dibuje un tomo explicando cada una de sus partes. 9. Bohr explico la existencia de los espectros atmicos en que consisti. Ahora aprendamos a ubicar los elementos en la tabla peridica, a partir del nmero atmico y la tabla de configuracin electrnica; Con la ayuda de tu profesor realiza la tabla de configuracin y dibuja los orbitales moleculares, Aplica las frmulas matemticas para ubicar exactamente los elementos en tu propia tabla peridica FORMULAS 1. nsx n= mayor nivel de energa x= variante 12 indica el grupo A I o II 2. ns2 npx n= mayor nivel de energa; p utima letra; x= variante entre 1 a 6 indica el grupo A al que pertenece puede ser del III al VIII
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 5p 6d 6f 7s 7p 7d 7f
3. ns2 (n-1) dx n= mayor nivel de energa; d ultima letra; x= variante que puede tomar valores entre 1 a 10 y permite ubicar los elementos de los grupos B de la t. P., segn indique la explicacin e el despeje de as formulas 4. ns2-1(n-2) fx-2 n= ultimo nivel de enrgia; f ultima letra y primero hago las restas pertinentes para saber el valor real de los exponentes que ubican columnas de la 1 a la 14 s tiene mximo 2 ep tiene mximo 6 ed tiene mximo 10ef tiene mximo 14e-
A partir del numero atmico y con la ayuda de la tabla realizada puedo hacer configuracin electrnica y aprender a ubicar los elementos, asi que manos a la obra y empieza a hacer ejercicios Ahora conozcamos las propiedades peridicas, entendindolas en la T:P: que estamos construyendo Radio atmico Peso atmico Electronegatividad Afinidad electrnica entre otras que debes investigar
Logros:1. qumicos
Identifica los en la Tabla
elementos peridica
2. identifica los grupos y periodos de los elementos de la Tabla Peridica. Competencia: Plantean estrategias de solucin para resolver problemas relacionados con la organizacin de los elementos qumicos en la Tabla Peridica. Palabras Clave: Elementos, qumicos, grupos, periodos. smbolos
programa lo utilizaremos a travs de Internet. 2. Materiales necesarios Ordenador Enlaces a pginas web Tabla peridica 3. La tabla peridica Observa en la tabla peridica del siguiente enlace y comprueba las siguientes cuestiones: Tabla peridica a. Observa que la tabla peridica est organizada en columnas, llamadas GRUPOS y en filas, llamadas PERIODOS. Los grupos nos informan del nmero de electrones que tienen esos tomos en su ltima capa de la corteza electrnica. En cambio, los periodos nos informan del nmero de capas que electrnica. existen en su corteza
Pregunta Generadora:Sabes cmo estn organizados los elementos en la Tabla Peridica? Situacin de aprendizaje :Observacin y reconocimiento de la posicin de los elementos qumicos en la Tabla Peridica. Tarea: Actividad 1. Repasar los smbolos qumicos de los elementos. Actividad 2. Repasar los elementos de la Tabla peridica por grupos y por periodos. Actividad 3. Resolver la actividad de construir tu propia tabla peridica Criterios de Evaluacin: 1. Realiza la actividad de rompecabezas con lgica y rapidez, teniendo en cuenta los grupos y periodos de los elementos qumicos de la Tabla Peridica. Recursos: Recurso humano: docentes y estudiantes. En este trabajo prctico nos planteamos conocer la tabla peridica de los elementos desde varios puntos de vista: Estructura de la tabla peridica: los grupos y los periodos. Configuraciones electrnicas de algunos Elementos. Aplicaciones de algunos elementos Para ello en esta ocasin no vamos a trabajar en el laboratorio, sino que vamos a utilizar un programa informtico que nos proporciona informacin sobre los distintos elementos de la tabla peridica. Este
b. Observa la tabla peridica y completa la siguiente tabla: Elemento K S Be I Ar N de electrones en su ltima capa N de capas de la corteza electrnica. Observa los colores y pon dos ejemplos de elemento en estado slido, lquido y gaseoso a temperatura ambiente. d. Pulsa sobre algunos elementos para conocer el origen de su smbolo y nombre: Na, S, Fe, Ag, Kr. 4. Configuracin elementos. electrnica de los
Conecta con el enlace de internet que te mostramos a continuacin y comprueba las siguientes cuestiones:
http://concurso.cnice.mec.es/cnice2005/93 _iniciacion_interactiva_materia/curso/mat eriales/atomo/ modelos.htm Tabla Peridica Interactiva a. En este enlace puedes observar algunas caractersticas muy interesantes de los tomos, como son su espectro atmico, su configuracin electrnica y su corteza electrnica. b. Analiza cmo es la configuracin electrnica del grupo IA, o grupo 1, llamado Elementos Alcalinos. Para ello pulsa sobre los elementos Li, Na, K, Rb y observa qu tienen en comn. c. Veamos ahora el grupo VIIA, llamado grupo de los halgenos y comprueba de nuevo qu tienen en comn. Recuerda que los elementos que se encuentran en el mismo grupo tienen propiedades qumicas parecidas, por lo que es muy importante saber en qu se parecen sus configuraciones electrnicas. d. La escala de energa que puedes observar a la derecha de las rbitas te informa de la energa que tienen los electrones. Cuanto ms bajos se encuentran, ms energa tienen, y ms cerca se encuentran del ncleo del tomo. e. Por ltimo, vamos a viajar hasta el ncleo del tomo. Para ello puedes pulsar sobre el botn Ver el ncleo. Observa el ncleo de algunos elementos como H, He, Li, C, Br. Puedes ver cmo el nmero de protones y neutrones aumenta conforme nos vamos hacia abajo y hacia la derecha en la tabla peridica. 5. Aplicaciones de algunos elementos En este apartado vamos a analizar las principales aplicaciones o utilidades de algunos elementos de la tabla peridica. Para ello nos vamos a centrar en dos cuestiones: a. Elementos con inters industrial. Utiliza el siguiente enlace para ver las utilidades
que tienen los siguientes elementos: Na, Cu, Ag, Fe, Mg. Tabla peridica b. Oligoelementos. Son los elementos qumicos que se encuentran en nuestro cuerpo, muchos de ellos en muy pequeas proporciones, pero que son fundamentales para un buen estado de salud. Oligoelementos, bioelementos 6. Juega con la tabla peridica Mientras conoces propiedades de los elementos qumicos. Juega con la tabla peridica para iniciar a estudiar como se unen los elementos qumicos a travs de los enlaces qumicos y posteriormente estudiar funciones qumicas, reacciones qumicas, nomenclatura y estequiometria entre otros temas, as que manos a la obra.
Das könnte Ihnen auch gefallen
- ¿Todos a la escuela?: Retos de la gratuidad de la educación pública en Colombia: la Sentencia C-376 de 2010Von Everand¿Todos a la escuela?: Retos de la gratuidad de la educación pública en Colombia: la Sentencia C-376 de 2010Noch keine Bewertungen
- 8 Basico Cs Naturales Guia 3 Ser SaludableDokument6 Seiten8 Basico Cs Naturales Guia 3 Ser SaludableIPUC Caldas CentralNoch keine Bewertungen
- Planificacion Historia Tercero Unidad 3Dokument5 SeitenPlanificacion Historia Tercero Unidad 3Sugar SugarNoch keine Bewertungen
- Actividad para Reforzar La Consonate CH Texto ChuchitoDokument4 SeitenActividad para Reforzar La Consonate CH Texto ChuchitoLiz Villagrán SilvaNoch keine Bewertungen
- Actividad 3 AtomoDokument1 SeiteActividad 3 AtomolujulNoch keine Bewertungen
- CELULADokument3 SeitenCELULAJose Luis VergelNoch keine Bewertungen
- Planificacion RomanosDokument4 SeitenPlanificacion Romanosroxana moyaNoch keine Bewertungen
- Prueba 8vo - Ciencias Coef.12016 CelulasDokument6 SeitenPrueba 8vo - Ciencias Coef.12016 CelulasAlejandra JaiHelk100% (1)
- Herencia de Los Pueblos OriginariosDokument4 SeitenHerencia de Los Pueblos OriginariosMarcela CeballosNoch keine Bewertungen
- Planificación Anual Historia 3º Básico 2017Dokument16 SeitenPlanificación Anual Historia 3º Básico 2017GISELA LORENA CAMPOS FUENZALIDANoch keine Bewertungen
- Guia Docente 3B Mod1 PDFDokument46 SeitenGuia Docente 3B Mod1 PDFSara VANoch keine Bewertungen
- Guia de Aprendizaje La EnergiaDokument12 SeitenGuia de Aprendizaje La EnergiayeimyNoch keine Bewertungen
- Guia 8°BASICOelectricidad PDFDokument4 SeitenGuia 8°BASICOelectricidad PDFpapelmdmNoch keine Bewertungen
- Planificacion 3° Básico Historia Unidad 2Dokument23 SeitenPlanificacion 3° Básico Historia Unidad 2AndreaSepulvedaNoch keine Bewertungen
- Evaluación Diagnostica de Ciencias Naturales 5 AñoDokument4 SeitenEvaluación Diagnostica de Ciencias Naturales 5 AñovcperezNoch keine Bewertungen
- Historia 3° BásicoDokument16 SeitenHistoria 3° Básicodaniela morenoNoch keine Bewertungen
- Celula 1Dokument4 SeitenCelula 1Lucero ReyesNoch keine Bewertungen
- Conversion de Unidades GuiaDokument6 SeitenConversion de Unidades GuiaDavid ZapataNoch keine Bewertungen
- Ciencias 8° Celulas, Tejidos y Transporte BasicoDokument10 SeitenCiencias 8° Celulas, Tejidos y Transporte Basicoalex reyesNoch keine Bewertungen
- Crucigrama El Atomo Guia de Quimica Prueba Tabla PeriodicaDokument7 SeitenCrucigrama El Atomo Guia de Quimica Prueba Tabla PeriodicaLaura Ramirez0% (1)
- 1-La Tabla PeriodicaDokument9 Seiten1-La Tabla PeriodicaANGUI HANELOREN ROA CELISNoch keine Bewertungen
- Ciencias Naturales Sexto GradoDokument2 SeitenCiencias Naturales Sexto Gradoisa A VelasquezNoch keine Bewertungen
- S1. Guia 1 Capas de La Tierra 6 Año PlataformaDokument2 SeitenS1. Guia 1 Capas de La Tierra 6 Año PlataformaVicente Alonso Yáñez LagosNoch keine Bewertungen
- 3 Ciencias Naturales Quinto - Sede Principal PDFDokument10 Seiten3 Ciencias Naturales Quinto - Sede Principal PDFJuliana PovedaNoch keine Bewertungen
- E2 - 1° Ciencias NaturalesDokument8 SeitenE2 - 1° Ciencias NaturalesManuelGuillermoMartinezCanchilaNoch keine Bewertungen
- Unidad 2 La Civilización GriegaDokument69 SeitenUnidad 2 La Civilización GriegaMyriam FernandezNoch keine Bewertungen
- Masa y Peso TOPDokument3 SeitenMasa y Peso TOPJaime Mauricio González GuzmánNoch keine Bewertungen
- Guia 5 Fisica 7 Conservacion de La EnergiaDokument4 SeitenGuia 5 Fisica 7 Conservacion de La EnergiaJUAN DEL CRISTO FLOREZ ROMERONoch keine Bewertungen
- QUIMICADokument5 SeitenQUIMICApatito feoNoch keine Bewertungen
- 8° B PAUTA Guía de Trabajo Nutricion y SaludDokument4 Seiten8° B PAUTA Guía de Trabajo Nutricion y SaludcarmenceciliaNoch keine Bewertungen
- Trabajo Práctico Biologia EtiquetasDokument9 SeitenTrabajo Práctico Biologia EtiquetasPaula BarriosNoch keine Bewertungen
- Fichas de Sugerencias Didacticas de Conocimiento Del Medio y Ciencias NaturalesDokument64 SeitenFichas de Sugerencias Didacticas de Conocimiento Del Medio y Ciencias NaturalesAbby ContrerasNoch keine Bewertungen
- Guía de Estudio Modelos AtómicosDokument6 SeitenGuía de Estudio Modelos AtómicosPamelaNoch keine Bewertungen
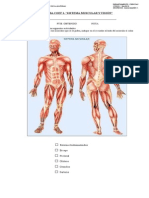
- 5 Basico - Sistema MuscularDokument3 Seiten5 Basico - Sistema MuscularIvan Vargas BustamanteNoch keine Bewertungen
- Examen 6toDokument3 SeitenExamen 6toCarolina PantojaNoch keine Bewertungen
- COMO CALCULAR EL NUMERO ATOMICO Y MASICO 1 CorrecionDokument1 SeiteCOMO CALCULAR EL NUMERO ATOMICO Y MASICO 1 Correcionvanessa paola perez vivanqueNoch keine Bewertungen
- Consonante QDokument3 SeitenConsonante Qdenis darwitgNoch keine Bewertungen
- 6° Basico Ciencias Naturales Cambios de EstadoDokument20 Seiten6° Basico Ciencias Naturales Cambios de EstadoWalt Arnaldi LeivaNoch keine Bewertungen
- 03-19 Clase 3 CIENCIAS Cambios en Los Materiales.Dokument23 Seiten03-19 Clase 3 CIENCIAS Cambios en Los Materiales.Daniela HerreraNoch keine Bewertungen
- 2 Guia de Nutricion Octavo Basico OlimpiaDokument4 Seiten2 Guia de Nutricion Octavo Basico OlimpiaGerith MuñozNoch keine Bewertungen
- Evaluacion de Seguimeinto 7°Dokument2 SeitenEvaluacion de Seguimeinto 7°darlenisNoch keine Bewertungen
- Estados y Cambios de La Materia 2aDokument6 SeitenEstados y Cambios de La Materia 2adanielleNoch keine Bewertungen
- Estados de La MateriaDokument34 SeitenEstados de La Materiapaula0909Noch keine Bewertungen
- C NATURALES EL UNIVERSO Como Se Formo El Sistema Solar 5Dokument6 SeitenC NATURALES EL UNIVERSO Como Se Formo El Sistema Solar 5Julian MendietaNoch keine Bewertungen
- Guía N°3 La Fuerza y Tipos de FuerzasDokument3 SeitenGuía N°3 La Fuerza y Tipos de FuerzasJorge Enrique Barrera Maigual100% (1)
- Leyes de KeplerDokument82 SeitenLeyes de KeplerNedko JunuzovicNoch keine Bewertungen
- Leccion N°2 Los Estados de La MateriaDokument12 SeitenLeccion N°2 Los Estados de La MateriaPiery Contreras ZuñigaNoch keine Bewertungen
- Taller Modelos AtomicosDokument7 SeitenTaller Modelos AtomicosRosiDanis0% (1)
- Prueba Historia CONTINENTESDokument5 SeitenPrueba Historia CONTINENTESMarisol Morales SánchezNoch keine Bewertungen
- Guía Gases Ejercicios Resueltos PDFDokument11 SeitenGuía Gases Ejercicios Resueltos PDFYaira Mamani ApazaNoch keine Bewertungen
- Guía 4 Cambios de Estado en La NaturalezaDokument3 SeitenGuía 4 Cambios de Estado en La NaturalezaMarcosAndrésValenzuelaHuentrutripaiNoch keine Bewertungen
- Guia Amilasa SalivalDokument3 SeitenGuia Amilasa SalivalJULIETA0% (1)
- Ejer Cici Os de Qui MicaDokument6 SeitenEjer Cici Os de Qui MicaRuth Solis MuñozNoch keine Bewertungen
- Leyes de Newton AplicacionesDokument127 SeitenLeyes de Newton AplicacionesDANIELA YAURIS LAZO100% (1)
- Guia de Estudio - U1 - El Universo - Ciencias Sociales Grado 4Dokument2 SeitenGuia de Estudio - U1 - El Universo - Ciencias Sociales Grado 4CarlosNoch keine Bewertungen
- Guia Electrostatica - 8vo 2020Dokument7 SeitenGuia Electrostatica - 8vo 2020Valeria JimenezNoch keine Bewertungen
- Guia de Nutricion 8° BasicoDokument7 SeitenGuia de Nutricion 8° BasicoAlex Mauricio ReyesNoch keine Bewertungen
- Guía Estructura de La Materia (Séptimo)Dokument9 SeitenGuía Estructura de La Materia (Séptimo)pablosexto31100% (1)
- Guia Estructura de La Materia de Septimo y Tabla PeriodicaDokument7 SeitenGuia Estructura de La Materia de Septimo y Tabla PeriodicajahecoNoch keine Bewertungen
- Estructura Del Átomo ModernoDokument8 SeitenEstructura Del Átomo Modernoarnaldo simon sirpa laricoNoch keine Bewertungen
- Guia 2 Grado 11 SolucionesDokument13 SeitenGuia 2 Grado 11 SolucionesJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Guia Noveno FILOGENIADokument16 SeitenGuia Noveno FILOGENIAJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Guia Grado 11 El Carbono y Funciones OrgánicasDokument9 SeitenGuia Grado 11 El Carbono y Funciones OrgánicasJaime Hernan Cortes Restrepo67% (3)
- Guía Gases Grado 11 Primer PeriodoDokument19 SeitenGuía Gases Grado 11 Primer PeriodoJaime Hernan Cortes Restrepo0% (1)
- Guia Genetica Grado NovenoDokument13 SeitenGuia Genetica Grado NovenoJaime Hernan Cortes Restrepo89% (37)
- Guia Quimica Decimo Nomenclatura, Reacciones Quimicas y EstequiometriaDokument15 SeitenGuia Quimica Decimo Nomenclatura, Reacciones Quimicas y EstequiometriaJaime Hernan Cortes Restrepo100% (1)
- Guia de Sexto Seres VivosDokument10 SeitenGuia de Sexto Seres VivosJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Guiaciencia Septimo Seres Vivos - ReproducciónDokument31 SeitenGuiaciencia Septimo Seres Vivos - ReproducciónJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Grado Octavo Seres VivosDokument15 SeitenGrado Octavo Seres VivosJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Guia de Enlace Quimico de SeptimoDokument5 SeitenGuia de Enlace Quimico de SeptimoJaime Hernan Cortes Restrepo100% (3)
- Guia de Nivelacion Del Grado DecimoDokument10 SeitenGuia de Nivelacion Del Grado DecimoJaime Hernan Cortes Restrepo100% (2)
- Guia Nomenclatura NovenoDokument9 SeitenGuia Nomenclatura NovenoJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Guia de Introduccion A La Quimica Grado DecimoDokument7 SeitenGuia de Introduccion A La Quimica Grado DecimoJaime Hernan Cortes Restrepo100% (1)
- Guia de Materia y Energia SextoDokument13 SeitenGuia de Materia y Energia SextoJaime Hernan Cortes RestrepoNoch keine Bewertungen
- Guia de Materia y Energìa Grado OctavoDokument9 SeitenGuia de Materia y Energìa Grado OctavoJaime Hernan Cortes Restrepo0% (1)
- Tabla PeriodicaDokument4 SeitenTabla PeriodicanatachaNoch keine Bewertungen
- 11-2. Geometría Molecular 2 Quimica 1Dokument19 Seiten11-2. Geometría Molecular 2 Quimica 1Esteban CastilloNoch keine Bewertungen
- Electronica BasicaDokument67 SeitenElectronica BasicaWilson Morales100% (1)
- Taller de Física ElectromagnéticaDokument3 SeitenTaller de Física ElectromagnéticaSaray San Juan Reyes0% (1)
- Estudio de Las Propiedades Fisicas de Peliculas PoDokument15 SeitenEstudio de Las Propiedades Fisicas de Peliculas PoCarolina López GonzálezNoch keine Bewertungen
- Martinez Sanchez Erika Lorena 1MM1Dokument8 SeitenMartinez Sanchez Erika Lorena 1MM1Erika LorenaNoch keine Bewertungen
- U1-Modelos AtómicosDokument5 SeitenU1-Modelos AtómicosAnalia HernandezNoch keine Bewertungen
- Paquete de OndaDokument21 SeitenPaquete de Ondashayna7Noch keine Bewertungen
- Modelo Atómico de DaltonDokument6 SeitenModelo Atómico de DaltonJuan CastilloNoch keine Bewertungen
- Modelo Atomico de DaltonDokument2 SeitenModelo Atomico de DaltonlapzserNoch keine Bewertungen
- Cuaderno Tecnico ABB Cuadros de BT Resistentes A Los Arcos InternosDokument33 SeitenCuaderno Tecnico ABB Cuadros de BT Resistentes A Los Arcos InternosDiego MontoyaNoch keine Bewertungen
- PRÁCTICA 1 MateriaDokument2 SeitenPRÁCTICA 1 Materiagael lechuga100% (1)
- Apuntes BiotsavartDokument17 SeitenApuntes BiotsavartPablo ParraguezNoch keine Bewertungen
- Fotodiodo BPW34 Como Receptor de RadiaciDokument22 SeitenFotodiodo BPW34 Como Receptor de Radiacijalmeida88Noch keine Bewertungen
- Constantes NumericasDokument1 SeiteConstantes Numericasmarcuadrado5342Noch keine Bewertungen
- 1.5 - Clase 4 - Modelo de Bandas de EnergiaDokument19 Seiten1.5 - Clase 4 - Modelo de Bandas de EnergiaFeru NandaNoch keine Bewertungen
- Radiografia Industria1l Nivel11Dokument183 SeitenRadiografia Industria1l Nivel11PercyAlexander100% (1)
- Ensayo de ElectromagnetismoDokument3 SeitenEnsayo de ElectromagnetismoJesik Paolita MartinezNoch keine Bewertungen
- 1 IntroducciónDokument53 Seiten1 IntroducciónRoy QuispeNoch keine Bewertungen
- Quimica Bloque 1Dokument49 SeitenQuimica Bloque 1JocelynNoch keine Bewertungen
- Deteccion y DosimetriaDokument27 SeitenDeteccion y DosimetriaWolfgang Rubén OrtizNoch keine Bewertungen
- Unitec Mde 106 BiofísicaDokument32 SeitenUnitec Mde 106 BiofísicaEduardo MiguelNoch keine Bewertungen
- Lab N°12Dokument26 SeitenLab N°12Alejandra Gutierrez ʚïɞ100% (1)
- Asignación 4Dokument1 SeiteAsignación 4Julian RamirezNoch keine Bewertungen
- Dieléctricos LíquidosDokument11 SeitenDieléctricos LíquidosEstefania VeraNoch keine Bewertungen
- P1Res.y Tex. Deprob - EL ATOMO2Dokument2 SeitenP1Res.y Tex. Deprob - EL ATOMO2Carlos AlexisNoch keine Bewertungen
- Cuadernillo de Trabajo Q1 (Autoguardado)Dokument35 SeitenCuadernillo de Trabajo Q1 (Autoguardado)papeleria ciberborealNoch keine Bewertungen
- Sistema Electrico King AirDokument73 SeitenSistema Electrico King AirWilly Andrety100% (3)
- Apuntes FirmesDokument150 SeitenApuntes FirmesRamiroNoch keine Bewertungen
- Modelo de Corriente EléctricaDokument7 SeitenModelo de Corriente EléctricaLuis Quiroga0% (1)