Beruflich Dokumente
Kultur Dokumente
Correction TP Dosage Colorimetrique
Hochgeladen von
Achraf BenkiraneCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Correction TP Dosage Colorimetrique
Hochgeladen von
Achraf BenkiraneCopyright:
Verfügbare Formate
Correction
I.
Gnralits
II.
Etude pralable
II.1
Solution Formule Couleur
Ion responsable des couleurs des solutions utilises : Permanganate de potassium (K+, MnO4) violet : Chlorure de potassium (K+, Cl) incolore : Sulfate de fer (II) (sel de Mohr) (Fe2+, SO42) vert ple : Sulfate de zinc (Zn 2+, SO42) incolore
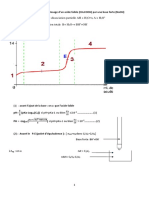
Lion responsable de la teinte de la solution est MnO4 car K+ est incolore. Lion responsable de la teinte de la solution est Fe2+ car SO42 est incolore. II.2 Ractions entre les ions colors Une solution de permanganate de potassium verse dans une solution de sel de Mohr se dcolore. Cette dcoloration est due la consommation de lion color MnO4 ; parmi les espces apportes, il ne reste que les ions K+ incolores. La coloration vert ple du mlange obtenu devient jaune. Cette apparition de couleur traduit la transformation de lion Fe2+ en ion Fe3+. Aprs persistance de la teinte violette, MnO4 est en excs, Fe2+ est devenu limitant. Avant lquivalence, tant que le ractif titrant MnO4 est entirement consomm, le mlange ractionnel est vert (Fe2+ en excs) puis jaune (apparition de Fe3+). Aprs lquivalence, MnO4 nest plus limitant, il ny a plus de Fe2+ entirement consomms donc plus de raction : on ne fait quajouter des ions colors MnO4 do la persistance de la coloration violette. Le reprage prcis de lquivalence est alors observ par le changement brutal de teinte du milieu ractionnel : la goutte de ractif titrant ajout qui ne se dcolore pas (apparition de la teinte violette persistante) indique le moment prcis o les deux ions ont t apport dans des proportions stoechiomtriques. Burette contenant la solution de permanganate de potassium: = 1,0.10-2 mol.L-1.
III.
Dosages :
V1 q = 10,0 mL
IV. IV.1
Exploitation Dispositif Raction de dosage Fe2+ = Fe3+ + e MnO4 + 8 H+ + 5 e = Mn2+ + 4 H2O
IV.2
Erlenmeyer contenant V3 = 20 mL de solution de sel de Mohr titrer et le barreau aimant
_________________________________________________________________
MnO4 + 8 H+ + 5 Fe2+ Mn2+ + 4 H2O + 5 Fe3+ La particule change lors de la transformation est llectron. Cest donc une raction doxydorduction. Loxydant est lespce qui capte les lectrons : MnO4. Le rducteur est celui qui perd les lectrons : Fe2+. Les ions K+ et SO42 sont spectateurs ; incolores, ils ninfluent pas sur la couleur du mlange ractionnel. IV.3 Dtermination de la concentration inconnue A lquivalence, lavancement xq est tel que les quantits de matire des ractifs sont nulles : les ractifs ont t apports en proportions stoechiomtriques.
Agitateur magntique
restants
quation tat initial 0 quivalence xq
MnO4 V1 V1 q xq = 0
+ 8 H+ + excs
5 Fe2+ V3 V3 5 xq = 0
Mn2+ 0 xq
+ 4 H2O + solvant
5 Fe3+ 0 5 xq
Quantit de matire dions fer (II) doss :
xq = V1 q =
n = V3 = 5 V1 q n = 5 x 1,0.10-2 x 10,0.10-3 = 5,0.10-4 mol Concentration en ions Fe2+ de la solution de sel de Mohr : V3 = 5 V1 q
= = = 2,5.10-2 mol.L-1.
Das könnte Ihnen auch gefallen
- Applications de la spectrophotomérie en phytochimie: sciencesVon EverandApplications de la spectrophotomérie en phytochimie: sciencesNoch keine Bewertungen
- TPChi8 Corrige 1S4Dokument3 SeitenTPChi8 Corrige 1S4Abdelkrim ABNoch keine Bewertungen
- TD N°3 Chimie Des SolutionsDokument6 SeitenTD N°3 Chimie Des SolutionsKir3SkalNoch keine Bewertungen
- Chimie-TP4 Determination de QRDokument2 SeitenChimie-TP4 Determination de QRChartier JulienNoch keine Bewertungen
- 04 - Chapitre - 1 - Comportement Des Metaux Lourds Dans Le SolsDokument41 Seiten04 - Chapitre - 1 - Comportement Des Metaux Lourds Dans Le SolsMohamed El BaghdadiNoch keine Bewertungen
- Cours N 02Dokument6 SeitenCours N 02rou röuNoch keine Bewertungen
- 3 Les Liaisons Chimiques - Theorie - 2013Dokument24 Seiten3 Les Liaisons Chimiques - Theorie - 2013Bibi BibaNoch keine Bewertungen
- Protocole Chromatographie - ExtractionDokument3 SeitenProtocole Chromatographie - ExtractionOthilieNoch keine Bewertungen
- Mangani M Ét RieDokument5 SeitenMangani M Ét RieVictoria BuciuceanuNoch keine Bewertungen
- c1 - Correction Des ExercicsDokument7 Seitenc1 - Correction Des ExercicsBenjamin JavaudinNoch keine Bewertungen
- Méthode D'extraction: Réaliser Par: Benzeghiba ChahinezDokument23 SeitenMéthode D'extraction: Réaliser Par: Benzeghiba ChahinezChahinez BenzeghibaNoch keine Bewertungen
- Corrigé Série 5Dokument26 SeitenCorrigé Série 5Ghada SOUIKINoch keine Bewertungen
- Terpènes Et Biosynthèse TerpéniqueDokument15 SeitenTerpènes Et Biosynthèse TerpéniqueRẵmîRandyHassad100% (1)
- 10 ComplexometrieDokument4 Seiten10 Complexometrieرضاك ابي واميNoch keine Bewertungen
- La Spectrofluorimetrie ToDokument15 SeitenLa Spectrofluorimetrie ToMiskine FilsNoch keine Bewertungen
- La Digestion - Test D'identificationDokument26 SeitenLa Digestion - Test D'identificationSika x100% (1)
- Corrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Dokument2 SeitenCorrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Zahra l زهرة50% (2)
- QCM Dentrainement Chimie GeneraleDokument6 SeitenQCM Dentrainement Chimie GeneraleHarakat Elhoucine100% (1)
- Chimie AnalytiqueDokument71 SeitenChimie Analytiquemejri amalNoch keine Bewertungen
- Cours SM - Master - 2021-2022 PDFDokument37 SeitenCours SM - Master - 2021-2022 PDFHasna DaoudiNoch keine Bewertungen
- Fiche TD-5 Avec CorrigéDokument6 SeitenFiche TD-5 Avec CorrigéFarouk AliNoch keine Bewertungen
- Spectrometrie de Masse LPVPT 2022 - 2023Dokument81 SeitenSpectrometrie de Masse LPVPT 2022 - 2023Mimi BCG100% (1)
- Dosage RedoxDokument13 SeitenDosage RedoxLina BahazNoch keine Bewertungen
- Chapitre 2 - SpectroscopieDokument5 SeitenChapitre 2 - SpectroscopieBeatrice Florin100% (3)
- Méthodes D'analyses Spectroscopiques UVDokument29 SeitenMéthodes D'analyses Spectroscopiques UVKhaled BouchaourNoch keine Bewertungen
- CHAPVDokument65 SeitenCHAPVsoumia bouNoch keine Bewertungen
- Trafic Intracellulaire Et Compartiment CellulaireDokument24 SeitenTrafic Intracellulaire Et Compartiment Cellulairecoursenligne.lille186% (7)
- S6 Chapitre 6 Cinetique Chimique PDFDokument12 SeitenS6 Chapitre 6 Cinetique Chimique PDFAzizElheni100% (1)
- Metabolisme SecondaireDokument32 SeitenMetabolisme Secondairemekaek100% (7)
- TP Spectroscopie M1 Chim Des MatDokument7 SeitenTP Spectroscopie M1 Chim Des MatIbtissam EnnaouiriNoch keine Bewertungen
- SMC3 - TD & Examens Corrigés (Chimie Descriptive II)Dokument52 SeitenSMC3 - TD & Examens Corrigés (Chimie Descriptive II)Yc YacineNoch keine Bewertungen
- Liste Exercices Photosynthèse Début PétroleDokument3 SeitenListe Exercices Photosynthèse Début PétroleSouha JoukhadarNoch keine Bewertungen
- TD 3 Avec Corrigé de Chimie en SolutionDokument7 SeitenTD 3 Avec Corrigé de Chimie en SolutionETUSUPNoch keine Bewertungen
- Fiche 2-Logiciel-2 - Corrigé (Conditions de Germination D'une Graine)Dokument2 SeitenFiche 2-Logiciel-2 - Corrigé (Conditions de Germination D'une Graine)Roger Asmar100% (3)
- Dosage Des Ions FluoruresDokument6 SeitenDosage Des Ions Fluoruresselmi nourelhoudaNoch keine Bewertungen
- Exposé Sur DosageDokument30 SeitenExposé Sur DosageFaiçalEssabery100% (2)
- TP s5 2018 2019 PR Abdelaaziz El Gadi Et Pr. Kholtei AbdelilahDokument34 SeitenTP s5 2018 2019 PR Abdelaaziz El Gadi Et Pr. Kholtei AbdelilahMounir DABOUZNoch keine Bewertungen
- TD 1 Techniques D'analysesDokument4 SeitenTD 1 Techniques D'analysesGalounou IssaNoch keine Bewertungen
- Ds 2 CorrigéDokument22 SeitenDs 2 CorrigéSouad BouafiaNoch keine Bewertungen
- TD2 CorrectionsDokument4 SeitenTD2 CorrectionsELKEDMIRIabdeljalilNoch keine Bewertungen
- LPVPT - TD N°1 - TD N°2Dokument30 SeitenLPVPT - TD N°1 - TD N°2Mimi BCGNoch keine Bewertungen
- TSMS - Cours.BH .Chap1. - .III.-.L Appareil - Respiratoire.et - Les.echanges - GazeuxDokument4 SeitenTSMS - Cours.BH .Chap1. - .III.-.L Appareil - Respiratoire.et - Les.echanges - GazeuxWoonam Bang100% (1)
- Biochimie MétaboliqueDokument225 SeitenBiochimie MétaboliqueNicholNoch keine Bewertungen
- Chimie MecanismesReactionnelsDokument6 SeitenChimie MecanismesReactionnelsAshall David WheiNoch keine Bewertungen
- OsmomètrieDokument16 SeitenOsmomètrieredwaneNoch keine Bewertungen
- B3a Spectroscopie IRDokument5 SeitenB3a Spectroscopie IRhamoumNoch keine Bewertungen
- Exercices N 5 Et 6Dokument7 SeitenExercices N 5 Et 6ahlemmNoch keine Bewertungen
- ChemDokument5 SeitenChemAnonymous svBEhGhEINoch keine Bewertungen
- Série n6 SPECTRO DE MASSE PDFDokument3 SeitenSérie n6 SPECTRO DE MASSE PDFMahdi Jmai100% (1)
- TD AtomistiqueDokument8 SeitenTD AtomistiqueMoustapha BelmoudenNoch keine Bewertungen
- Cours Rhéologie 2 - Typologie Des Differents Modes DécoulementDokument11 SeitenCours Rhéologie 2 - Typologie Des Differents Modes Découlementmohamed kamal100% (1)
- Fluorimetrie PDFDokument12 SeitenFluorimetrie PDFЮляВиталикNoch keine Bewertungen
- TP 1 Preparation Solution 2020 2021 1Dokument6 SeitenTP 1 Preparation Solution 2020 2021 1BillarjohnNoch keine Bewertungen
- Chimie TD 3 Cinétique ChimiqueDokument4 SeitenChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- Exercices de Biochimie Métabolique: TweeterDokument7 SeitenExercices de Biochimie Métabolique: TweeterLAMINE DEGUISTARNoch keine Bewertungen
- Dosage Acido-Basique FRDokument3 SeitenDosage Acido-Basique FRAicha DaouNoch keine Bewertungen
- TitrageDokument2 SeitenTitrageRebecca JacksonNoch keine Bewertungen
- Chimie Chapitre3 III - ApplicationDokument1 SeiteChimie Chapitre3 III - Applicationmourad.mustaphaNoch keine Bewertungen
- TP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrDokument15 SeitenTP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrLawrence Mundene-timotheeNoch keine Bewertungen
- DM 1 Chap 2 3 4Dokument3 SeitenDM 1 Chap 2 3 4Mattys TotoNoch keine Bewertungen
- Le CND Par GC Et CGDokument2 SeitenLe CND Par GC Et CGEl Mehdi AkhatarNoch keine Bewertungen
- Fiche Methode Modele LewisDokument23 SeitenFiche Methode Modele LewisEl Mehdi AkhatarNoch keine Bewertungen
- 1S - DS4 PDFDokument2 Seiten1S - DS4 PDFEl Mehdi AkhatarNoch keine Bewertungen
- Correction Physique Chimie S 2013Dokument8 SeitenCorrection Physique Chimie S 2013El Mehdi AkhatarNoch keine Bewertungen
- Piles Et AccusDokument14 SeitenPiles Et AccusEl Mehdi AkhatarNoch keine Bewertungen
- Exercices de Physique TSDokument116 SeitenExercices de Physique TSerrairachid100% (4)
- Exercices de Physique TSDokument116 SeitenExercices de Physique TSerrairachid100% (4)
- Paradoxe de JumeauxDokument6 SeitenParadoxe de JumeauxEl Mehdi AkhatarNoch keine Bewertungen
- E06 MecaniqueDokument42 SeitenE06 Mecaniquefirhtam_20087250100% (1)
- Exercices Equilibre 3 Forces Bep IndustrielDokument16 SeitenExercices Equilibre 3 Forces Bep IndustrielEl Mehdi Akhatar0% (1)
- 1S.pb4.TP Etalonnage RessortDokument3 Seiten1S.pb4.TP Etalonnage RessortEl Mehdi Akhatar0% (1)
- Cours & Exercices D'electricite - Cesi - 20042007Dokument114 SeitenCours & Exercices D'electricite - Cesi - 20042007Oumaima Slim100% (4)