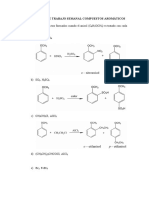
Beruflich Dokumente
Kultur Dokumente
Quimica PDF
Hochgeladen von
reyes_3100Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Quimica PDF
Hochgeladen von
reyes_3100Copyright:
Verfügbare Formate
Introduccin al estudio de la qumica
Por qu estudiar qumica?
El asombro por la observacin del mundo que le rodea, le ha permitido al ser humano desarrollar su inteligencia y su creatividad a partir de la curiosidad con la que cuenta, y que es caracterstica de su condicin humana. Observa en su entorno seres vivos semejantes a l y algunos que no lo son, objetos inanimados de diferentes clases, paisajes que varan segn el lugar donde se encuentre ubicado, sucesos que ocurren de manera natural; descubre tanto propiedades como fases que se suceden de alguno de esos eventos; comienza a reconocer sus propias ideas y reflexiones respecto de lo que observa, de cmo lo observa (percatacin) y de cmo puede utilizar lo que observ. Se auxilia de clasificaciones de aquello que perciben sus sentidos y descubre su inters en algunos temas particulares. Desarrolla un pensamiento sistemtico que lo conduce a comprender su universo y a establecer bases adecuadas para continuar el estudio de cualquier evento de manera cientfica. Uno de los temas de su inters es el estudio de la composicin de la materia y la energa, y las distintas formas en que stas se encuentran en la naturaleza; tambin la transformacin de ellas para dar origen a mltiples materiales que transforma para satisfacer sus necesidades. Incluso ha desarrollado sistemas llamados industrias que se encargan de dichas transformaciones. Si damos un vistazo al mundo que nos rodea podremos observar que ha habido un gran desarrollo en la industria de los alimentos, la construccin, la medicina, la robtica, la industria textil, la electrnica, la tecnologa de autos, aviones y naves espaciales, etctera. Es entonces cuando se requiere que existan personas especializadas en estos campos de conocimiento. Se les llama profesionales y entre ellos estn los ingenieros: civiles, industriales, mecnicos, qumicos, electrnicos, mecatrnicos e inclusive los ingenieros en computacin. Todos ellos necesitan, para su desempeo laboral, conocer las caractersticas fsicas y qumicas de un gran nmero de materiales entre los que puedan seleccionar aquellos que respondan a necesidades especficas de su campo. En resumen, el conocimiento de los materiales, sean stos naturales, artificiales, sintticos o modificados por el ser humano, es de suma importancia para un estudiante de ingeniera: la qumica est presente en todas partes. La estructura de un material depende de su composicin y de la disposicin de los tomos, iones o molculas que lo forman, lo que determina la manera en que se unen a travs de enlaces qumicos al interaccionar con otras sustancias. El estudio de la qumica es por ello una herramienta fundamental para conocer las propiedades de las sustancias, y un punto de partida para disear nuevos materiales que satisfagan necesidades especficas. El objetivo de este libro es que adquieras un conocimiento bsico de la qumica, que te permita comprender las propiedades de los materiales y su utilidad para algunas aplicaciones especficas relacionadas con tu inters profesional.
u n i d a d
Concepto de qumica
En una concepcin general podemos delimitar el campo de estudio de la qumica entre materia, energa y cambio; en trminos ms especficos: la qumica es la ciencia que estudia la composicin y las propiedades de la materia, as como las transformaciones que experimenta y la energa asociada con esos cambios.
17
Qumica
Ejercicio
u n i d a d
1. En el rea de ingeniera de tu inters se manejan diversos materiales. Investiga el nombre de cinco materiales slidos de origen natural y su aplicacin en alguna actividad que hayas observado o realizado. Por ejemplo, la madera y su uso para construir libreros. Material ___________________ ___________________ ___________________ ___________________ ___________________ Aplicacin ____________________________________________________________ ____________________________________________________________ ____________________________________________________________ ____________________________________________________________ ____________________________________________________________
2. En relacin con la pregunta anterior, investiga el nombre de cinco materiales slidos nuevos, es decir, fabricados por el ingenio humano, e igualmente, su aplicacin en alguna actividad que hayas observado o realizado. Por ejemplo, el caucho sinttico y su uso para la fabricacin de llantas. Material ___________________ ___________________ ___________________ ___________________ ___________________ Aplicacin ____________________________________________________________ ____________________________________________________________ ____________________________________________________________ ____________________________________________________________ ____________________________________________________________
3. Muchos trminos asociados con la qumica se utilizan comnmente en la vida cotidiana, aunque en ocasiones no conocemos su significado preciso. Encuentra su significado en una publicacin (libro, revista, diccionario, etc.) y utiliza el trmino o alguno de sus derivados, en la construccin de una aseveracin que escribirs en tu cuaderno. Entre los ms comunes estn: densidad, solubilidad, oxidacin, corrosin, biodegradable, estabilidad, residuo, evaporacin, voltil y material.
Conceptos bsicos de qumica
En esta unidad se estudian los estados fsicos de la materia, su estructura qumica y la naturaleza de las partculas que la conforman.
La materia
Composicin de la materia Desde los tiempos ms remotos, el hombre se ha preguntado de qu est hecho tanto l como todo lo que le rodea. En cuanto a la sustancia de la que est hecho el hombre, a lo largo de los siglos surgieron muchas explicaciones: las religiosas hablaban de materiales que iban desde el barro (tradicin judeocristiana) hasta materiales como el maz (tradicin mesoamericana).
18
Introduccin al estudio de la qumica
Filsofos como Aristteles (384-322 a. C.) postularon que las sustancias elementales eran cuatro: el agua, el aire, el fuego y la tierra. Los alquimistas trataron con empeo de encontrar al quinto elemento, la quintaesencia o piedra filosofal, un algo que permitira transmutar la naturaleza de las sustancias y as, por ejemplo, convertir el plomo en oro. Pero fue hasta que el hombre aprendi a manejar diversas sustancias qumicas cuando surgi la idea de que los humanos podramos estar formados por las mismas sustancias que componen al resto del universo. De hecho, ahora sabemos que el ser humano, al igual que los dems seres vivos y todas las cosas que hay en nuestro planeta, estn constituidos por los mismos componentes. Estamos formados de materia diversa que se relaciona entre s de manera bioqumica y biofsica. Somos, de hecho, un conjunto de sustancias qumicas complejas, producto de la evolucin del universo de miles de millones de aos.
u n i d a d
Materia es todo lo que ocupa un lugar en el espacio y posee masa. A una porcin definida de materia se le llama cuerpo: un transistor, un anillo, un cuaderno, un torno, un globo, un reactor, el sol, el agua dentro del vaso o el aire contenido en un globo son ejemplos de cuerpos; mientras que hablar de oro, papel, vidrio, polietileno, caucho, hierro, agua y aire, es referirse a tipos de materia. De esta manera al polietileno se le define como materia, una botella de polietileno es un cuerpo.
Clasificacin de la materia
Toda la materia posee caractersticas propias que nos permiten distinguirla de entre otras. Algunas de esas caractersticas son directamente observables, como la forma, la textura, el color, la masa o el volumen; otras deben determinarse a travs de pruebas o exmenes, por ejemplo: la densidad, la composicin elemental, la pureza, etctera. Dada la amplia variedad de sustancias, se les clasifica para facilitar su estudio. La clasificacin puede hacerse con base en diferentes criterios, por ejemplo: a) En funcin de su estado de agregacin: slido, lquido o gas. b) Considerando su pureza: sustancias puras o mezclas. c) A partir de su composicin: como elementos simples o compuestos. Otras clasificaciones podran basarse, por ejemplo, en su origen (naturales o sintticas), su relacin con los componentes de los seres vivos o minerales (orgnicas o inorgnicas), su peligrosidad (txicas, inflamables, explosivas), su abundancia relativa en la naturaleza (componentes mayoritarios, componentes menores, trazas).
Estados de agregacin de la materia Tradicionalmente se considera que los estados de agregacin son tres: estado slido, estado lquido y estado gaseoso. No obstante, los fsicos y los qumicos nucleares reconocen otros estados de agregacin, el que se menciona con mayor frecuencia es el plasma, que no es otra cosa que un elemento gaseoso ionizado, generalmente a muy alta temperatura. Ionizado significa que los tomos del elemento han perdido algunos o todos sus electrones, y por lo tanto sus tomos se encuentran en un estado excitado. Esto es observable directamente porque el gas 19
Qumica
u n i d a d
emite luz. Son ejemplos de plasma el gas ionizado y caliente de las estrellas, incluyendo nuestro Sol, y el fuego, que no es otra cosa que los gases de la combustin calientes e iluminados; asimismo las lmparas de halgeno o lmparas de nen contienen un gas que, al paso de la electricidad, se ioniza y se ilumina emitiendo colores muy vistosos y caractersticos del gas que est presente. Otras formas todava ms extraas en las que se presenta la materia, son las estudiadas por la fsica estelar y la fsica cuntica. As, la materia supercondensada de las estrellas enanas blancas, de los pulsares y de los hoyos negros que existen en el espacio estelar, cuyas condiciones de extraordinaria fuerza gravitacional literalmente aplastan a la materia haciendo que se junten los ncleos de los tomos unos con otros, da lugar a una concentracin de la materia en volmenes tan pequeos que nada tienen que ver con lo que conocemos. La primera caracterstica observable de la materia es sin duda el estado fsico en que se encuentra, lo cual afecta su comportamiento. Por ejemplo, un baln, un poco de agua y un poco de humo se comportarn de distinta manera al colocarlos en diversos recipientes. Si se introduce en un vaso o se coloca sobre la mesa, el baln (slido) conservar su forma; en tanto que, el agua (lquido) fluye y se adaptar a la forma del recipiente: dentro del vaso tomar la forma de ste y sobre la mesa se extender al mximo. Finalmente, el humo (gas) tambin fluye y se difundir hasta llenar el vaso y luego se escapar, expandindose por toda la habitacin, y difcilmente entrar en contacto con la mesa. Los slidos tienen una forma definida y un volumen fijo. Los lquidos tienen volumen fijo pero no tienen forma definida. Los gases no tienen forma definida ni volumen fijo. Puede decirse que el ms ordenado de los estados de la materia es el estado slido, pues todos los cuerpos slidos conservan su forma, y por lo mismo su volumen, en tanto que el ms desordenado es el estado gaseoso, ya que los gases tienden a ocupar todo el espacio disponible y se escapan si no se les mantiene encerrados en un recipiente hermtico. En los lquidos, la ordenacin es intermedia, pues aunque no tienen forma definida, s ocupan un volumen fijo. Los slidos son los que tienen mayor importancia como materiales de ingeniera, aunque los lquidos y los gases tambin estn presentes en muchos procesos industriales. Los estados fsicos de la materia se llaman estados de agregacin molecular. El estado fsico de la materia no es permanente, depende de las condiciones de presin y temperatura en que sta se encuentre. Por ejemplo, el agua se encuentra en estado lquido en los mares, ros y lagos, pero se congela y convierte en hielo, o nieve, en lugares donde la temperatura es muy baja, como en Alaska, en el Polo Sur o en algunos lugares montaosos. En cambio, en lugares extremadamente calurosos como los desiertos, o al someterla a calentamiento, el agua se convierte en vapor. Para llevar a cabo los cambios de slido a lquido, de lquido a gas y de slido a gas, es necesario aplicar calor, mientras que para realizar los procesos inversos, lo indicado es enfriar (quitar calor). A cada uno de los cambios de estado se les designa por un nombre especfico como se muestra en la figura 1.1.
20
Introduccin al estudio de la qumica
Fusin Slido Solidificacin Lquido
Gas
E o vap eb or ull ac ici in o Lic n co ue nd fa c en ci sa n ci n
Figura 1.1 Procesos de cambio para los estados de agregacin de la materia.
u n i d a d
s De ub lim
Su ac m bli in
Como se puede apreciar en la figura anterior se observan diferencias en la distancia entre las partculas, lo que causa las marcadas diferencias en las propiedades que caracterizan a las sustancias que se encuentran en cada uno de los estados de agregacin. Los slidos poseen el mximo empaquetamiento, por lo que son incompresibles, es decir, no es posible que sus partculas se acerquen ms entre s. Se considera que una sustancia se encuentra en estado slido nicamente si posee el empaquetamiento regular y repetitivo de un sistema cristalino, si esa condicin no se cumple, la sustancia aparentemente slida no es sino un lquido sobreenfriado, es decir, un vidrio, ya que sus tomos no mantienen una distribucin homognea a corto y a largo alcance. En un gas, las partculas son independientes entre s. Se mantienen tan alejadas unas de otras como se los permite el volumen del recipiente que los contiene. Es posible comprimir un gas, aumentando su presin o disminuyendo su temperatura, hasta que sus partculas estn lo suficientemente prximas entre s para licuarlo o, incluso, solidificarlo. Entre las partculas de un lquido hay una ligera interaccin: las fuerzas de cohesin son moderadas y no muy diferentes en magnitud a las trmicas, por lo que se observa una estructura hasta cierto punto ordenada, pero sin mantener una distribucin rgida. Las partculas poseen movimiento de traslacin que, sin embargo, las mantiene muy cercanas entre s y con muy poco espacio libre entre ellas. sta es la razn por la que los lquidos son, al igual que los slidos, virtualmente incompresibles. Tericamente, la mayora de las sustancias pueden existir en cualquiera de los tres estados fsicos y aun en estados simultneos de equilibrio entre dos o ms fases. Algunas sustancias requieren condiciones de temperatura y presin extremas para pasar del estado slido al estado lquido. Esto ocurre en algunos metales (enlace metlico), las sales metlicas (enlace inico), el diamante (enlace covalente) y minerales como el cuarzo (enlaces mixtos), debido a que en estos materiales no es posible determinar el inicio o el final de una molcula; todos y cada uno de los tomos que los constituyen se encuentran enlazados con el mismo tipo o combinacin de enlaces, por lo que se considera que todo el conjunto de tomos conforma una sola molcula. El estado de agregacin es resultado del balance de las fuerzas de cohesin entre los tomos, iones o molculas, que tienden a ordenar las partculas, y las fuerzas trmicas (temperatura), que tienden a desordenarlas. En la prctica hemos observado que no todas las sustancias se funden o solidifican a la misma temperatura. Por ejemplo, si calentamos en la estufa un poco de sal, a esa temperatura los cristales no alcanzan a fundirse; en cambio, si tratamos de la misma manera un poco de azcar, no slo se funde, sino que se oscurece y termina por quemarse. Si introducimos en el congelador un pequeo volumen de alcohol, el alcohol se mantiene en estado lquido; en tanto que bajo las mismas condiciones, el agua se congela. La temperatura a la cual se funde cada sustancia es caracterstica y se le llama punto de fusin. De modo semejante, a la temperatura a la que hierve cada lquido se le llama punto de ebullicin.
ac in
21
Qumica
u n i d a d
Si en un laboratorio a nivel del mar, calentamos poco a poco un recipiente que contenga hielo, observaremos que la temperatura del slido aumenta, lo que ocasiona que se funda y se convierta en agua lquida; si la temperatura del agua se sigue elevando hasta llegar a 100 C, una vez alcanzada esta temperatura, el agua empieza a hervir y la temperatura se mantiene sin cambio a pesar de que el calentamiento contine. Si se registran en una tabla de datos los valores de temperatura y tiempo, y se grafican, se obtiene un trazo similar al que se muestra en la figura 1.2. Las secciones horizontales indican que la temperatura permanece constante a pesar de que el calentamiento contine.
T oC 140 Agua lquida y vapor de agua Vapor de agua Agua lquida
nt o
Figura 1.2 Grfica de los datos obtenidos durante el calentamiento de agua en el nivel del mar.
120 100 80 60 40 20 0 10 Agua lquida y agua slida
C al ie
en
am
Agua slida (hielo) t (min)
En la figura 1.2 se observan dos secciones horizontales que indican que la temperatura se mantiene constante. La primera, que corresponde a los 0 C, ilustra el punto de fusin del hielo, periodo durante el cual, el calor suministrado incrementa el movimiento entre las molculas, las aleja unas de otras y se va destruyendo la disposicin geomtrica del slido. La segunda seccin corresponde a los 100 C, cuando se alcanza el punto de ebullicin del agua, la temperatura permanece constante porque el calor suministrado se utiliza para el cambio del estado lquido al estado gaseoso, la distancia entre las molculas aumenta y el volumen se incrementa proporcionalmente al calentamiento. Al convertirse el lquido en vapor, la temperatura aumenta nuevamente. A nivel del mar el agua hierve a 100 C, pero en la Ciudad de Mxico, debido a la altitud y la consecuente menor presin atmosfrica, el agua hierve a 92 C. Esto demuestra que los puntos de ebullicin, referidos como constantes de los lquidos, varan con la altitud, es decir, con la presin atmosfrica.
Ejercicio 2
1. Menciona los estados de agregacin de la materia y dos caractersticas macroscpicas observables. 2. Indica por qu los gases y los lquidos se inscriben en una categora llamada fluidos. 3. Identifica en la tabla de la pgina siguente con una si se trata de gases, mezclas gaseosas, lquidos, soluciones, slidos o aleaciones (Referencia: 25 C). 4. Algunas propiedades, como el punto de fusin y el punto de ebullicin, son constantes y caractersticas de cada sustancia, por lo que pueden servir para identificarlas. En la primera seccin de la columna distingue con una el tipo sustancia. Investiga en la bibliografa recomendada el punto de fusin y el punto de ebullicin (en el caso de existir) de las sustancias incluidas en la tabla y complementa la informacin donde corresponde.
22
Introduccin al estudio de la qumica
Salsa de soya Plstico Pintura de zapatos Merthiolate Mercurio Madera Latn Hierro Helio Gas combustible Dixido de carbono Cloro Bronce Amalgama Alcohol Aire Aceite
Gas
Mezcla Lquido Solucin Slido Aleacin gaseosa
T fusin (C)
T
ebullicin
(C)
u n i d a d
5. Investiga el significado de fusin y su relacin con el punto de ebullicin. Revisa la bibliografa recomendada. 6. Investiga el significado de fundir y fusionar. Haz notar las diferencias entre el significado de esos trminos. Revisa la bibliografa recomendada. 7. Cul ser el estado fsico que tendr, a la temperatura ambiente, una sustancia cuyo punto de ebullicin es 75 C? 8. Anota el nombre de los cambios de estado que se indican: Cambio de slido a lquido ___________________________________________________ Cambio de lquido a gas ___________________________________________________ Cambio de gas a lquido ___________________________________________________ Cambio de lquido a slido ___________________________________________________ Cambio de slido a gas ___________________________________________________ Cambio de gas a slido ___________________________________________________
Sustancias puras y mezclas
Tomando en cuenta tus experiencias en la vida diaria y lo aprendido sobre los estados de agregacin de la materia, sabrs que basta observar la forma y el volumen de una sustancia para clasificarla como un lquido, un slido o un gas; sin embargo, existen otras caractersticas de la materia, como la pureza, que en ocasiones son difciles de percibir. Existen dos clases de sustancias puras: los compuestos y los elementos. La diferencia entre ellas es la variedad de sus componentes: en tanto los compuestos estn formados por dos o ms elementos qumicos, los elementos estn formados solamente por tomos iguales entre s. Algunos ejemplos de sustancias puras son: oxgeno, plata y aluminio (que son elementos) y cloruro de sodio (sal), etanol (alcohol), propanona (acetona), glucosa, benceno, sacarosa (azcar) (que son compuestos), etctera. En una sustancia pura todas las partculas, tomos o molculas, son iguales. 23
Das könnte Ihnen auch gefallen
- AaaaaaaaaaaaDokument134 SeitenAaaaaaaaaaaaHENRY HUACCAYCACHACC CAJAMARCANoch keine Bewertungen
- Solucionario de Hidrolisis y BufferDokument23 SeitenSolucionario de Hidrolisis y BufferEDWIN ALEXANDER HUERTAS CUEVA86% (7)
- Ejercicios Estructura Atomica, Tabla Periodica y EnlacesDokument2 SeitenEjercicios Estructura Atomica, Tabla Periodica y EnlacesNicol Alexandra Urbina LovonNoch keine Bewertungen
- Alcohol IsopropílicoDokument3 SeitenAlcohol Isopropílicofreshmarket andinoNoch keine Bewertungen
- 2.5 Principios de Funcionamiento Del ConductímetroDokument2 Seiten2.5 Principios de Funcionamiento Del ConductímetroDiana RidderNoch keine Bewertungen
- Lab - QG II Repor Práctica 6 - 2022-2Dokument6 SeitenLab - QG II Repor Práctica 6 - 2022-2arturo saltivañeNoch keine Bewertungen
- Estequiometría. Meteorización QuímicaDokument4 SeitenEstequiometría. Meteorización QuímicaLuisaFernandaLeonOrtizNoch keine Bewertungen
- Práctica 1. Ejemplos de Mezcla Homogénea y Heterogénea.Dokument3 SeitenPráctica 1. Ejemplos de Mezcla Homogénea y Heterogénea.Ángel ArriagaNoch keine Bewertungen
- Memoria Descriptiva Aguavila CopiapoDokument12 SeitenMemoria Descriptiva Aguavila CopiapoFernando ValdesNoch keine Bewertungen
- Posiciones de SoldaduraDokument4 SeitenPosiciones de SoldaduraVictor Ticona100% (2)
- Sustancias y Preparados PeligrososDokument42 SeitenSustancias y Preparados Peligrososedgardo villazon gutierrezNoch keine Bewertungen
- Química Taller Ácidos y SalesDokument1 SeiteQuímica Taller Ácidos y Saleselissa medinaNoch keine Bewertungen
- Regla de La Palanca 2Dokument3 SeitenRegla de La Palanca 2josSAN.6262Noch keine Bewertungen
- Informe de PasantiasDokument9 SeitenInforme de Pasantiasjhoana montillaNoch keine Bewertungen
- Cuaderno de Trabajo de Quimica Organica IIDokument20 SeitenCuaderno de Trabajo de Quimica Organica IIrosa0% (1)
- Guía de Laboratorio AMCDokument24 SeitenGuía de Laboratorio AMCGeraldine MargaretNoch keine Bewertungen
- Presentacion Quimica IIDokument12 SeitenPresentacion Quimica IIHERNANNoch keine Bewertungen
- Informe de Practica 4 CromatografiaDokument14 SeitenInforme de Practica 4 CromatografiaDavid BurbanoNoch keine Bewertungen
- Quimica 1Dokument2 SeitenQuimica 1Maria De Jesus Roblez VegaNoch keine Bewertungen
- Síntesis de DilantinaDokument3 SeitenSíntesis de Dilantinamirybendecida91Noch keine Bewertungen
- Erosion CorrosionDokument9 SeitenErosion CorrosionCesar Perez SerratoNoch keine Bewertungen
- Quiz 1 - Semana 3 - CB - PRIMER BLOQUE-FLUIDOS Y TERMODINAMICA - (GRUPO6) JIARO INTENTO 2Dokument5 SeitenQuiz 1 - Semana 3 - CB - PRIMER BLOQUE-FLUIDOS Y TERMODINAMICA - (GRUPO6) JIARO INTENTO 2ScarpettaJairoNoch keine Bewertungen
- Hoja Tecnica Compuerta API 6DDokument2 SeitenHoja Tecnica Compuerta API 6DJulio César Méndez VargasNoch keine Bewertungen
- ALCOHOL DiapositivasDokument57 SeitenALCOHOL DiapositivassaulNoch keine Bewertungen
- Ácidos CarboxílicosDokument16 SeitenÁcidos CarboxílicosbsjxujdnNoch keine Bewertungen
- Tesis 2Dokument97 SeitenTesis 2Fran velazquezNoch keine Bewertungen
- Nomenclatura ARENOS 2020Dokument7 SeitenNomenclatura ARENOS 2020Elmer CanelNoch keine Bewertungen
- AF10 Quimica 1 BachDokument15 SeitenAF10 Quimica 1 BachEstefania1987265Noch keine Bewertungen
- Multipro 3000Dokument2 SeitenMultipro 3000RICARDO DONOSONoch keine Bewertungen
- Hoja - EcuRedDokument5 SeitenHoja - EcuRedAlexandre TarquiNoch keine Bewertungen