Beruflich Dokumente
Kultur Dokumente
La Geometría Del Agua 1
Hochgeladen von
Biank ChavezOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
La Geometría Del Agua 1
Hochgeladen von
Biank ChavezCopyright:
Verfügbare Formate
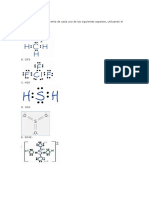
La Geometra del Agua La molcula de agua est constituida por dos tomos de hidrgeno unidos por sendos enlaces
covalentes al tomo de oxgeno. Cada enlace covalente implica la comparticin de dos electrones entre los tomos de hidrgeno, en que cada tomo aporta un electrn. Por lo tanto, los electrones puestos en juego en ambos enlaces covalentes son cuatro. Estos electrones enlazantes, se suelen representar por pares de puntos o trazos, de manera que la molcula de agua puede representarse por los smbolos de los elementos de hidrgeno y oxgeno unidos por trazos: H-O-H. Esta frmula insina una estructura lineal. Adems existen en el tomo de oxgeno dos pares de electrones, que no participan en enlace, situados en un nivel de menor energa, o ltima capa. Al considerar todos los 8 electrones situados en la ltima capa del oxgeno, 2 pares enlazantes y 2 pares no enlazantes, la teora de Repulsin de Pares Electrnicos del Nivel de Valencia, predice la forma de la molcula de agua. Esta teora establece que los pares electrnicos del nivel de valencia, que corresponden a la ltima capa energtica, se sitan en el espacio de manera que entre ellos exista la mnima repulsin ocasionada por su carga negativa. Si los cuatro pares fuesen de igual naturaleza se podra predecir una estructura tetradrica regular para el agua, porque la mejor manera de acomodar cuatro cargas negativas en el espacio, para que exista entre ellas la mnima interaccin, es situndolas en los vrtices de un tetraedro, cuyos lados subtienden un ngulo de 109,5. Puesto que slo dos pares de electrones son enlazantes, stos estn compartidos entre los ncleos de O e H y por lo tanto estos electrones estn mas cerca a ambos ncleos. Los dos pares no enlazantes estn slo localizados sobre el tomo de O por lo que tienden a ocupar mayor espacio alrededor de este tomo y en consecuencia a restarle espacio a los pares enlazantes. Por lo tanto, el ngulo que subtiende las dos uniones oxgeno-hidrgeno es 104,5, menor que el ngulo tetradrico. Si slo se considera los ncleos de los tomos de la molcula de agua, esta especie debera tener una estructura plana, puesto que tres puntos, que no estn en lnea, definen un plano. Si ahora se considera a los electrones enlazantes y no enlazantes de la molcula de agua, su estructura es la de un tetraedro irregular. Cabe deducir que si la molcula de agua no es lineal, tampoco ser una especie apolar. Una molcula polar presenta dos polos o centros de gravitacin de carga negativa y positiva que resultan de la diferente concentracin de electrones en el espacio. Aquel sitio donde exista una mayor concentracin da origen a un centro donde gravita carga negativa y en el otro extremo de ese espacio gravitar, por consecuencia, carga positiva. Al existir un dipolo en tal molcula, sta puede atraer a sus vecinas por fuerzas de atraccin entre cargas de diferente signo.
. Estas fuerzas se denominan atraccin dipolo-dipolo, las cuales son importantes en sustancias al estado lquido o slido donde la cercana molecular es muy grande. Polaridad de la molcula de agua La polaridad de la molcula de agua no slo es consecuencia de su geometra tetradrica irregular, sino que tambin de la naturaleza de sus tomos: hidrgeno, el tomo ms pequeo de la Qumica, y oxgeno, un tomo pequeo, pero principalmente de alta electronegatividad. Este trmino denota a los tomos que presentan gran capacidad de atraer electrones de enlace hacia s. Por lo tanto, el tomo de oxgeno de la molcula de agua atrae hacia s los electrones de los enlaces covalentes con los hidrgenos; hecho que da lugar a una polaridad de enlace. Si la polaridad de enlace se representa por la letra , con su correspondiente signo, entonces la molcula de agua podr representarse como el dibujo de la izquierda.
El puente de hidrgeno Dado que el tomo de oxgeno es pequeo y bastante electronegativo, la concentracin de electrones en su entorno es elevada, por lo que las cargas negativa sobre oxgeno y positiva entre los tomos de hidrgeno son considerables. Se deduce que las atracciones dipolodipolo entre molculas de agua son importantes, en realidad muy fuertes, porque las molculas polares de agua, siendo pequeas, pueden acercarse mucho ms que molculas mayores y pueden atraerse fuertemente por su gran polaridad. Esta atraccin dipolo-dipolo que es inusualmente fuerte y en la que participa el tomo de hidrgeno se denomina puente de hidrgeno.
Esta asociacin intermolecular que se da en el agua lquida y en el hielo, se suele representar por una lnea de puntos. En el hielo, la longitud del enlace de hidrgeno es de 1,77 que se compara con la longitud del enlace covalente H-O de 0,99 . Esta estructura muestra que cada tomo de oxgeno de las molculas de agua que forman una masa de hielo est unido por dos enlaces covalentes a sendos tomos de hidrgeno y por puente de hidrgeno a molculas vecinas. La energa de los puentes de hidrgeno es aproximadamente un 1% del enlace covalente. Esta gran diferencia de energa hace la distincin entre el enlace covalente, que es un enlace qumico y por lo tanto muy fuerte, y el mal llamado enlace de hidrgeno, que slo es una asociacin fsica, porque es una atraccin dipolo-dipolo. Se explic que en la molcula de agua los pares electrnicos enlazantes y no enlazantes estn orientados hacia los vrtices de un tetraedro irregular, por lo que al considerar una masa de hielo, sus molculas forman una inmensa red tridimensional altamente ordenada que evita que las molculas se acerquen mucho entre s. El puente de hidrgeno que se establece, hace que las molculas de agua adopten una estructura que deja huecos hexagonales que forman una especie de canales a travs de la red tridimensional.
Por qu se derrite el hielo? Cuando la energa externa o medio ambiental es superior a la que se encuentra en la masa de hielo, existe mayor vibracin entre las molculas de agua, y, como consecuencia, se rompe dicha red tridimensional para dar paso al agua lquida que se caracteriza por su falta de forma.
Das könnte Ihnen auch gefallen
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseVon EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Mapa de RiesgosDokument5 SeitenMapa de RiesgosRocio Gonzales Horna100% (1)
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaVon EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaBewertung: 5 von 5 Sternen5/5 (1)
- Resumen Primer Parcial IBCMDokument44 SeitenResumen Primer Parcial IBCMNatiele MagdalenoNoch keine Bewertungen
- Bombeo de Protones en Levaduras y Sus Procesos InhibitoriosDokument10 SeitenBombeo de Protones en Levaduras y Sus Procesos InhibitoriosAnnie Villegas0% (1)
- 12-Balances de Masa Con Reacciones Quimicas MultiplesDokument5 Seiten12-Balances de Masa Con Reacciones Quimicas MultiplesLu VargasNoch keine Bewertungen
- Guia 5 Enlaces QuimicosDokument3 SeitenGuia 5 Enlaces QuimicosJuan Pablo Urbano UrbanoNoch keine Bewertungen
- 9.6 - Mecanismos de Secado TransversalDokument42 Seiten9.6 - Mecanismos de Secado TransversalXiime Walburg100% (1)
- Estructura Química Del AguaDokument5 SeitenEstructura Química Del AguaDruciilah BarriiosNoch keine Bewertungen
- Taller Enlace Químico y SoluciónDokument9 SeitenTaller Enlace Químico y SoluciónIdeihanz SanhiedNoch keine Bewertungen
- Ejercicios Eq 1Dokument36 SeitenEjercicios Eq 1Danny GutierrezNoch keine Bewertungen
- GeometríaDokument24 SeitenGeometríaolgaNoch keine Bewertungen
- Tema 2 Agua. Autor Alexander Sanchez Lamas. APROBADODokument16 SeitenTema 2 Agua. Autor Alexander Sanchez Lamas. APROBADOAlexander SanchezNoch keine Bewertungen
- Enlace o Puente de HidrogenoDokument5 SeitenEnlace o Puente de HidrogenojuanNoch keine Bewertungen
- Puentes de Hidrógeno de Las Moléculas de AguaDokument3 SeitenPuentes de Hidrógeno de Las Moléculas de AguaadrianasofiaiparraguirrechuquiNoch keine Bewertungen
- Tema 3 Enlace Químico, Quimica General UDO PDFDokument15 SeitenTema 3 Enlace Químico, Quimica General UDO PDFArioc ParicaNoch keine Bewertungen
- Enlace - Actividades Con Solucion PDFDokument16 SeitenEnlace - Actividades Con Solucion PDFEl Mostajo El MostajoNoch keine Bewertungen
- En LaceDokument6 SeitenEn LacePablo ChumaNoch keine Bewertungen
- 3 Estructura Fuerzas IntermolecularesDokument5 Seiten3 Estructura Fuerzas Intermolecularessalvador garciaNoch keine Bewertungen
- 1 El Agua Como Compuesto QuimicoDokument4 Seiten1 El Agua Como Compuesto QuimicoGabriela Lagua LópezNoch keine Bewertungen
- QUIIMICADokument6 SeitenQUIIMICAJOSUE MANUEL LOPEZ MENDOZANoch keine Bewertungen
- Co ValenteDokument13 SeitenCo ValenteJaviSerewNoch keine Bewertungen
- Contexto Químico de Las CélulasDokument9 SeitenContexto Químico de Las CélulasPaula SoriaNoch keine Bewertungen
- Enlaces Químicos - Química 3ro2daDokument8 SeitenEnlaces Químicos - Química 3ro2daMajo AllendeNoch keine Bewertungen
- Puente de HidrogenoDokument2 SeitenPuente de HidrogenoFernando VarelaNoch keine Bewertungen
- Enlace QuímicoDokument7 SeitenEnlace QuímicoPau Arriaga VeraNoch keine Bewertungen
- 3.1.4 Enlace CovalenteDokument7 Seiten3.1.4 Enlace CovalenteDaniel VázquezNoch keine Bewertungen
- UNIDAD I (Agua 3)Dokument16 SeitenUNIDAD I (Agua 3)jesus sanchez coelhoNoch keine Bewertungen
- Teoria de Orbitales AtomicosDokument7 SeitenTeoria de Orbitales AtomicosDark HikaruNoch keine Bewertungen
- Enlace Por Puente de HidrógenoDokument5 SeitenEnlace Por Puente de HidrógenoJose100% (1)
- Ejercicios Resueltos de EnlaceDokument4 SeitenEjercicios Resueltos de EnlaceKarol GonzálezNoch keine Bewertungen
- Estructura, Enlace Puente Hidrogeno y Densidad Del AguaDokument21 SeitenEstructura, Enlace Puente Hidrogeno y Densidad Del AguaYüssêïïkâ DêlgädôNoch keine Bewertungen
- Enlace e HibridaciónDokument19 SeitenEnlace e HibridaciónAlonso Pino100% (4)
- Practica LabDokument15 SeitenPractica Labjonathanjc280601Noch keine Bewertungen
- Enlaces S-ODokument17 SeitenEnlaces S-OSabrina_rosseNoch keine Bewertungen
- Temas de Bioquímica para El ExamenDokument57 SeitenTemas de Bioquímica para El ExamenFiore AnianoNoch keine Bewertungen
- Moelcula de Agua, AficheDokument1 SeiteMoelcula de Agua, AficheVictoria Paolillo WeissNoch keine Bewertungen
- Ley de LewisDokument7 SeitenLey de LewisJonh LionNoch keine Bewertungen
- Diapositivas Tema 3 (Enlaces Quimicos)Dokument11 SeitenDiapositivas Tema 3 (Enlaces Quimicos)CesarNoch keine Bewertungen
- Ensayo Enlaces QuimicosDokument13 SeitenEnsayo Enlaces QuimicosMiguel Ángel VillamaresNoch keine Bewertungen
- Propiedades Disolventes Del AguaDokument9 SeitenPropiedades Disolventes Del AguagabyvargasNoch keine Bewertungen
- Punto 1 de ContenidoDokument6 SeitenPunto 1 de ContenidoArmando ArmendarizNoch keine Bewertungen
- Enlaces Inter e Intramoleculares Del AguaDokument2 SeitenEnlaces Inter e Intramoleculares Del AguaVictor Pérez FuentesNoch keine Bewertungen
- Modelo de LewisDokument5 SeitenModelo de LewisKyle LewisNoch keine Bewertungen
- 2015 Solucionario Clase 6 Polaridad de Las Moléculas y Fuerzas Intermoléculares (OK)Dokument9 Seiten2015 Solucionario Clase 6 Polaridad de Las Moléculas y Fuerzas Intermoléculares (OK)linda3322Noch keine Bewertungen
- Moléculas y Seres VivosDokument17 SeitenMoléculas y Seres VivosRoxi RivasNoch keine Bewertungen
- El Enlace CovalenteDokument3 SeitenEl Enlace Covalentecolumba_mcNoch keine Bewertungen
- Enlaces BioquímicosDokument39 SeitenEnlaces BioquímicosMichel Alejandro García100% (1)
- Solución Ejercicios de Enlace QuímicoDokument6 SeitenSolución Ejercicios de Enlace QuímicoJUAN PABLO ARISMENDI LONDOÑONoch keine Bewertungen
- Guia de Ejercicios LewisDokument8 SeitenGuia de Ejercicios LewisValeria ApablazaNoch keine Bewertungen
- Enlace de ValenciaDokument14 SeitenEnlace de ValenciaMiguel SánchezNoch keine Bewertungen
- Puntos 4-6Dokument4 SeitenPuntos 4-6alejo uribeNoch keine Bewertungen
- Informe Capítulos 1 y 2 Del Libro de John McmurryDokument4 SeitenInforme Capítulos 1 y 2 Del Libro de John McmurryPaula Marialys Ramirez ManzuetaNoch keine Bewertungen
- Estudiar para Examen de La Segunda Unidad QuimicaDokument16 SeitenEstudiar para Examen de La Segunda Unidad Quimicajose fuentesNoch keine Bewertungen
- Resumen LibroDokument12 SeitenResumen LibroJair Mauricio RodriguezNoch keine Bewertungen
- Enlace CovalenteDokument12 SeitenEnlace CovalenteMaria CarranzaNoch keine Bewertungen
- Puentes de HidrogenoDokument14 SeitenPuentes de HidrogenoOmar Alejandro SalazarNoch keine Bewertungen
- Enlace CovalenteDokument6 SeitenEnlace Covalentemaritza loyoNoch keine Bewertungen
- Capitulo 4.enlace Químico 2022-IDokument10 SeitenCapitulo 4.enlace Químico 2022-IJesus Miguel Anaya DoriaNoch keine Bewertungen
- Unidad Iv.-Enlaces Quimicos E Interacciones Intermoleculares. 4.1. Enlaces QuimicosDokument25 SeitenUnidad Iv.-Enlaces Quimicos E Interacciones Intermoleculares. 4.1. Enlaces QuimicosLuis CardozaNoch keine Bewertungen
- Guia Enlace CovalenteDokument17 SeitenGuia Enlace CovalenteMariana AgustinaNoch keine Bewertungen
- Propiedades Coligativas ResumenDokument10 SeitenPropiedades Coligativas ResumenKarla Patricia Barrientos LópezNoch keine Bewertungen
- 10 - Nitrogenados 2009Dokument49 Seiten10 - Nitrogenados 2009Gustavo TulaNoch keine Bewertungen
- Calandra DoDokument18 SeitenCalandra Doana9304Noch keine Bewertungen
- FT-SAE 1045 TrefiladoDokument2 SeitenFT-SAE 1045 TrefiladoHector Muñoz BravoNoch keine Bewertungen
- Acido BaseDokument3 SeitenAcido BaseAnaSAfonsoSNoch keine Bewertungen
- Monografia Quimica AnaliticaDokument7 SeitenMonografia Quimica AnaliticaNelsa ReginaldoNoch keine Bewertungen
- Siliconas Frecuentes en Productos Cosméticos y CapilaresDokument2 SeitenSiliconas Frecuentes en Productos Cosméticos y CapilaresTRISNoch keine Bewertungen
- Reporte 3 InteracciónDokument12 SeitenReporte 3 InteracciónLiliana Lucila LunaNoch keine Bewertungen
- Norma Produc Hormi AutocompacDokument9 SeitenNorma Produc Hormi AutocompacJimfer MoreNoch keine Bewertungen
- Propiedades Mecánicas de Perfiles METASADokument20 SeitenPropiedades Mecánicas de Perfiles METASAcliford_montalvanNoch keine Bewertungen
- Leyes de Fick 1 y 2Dokument15 SeitenLeyes de Fick 1 y 2AaronAdrianPalmaRizo100% (1)
- Partes de Un Informe Final de Laboratorio 3Dokument6 SeitenPartes de Un Informe Final de Laboratorio 3Kenyo Galarza100% (1)
- Placenta CatalogoDokument6 SeitenPlacenta Catalogoivan martinezNoch keine Bewertungen
- Hormigón Pretensado: Diego Arroyo Mayo 2012Dokument89 SeitenHormigón Pretensado: Diego Arroyo Mayo 2012AlfredFloresCortezNoch keine Bewertungen
- Preguntas Pau ProteínasDokument7 SeitenPreguntas Pau ProteínasAda BernalNoch keine Bewertungen
- Mineria A Cielo AbiertoDokument37 SeitenMineria A Cielo AbiertoLuisCarlosEstupiñan100% (1)
- Neurociencia Del Consumo y Dependencia de Sustancias Psicoactivas - Resumen OPS-OMS 2005Dokument60 SeitenNeurociencia Del Consumo y Dependencia de Sustancias Psicoactivas - Resumen OPS-OMS 2005javier chavezNoch keine Bewertungen
- Proyecto Soporte de Cartel RioDokument9 SeitenProyecto Soporte de Cartel RioJOSRIVERC4506100% (1)
- Toallitas Humedas DesinfectantesDokument1 SeiteToallitas Humedas Desinfectantessidartha_690% (1)
- Tema 5 LípidosDokument6 SeitenTema 5 LípidosroynaNoch keine Bewertungen
- Clasificacion de Los MicroorganismosDokument61 SeitenClasificacion de Los MicroorganismosRoxana Villanueva100% (1)
- Resumen Del Video de Extracion de Mezcla.Dokument3 SeitenResumen Del Video de Extracion de Mezcla.Alejandroxd45Noch keine Bewertungen
- Minerales RadiactivosDokument112 SeitenMinerales RadiactivosPato Kaminsky100% (1)
- Validación Dobesilato CADokument67 SeitenValidación Dobesilato CALaura RosalesNoch keine Bewertungen
- Capitulo Vi. Fisica II. Temperatura y DilataciónDokument41 SeitenCapitulo Vi. Fisica II. Temperatura y DilataciónOmar León100% (2)
- Ejercicio Diseño de MezclasDokument12 SeitenEjercicio Diseño de MezclasLuis Enrique Pasapera Sánchez100% (1)