Beruflich Dokumente
Kultur Dokumente
Chimie
Hochgeladen von
Moukhtar DiopOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Chimie
Hochgeladen von
Moukhtar DiopCopyright:
Verfügbare Formate
COLE POLYTECHNIQUE COLE SUPRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS DADMISSION 2000
FILIRE
PC
COMPOSITION DE CHIMIE
(Dure : 4 heures) Lutilisation des calculatrices nest pas autorise. Lpreuve comporte deux problmes indpendants.
I - Synthse biomimtique dun prcurseur de la progestrone
Pour allger lcriture, les candidats pourront ne faire gurer dans la reprsentation des molcules que la partie qui intervient dans la raction considre, tout en prcisant la lettre qui dsigne cette molcule.
Donnes Dplacements chimiques (ppm) en RMN de quelques types de protons de molcules organiques CH3 C CH3 C=C CH2 C=0 0,9-1 1,6-2,1 2,1-2,5 CH2 =C CH=CH(cyclique) CHC=O 4,5-6 5,2-6 2,4-2,8
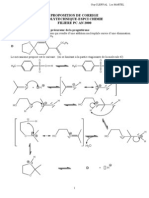
Les ractions enzymatiques, la fois par leur ingniosit et leur grande slectivit, ont inspir les chimistes qui ont cherch les reproduire de manire classique pour synthtiser plus ecacement des molcules jusqualors trs diciles obtenir. Ainsi, des chercheurs ont dvelopp la synthse dune hormone, la progestrone, en utilisant comme tape cl la cyclisation lectrophile biomimtique du trinynol A en 1 -5 -pregnen-20-one, B.
146
1. La synthse de B dbute par le chauage du ctoester C, reprsent ci-dessous, avec de lthane-1,2-diol dans le tolune, en prsence dune quantit catalytique dacide paratolunesulfonique (not APTS). Le produit D obtenu est alors transform in situ en compos E :
a) Donner la formule semi-dveloppe de D ; prciser la nature de la raction correspondant la formation de D, puis dtailler son mcanisme. b) Quelle relation disomrie existe-t-il entre les produits D et E ? Indiquer de manire simple comment lutilisation de la RMN proton permettrait dattribuer E sans ambigut la structure ci-dessus. c) Proposer un mcanisme illustrant la formation de E partir de D. Pourquoi lisomre E est-il plus stable que D ? 2. E est ensuite rduit par un excs d aluminohydrure de lithium (LiAlH4 ) dans lthoxythane anhydre pour fournir F, de formule brute C10 H16 O3 , qui est dshydrat en prsence dune solution dacide chlorhydrique 10 % dans le ttrahydrofuranne (not THF). Le produit G alors isol, de formule brute C8 H10 O, prsente en infrarouge une bande intense 1680 cm1 et aucune bande au-del de 3000 cm1 . En RMN proton, on observe en particulier un pic 5,4 ppm qui intgre pour deux protons, un pic 5,9 ppm qui compte pour un proton, et un pic singulet 2,1 ppm intgrant pour trois hydrognes. a) Donner la formule semi-dveloppe de F. b) Montrer que les donnes fournies sont compatibles avec la formation, aprs hydrolyse de la fonction actal de F en F, dune dinone conjugue (ctone conjugue avec deux doubles liaisons thylniques) dont on prcisera la formule semi-dveloppe, ainsi que le mcanisme de formation. c) Indiquer pourquoi il est ncessaire de protger la fonction ctone dans la premire tape de cette synthse. 3. Laction dune quantit quimolculaire de mthanolate de sodium sur le malonate de dimthyle CH2 (CO2 CH3 )2 dans le mthanol donne un ractif H, que lon fait ragir mole mole avec G pour obtenir aprs neutralisation le compos I ci-contre. 147
a) Justier le fait que le malonate de dimthyle possde des hydrognes caractre acide. Quel est le ractif H form ? b) Indiquer les autres sites possibles daddition nuclophile du ractif H sur la molcule G, et donner les structures des produits qui seraient alors obtenus. c) Par analogie avec la raction daddition dun nuclophile carbon sur une -none, proposer un mcanisme expliquant la formation de I. 4. On donne les orbitales molculaires obtenues par un calcul de Hckel sur G modlis par la 4,5-dimthylhexan-3,5-din-2-one, de formule brute C8 H12 O. Chaque substituant mthyle est dcrit dans cette modlisation comme un htroatome deux lectrons dni par les paramtres Me = + 2 et C-Me = 0, 7 . Latome doxygne est dni par les paramtres O = + et CO = , tant une grandeur ngative. Seuls les coecients sur loxygne et les carbones thylniques ont t tabuls ; la numrotation des carbones est celle de la nomenclature.
orbitale n E O C2 C3 C4 C5 C6 1 + 2, 52 0,188 0,285 0,258 0,364 0,312 0,124 2 + 2, 36 0,259 0,353 0,094 -0,130 -0,225 -0,095 3 + 2, 18 0,036 0,042 -0,061 -0,174 0,165 0,076 4 + 1, 56 -0,617 -0,347 -0,314 -0,143 -0,070 -0,045 5 + 1, 18 -0,410 -0,073 0,280 0,403 0,435 0,370 6 + 0, 64 0,404 -0,147 -0,550 -0,202 0,349 0,549 7 0, 35 0,319 -0,429 -0,260 0,519 0,189 -0,545 8 1, 23 0,259 -0,577 0,362 0,132 -0,504 0,411
nergies et coecients des orbitales molculaires de la 4,5-dimthylhexan-3,5-din-2-one a) Aprs avoir prcis la formule semi-dveloppe de la 4,5-dimthylhexan-3,5-din-2-one, identier ses orbitales frontires. b) Quelle est lorbitale considrer pour tudier la ractivit de cette molcule avec un nuclophile comme lanion du malonate de dimthyle ? Sur quel carbone se fera prfrentiellement laddition dun tel nuclophile ? Justier. c) Daprs cette analyse, I est-il le produit majoritaire attendu ? Quel autre facteur peut orienter la raction vers la formation de ce produit ? 5. Le compos I, dabord saponi par une solution de soude, est ensuite chau en prsence dacide chlorhydrique. Cette raction qui saccompagne dun dgagement gazeux donne naissance au produit J de formule brute C10 H14 O3 . J chau dans le mthanol en prsence dune quantit catalytique dAPTS engendre la formation de K. a) Schmatiser la squence de ractions qui mne K. Quelle est la nature du gaz dgag ? 148
b) Dtailler le mcanisme de ltape au cours de laquelle se produit ce dgagement gazeux. 6. Le groupement ctone de K est ensuite protg par raction avec un excs dthane1,2-dithiol (HSCH2 CH2 SH) dans le mthanol, en prsence de triuorure de bore complex par lthoxythane : BF3 .(C2 H5 )2 O. Le compos L obtenu (de formule brute C13 H20 O2 S2 ), possde une grande stabilit la fois en milieu basique et en milieu acide. Son spectre de RMN du proton prsente notamment des dplacements chimiques caractristiques 1,7 ppm et 5,6 ppm qui correspondent deux singulets intgrant dans un rapport 3 :1. a) Sachant que lthane-1,2-dithiol donne avec un groupement carbonyle une raction quivalente celle de lthane-1,2-diol (cf. question 1.a)), en dduire la formule semi-dveloppe du produit L, en accord avec les donnes RMN ci-dessus. b) Rappeler les structures lectroniques des atomes de bore et de uor. En dduire la formule de Lewis de BF3 , ainsi que sa gomtrie. Quelle proprit cela met-il en vidence, permettant notamment dexpliquer le type de complexe que BF3 donne avec lthoxythane ? c) En dduire le rle de BF3 dans la raction de protection du groupement ctone de K. d) Quel compos L obtiendrait-on par action de lthane-1,2-diol en prsence dAPTS sur K ? 7. L, aprs hydrolyse basique temprature ambiante, conduit M qui est chau dans lactate dthyle avec une quantit quimolculaire de (R)-(+)-1-phnylthanamine. Par refroidissement, il cristallise un sel N, qui est puri par trois recristallisations successives. N, dont la conguration absolue des carbones asymtriques est (R, R), est ensuite trait par une solution aqueuse dacide chlorhydrique pour conduire, aprs extraction avec de lactate dthyle, O qui prsente un pouvoir rotatoire spcique positif. a) Rappeler la signication des prxes (R) et (+). Donner la formule topologique de la (R)-(+)-1-phnylthanamine. b) Donner la formule semi-dveloppe de M. Possde-t-il des carbones asymtriques ? Prciser, en justiant, si ce compos est optiquement pur. c) Expliquer pourquoi il est possible disoler N cristallis. Quelle est sa formule topologique ? Pourquoi faut-il purier N par recristallisation ? d) Quelle est la formule topologique de O ? Comment sappelle lopration qui permet dobtenir O partir de M ? 8. O est maintenant rduit avec un excs de LiAlH4 dans le THF pour donner P qui est trait par un quivalent de TsCl (chlorure de lAPTS) dans la pyridine pour fournir Q. Laction dune solution sature diodure de sodium dans la propanone sur Q conduit R qui, aprs extraction, est oppos la triphnylphosphine pour donner naissance S, de formule brute C30 H34 IPS2 . a) Donner les structures des composs P S.
149
b) Prciser les mcanismes permettant la transformation de P en Q, et de Q en R. c) Quelle est la nature de la raction conduisant S ? Justier. 9. A une suspension de S dans le THF basse temprature est ajout un lger excs de phnyllithium en solution dans le THF, puis une quantit quimolculaire de laldhyde reprsent ci-contre. Un traitement ultrieur (appel modication de Schlosser) permet dobtenir, au lieu du mlange T + T attendu, le compos T trs majoritaire, de formule brute C23 H34 S2 , qui possde deux doubles liaisons de conguration E , et qui est le prcurseur direct de la molcule A. Rappeler le nom de la raction qui conduit T, puis crire les quations-bilan correspondant la formation de T. 10. Aprs dprotection de la fonction ctone de T, puis rduction, lalcool A obtenu est agit en milieu acide dans un solvant ionisant pour fournir B optiquement pur avec un bon rendement. a) Imaginer un mcanisme, faisant intervenir le carbocation ci-aprs, qui permette dexpliquer la formation de B par cyclisation concerte de A (on ne tiendra pas compte de la strochimie). b) Combien de centres asymtriques sont crs et controls au cours de cette tape ? c) Quel compos obtiendrait-on si la synthse avait t poursuivie avec M la place de O ?
II - Dosages par spectrophotomtrie UV-Visible
Les parties 3 et 4 de ce problme peuvent tre traites dans un ordre quelconque. Dans lcriture symbolique des direntes formes acido-basiques, les charges ventuelles sont omises pour simplier lcriture. Les indicateurs colors acido-basiques, appels aussi molcules sondes de pH, sont des molcules dont les proprits spectroscopiques, en gnral labsorption dans lUV-visible, dpendent du pH de la solution. Elles prsentent lavantage dtre ecaces des concentrations trs faibles. Cette technique est lune des rares permettant une mesure de pH dans des volumes infrieurs aux mm3 et allant jusquau m3 . Le problme montrera comment de telles sondes sont tudies, puis comment elles peuvent tre utilises pour une tude cintique. Dans tout le problme, la longueur de la cuve l est prise gale 1 cm, et le solvant est leau. 150
Premire partie : gnralits
Une solution de colorant de concentration c, absorbant une longueur donde , avec un coecient dabsorption molaire , est place dans une cuve de longueur l lintrieur dun spectromtre UV-visible. A partir du rapport de lintensit mesure I sur lintensit initiale I0 , on peut dnir labsorbance A, ou densit optique. 1. Quelle relation existe-t-il entre I , I0 et A ? Rappeler la loi de Beer-Lambert. 2. Une solution de concentration c = 1, 0 105 mol L1 prsente une absorbance de 0,020 dans une cuve de trajet optique 1 cm. Quel est le coecient dabsorption molaire de la molcule, exprim en mol1 L cm1 ? Sachant quil nest pas possible de mesurer des absorbances suprieures 2, quelle est la concentration maximale que lon puisse mesurer ? Commenter cette valeur. 3. Montrer que pour une solution contenant n espces Xi , de concentrations respectives ci , et de coecients dabsorption molaire respectifs i , labsorbance de la solution est l(ci i ). En dduire labsorbance A pour une solution de deux composs en fonction de l, 1 , 2 , la concentration totale c0 et de x1 , la fraction molaire en X1 , dnie comme le rapport du nombre de moles de X1 au nombre total de moles X1 +X2 . 4. Les drivs des phnols sont utiliss comme sondes de pH grce leurs proprits spectroscopiques et acido-basiques. Quelle caractristique possdent les molcules qui prsentent une bande dabsorption dans lUV-visible ? Quel est le phnomne lorigine de cette absorption ? Les composs aromatiques font-ils partie de cette famille ? Pourquoi ? Deuxime partie : dosage dun acide faible
Le p-nitrophnol est un acide faible. Son pKa, voisin de 7, peut tre dtermin par dosage pHmtrique et par dosage spectrophotomtrique. La gure 1 montre la courbe de titrage de 10 mL dune solution de p-nitrophnol de concentration 1, 0 104 mol L1 par de la soude 1, 0 102 mol L1 . Les courbes de rpartition des deux formes acide-base conjugues, obtenues par simulation, sont galement reprsentes (pourcentages rapports lchelle de droite). 1. Comment expliquez vous la trs faible amplitude du saut de pH autour du point dquivalence ?
Figure 1
151
2. Quelles sont les conditions, satisfaites ici, faisant que lon ait pH = pKa la demiquivalence ? Quelle dicult exprimentale voyez-vous nanmoins lutilisation de cette mthode pour la dtermination du pKa, dans le cas o la concentration du p-nitrophnol ne serait pas connue avec une grande prcision ? On dsigne par x le rapport du nombre de moles de soude ajout au nombre de moles de p-nitrophnol initial. Que vaut d(pH)/dx pour x = 0,5 ? Si lon admet que x ne peut tre dtermin qu 10 % prs, quelle sera lincertitude rsultante sur la dtermination de pKa ? On prendra ln(10) = 2,30 = 1/0,435. Le titrage prcdent est suivi par spectrophotomtrie UV-visible. On obtient les courbes de la gure 2. 3. Les longueurs donde des deux maximums observs sur la gure 2 sont respectivement 310 et 390 nm. Identier les deux formes du p-nitrophnol correspondantes. 4. Lorsque, une longueur donde iso , les deux espces ont le mme coecient dabsorption molaire iso , on observe sur les dirents spectres un point particulier appel point isobestique. Identier ce point sur la gure 2. Justier votre rponse. 5. La gure 3 donne les points reprsentant la variation de labsorbance A1 310 nm en fonction de labsorbance A2 390 nm. Soit Figure 2 i,BH et i,B les coecients dabsorption molaire du p-nitrophnol (BH) et du phnate (B) une longueur donde i , calculer Ai , labsorbance cette longueur donde. En dduire que la relation suivante est vraie quel que soit le pH : A1 (2,B 2,BH ) = A2 (1,B 1,BH ) l c0 (1,B 2,BH 1,BH 2,B ) Comparer avec les donnes exprimentales.
Figure 3
Figure 4 152
6. Montrer quil existe une relation linaire entre la fonction f = log[(A1 l 1,BH c0 )/(l 1,B c0 A1 )] et le pH. On donne sur la gure 4 les variations de f en fonction du pH. En dduire le pKa du p-nitrophnol. Comparer la prcision de cette mthode avec celle rsultant dun dosage simple pHmtrique. Troisime partie : application au dosage dun diacide faible
Sous sa forme neutre de formule ci-contre symbolise ensuite par HA, la 4-deoxypyridoxine est un ampholyte (compos amphotre). On considre le titrage de 10 mL dune solution de la forme acide de la 4-deoxypyridoxine (c1 = 104 mol L1 ), isole sous forme de son chlorhydrate, par de la soude 0,01 mol L1 . La courbe de titrage est reprsente sur la gure 5, de mme que les courbes de rpartition des direntes formes acido-basiques. 1. Sachant que le pKA du couple pyridinium/pyridine RNH+ /RN est voisin de 5 et le pKA du phnol/phnolate est voisin de 10, tablir un diagramme de prdominance des direntes formes en fonction du pH, en faisant gurer les formules semi-dveloppes. 2. En considrant la gure 5, interprter : a) la composition relle de la solution au point de dpart ; b) la prsence dun seul saut de pH visible, lequel permet nanmoins de dterminer la concentration c si elle nest pas connue avec prcision ; Figure 5 c) le non-passage de la courbe de titrage par les points pH = pKi aux deux points de demi-quivalence.
3. Que peut-on conclure de la dtermination des pKi par cette mthode ? 4. Ce dosage est suivi en mme temps par spectrophotomtrie UV-visible. On observe exprimentalement que toutes les courbes dabsorption ne passent pas par un point rpondant la dnition prcdente dun point isobestique. Proposer une interprtation.
153
5. La gure 6 montre la variation de labsorbance A4 316 nm en fonction de labsorbance A3 247 nm. Quelques valeurs sont regroupes dans le tableau I. Chaque branche de la gure 6 est imputable la prsence de deux formes acido-basiques conjugues. Prciser lesquelles en justiant votre rponse. Figure 6 pH 5 5.2 5.4 5.6 6 9 9.5 9.7 9.9 10.1 10.3 A3 0.152 0.177 0.203 0.228 0.265 0.353 0.429 0.473 0.518 0.562 0.600 A4 0.316 0.399 0.485 0.565 0.684 0.728 0.622 0.563 0.500 0.439 0.387 Tableau I 6. On peut dnir deux fonctions f1 = log[(A3 l3,AH2 c1 )/(l3,AH c1 A3 )] et f2 = log[(A3 l3,AH c1 )/(l3,A c1 A3 )] o 3,AH2 , 3,AH et 3,A dsignent respectivement les coecients dabsorption molaire de la forme acide, amphotre et basique 247nm. Expliquer pourquoi f1 est nulle pour pH = pK1 et f2 est nulle pour pH = pK2 . En dduire les pKa de la 4-deoxypyridoxine. Quelle est la prcision de cette mthode ? Quatrime partie : tude cintique de la diusion membranaire f1 -0.260 -0.060 0.140 0.340 0.741 f2
-0.820 -0.320 -0.120 0.080 0.280 0.480
Les vsicules ou liposomes sont des assembles de molcules qui sorganisent en bicouches formant elles mmes une enveloppe ferme de forme sphrique. Le compartiment intrieur dune vsicule est donc spar de lextrieur, cest--dire de la solution, par la bicouche lipidique, et 154
la vsicule se comporte donc comme un micro rservoir dont la taille est infrieure au micron. Ces vsicules sont utilises pour encapsuler et transporter des principes actifs dans les industries pharmaceutiques et cosmtiques. La diusion des molcules au travers de la membrane permet une libration lente et contrle de ces molcules. Le compartiment interne des vsicules est rempli dune solution de pH initial pHi et dune sonde indicatrice de pH dont la constante dacidit est KA . Le pH extrieur des vsicules est initialement identique celui lintrieur, mais la solution extrieure ne contient pas dindicateur color. A un instant t = 0, on acidie brusquement le milieu un pH nal pHf . 1. Quels sont les pH mesurs respectivement par le pH-mtre et par absorptiomtrie ? Sontce les mmes ? La diusion des protons au travers de la membrane est lente. Le volume extrieur tant trs grand devant le volume intrieur des vsicules, comment la mesure de pH par spectrophotomtrie permet-elle dtudier cette diusion ? On pourra sappuyer sur un schma. 2. Soient c0 la concentration totale de sonde et h = [H+ ]. Etablir la relation suivante : g = (A lc0 B )/(lc0 BH A) = h et dterminer la constante . 3. Le graphe de g en fonction du temps donne une droite. La concentration en protons lintrieur de la vsicule varie-t-elle linairement ou exponentiellement ? 4. La pente de cette droite est 10 s1 . Sachant que pKa = 7, quelle est la vitesse daugmentation de la concentration des protons lintrieur des vsicules en mol L1 s1 ? Combien de temps faut-il pour que la concentration en protons augmente de 104 mol L1 ?
155
Das könnte Ihnen auch gefallen
- Mathematiques Annales Brevet SenegalDokument63 SeitenMathematiques Annales Brevet Senegalamadzz86% (28)
- Glucides: Les Grands Articles d'UniversalisVon EverandGlucides: Les Grands Articles d'UniversalisNoch keine Bewertungen
- Tout Sur Les Viandes, Les Poissons Et Les Fruits de Mer (PDFDrive)Dokument224 SeitenTout Sur Les Viandes, Les Poissons Et Les Fruits de Mer (PDFDrive)Rivo RoberalimananaNoch keine Bewertungen
- Yummy Magazine N°7Dokument48 SeitenYummy Magazine N°7Yummy Magazine100% (4)
- Examen Correction L2 Chimie Organique 2007 4Dokument6 SeitenExamen Correction L2 Chimie Organique 2007 4R-win100% (1)
- Altération Du Béton en Site MaritimeDokument70 SeitenAltération Du Béton en Site Maritimexmane111100% (1)
- Étude Et Mise en Place D'une Solution VOIP SécuriséeDokument94 SeitenÉtude Et Mise en Place D'une Solution VOIP SécuriséeMoukhtar Diop100% (1)
- QCM LinuxDokument4 SeitenQCM LinuxMoukhtar Diop100% (3)
- Exos Chimie Cours PRIAMSDokument60 SeitenExos Chimie Cours PRIAMSLevier Poids86% (7)
- Lip IdesDokument17 SeitenLip IdesAhmed100% (2)
- TD Chimie Organique SMC S4Dokument4 SeitenTD Chimie Organique SMC S4Khalid Zeg100% (1)
- 16-Evaluation de La Duree de Vie D Un Ouvrage en ServiceDokument32 Seiten16-Evaluation de La Duree de Vie D Un Ouvrage en ServiceJeudi VeritéNoch keine Bewertungen
- QCM MonophaseDokument4 SeitenQCM MonophaseKryss KéréNoch keine Bewertungen
- Manuel START MAX PDFDokument72 SeitenManuel START MAX PDFأنور مازوز أبو يوسف50% (2)
- Al CoolsDokument13 SeitenAl Coolsbmm2Noch keine Bewertungen
- AlcenesDokument13 SeitenAlcenesitto350% (1)
- Chimie Organique Et Chimie Des Solutions AqueusesDokument10 SeitenChimie Organique Et Chimie Des Solutions AqueusesbangnhatquangquangNoch keine Bewertungen
- 2001 Preselection Partie1Dokument7 Seiten2001 Preselection Partie1Majed GharibNoch keine Bewertungen
- C 02 Ab 1 eDokument5 SeitenC 02 Ab 1 eMihnea GamanNoch keine Bewertungen
- CHIMIE Tles C&D N°2 2009 - 2010Dokument2 SeitenCHIMIE Tles C&D N°2 2009 - 2010Haman Bello OumarouNoch keine Bewertungen
- CCP PC 2003 Chimie-1Dokument14 SeitenCCP PC 2003 Chimie-1Hamza M'hateNoch keine Bewertungen
- Epreuve de Chimie Tle C Lycee de MoukoDokument3 SeitenEpreuve de Chimie Tle C Lycee de Moukocoulibaly emmanuelNoch keine Bewertungen
- Axlou Toth Pour L'innovation: Composés Aromatiques (Le Benzène)Dokument6 SeitenAxlou Toth Pour L'innovation: Composés Aromatiques (Le Benzène)djibril fayeNoch keine Bewertungen
- T Science DevoirdDokument2 SeitenT Science DevoirdOumar TraoréNoch keine Bewertungen
- CAHIER D'Exercices ChimieDokument67 SeitenCAHIER D'Exercices ChimieAdama MaigaNoch keine Bewertungen
- Épreuve 1er-Groupe S2 2023Dokument4 SeitenÉpreuve 1er-Groupe S2 2023kara baNoch keine Bewertungen
- Serie N°1: Acides Carboxyliques Et Ses Derivees - TS: Nommer Les Composés SuivantsDokument6 SeitenSerie N°1: Acides Carboxyliques Et Ses Derivees - TS: Nommer Les Composés SuivantsRom DanteNoch keine Bewertungen
- Examen Chimie Organique 2018-2019 Exercice 3 U-ManDokument23 SeitenExamen Chimie Organique 2018-2019 Exercice 3 U-ManHarvey SpecterNoch keine Bewertungen
- Série 2 + SolutionDokument9 SeitenSérie 2 + Solutionمريم ياسمينNoch keine Bewertungen
- T Science DevoirdDokument2 SeitenT Science DevoirdOumar TraoréNoch keine Bewertungen
- Compo2012SBT Facou 2ère PériodeDokument3 SeitenCompo2012SBT Facou 2ère PériodeOumar TraoréNoch keine Bewertungen
- Les Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtDokument4 SeitenLes Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtNjipnangNoch keine Bewertungen
- Exercices Avec Solution SV2-STU2Dokument18 SeitenExercices Avec Solution SV2-STU2SaoudNoch keine Bewertungen
- Coo NcorDokument4 SeitenCoo NcorPFENoch keine Bewertungen
- A E R M O S MédecineDokument4 SeitenA E R M O S MédecineIssouf BertheNoch keine Bewertungen
- Série D'exercices Sur Les Acides Carboxyliques Et Dérivés - Ts - SunudaaraDokument5 SeitenSérie D'exercices Sur Les Acides Carboxyliques Et Dérivés - Ts - SunudaaraJule BaNoch keine Bewertungen
- Acide CarboxyliuqeDokument4 SeitenAcide CarboxyliuqealphadzoNoch keine Bewertungen
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODokument28 SeitenAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoNoch keine Bewertungen
- 10.DerivesAcides TDDokument3 Seiten10.DerivesAcides TDayoubNoch keine Bewertungen
- D1 Ts 21-22 LAMBDokument3 SeitenD1 Ts 21-22 LAMBb8rhk2thb4Noch keine Bewertungen
- Epoxy DesDokument7 SeitenEpoxy Dessalam100% (1)
- C 05 Do 1 eDokument15 SeitenC 05 Do 1 eMihnea GamanNoch keine Bewertungen
- Capture D'écran . 2023-05-11 À 02.16.46Dokument3 SeitenCapture D'écran . 2023-05-11 À 02.16.46cmamadouidrissaNoch keine Bewertungen
- Serie C4-benzene-WahabDiopDokument2 SeitenSerie C4-benzene-WahabDiophamd kabore100% (2)
- TD Chim Orga FonctDokument11 SeitenTD Chim Orga FonctAnäśś AnassNoch keine Bewertungen
- Chimie Baccalaureat Blanc N°2 - Session de Mai 2017Dokument5 SeitenChimie Baccalaureat Blanc N°2 - Session de Mai 2017Junior NoulaNoch keine Bewertungen
- Bac CD ChimieDokument2 SeitenBac CD ChimieRonel TsameneNoch keine Bewertungen
- DS05Dokument11 SeitenDS05baatoutmbNoch keine Bewertungen
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Dokument8 SeitenControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- TD C5: Composes Organiques OxygenesDokument2 SeitenTD C5: Composes Organiques Oxygenesbabacar mbayeNoch keine Bewertungen
- Decembre 2005Dokument8 SeitenDecembre 2005Gomez Bakoua PegaNoch keine Bewertungen
- Dioxyde de Carbone Et CarbonatesDokument4 SeitenDioxyde de Carbone Et Carbonatesamine2017khalilNoch keine Bewertungen
- Bac S2 1G 2023 SN - Sujet - WahabdiopDokument4 SeitenBac S2 1G 2023 SN - Sujet - WahabdiopAmadou Oury DialloNoch keine Bewertungen
- Rof1 - TD 2022Dokument10 SeitenRof1 - TD 2022Lisa CrpsNoch keine Bewertungen
- Rof1 - TD 2022Dokument10 SeitenRof1 - TD 2022Lisa CrpsNoch keine Bewertungen
- ExtraitDokument8 SeitenExtraitLewis HamiltonNoch keine Bewertungen
- Travaux Dirigés Chimie OrganiqueDokument3 SeitenTravaux Dirigés Chimie Organiquezoungranasebastien102Noch keine Bewertungen
- DiolsDokument9 SeitenDiolsAhmad ElhamriNoch keine Bewertungen
- Exercices Dérivés Carbonylés Partie 1: Exercice 1: Pour DébuterDokument13 SeitenExercices Dérivés Carbonylés Partie 1: Exercice 1: Pour DébuterMoncef AbbesNoch keine Bewertungen
- TD Acide Carboxylique-1Dokument3 SeitenTD Acide Carboxylique-1kadilelenta21Noch keine Bewertungen
- C 00 XP 1 CDokument13 SeitenC 00 XP 1 CMihnea GamanNoch keine Bewertungen
- Lacide ButyriqueDokument3 SeitenLacide Butyriquemaxence.boronat2006Noch keine Bewertungen
- Exercices Chimie OrganiqueDokument2 SeitenExercices Chimie OrganiqueIsma ZerboNoch keine Bewertungen
- Derives HalogenesDokument15 SeitenDerives HalogenesAhmad ElhamriNoch keine Bewertungen
- Chimie Tle DBLANCDokument2 SeitenChimie Tle DBLANCFabien KenmogneNoch keine Bewertungen
- CHIMIE6CDokument5 SeitenCHIMIE6CPc-med NouhNoch keine Bewertungen
- Concours 2012 (+sol.) Proposition EPST23Dokument19 SeitenConcours 2012 (+sol.) Proposition EPST23Nidal BestNoch keine Bewertungen
- 08 MP 1 Alg 3Dokument9 Seiten08 MP 1 Alg 3Moukhtar DiopNoch keine Bewertungen
- 08 MP 1 Alg 3Dokument9 Seiten08 MP 1 Alg 3Moukhtar DiopNoch keine Bewertungen
- Test de Niveau N° 1Dokument4 SeitenTest de Niveau N° 1Moukhtar DiopNoch keine Bewertungen
- Examen Régional PC Tanger 2022 FRDokument4 SeitenExamen Régional PC Tanger 2022 FRfan de Disney ChannelNoch keine Bewertungen
- Plan D'activites Enock KatongoDokument20 SeitenPlan D'activites Enock Katongofrancis mukendiNoch keine Bewertungen
- ANNEXE 1 Bordereaux de Prix RénovationDokument4 SeitenANNEXE 1 Bordereaux de Prix RénovationAO2 TRAVNoch keine Bewertungen
- Gaz de Schist Final Version 2Dokument142 SeitenGaz de Schist Final Version 2amrt100% (1)
- Livret Bonnes Pratiques Prelevement Flacons Bactalert 2019Dokument6 SeitenLivret Bonnes Pratiques Prelevement Flacons Bactalert 2019KadijaaNoch keine Bewertungen
- ACFrOgAA86SYiZjAK4rZ1OtrddBWXhmAgnE ItJCPswJ5690wN0B9fuqErrESfXl-1TDzU2x96LI24G4kfLfEnqE0RD Nu VrKhTNtu3WpQl3ptDHdnncmqzxzAHF5SldTSlc3IZHywxHZKgd9mNDokument1 SeiteACFrOgAA86SYiZjAK4rZ1OtrddBWXhmAgnE ItJCPswJ5690wN0B9fuqErrESfXl-1TDzU2x96LI24G4kfLfEnqE0RD Nu VrKhTNtu3WpQl3ptDHdnncmqzxzAHF5SldTSlc3IZHywxHZKgd9mNwahid El baz100% (1)
- 2-ECG Normal ÉliteDokument75 Seiten2-ECG Normal ÉliteNa WelNoch keine Bewertungen
- Réserve Naturelle Des Gorges de La LoireDokument185 SeitenRéserve Naturelle Des Gorges de La LoireAlexandra GalerNoch keine Bewertungen
- Exercices HalogenoalcanesDokument10 SeitenExercices HalogenoalcanesJean-François Abena100% (1)
- Questionnaire Sur Le Bus Doté D'un Diffuseur de ParfumDokument3 SeitenQuestionnaire Sur Le Bus Doté D'un Diffuseur de ParfumVincent BallesterNoch keine Bewertungen
- É Preuve Écrite #1 de SVT: Conseils Pour L'épreuveDokument2 SeitenÉ Preuve Écrite #1 de SVT: Conseils Pour L'épreuveFirass Biad100% (1)
- 109 Hair Salon Slogans Et SlogansDokument2 Seiten109 Hair Salon Slogans Et Slogansequableenthusia3Noch keine Bewertungen
- 5me Chap.8Dokument3 Seiten5me Chap.8moovitchNoch keine Bewertungen
- NIKON Super Coolscan 4000 ED Notice Manuel Guide Mode EmploiDokument112 SeitenNIKON Super Coolscan 4000 ED Notice Manuel Guide Mode EmploiPhilippe GillionNoch keine Bewertungen
- Questionnaires Audit 2Dokument8 SeitenQuestionnaires Audit 2Mahaliana RatolojanaharyNoch keine Bewertungen
- TD 4Dokument2 SeitenTD 4Ayella Ôë100% (1)
- 20 1552ea FDISDokument14 Seiten20 1552ea FDISchili15Noch keine Bewertungen
- Fiche 1Dokument5 SeitenFiche 1othman okNoch keine Bewertungen
- Fiches MO EpurationDokument15 SeitenFiches MO EpurationkaoutarNoch keine Bewertungen
- PC23 Cycle3-6e - ProgrammeDokument12 SeitenPC23 Cycle3-6e - Programmeestelle.buchyNoch keine Bewertungen
- PrecipitationsDokument12 SeitenPrecipitationsBenslimane mahmoudNoch keine Bewertungen
- UMIH - Loi Anti-Gaspillage Et Pour Une Économie CirculaireDokument10 SeitenUMIH - Loi Anti-Gaspillage Et Pour Une Économie CirculaireAnalyNoch keine Bewertungen
- Le Béton EXPOSÉ ANGLAISDokument2 SeitenLe Béton EXPOSÉ ANGLAISAMEYRENoch keine Bewertungen
- Armines-Secheresse SyntheseDokument54 SeitenArmines-Secheresse SyntheseFredj Ben SalemNoch keine Bewertungen