Beruflich Dokumente
Kultur Dokumente
Propiedades Atómicas y Su Variación Periódica
Hochgeladen von
Mauricio MauOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Propiedades Atómicas y Su Variación Periódica
Hochgeladen von
Mauricio MauCopyright:
Verfügbare Formate
Propiedades atmicas y su variacin peridica Carga nuclear efectiva El concepto de carga nuclear efectiva es muy til para analizar
las propiedades de los tomos polielectrnicos. La carga nuclear efectiva esta dad por: Zef=Z-s Donde Z es la carga nuclear real y sigma se llama constante de apantallimiento. Una forma de mostrar el apantallamiento de los electrones es analizar el valor de la energa requerida para quitar un electrn de un tomo polielectrnico. Las mediciones muestran que se requieren 2373kJ de energa para mover el electrn restante de un mol de tomos de He y 5248 kJ de energa para remover el electrn restante de un mol de iones de He+. La razn por la cual se requiere menos energa en el primer paso es que la repulsin electrn- electrn el apantallamiento, provoca una reduccin en la atraccin del ncleo sobre cada electrn. En el He+ hay presente un solo electrn, as es que no hay apantallamiento y el electrn siente el efecto total de la carga nuclear +2. Por consiguiente, se requiere de mucho ms energa parea quitar el segundo electrn. Energa de ionizacin Es la energa de requerida para mover un electrn de un tomo o un ion. La primera energa de ionizacin para un tomo en particular es por tanto la cantidad de energa requerida para remover un electrn de dicho tomo; la segunda energa de ionizacin es siempre mayor que la primera debido a que ha sido removido un electrn de un ion positivo y tercero es igualmente mayor que la segunda. En la siguiente tabla se puede observar que una vez adquirida la configuracin de gas noble, como lo es el caso del Na+, Be2+ y Mg 2+ la prxima energa de ionizacin es muy alta. Esto explica por que una vez se ha obtenido la configuracin de gas noble, no se puede remover ms electrones del tomo por medio de una simple reaccin qumica. Afinidad electrnica La cantidad de energa librada cuando un tomo gana un electrn, se llama afinidad electrnica. En la tabla No.3 se muestran las afinidades de algunos elementos no metales. Puede verse a partir de esta tabla que al avanzar en un periodo, por ejemplo desde el nitrgeno hasta el flor la afinidad electrnica se incrementa. Al igual que en el tamao atmico ya la energa de ionizacin, esto se debe al hecho de que los electrones de valencia estn en el mismo nivel de energa pero la carga nuclear es mayor. De esta forma, con los electrones de valencia cada vez ms cerca del ncleo y con mayor carga nuclear, se libera mayor cantidad de energa cuando se agrega un electrn a la capa de valencia. Bajando en el grupo de no metales, como en el caso de los halgenos la afinidad electrnica disminuye. Esto se debe al hecho de que al bajar en el grupo, los electrones de valencia estn ms alejados del ncleo y por lo tanto no se libera tanta energa cuando una capa de valencia acepta un electrn. El flor es una excepcin ala regla general. Esto se debe al tamao pequeo del tomo y contrario a lo que esperaramos, a la poca tendencia a aceptar un electrn. EL tamao pequeo del tomo causa mayor repulsin entre los electrones de valencia. Electronegatividad La electronegatividad de un tomo se define como la tendencia general de un tomo para tener electrones hacia s mismo en un compuesto. Esta es determina a partir de la electroafinidad y de la energa de ionizacin. Sin embargo, no es una medida de energa, pero s una simple tendencia de los tomos para atraer electrones. Hay diferentes escalas de electronegatividad, pero la ms comn es la escala que realiz Linus Paulig. La siguiente tabla muestra una lista de las electronegatividades de los elementos segn la escala de Linus Pauling. Se puede notar que hay un aumento en la electronegatividad a medida que avanzamos de izquierda a derecha en un periodo y una disminucin a medida que bajamos en un grupo.
RADIO ATOMICO
Medir directamente el radio atmico es muy difcil ya que el tamao de un tomo se piensa como el volumen que contienen el 90% de la totalidad de la densidad electrnica. As el radio atmico es la mitad de la distancia entre dos ncleos de dos tomos adyacentes Analicemos la tendencia peridica en un periodo, siempre teniendo en cuenta que el radio atmico esta determinado por cun fuerte atrae el ncleo a los electrones. A mayor carga nuclear efectiva, los electrones estarn mas fuertemente enlazados al ncleo y menor ser el radio atmico En el Segundo periodo de la tabla peridica los elementos del Li al F, el nmero de niveles es el mismo 2, es decir todos tienen un orbital 1s lleno y el subnivel 2 pasa de tener 1 electrn en el Litio a tener 7 en el caso del Fluor. Como vimos y es de esperar la carga nuclear efectiva aumenta, por lo tanto hay una mayor atraccin del ncleo por los ltimos electrones y el radio atmico disminuye constantemente del Litio al Fluor.
A medida que se desciende en un grupo, por ejemplo el grupo IA se encuentra que el radio atmico aumenta segn aumenta el nmero atmico. Esto se explica por que la carga nuclear efectiva permanece prcticamente constante, pero el nmero de niveles aumenta. Como el tamao de los orbitales aumenta con el incremento del nmero cuntico principal, n, el tamao de los tomos metlicos aumenta del Li al Cs. El mismo razonamiento se puede explicar a los elementos de otros grupos.
RADIO IONICO
El radio inico es el radio de un anin o de un catin. El radio inico afecta las propiedades fsicas y qumicas de un compuesto inico Cuando un tomo neutro se convierte en un anin, su tamao o radio aumenta, dado que la carga nuclear permanece constante pero la repulsin resultante de la adicin de un electrn es mayor. Por otra parte un catin es menor que su tomo neutro, dado que al quitar electrones reduce la repulsin electrnica y se contrae la nube electrnica En un grupo el radio atmico y el radio inico varan de igual forma, es decir al descender en un grupo el radio atmico aumenta y el radio inico tambin. Para iones derivados de elementos de diferentes grupos la comparacin solo tiene significado si los iones son isoelectrnicos. Si se analizan iones isoelectrnicos se encuentra que los aniones son ms grandes que los cationes. Propiedades Quimicas Y Variacion Periodica: tendencias generales y por grupo. La tabla peridica de los elementos fue propuesta por Dimitri Mendeleiev y Julius Lothar Meyer quienes, trabajando por separado, prepararon una ordenacin de todos los 64 elementos conocidos, basndose en la variacin de las propiedades qumicas (Mendeleiev) y fsicas (Meyer) con la variacin de sus masas atmicas. A diferencia de lo que haba supuesto Newlands, en la Tabla peridica de Mendeleiev los periodos (filas diagonales y oblicuas) no tenan siempre la misma longitud, pero a lo largo de los mismos haba una variacin gradual de las propiedades, de tal forma que los elementos de un mismo grupo o familia se correspondan en los diferentes periodos. Esta tabla fue publicada en 1869, sobre la base de que las propiedades de los elementos son funcin peridica de sus pesos atmicos. La nocin de nmero atmico y la mecnica cuntica [editar] La tabla peridica de Mendeliev presentaba ciertas irregularidades y problemas. En las dcadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las tierras raras y los elementos radioactivos. Otro problema adicional eran las irregularidades que existan para compaginar el criterio de ordenacin por peso atmico creciente y la agrupacin por familias con propiedades qumicas comunes. Ejemplos de esta dificultad se encuentran en las parejas telurio-yodo, argon-potasio y cobalto-niquel, en las que se hace necesario alterar el criterio de pesos atmicos crecientes en favor de la
agrupacin en familias con propiedades qumicas semejantes. Durante algn tiempo, esta cuestin no pudo resolverse satisfactoriamente hasta que Henry Moseley (18671919) realiz un estudio sobre los espectros de rayos X en 1913. Moseley comprob que al representar la raiz cuadrada de la frecuencia de la radiacin en funcin del nmero de orden en el sistema peridico se obtena una recta, lo cual permita pensar que este orden no era casual sino reflejo de alguna propiedad de la estructura atmica. Hoy sabemos que esa propiedad es el nmero atmico (Z) o nmero de cargas positivas del ncleo. La explicacin que aceptamos actualmente de la ley peridica descubiert a por los qumicos de mediados del siglo pasado surgi tras los desarrollos tericos producidos en el primer tercio del siglo XX. En el primer tercio del siglo XX se construy la mecnica cuntica. Gracias a estas investigaciones y a los desarrollos posteriores, hoy se acepta que la ordenacin de los elementos en el sistema peridico est relacionada con la estructura electrnica de los tomos de los diversos elementos, a partir de la cual se pueden predecir sus diferentes propiedades qumicas.
Tabla peridica de los elementos
Grupo
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I III Periodo II IV
VI
VII
VIII
11H
2 He
2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne
3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe
6 55 Cs 56 Ba 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn
7 87 Fr 88 Ra 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg 112 Uub 113 Uut 114 Uuq 115 Uup 116 Uuh 117 Uus 118 Uuo Lantnidos 57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu Actnidos 89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95 Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101 Md 102 No 103 Lr Alcalinos Alcalinotrreos Lantnidos Actnidos Metales de transicin Metales del bloque p Metaloides No metales Halgenos Gases nobles Grupos A las columnas verticales de la Tabla Peridica se las conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia, y por ello, tienen caractersticas o propiedades similares entre si. Por ejemplo los elementos en el grupo IA tienen valencia de 1 (un electrn su ltimo nivel de energa) y todos tienden a perder ese electrn al enlazarse como iones positivos de +1. Los elementos en el ltimo grupo de la derecha son los Gases Nobles, los cuales tienen su ltimo nivel de energa lleno (regla del octeto) y por ello son todos extremadamente no-reactivos. Los grupos de la Tabla Peridica, numerados de izquierda a derecha son:
Grupo 1 (IA): los metales alcalinos Grupo 2 (IIA): los metales alcalinotrreos Grupo 3 al Grupo 12: los metales de transicin , metales nobles y metales mansos Grupo 13 (IIIA): Trreos Grupo 14 (IVA): carbonoideos Grupo 15 (VA): nitrogenoideos Grupo 16 (VIA): los calcgenos o anfgenos Grupo 17 (VIIA): los halgenos Grupo 18 (VIIIA): los gases nobles Perodos Artculo principal: Perodos de la tabla peridica Las filas horizontales de la Tabla Peridica son llamadas Perodos. Contrario a como ocurre en el caso de los grupos de la tabla peridica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un perodo tienen el mismo nmero de orbitales. Siguiendo esa norma, cada elemento se coloca de acuerdo a su configuracin electrnica. El primer perodo solo tiene dos miembros: hidrgeno y helio, ambos tienen solo el orbital 1s. La tabla peridica consta de 7 perodos. Elementos de importancia economica, industrial y ambiental. Elemento de Importancia Econmica: Hidrogeno (H) Los principales uso del hidrogeno son: a) para la produccin de amoniaco (N3H) por el proceso (Haber). b) En la produccin del cido clorhdrico al combinarse con cloro, en la sntesis del alcohol metilito (CH3OH) al combinar con monxido de carbono. c) Refinacin de petrleo. d) Hidrogeno de aceite. Boro (B) este no metal se utiliza como fertilizante foliar y edfico. Carbono este metal es importante ya que forma parte de numerosos compuestos y son importantes para la vida cotidiana del ser humano. Tambin forma parte de las estructuras de las grasas o lpidos de la cual la parte estructural esta formada por el glicerol y glicerina el cual es un alcohol. El carbono tambin forma parte de las estructuras de cidos nucleicos, vitaminas. Nitrgeno (N) la mayor parte del nitrgeno se encuentra en el aire de la atmsfera y se usa para fabricar amoniaco al combinarse con el hidrogeno en su forma liquida, el nitrgeno se utiliza como congelante.
Oxigeno (O) este elemento tambin se encuentra en el aire de la atmsfera y es muy importante en la vida del ser humano ya que el depende de su respiracin. Tambin se utiliza ampliamente en la industria y tambin se utiliza en la soldadura autgena o acetilnica. Flor (F) los usos de los fluoruros principalmente el fluoruro de sodio se utiliza en la fluoracin del agua potable y en las pastas dentales para prevenir las caries. Cloro (Cl) se utiliza para la elaboracin de plstico disolvente, pesticidas, producto farmacutico, refrigerante y colorante. Tambin se utiliza en la desinfeccin y para blanquear textiles. Bromo (Br) los compuestos orgnicos que contienen bromo se utilizan como intermediarios en las sntesis industriales de colorantes. Los bromuros inorgnicos se utilizan como medicina en el blanqueo de tejidos y en fotografas bromuro de plata. Yodo (I) sus compuestos no se usan tan extensamente como las de otros halgenos del grupo 7 y sus principales usos: productos farmacuticos, pinturas, para fotografa en su forma de yoduro de plata y tambin como desinfectantes.
Elemento de Importancia Industrial: Aluminio es resistente a la corrosin, se puede laminar e hilar por los que se emplea en la construccin de vehculos, aviones y utensilios domsticos. Se extrae de la bauxita por reduccin electroltica. Cobalto se emplea en la elaboracin de aceros especiales debido a su alta resistencia al calor, corrosin y friccin. Se emplea en herramienta mecnica de alta velocidad, imanes y motores. En forma de polvo, se emplea como pigmento azul para el vidrio. Su istopo radiactivo se emplea en el Instituto Nacional de Investigacin Nuclear (ININ) de Mxico, por que produce radiaciones gamma. Mercurio es resistente a la corrosin y un bueno conductor elctrico. Se usa en la fabricacin de instrumentos de presin, bateras, termmetro, barmetro, amalgamas dentales, sosa custica, medicamentos e insecticidas. Antimonio se utiliza, metal de imprenta, bateras y textiles. Plata se emplea en la acuacin de monedas y manufacturas de vajillas y joyas, en fotografas, aparatos elctricos, aleaciones y soldaduras. Cobre usado principalmente como conductor elctrico, en la elaboracin de monedas y aleaciones como el latn y bronce. Plomo se emplea para la fabricacin de de barias y acumuladores, de pinturas, soldaduras e investigaciones nucleares.Hierro se utiliza en la industria, el arte y la medicina. Para fabricar acero, cemento, fundiciones de metales ferrosos, adems es un componente importante de la sangre contenido en la hemoglobina. Oro es el patrn monetario internacional, sus aleaciones se emplean en joyeras, y ornamentos, piezas dentales y equipo cientficos de elaboracin. En la actualidad se ha reemplazado por iridio y rutenio en la joyera, y en piezas dentales, por platino y paladio. Elementos de Importancia Ambiental: Bromo sus vapores contamina el aire, adems sus compuestos derivados solo lacrimgenos y venenosos. Azufre sus xidos (SO2 Y SO3) contaminan el aire y mezclados con agua producen la lluvia cida. Algunas sustancias como los derivados clorados, sulfatos y cidos son corrosivos, el gas H2S es sumamente toxico y contamina el aire. Cadmio contamina el agua y el aire es constituyente de algunos fertilizantes que contaminan el suelo.
Mercurio contamina el agua, el aire y causa envenenamiento. Las algas lo absorben, luego los peces y finalmente el hombre. Los granos lo retienen y como el hombre los ingiere, lo incorpora a sus tejidos. Tambin puede absorberse por la piel. Antimonio el envenenamiento por antimonio se produce por ingestin, inhalacin de vapor y principalmente por un gas llamado estibina. Arsnico en general, todos sus compuestos y derivados son altamente txicos. Fsforo debido a que se emplea en la sntesis de pinturas, plaguicidas y fertilizantes, contaminan el aire, el suelo y el agua. Plomo contaminan el aire, el agua y el suelo (produce graves daos a la agricultura), y cuando se inhala o se ingiere como alimento, se acumula en el cuerpo y produce una enfermedad conocida como saturnismo. Cloro sus vapores contaminan el aire y son corrosivo. En forma de clorato, contamina el agua, adems de forma mezcla explosiva con compuestos orgnicos que daan el hgado y el cerebro. Algunos medicamentos que contienen cloro afectan al sistema nervioso. Cromo en su forma de cromato soluble contamina el agua. Sus compuestos son perjudiciales para el organismo, pues destruyen todas las clulas. Manganeso los polvos y humos que contienen manganeso causan envenenamientos y atrofian el cerebro, cuando se inhala, adems de contaminar el agua.
Das könnte Ihnen auch gefallen
- Unidad2 ELEMENTOS QUÍMICOSDokument9 SeitenUnidad2 ELEMENTOS QUÍMICOSmario aguilarNoch keine Bewertungen
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseVon EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Propiedades Atómicas de Los Elementos QuímicosDokument7 SeitenPropiedades Atómicas de Los Elementos QuímicosAnonymous DgeLm1nzRUNoch keine Bewertungen
- Tabla PeriodicaDokument6 SeitenTabla PeriodicaFRANKLINNoch keine Bewertungen
- Bloque SDokument8 SeitenBloque SAlejandra NuñezNoch keine Bewertungen
- Capítulo 9 - RodgersDokument7 SeitenCapítulo 9 - RodgersGiuliana AlbanoNoch keine Bewertungen
- Diaporama Base Experimental Teoria Cuantica, Estructura Atomica, Periocidad Quimica, Clasificaciones Periodicas InicialesDokument40 SeitenDiaporama Base Experimental Teoria Cuantica, Estructura Atomica, Periocidad Quimica, Clasificaciones Periodicas InicialesFlorii Parker Gr100% (1)
- Propiedades Atómicas QuimicaDokument6 SeitenPropiedades Atómicas QuimicaDani SangarNoch keine Bewertungen
- Quimica UIDokument15 SeitenQuimica UIEl SeñorNoch keine Bewertungen
- Electrones de Valencia, Estructura de Lewis y Regla Del OctetoDokument8 SeitenElectrones de Valencia, Estructura de Lewis y Regla Del OctetoBelénJimenezTofhiNoch keine Bewertungen
- 3° Año-Teoría 12Dokument2 Seiten3° Año-Teoría 12Jackson López LaviNoch keine Bewertungen
- Tendencia QuímicaDokument18 SeitenTendencia QuímicaFERNANDO HERNANDEZ REYESNoch keine Bewertungen
- Energía de IonizaciónDokument3 SeitenEnergía de Ionizaciónsharon moreiraNoch keine Bewertungen
- Las Propiedades Periódicas Son Las Que Se Repiten en Todos Los Elementos Químicos y Que Van Cambiando de Forma Secuencial A Lo Largo de La Tabla PeriódicaDokument3 SeitenLas Propiedades Periódicas Son Las Que Se Repiten en Todos Los Elementos Químicos y Que Van Cambiando de Forma Secuencial A Lo Largo de La Tabla PeriódicaÄndrËs BËdöyÄNoch keine Bewertungen
- Propiedades Periódicas y Los Alòtropos 1Dokument16 SeitenPropiedades Periódicas y Los Alòtropos 1Andrea Elise Velásquez PérezNoch keine Bewertungen
- Tabla Periódica Por Todos XDDokument39 SeitenTabla Periódica Por Todos XDJulioNoch keine Bewertungen
- 102-QC03 04 05 15Dokument19 Seiten102-QC03 04 05 15Adela Chamorro100% (1)
- MARCO TEORICO Tabla PeriodicaDokument11 SeitenMARCO TEORICO Tabla PeriodicaCarlos Mario Barrios Ruiz100% (1)
- QC04 - 05 - 05 - 14 Tabla PeriódicaDokument20 SeitenQC04 - 05 - 05 - 14 Tabla PeriódicaCarolina TorresNoch keine Bewertungen
- 4.ley PeriodicaDokument16 Seiten4.ley PeriodicaToto UlloaNoch keine Bewertungen
- Radio AtómicoDokument6 SeitenRadio AtómicojesusNoch keine Bewertungen
- Uniones Químicas 2021 (Aldana)Dokument9 SeitenUniones Químicas 2021 (Aldana)fran aNoch keine Bewertungen
- QUIMICA UNIDAD 2 Parte 1Dokument4 SeitenQUIMICA UNIDAD 2 Parte 1FannyNoch keine Bewertungen
- Radio AtómicoDokument13 SeitenRadio AtómicoGabriela AvilesNoch keine Bewertungen
- Tabla PeriódicaDokument19 SeitenTabla PeriódicaSofia Dominguez VenezianNoch keine Bewertungen
- Propiedades de La Tabla PeriódicaDokument5 SeitenPropiedades de La Tabla PeriódicaAlexerNoch keine Bewertungen
- Periodicidad QuímicaDokument41 SeitenPeriodicidad QuímicaDaniel Santiago Ruiz SandovalNoch keine Bewertungen
- Carga Nuclear EfectivaDokument7 SeitenCarga Nuclear EfectivaDaniela MedinaNoch keine Bewertungen
- Carga Nuclear EfectivaDokument7 SeitenCarga Nuclear EfectivaDaniela MedinaNoch keine Bewertungen
- Actividades Quimica-Balderas CastilloDokument10 SeitenActividades Quimica-Balderas Castilloelprogamer186Noch keine Bewertungen
- Quimica General PropiedadesDokument22 SeitenQuimica General PropiedadesIván Sebastián Arias LoarteNoch keine Bewertungen
- ESTRUCTURA ATÓMICA, Ejercicios PropuestosDokument12 SeitenESTRUCTURA ATÓMICA, Ejercicios PropuestosJuanSanchezMuñizNoch keine Bewertungen
- Propiedades Periódicas de Los ElementosDokument2 SeitenPropiedades Periódicas de Los ElementosMary Rivas DíazNoch keine Bewertungen
- QC03 - Tabla PeriódicaDokument19 SeitenQC03 - Tabla PeriódicaJOSE EDWARD ORTEGA GALEANONoch keine Bewertungen
- Ebau2023 222 Química Estructura Atómica, Ejercicios Propuestos 2023Dokument12 SeitenEbau2023 222 Química Estructura Atómica, Ejercicios Propuestos 2023ilias fakhriNoch keine Bewertungen
- Apuntes de EstructuraDokument53 SeitenApuntes de EstructurapersodiselgNoch keine Bewertungen
- Estructura de La MateriaDokument3 SeitenEstructura de La MateriaMARIA NICOLAS GOMEZNoch keine Bewertungen
- P2 - Periodicidad QuímicaDokument48 SeitenP2 - Periodicidad QuímicaElisa suarezNoch keine Bewertungen
- Unidad Iii Sistema PeriódicoDokument22 SeitenUnidad Iii Sistema PeriódicoTamara AlfonsoNoch keine Bewertungen
- Química y Tendencia Periódicas de Metales EnsayoDokument11 SeitenQuímica y Tendencia Periódicas de Metales EnsayoistillthinkNoch keine Bewertungen
- Carga Nuclear EfectivaDokument13 SeitenCarga Nuclear Efectivaleonathan Baños HernandezNoch keine Bewertungen
- Taller de Nivelación Química 2020Dokument20 SeitenTaller de Nivelación Química 2020xNoch keine Bewertungen
- Practica 1. Oxidacion de Los Metales.Dokument9 SeitenPractica 1. Oxidacion de Los Metales.DENISE YAEL VIZCAYA ROJASNoch keine Bewertungen
- Propiedades PeriódicasDokument11 SeitenPropiedades PeriódicasMarco Antonio Sandoval AlvaradoNoch keine Bewertungen
- Lectura 1.2-Tendencias PeriódicasDokument9 SeitenLectura 1.2-Tendencias PeriódicasLindao Sánchez AldoNoch keine Bewertungen
- Química Apuntes 1 TrimestreDokument12 SeitenQuímica Apuntes 1 TrimestrePilar Martin VelezNoch keine Bewertungen
- ElectronegatividadDokument6 SeitenElectronegatividadJsa SantiaGo AvilaNoch keine Bewertungen
- Propiedades PeriódicasDokument35 SeitenPropiedades PeriódicasLeidi HernandezNoch keine Bewertungen
- QUI-115 Quimica General I - Unidad 2-Semana 6-2.10Dokument47 SeitenQUI-115 Quimica General I - Unidad 2-Semana 6-2.10AleNoch keine Bewertungen
- Propiedades Periódicas PDFDokument18 SeitenPropiedades Periódicas PDFwaldemarNoch keine Bewertungen
- Propiedades PeriódicasDokument8 SeitenPropiedades PeriódicasNohelia Delgado MendozaNoch keine Bewertungen
- Clase 6Dokument17 SeitenClase 6Edwin VasquezNoch keine Bewertungen
- Unidad III Química IDokument8 SeitenUnidad III Química IGracielaNoch keine Bewertungen
- QUIMICADokument15 SeitenQUIMICAlizzy amadorNoch keine Bewertungen
- 2 - Desarrollo Tabla Periodica, Tamano de Atomos e Iones y Energia de IonizacionDokument23 Seiten2 - Desarrollo Tabla Periodica, Tamano de Atomos e Iones y Energia de IonizacionEliana Maité BenítezNoch keine Bewertungen
- Plan de Continuidad Pedagógica 6Dokument2 SeitenPlan de Continuidad Pedagógica 6micafavaNoch keine Bewertungen
- Quimica DuvanDokument9 SeitenQuimica DuvanDiego BoadaNoch keine Bewertungen
- 10 - A Guia Propiedades PeriodicasDokument8 Seiten10 - A Guia Propiedades PeriodicasJuan Manuel Castro De La HozNoch keine Bewertungen
- Propiedades AtomicasDokument3 SeitenPropiedades Atomicasluisao218Noch keine Bewertungen
- Análisis FODADokument2 SeitenAnálisis FODAMauricio MauNoch keine Bewertungen
- Juan Muga - La Fisica Cuantica en La Vida DiariaDokument16 SeitenJuan Muga - La Fisica Cuantica en La Vida Diariaruilov93% (14)
- Programacion Basada en ObjetosDokument8 SeitenProgramacion Basada en ObjetosDiego ZurrejosNoch keine Bewertungen
- Distintas Clases de EventosDokument10 SeitenDistintas Clases de EventosMauricio MauNoch keine Bewertungen
- Anon - Guia Desarrollo Plan de NegociosDokument29 SeitenAnon - Guia Desarrollo Plan de Negociosapi-3742403100% (1)
- Empresa Yakult SDokument10 SeitenEmpresa Yakult SMauricio Mau100% (1)
- SQL Server 2008 R2Dokument29 SeitenSQL Server 2008 R2Ariel Barros OrtegaNoch keine Bewertungen
- 7 Casos de FactorizacionDokument2 Seiten7 Casos de FactorizacionErvin Acuña56% (16)
- Propiedades Atómicas y Su Variación PeriódicaDokument7 SeitenPropiedades Atómicas y Su Variación PeriódicaMauricio MauNoch keine Bewertungen
- Instalar Servidor WINS en Windows Server 2008Dokument8 SeitenInstalar Servidor WINS en Windows Server 2008Mauricio MauNoch keine Bewertungen
- Análisis FODADokument2 SeitenAnálisis FODAMauricio MauNoch keine Bewertungen
- Programacion Basada en ObjetosDokument8 SeitenProgramacion Basada en ObjetosDiego ZurrejosNoch keine Bewertungen
- Importancia de Internet para Las EMPRESASDokument3 SeitenImportancia de Internet para Las EMPRESASMauricio MauNoch keine Bewertungen
- Análisis FODADokument2 SeitenAnálisis FODAMauricio MauNoch keine Bewertungen
- Resumen de Las Principales Formulas e Identidades TrigonometricasDokument2 SeitenResumen de Las Principales Formulas e Identidades TrigonometricasGuillermo CapellanNoch keine Bewertungen
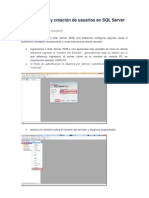
- Configuración y Creación de Usuarios en SQL Server 2008Dokument7 SeitenConfiguración y Creación de Usuarios en SQL Server 2008Patrick Casiano ContrerasNoch keine Bewertungen
- Unidad 1 Sistemas Gestores de BDDokument26 SeitenUnidad 1 Sistemas Gestores de BDMauricio MauNoch keine Bewertungen
- ATMDokument7 SeitenATMMauricio SanchezNoch keine Bewertungen
- Numeros ComplejosDokument23 SeitenNumeros ComplejosJose Reyes PonceNoch keine Bewertungen
- Codigo DeontDokument13 SeitenCodigo DeontMauricio MauNoch keine Bewertungen
- Circulo UnitarioDokument1 SeiteCirculo UnitarioHolman Alejandro Calderon VillamizarNoch keine Bewertungen
- Las Teorías X y YDokument5 SeitenLas Teorías X y Ymau9056Noch keine Bewertungen
- Codigo DeontDokument13 SeitenCodigo DeontMauricio MauNoch keine Bewertungen
- Propiedades Coligativas 1505Dokument9 SeitenPropiedades Coligativas 1505jemimaraquelNoch keine Bewertungen
- Manual UMAG 2013 - REV.06 - EspañolDokument49 SeitenManual UMAG 2013 - REV.06 - EspañolVíctor Barreto Vásquez100% (2)
- Conservación de CarreterasDokument15 SeitenConservación de CarreterasarielNoch keine Bewertungen
- Trabajo Final Chilis 2Dokument188 SeitenTrabajo Final Chilis 2Joel DavidNoch keine Bewertungen
- Estequiometria BSB 1 PDFDokument11 SeitenEstequiometria BSB 1 PDFDani ValverdeNoch keine Bewertungen
- Introduccion A La Química OrgánicaDokument3 SeitenIntroduccion A La Química Orgánicalisbeth vargasNoch keine Bewertungen
- Campos Blanca VinitaDokument39 SeitenCampos Blanca Vinitajohan100% (1)
- Examen de Ciencia Salud y Medio AmbienteDokument1 SeiteExamen de Ciencia Salud y Medio AmbienteIng Vladimir MartinezNoch keine Bewertungen
- Aditivo - AceleranteDokument2 SeitenAditivo - AceleranteJeampool Brayan QuispeNoch keine Bewertungen
- 5B Unidades Quimicas de MasaDokument5 Seiten5B Unidades Quimicas de MasaleaNoch keine Bewertungen
- Proyecto CincoDokument38 SeitenProyecto CincoJerry PonceNoch keine Bewertungen
- Torre de Pared MojadaDokument7 SeitenTorre de Pared MojadaRodrigo GarciaNoch keine Bewertungen
- XerografíaDokument3 SeitenXerografíaEduardo MartinezNoch keine Bewertungen
- Star San HB SDS ESDokument9 SeitenStar San HB SDS ESwalter esquivelNoch keine Bewertungen
- Especificaciones Tecnicas Puente CangalliDokument29 SeitenEspecificaciones Tecnicas Puente CangalliJaime Chaiña ChurataNoch keine Bewertungen
- Informe de Lab 2 Estado GaseosoDokument8 SeitenInforme de Lab 2 Estado GaseosoDaAlCoAg100% (3)
- Canaletas de Aluminio Vs Canaletas GalvanizadasDokument3 SeitenCanaletas de Aluminio Vs Canaletas GalvanizadasDayana Zevallos100% (1)
- Water Cube - PTW ArchitectsDokument14 SeitenWater Cube - PTW ArchitectsJuan Gigoux S0% (1)
- ALGORITMO DE LANE - UNMSM Ley de Corte Dinámica PDFDokument36 SeitenALGORITMO DE LANE - UNMSM Ley de Corte Dinámica PDFJosé R. Castro100% (1)
- Amalgama DentalDokument42 SeitenAmalgama DentalRevorg zeñaY adecamNoch keine Bewertungen
- Procesamiento de Minerales 2019Dokument194 SeitenProcesamiento de Minerales 2019Cristian P OlmosNoch keine Bewertungen
- Anexo 5 PDFDokument58 SeitenAnexo 5 PDFJose MiguelNoch keine Bewertungen
- Determinación de La Actividad de Glutamina SintetasaDokument2 SeitenDeterminación de La Actividad de Glutamina SintetasapatriciaNoch keine Bewertungen
- Agregado Lavado y Sin LavarDokument9 SeitenAgregado Lavado y Sin LavaryeserNoch keine Bewertungen
- Guía de Problemas Técnicas ESPECTROFOTOMETRÍA1Dokument7 SeitenGuía de Problemas Técnicas ESPECTROFOTOMETRÍA1Hilario Cantaro MejiaNoch keine Bewertungen
- Aplicación de La Segunda Ley de La TermodinamicaDokument17 SeitenAplicación de La Segunda Ley de La TermodinamicaelfelloNoch keine Bewertungen
- Test PercolacionDokument12 SeitenTest PercolacionAlex Ricardo Cano CarbajalNoch keine Bewertungen
- Medidas de Seguridad en DocumentosDokument12 SeitenMedidas de Seguridad en Documentosapi-376166174% (31)
- Liquídos y Electrolitos en Pediatría 2014Dokument6 SeitenLiquídos y Electrolitos en Pediatría 2014Victor JulioNoch keine Bewertungen
- Eiib Guadeproblemaspropuestos 160727203209 PDFDokument97 SeitenEiib Guadeproblemaspropuestos 160727203209 PDFMarlon Damian100% (1)