Beruflich Dokumente
Kultur Dokumente
Reaccione
Hochgeladen von
Amparo OssaOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Reaccione
Hochgeladen von
Amparo OssaCopyright:
Verfügbare Formate
Reacciones de adicin electrfila La reaccin caracterstica de los alquenos es la adicin de sustancias al doble enlace, segn la ecuacin:
La primera etapa de la reaccin es la adicin del protn al alqueno nuclefilo, para formar el carbocatin. En la segunda etapa, el carbocatin reacciona con el nuclefilo.
La adicin de electrfilos a alquenos hace posible la sntesis de muchas clases de compuestos:
Halogenuros de alquilo, alcoholes, alcanos, dioles, teres pueden ser sintetizados a partir de alquenos por reacciones de sustitucin electrfila. El producto obtenido depende solamente del electrfilo y del nuclefilo usado en la reaccin Hidrogenacin de Alquenos La hidrogenacin es la adicin de hidrgeno al doble enlace para formar alcanos. Platino y paladio son los catalizadores ms comunmente usados en la hidrogenacin de alquenos. El paladio se emplea en forma de polvo absorbido en carbn (Pd/C). El platino se mplea como PtO2 (Catalizador de Adams).
Adicin de HX Los haluros de hidrgeno se adicionan a alquenos, formando haloalcanos. El protn acta como electrfilo, siendo atacado por el alqueno en la primera etapa. En esta reaccin se pueden utilizar como reactivos HF, HCl, HBr, HI.
En estos ejemplos el alqueno es simtrico y es indiferente a que carbono del alqueno se une el hidrgeno. En alquenos asimtricos se pueden dar dos tipos de productos dependiendo de a que carbono sp2 se adicione el hidrgeno. Veamos un ejemplo:
La adicin de HBr al 2-metil-2-buteno puede generar dos productos, dependiendo de que el hidrgeno se adicione al carbono del metilo o al vecino. Experimentalmente se observa
que se obtiene 2-bromo-2-metilbutano y no aparece el 2-bromo-3-metilbutano como producto de la reaccin. Cmo se puede explicar este hecho experimental? La respuesta est en el mecanismo de la reaccin, que vamos a especificar a continuacin.
La etapa limitante de este mecanismo es el ataque electrfilo al protn (primer paso), en esta etapa se forma un intermedio de reaccin muy inestable, llamado carbocatin. La mayor estabilidad del carbocatin [1] (terciario), comparada con la del carbocatin [2] (secundario), hace que el primer mecanismo sea ms favorable que el segundo. Regla de Markovnikov - Regioselectividad Cuando un alqueno no tiene los mismos sustituyentes en sus carbonos sp2 puede formar dos tipos de productos en reacciones de sustitucin electrfila. El producto mayoritario es el que se obtiene por adicin del protn al carbono sp2, que genera el carbocatin de mayor estabilidad. Por ejemplo, cuando el propeno reacciona con HBr, el protn puede unirse al carbono 1 formndose el carbocatin en el carbono 2. Este carbocatin es secundario y la hiperconjugacin le da una importante estabilidad. Si el protn se une al carbono 2, se obtiene un carbocatin primario sobre el carbono 1. La estabilidad del carbocatin primario es muy inferior a la del secundario y se formar ms lentamente, dando lugar a un pequeo porcentaje del 1-bromopropano.
El 1-bromopropano y el 2-bromopropano son ismeros estructurales, tambin llamados regioismeros. Cuando una reaccin genera un ismero estructural, en ms proporcin que el otro, se dice que es regioselectiva. Existen diferentes grados de regioselectividad, segn la proporcin en la que se obtienen los productos finales. Una reaccin que da proporciones similares de ambos productos es poco regioselectiva. Una reaccin que genera casi el 100% de un regioismero tendr una elevada regioselectividad. Los mnimos porcentajes obtenidos del 1-bromopropano, hacen que la reaccin anterior sea altamente regioselectiva. La adicin de HI al 2-penteno, tiene una regioselectividad muy baja, puesto que ambos productos se obtienen en una proporcin similar.
Tanto la formacin del 3-yodopentano como la del 2-yodopentano, transcurren a travs de carbocationes secundarios, con una estabilidad muy prxima, que explica un rendimiento similar en ambos productos. En 1865, el qumico ruso Vladimir Markovnikov, public un trabajo en el que predeca la posicin que ocupaba el protn cuando se adicionaba a alquenos asimtricos. El mrito de Markovnikov est en predecir mediante una sencilla regla, la regioselectividad de las adiciones electrfilas, en una poca en la que an no se conoca la existencia de los carbocationes.
Hidratacin de Alquenos
El agua es un cido muy dbil, con una concentracin de protones insuficiente para iniciar la reaccin de adicin electrfila. Es necesario aadir al medio un cido (H 2SO4) para que la reaccin tenga lugar. Esta reaccin tambin es conocida como hidratacin de alquenos y genera alcoholes.
Esta reaccin se realiza con cido sulfrio diluido 50% sulfrico/H2O y no precisa de hidrlisis final. El mecanismo transcurre con formacin de un carbocatin previa adicin del protn al doble enlace. La hidratacin de alquenos es Markovnikov, es decir, el protn se adiciona al carbono menos sustituido del alqueno (carbono con ms hidrgenos). Etapa 1. Ataque del alqueno al protn (adicin electrfila)
Etapa 2. Ataque nuclefilo del agua al carbocatin formado
Etapa 3. Desprotonacin del alcohol. El agua acta como base.
Por el principio de Le Chtelier, al aumentar la concentracin de un reactivo se produce el desplazamiento del equilibrio hacia el producto final. Para aumentar el rendimiento de esta reaccin se puede aadir exceso de agua, provocando un deplazamiento del equilibrio hacia el alcohol final.
Adicin de halgenos
El cloro y el bromo se adicionan a alquenos para dar 1,2-dihaloalcanos. Por ejemplo, el 1,2dicloroetano es sintetizado por la adicin de cloro a eteno.
El F2 y el I2 no se emplean como reactivos en esta reaccin. El Fluor reacciona de forma explosiva con alquenos y la adicin de I2 es termodinamicamente desfavorable. } El mecanismo de esta reaccin involucra la formacin del ion bromonio en una primera etapa. En el segundo paso, el Br- acta como nuclefilo abriendo el ciclo del ion bromonio para formar un 1,2dibromoalcano
Oximercuriacin - Desmercuriacin
Los alquenos pueden hidratarse con acetato de mercurio acuoso seguido de reduccin con borohidruro de sodio. Esta reaccin produce alcoholes y sigue la regla de Markovnikov.
El mecanismo de la reaccin comienza con el ataque del doble enlace al in +HgOAc procedente de la disociacin del acetato de mercurio, formndose el in mercurinio que abre por ataque del agua. El tratamiento con borohidruro de sodio reemplaza el mercurio por hidrgeno.
Etapa 1. Ionizacin del acetato de mercurio
Etapa 2. Adicin electrfila al doble enlace
Etapa 3. Apertura del in mercurinio
Etapa 4. Desprotonacin del agua
Etapa 5. Reduccin del mercurio con borohidruro de sodio
La regioqumica de la reaccin corresponde con una adicin Markovnikov de agua. En cuanto a la estereoqumica, el hidrgeno y el grupo hidroxilo se adicionan Anti.
----------------------------------------------------------------------------------------------------------------------
Das könnte Ihnen auch gefallen
- MixologiaDokument13 SeitenMixologiaLaura Velázquez100% (1)
- El PerdónDokument6 SeitenEl PerdónYosed Estiven Sosa Bernal100% (1)
- Biologia Reinos PDFDokument36 SeitenBiologia Reinos PDFAmparo OssaNoch keine Bewertungen
- Subsistema de La TierraDokument25 SeitenSubsistema de La TierraljlaljlaNoch keine Bewertungen
- Hojas de Trabajo de Preparatoria PDFDokument219 SeitenHojas de Trabajo de Preparatoria PDFMaykol Gonzalez AlvaradoNoch keine Bewertungen
- Monoetilenglicol Tabla CongelacionDokument2 SeitenMonoetilenglicol Tabla CongelacionCarlos KhangNoch keine Bewertungen
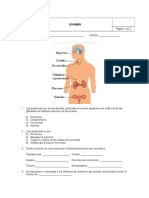
- EXAMEN HormonasDokument3 SeitenEXAMEN HormonasAmparo OssaNoch keine Bewertungen
- Lectura Rápida en 2 Minutos PDFDokument48 SeitenLectura Rápida en 2 Minutos PDFCarlos Andrés Marín100% (4)
- Reinos Seres VivosDokument1 SeiteReinos Seres VivosAmparo OssaNoch keine Bewertungen
- Datos Identificativos Del AlumnoDokument2 SeitenDatos Identificativos Del AlumnoAmparo OssaNoch keine Bewertungen
- sopaybingoLOSMUSCULOS PDFDokument1 SeitesopaybingoLOSMUSCULOS PDFAmparo OssaNoch keine Bewertungen
- Importancia Del Proyecto de VidaDokument209 SeitenImportancia Del Proyecto de VidaAmparo OssaNoch keine Bewertungen
- Agar MacConkey para Cultivos de BacteriasDokument3 SeitenAgar MacConkey para Cultivos de BacteriasAmparo OssaNoch keine Bewertungen
- Leche de ColoresDokument14 SeitenLeche de ColoresAmparo Ossa100% (2)
- Palabras MágicasDokument4 SeitenPalabras MágicasAmparo OssaNoch keine Bewertungen
- Valor Posicional DivisionDokument4 SeitenValor Posicional DivisionAmparo OssaNoch keine Bewertungen
- Bueno. - Cartilla Emprendimiento Ceico 8Dokument153 SeitenBueno. - Cartilla Emprendimiento Ceico 8Amparo Ossa67% (3)
- Circulacic3b3n en AnimalesDokument12 SeitenCirculacic3b3n en AnimalesAmparo OssaNoch keine Bewertungen
- SEÑALIZACIONDokument50 SeitenSEÑALIZACIONcesarNoch keine Bewertungen
- Trabajo Economía (Ventajas, Desventajas e Impacto Económico)Dokument5 SeitenTrabajo Economía (Ventajas, Desventajas e Impacto Económico)cristian torresNoch keine Bewertungen
- 6º Evaluacion Matematicas EnterosDokument2 Seiten6º Evaluacion Matematicas EnterosMARIA FERNANDA CAMARGO MARTINEZ100% (1)
- Efecto de Cambios de La Corriente de CampoDokument5 SeitenEfecto de Cambios de La Corriente de CampoAlbert Martinez100% (1)
- EnsayoDokument4 SeitenEnsayoCarlos MirandaNoch keine Bewertungen
- Cuaderno de Informes 3er Semestre Semana 3Dokument13 SeitenCuaderno de Informes 3er Semestre Semana 3AmyJomajoNoch keine Bewertungen
- Resolución 715 de Junio 8 de 2018Dokument2 SeitenResolución 715 de Junio 8 de 2018luis carlos arguello ardilaNoch keine Bewertungen
- Actividad de Precios UnitariosDokument45 SeitenActividad de Precios UnitariosBrando DomínguezNoch keine Bewertungen
- Catalogo de CasingDokument18 SeitenCatalogo de CasingBenjamin AndradeNoch keine Bewertungen
- Propiedades Periódicas de Los Elementos QuímicosDokument2 SeitenPropiedades Periódicas de Los Elementos QuímicosSalomé jaramillo grajalesNoch keine Bewertungen
- Giorgio, Alberti Reciprocidad e Intercambio de Los Andes PeruanosDokument61 SeitenGiorgio, Alberti Reciprocidad e Intercambio de Los Andes Peruanosanon_113256031Noch keine Bewertungen
- Menendez - El Arte en La PrehistoriaDokument8 SeitenMenendez - El Arte en La PrehistoriaMagali FranciaNoch keine Bewertungen
- Cancionero 2.9Dokument34 SeitenCancionero 2.9Daniela Michelle CastellanosNoch keine Bewertungen
- Informe Final TermodinamicaDokument14 SeitenInforme Final TermodinamicaCristian Alejandro Cuervo RubioNoch keine Bewertungen
- Reporte Péndulo FurutaDokument9 SeitenReporte Péndulo FurutaEve MegNoch keine Bewertungen
- Monografia de Eva Disglosias Disartrias y DislaliasDokument30 SeitenMonografia de Eva Disglosias Disartrias y DislaliasRony GrandaNoch keine Bewertungen
- TRANSITODokument6 SeitenTRANSITOcleot turcoNoch keine Bewertungen
- E Specific Ac I OnesDokument49 SeitenE Specific Ac I OnesRachid Bekaddour BenatiaNoch keine Bewertungen
- AsmaDokument42 SeitenAsmaAldo ReyesNoch keine Bewertungen
- Jilguero FichaDokument9 SeitenJilguero Fichapennatus61Noch keine Bewertungen
- Instrumentos y Familias Instrumentales - WikipediaDokument6 SeitenInstrumentos y Familias Instrumentales - WikipediaVeronicaNoch keine Bewertungen
- Norma Inv e 310 07Dokument6 SeitenNorma Inv e 310 07Jenniffer Andrea Bolanos MunozNoch keine Bewertungen
- Terapia PeriodontalDokument25 SeitenTerapia PeriodontalRobert AucancelaNoch keine Bewertungen
- Iqi-041e-Paucarchuco Castillo Ricardo Wilder PDFDokument7 SeitenIqi-041e-Paucarchuco Castillo Ricardo Wilder PDFErick Gómez RomeroNoch keine Bewertungen
- Práctica 3 Guía 2022Dokument7 SeitenPráctica 3 Guía 2022Daniel PazmiñoNoch keine Bewertungen