Beruflich Dokumente
Kultur Dokumente
Practica 2
Hochgeladen von
Eve LinkOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Practica 2
Hochgeladen von
Eve LinkCopyright:
Verfügbare Formate
GASES
PRACTICA N 2
GASES
2.1 OBJETIVO GENERAL Verificar las Leyes de los Gases Ideales 2.2 OBJETIVOS DE LA PRCTICA Realizar mediciones de presin utilizando manmetros en U. Estudiar el comportamiento de un gas y comprobar en forma practica el cumplimiento de las leyes empricas desarrolladas por Boyle, Charles y Gay Lussac Generar un gas en condiciones controladas y recogerlo sobre agua, utilizando para ello en eudimetro. Realizar medidas de magnitudes comunes en forma correcta y confiable. Calcular experimentalmente el valor de la constante R y comparar el valor hallado con el valor bibliogrfico. Realizar el tratamiento de datos con nfasis en promedios aritmticos y errores absoluto y relativo
2.3 MARCO TERICO 2.3.1 Gas Sustancia en uno de los tres estados diferentes de la materia ordinaria, que son el slido, el lquido y el gaseoso. Los slidos tienen una forma bien definida y son difciles de comprimir. Los lquidos fluyen libremente y estn limitados por superficies que forman por s solos. Los gases se expanden libremente hasta llenar el recipiente que los contiene, y su densidad es mucho menor que la de los lquidos y slidos. La teora atmica de la materia define los estados, o fases, de acuerdo al orden que implican. Las molculas tienen una cierta libertad de movimientos en el espacio. Estos grados de libertad microscpicos estn asociados con el concepto de orden macroscpico. Las molculas de un slido estn colocadas en una red, y su libertad est restringida a pequeas vibraciones en torno a los puntos de esa red. En cambio, un gas no tiene un orden espacial macroscpico. Sus molculas se mueven aleatoriamente, y slo estn limitadas por las paredes del recipiente que lo contiene. Se han desarrollado leyes empricas que relacionan las variables macroscpicas. En los gases ideales, estas variables incluyen la presin (p), el volumen (V) y la temperatura (T). La ley de Boyle-Mariotte afirma que el volumen de un gas a temperatura constante es inversamente proporcional a la presin. La ley de Charles y Gay-Lussac afirma que el volumen de un gas a presin constante es directamente proporcional a la temperatura absoluta. La combinacin de estas dos leyes proporciona la ley de los gases ideales pV = nRT (n es el nmero de moles), tambin llamada ecuacin de estado del gas ideal. La constante de la derecha, R, es una constante universal cuyo descubrimiento fue una piedra angular de la ciencia moderna. 2.3.2 Ley de Boyle-Mariotte En fsica, ley que afirma que el volumen de un gas a temperatura constante es inversamente proporcional a su presin.
P =
k(n,T ) V
La ley de Boyle tambin se puede enunciar de la siguiente manera: En un sistema aislado para cualquier masa de gas en un proceso isotrmico (temperatura constante), el producto de la presin por el volumen es constante. 2.3.3 Ley de Charles Ley que afirma que el volumen de un gas ideal a presin constante es proporcional a su temperatura absoluta.
V = k( n,P ) T
2.3.4 Ley de Gay-Lussac Se puede expresar de la siguiente manera:
V = T k( n,P )
En todo proceso isocrico (volumen constante), manteniendo el nmero de moles constante, la presin de cualquier gas es directamente proporcional a su temperatura constante. 61
GASES
P = k( n,V ) T
2.3.5 Condiciones normales
P = T k(n,V )
Se conoce como condiciones normales de la materia gaseosa, a ciertos valores arbitrarios (acordados universalmente), de presin y temperatura, los que son: T = 273 K t = 0 C
P = 1 atm = 760 mmHg En estas condiciones el volumen ocupado por un mol de cualquier gas es de 22.4 litros (valor igual a V0 en la ley de Charles). Al volumen ocupado por un mol de sustancia se denomina volumen molar. 2.3.6 Vapor Sustancia en estado gaseoso. Los trminos de vapor y gas son intercambiables, aunque en la prctica se emplea la palabra vapor para referirse al de una sustancia que normalmente se encuentra en estado lquido o slido, como por ejemplo agua, benceno o yodo. Se ha propuesto restringir el uso del trmino a las sustancias gaseosas que se encuentren por debajo de su punto crtico (la mxima temperatura a la que se puede licuar aplicando una presin suficiente) y hablar de gas por encima de la temperatura crtica, cuando es imposible que la sustancia exista en estado lquido o slido. Esencialmente, el uso de los trminos es arbitrario, porque todas las sustancias gaseosas tienen un comportamiento similar por debajo y por encima del punto crtico. Cuando se confina el vapor emitido por una sustancia a cualquier temperatura, ejerce una presin conocida como presin de vapor. Al aumentar la temperatura de la sustancia, la presin de vapor se eleva, como resultado de una mayor evaporacin. Cuando se calienta un lquido hasta la temperatura en la que la presin de vapor se hace igual a la presin total que existe sobre el lquido, se produce la ebullicin. En el punto de ebullicin, al que corresponde una nica presin para cada temperatura, el vapor en equilibrio con el lquido se conoce como vapor saturado; es el caso, por ejemplo, del vapor de agua a 100 C y a una presin de 1 atmsfera. El vapor a una temperatura superior al punto de ebullicin se denomina vapor sobrecalentado, y se condensa parcialmente si se disminuye la temperatura a presin constante. A temperaturas y presiones normales, la presin de vapor de los slidos es pequea y suele ser despreciable. Sin embargo, la presencia de vapor de agua sobre el hielo demuestra su existencia. Incluso en los metales, la presin de vapor puede ser importante a temperatura elevada y presin reducida. Por ejemplo, la rotura del filamento de wolframio de una bombilla (foco) incandescente se debe fundamentalmente a la evaporacin, que implica un aumento de la presin de vapor. Cuando se calienta una solucin de dos sustancias voltiles, como agua y alcohol, el vapor resultante contiene ambas sustancias, aunque generalmente en proporciones distintas de las de la solucin original. Normalmente se evapora primero un porcentaje mayor de la sustancia ms voltil; este es el principio de la destilacin. 2.3.7 Gas Hmedo Se entiende por gas hmedo a la mezcla homognea de gas seco y el vapor de un lquido. Los gases hmedos tienen las siguientes caractersticas: Se recogen generalmente sobre un lquido no voltil. Tiene una aplicacin de la ley de Dalton de las presiones parciales. Se obtiene este gas burbujeando a travs de un lquido. Las molculas arrastradas en forma de vapor son recolectadas como molculas de gas y de lquido vaporizado.
2.3.8 Humedad absoluta Humedad absoluta es la relacin entre la masa de vapor y la masa del gas seco, contenidos en una masa de gas hmedo.
y =
2.3.9 Humedad relativa
m(vapor ) m(gas sec o)
La humedad relativa es la relacin entre la presin de vapor que contiene una masa de aire y la que contendra si estuviese saturado a la misma temperatura. Pv j = 100 Pv *
62
GASES 2.4 MATERIAL Y REACTIVOS 4 Manmetros en U de vidrio. 1 Blader de pelota 1 Termmetro de mercurio 1 Aparato para leyes de Charles y Gay-Lussac 1 Eudimetro de 50 cm3 1 Regla 1 Soporte universal 1 Pinza porta bureta 1 Hornilla Magnesio en cinta 2.5 PROCEDIMIENTO 1 Inflador porttil 1 Vernier 1 Aparato CENCO para gases 1 Tubo generador de gases 1 Jarro metlico 1 Vaso de precipitados de 1000 cm3 1 Tapn de goma con una perforacin 1 Tubo de vidrio en forma de U cido clorhdrico Zinc p.a
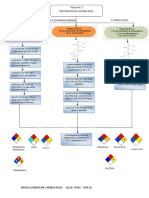
MEDIDAS DE LA PRESIN
Coloque papel milimetrado en el equipo
Medir diametro interno del tubo
Inflar el blader hasta unos 20cm
Conectar el blader en los manmetros
Medir la presin manomtrica Calcular la presin absoluta
LEY DE BOYLE
Registre los volumenes A partir del diametro interno del tubo y la altura del gas
Registre las presiones
Mantenga constante la temperatura que es la de laboratorio
La presin es la diferencia entre las alturas
Manmetros en U
Aparato CENCO para gases
63
GASES
LEY DE CHARLES
Registre la variacin de temperatura Llenar la camisa calefactora con agua caliente
Registre la variacin de volumen
Mantenga la presin constante Coloque las columnas del manmetro a la misma altura
Registrar los datos de volumen y temperatura a medida que enfra el agua
LEY DE GAY - LUSSAC
Registre la variacin de la temperatura Llenar la camisa calefactora con agua caliente
Registre la variacin de la presin Es la diferencia entre las dos columnas mercuriales
Mantenga el volumen constante
Aparato para Leyes de Charles y Gay Lussac
64
GASES
DETERMINACIN DE LA CONSTANTE "R"
Se debe generar gas hidrgeno y recogerlo sobre agua
Determinar el volumen del gas
Determinar la temperatura
Determinar la presin
Calcular el nmero de moles A partir: Mg+2HCl=MgCl2+H2
Sistema para determinar la constante R 2.6 INFORME a) DETERMINACIN DE LAS PRESIONES MANOMTRICAS PRESIN MANOMTRICA (mmHg) Lquido manomtrico Agua Lquido manomtrico Aceite 1 2 3 4 5 6 7 8 9
Lquido manomtrico mercurio
b)
LEY DE BOYLE .. Presin atmosfrica (mm Hg)
Temperatura (C)
Dimetro interno del tubo (mm) REGISTRO DE DATOS 1 2 3 4 5 6 7 8 9
Presin manomtrica Altura del gas h (mm)
D h (mm Hg)
65
GASES
c)
LEY DE CHARLES
Presin del gas (mm Hg) REGISTRO DE DATOS 1 2 3 4 5 6 7 8 9
Temperatura (C) Volumen del gas (cm3)
d)
LEY DE GAY LUSSAC
Volumen del gas (cm3) Presin atmosfrica (mm Hg)
REGISTRO DE DATOS Temperatura (C) Presin manomtrica del gas (mm Hg)
e) DETERMINACIN DE LA CONSTANTE R REGISTRO DE DATOS Masa del Magnesio (g) Volumen del Hidrgeno (cm3) temperatura (C) Presin manomtrica (mm H2O) Presin de vapor del agua (mm Hg) (de tablas) 1 2 3
mMg = g VH2 = cm3 = l T = C = K P = mmHg h1 = mmH2O Pv* = mmHg
R=
2.7 TRATAMIENTO DE DATOS EXPERIMENTALES a) MEDIDAS DE LA PRESIN
PV Tn
1. Calcule la presin absoluta del gas en mm Hg. cm de Agua y cm de aceite. 2.- Determine la densidad del aceite considerando que el agua tiene una densidad de 1 g/cm3. 3.- Exprese el resultado de la presin como un intervalo de confianza con el 95% b) LEY DE BOYLE Calcule la presin absoluta de cada medida y el volumen del gas 66
GASES c) d) e) Realice un grfico Presin vs Volumen Realice un grfico P vs 1/V y calcule la pendiente que equivale a la constante de Boyle Calcule la constante de Boyle de los datos de P y de V y compare con el valor calculado grficamente. LEY DE CHARLES Realice un grfico de Volumen vs Temperatura y calcule la pendiente que equivale a la constante de Charles Calcule la constante de Charles de los datos de V y de T y compare con el valor calculado grficamente. LEY DE GAY LUSSAC Realice un grfico de Presin vs Temperatura y calcule la pendiente que equivale a la constante de Gay Lussac Calcule la constante de Gay Lussac de los datos de P y de T y compare con el valor calculado grficamente. DETERMINACIN DE R Calcule la presin del hidrogeno seco Para cada experiencia, calcule el valor de R experimental Exprese el resultado como un intervalo de confianza con el 95% Compare con el valor bibliogrfico y calcule error absoluto y relativo
2.8 CONCLUSIONES 1. Se cumplieron los objetivos de la prctica? Responda cada uno de los objetivos especficos. 2. Mencione que se puede concluir sobre la relacin entre las presiones manomtricas de los diferentes lquidos. 3.- Compare la constante determinada en laboratorio con la constante universal de los gases ideales. Por qu no son iguales? 4. Qu sugiere para obtener resultados ms confiables y precisos? 2.9 CUESTIONARIO 2.1.- Dibuja dos isbaras en un diagrama V vs. T y dos isbaras en un diagrama P vs V. Indica cual de las dos tiene mayor volumen. 2.2.- Cul es la presin manomtrica si la presin absoluta es de 500 mm Hg. en Santa Cruz? 2.3.- Si la presin manomtrica de un recipiente en La Paz es 550 mm Hg. Cul ser la presin manomtrica en Santa Cruz? 2.4.- Expresa la constante R en todas las unidades que conozcas 2.5.- Si un gas se calienta al doble de su temperatura inicial y su volumen se duplica. Cul ser la P final? 2.6.- Dibuja dos iscoras en un diagrama P vs T y dos iscoras en un diagrama P vs V. Indica cual de las dos tiene mayor volumen. 2.7.- Si la presin manomtrica de un recipiente en Sta Cruz es 850 mm Hg. Cul ser la presin manomtrica en La Paz? 2.8.- Un gas hmedo tiene una presin de 560 mm Hg Si la Pv a la temperatura del gas es de 20 mm Hg. Cul es la presin del gas seco? 2.9.- Dibuja dos isotermas en un grafico P vs V. Indica cual tiene temperatura menor. 2.10.- Si un gas se calienta al doble de su temperatura inicial y su volumen se triplica. Cul ser la P final? 2.11.- Qu masa de hidrgeno se producir a partir de 0.02 g de Mg cuando reacciona con HCl? 2.12.- Cul es la presin absoluta en La Paz si la presin absoluta es de 1500 mm Hg en Santa Cruz? 2.13.- Un recipiente de 3 litros con una presin de 870 mm Hg se une a otro recipiente de 2 litros con una presin de 1400 mm Hg. Cul es la presin del sistema unido? 2.14.- Un sistema gaseoso se comprime a la mitad del volumen inicial y se enfra a un tercio de su temperatura original. Cul es la presin final? 2.15.- Enuncie la ley de Boyle literal y matemticamente 2.16.- Enuncie la ley de Charles literal y matemticamente 67
GASES 2.17.- Enuncie la ley de Gay Lussac literal y matemticamente 2.18.- Cules son las caractersticas de un gas ideal? 2.19.- De acuerdo a la ecuacin de estado: R=PV/ nT. Se necesita cuatro variables para obtener R, explique claramente como se obtiene cada una de estas variables, desde lo experimental hasta los clculos. 2.20.- Deducir la ley combinada de los gases. 2.21.Deducir la ecuacin de estado
2.22.- Una muestra de aire est saturada en un 50% con vapor de agua a 30 C y se halla a una presin de 700 mmHg. Cul ser la presin parcial del vapor de agua si la presin del gas se reduce a 100 mmHg? La presin de vapor del agua a 30 C es 31.8 mmHg. 2.23.- Una muestra de 500 litros de aire seco a 25 C y 750 mmHg de presin se hace burbujear lentamente a travs de agua a 25 C y se recoge en un gasmetro cerrado con agua. La presin del gas recogido es de 750 mmHg. Cul es el volumen del gas hmedo? La presin de vapor del agua a 25 C es 23.8 mmHg. 2.24.- En un edificio con acondicionamiento de aire se absorben desde el exterior 1000 litros de aire, a la temperatura de 11 C, presin de 780 mmHg y humedad relativa de un 20%. Dicho aire pasa a travs de los aparatos adecuados, donde la temperatura aumenta a 20 C y la humedad relativa a un 40%. Cul ser el volumen ocupado por dicha masa de aire, si la presin en el edificio es de 765 mmHg? Las presiones de vapor del agua a 11 C y 20 C son respectivamente, 9.8 mmHg y 17.5 mmHg. 2.25.- 1 litro de aire satura de vapor de benceno a 20 C y a la presin total de 750 mmHg se expande a dicha temperatura, en contacto con benceno lquido, hasta un volumen de 3 litros. La presin de vapor de benceno a 20 C es 74.7 mmHg. Hallar la presin final del aire satura de vapor de benceno. 2.26.- Aire saturado en un 60% de alcohol etlico, a 40 C y 760 mmHg, se comprime dentro de un tanque de 100 litros de capacidad a 10.0 atm y 30 C. Calcular el volumen del aire en las condiciones iniciales. Las presiones de vapor del alcohol etlico a 30 C y 40 C son, respectivamente, 78.8 y 135.3 mmHg. Suponer nulo el volumen del alcohol etlico condensado. 2.10 BIBLIOGRAFA Alvarez, Alfredo Valenzuela Julio Yujra Federico. Prcticas de Qumica General. Docentes Facultad de Ingeniera. Qumica Curso Prefacultativo. 2004 Gray, Harry Haight, Gilbert. Principios Bsicos de Qumica. Editorial Revert. 1969. Montecinos Edgar Montecinos Jos. Qumica General. Prcticas de Laboratorio. La Paz (1989) Leonardo G. Coronel Rodrguez. Como resolver Problemas en Qumica General. Ed. 2010 http://es.wikipedia.org/wiki/Ley_de_los_gases_ideales http://perso.wanadoo.es/cpalacio/GasesIdeales2.htm http://soko.com.ar/Fisica/Gases_ideales.htm http://www.educaplus.org/play-186-Ley-de-los-gases-ideales.html http://www.worldlingo.com/ma/enwiki/es/Ideal_gas http://personal5.iddeo.es/vegalonso/gases.htm
68
Das könnte Ihnen auch gefallen
- Practica n°1COMPORTAMIENTO P-V-T DEL AIRE ATMOSFERICODokument14 SeitenPractica n°1COMPORTAMIENTO P-V-T DEL AIRE ATMOSFERICOKatia Yesica Tineo Canales0% (1)
- Leyes de Los GasesDokument18 SeitenLeyes de Los GasesDayanebertel100% (1)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesVon EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNoch keine Bewertungen
- Pets SoldaduraDokument2 SeitenPets SoldaduraJulioMedina100% (4)
- Practica 2 Gases PDFDokument8 SeitenPractica 2 Gases PDFLuis UlakiaNoch keine Bewertungen
- Practica Nro4Dokument10 SeitenPractica Nro4Franklin Gutiérrez MorenoNoch keine Bewertungen
- Univeridad Mayor de San AndrésDokument14 SeitenUniveridad Mayor de San Andrésyhamil fernando marca rojasNoch keine Bewertungen
- Gases AbdielDokument14 SeitenGases Abdielabdiel ludeño chambiNoch keine Bewertungen
- 4 Estado GaseosoDokument21 Seiten4 Estado GaseosoHerlandNoch keine Bewertungen
- Estado Gaseoso - Lab 4Dokument22 SeitenEstado Gaseoso - Lab 4Juan Marcelo Tenorio Barboza75% (8)
- 4 Estado GaseosoDokument22 Seiten4 Estado GaseosoRonald Cristhian Mamani CopaNoch keine Bewertungen
- 4 ESTADO GASEOSO JosiDokument26 Seiten4 ESTADO GASEOSO JosiMartyn Enoc Rioja OrtegaNoch keine Bewertungen
- 4 Estado Gaseoso InformeDokument14 Seiten4 Estado Gaseoso InformeLuzNoch keine Bewertungen
- 4 ESTADO GASEOSO JosiDokument25 Seiten4 ESTADO GASEOSO JosiAbigail Ancasi LauraNoch keine Bewertungen
- Guia Practica 4 Gases 2021Dokument11 SeitenGuia Practica 4 Gases 2021JuanNoch keine Bewertungen
- Practica No 4 Gases 2-2021Dokument9 SeitenPractica No 4 Gases 2-2021ALEXANDER JAVIER BALDIVIESO NINANoch keine Bewertungen
- Practica de Laboratorio 4 GasesDokument10 SeitenPractica de Laboratorio 4 Gasesisra.nyo2015Noch keine Bewertungen
- Guia Practica 4 GasesDokument12 SeitenGuia Practica 4 GasesArgandoña Aysa Gabriel AyrthonNoch keine Bewertungen
- Luna Calle Limber - Informe 4Dokument12 SeitenLuna Calle Limber - Informe 4Limber Luna CalleNoch keine Bewertungen
- Estado Gaseoso InformeDokument11 SeitenEstado Gaseoso InformeWilder MamaniNoch keine Bewertungen
- Gases Ideales EnsayoDokument10 SeitenGases Ideales EnsayoLeonardo Rodriguez ChavezNoch keine Bewertungen
- Informe Estado Gaseoso P4Dokument26 SeitenInforme Estado Gaseoso P4SolAngel Eulate RamosNoch keine Bewertungen
- Práctica 9Dokument7 SeitenPráctica 9CindyCarballarNoch keine Bewertungen
- Guia Practica 4Dokument10 SeitenGuia Practica 4Alexander Baldivieso NinaNoch keine Bewertungen
- Informe Gases Lab QMC 100 - CompressDokument11 SeitenInforme Gases Lab QMC 100 - CompressMauchNoch keine Bewertungen
- Estado GaseosoDokument9 SeitenEstado Gaseosoisra.nyo2015Noch keine Bewertungen
- Practica 1 de Quimica Aplicada EsimeDokument10 SeitenPractica 1 de Quimica Aplicada EsimeDaniel VelázquezNoch keine Bewertungen
- Informe Estado GaseosoDokument17 SeitenInforme Estado Gaseosoisra.nyo2015Noch keine Bewertungen
- Iinforme Gases LaboratorioDokument10 SeitenIinforme Gases LaboratorioAylin SalgadoNoch keine Bewertungen
- Estado GaseosoDokument28 SeitenEstado GaseosoGrover Quispe CallisayaNoch keine Bewertungen
- Práctico Ley de CharlesDokument6 SeitenPráctico Ley de Charlesanalaura.englishNoch keine Bewertungen
- Taller 3 Segunda ParteDokument7 SeitenTaller 3 Segunda ParteHydra OrionNoch keine Bewertungen
- El Estado Gaseoso y Fuerzas IntermolecularesDokument67 SeitenEl Estado Gaseoso y Fuerzas IntermolecularesLuis Agudelo0% (1)
- David Gutierrez Condori. GasesDokument12 SeitenDavid Gutierrez Condori. GasesDavid GutierrezNoch keine Bewertungen
- Estado-Gaseoso 4Dokument28 SeitenEstado-Gaseoso 4Helen AndreaNoch keine Bewertungen
- Guia de Estudio FB Primera Parte.Dokument64 SeitenGuia de Estudio FB Primera Parte.Sofia SirrNoch keine Bewertungen
- Estado GaseosoDokument11 SeitenEstado GaseosoAna Nayde ChristopherNoch keine Bewertungen
- Leyes de Los GasesDokument11 SeitenLeyes de Los Gasesapi-371953983% (18)
- Info 4Dokument14 SeitenInfo 4LimberNoch keine Bewertungen
- LAB 11 ZavaletaDokument8 SeitenLAB 11 ZavaletaRoberto Carlos Zavaleta CrispinNoch keine Bewertungen
- Guia de Gases TerminadaDokument31 SeitenGuia de Gases Terminadakendyyanethbs100% (7)
- Gases RealesDokument17 SeitenGases RealesE.G.C.Noch keine Bewertungen
- Estado GaseosoDokument24 SeitenEstado GaseosoFernando Lopez AveiraNoch keine Bewertungen
- Material Unidad 3Dokument14 SeitenMaterial Unidad 3cesar augusto garcia guerreroNoch keine Bewertungen
- Daniel Reyes - P4-GUÍA 1-FÍSICA-1er. AÑODokument8 SeitenDaniel Reyes - P4-GUÍA 1-FÍSICA-1er. AÑODaniel ReyesNoch keine Bewertungen
- Estado GaseosoDokument24 SeitenEstado GaseosoRodrigo Miranda LlanosNoch keine Bewertungen
- Quimica - Aplicada - Unidad - 1 - Estado GaseosoDokument13 SeitenQuimica - Aplicada - Unidad - 1 - Estado GaseosocynthiaNoch keine Bewertungen
- Universidad Cientifica Del Surdocx - CompressDokument13 SeitenUniversidad Cientifica Del Surdocx - CompressPaula ManriqueNoch keine Bewertungen
- Informe de LaboratorioDokument20 SeitenInforme de LaboratorioLucaRio1035Noch keine Bewertungen
- Articulo Manipulacion de GasesDokument12 SeitenArticulo Manipulacion de GasesPaula AndradeNoch keine Bewertungen
- Practica 1-Quimica 2Dokument15 SeitenPractica 1-Quimica 2Sebastian Gallardo LopezNoch keine Bewertungen
- Unidad 1 EstudiantesDokument117 SeitenUnidad 1 EstudiantesFernanda Raymundo Gamboa0% (1)
- Investigacion Quimica Unidad 5Dokument12 SeitenInvestigacion Quimica Unidad 5Jesus EnriquezNoch keine Bewertungen
- Taller de GasesDokument6 SeitenTaller de GasesChavezz MǎlìānNoch keine Bewertungen
- GasDokument6 SeitenGasPame LxuNoch keine Bewertungen
- Reporte de Primer LaboratorioDokument20 SeitenReporte de Primer LaboratorioDanthe VergaraNoch keine Bewertungen
- Informe 9 Laboratorio Quimica General TDokument8 SeitenInforme 9 Laboratorio Quimica General Tkhadir acuna cayojaNoch keine Bewertungen
- Practica 1Dokument14 SeitenPractica 1alanntorres09ctrlNoch keine Bewertungen
- LEY GasesDokument6 SeitenLEY GasesLeydii Yazz ArévaLoNoch keine Bewertungen
- Psicometría. Principios básicos y protocolos experimentales diversosVon EverandPsicometría. Principios básicos y protocolos experimentales diversosNoch keine Bewertungen
- Guia 3Dokument3 SeitenGuia 3Eve LinkNoch keine Bewertungen
- INFORME VT - Reformado de Queroseno para Aplicaciones AeroespacialesDokument64 SeitenINFORME VT - Reformado de Queroseno para Aplicaciones AeroespacialesFidel BarraganNoch keine Bewertungen
- El Pozo IlustradoDokument671 SeitenEl Pozo IlustradoSamuel U100% (2)
- INFORME VT - Reformado de Queroseno para Aplicaciones AeroespacialesDokument64 SeitenINFORME VT - Reformado de Queroseno para Aplicaciones AeroespacialesFidel BarraganNoch keine Bewertungen
- El Pozo IlustradoDokument671 SeitenEl Pozo IlustradoSamuel U100% (2)
- Guia 3Dokument3 SeitenGuia 3Eve LinkNoch keine Bewertungen
- Sismica para GeologosDokument32 SeitenSismica para GeologosrumpelstiltskinrumpeNoch keine Bewertungen
- Sismica para GeologosDokument32 SeitenSismica para GeologosrumpelstiltskinrumpeNoch keine Bewertungen
- El Pozo IlustradoDokument671 SeitenEl Pozo IlustradoSamuel U100% (2)
- Taller 5Dokument1 SeiteTaller 5Eve LinkNoch keine Bewertungen
- LodosDokument11 SeitenLodosChristian HunterNoch keine Bewertungen
- Guia 3Dokument3 SeitenGuia 3Eve LinkNoch keine Bewertungen
- Introducción A La Antropología Social y CulturalDokument130 SeitenIntroducción A La Antropología Social y CulturalJLuis Carrasco Ramos100% (1)
- El Pozo IlustradoDokument671 SeitenEl Pozo IlustradoSamuel U100% (2)
- Accesit2 ExperimentosDokument8 SeitenAccesit2 ExperimentosAlejandro AriasNoch keine Bewertungen
- 661873009.trabajo Practico #3Dokument13 Seiten661873009.trabajo Practico #3Edwar LopezNoch keine Bewertungen
- Manual FIII CompletoDokument25 SeitenManual FIII CompletoEve LinkNoch keine Bewertungen
- Generador de Van de GraaffDokument5 SeitenGenerador de Van de GraaffEve LinkNoch keine Bewertungen
- Tipos de Señales Sismica y Ruido SismicoDokument31 SeitenTipos de Señales Sismica y Ruido SismicoKeyla Karina Viloria ValecillosNoch keine Bewertungen
- Guia 3Dokument3 SeitenGuia 3Eve LinkNoch keine Bewertungen
- Aldo y CetoDokument14 SeitenAldo y CetoFernando Mejia TorresNoch keine Bewertungen
- Accesit2 ExperimentosDokument8 SeitenAccesit2 ExperimentosAlejandro AriasNoch keine Bewertungen
- Accesit2 ExperimentosDokument8 SeitenAccesit2 ExperimentosAlejandro AriasNoch keine Bewertungen
- Tipos de Señales Sismica y Ruido SismicoDokument31 SeitenTipos de Señales Sismica y Ruido SismicoKeyla Karina Viloria ValecillosNoch keine Bewertungen
- Laboratorio de GasesDokument3 SeitenLaboratorio de GasesCarlo Hurtado100% (1)
- Momentos y Centro GravedadDokument19 SeitenMomentos y Centro GravedadEve LinkNoch keine Bewertungen
- Tipos de Señales Sismica y Ruido SismicoDokument31 SeitenTipos de Señales Sismica y Ruido SismicoKeyla Karina Viloria ValecillosNoch keine Bewertungen
- Tipos de Señales Sismica y Ruido SismicoDokument31 SeitenTipos de Señales Sismica y Ruido SismicoKeyla Karina Viloria ValecillosNoch keine Bewertungen
- Momentos y Centro GravedadDokument19 SeitenMomentos y Centro GravedadEve LinkNoch keine Bewertungen
- SIMTDokument18 SeitenSIMTenergetic001Noch keine Bewertungen
- Trabajo Practico de TermofluidosDokument51 SeitenTrabajo Practico de TermofluidosnelsonoctavioNoch keine Bewertungen
- Foro Calor y TemperaturaDokument2 SeitenForo Calor y TemperaturaMarco Antonio Tasayco Yataco100% (1)
- Cuestionario 10calorimetriaDokument7 SeitenCuestionario 10calorimetriamarca.12733262Noch keine Bewertungen
- 1 - 0 ForjadoDokument84 Seiten1 - 0 ForjadoEdna R. Barreto100% (1)
- Procedimiento de Granallado y Pintado CHILCA - I+C (ARD) Rev00 PDFDokument9 SeitenProcedimiento de Granallado y Pintado CHILCA - I+C (ARD) Rev00 PDFR Flores Curiñaupa100% (2)
- Experimento Sobre La ViscocidadDokument7 SeitenExperimento Sobre La ViscocidadLuis Fernando Vidal RojasNoch keine Bewertungen
- EVALUACIÓNDokument2 SeitenEVALUACIÓNdi briNoch keine Bewertungen
- Informe de ESTERILIDAD EN CONSERVASDokument10 SeitenInforme de ESTERILIDAD EN CONSERVASGERALDINE RAMIREZ TOVARNoch keine Bewertungen
- Metabolismo de Carbohidratos Trabajo Grupal 2020 MBH (Autoguardado)Dokument14 SeitenMetabolismo de Carbohidratos Trabajo Grupal 2020 MBH (Autoguardado)Delgado H FabianNoch keine Bewertungen
- Identificar Los Tipos de Contaminación en Cada FotografíaDokument7 SeitenIdentificar Los Tipos de Contaminación en Cada FotografíaRosalinda Oscco HuaccaicachaccNoch keine Bewertungen
- Aceros Estructurales ModernosDokument8 SeitenAceros Estructurales ModernosMagali Alcocer PérezNoch keine Bewertungen
- 6-Vma Huancayo PDFDokument38 Seiten6-Vma Huancayo PDFaldanramosNoch keine Bewertungen
- HOMOPOLISACARIDOS Son Monosacáridos Que Están Formados Por Un Solo Tipo de MonosacáridosDokument1 SeiteHOMOPOLISACARIDOS Son Monosacáridos Que Están Formados Por Un Solo Tipo de MonosacáridosKidry RobleroNoch keine Bewertungen
- Aldehidos y Cetonas en La IndustriaDokument3 SeitenAldehidos y Cetonas en La IndustriaCristel Mendoza TincopaNoch keine Bewertungen
- Analisis Microbiologico MedicamentosDokument15 SeitenAnalisis Microbiologico MedicamentosStuard Montoya VizueteNoch keine Bewertungen
- Informe Aditivos para ConcretoDokument10 SeitenInforme Aditivos para ConcretoDeivis D. CornelioNoch keine Bewertungen
- Elizabeth Trabajo Bachiller 2020Dokument12 SeitenElizabeth Trabajo Bachiller 2020ANTERO JOSUE CORDOVA RIOSNoch keine Bewertungen
- Semana 1Dokument16 SeitenSemana 1carlos rafael anhuaman aristaNoch keine Bewertungen
- Informe de Acondicionamiento para CamaronesDokument11 SeitenInforme de Acondicionamiento para CamaronesDiego RivadacunhaNoch keine Bewertungen
- Control de CalidadDokument34 SeitenControl de CalidadLenebón Girón0% (1)
- Curtiembre - Tema 2 - El RemojoDokument8 SeitenCurtiembre - Tema 2 - El RemojoRigel Edward Vega LlanaNoch keine Bewertungen
- Preparación Del Sistema IndolDokument1 SeitePreparación Del Sistema Indolangie creyesNoch keine Bewertungen
- BATERIA EspecificacionesDokument12 SeitenBATERIA EspecificacionesToshiro AylasNoch keine Bewertungen
- PPT. Ciencia de Los MaterialesDokument57 SeitenPPT. Ciencia de Los MaterialesAdriel MezaNoch keine Bewertungen
- A.-Páginas Preliminares: Universidad Técnica de AmbatoDokument117 SeitenA.-Páginas Preliminares: Universidad Técnica de AmbatoAle PereiraNoch keine Bewertungen
- Obtención de Aceite Esencial BoliviaDokument16 SeitenObtención de Aceite Esencial BoliviaRonald Tito Cusiquispe MolleNoch keine Bewertungen
- CERVEZADokument8 SeitenCERVEZAmiguel angel cruzNoch keine Bewertungen
- 4° Básico - Cuaderno de Trabajo - Ciencias NaturalesDokument54 Seiten4° Básico - Cuaderno de Trabajo - Ciencias NaturalesNawel Molfin100% (1)
- Barras ParalelasDokument5 SeitenBarras ParalelasJHON CHUQNoch keine Bewertungen