Beruflich Dokumente
Kultur Dokumente
Curvas de Enfriamiento
Hochgeladen von
marzinusCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Curvas de Enfriamiento
Hochgeladen von
marzinusCopyright:
Verfügbare Formate
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
Trabajo Prctico N 4
- Curvas de Enfriamiento y Equilibrio Slido-Lquido: Sistema Naftaleno-BencenoObjetivo: Estudiar el equilibrio de fusin de un sistema de dos lquidos totalmente miscibles con eutctico simple: Sistema benceno-naftaleno. Construir el diagrama de fases Temperatura-Composicin de este sistema a partir del anlisis de las curvas de enfriamiento. Determinar la constante crioscpica del benceno. 1. Introduccin
Como se ha dicho en el TP N3 Sistema Fenol-Agua, la regla de las fases de Gibbs establece que: (1) Para un sistema de dos componentes, el nmero mximo de grados de libertad es 3. Este resultado nos indica que sera necesario construir una grfica de tres dimensiones para hacer una representacin completa de las condiciones de equilibrio (T,P,xi), donde xi es la composicin de uno de los componentes. En este trabajo prctico se estudiar un sistema de fases condensadas. Para este tipo de sistemas, el efecto de la presin es mnimo y a menos que se est interesado en fenmenos de presiones altas, se puede mantener la presin fija a 1atm y examinar los efectos de temperatura y composicin. Adems, en procesos de fusin la presin es constante. Con esta condicin impuesta, los grados de libertad disminuyen en una variable y la regla de las fases se reduce a:
V =CF +2
V = C F +1
(2)
Fig. 1. Diagrama de fases Lquido-Slido.
La Figura 1 muestra el diagrama de fases temperatura-composicin a presin constante tpico de un sistema de dos lquidos totalmente miscibles que forman eutctico simple. Para poder construir un diagrama de este tipo se utilizan las curvas de enfriamiento de sistemas de diferente composicin.
Fig.2
Fig. 3
Consideremos lo que sucede al enfriar un lquido puro (Fig. 2). Para un sistema de un componente puro en la fase lquida, hay un grado de libertad, la temperatura, y usando la ecuacin (2), los grados de libertad son V = 1, siendo la temperatura la variable que describe el sistema (porcin (a)). Tan pronto coexisten las dos fases (slido y lquido), P=2 y F=O y por lo tanto la temperatura es constante (b). Cuando todo el sistema se convierte en slido la temperatura vuelve a variar (c). El cambio en pendiente se debe a la diferencia en la capacidad calorfica del lquido y el slido. 1
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
La Fig. 3 representa la curva de enfriamiento de una mezcla simple. La solucin lquida comienza a enfriarse, disminuyendo su temperatura a cierta velocidad (d). A cierta temperatura comienza a separarse un slido formado por alguno de los componentes puros. El congelamiento es un fenmeno exotrmico y por eso la velocidad de enfriamiento disminuye (e). A medida que el slido se separa, la composicin del lquido se hace ms rica en el otro componente y su temperatura de fusin disminuye. Cuando la solucin alcanza una cierta composicin (la composicin eutctica) el sistema se congela como si se tratase de una sustancia pura y la temperatura se mantiene constante (f).
Fig. 4. Consideremos el diagrama de fases de la Fig. 4. En este diagrama TA y TB son las temperaturas de fusin de los slidos A y B puros. Las distintas curvas separan las regiones donde el sistema presenta una o ms fases. En la Regin I, cualquier punto corresponde al sistema formado por una solucin homognea. En la regin II, un punto corresponde a una situacin en la que el slido A puro coexiste en equilibrio con una solucin lquida de B disuelto en A. Una situacin anloga corresponde a la regin III, con el slido B en equilibrio con una solucin de A disuelto en B. Por debajo de la temperatura Te , en la regin IV, existen los slidos A y B y no puede observarse ninguna solucin lquida. A la temperatura Te se la llama temperatura eutctica. Las curvas a y b dan la dependencia de la composicin de la solucin lquida con la temperatura. En trminos generales, estas curvas indican cmo vara la solubilidad de A en B o B en A en funcin de la temperatura. En la regin I el nmero de grados de libertad es 2, por lo tanto, debe especificarse la temperatura y la composicin para definir el estado del sistema. En las dems regiones, el nmero de grados de libertad se reduce a 1. As, los puntos de diagrama de fases se obtienen preparando mezclas de los dos componentes de fracciones molares conocidas. Las mezclas se calientan hasta fundirse, se agita la solucin para obtener una solucin homognea y se deja enfriar lentamente. Mientras la solucin se enfra se agita continuamente y se toma la temperatura como funcin de tiempo. La regin entre a1 y a2 representa el enfriamiento de la solucin. Al llegar a la temperatura T2, se nota un cambio en la pendiente debido a que a esa temperatura empieza a separarse el slido A puro. La precipitacin del slido A libera energa. Esto hace que la mezcla se enfre ms lentamente que la solucin. T2 es el punto de fusin de la solucin de composicin x1. De T2 a Te hay una sucesin de equilibrios entre la solucin y el slido A. La temperatura no se mantiene constante en esta regin ya que el slido A se est precipitando y la concentracin de A en la solucin disminuye. Esto es, la composicin de la solucin est cambiando entre a2 y a3. A partir de Te ocurre la precipitacin simultnea de dos slidos separados en fases diferentes. Una inspeccin microscpica de ese slido revela cristales de A puros mezclados con cristales de B puro. Al llegar a Te la composicin de la solucin ha cambiado el mximo permitido para ese sistema binario. La solucin en Te tiene el punto de fusin ms bajo posible. A esta temperatura y composicin es donde la fase lquida esta en equilibrio con los slidos A y B. A la temperatura Te se le llama la temperatura eutctica y la composicin de la solucin cuyo punto de fusin es Te (el ms bajo posible) es la composicin eutctica. La palabra eutctica viene del griego que significa "fcilmente fundible". 2
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
Para las curvas de enfriamiento de mezclas, habr tres regiones y dos puntos de inflexin, (a las temperaturas T2 y Te ). La temperatura Te ser comn para todas las fracciones molares. La temperatura T2 variar segn xA vare. La nica excepcin ocurre cuando se logra que xA corresponda a la composicin eutctica. Para la composicin eutctica Te = T2 y la curva de enfriamiento de la solucin mostrar solamente un cambio notable en la pendiente. Al graficar los valores de (T2 , xA ) y de (Te , xA) para varias composiciones, se obtiene el diagrama de fases buscado.
2. Fundamento
La deduccin y anlisis y de esta ecuacin se discutir oportunamente en la clase terica. Consideremos el equilibrio slido puro- solucin. Como se ver ms adelante, la condicin de equilibrio requiere la igualdad de las energas libre molares parciales (o potenciales qumicos, ) de cada componente en cada fase. A, soluc (T , p, xA ) = A, slido (T , p) (3) Para las soluciones lquidas ideales, el potencial qumico puede escribirse como: A, soluc (T , p, x A ) = A + RT ln( x A ) (4) Donde
es el potencial qumico de de la sustancia A como lquido puro a la temperatura T. Se dice
que el lquido puro es el estado de estado de referencia que se elige para este anlisis, Por lo tanto,
A = A,liq *
A, slido (T , p ) = A,lq * + RT ln( x A )
Reordenando,
(5)
ln( x A ) =
A, slido (T , p ) A,lq* (T , p)
RT
fus GA (T , p ) RT
(6)
Donde fus G (T , p) es el cambio de energa libre de Gibbs en la fusin de un mol de A puro. Si derivamos con respecto a la temperatura,
fus H A 1 fus GA (T , p ) / T ln( x A ) = = R RT 2 T T p p
H G / T = 2 T p T
(7)
Donde se ha utilizado la ecuacin de Gibbs-Helmholtz (cuya deduccin se dar en la teora) (8)
Si integramos la ecuacin (7), entre x A = 1 (liquido puro en equilibrio con el slido puro) y un cierto valor de x A y correspondientemente entre la temperatura de fusin de A puro, T f , A , y la temperatura de
*
fusin de la mezcla de composicin x A , T f , resulta
dT RT 2 H 1 1 ln( x A ) = fus A * R T f Tf , A
1 Tf ,A
xA
d ln( x A ) = *
Tf
fus H A
(9)
(10)
Donde se ha supuesto que la entalpa de fusin no depende de la temperatura. En general, se tendr, para ambos componentes,
ln( x A ) = ln( xB ) =
Tf
fus H A RT 2 fus H B RT 2
T f* , A Tf
dT dT
(11) (12)
T f* ,B
Esta ecuacin da cuenta de cmo debe variar la solubilidad de una sustancia en un solvente dado cuando la solucin que se forma es ideal. En estos casos la solubilidad depende del calor de fusin de la misma y de la temperatura, pero no del solvente. Por este motivo, se la define como solubilidad ideal. La temperatura y composicin del eutctico pueden determinarse a partir de las ecuaciones (11) y (12). Los sistemas reales no satisfacen estas relaciones, pero si las desviaciones de la ley de Raoult no son grandes, pueden emplearse para estimar las propiedades fisicoqumicas del sistema. 3
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
El sistema Benceno- Naftaleno. Para el benceno, T f , B = 278.5 K y fus H B = 9888.5 J / mol , por lo que la integracin de la ecuacin
*
(11) conduce a
1 ln(x B ) = 1189.3 K 3.59 10 3 K 1 (13) T * Para el naftaleno, T f , N = 353.2 K y fus H N = (12476.7 + 20.13T ) J / mol . La integracin de la
ecuacin (12) conduce a
1 ln( xN ) = 1500 K 2.83 103 K 1 + 2.42 ln (T / 353.2 ) T
Descenso Crioscpico. La Constante Crioscpica.
(14)
Como se ha estudiado en el Curso de Qumica General, el descenso crioscpico se clasifica en el grupo de las propiedades coligativas. Estas propiedades dependen del nmero de partculas presentes en la * solucin. El descenso crioscpico definido como Tc = T f , A T f , se refiere a la disminucin de la temperatura de fusin de una mezcla respecto del solvente puro. En soluciones diluidas, este descenso es proporcional a la concentracin de soluto y al nmero de partculas que aporta esta sustancia en la solucin (en este sistema un solo tipo de partcula por cada componente). Aqu se deducir una expresin vlida para el caso de soluciones ideales. Consideremos nuevamente la ecuacin (10).
ln( x A ) =
fus H A 1 1 * R T f Tf , A
Esta ecuacin vincula la concentracin de un componente con la temperatura de fusin de la solucin. Si escribimos
* * 1 Tc 1 T f , A Tf T f , A Tf = = 2 2 T T* T* T * f ,A f ,A f f (Tf , A ) (Tf*, A )
(15)
Y x A = 1 xB y desarrollamos el logaritmo en serie de potencias de Maclaurin,
xB 2 xB 3 ln(1 xB ) = xB ..... (16) 2 3 Si la solucin es diluida, xB << 1 y puede considerarse slo el primer trmino del desarrollo, con lo que la
ecuacin (10) puede escribirse como
xB =
fus H A R
Tc
(Tf*, A )
2
(17)
Resulta entonces que
Tc =
R ( T f*, A ) fus H A R (T f*, A ) fus H A
xB = kc' , A xB
(18)
Donde hemos definido la constante crioscpica en trmino de fracciones molares como
2
' c, A
(19)
Esta constante, para soluciones ideales, slo depende de las propiedades del componente A y en el caso de solubilidad ideal, debe ser independiente de la naturaleza de la sustancia B. Una expresin anloga debe obtenerse si se estudia el equilibrio de B slido con una solucin de A y B. En ambos casos, la solucin que resulta (A en B o de B en A) debe ser ideal. Si la solucin es diluida, la fraccin molar de B est relacionada con la molalidad
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
xB =
nB n nB B = = M AmB n + nB nA mA / M A
R ( T f*, A ) M A fus H A R (T f*, A ) M A fus H A
2 2
(20)
Donde M A es el peso molecular del solvente en Kg/mol. Entonces,
Tc =
mB = kc, A mB
(21)
Donde se ha definido la constante crioscpica en trminos de molalidades
kc , A =
(22)
3. Desarrollo de la Experiencia
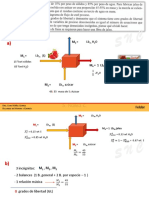
Se proceder a obtener curvas de enfriamiento (temperatura vs tiempo) para el sistema naftalenobenceno. Para ello se arma el equipo representado en la Fig. 5. Este tubo se coloca en una de mayor dimetro que proporciona una camisa de aire. En el tubo A se pesan 3 ml de benceno y se agrega naftaleno en la cantidad indicada en la Tabla I para la muestra 1. En el tubo B se pesan 3 ml de benceno y se agrega naftaleno en la cantidad indicada para la muestra 5 en la Tabla I.
TABLA I. Valores aproximados de las temperaturas de fusin medidas en un experimento.
Muestra 1 2 3 4 5 6 7 Tubo A A A A B B B gr. naftaleno agregados 0.00 0.26 0.27 0.27 2.33 1.00 3.00 gr. naftaleno totales 0.00 0.26 0.53 0.80 2.33 3.33 6.33 % benceno 100 90 82 75 51 42 27 T aprox. (C) 5 1 -2 2 33 43 60
Se conecta el termistor al multmetro y ste a una PC que registrar automticamente las lecturas de resistencia y las convertir en valores de temperatura haciendo uso de una recta de calibracin cargada previamente. Las muestras del tubo B se calientan en un bao de agua hasta que desaparece la fase slida y luego se enfran al aire hasta unos 5 C luego de la aparicin del slido. Es importante que la agitacin sea uniforme y continua durante el enfriamiento, para evitar sobreenfriamientos. Las muestras 6 y 7 se preparan por agregado sucesivo de naftaleno en el tubo B y luego de cada agregado se repite el procedimiento anterior. Las muestras 1 a 4 se enfran en un criostato, cuyo bao debe encontrarse a temperatura inferior a -5 C. Se repite el procedimiento seguido para el tubo B. A partir de los grficos de Temperatura en funcin del tiempo, se determinan las temperaturas de quiebre empleando un subprograma grfico. Estas temperaturas corresponden a la temperatura de fusin de cada mezcla. Fig. 5 5
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
Actividades Previas a la Realizacin del Trabajo Prctico Cuestionario Previo
Antes de concurrir al TP, debe resolver el siguiente cuestionario. Para ello, recurra a sus apuntes y libros del curso de Qumica General. (1) Qu es una propiedad coligativa? (2) Qu entiende por descenso crioscpico? Qu otras propiedades coligativas conoce? (3) En el Curso de Qumica General se midi el descenso crioscpico de una solucin de urea. Qu informacin se obtuvo a partir de esta medida? Podra aplicar un anlisis similar en este trabajo prctico? Que informacin se requiere para este fin? (4) A qu se llama sobreenfriamiento? Cmo puede evitarse o minimizarse? (5) Qu sucede con las propiedades coligativas cuando el soluto es un electrolito?
Grficos
Para la realizacin de las actividades en el laboratorio, deben traerse los siguientes grficos que se indican en el siguiente punto. Recuerde escribir el ttulo de cada eje y las unidades correspondientes. Si va a realiza los grficos en forma manual, utilice papel milimetrado. En caso de realizar los grficos con algn programa informtico, asegrese de imprimir tambin la grilla, de manera equivalente a un papel milimetrado.
Grfico 1. (T vs xB) Represente los datos de temperatura de fusin de la mezcla en funcin de la fraccin
molar de benceno (diagrama de fases Slido-Lquido). Para ello, utilice las ecuaciones (13) y (14) de la siguiente forma: (a) Curva del Benceno. Emplee valores de temperatura entre 5 y -6C en la ecuacin (13) (la temperatura debe estar en kelvin) y calcule la fraccin molar de benceno correspondiente. Puede emplear por ejemplo, los valores de temperatura que figuran en la tabla II. (b) Curva del naftaleno. D valores de temperatura entre 80 y -6C a la ecuacin (14) y calcule la fraccin molar correspondiente de naftaleno. Convierta este valor en fraccin molar de benceno ( xB = 1 xN ).Puede emplear por ejemplo, los valores de temperatura que figuran en la tabla II. (c) Represente los valores de temperatura en funcin de la fraccin molar de benceno para las dos curvas en un mismo grfico, tal como se muestra en la Fig. 6.
TABLA II. Valores propuestos para el clculo
de las curvas tericas del Diagrama de Fases Slido-Lquido. Curva del Benceno 1 2 3 4 5 6 7 8 5 3.5 2 0.5 -1 -2.5 -4 -6 1 2 3 4 5 6 7 8 9 10 80 70 60 50 40 30 20 10 0 -10 . 6 Fig. 6. Diagrama de fases terico T (C)
xB
Curva del Naftaleno
T (C)
xN
xB
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
Informe del Trabajo Prctico Ttulo del Trabajo Prctico: Curvas de Enfriamiento Nombre:____________________________________________________ Turno:_________________________Comisin:______________________ Fecha:_________________________ Objetivo:_______________________________________________________________ Ecuaciones y Leyes empleadas:
Medidas Experimentales
(1) Complete la siguiente tabla con los datos experimentales Masa de Benceno en el tubo A: ___________ Masa de Benceno en el tubo B: ___________ TABLA III. Datos experimentales. Muestra 1 2 3 4 5 6 7 Tubo A A A A B B B gr. naftaleno totales
xB
T f (K )
(2) Agregue sus puntos experimentales al Grfico 1 (T vs xB ).
A) Clculo de la Constante Crioscpica
Utilizar los datos de la muestra 2 para determinar la constante crioscpica experimental del benceno en trmino de fracciones molares y molaridades.
kc' , B =
Tc Tc y kc , B = xN mN
Comparar estos valores con los predichos por las ecuaciones (19) y (22).
B) Cuestiones Relacionadas al Trabajo Prctico.
(I) (II) (III) El sistema estudiado es abierto o cerrado? Defina la temperatura y composicin eutctica. Describa cmo empleara las ecuaciones (13) y (14) para determinar la temperatura y composicin eutctica. 7
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
(IV) (V)
Cmo justifica la diferencia entre las constantes crioscpicas experimentales y tericas? En los siguientes problemas emplee el valor de la constante crioscpica terica: (a) Una solucin de tolueno en benceno tiene se congela a 276.5 K. Determine su molalidad. (b)Una solucin 7.5% (peso en peso) de una sustancia A en benceno se congela a 275.24K. Determine el peso molecular del compuesto A. (c) El cido actico forma dmeros en benceno segn 2 AcH ( AcH ) 2 , con una constante de dimerizacin dada por K D =
[( AcH )2 ] . [ AcH ]2
Cuando se prepar una solucin a partir de 0.8329g de cido actico y 287.82g de benceno, se observ un descenso crioscpico de 0.1472K. El volumen de la solucin es de 328,5 ml. Calcule la constante de dimerizacin. (VI) (VII) (VIII) (IX) (X) Explique cmo se emplean las curvas de enfriamiento en la construccin de diagramas de fases. Explique tambin de que depende que se observe o no sobreenfriamiento. Aplique la regla de las fases a cada zona del diagrama de fases del grfico 1. Especifique cules son las fases presentes. Cules son los grados de libertad en el punto eutctico? Qu otro diagrama temperatura-composicin conoce? Dibuje las curvas de enfriamiento correspondientes al solvente puro y mezclas de composicin menor, igual y mayor que la composicin eutctica. A qu se denomina solubilidad ideal? El sistema estudiado corresponde a un caso de solubilidad ideal? Compare el diagrama de fases experimental con el calculado con las expresiones tericas para justificar su respuesta.
C) Grficos.
En el informe debe incluirse el grfico 1, que debe incluir los puntos experimentales.
D) Discusin.
Discuta brevemente los resultados del Trabajo Prctico.
E) Anlisis de un sistema de dos componentes que forma soluciones slidas.
El sistema que se indica en la Fig. 7 corresponde a un sistema de 2 componentes A y B donde los slidos que se separan forman soluciones slidas de B en A (solucin slida ) o de A en B ( ).As, en las distintas regiones, se tienen las siguientes situaciones de equilibrio y grados de libertad Regin I II III IV V VI Caractersticas del sistema solucin lquida solucin lquida en equilibrio con solucin slida solucin lquida en equilibrio con solucin slida soluciones slidas y parcialmente miscibles P 1 2 1 2 1 2 V 2 1 2 1 2 1
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2011
Fig. 7. Diagrama de Fases de un sistema que forma soluciones slidas. Considrese un sistema representado por el punto 1. Si este sistema se enfra, la temperatura desciende a lo largo de la lnea de puntos hasta alcanzar la curva (a) a la temperatura T1. Aqu estn dadas las condiciones para que se separe slido a de composicin x1. Si se contina con el enfriamiento, las composiciones de las soluciones lquida y slida a evolucionarn a lo largo de las curvas (a) y (a') respectivamente. As, a la temperatura T, las composiciones de las fases en equilibrio son x y x respectivamente. A medida que el enfriamiento prosigue la composicin de las fases contina evolucionando sobre estas curvas hasta que la temperatura alcanza el valor Te. Aqu, se dan las condiciones para que aparezca solucin slida de composicin xe en equilibrio con solucin slida de composicin xe y un lquido de composicin xe. Mientras coexisten las tres fases en equilibrio, el nmero de grados de libertad es cero. Al desaparecer la ltima gota de lquido de composicin xe , el sistema contina su enfriamiento ingresando en la regin donde y forman soluciones slidas conjugadas. Un anlisis similar puede realizarse considerando un sistema de composicin x2 a la temperatura T. En gran medida, cualquiera de estos diagramas puede construirse con ayuda del anlisis de las llamadas curvas de enfriamiento. Estas se obtienen estudiando cmo evoluciona la temperatura del sistema durante el enfriamiento como una funcin del tiempo. Esta tcnica es til cuando se desea construir las curvas de equilibrio donde est involucrada una solucin lquida y slidos. En regiones donde estn presentes soluciones slidas en equilibrio, debe recurrirse a estudiar las mismas siguiendo por ejemplo el comportamiento de los espectros de rayos X, ya que la medida de la temperatura est afectada por otros problemas originados en la imposibilidad de tener un sistema trmicamente uniforme. (a) Dibuje las curvas de enfriamiento que esperara observar para las mezclas representadas por los puntos (1) y (2) en el diagrama de fases anterior.
Bibliografa:
FINDLAY, A.: Trabajos experimentales de Fisicoqumica. FINDLAY, A.: The phase rule and its applications, Dover (1945). SCHOMAKER: Experimentos de Fisicoqumica.
Das könnte Ihnen auch gefallen
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSVon EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Curvas de EnfriamientoDokument9 SeitenCurvas de Enfriamientoguiye_Noch keine Bewertungen
- Diagrama de FasesDokument12 SeitenDiagrama de FasesJhon LeonNoch keine Bewertungen
- Punto EutecticoDokument9 SeitenPunto EutecticoYunuen TapiaNoch keine Bewertungen
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesVon EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNoch keine Bewertungen
- Crearemos La Curva de Enfriamiento de Una Aleación Con 60Dokument14 SeitenCrearemos La Curva de Enfriamiento de Una Aleación Con 60Albertt Aparicio MolinaNoch keine Bewertungen
- Resumen Practica 4 FQ Equilibrio Binario Naftaleno-BifeniloDokument4 SeitenResumen Practica 4 FQ Equilibrio Binario Naftaleno-BifeniloLilian SalasNoch keine Bewertungen
- Psicometría. Principios básicos y protocolos experimentales diversosVon EverandPsicometría. Principios básicos y protocolos experimentales diversosNoch keine Bewertungen
- 10 Equilibrio Solido LiquidoDokument10 Seiten10 Equilibrio Solido LiquidoEduar Moreno LondoñoNoch keine Bewertungen
- Ejercicios de Integrales y Ecuaciones Integrales-DiferencialesVon EverandEjercicios de Integrales y Ecuaciones Integrales-DiferencialesNoch keine Bewertungen
- PRACTICA 1 FicoDokument27 SeitenPRACTICA 1 FicoArtemio Pereyra VásquezNoch keine Bewertungen
- Informe-IV.-sólido Eutéctico - Grupo 1Dokument10 SeitenInforme-IV.-sólido Eutéctico - Grupo 1Jorge ForeroNoch keine Bewertungen
- Mezcla EutecticaDokument25 SeitenMezcla EutecticaTania Mireya VillarroelNoch keine Bewertungen
- Solido LiquidoDokument17 SeitenSolido LiquidoRaque PcNoch keine Bewertungen
- Laboratorio 3 de FisicoquímicaDokument14 SeitenLaboratorio 3 de FisicoquímicaUlrich MogrovejoNoch keine Bewertungen
- Equilibrio HeterogeneoDokument34 SeitenEquilibrio HeterogeneoStephany Mariela BermudezNoch keine Bewertungen
- Informe 07Dokument13 SeitenInforme 07JosephAdrianSeaNoch keine Bewertungen
- Diagrama de FasesDokument26 SeitenDiagrama de FasesElizabeth Marlene LópezNoch keine Bewertungen
- PRAC3 FasesDokument11 SeitenPRAC3 FasesPablo Lopez OrtizNoch keine Bewertungen
- Equilibrio Líquido Líquido y Sólido LíquidoDokument21 SeitenEquilibrio Líquido Líquido y Sólido LíquidoEsteban AmadorNoch keine Bewertungen
- Diagramas ComposicionalesDokument14 SeitenDiagramas ComposicionalesChäz XdNoch keine Bewertungen
- Diagrama de 3 Fases TermoDokument15 SeitenDiagrama de 3 Fases TermoNicole AracelyNoch keine Bewertungen
- Equilibrio Solido-LiquidoDokument9 SeitenEquilibrio Solido-LiquidoCristian FigueroaNoch keine Bewertungen
- Diagramas Líquido VaporDokument2 SeitenDiagramas Líquido VaporLuis FlogNoch keine Bewertungen
- FQ Metalurgica Guia Lab ExtensoDokument23 SeitenFQ Metalurgica Guia Lab ExtensoCarlo Bastidas JaimesNoch keine Bewertungen
- 1.1 Al 1.5 LeslieDokument6 Seiten1.1 Al 1.5 LeslieMARTIR GARCIANoch keine Bewertungen
- EVL Benceno-ToluenoDokument10 SeitenEVL Benceno-ToluenoMiguel Jiménez FloresNoch keine Bewertungen
- Practica 4 Laboratorio IntegralDokument11 SeitenPractica 4 Laboratorio Integraljorge redeNoch keine Bewertungen
- Laboratorio Integral II P7Dokument6 SeitenLaboratorio Integral II P7Yozlin Medel ReyesNoch keine Bewertungen
- Propiedades Termodinámicas Del Vapor de AguaDokument6 SeitenPropiedades Termodinámicas Del Vapor de AguasolangeNoch keine Bewertungen
- Resumen Capitulo 15 CastellanDokument30 SeitenResumen Capitulo 15 CastellanAlejandro Garcia GarciaNoch keine Bewertungen
- Diagramas de Fase Con TextoDokument13 SeitenDiagramas de Fase Con TextoFernanda PascacioNoch keine Bewertungen
- Equilibrios en Sistemas de Un Solo ComponenteDokument17 SeitenEquilibrios en Sistemas de Un Solo ComponenteVanessa AgipNoch keine Bewertungen
- Procesos de Separacion T2Dokument10 SeitenProcesos de Separacion T2davidNoch keine Bewertungen
- Ce 2020 PDFDokument11 SeitenCe 2020 PDFMilitza GalvezNoch keine Bewertungen
- Preinforme Punto de Burbuja 1Dokument7 SeitenPreinforme Punto de Burbuja 1Magaly PinzónNoch keine Bewertungen
- Equilibrio Liquido VaporDokument6 SeitenEquilibrio Liquido VaporAlexChacónNoch keine Bewertungen
- Practica 8Dokument9 SeitenPractica 8Rosella Katerine Joaquin DiegoNoch keine Bewertungen
- Diagramas TermodinamicosDokument7 SeitenDiagramas TermodinamicosNelson OrtaNoch keine Bewertungen
- Practica 3Dokument14 SeitenPractica 3Brisa janeth Ortiz paredesNoch keine Bewertungen
- Trabajo Equilibrio Liquido-Vapor PDFDokument26 SeitenTrabajo Equilibrio Liquido-Vapor PDFHildreth JadiraNoch keine Bewertungen
- Resumen Capitulo 15Dokument12 SeitenResumen Capitulo 15juan islasNoch keine Bewertungen
- PRACTICA 7 ELABORACIÓN DE DIAGRAMA T-X-YDokument5 SeitenPRACTICA 7 ELABORACIÓN DE DIAGRAMA T-X-YIrvingNoch keine Bewertungen
- Primer Trabajo Diagrama Acetona - AguaDokument17 SeitenPrimer Trabajo Diagrama Acetona - AguaSebastian Ochoa GomezNoch keine Bewertungen
- Equilibrio Entre FasesDokument11 SeitenEquilibrio Entre FasesAnly MendozaNoch keine Bewertungen
- Equilibrio Liquido VaporDokument8 SeitenEquilibrio Liquido VaporARNOLD BRAVO RAMIREZNoch keine Bewertungen
- 08 Tema Equilibrio Fases IDokument32 Seiten08 Tema Equilibrio Fases INelson ArcosNoch keine Bewertungen
- Equilibro de Fases InformeDokument13 SeitenEquilibro de Fases InformeJuly Nym NeylaNoch keine Bewertungen
- Regla de Fases y Diagrama de EquilibrioDokument15 SeitenRegla de Fases y Diagrama de EquilibrioclaraNoch keine Bewertungen
- Equilibrio Líquido LíquidoDokument14 SeitenEquilibrio Líquido LíquidoISABELLANoch keine Bewertungen
- Trabajo Diagrama de FasesDokument27 SeitenTrabajo Diagrama de FasesAriana PérezNoch keine Bewertungen
- 6 - Unidad 4 Termondinámica y CinéticaDokument30 Seiten6 - Unidad 4 Termondinámica y CinéticaIsmael GuillenNoch keine Bewertungen
- Ecuación de Van Laar (Destilación)Dokument50 SeitenEcuación de Van Laar (Destilación)Mayumy Aguilar SilvaNoch keine Bewertungen
- Objetivo GeneralDokument11 SeitenObjetivo GeneralAdal SandovalNoch keine Bewertungen
- Nomograma de PriesterDokument56 SeitenNomograma de PriesterdanifexNoch keine Bewertungen
- Importancia Del Equilibrio Fisico en La Ing.Dokument4 SeitenImportancia Del Equilibrio Fisico en La Ing.Fanny Torres OrtizNoch keine Bewertungen
- Informe Labo IIDokument18 SeitenInforme Labo IIDilam Diaz RamirezNoch keine Bewertungen
- Guia Aplicacion DBHE2019Dokument76 SeitenGuia Aplicacion DBHE2019Estefanía ÁlvarezNoch keine Bewertungen
- Etica en La IngenieriaDokument1 SeiteEtica en La IngenieriamarzinusNoch keine Bewertungen
- ¿Qué Es El CapitalismoDokument22 Seiten¿Qué Es El CapitalismomarzinusNoch keine Bewertungen
- HULC - Manual de UsuarioDokument287 SeitenHULC - Manual de Usuarioel_gallifanteNoch keine Bewertungen
- 5 Trucos para Estudiar Mejor para Un ExamenDokument20 Seiten5 Trucos para Estudiar Mejor para Un ExamenmarzinusNoch keine Bewertungen
- ¿Qué Es El CapitalismoDokument22 Seiten¿Qué Es El CapitalismomarzinusNoch keine Bewertungen
- Prestaciones Medias Estacionales Bombas de Calor PDFDokument21 SeitenPrestaciones Medias Estacionales Bombas de Calor PDFSteve LuckaterNoch keine Bewertungen
- Guia de Supervivencia para Estudiantes de IngenieriaDokument5 SeitenGuia de Supervivencia para Estudiantes de Ingenieriaersand2002Noch keine Bewertungen
- Noticia46 1336125335Dokument28 SeitenNoticia46 1336125335marzinusNoch keine Bewertungen
- 07 Wray1Dokument3 Seiten07 Wray1marzinusNoch keine Bewertungen
- Guia de La Cogeneracion Fenercom 2010Dokument313 SeitenGuia de La Cogeneracion Fenercom 2010visrulNoch keine Bewertungen
- Beneficios de Las Redes Urbanas de Calor y Fro. DHCDokument15 SeitenBeneficios de Las Redes Urbanas de Calor y Fro. DHCmarzinusNoch keine Bewertungen
- Guia de Supervivencia para Estudiantes de IngenieriaDokument5 SeitenGuia de Supervivencia para Estudiantes de Ingenieriaersand2002Noch keine Bewertungen
- 2012 05 INFOPOWER Climatizacion Urbana TangerDokument20 Seiten2012 05 INFOPOWER Climatizacion Urbana TangermarzinusNoch keine Bewertungen
- Pila DaniellDokument5 SeitenPila DaniellmarzinusNoch keine Bewertungen
- Beneficios de Las Redes Urbanas de Calor y Fro. DHCDokument15 SeitenBeneficios de Las Redes Urbanas de Calor y Fro. DHCmarzinusNoch keine Bewertungen
- Análisis de Densidad de La OrinaDokument3 SeitenAnálisis de Densidad de La OrinamarzinusNoch keine Bewertungen
- Demonio SDokument9 SeitenDemonio SmarzinusNoch keine Bewertungen
- Construyamos Un Anemómetro ManualDokument8 SeitenConstruyamos Un Anemómetro ManualmarzinusNoch keine Bewertungen
- 2010 12 12 LA VANGUARDIA Climatizacion A Lo New YorkDokument1 Seite2010 12 12 LA VANGUARDIA Climatizacion A Lo New YorkmarzinusNoch keine Bewertungen
- Separador de AceiteDokument1 SeiteSeparador de AceitemarzinusNoch keine Bewertungen
- Estimacion LinealDokument9 SeitenEstimacion LinealmarzinusNoch keine Bewertungen
- Volumenes Molares ParcialesDokument10 SeitenVolumenes Molares ParcialesmarzinusNoch keine Bewertungen
- Trigo No Me TriaDokument3 SeitenTrigo No Me TriamarzinusNoch keine Bewertungen
- Un Modelo de Financiación de La Renta Básica para El Conjunto Del Reino - RbuespDokument9 SeitenUn Modelo de Financiación de La Renta Básica para El Conjunto Del Reino - RbuespmarzinusNoch keine Bewertungen
- Calderas Gas - CalderasDokument4 SeitenCalderas Gas - CalderasmarzinusNoch keine Bewertungen
- Fundamentos Teóricos de La Conductividad EléctricaDokument4 SeitenFundamentos Teóricos de La Conductividad EléctricamarzinusNoch keine Bewertungen
- Rectas de Mejor Ajuste en ExcelDokument22 SeitenRectas de Mejor Ajuste en ExcelmarzinusNoch keine Bewertungen
- Berardi Franco - La Fabrica de La Infelicidad (PDF)Dokument190 SeitenBerardi Franco - La Fabrica de La Infelicidad (PDF)Felix ManzanoNoch keine Bewertungen
- Aom CliDokument80 SeitenAom ClimarzinusNoch keine Bewertungen
- CINETICAAADokument8 SeitenCINETICAAARivera MelyNoch keine Bewertungen
- TallerFQ PDFDokument2 SeitenTallerFQ PDFMiguel Betancourt GNoch keine Bewertungen
- TI1 S2 CristianRodriguezDokument5 SeitenTI1 S2 CristianRodriguezCrsitianNoch keine Bewertungen
- Impedancia en Circuito RLC SerieDokument10 SeitenImpedancia en Circuito RLC SeriegeorgeNoch keine Bewertungen
- Fórmula Molecular, Densidad y EfusiónDokument2 SeitenFórmula Molecular, Densidad y EfusiónFernando MoralesNoch keine Bewertungen
- Guía1físicag10 4P PDFDokument14 SeitenGuía1físicag10 4P PDFSofia YepesNoch keine Bewertungen
- Medidores Electromecánicos Y ElectrónicosDokument12 SeitenMedidores Electromecánicos Y ElectrónicosJulissa DzNoch keine Bewertungen
- PD CORREGIDADokument18 SeitenPD CORREGIDASasuke UchihaaNoch keine Bewertungen
- Individual Colab 2Dokument4 SeitenIndividual Colab 2Angie Carolina ChacónNoch keine Bewertungen
- Guia 1 Fuerza Electrica Campo Electrico y Potencial ElectricoDokument7 SeitenGuia 1 Fuerza Electrica Campo Electrico y Potencial ElectricoLeandro AmigoNoch keine Bewertungen
- CALORIMETRIADokument6 SeitenCALORIMETRIANemetNoch keine Bewertungen
- Cuadro Tarifario Diciembre 2023Dokument6 SeitenCuadro Tarifario Diciembre 2023tropus58Noch keine Bewertungen
- Electricos MT IUSADokument14 SeitenElectricos MT IUSAMoisésIxbaNoch keine Bewertungen
- Problemas Resueltos EstaticaDokument30 SeitenProblemas Resueltos EstaticaPedro Baltazar BravoNoch keine Bewertungen
- Diseño de Un Sistema Contra Incendio Con Rociadores Automáticos y Cajetines DIAZDokument13 SeitenDiseño de Un Sistema Contra Incendio Con Rociadores Automáticos y Cajetines DIAZJhonatan BlanquicettNoch keine Bewertungen
- El SonidoDokument1 SeiteEl SonidoMariana Palacios MarínNoch keine Bewertungen
- Sistemas No InercialesDokument9 SeitenSistemas No InercialesAndrés Gonzalo Miranda VegaNoch keine Bewertungen
- Introduccion - Practica 1 PotenciaDokument21 SeitenIntroduccion - Practica 1 PotenciaDiego RochaNoch keine Bewertungen
- Folleto Kaysun Casual ES 2023Dokument2 SeitenFolleto Kaysun Casual ES 2023Climatics JerezNoch keine Bewertungen
- Actividad 2 Solución DR PDFDokument15 SeitenActividad 2 Solución DR PDFChristian Bibiana RojasNoch keine Bewertungen
- Módulo 1 - Sistemas Eléctricos de ProtecciónDokument32 SeitenMódulo 1 - Sistemas Eléctricos de Protecciónjuan carlosNoch keine Bewertungen
- Solucionario de Presion Efectiva y Neutra en Los Suelos 60699 DownloableDokument13 SeitenSolucionario de Presion Efectiva y Neutra en Los Suelos 60699 Downloablecarlos lupacaNoch keine Bewertungen
- Examen de Conocimientos INGPETDokument14 SeitenExamen de Conocimientos INGPETDavid VillanuevaNoch keine Bewertungen
- III Bim - Fisi - 5. Año - Guia - Movimiento Circular - Aceleracion CentrìpetaDokument3 SeitenIII Bim - Fisi - 5. Año - Guia - Movimiento Circular - Aceleracion CentrìpetaJANET ONTANEDANoch keine Bewertungen
- Ciclo RakeinDokument4 SeitenCiclo RakeinAndyPaoNoch keine Bewertungen
- 5 1.3.2 Problemas de Aplicacion de PascalDokument3 Seiten5 1.3.2 Problemas de Aplicacion de PascalKevin Agustín Salazar GuzmánNoch keine Bewertungen
- Ibf-1009 Colin PR 1peDokument5 SeitenIbf-1009 Colin PR 1peRodrigo ColinNoch keine Bewertungen
- Practica 4 Dinamica Lazares Uni FicDokument2 SeitenPractica 4 Dinamica Lazares Uni FicyeraldinNoch keine Bewertungen
- Relaciones Graficas de La CinematicaDokument5 SeitenRelaciones Graficas de La CinematicaJESUS ALEJANDRO VIDES RENDEROSNoch keine Bewertungen
- Termorregulacion Del Recien Nacido-1Dokument18 SeitenTermorregulacion Del Recien Nacido-1priscilagarciagomeznekoNoch keine Bewertungen