Beruflich Dokumente
Kultur Dokumente
Fuerzas de Atracción de Sólidos y Líquidos
Hochgeladen von
Jiancarlo O. HidalgoOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Fuerzas de Atracción de Sólidos y Líquidos
Hochgeladen von
Jiancarlo O. HidalgoCopyright:
Verfügbare Formate
1.
Fuerzas de atraccin de slidos y lquidos:
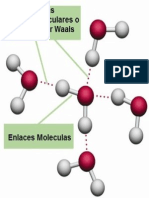
Las Fuerzas Intermoleculares, son fuerzas de atraccin y repulsin entre las molculas. El comportamiento molecular depende en gran medida del equilibrio (o falta de l) de las fuerzas que unen o separan las molculas, y el estudio de esos fenmenos fue parte importante del desarrollo de la qumica fsica en el siglo XX.as fuerzas de atraccin explican la cohesin de las molculas en los estados liquido y slido de la materia, y se llaman fuerzas de largo alcance o Fuerzas de Van der Waals en honor al fsico holands Johannes van der Waals. Estas fuerzas son las responsables de muchos fenmenos fsicos y qumicos como la adhesin, rozamiento, difusin, tensin superficial y la viscosidad.Entre las diferentes fuerzas de orden intermoleculares que mantienen unidos los tomos dentro de la molcula y mantener la estabilidad de las molculas individuales.
Hay varios tipos de interacciones:
-Fuerzas de orientacin (aparecen entre molculas con momento dipolar diferente) -Fuerzas de induccin (ion o dipolo permanente producen en una molcula apolar una separacin de cargas por el fenmeno de induccin electrosttica)
-Fuerzas de dispersin (aparecen en tres molculas apolares).
En la naturaleza, las uniones entre molcula son de tipo dipolar, siendo las ms caractersticas las fuerzas de Van der Waals y los puentes de hidrgeno.
Las fuerzas de atraccin entre molculas (monoatmicas o poliatmicas) sin carga neta se conocen con el nombre de fuerzas intermoleculares o fuerzas de van der Waals. Dichas fuerzas pueden dividirse en tres grandes grupos: las debidas a la existencia de dipolos permanentes, las de enlace de hidrgeno y las debidas a fenmenos de polarizacin transitoria (fuerzas de London). A continuacin realizaremos un estudio elemental de cada uno de dichos grupos.
Fuerzas de Van der Waals: Es una fuerza intermolecular atractiva, pero poco intensa, que se ejerce a distancia entre molculas. Son fuerzas de origen elctrico que pueden tener lugar entre dipolos instantneos o inducidos y entre dipolos permanentes.Las sustancias moleculares estn formadas por molculas individuales entre las que nicamente existen interacciones de tipo residual que son las responsables del enlace conocido como fuerza de Van der Waals. Pero este tipo de fuerza no slo est presente en los slo los slidos moleculares, sino que tambin aparece entre los tomos o iones sometidos a cualquier clase de enlace, ya sea inico, metlico o covalente; por eso se considera como una interaccin residual. Su energa es mucho menor que la de los otros tipos de enlace y normalmente aparezca enmascarada. Por otra parte, la interaccin conocida como fuerza de Van der Waals se caracteriza tambin porque carece de carcter dirigido y porque opera a distancias mucho mayores.
Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusin de las sustancias covalentes son siempre bajos, ya que la agitacin trmica domina; las fuerzas de Van der Waals son las nicas responsables de la estabilidad de estos gases nobles en estado slido.
La mayor parte de las sustancias covalentes, a temperatura ambiente, son los gases o lquidos de punto de ebullicin bajo (ejemplo: Agua).
En cuanto a la solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en disolventes apolares y no en disolventes polares.
Se conocen algunos slidos covalentes prcticamente infusibles e insolubles, que son excepcin al comportamiento general descrito. Un ejemplo de esto es el diamante. La gran estabilidad de estas redes cristalinas se debe a que los tomos que las forman estn unidos entre s mediante enlaces covalentes. Para deshacer la red, es necesario romper estos enlaces, lo cual consume gran cantidad de energa.
Las fuerzas entre dipolos instantneos o inducidos se producen entre molculas apolares como es el caso del oxigeno, nitrgeno o cloro, y tambin entre tomos como el helio o nen, y reciben el nombre de fuerzas de dispersin. Este tipo de fuerzas es el responsable de que estas sustancias pueden ser licuadas e incluso solidificadas. Las nubes electrnicas de las molculas o delos tomos sufren vibraciones y producen dipolos con una orientacin determinada, pero de vida muy breve ya que en un instante despus el dipolo tiene la orientacin contraria. Estos dipolos inducen otra deformacin en las molculas contiguas y originan fuerzas de atraccin entre ellas.
Las fuerzas entre dipolos permanentes se producen cuando las molculas son polares, como el oxido de azufre (SO2) o el monxido de carbono (CO), y existe atraccin entre el polo de una molcula y el polo opuesto de otra molcula contigua. Estas fuerzas siguen siendo dbiles pero son ms intensas que las fuerzas de dispersin y, aunque stas siguen existiendo, predominan las de atraccin dipolo-dipolo.
Enlace dipolo-dipolo: Existen gases cuyas molculas estn formadas por tomos
que tienen diferente electronegatividad (enlace covalente polar) y que se hallan dispuestos de forma que en la molcula existen zonas con mayor densidad de electrones que otras (polo negativo y positivo respectivamente). Este es el caso, por ejemplo, de los gases fluoruro de hidrgeno (HF), cloruro de hidrgeno (HCl), bromuro de hidrgeno (HBr) y ioduro de hidrgeno (HI).
Ejemplo:
La molcula de agua est formada por dos tomos de H unidos a un tomo de O por medio de dos enlaces covalentes. La disposicin tetradrica de los orbitales sp3 del oxgeno determina un ngulo entre los enlaces H-O-H aproximadamente de 104'5:, adems el oxgeno es ms electronegativo que el hidrgeno y atrae con ms fuerza a los electrones de cada enlace.
El resultado es que la molcula de agua aunque tiene una carga total neutra (igual nmero de protones que de electrones ), presenta una distribucin asimtrica de sus electrones, lo que la convierte en una molcula polar, alrededor del oxgeno se concentra una densidad de carga negativa , mientras que los ncleos de hidrgeno quedan desnudos, desprovistos parcialmente de sus electrones y manifiestan, por tanto, una densidad de carga positiva.
Por eso en la prctica la molcula de agua se comporta como un dipolo.
As se establecen interacciones dipolo-dipolo entre las propias molculas de agua, formndose enlaces o puentes de hidrgeno, la carga parcial negativa del oxgeno de una molcula ejerce atraccin electrosttica sobre las cargas parciales positivas de los tomos de hidrgeno de otras molculas adyacentes. Aunque son uniones dbiles, el hecho de que alrededor de cada molcula de agua se dispongan otras cuatro molculas unidas por puentes de hidrgeno permite que se forme en el agua (lquida o slida) una estructura de tipo reticular, responsable en gran parte de su comportamiento anmalo y de la peculiaridad de sus propiedades fisicoqumicas.
Puente de Hidrgeno:
La unin intermolecular por puentes de hidrgeno se produce en molculas formadas por tomos de hidrgeno y elementos de elevada electronegatividad y tamao pequeo, como es el caso del flor, oxigeno o nitrgeno (que son los nicos elementos cuyos tomos pueden formar puentes de hidrgeno), el par de electrones que forma el enlace esta fuertemente atrado por el tomo ms electronegativo, producindose una polarizacin del enlace. Esto proporciona una carga parcial positiva al tomo de H y una carga parcial negativa al otro tomo. En virtud de estas cargas, puede establecerse atraccin elctrica entre los hidrgenos de una molcula y los tomos electronegativos de una molcula vecina.
Como el enlace de Van der Waals, el puente de hidrgeno es mucho menos energtico que el enlace covalente o el inico, con los valores de entre 1 y 10 Kcal/mol.
Un ejemplo lo encontramos en la molcula de agua, donde los electrones de la unin H-O se encuentran fuertemente atrados por el tomo de oxigeno. Por ello, el ncleo de hidrgeno H+ va a actuar como polo positivo de gran intensidad que establece uniones de tipo electrosttico con los tomos de oxigeno de las molculas cercanas. Grficamente, la unin del puente de hidrgeno se representa mediante una lnea de puntos.
El enlace anterior entre el oxgeno y el hidrgeno de molculas de agua distintas (representado aqu por una lnea punteada) recibe el nombre de enlace de hidrgeno. Un enlace de hidrgeno es una unin de tipo intermolecular generada por un tomo de hidrgeno que se halla entre dos tomos fuertemente electronegativos. De hecho slo los tomos de F, O y N tienen la electronegatividad y condiciones necesarias para intervenir en un enlace de hidrgeno. La clave de la formacin del enlace de hidrgeno es el carcter fuertemente polar del enlace covalente entre el hidrgeno H y otro tomo (por ejemplo O). La carga parcial positiva originada en el tomo de hidrgeno atrae a los electrones del tomo de oxgeno de una molcula vecina. Dicha atraccin se ve favorecida cuando ese otro tomo es tan electronegativo que tiene una elevada carga parcial negativa.
El hidrgeno es el nico tomo capaz de formar este tipo de enlace porque al ser tan pequeo permite que los otros tomos ms electronegativos de las molculas vecinas puedan aproximarse lo suficiente a l como para que la fuerza de atraccin sea bastante intensa. Este tipo de enlace intermolecular es el responsable, por ejemplo, de la existencia de ocanos de agua lquida en nuestro planeta. Si no existiera, el agua se encontrara en forma de vapor.
2.
Estado solido
Los slidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partculas que los forman estn unidas por unas fuerzas de atraccin grandes de modo que ocupan posiciones casi fijas. En el estado slido las partculas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladndose libremente a lo largo del slido. Las partculas en el estado slido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geomtrica, que da lugar a diversas estructuras cristalinas. Al aumentar la temperatura aumenta la vibracin de las partculas
Un cuerpo slido, uno de los cinco estados de agregacin de la materia, se caracteriza porque opone resistencia a cambios de forma y de volumen. Existen varias disciplinas que estudian los slidos:
La fsica del estado slido estudia cmo emergen las propiedades fsicas de los slidos a partir de su estructura de la materia condensada.
La mecnica de slidos deformables estudia propiedades macroscpicas desde la perspectiva de la mecnica de medios continuos (tensin, deformacin, magnitudes termodinmicas, &c.) e ignora la estructura atmica interna porque para cierto tipo de problemas esta no es relevante. La ciencia de los materiales se ocupa principalmente de propiedades de los slidos como estructura y transformaciones de fase. La qumica del estado slido se especializa en la sntesis de nuevos materiales.
Manteniendo constante la presin a baja temperatura los cuerpos se presentan en forma slida y encontrndose entrelazados formando generalmente estructuras cristalinas. Esto confiere al cuerpo la capacidad de soportar fuerzas sin deformacin aparente. Son, por tanto, agregados generalmente rgidos, incompresibles (que no pueden ser comprimidos), duros y resistentes. Poseen volumen constante y no se difunden, ya que no pueden desplazarse.
Los slidos presentan propiedades especficas:
Elasticidad: Un slido recupera su forma original cuando es deformado. Un resorte es un objeto en que podemos observar esta propiedad. Fragilidad: Un slido puede romperse en muchos pedazos (quebradizo). Dureza: Un slido es duro cuando no puede ser rayado por otro ms blando. El diamante es un slido con dureza elevada. Forma definida: Tienen forma definida, son relativamente rgidos y no fluyen como lo hacen los gases y los lquidos, excepto a bajas presiones extremas. Volumen definido: Debido a que tienen una forma definida, su volumen tambin es constante. Alta densidad: Los slidos tienen densidades relativamente altas debido a la cercana de sus molculas por eso se dice que son ms pesados Flotacin: Algunos slidos cumplen con esta propiedad, solo si su densidad es menor a la del liquido en el cual se coloca. Inercia: es la dificultad o resistencia que opone un sistema fsico o un sistema social a posibles cambios, en el caso de los slidos pone resistencia a cambiar su estado de reposo. Tenacidad: En ciencia de los Materiales la tenacidad es la resistencia que opone un material a que se propaguen fisuras o grietas. Maleabilidad: Es la propiedad de la materia, que presentan los cuerpos a ser labrados por deformacin. La maleabilidad permite la obtenci n de delgadas lminas de material sin que ste se rompa, teniendo en comn que no existe ningn mtodo para cuantificarlas. Ductilidad La ductilidad se refiere a la propiedad de los slidos de poder obtener hilos de ellos
El slido ms ligero conocido es un material artificial, el aerogel, que tiene una densidad de 1,9 mg/cm, mientras que el ms denso es un metal, el osmio (Os), que tiene una densidad de 22,6 g/cm. Las molculas de un slido tienen una gran cohesin y adoptan formas bien definidas.
3.
Estado lquido: El lquido es uno de los tres estados de agregacin de la materia. Un lquido es un fluido cuyo volumen es constante en condiciones de temperatura y presin constantes y su forma es esfrica. Sin embargo, debido a la gravedad sta queda definida por su contenedor. Un lquido ejerce presin en el contenedor con igual magnitud hacia todos los lados. Si un lquido se encuentra en reposo, la presin que
Los lquidos presentan tensin superficial y capilaridad, generalmente se expanden cuando se incrementa su temperatura y se comprimen cuando se enfran. Los objetos inmersos en algn lquido son sujetos a un fenmeno conocido como flotabilidad.
Las molculas en el estado lquido ocupan posiciones al azar que varan con el tiempo. Las distancias intermoleculares son constantes dentro de un estrecho margen.
Cuando un lquido sobrepasa su punto de ebullicin cambia su estado a gaseoso, y cuando alcanza su punto de congelacin cambia a slido.
Por medio de la destilacin fraccionada, los lquidos pueden separarse de entre s al evaporarse cada uno al alcanzar sus respectivos puntos de ebullicin. La cohesin entre las molculas de un lquido no es lo suficientemente fuerte por lo que las molculas superficiales se pueden evaporar.
Lquidos, sustancias en un estado de la materia intermedio entre los estados slido y gaseoso. Las molculas de los lquidos no estn tan prximas como las de los slidos, pero estn menos separadas que las de los gases. En algunos lquidos, las molculas tienen una orientacin preferente, lo que hace que el lquido presente propiedades anistropas (propiedades, como el ndice de refraccin, que varan segn la direccin dentro del material). En condiciones apropiadas de temperatura y presin, la mayora de las sustancias puede existir en estado lquido. A presin atmosfrica, sin embargo, algunos slidos se subliman al calentarse; es decir, pasan directamente del estado slido al estado gaseoso (vase Evaporacin). La densidad de los lquidos suele ser algo menor que la densidad de la misma sustancia en estado slido. Algunas sustancias, como el agua, son ms densas en estado lquido.
Viscosidad
Los lquidos se caracterizan por una resistencia al flujo llamada viscosidad. La viscosidad de un lquido crece al aumentar el nmero de moles y disminuye al crecer la temperatura. La viscosidad tambin est relacionada con la complejidad de las molculas que constituyen el lquido: es baja en los gases inertes licuados y alta en los aceites pesados. Es una propiedad caracterstica de todo fluido (lquidos o gases). La viscosidad es una medida de la resistencia al desplazamiento de un fluido cuando existe una diferencia de presin. Cuando un liquido o un gas fluyen se supone la existencia de una capa estacionaria, de lquido o gas, adherida sobre la superficie del material a travs del cual se presenta el flujo. La segunda capa roza con la adherida superficialmente y sta segunda con una tercera y as sucesivamente. Este roce entre las capas sucesivas es el responsable de la oposicin al flujo o sea el responsable de la viscosidad.
La viscosidad se mide en poise, siendo un poise la viscosidad de un lquido en el que para deslizar una capa de un centmetro cuadrado de rea a la velocidad de 1 cm/s respecto a otra estacionaria situado a 1 cm de distancia fuese necesaria a la fuerza de una dina.
La viscosidad suele decrecer en los lquidos al aumentar la temperatura, aunque algunos pocos lquidos presentan un aumento de viscosidad cuando se calientan. Para los gases la viscosidad aumenta al aumentar la temperatura.
La viscosidad de un liquido se determina por medio de un viscosmetro entre los cuales el ms utilizado es el de Ostwald, este se utiliza para determinar viscosidad relativas, es decir, que conociendo la viscosidad de un lquido patrn, generalmente agua
Ductilidad
La ductilidad es una caracterstica de los lquidos y/o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por mas pequeo que sea siempre que est a un mismo o inferior nivel del recipiente en el que se encuentren (el lquido y el gas), a diferencia del restante estado de agregacin conocido como slido.
Presin de vapor y otros parmetros
Presin de un vapor en equilibrio con su forma lquida, la llamada presin de vapor, slo depende de la temperatura; su valor a una temperatura dada es una propiedad caracterstica de cada lquido.
Tambin lo son el punto de ebullicin, el punto de solidificacin y el calor de vaporizacin (esencialmente, el calor necesario para transformar en vapor una determinada cantidad de lquido).
En ciertas condiciones, un lquido puede calentarse por encima de su punto de ebullicin; los lquidos en ese estado se denominan supercalentados. Tambin es posible enfriar un lquido por debajo de su punto de congelacin y entonces se denomina lquido superenfriado.
4.
Transferencia de calor durante cambio de un estado a otro: En la naturaleza existen tres estados usuales de la materia: slido, lquido y gaseoso. Al aplicarle calor a una sustancia, sta puede cambiar de un estado a otro. A estos procesos se les conoce como Cambios de Fase. Los posibles cambios de fase son:
de estado slido a lquido, llamado fusin, de estado lquido a slido, llamado solidificacin, de estado lquido a gaseoso, llamado evaporacin o vaporizacin, de estado gaseoso a lquido, llamado condensacin, de estado slido a gaseoso, llamado sublimacin progresiva, de estado gaseoso a slido, llamado sublimacin regresiva o deposicin, de estado gaseoso a plasma, llamado ionizacin.
Calor latente Artculo principal: Calor latente
Un cuerpo slido puede estar en equilibrio trmico con un lquido o un gas a cualquier temperatura, o que un lquido y un gas pueden estar en equilibrio trmico entre s, en una amplia gama de temperaturas, ya que se trata de sustancias diferentes. Pero lo que es menos evidente es que dos fases o estados de agregacin , distintas de una misma sustancia, puedan estar en equilibrio trmico entre s en circunstancias apropiadas.
Un sistema que consiste en formas slida y lquida de determinada sustancia, a una presin constante dada, puede estar en equilibrio trmico, pero nicamente a una temperatura llamada punto de fusin simbolizado a veces como tf. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material slido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energa se le llama calor de fusin, calor latente de fusin o entalpa de fusin, y vara segn las diferentes sustancias. Se denota por L f. El calor de fusin representa la energa necesaria para deshacer la fase slida que est estrechamente unida y convertirla en lquido. Para convertir lquido en slido se necesita la misma cantidad de energa, por ellos el calor de fusin representa la energa necesaria para cambiar del estado slido a lquido, y tambin para pasar del estado lquido a slido.
De manera similar, un lquido y un vapor de una misma sustancia pueden estar en equilibrio trmico a una temperatura llamada punto de ebullicin simbolizado por te. El calor necesario para evaporar una sustancia en estado lquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullicin o calor latente de ebullicin o entalpa de ebullicin, y se mide en las mismas unidades que el calor latente de fusin. Se denota por Le.
En la siguiente tabla se muestran algunos valores de los puntos de fusin y ebullicin y entalpas de algunas sustancias:
Transmisin de calor
Artculo principal: Transmisin de calor
El calor puede ser transmitido de tres formas distintas: por conduccin, por conveccin o por radiacin.
Conduccin trmica: es el proceso que se produce por contacto trmico entre dos cuerpos, debido al contacto directo entre las partculas individuales de los cuerpos que estn a diferentes temperaturas, lo que produce que las partculas lleguen al equilibrio trmico. Ej: cuchara metlica en la taza de t.
Conveccin trmica: slo se produce en fluidos (lquidos o gases), ya que implica movimiento de volmenes de fluido de regiones que estn a una temperatura, a regiones que estn a otra temperatura. El transporte de calor est inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
Radiacin trmica: es el proceso por el cual se transmite a travs de ondas electromagnticas. Implica doble transformacin de la energa para llegar al cuerpo al que se va a propagar: primero de energa trmica a radiante y luego viceversa. Ej.: La energa solar.
La conduccin pura se presenta slo en materiales slidos.
La conveccin siempre est acompaada de la conduccin, debido al contacto directo entre partculas de distinta temperatura en un lquido o gas en movimiento.
En el caso de la conduccin, la temperatura de calentamiento depende del tipo de material, de la seccin del cuerpo y del largo del cuerpo. Esto explica porqu algunos cuerpos se calientan ms rpido que otros a pesar de tener exactamente la misma forma, y que se les entregue la misma cantidad de calor.
Conductividad trmica
donde:
Q es el calor entregado, t es el intervalo de tiempo durante el cual se entreg calor, A es la seccin del cuerpo, L es la longitud, y T es el incremento en la temperatura.
Diagrama de fases: temperatura y presin crtica: se denomina diagrama de fase a la representacin grfica de las fronteras entre diferentes estados de la materia de un sistema, en funcin de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregacin diferentes se suele denominar diagrama de cambio de estado.
En ciencia de materiales se utilizan ampliamente los diagramas de fase binarios, mientras que en termodinmica se emplean sobre todo los diagramas de fase de una sustancia pura.
Diagrama de fase de una sustancia pura
Los diagramas de fase ms sencillos son los de presin - temperatura de una sustancia pura, como puede ser el del agua. En el eje de ordenadas se coloca la presin y en el de abscisas la temperatura. Generalmente, para una presin y temperatura dadas, el cuerpo presenta una nica fase excepto en las siguientes zonas:
Punto triple: En este punto del diagrama coexisten los estados slido, lquido y gaseoso. Estos puntos tienen cierto inters, ya que representan un invariante y por lo tanto se pueden utilizar para calibrar termmetros. Los pares (presin, temperatura) que corresponden a una transicin de fase entre:
o o o o
Dos fases slidas: Cambio alotrpico; Entre una fase slida y una fase lquida: fusin - solidificacin; Entre una fase slida y una fase vapor (gas): sublimacin - deposicin (o sublimacin inversa); Entre una fase lquida y una fase vapor: vaporizacin - condensacin (o licuefaccin).
Es importante sealar que la curva que separa las fases vapor-lquido se detiene en un punto llamado punto crtico. Ms all de este punto, la materia se presenta como un fluido supercrtico que tiene propiedades tanto de los lquidos como de los gases. Modificando la presn y temperatura en valores alrededor del punto crtico se producen reacciones que pueden tener inters industrial, como por ejemplo las utilizadas para obtener caf descafeinado.
Es preciso anotar que, en el diagrama PV del agua, la lnea que separa los estados lquido y slido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando la preson el hielo se funde, y tambin que la fase slida tiene menor densidad que la fase lquida.
Diagrama de fase binario
Cuando aparecen varias sustancias, la representacin de los cambios de fase puede ser ms compleja. Un caso particular, el ms sencillo, corresponde a los diagramas de fase binarios. Ahora las variables a tener en cuenta son la temperatura y la concentracin, normalmente en masa. En un diagrama binario pueden aparecer las siguientes regiones:
Slido puro o disolucin slida Mezcla de disoluciones slidas (eutctica, eutectoide, peritctica, peritectoide) Mezcla slido - lquido nicamente lquido, ya sea mezcla de lquidos inmiscibles (emulsin), ya sea un lquido completamente homogneo. Mezcla lquido - gas Gas (lo consideraremos siempre homogneo, trabajando con pocas variaciones da altitud).
Hay punto y lneas en estos diagramas importantes para su caracterizacin:
Lnea de lquidus, por encima de la cual solo existen fases lquidas. Lnea de slidus, por debajo de la cual solo existen fases slidas. Lnea eutctica y eutectoide. Son lneas horizontales (isotermas) en las que tienen lugar transformaciones eutcticas y eutectoides, respectivamente. Lnea de solvus, que indica las temperaturas para las cuales una disolucin slida ( ) de A y B deja de ser soluble para transformarse en ()+ sustancia pura (A B).
La presin crtica es una caracterstica de cualquier sustancia, que define el campo en el que sta puede transformarse en vapor en presencia del lquido correspondiente.
En la imagen de al lado se muestra el comportamiento del agua en el plano temperatura (temperature-T) entropa (entropie-S), la curva del agua en este caso es empleada slo como ejemplo, dado que una curva anloga puede ser definida para cualquier otra sustancia. Desde la curva (en rojo) que separa la fase lquida (bajos valores de T y de S) hasta la fase gaseosa (altos valores de T y de S) se ve que el plano prcticamente est dividido en tres zonas: una zona a la izquierda de la curva, en la que existe el lquido, una zona a la derecha de la curva en la que la sustancia est presente como gas y finalmente una zona encerrada por la curva en la que la sustancia coexiste en equilibrio con el vapor, habiendo un cierto ttulo que representa la relacin en peso entre lquido y vapor en equilibrio. El vrtice de la curva es el punto crtico (Kritischer Punkt) que es individual da un determinado valor de presin (presin crtica) y temperatura (temperatura crtica).
La relevancia de estas caractersticas de las sustancias viene del hecho de que, a presiones superiores a la presin crtica la transformacin del lquido en gas sucede sin paso por la fase del vapor, por lo tanto de modo prcticamente instantneo y conservando la continuidad de las caractersticas fsicas.
Como datos fundamentales:
Pc del agua es 218 atm. Tc del agua es 647,4 K. Se denomina temperatura crtica a la temperatura lmite por encima de la cual un gas miscible no puede ser licuado por compresin. Por encima de esta temperatura no es posible condensar un gas aumentando la presin. A esta temperatura crtica, si adems tenemos una presin crtica (la presin de vapor del lquido a esta temperatura), nos encontraremos en el punto crtico de la sustancia. La temperatura crtica es caracterstica de cada sustancia. Las sustancias a temperaturas superiores de la crtica tienen un estado de agregacin tipo gas, que tiene un comportamiento muy parecido al de un gas ideal.
Propiedades fsicas del agua:
Propiedades fsicas del agua.
1) Densidad del agua.
Procedimiento.
En la probeta colocamos agua destilada. Luego introducimos el
densmetro y esperamos a que terminara de balancearse.
Observaciones.
El agua tena una densidad de 1gr por cc.
2) Punto de fusin del agua.
Procedimiento.
En un vaso precipitado colocamos hielo y un termmetro para
registrar su temperatura.
Observaciones e inferencias.
La t inicial del hielo fue de -10C, esta t comenz a subir hasta 2C cuando el hielo se transformo en agua lquida.
Nosotros inferimos que al hielo le afecto la t ambiente y esto hizo que cambiara de estado.
3) Densidad del alcohol etlico.
Pregunta.
Cul es la densidad del alcohol etlico si la masa de un litro es de 798 gr?
Por lo tanto
Despus comprobamos que esto era correcto a travs de un libro.
4) Tensin superficial.
Procedimiento.
Llenamos un vaso precipitado con agua, en ella colocamos
un trozo de papel (6 x 9cm) doblado en un ngulo de 90.
Observaciones e inferencias.
El papel flota. Inferimos que esto paso por la tensin superficial.
Tensin superficial: Es una fuerza ejercida por las molculas de agua, las cuales mediante la unin de sus hidrgenos forman una capa en la superficie del agua que impide que se hunda el papel.
El zapatero es un organismo que utiliza la tensin superficial.
5) Solvente universal.
Procedimiento.
En un vaso precipitado colocamos 100cc de agua y 20 gr de sal, luego revolvimos y observamos. Agregamos 20cc ms revolvimos y observamos. Repetimos este proceso una vez ms.
20cc: Al colocar la sal el agua se torno de un color
blanco que fue desapareciendo a medida que
agitbamos con la cuchara.
40cc: Ocurri lo mismo.
60cc: El agua no pudo disolver los 20cc agregados.
Inferencias.
Inferimos que el agua no pudo disolver ms sal porque se satur.
Preguntas.
a) Investiga que factores influyen en la solubilidad del agua.
Temperatura: Si aumenta la t aumentar la solubilidad del agua.
Ejemplo del NaNo3.
T en C Solubilidad
10
20
30
40
60
80
100
80 (gr/100 gr de agua)
88
96
104
124
148
180
Aqu se demuestra que lo anterior dicho como en el caso en que el agua a 100 C puede disolver 180 gr NaNo3 en 100 gr de agua.
Presin: Por lo general tiene muy poco efecto en la solubilidad de lquidos y slidos. En solventes lquidos la solubilidad de los gases aumenta a mayor presin.
b) Cundo una solucin se denomina saturada?
Solucin saturada: Solucin en la cual el solvente no puede disolver ms soluto. En este momento hay un equilibrio dinmico entre el soluto disuelto y el no disuelto.
HIDRLISIS DEL AGUA.
1)Sin tubos.
Procedimiento.
A una batera le conectamos cables que iban ha un recipiente
con agua destilada. Pero no ocurri nada porque el voltaje
era muy poco (9v) y haba que usar agua potable. Estos dos
inconvenientes hicieron al experimento lento.
Observaciones.
Si hubiramos visto el final del experimento el agua debera haberse calentado.
2)Con tubos.
Procedimiento.
A una batera se le colocaron 2 cables (conductores). Estos cables se introducieron en dos tubos de ensayo dentro de un recipiente que contena agua.
Observaciones.
Comenzaron a salir burbujas en el agua y adentro de los tubos se vean gases.
Preguntas.
a) Cules son los gases?
Tubo A=cable nodo (conectado al + de la batera) atrae - gas de O
Tubo B= cable ctodo (conectado al - de la batera) atrae + gas de H
Al colocar corriente al agua esta se rompi y por eso quedaron tomos de O (como gas) en un tubo y tomos de H (como gas) en el otro tubo.
b) Qu gas se desprende en el ctodo?
El ctodo tiene cargas - que atraen a las cargas + que tiene el H, por lo tanto se desprenden tomos de este en forma de gas.
c) Cmo deberan ser los volmenes de los gases recogidos en los tubos de ensayo?
Los volmenes de gas de los tubos estn en la proporcin 1: 2, siendo el H el doble del O.
Tubo A=cable nodo (conectado al + de la batera) atrae - gas de O
Tubo B= cable ctodo (conectado al - de la batera) atrae + gas de H
En el experimento observamos que el ctodo desprendi casi el doble de burbujas que el nodo, por lo tanto inferimos que el tubo con gas de H tena el doble de volumen que el de gas O.
Das könnte Ihnen auch gefallen
- AntecedentesDokument17 SeitenAntecedentesJosafat VidalNoch keine Bewertungen
- Fuerzas IntermolecularesDokument8 SeitenFuerzas IntermolecularesElcira Alejandra Jaque JaqueNoch keine Bewertungen
- Características y Propiedades de Los Compuestos CovalentesDokument4 SeitenCaracterísticas y Propiedades de Los Compuestos CovalentesPamela Cubas FloresNoch keine Bewertungen
- Enlaces IntermocularesDokument4 SeitenEnlaces Intermocularesskyfire aaNoch keine Bewertungen
- Fuerzas IntermolecularesDokument9 SeitenFuerzas IntermoleculareslauraosoriocNoch keine Bewertungen
- Enlaces QuímicosDokument46 SeitenEnlaces QuímicosCindy GutiérrezNoch keine Bewertungen
- Fuerzas IntermolecularesDokument9 SeitenFuerzas Intermolecularesカリイオ ヘクトルNoch keine Bewertungen
- Fuerzas de Van Der WaalsDokument4 SeitenFuerzas de Van Der WaalsSailly Johana Saurith CandelarioNoch keine Bewertungen
- Numero 2Dokument4 SeitenNumero 2skyfire aaNoch keine Bewertungen
- Fuerzas IntermolecularesDokument6 SeitenFuerzas IntermolecularesMaría De SousaNoch keine Bewertungen
- Estructura y Propiedades de Los Compuestos Químicos OrgánicosDokument11 SeitenEstructura y Propiedades de Los Compuestos Químicos OrgánicosPaula Elena33% (3)
- Puentes de Hidrógeno 4,5,6Dokument4 SeitenPuentes de Hidrógeno 4,5,6Juan Diego RujanoNoch keine Bewertungen
- Taller de Química Fuerzas IntermolecularesDokument2 SeitenTaller de Química Fuerzas IntermolecularesDiego Fernando Ardila ArizaNoch keine Bewertungen
- Seminario #3Dokument13 SeitenSeminario #3Kristell QuezadaNoch keine Bewertungen
- Fuerzas Intermolecularez 2018Dokument3 SeitenFuerzas Intermolecularez 2018Emilse GonzalezNoch keine Bewertungen
- Apunte Complementario Fuerzas Intermoleculares - Qca Biologica y AplicadaDokument5 SeitenApunte Complementario Fuerzas Intermoleculares - Qca Biologica y AplicadaAldana CuevasNoch keine Bewertungen
- UNIONESDokument3 SeitenUNIONESJazmin VelizNoch keine Bewertungen
- Enlaces Químicos.Dokument24 SeitenEnlaces Químicos.nathaliaortiz.9732.uo62Noch keine Bewertungen
- Las Fuerzas IntermolecularesDokument12 SeitenLas Fuerzas IntermolecularesJohanna Catalina100% (1)
- Momento Dipolar y Fuerzas IntermolecularesDokument6 SeitenMomento Dipolar y Fuerzas IntermolecularesJesusito Manuel RojasNoch keine Bewertungen
- Teoria Trabajo 1Dokument10 SeitenTeoria Trabajo 1miguelNoch keine Bewertungen
- Fuerzas IntermolecularesDokument15 SeitenFuerzas IntermolecularesWendy CedeñoNoch keine Bewertungen
- Resumen Primer Parcial IBCMDokument44 SeitenResumen Primer Parcial IBCMNatiele MagdalenoNoch keine Bewertungen
- Presentación 1Dokument6 SeitenPresentación 1kraiserNoch keine Bewertungen
- Fuerza IntramolecularDokument6 SeitenFuerza IntramolecularMathias Santiago Sánchez AguilarNoch keine Bewertungen
- Laboratorio de Química OrgánicaDokument23 SeitenLaboratorio de Química Orgánicamarlene-stemkeNoch keine Bewertungen
- Tema 6Dokument10 SeitenTema 6elcapiteniarazonNoch keine Bewertungen
- Taller 8..Dokument7 SeitenTaller 8..Luz Marina Peña MorajxkfjjkkzkfNoch keine Bewertungen
- Fuerzas IntermolecularesDokument13 SeitenFuerzas Intermoleculareserick joelNoch keine Bewertungen
- Fuerzas IntermolecularesDokument3 SeitenFuerzas IntermolecularesLeo SNoch keine Bewertungen
- Monografia de QuimicaDokument8 SeitenMonografia de QuimicaJoa King Chaupis AdrianoNoch keine Bewertungen
- Fuerzas de Vander WallsDokument3 SeitenFuerzas de Vander WallsKevin Salmeron VicenteNoch keine Bewertungen
- Fuerzas IntermolecularesDokument7 SeitenFuerzas IntermolecularesecmNoch keine Bewertungen
- Colegio Militarizado Legión de Honor BachilleratoDokument14 SeitenColegio Militarizado Legión de Honor BachilleratoJuan David MelendezNoch keine Bewertungen
- Fuerzas de Van Der WaalsDokument7 SeitenFuerzas de Van Der WaalsareacienciasNoch keine Bewertungen
- Fuerzas IntermolecularesDokument15 SeitenFuerzas IntermolecularesAbigail VicencioNoch keine Bewertungen
- Fuerzas de Interacción MolecularDokument8 SeitenFuerzas de Interacción MolecularNoelia MontoyaNoch keine Bewertungen
- Fuerzas IntermolecularesDokument5 SeitenFuerzas IntermolecularesOrtega Durán Abel JoséNoch keine Bewertungen
- Fuerzas IntermolecularesDokument4 SeitenFuerzas IntermolecularesDario de los SantosNoch keine Bewertungen
- Fuerzas IntermolecularesDokument11 SeitenFuerzas IntermolecularesirisevangelinajerezNoch keine Bewertungen
- Fuerzas IntermolecularesDokument4 SeitenFuerzas IntermolecularesIvan SailemaNoch keine Bewertungen
- Trabajo QuimicaDokument4 SeitenTrabajo QuimicaVicente AcostaNoch keine Bewertungen
- Fuerzas de Van Der WaalsDokument5 SeitenFuerzas de Van Der WaalsLaura CervantesNoch keine Bewertungen
- Fuerzas IntermolecularesDokument12 SeitenFuerzas IntermolecularesRenzoNoch keine Bewertungen
- Fuerzas Intermoleculares.Dokument6 SeitenFuerzas Intermoleculares.EDGAR IVAN MORALES VALLESNoch keine Bewertungen
- Fuerzas IntermolecularesDokument10 SeitenFuerzas IntermolecularesIvan JimenezNoch keine Bewertungen
- Puente de HidrógenoDokument4 SeitenPuente de HidrógenoPedro Montaño ChinoNoch keine Bewertungen
- BrayanDokument12 SeitenBrayanBrayan Ayna RamosNoch keine Bewertungen
- Fuerzas de Atracción Entre MoléculasDokument7 SeitenFuerzas de Atracción Entre MoléculasCuauhtemoc Torres ArreolaNoch keine Bewertungen
- V-Fuerzas Intermoleculares - PPTMDokument50 SeitenV-Fuerzas Intermoleculares - PPTMBrayan Rivera ArgumedoNoch keine Bewertungen
- QMICDokument6 SeitenQMICValentin VasquezNoch keine Bewertungen
- Fuerzas IntermolecularesDokument15 SeitenFuerzas IntermolecularesAntonio Pérez GarcíaNoch keine Bewertungen
- Teoría Lewis, Ley de Octeto y OxidaciónDokument9 SeitenTeoría Lewis, Ley de Octeto y OxidaciónMARIA MARCELA NOELLER SANDOVAL100% (1)
- Fuerzas IntermolecularesDokument6 SeitenFuerzas IntermolecularesVickyNoch keine Bewertungen
- Informe de Quimica N°03Dokument9 SeitenInforme de Quimica N°03JriellNoch keine Bewertungen
- Que Es Un Enlace MetálicoDokument2 SeitenQue Es Un Enlace MetálicoHanneNoch keine Bewertungen
- Enlace Van Der WaalsDokument2 SeitenEnlace Van Der Waalsalejandro romero capuñayNoch keine Bewertungen
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseVon EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Calculo APDokument9 SeitenCalculo APJiancarlo O. HidalgoNoch keine Bewertungen
- Prevención de Riesgos en TractoresDokument28 SeitenPrevención de Riesgos en TractoresJiancarlo O. HidalgoNoch keine Bewertungen
- AP Limites y ContinuidadDokument7 SeitenAP Limites y ContinuidadJiancarlo O. HidalgoNoch keine Bewertungen
- HosteleriaDokument128 SeitenHosteleriaJiancarlo O. HidalgoNoch keine Bewertungen
- RECOMENDACIONES ErgonomíaDokument4 SeitenRECOMENDACIONES ErgonomíaJiancarlo O. HidalgoNoch keine Bewertungen
- Tabla Durbin WatsonDokument5 SeitenTabla Durbin WatsonJiancarlo O. HidalgoNoch keine Bewertungen
- Cuál Es La Misión Del Espíritu SantoDokument3 SeitenCuál Es La Misión Del Espíritu SantoJiancarlo O. Hidalgo43% (7)
- Daniel Alcides CarriónDokument2 SeitenDaniel Alcides CarriónJiancarlo O. HidalgoNoch keine Bewertungen
- Situaciones LógicasDokument3 SeitenSituaciones LógicasJiancarlo O. Hidalgo100% (1)
- 4 - Leyes de Thevenin y NortonDokument10 Seiten4 - Leyes de Thevenin y NortonRosa Emily Rodríguez HuamánNoch keine Bewertungen
- Bases TeoricasDokument14 SeitenBases TeoricasCristhian StalinNoch keine Bewertungen
- Guía de Practica Nro 1 Control AutomáticoDokument9 SeitenGuía de Practica Nro 1 Control AutomáticoMishel AciencioNoch keine Bewertungen
- Cable N2xohDokument7 SeitenCable N2xohkichi456Noch keine Bewertungen
- Símbolos y Planos Eléctricos PDFDokument54 SeitenSímbolos y Planos Eléctricos PDFIgnacio Alvarez100% (4)
- Lab06 - Control de Fase de Triac Culminado DiegoDokument19 SeitenLab06 - Control de Fase de Triac Culminado Diegoanon_843632677Noch keine Bewertungen
- BTTRMTB4 PDFDokument1 SeiteBTTRMTB4 PDFOswaldo GuzmanNoch keine Bewertungen
- DB SFG Unmsm2007Dokument145 SeitenDB SFG Unmsm2007Arnold Ramon AvilaNoch keine Bewertungen
- Actividad Semana Tres Bombas Lineales MecanicasDokument4 SeitenActividad Semana Tres Bombas Lineales Mecanicasjhon jairo67% (3)
- Transistores PDFDokument4 SeitenTransistores PDFkimNoch keine Bewertungen
- Practica 2 de Electrotecnia ESPOL With Eduardo Mendieta FIMCPDokument4 SeitenPractica 2 de Electrotecnia ESPOL With Eduardo Mendieta FIMCPJunge AkademischNoch keine Bewertungen
- Requerimientos Esenciales para Elegir Un DBMSDokument3 SeitenRequerimientos Esenciales para Elegir Un DBMSSky WarNoch keine Bewertungen
- Laboratorio II MEDokument2 SeitenLaboratorio II MEJorge HB50% (2)
- PC2 - Caf2 - UtpDokument5 SeitenPC2 - Caf2 - UtpJose Mallqui Ramirez67% (3)
- Semana de La Iluminacion 2023 - 29Dokument11 SeitenSemana de La Iluminacion 2023 - 29Jessenia MartinezNoch keine Bewertungen
- PCMH LST 21 Ee 2000 0Dokument25 SeitenPCMH LST 21 Ee 2000 0pedro torresNoch keine Bewertungen
- Inorme Practica 1 - ModeloDokument5 SeitenInorme Practica 1 - ModeloAaron HidalgoNoch keine Bewertungen
- Teoría de Muestreo, Discretización, y Reconstrucción de SeñalesDokument10 SeitenTeoría de Muestreo, Discretización, y Reconstrucción de SeñalesEdward Javier PatiñoNoch keine Bewertungen
- Plan de Estudios EPIT 2011 Vigente CODIFICADODokument4 SeitenPlan de Estudios EPIT 2011 Vigente CODIFICADOPierre LopezNoch keine Bewertungen
- Metodos de SintonizacionDokument14 SeitenMetodos de Sintonizacionejprieto100% (1)
- Presentación Productos X-TrongDokument11 SeitenPresentación Productos X-TrongAnonymous FmtZ7ME8100% (1)
- Amplificador de 500 WDokument15 SeitenAmplificador de 500 WFrancisco GrassiNoch keine Bewertungen
- DivisorDokument7 SeitenDivisorLuis Miguel Huayllani QuispeNoch keine Bewertungen
- Autoradio Pioneer AVH X7800BT Instrucciones 44775Dokument59 SeitenAutoradio Pioneer AVH X7800BT Instrucciones 44775Jonathan PeñarandaNoch keine Bewertungen
- Fase 3Dokument24 SeitenFase 3Sergio MontoyaNoch keine Bewertungen
- Especificaciones Tecnicas Translado de TableroDokument5 SeitenEspecificaciones Tecnicas Translado de TableroDenis Javier Yupa IquiapazaNoch keine Bewertungen
- Agrupacion de CapacitoresDokument8 SeitenAgrupacion de CapacitoresAna PuertaNoch keine Bewertungen
- Informe Laboratorio 2 MicroDokument11 SeitenInforme Laboratorio 2 MicroDavid Paolo Rocha JaureguiNoch keine Bewertungen
- Tecnel B EsDokument16 SeitenTecnel B EsvicenteNoch keine Bewertungen
- Criterios Aprobacion GPD Proyectos2Dokument2 SeitenCriterios Aprobacion GPD Proyectos2CAMPEAN18Noch keine Bewertungen