Beruflich Dokumente
Kultur Dokumente
Apostila 06 Eletroforese
Hochgeladen von
napaulafernandes31Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Apostila 06 Eletroforese
Hochgeladen von
napaulafernandes31Copyright:
Verfügbare Formate
PRTICA 2 (continuao)
ELETROFORESE A eletroforese em gel de agarose consiste no mtodo padro usado para separar, identificar, analisar, caracterizar e purificar fragmentos de DNA. A eletroforese em gel de acrilamida usada em menor escala. A tcnica simples, rpida e capaz de separar misturas de fragmentos de DNA que no podem ser separados por outros mtodos, tais como centrifugao com densidade de gradiente ou por velocidade de sedimentao. A localizao do DNA no gel pode ser determinada diretamente. As bandas no gel so coloridas principalmente por Brometo de Etdeo em baixa concentrao, que colore por intercalar-se na dupla fita de DNA. Concentraes de at 1 ng de DNA podem ser visualizadas por exame direto de gel na luz ultravioleta. Uma molcula de DNA, quando exposta a um campo eltrico, migra para o eletrodo na velocidade ou mobilidade eletrofortica, proporcional a fora do campo e a carga lquida da molcula. A mobilidade eletrofortica tambm inversamente proporcional ao coeficiente friccional da molcula, que, por sua vez, funo do tamanho e forma da molcula, e da viscosidade do meio. Portanto, uma mistura de molculas diferentes pode ser separada eletroforeticamente com base em : a. tamanho da molcula; b. forma ou conformao da molcula; c. magnitude das cargas eltricas lquida na molcula; Quando aplicadas na mesma posio num campo eltrico, as molculas sero separadas em bandas e migraro a velocidades diferentes para posies diferentes no meio. Sob condies fisiolgicas, os grupos fosfatos dos cidos nucleicos encontram-se ionizados. Cadeias de polinucleotdeos de DNA e RNA so chamados de polinions e migram para o eletrodo POSITIVO (anodo) quando colocados em campo eltrico. Devido a natureza repetitiva dos fosfatos, o DNA dupla fita possuem aproximadamente a mesma relao de massa e carga lquida. Ajustando a viscosidade do meio, entretanto, os efeitos da frico e o formato das molculas pode ser usado, permitindo separar os cidos nucleicos eletroforeticamente por tamanho. A viscosidade do meio pode ser determinada pelo tamanho dos poros do meio atravs da concentrao de agarose ou poliacrilamida. Portanto, a taxa de migrao de DNA atravs de gel de agarose dependente de cinco parmetros: 1. Tamanho da molcula de DNA: uma molcula linear de DNA dupla fita move-se atravs da matriz de agarose numa taxa inversamente proporcional ao log 10 dos seu peso molecular (ver figura). 2. Concentrao de Agarose: o fragmento de DNA de um determinado peso migra em velocidade distinta atravs de gis de diferentes concentraes de agarose. Existe uma relao linear entre o logaritmo da mobilidade eletrofortica do DNA ( ) e a concentrao do gel (), descrita na equao:
log = log 0 Kr onde: 0 a mobilidade eletrofortica livre e Kr o coeficiente de atraso, uma constante relacionada com as propriedades do gel, o tamanho e a forma das molculas. Portanto, usando gis com diferentes concentraes, possvel separar vrios tamanhos de fragmento de DNA. 3. Conformao de DNA: DNA circular fechado e tenso supercoiled (Forma I); circular relaxado com corte nick (Forma II); e linear (Forma III) com mesmo peso molecular, migram atravs de gis a velocidades diferentes. A mobilidade relativa das trs formas depende, primeiramente, da concentrao de agarose no gel, mas tambm influenciada pela voltagem aplicada, a fora inica do tampo, e a densidade de toro do DNA na Forma I. Sob algumas condies, a Forma I migra mais rapidamente que a Forma III; e sob outras condies, a ordem invertida. 4. Corrente aplicada: Sob baixa voltagem, a taxa de migrao de fragmentos de DNA linear proporcional a voltagem aplicada. Entretanto, com um aumento no campo de fora aplicado, a mobilidade de fragmentos de alto peso molecular aumenta diferencialmente. Portanto, a faixa efetiva de separao por gel de agarose decresce com um aumento na voltagem. Para obter uma maior resoluo dos fragmentos de DNA, os gis no devem ser submetidos a voltagens maiores que 5 V/cm. 5. Composio de Bases e Temperatura: O comportamento eletrofortico de DNA em gis de agarose (em contraste a gis de poliacrilamida) no muito afetado pela composio de bases do DNA, nem pela temperatura em que o gel corrido. Portanto, a mobilidade eletrofortica relativa de fragmentos de DNA em gis de agarose no muito afetada por temperaturas entre 4 e 30 oC. De modo geral, gis de agarose so corridos em temperatura ambiente. Entretanto, gis contendo menos de 0,5% de agarose so muito frgeis e devem ser corridos a 4 oC, para terem maior rigidez. A agarose consiste num polissacardeo linear de galactose e um derivativo de galactose associados atravs de ponte de hidrognio. Agarose composta de unidades de de -D-galactopiranose com ligao 1,3 e 3,6 anidro-a-L-galactopiranose com ligao 1,4. Essa unidade bsica de agarobiose repetida cerca de 4000 vzes, formando longas cadeias de com peso molecular mdio de 120.000 daltons. Tambm podem ocorrer no polissacardeo, grupos com carga, tipicamente piruvato e sulfato. Esses grupos so responsveis por vrias propriedades da agarose, e a seleo cuidadosa de matria prima para o preparo da agarose controla a qualidade para fins especficos.
Eletroendosmose (EEO) uma medida funcional do nmero de resduos de piruvato e sulfato presente no polissacardeo agarose. Eletroendosmose um fenmeno que ocorre durante a eletroforese quando um meio anti-convectivo (no caso a prpria agarose) possui um carga negativa fixa. Num campo eltrico, os ons positivos hidratados associados com os grupos anionicos fixos da agarose migram para o catodo. A gua ento puxada com os ons positivos e a migrao de molculas negativas, tais como o DNA retardada. Eletroendosmose quantificada pela eletroforese de uma mistura de Dextran e Albumina, e visualizando ambas e medindo a distancia de migrao a partirda origem. A quantidade de EEO (-mr) calculada pela diviso da distncia de migrao do Dextran neutro (OD) pela soma das distncias de migrao de Dextran e Albumina (OD + AO): -mr = OD/(OD+AO)
O mecanismo de tornar agarose em gel envolve uma mudana de estado de enovelao aleatria na soluo, para dupla helicoidal no estgio inicial de geleificao e para feixes de helicides duplas. O tamanho mdio de poro varia com a concentrao e tipo de agarose, mas tipicamente varia de 100 a 300 nm.
Agentes que interferem com a formao de pontes de hidrognio (agentes caotrpicos, tais como uria ou iodeto de potssio) podem diminuir a temperatura de fuso, de geleificao e fora do gel de agarose, ou mesmo inibir a formao de gel. Como algumas aplicaes requerem a incorporao de urea no gel, importante estar ciente dos efeitos. Eletroforese de DNA em gis de Agarose Tampes: Durante a eletroforese, a gua eletrolisada, gerando prtons no anodo e hidroxilas no catodo. O terminal catdico da cmara de eletroforese torna-se bsica e a andica acdica. O uso de sistema de tampo portanto requerido, quando molculas carregadas so corridas por eletroforese em meio de separao. Os dois tampes mais comumente usados para eletroforese de DNA so Tris-Acetato com EDTA (TAE; 40 mM Trisacetato, 1 mM EDTA) e Tris-Borato com EDTA (TBE; 89 mM Tris-Borato, 2 mM EDTA). O pH desses tampes bsico, e portanto as molculas de DNA com suas cadeias com grupos fosfato possuem carga lquida negativa, e migram para o catodo.
Apesar da aparente similaridade entre os tampes TAE e TBE, cada um possui propriedades especficas, que os fazem melhos adapatdos para diversas aplicaes: Tampo TAE Aplicao e comentrios Usar quando o DNA vai ser recuperado Usar para eletroforese de DNA de grande tamanho (> 12 Kb) Baixa fora inica Propriedades: Baixa capacidade tamponante - recirculao pode ser necessria para corridas eletroforticas longas (> 6 horas). Usar para eletroforese de DNA pequeno (< 1 Kb) Melhor resoluo de DNA pequeno (< 1 Kb) Mobilidade do DNA mais restrita Alta fora inica Propriedades: Diminui a mobilidade do DNA. Alta capacidade tamponante - no requer recirculao para corridas longas.
TBE
Quando usar tampo TAE ou TBE? Quando o DNA no ser recuperado, pode-se usar tanto 1 X TAE como TBE (1 X ou 0,5 X), pois ambos podem ser usados para molculas de DNA menores que 12 a 15 Kpb. Para DNA maior, recomendvel utilizar TAE na eletroforese associado a um baixo campo de fora (1 a 2 V/cm). Durante longas corridas de eletroforese, a maior porosidade, menor EEO e menor campo de fora diminui tendncia a quebra do DNA. Tampo TBE preferido para a separao de molculas pequenas de DNA (< 1 kb), quando a recuperao de DNA no necessria. A interao do tampo TBE com a agarose resulta poros menores. Esse gel mais compacto reduz a expanso das bandas de DNA, causado pela disperso e difuso. Profundidade de Tampo: Independente do tampo utilizado, a profundidade de tampo sobre o gel num sistema de eletroforese horizontal deve ser de 3 a 5 mm. Uma menor quantidade pode levar ao dessecamento do gel durante a eletroforese, Profundidade excessiva pode restringir a mobilidade do DNA, promovendo a distoro de bandas e pode causar acmulo de calor no sistema. Depleo de Tampo: A taxa de depleo de tampo depende do tampo usado e sua capacidade tamponante. Um tampo 0,5X TBE possui uma capacidade tamponante maior do que 1X TAE, no pH utilizado, pois o pKa do Borato mais prximo ao pH inicial do tampo do que o pKa do acetato. Cubas de eletroforese de tamanho padro (15 x 30 cm) com capacidade de 1,5 a 2 litros pode tolerar 40 a 50 Watt-horas antes da perda da capacidade tamponante. A perda da capacidade tamponante em mini-cubas de eletroforese, no ocorre antes de 10 a 13 Watt-horas. As indicaes de perda da capacidade tamponente advm da fuso do gel, formao de rastro de DNA, e/ou sobreaquecimento. Esses efeitos de perda de capacidade tamponante e desenvolvimento de gradiente de pH podem ser reduzidos pela re-circulao do tampo. Isso normalmente necessrio apenas quando a eletroforese feita por longos perodos de tempo ou o tampo de eletroforese possui baixa capacidade tamponante.
Prepao de Tampo Estoqie de 50X TAE (Tris-Acetato) (1X= 40 mM Tris base; 40 mM cido actico; 1 mM EDTA) 242,0 g Tris base 57,1 mL cido actico Glacial 18,61 g Na2 EDTA2H2O Completar para 1 litro com gua destilada Estoque de 5X TBE (Tris-Borato) (1X = 89 mM Tris base, 89 mM cido brico; 2 mM EDTA) (0,5X = 45 mM Tris-borate, 1 mM EDTA) 54,0 g Tris base 27,5 g cido brico 3,72 g Na2 EDTA2H2O Completar para 1 litro com gua destilada
Outros Sistemas de Tampo: Tampo Tris-Fosfato (TPE, Tris-Phosphate) tambm pode ser usado para eletroforese de DNA. Assim como tampo TBE, TPE possui alta capacidade tamponante, mas no interfere com a recuperao de DNA do gel. Tampo 10X Tris-Fosfato (TPE) 1X = 90 mM Tris base, 90 mM cido fosfrico; 2 mM EDTA 108,0 g Tris-base 15,5 mL 85% Phosphoric acid 7,44 g Na2 EDTA2H2O Completar para 1 litro com gua destilada Voltagem Ideal e Tempo de eletroforese Voltagem ideal: A distncia usada para determinar o gradiente de voltagem a distncia entre os eletrodos e no o comprimento do gel. Se a voltagem for excessiva, pode ocorrer a rastro de banda ("band streaking"), especialmente para DNA >12-15 Kb. Quando a voltagem muito baixa, a mobilidade de fragmentos de DNA muito pequenos (< 1 Kb) reduzida, causando o alargamento das bandas pela disperso e difuso do DNA. O tampo utilizado tambm influencia a clareza das bandas. As bandas pequenas de DNA tendem a ser mais finas e claras em gis com TBE, enquanto que em TAE melhor para grandes fragmentos de DNA (>12 Kb). Tabela de Voltagem: A tabela abaixo fornece referncias para voltagem ideal e tampo para corrida de eletroforese de DNA. Tamanho < 1 kb 1 to 12 kb > 12 kb Voltagem 5 V/cm 4-10 V/cm 1-2 V/cm Tampo Recuperao Anlise TAE TBE TAE TAE/TBE TAE TAE
Tempo timo de corrida de eletroforese: O gel deve ser corrido at que a banda de interesse tenha migrado de 40 a 60% do comprimento do gel O alargamento da banda
resultante de disperso e difuso resulta numa perda de resoluo no tero inferior do gel. A resoluo tambm pode ser menor em gis pequenos, pois corridas eletroforticas mais longas resultam em melhor separao entre dois fragmentos.
Carregamento de DNA e Tampo de Carregamento
Quantidade de DNA ideal para acarregamento: A quantidade de DNA que pode ser usada para carregamento no gel depende de vrios fatores: 1. Volume do poo 2. Tamanho do fragmento: a capacidade do gel diminui rapidamente com o aumento do tamanho do fragmento, especialmente acima de alguns Kbp; 3. Distribuio de tamanhos de fragmentos; 4. Gradiente de voltagem: gradientes de voltagem maiores so mais apropriados para fragmentos de DNA < 1 Kb, e gradientes menores para fragmentos > 1 Kb. A menor quantidade de DNA numa nica banda que pode ser detectada com segurana com colorao de brometo de etdeo aproximadamente 10 ng e cerca de 60 pg com SYBR Green I. Para uma banda clara, definida e limpa so necessrios cerca de 100 ng. Carregamento em excesso de DNA resulta em rastro no gel, um problema que se torna mais srio com o aumento do tamanho do DNA em anlise. Tampo de Carregamento: Os tampes de carregamento de amostra servem para trs funes na eletroforese de DNA: 1. Aumentar a densidade da amostra de forma a assegurar que o DNA ser depositado uniformemente dentro do poo; 2. Acrescentar cor na amostra para simplificar o carregamento to the sample; 3. Acrescentrar corantes de mobilidade. Os corantes migram num campo eltrico em direo do anodo em velocidades estabelecidas, permitiando a monitorao do processo de eletroforese. Pelo menos 5 tampes de carregamento de amostra so comumente usados em eletroforese em gel de agarose. Normalmente, os tampes de carregamento de amostra so preparados em solues com concentrao de 6 a 10 vzes.
Tampo de Carregamento Baseado em Sucrose Baseado em Glicerol Baseado em Ficoll
Concentrao a 6X 40% (p/v) Sucrose 0,25% Bromophenol Blue 0,25% Xylene cyanol FF 30% Glycerol em gua destilida 0,25% Bromophenol Blue 0,25% Xylene cyanol FF 15% Ficoll (tipo 400) polmero em gua destilada 0,25% Bromophenol Blue 0,25% Xylene cyanol FF 300 mN NaOH 6 mM EDTA 0,15% Bromocresol Green 0,25% Xylene cyanol FF
Temperatura d Armazenamento 4o C
4o C
Temperatura ambiente
Alcalino
4o C
Tampes de carregamento baseado em Ficoll: Para aumentar a clareza das bandas de DNA, pode ser usado o polmero Ficoll (tipo 400) como agente de carregamento ao invs de glicerol. O uso de glicerol com baixo peso molecular no tampo de amostra permite que o DNA de subir os lados dos poos antes do incio da eletroforese e levar a formao de bandas em forma de U. Em gis com tampo TBE, o glicerol pode tambm interagir com o borato, podendo alterar o pH local. Preparao da amostra: Tampo de carregamento que possui fora inica muito alta pode levar a formao de bandas desfocadas ("fuzzy"). A amostra de DNA deve ser ressupendida na mesma soluo que for usada como tampo de corrida. Caso isso no seja possvel, usar um tampo de amostra com fora inica mais baixa do que o tampo de corrida. Uria em gis de agarose: A presena de uria inibe a gelatinizao da agarose por interferir nas pontes de hidrognio das cadeias de polissacardeos. Essa problema pode ser evitado pela preparao cautelosa do gel, usando perodo de cura sob refrigerao, geralmente por toda a noite. O gel resultante ser mais frgil do que um gel normal de agarose, e no deve ser usado em blots de hibridizao. Gis de uria-agarose (4 a 6 M uria) pode ser preparado inicialmente pela dissolvio da agarose num volume reduzido de gua ou tampo, sendo em seguida resfriado para 50 oC, quando adicionada a uria sob agitao. A dissolvio de uria cristalina, ultrapura ou em solues concentradas um processo endotrmico. Apesar de haver um resfriamento da soluo, com um acrscimo de viscosidade, a soluo no formar gel. Aps a uria ser dissolvida, ajustar o peso/volume totoal com gua destilada ou tampo, enformar o gel e refrigerar por toda a noite. Alternativamente, possvel resfriar o gel, colocando-os inicilamente em freezer por 15-30 minutos. A uria impede a formao de cristais de gelo. Se cristais de uria se formarem, deixe o gel a temperatura ambiente antes do uso,
at os cristais desaparecerem (normalmente alguns minutos). Caso no seja possvel obter um gel dessa forma, prepare um gel normalmente, e deixe-o equilibrar em tampo contendo uria. Evite expor uria a altas temperaturas. Solues de uris se decompes em amnia e biureto com calor excesivo. A formao de cianeto com outros componentes pode ocorrer.
Gel de Poliacrilamida:
Gis de Poliacrilamida so obtidos a partir da formao de ligaes entre o polmero acrilamida e o co-monmero bis-acrilamida. Essa reao covalente geralmente catalizada por persulfato de amnio e iniciada por TEMED, uma amina terciria. Acrilamida O H || H2C=CCNH2 Metilenebisacrilamida O H ||
H2C=CCNH | | C 2 O | H || | H2C=CCNH
+ S2O8 2- (persulfato) CONH2 CONH2 CONH2 | | | CH2CHCH2CHCH2CHCH2CH | CONH | CH2 | CONH | CH2CHCH2CHCH2CHCH2CH | | | CONH2 CONH2 CONH2
Uma ampla faixa de tamanho de poros pode ser obtida atravs de variaes:
1. concentrao de acrilamida e bis-acrilamida; 2. grau de polimerizao. A matriz de poliacrilamida por possuir poros menores do que a matriz de agarose, gis de acrilamida so usados para separar fragmentos de DNA menores que 4 kpb, enquanto que molculas de at 200 kpb podem ser separaradas em em gis de agarose. De forma geral, um gel de 12 cm, a 1% de agarose separa fragmentos na faixa de 30 a 0,2 Kbp, enquanto que a 7,5% de poliacrilamida separa entre 2 a 0,05 Kpb.
CONCENTRAO RECOMENDADA PARA MELHOR RESOLUO DE DNA DUPLA FITA
LINEAR
Agarose (%) 0,5 0,7 1,0 1,2 1,5 2,0
Tamanho dos Fragmentos Separados (Kpb) 1 30 0,8 12 0,5 10 0,4 7 0,2 3 0,05 - 2
O corante Azul de Bromofenol (Bromphenol Blue) migra a aproximadamente a 300 pares de base e Xileno Cianol (Xylene Cyanol) a 4 Kpb, independente da concentrao de agarose entre 0,5 e 1,4% em 0,5 x de TBE. CONCENTRAES DE ACRILAMIDA RECOMENDADA PARA RESOLUO DE DNA LINEAR DUPLA FITA (CONDIES NO-DESNATURANTE) Acrilamida* (%) 3,5 5,0 8,0 12,0 15,0 20,0 Tamanho de Fragmentos Separados (pares de base) 100 1000 80 500 60 400 40 200 25 150 6 100 Migrao de Corante Xileno Cianol 460 260 160 70 60 45 Azul de Bromofenol pb 100 65 45 20 15 12
* 19:1 (pso/pso) acrilamida/bis-acrilamida MIGRAO DE CORANTE EM GEL DE ACRILAMIDA EM CONDIES DESNATURANTES Acrilamida * (%) 5,0 6,0 8,0 10,0 20,0 Migrao de Corante Xileno Cianol Azul de Bromofenol 140 35 106 26 75 19 55 12 28 8
* 19:1 (pso/pso) acrilamida/bis-acrilamida
Visualizao do DNA por Fluorescncia Brometo de etdeo um corante fluorescente que detecta DNA fita dupla ou fita simples. Entretanto, a afinidade por DNA fita simples reduzida comparada com fita dupla. Brometo de etdeo contm um grupo planar que intercala entre bases de DNA e quando ligado ao DNA, ocorre um aumento fluorescncia. DAN corado com brometo de etdeo detectado em ultravioleta. A 254 nm, a luz UV absorvida pelo DNA e transmitida para o corante; a 302 nm e 366 nm a luz UV absorvida pelo prprio corante. Desde quando o brometo de etdeo pode intercalar-se entre as bases de RNA e DNA, utilizado para visualizar os cidos nucleicos em gis de agarose ou poliacrilamida. Quando o gel colocado em uma soluo de Brometo de Etdeo, o corante liga-se com todos so stios disponveis do DNA, no se associando com agarose ou poliacrilamida.. A intensida de fluorescncia de cada banda proporcional ao tamanho do fragmento. Brometo de Etdeo pode ser incorporado no gel (0,5 g/ml), mas que afeta a mobilidade dos fragmentos, ou corado a posteriori por imerso em soluo com gua ou tampo por 10-30 minutos, dependendo da concentrao usada. De modo geral utliza-se um estoque de Brometo de Etdeo 10 mg/ml, adicionando-se entre 10 a 40 l por 500 ml de gua mQ. Corante Brometo de Etdeo Prata para agarose SYBR Green I SYBR Green II Methylene blue Acridine orange Limite de Deteco Comentrios dsDNA ssDNA 1-5 ng 5 ng Reconhecido Carcinognico 1 ng 5 ng Melhor Sensibilidade em gel de poliacrilamida 60 pg 1 ng Maior sensibilidade de deteco Maior sensibilidade de deteco de ssDNA e 5 ng 1 ng para RNA No Txico 40-200 ng N/A Necessita grandes quantidades de DNA 50 ng 100 ng Distingue ssDNA de dsDNA
Interpretao de Padres de Eletroforese Devido o fato que a migrao da molcula de DNA inversamente proporcional ao coeficiente de frico, que depende do tamanho e formato da molcula, a anlise do DNA pode ser complicada pela variedade de conformaes que a molcula de DNA pode assumir. Um DNA plasmidial pode exister em trs ismeros conformacionais: supercoil (Forma I); crculo relaxado (Forma II); e linear (Forma III). Em termos de mobilidade relativa atravs da matriz do gel, a Forma II deve ser a mais lenta pois seu formato no compacto como a Forma I (supercoiled) e no possui a mobilidade da molcula linear (Forma III). De modo geral a mobilidade deve ser: Forma III (linear) > Forma I (supercoiled) > Forma II (crculo relaxado) Mas essa relao constante apenas em algumas circunstncias, sendo influenciada por tamanho do poro,corrente, peso molecular e tampo. Tambm, em casos que o gel corrido na presena de Brometo de Etdeo, a Forma II pode ser induzida a assumir a Forma I pela intercalagem do corante nas bases e com isso aumentar sua taxa de mobilidade eletrofortica. A anlise de DNA de plasmdeo pode ser ainda mais
complexa pela formao de dmeros das Formas I e II, que de modo geral migrariam de forma mais lenta do seus respectivos monmeros.
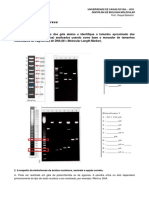
Gel 1% de agarose contendo amostras no digeridas e parcialmente digeridas por HindIII. Linhas a, b, c demonstram o efeito de borda, alm de apresentaram as diferentes Formas de conformao de pBR322 atravs das setas numeradas: 1. Monmero supercoiled (Forma I); 2. Monmero crculo relaxado ou aberto (Forma II); 3. DNA linear (Forma III); 4. Dmero de supercoiled; 6. Dmero linear. Os dmeros de crculos relaxados ou abertos no so visveis. Linha d exibe um super-carregamento de plasmdeo (2 mg). Linha e. pBR322 no digerido.
Das könnte Ihnen auch gefallen
- 1576880239e-Book RED VELVETDokument10 Seiten1576880239e-Book RED VELVETSi Hing Hélio Sandro100% (8)
- Perguntas Imuno Teste 1Dokument37 SeitenPerguntas Imuno Teste 1Érica MunhozNoch keine Bewertungen
- Biotec Aula 2Dokument25 SeitenBiotec Aula 2Ana Barth100% (1)
- Exercicios8 - PCR e EletroforeseDokument3 SeitenExercicios8 - PCR e EletroforeseFernando BonnoNoch keine Bewertungen
- Parâmetros Sugeridos para Solda TIGDokument3 SeitenParâmetros Sugeridos para Solda TIGLourival Santos100% (2)
- Relatorio Reatividade Dos MetaisDokument12 SeitenRelatorio Reatividade Dos MetaisAndré Ferraz de SouzaNoch keine Bewertungen
- Aula TBM4 2022-2023Dokument27 SeitenAula TBM4 2022-2023Diogo Botelho Medeiros BrilhanteNoch keine Bewertungen
- Eletroforese em GelDokument5 SeitenEletroforese em Geldinho tavNoch keine Bewertungen
- Aula Texto - EletroforeseDokument9 SeitenAula Texto - EletroforeseHelton ResendeNoch keine Bewertungen
- Eletroforese em GelDokument3 SeitenEletroforese em GelKananda Lima Barreto100% (1)
- Relatório de Aula Prática: Extração de DNA.Dokument4 SeitenRelatório de Aula Prática: Extração de DNA.Charlles MaggOtNoch keine Bewertungen
- Aula EletroforeseDokument27 SeitenAula EletroforesesamuelmuricyNoch keine Bewertungen
- Relatório de DNADokument9 SeitenRelatório de DNALucila AndradeNoch keine Bewertungen
- BMA3Dokument63 SeitenBMA3Beatriz NunesNoch keine Bewertungen
- Universidade Federal de Santa MariaDokument52 SeitenUniversidade Federal de Santa MariaGih DrenNoch keine Bewertungen
- PCR e Eletrofore em Gel de AgaroseDokument8 SeitenPCR e Eletrofore em Gel de AgaroseAndré Vinícius100% (1)
- Aula 7 - Técnicas de Eletroforese e CromatografiaDokument29 SeitenAula 7 - Técnicas de Eletroforese e CromatografiaBruno AvelarNoch keine Bewertungen
- Eletroforese Agarose e PoliacrilamidaDokument30 SeitenEletroforese Agarose e PoliacrilamidaEdnilton Nobre NunesNoch keine Bewertungen
- Slide Da Unidade - Detecção e Produção de Material GenéticoDokument39 SeitenSlide Da Unidade - Detecção e Produção de Material GenéticoRenan Bisi CyprianoNoch keine Bewertungen
- Relatório 2 - Extração e Caracterização DNADokument10 SeitenRelatório 2 - Extração e Caracterização DNABruno Julio FonteNoch keine Bewertungen
- Eletroforese em Gel de Campo PulsadoDokument4 SeitenEletroforese em Gel de Campo PulsadohericaNoch keine Bewertungen
- Eletroforese Agarose e PoliacrilamidaDokument30 SeitenEletroforese Agarose e PoliacrilamidaSuzanne RodriguesNoch keine Bewertungen
- Eletroforese em Gel de AgaroseDokument2 SeitenEletroforese em Gel de AgaroseIsack Oliveira PintoNoch keine Bewertungen
- Ficha de Trabalho - EletroforeseDokument4 SeitenFicha de Trabalho - EletroforeseAnabela Mota100% (1)
- ELETROFORESE SeminarioDokument3 SeitenELETROFORESE SeminarioIzadora VeigaNoch keine Bewertungen
- Definição de SDS - Post BlogDokument3 SeitenDefinição de SDS - Post Blogthiagolima18Noch keine Bewertungen
- BQIExp 2020 - Relatório 11 - Grupo 4 - VRSDokument11 SeitenBQIExp 2020 - Relatório 11 - Grupo 4 - VRSÂngela TavaresNoch keine Bewertungen
- Resumo Biologia MolecularDokument6 SeitenResumo Biologia MolecularMIRELLA DE MELO MORETONoch keine Bewertungen
- Caderno Biomol PDFDokument23 SeitenCaderno Biomol PDFFCiênciasNoch keine Bewertungen
- Prática - RespostasDokument4 SeitenPrática - RespostasLucasNoch keine Bewertungen
- Relatório Aula Prática EletroforeseDokument9 SeitenRelatório Aula Prática EletroforeseRenas Pereira100% (2)
- Aula EletroforeseDokument27 SeitenAula EletroforesepauloNoch keine Bewertungen
- PCR EletroforeseDokument17 SeitenPCR EletroforeseKairã LódeNoch keine Bewertungen
- Aula 1 - Extração de DNADokument42 SeitenAula 1 - Extração de DNAMurilo xXxNoch keine Bewertungen
- Manual de EletroforeseDokument11 SeitenManual de Eletroforesejosli100% (1)
- Aula BM 7 EletroforeseDokument42 SeitenAula BM 7 EletroforeseJoab Ana MenezesNoch keine Bewertungen
- Aula 1.3 - Métodos em GenéticaDokument59 SeitenAula 1.3 - Métodos em GenéticaDiego AlarconNoch keine Bewertungen
- Protocolo MiniprepDokument7 SeitenProtocolo MiniprepDiogo MarquesNoch keine Bewertungen
- Roteiro - EletroforeseDokument4 SeitenRoteiro - EletroforeseGustavo HenriqueNoch keine Bewertungen
- Ed - IlDokument5 SeitenEd - IlKAYLLANY SILVANoch keine Bewertungen
- Resumo GenéticaDokument30 SeitenResumo GenéticaAdrieny da Silva100% (1)
- Exercicios5 - Eletroforese-1Dokument2 SeitenExercicios5 - Eletroforese-1Carine GuerraNoch keine Bewertungen
- Relatorio V EletroforeseDokument6 SeitenRelatorio V EletroforeseViven Janai Adolfo LopesNoch keine Bewertungen
- GensalDokument10 SeitenGensalIago FerrazNoch keine Bewertungen
- Reação em Cadeia Da DNA Polimerase e EletroforeseDokument5 SeitenReação em Cadeia Da DNA Polimerase e EletroforeseFelipe FerreiraNoch keine Bewertungen
- Manual Metodos de TipagemDokument27 SeitenManual Metodos de TipagemDionei Joaquim HaasNoch keine Bewertungen
- EletroforeseDokument8 SeitenEletroforeseAmanda BandeiraNoch keine Bewertungen
- Análise de Proteínas Por Eletroforese em Gel de Poliacrilamida (Sds-PageDokument11 SeitenAnálise de Proteínas Por Eletroforese em Gel de Poliacrilamida (Sds-PageLarissa CalixtoNoch keine Bewertungen
- Relatório Da Aula Prática 11 - EletroforeseDokument7 SeitenRelatório Da Aula Prática 11 - Eletroforeseandressa quadraNoch keine Bewertungen
- Método Sanger SequenciamentoDokument13 SeitenMétodo Sanger SequenciamentoEnnyo CrispimNoch keine Bewertungen
- Tecnicas de Analise de DNA e RNADokument31 SeitenTecnicas de Analise de DNA e RNAAline CunhaNoch keine Bewertungen
- Apostila Prática 1B - EletroforeseDokument5 SeitenApostila Prática 1B - EletroforeseJéssica N. CostaNoch keine Bewertungen
- BALC - Aula 10 - EletroforeseDokument10 SeitenBALC - Aula 10 - EletroforeseBruna CostaNoch keine Bewertungen
- Aula 4 Genetica ForenseDokument6 SeitenAula 4 Genetica ForenseMarcelo GonzagaNoch keine Bewertungen
- Northern BlotDokument4 SeitenNorthern Blotmusica limaNoch keine Bewertungen
- S (FBM) 1819LSDokument77 SeitenS (FBM) 1819LSJoão CoelhoNoch keine Bewertungen
- Exame Prático de BioquímicaDokument3 SeitenExame Prático de BioquímicaMarianaNoch keine Bewertungen
- Reação em Cadeia Da Polimerase (PCR)Dokument10 SeitenReação em Cadeia Da Polimerase (PCR)Jean Bressan AlbarelloNoch keine Bewertungen
- Impressões Digitais Genéticas Ou DNA FingerprintingDokument3 SeitenImpressões Digitais Genéticas Ou DNA FingerprintingMelissa FerreiraNoch keine Bewertungen
- Ponto 10 - Técnicas de Biologia Molecular e Suas AplicaçõesDokument8 SeitenPonto 10 - Técnicas de Biologia Molecular e Suas AplicaçõesWellington SoaresNoch keine Bewertungen
- Técnica de Western BlottingDokument24 SeitenTécnica de Western BlottingGustavo HenriqueNoch keine Bewertungen
- Isoladores Elétricos de Porcelana: avaliação do desempenho através do uso de recobrimentos poliméricos hidrofóbicosVon EverandIsoladores Elétricos de Porcelana: avaliação do desempenho através do uso de recobrimentos poliméricos hidrofóbicosNoch keine Bewertungen
- Programa de Limpeza - Processadora de RX (Versão 3.0)Dokument1 SeitePrograma de Limpeza - Processadora de RX (Versão 3.0)Hailton M. Do Amaral FilhoNoch keine Bewertungen
- Shampoo Sem SalDokument12 SeitenShampoo Sem Salkallynealvesg100% (1)
- Conservação Dos Solos Aula - 01 - IntroduçãoDokument21 SeitenConservação Dos Solos Aula - 01 - Introduçãodocumentosdiversos483Noch keine Bewertungen
- Necessidades Nutricionais No IdosoDokument5 SeitenNecessidades Nutricionais No IdosoMario GregoNoch keine Bewertungen
- Unidade 1 - Introdução - Relação Entre Estruturas e Propriedades Dos MateriaisDokument37 SeitenUnidade 1 - Introdução - Relação Entre Estruturas e Propriedades Dos MateriaisJoão Victor BertoldoNoch keine Bewertungen
- Zoologia Agr+¡cola Da Classe InsectaDokument55 SeitenZoologia Agr+¡cola Da Classe InsectaAltair SofiatiNoch keine Bewertungen
- Interação Antigeno AnticorpoDokument57 SeitenInteração Antigeno AnticorpoelaineuezoNoch keine Bewertungen
- TF 11 PortuguesDokument32 SeitenTF 11 PortuguesRenato CostaNoch keine Bewertungen
- Biologia ExercíciosDokument3 SeitenBiologia Exercíciosdamazio-iespaNoch keine Bewertungen
- Oliveira Et Al. 2013 PDFDokument4 SeitenOliveira Et Al. 2013 PDFlynthener1003616Noch keine Bewertungen
- Capítulo 16 - A Microcirculação e o Sistema Linfático - Trocas Capilares, Líquido Intersticial e Fluxo de Linfa - 3 PáginasDokument3 SeitenCapítulo 16 - A Microcirculação e o Sistema Linfático - Trocas Capilares, Líquido Intersticial e Fluxo de Linfa - 3 PáginasandreamokadaNoch keine Bewertungen
- Manifestações Patológicas - IntroduçãoDokument34 SeitenManifestações Patológicas - IntroduçãoElmer cesar MouraNoch keine Bewertungen
- Sabor Doces Gourmet - Apostila de Design de Bolos (Grátis)Dokument37 SeitenSabor Doces Gourmet - Apostila de Design de Bolos (Grátis)Bolos Gourmet100% (2)
- Planta BaixaDokument1 SeitePlanta BaixaAndré GomesNoch keine Bewertungen
- (Apresentação Perrotta1 PDFDokument47 Seiten(Apresentação Perrotta1 PDFMarcelo Mendes SantucciNoch keine Bewertungen
- Produção de Anidrido Ftálico A Partir Do NaftalenoDokument36 SeitenProdução de Anidrido Ftálico A Partir Do NaftalenoJOAO VICTOR MORAES AMORIMNoch keine Bewertungen
- Estrutura e Função Da HemoglobinaDokument18 SeitenEstrutura e Função Da HemoglobinaAfonso MoraisNoch keine Bewertungen
- Relatório - Prática 2 (Evidências de Transformações Químicas)Dokument7 SeitenRelatório - Prática 2 (Evidências de Transformações Químicas)stephanieclcordovaNoch keine Bewertungen
- 4º Bimestre - Aula 10 - LipídiosDokument45 Seiten4º Bimestre - Aula 10 - LipídiosFlavio Cardoso NetoNoch keine Bewertungen
- Alfa Laval Manual de Instruções Trocador de Calor M10 MFO - Serie - 30.112.89.975 - Ano2010Dokument54 SeitenAlfa Laval Manual de Instruções Trocador de Calor M10 MFO - Serie - 30.112.89.975 - Ano2010Valdir LermenNoch keine Bewertungen
- Elaboração Do Mapa de RiscoDokument19 SeitenElaboração Do Mapa de Riscolcs2006mvNoch keine Bewertungen
- 16 Questões Química Básica - Parte 2Dokument9 Seiten16 Questões Química Básica - Parte 2lucasecamiladNoch keine Bewertungen
- Leis de NewtonDokument5 SeitenLeis de Newtonsuldamerica_suldamericaNoch keine Bewertungen
- EG-C-406 Pisos Industriais Rev 6Dokument17 SeitenEG-C-406 Pisos Industriais Rev 6Marcelo Rubens F. SilvaNoch keine Bewertungen
- Fispq - Gel Repelente Pombos e MorcegosDokument4 SeitenFispq - Gel Repelente Pombos e MorcegosDEDETEC SERVIÇOS DE IMUNIZAÇÃO LTDANoch keine Bewertungen
- RELATÓRIO OSMOSE e EFEITOS EXTERNOS NA MEMBRANA DA BETERRABADokument13 SeitenRELATÓRIO OSMOSE e EFEITOS EXTERNOS NA MEMBRANA DA BETERRABACaliandra Cardoso0% (1)