Beruflich Dokumente
Kultur Dokumente
HOJA 5-2014-I Final Envio
Hochgeladen von
Yul LopeCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
HOJA 5-2014-I Final Envio
Hochgeladen von
Yul LopeCopyright:
Verfügbare Formate
CICLO ACADMICO 2014-I
SEMANA 05
2. Reaccin Endotrmica (H > 0): Absorben energa. Reactantes productos H= + N2( g )+O2( g ) 2 NO( g ) H= +180,5 kJ D. De acuerdo a la fase en que se desarrollan 1. Reaccin Heterognea: Se caracterizan por la presencia de dos o ms fases. 3 Cl2( g ) + 2 Al ( s ) 2 AlCl3 ( s ) 2. Reaccin Homognea: Se da en una sola fase. 2 SO3( g ) 2 SO2( g ) + O2( g )
QUMICA
CAPITULO V REACCIONES Y ECUACIONES QUMICAS
REACCIN QUMICA. Es un proceso donde unas sustancias llamadas reactivos, se transforman en otras llamados productos. Se produce la ruptura de enlaces en los reactivos y la formacin de nuevos enlaces en los productos, razn por la cual hay variacin en la energa. Toda reaccin qumica se puede representar mediante E. De acuerdo al cambio del nmero de oxidacin una ecuacin qumica: Reaccin de Oxidacin y Reduccin (REDOX) 1H 2 SO4 2 NaCl 1Na2 SO4 2 HCl Se caracterizan porque en ellas, ocurre simultneamente dos fenmenos: La oxidacin y la REACTANTES PRODUCTOS reduccin. Existe transferencia de electrones de un Donde: 1, 2, 1, 2 se denominan coeficientes tomo a otro. estequiomtricos. Oxidacin Evidencias prcticas de una reaccin qumica: E.O. -3 -2 -1 0 +1 +2 +3 +4 Formacin de precipitado. Reduccin Desprendimiento de gases. Ejemplo: NH3 + Cl2 NH4Cl + N2 Variacin de la energa. 2N-3 N20 + 6e- (oxidacin) Cambio de color, sabor u olor. Cl2 + 2e- 2Cl- (reduccin) A veces estos cambios son imperceptibles. Reduccin: gana electrones, el estado de oxidacin TIPOS DE REACCIONES QUIMICAS disminuye algebraicamente. A. Segn la naturaleza de los reaccionantes. Oxidacin: pierde electrones, el estado de oxidacin 1. Reaccin de Combinacin, Adicin Sntesis: aumenta algebraicamente. A + B AB Agente reductor.- Es toda sustancia que se oxida. S + O2 SO2 Agente oxidante.- Es toda sustancia que se reduce. 2. Reaccin de Descomposicin: Esquema de una reaccin REDOX AB A + B Pierde electrones Cu(OH)2 (s) CuO (S) + H2O (S) 3. Reaccin de desplazamiento o sustitucin simple: Agente Agente Forma Forma A + BC AC + B
I2 + H2S 2HI+ S
4. Reaccin de Desplazamiento Doble (METATESIS): No redox. AB + CD AC + BD CaF2 + H2SO4 CaSO4 + 2 HF B. De acuerdo al Sentido de la Reaccin 1. Reaccin Reversible: Doble sentido NH3 + H2O NH4+ + OH2. Reaccin Irreversible: Un solo sentido HCl + NaOH H2O + NaCl C. De acuerdo a su Energa 1. Reaccin Exotrmica (H < 0): Libera energa. Reactantes productos H= AgBr(S) +Cl2( g ) AgCl (s) +Br2( g ) H= -6,58 Kcal
reductor
oxidante
oxidada
reducida
Gana electrones
BALANCEO DE ECUACIONES QUMICAS 1. Mtodo de Tanteo: Vlido por lo general para reacciones sencillas, para ello se debe aplicar la siguiente regla:
1 Metal; 2 No metal; 3 Hidrgeno; 4 Oxgeno
2. MTODO REDOX Hallar el estado de oxidacin de cada elemento presente en la reaccin.
CENTRO PREUNIVERSITARIO
UNSCH
CICLO ACADMICO 2014-I
SEMANA 05
Se separa las sustancias en 2 semireacciones, una II. C4H10(g) + O2 (g) CO2(g) + H2O(g) de oxidacin y otra de reduccin. Se igualan estas III.Al(OH)3(s)+ H3PO4(ac) AlPO4 (s) + H2O (i) dos semireacciones con respecto a la masa y con respecto a la carga. A) Mettesis; desplazamiento; mettesis Se igualan el nmero de electrones perdidos y B) Neutralizacin; sntesis; combustin ganados para ello se multiplican las C) Mettesis; descomposicin; mettesis semireacciones por los menores nmeros enteros. D) Desplazamiento simple; combustin; Colocar los coeficientes determinados en el mettesis. balanceo en la ecuacin original. E) Doble sustitucin; mettesis, combustin Si algunos elementos faltan balancear, se balancea por tanteo. 05. Marque la proposicin correcta: 3. MTODO IN ELECTRN A) La variacin de entalpa () de una reaccin A. En medio cido (H+). Por cada tomo de oxgeno qumica es el calor absorbido o liberado en el que falte, se aade una molcula de agua y por cada curso de la misma a presin constante. tomo de H que falte, se agrega un in H+. B) En toda reaccin exotrmica la entalpa de los B. En medio bsico (OH-) Por cada tomo de oxgeno reactivos es menor que la de los productos. en exceso, Se aade una molcula de agua en el C) La energa de activacin es la mayor energa mismo lado y en el otro se aade el doble de iones OHque se requiere para alcanzar a formar el llamada complejo activado. EJERCICIOS D) En toda reaccin endotrmica la variacin de la entalpa es negativa. 01. Indique lo correcto, en relacin a los cambios que E) En toda reaccin exotrmica la variacin de la ocurre en una reaccin qumica. entalpa es positiva. A) El ncleo atmico no se destruye. B) Todas liberan energa en forma de calor. C) Segn el nmero de oxidacin pueden ser 06. En las siguientes semireacciones, el total de electrones perdidos es: exotrmicas o endotrmicas. D) Producen tomos de nuevos elementos. I. Na Na+1 E) Slo hay rupturas de enlaces II. F2 F 1III. S 2+ S 6+ 02. Marque la alternativa que contenga a una reaccin de 3+ IV. Cr Cr2 6+ mettesis y no redox a la vez. A) 8 B) 10 C) 11 D) 20 E) 14 A) 4Fe + 3O2 2Fe2O3 B) 2HBr(g) H2(g) + Br2(g) 07. Halle la suma de coeficientes estequiomtricos C) Mg(s) + 2HCl(ac) MgCl2(ac) + H2(g) para la siguiente ecuacin balanceada: D) AgNO3(ac) + KCl(ac) AgCl(s) + KNO3(ac) a Al(OH)3 + b H2SO4 c Al2(SO4)3 +d H2O A) 6 B) 3 C) 4 D) 12 E) 11 E) N2(g) + 3 H2(g) 2NH3 (g) Indique verdadero (V) o falso (F) en la relacin a la 08. Determine el estado de oxidacin del Mn, N, I y P, en las siguientes especies qumicas; siguiente reaccin qumica. respectivamente: C2H4(g) + H2 C2H6 (g) + 137KJ I. MnO2 I. Es una reaccin de adicin. II. NH4Cl II. Es una reaccin endotrmica. III. (IO4)1III. La ecuacin qumica esta balanceada. IV. (HPO4)2A) VVF B) VVV C) FFV D)VFV E) VFF A) 4 , 3- , 7, 5 B) 3, 5, 7, 5 C)4, 5, 3-,2D) 3-, 7, 5, 2- E) 1, 3, 3, 7 04. Clasifique cada una de las reacciones que se indican, respectivamente: 09. En las siguientes ecuaciones qumicas: I. Fe(s)+ HCl(ac) FeCl2(ac) + H2 (g) 03.
CENTRO PREUNIVERSITARIO
UNSCH
CICLO ACADMICO 2014-I
I) 2 Cu + O2 2 CuO II) 2 KClO3 2 KCl(s) +3O2(g) Qu elementos se reducen? A) Cu y O B) K y Cl D) Cu y Cl E) O y Cl 10.
3
14.
SEMANA 05
Completar la semireaccin y marque la proposicin correcta. Br - Br 5+ I. El Br - se oxida. II. El Br 5+ es la forma oxidada. III. El Br - es el agente reductor. IV. Pierde 6 electrones. A)Todas B) II y III C) slo III D) slo I E) III y IV Determinar el coeficiente estequiomtrico del agente reductor, en la siguiente ecuacin qumica: Cl2 + HBr Br2 +HCl A)2 B) 5 C) 8 D)3 E) 4 Indicar la alternativa correcta: PbS + H2O2 PbSO4 + H2O A) El H2O2 es el agente oxidante B) La forma reducida es el PbSO4 C) El PbS es la forma oxidada. D) El PbS es el agente oxidante. E) El H2O es el agente reductor. En la siguiente reaccin qumica: I2O5 + CO I2 + CO2 Determine el coeficiente del agente reductor. A)5 B) 6 C) 7 D)8 E) 1 Respecto a la siguiente Reaccin redox: Cl2 + KOH KCl +KClO3 + H2O Cul es el coeficiente del Cl2 gaseoso? A)6 B) 5 C) 8 D)2 E) 4 En la reaccin cul es la alternativa correcta? NaClO + AgNO3 NaNO3 + AgClO3 + AgCl A) El Na es el que se reduce. B) El AgClO3 es la forma oxidada C) El AgNO3 se reduce. D) El AgCl es la forma oxidada. E) El N es el agente reductor. Balancee la ecuacin por el mtodo in electrn (medio cido) e indique el coeficiente del agua: Zn + NO3- Zn2+ + NO A) 4 B) 5 C) 6 D) 7 E) 8 Balancee la ecuacin por in electrn en medio bsico: MnO4- + I- MnO2 + I2 Indique el coeficiente del OHA) 2 B) 4 C) 6 D) 7 E) 8
C) O y K
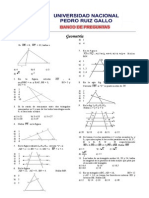
Para la siguiente reaccin por el mtodo del tanteo: P4 (g) + Cl2 (g) PCl3 (g) Determinar el coeficiente estequiomtrico del Cl2. 15. A) 2 B) 3 C)4 D) 5 E) 6 Luego de balancear por tanteo la siguiente ecuacin qumica, indique la suma de los coeficientes de los productos. 16. Ca(OH)2 + H3PO4 Ca3(PO4)2 + H2O A) 9 B) 7 C) 6 D) 10 E) 3 Balancear la reaccin por tanteo, seale el coeficiente del HCl. H2S + Cl2 + H2O HCl + H2SO4 A)3 B) 5 C) 8 D)2 E) 4 De la siguiente grfica, Qu afirmacin es 17. correcta?
(Kcal) 70 -----------------------
11.
12.
13.
18.
19.
50 H2+Cl2
15 ------------------------------------- HCl Avance de la reaccin
20.
A) B) C) D) E)
La energa de activacin es 10 Kcal. El proceso es endotrmico Se libera 20 Kcal. La entalpa de reaccin es -35 Kcal. Se absorbe 20 Kcal.
21.
CENTRO PREUNIVERSITARIO
UNSCH
Das könnte Ihnen auch gefallen
- 11 PDFDokument13 Seiten11 PDFbrayan abelNoch keine Bewertungen
- Sintitul 13 PDFDokument16 SeitenSintitul 13 PDFHRNoch keine Bewertungen
- Comprensión de lectura en el examen de admisión UNMSMDokument55 SeitenComprensión de lectura en el examen de admisión UNMSMHenry De AriesNoch keine Bewertungen
- SabadofIPbEbWdajs DesbloqueadoDokument60 SeitenSabadofIPbEbWdajs DesbloqueadoMARCOABADNoch keine Bewertungen
- Examen San Marcos 2015Dokument61 SeitenExamen San Marcos 2015Zona PreNoch keine Bewertungen
- Sol Unmsm 2014-Ii - Adekrdgsf56kklDokument60 SeitenSol Unmsm 2014-Ii - Adekrdgsf56kklHenry De AriesNoch keine Bewertungen
- solucionario-ADUNI 2016 IDokument45 Seitensolucionario-ADUNI 2016 Ibrownstonex100% (2)
- Razonamiento VerbalDokument28 SeitenRazonamiento VerbalAcademia-pre Adeu75% (4)
- Examen UNI 2011 de Aptitud Académica y Cultura GeneralDokument25 SeitenExamen UNI 2011 de Aptitud Académica y Cultura GeneralJAFEBYNoch keine Bewertungen
- Unmsm 2015 HumanidadesDokument55 SeitenUnmsm 2015 HumanidadesZona Pre100% (1)
- Sol Unmsm 2014Dokument53 SeitenSol Unmsm 2014jonaSoftNoch keine Bewertungen
- Sol Mateuni2011i PDFDokument13 SeitenSol Mateuni2011i PDFÓscar Cárdenas TorresNoch keine Bewertungen
- Examen Sab19set-UnmsmDokument48 SeitenExamen Sab19set-UnmsmJessica JohnsonNoch keine Bewertungen
- Sol Unmsm 2014-2Dokument58 SeitenSol Unmsm 2014-2jonaSoft100% (1)
- Domingo IAxd SW 0 Js Qe 0Dokument55 SeitenDomingo IAxd SW 0 Js Qe 0Henry De AriesNoch keine Bewertungen
- Solucionario San Marrcos 2014Dokument54 SeitenSolucionario San Marrcos 2014jonaSoft100% (1)
- Examen Talento Catolica 2015I PDFDokument41 SeitenExamen Talento Catolica 2015I PDFLudgar YinoNoch keine Bewertungen
- Examen Talento Catolica 2015IIDokument35 SeitenExamen Talento Catolica 2015IIMitchell Calixto0% (3)
- Examen Talento Catolica 2015IIDokument35 SeitenExamen Talento Catolica 2015IIMitchell Calixto0% (3)
- Fisica-UNPRGDokument22 SeitenFisica-UNPRGJoel Cabrera RomeroNoch keine Bewertungen
- PsicologiaDokument18 SeitenPsicologiaAcademia-pre Adeu100% (1)
- QuimicaDokument20 SeitenQuimicaAcademia-pre Adeu67% (3)
- LenguajeDokument17 SeitenLenguajeAcademia-pre Adeu100% (1)
- BiologiaDokument17 SeitenBiologiaAcademia-pre Adeu100% (3)
- EconomiaDokument18 SeitenEconomiaAcademia-pre Adeu100% (3)
- HistoriaDokument20 SeitenHistoriaAcademia-pre Adeu100% (2)
- AnatomiaDokument16 SeitenAnatomiaAcademia-pre Adeu100% (1)
- Razonamiento MatematicoDokument23 SeitenRazonamiento MatematicoAcademia-pre Adeu75% (4)
- Álgebra fundamentalDokument15 SeitenÁlgebra fundamentalThewilson H. Ramos100% (1)
- Geometria-UNPRGDokument15 SeitenGeometria-UNPRGJulio1029100% (1)
- 02 Calculo de Balance de Materia en Diferentes Unidades de ProcesosDokument22 Seiten02 Calculo de Balance de Materia en Diferentes Unidades de ProcesosDannert Bravo PadillaNoch keine Bewertungen
- Modulo3 Calentamiento Crudo PDFDokument72 SeitenModulo3 Calentamiento Crudo PDFNancho SarayNoch keine Bewertungen
- Plan Emergencias Quifa SWDokument30 SeitenPlan Emergencias Quifa SWFrank HernandezNoch keine Bewertungen
- Sistemas de Deteccion Vs Incendios y Normativa NFPA 72 y 101 en LA 03 Sistemas de Deteccion Vs Incendio y Evacuacion Segun Normativa NFPA 72 y 101 en Latinoamerica Manuel Villanueva Honeywell NotifierDokument45 SeitenSistemas de Deteccion Vs Incendios y Normativa NFPA 72 y 101 en LA 03 Sistemas de Deteccion Vs Incendio y Evacuacion Segun Normativa NFPA 72 y 101 en Latinoamerica Manuel Villanueva Honeywell NotifierRedes CertificadasNoch keine Bewertungen
- Guia Sobre El Medio Ambiente, Salud y Seguridad - Plantas de Manejo de Residuos PDFDokument42 SeitenGuia Sobre El Medio Ambiente, Salud y Seguridad - Plantas de Manejo de Residuos PDFJavier Francisco Herrera BahamonNoch keine Bewertungen
- Balances de masa y energíaDokument6 SeitenBalances de masa y energíaAbigailNoch keine Bewertungen
- Pegamento Azul PVC PegalonDokument7 SeitenPegamento Azul PVC PegalonEdithNoch keine Bewertungen
- 59 HDS Motonic 2 T Api TC R5Dokument5 Seiten59 HDS Motonic 2 T Api TC R5Genaro PachecoNoch keine Bewertungen
- 200122-Oxigeno MedicinalDokument3 Seiten200122-Oxigeno MedicinalRodrigo Apaza TiconaNoch keine Bewertungen
- Planta TostadoraDokument176 SeitenPlanta TostadoraCarlos Fam Torres Trejo100% (5)
- Formulación y nomenclatura en química inorgánicaDokument71 SeitenFormulación y nomenclatura en química inorgánicaDavid MoroNoch keine Bewertungen
- Instalaciones industriales - Clasificación y características de calderasDokument11 SeitenInstalaciones industriales - Clasificación y características de calderasNico FalzoneNoch keine Bewertungen
- Combustibles limpios y renovablesDokument13 SeitenCombustibles limpios y renovablesAgustin Estudillo MarquezNoch keine Bewertungen
- CalderasDokument24 SeitenCalderasDavid Santiago BarreraNoch keine Bewertungen
- Proyecto Horno Rotatorio Quemador 1Dokument9 SeitenProyecto Horno Rotatorio Quemador 1Cesar Ivan Hernandez JimenezNoch keine Bewertungen
- Calderas Con Lecho FluidizadoDokument21 SeitenCalderas Con Lecho FluidizadoEdson Vereau Rosas100% (1)
- Método Reformado en Vapor NH3Dokument11 SeitenMétodo Reformado en Vapor NH3Crezpo YzNoch keine Bewertungen
- Cajas Moldeo - unsaACDokument25 SeitenCajas Moldeo - unsaACyezetaNoch keine Bewertungen
- Apuntes ExplosivosDokument154 SeitenApuntes Explosivosrodriahum100% (3)
- Escuela Técnica Superior de Ingenieros Industriales y deDokument184 SeitenEscuela Técnica Superior de Ingenieros Industriales y defredl1Noch keine Bewertungen
- HS - Compact HealthDokument5 SeitenHS - Compact HealthCalidad Clave UnoNoch keine Bewertungen
- Selección suavizador calderas 40GPGDokument15 SeitenSelección suavizador calderas 40GPGFran Mendoza MendozaNoch keine Bewertungen
- RESOLUCIÓN NÚMERO 0491 DE 2020 Espacios ConfinadosDokument60 SeitenRESOLUCIÓN NÚMERO 0491 DE 2020 Espacios ConfinadosKñon AidaNoch keine Bewertungen
- 5 FabulasDokument4 Seiten5 FabulasCarlos C. ReyesNoch keine Bewertungen
- Ciclo Otto: eficiencia del motor de explosiónDokument5 SeitenCiclo Otto: eficiencia del motor de explosiónJulio CesarNoch keine Bewertungen
- Balance de EnergiaDokument21 SeitenBalance de EnergiaHugo Alejandro TorresNoch keine Bewertungen
- CD 6325 PDFDokument125 SeitenCD 6325 PDFSamuel Inca MárquezNoch keine Bewertungen
- Hoja de Datos de Seguridad Lubricante AutomotrizDokument8 SeitenHoja de Datos de Seguridad Lubricante AutomotrizIVAN HUBERT MEDRANO TERRELNoch keine Bewertungen
- Tratado de QuimicaDokument531 SeitenTratado de QuimicaJorge Osvaldo Sanchez100% (1)
- Experimento de CombustiónDokument12 SeitenExperimento de Combustiónfiorella chuaca quispeNoch keine Bewertungen