Beruflich Dokumente
Kultur Dokumente
Attachment
Hochgeladen von
Jennifer VillaCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Attachment
Hochgeladen von
Jennifer VillaCopyright:
Verfügbare Formate
Cintica de la corrosin a alta temperatura del cobre Franco Jorge, Narvez Camacho Jaime Facultad de Ciencias Bsicas, Departamento
de Ciencias Naturales Exactas y Estadsticas, Programa de Qumica, Laboratorio de Fisicoqumica III (Cintica) 21 de febrero de 2012 Cali Resumen En la practica de laboratorio se determino la cinetica de corrosin de una lamina de metal a alta temperatura, la cual consisti en someter 7 laminas de cobre a diferentes condiciones de tiempo y temperatura, en la primera parte del laboratorio se trabajo a una temperatura de 600 C sometiendo 5 laminas previamente limadas y pesadas a estas condiciones, cada una de estas se iba retirando por un espacio de 30 minutos trancurridos entre una y otra completando asi 2.5 horas, a cada placa se le retiraba la placa de oxido formada y se pesan. La segunda parte del laboratorio consisti en someter laminas de cobre previamente limadas y pesadas a 400 y 500 C respectivamente durante un lapso total de 2.5 horas , finalmente se les retira la capa de oxido y se pesan, Para determinar cuanta cantidad de cobre se pierde en la corrosin. Se calcul la y cintica del proceso el cual fue Y5,685 = 8,356 x10-5 * t. Para determinar se recojieron datos a diferentes temperaturtas pero cvon el ismo tiempo de exposicin a la corrosin se obtuvieron para 400C un G = -184.48 Kj/mol, para 500 un G = - 152.63 kJ / mol y para 600C un G = -142.10 Kj/mol, en la grafica de ln K vs 1/T obtuvo una pendiente negativala cual es igual a Ea/R y as se remplaz en la ecuacin de Arrhenius . Palabras claves: Corrosin, mufla, alta temperatura, cobre, cintica, tiempo, Arrhenius. Introduccin La corrosin a altas temperaturas es una forma de corrosin que no requiere la presencia de un electrolito lquido. En la mayor parte de los ambientes industriales, la oxidacin a menudo participa en las reacciones de corrosin a alta temperatura, independientemente del modo predominante de corrosin. Las aleaciones a menudo dependen de la reaccin de oxidacin para desarrollar una capa protectora que resista los ataques de corrosin tales como sulfuracin, carburizacin y otras formas de ataque a altas temperaturas. En general, los nombres del mecanismo de corrosin vienen determinados por los productos de corrosin dominantes ms abundantes. Por ejemplo, la oxidacin implica xido, la sulfuracin implica sulfuros, etc. Los ambientes oxidantes se refieren a actividades con alto contenido en oxgeno, con exceso de oxgeno. Los ambientes reductores se caracterizan por actividades de bajo contenido en
oxgeno, sin exceso de oxgeno disponible. Claramente, la formacin de escalas de xido son ms limitadas bajo tales condiciones reductoras. Es por este motivo que los ambientes industriales reductores se consideran generalmente ms corrosivos que la variedad oxidante. Sin embargo, hay importantes excepciones a esta generalizacin. A altas temperaturas, los metales pueden reaccionar directamente con la atmsfera gaseosa. Las secuencias de reacciones electromecnicas quedan como el mecanismo de corrosin a alta temperatura. Las propiedades de los films a alta temperatura, tales como la estabilidad termodinmica, estructura de defecto inico, y morfologa detallada, juegan un papel crucial en determinar la resistencia a la oxidacin de un metal o aleacin. La corrosin a alta temperatura es un problema extendido en varias industrias tales como: Generacin de energa (nuclear y combustibles fsiles). Aeroespacial y turbinas de gas. Tratamiento trmico. Procesado de minerales y metalurgia. Procesos qumicos. Refino y petroqumica. Automocin. Papel. Incineracin de residuos. Para que un xido sea protector a altas temperaturas debe poseer las siguientes condiciones: (1) buena adherencia, (2) punto de fusin alto, (3) baja presin de vapor, (4) coeficiente de expansin trmico casi igual al del metal, (5) plasticidad a alta temperatura para evitar su ruptura, (6) baja conductividad elctrica, y (7) bajo coeficiente de difusin para iones metlicos y oxgeno.1
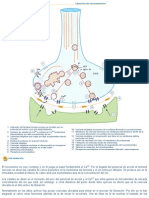
De manera ms general, la corrosin puede entenderse como la tendencia general que tienen los materiales a buscar su forma ms estable o de menor energa interna. Siempre que la corrosin est originada por una reaccin electroqumica (oxidacin), la velocidad a la que tiene lugar depender en alguna medida de la temperatura, de la salinidad del fluido en contacto con el metal y de las propiedades de los metales en cuestin. Otros materiales no metlicos tambin sufren corrosin mediante otros 2 mecanismos. La figura 1 muestra el proceso de la oxidacin de un metal en aire. La formacin del xido se presenta de modo general mediante la siguiente ecuacin qumica.
Una vez se forma el xido el proceso continuo por difusin. La reduccin de la sustancia agresiva y la oxidacin del metal ocurren en diferentes interfaces de una capa que recubre la superficie metlica. Si la presin parcial del oxgeno en el aire o en la atmosfera oxidante es mayor que la presin de equilibrio de descomposicin del xido el proceso es espontaneo, de lo contrario el oxgeno no atacar al metal.
En general la ley cintica de corrosin se puede expresar mediante la ecuacin:
Placa 2
Placa 3
Si n es igual a 1 se tiene una cintica lineal, si n es igual a 2 la cintica es de tipo parablico, para valores de n mayores que 2 pero menores que 3 se tiene una ley de potencias para el proceso de corrosin. Tambin se da el caso de n es mayor que 1 y menor que 2, en este caso se presenta un control difusivo-cintico del proceso; es decir, se presenta una combinacin entre la ley lineal y la parablica. 3 Objetivos Determinar la cintica de la corrosin de un metal a alta temperatura. Realizar la corrosin de cobre a distintas temperaturas y a diferentes tiempos
Placa 4
Placa 5
Tabla 2. Datos necesarios para la grfica de la corrosin del cobre a 600 C. Placa de cobre 1 2 3 4 5 tiempo (h) 0.5 1.0 1.5 2.0 2.5 Peso Peso final Corrosin inicial (g) Cu2O (g) (g) 10,0378 9,6414 0,3964 5,9170 7,1664 5,8002 5,4791 6,6718 5,2677 0,4379 0,4722 0,4946 0,5325 12,4507 11,9785
Datos y Clculos Tabla 1. Datos obtenidos a 600 C para la corrosin del cobre
Grafica 1. Cintica de la corrosin del cobre a 600 C 0 -0.05 1.2 1.7 2.2
Con la estequiometria se puede determinar la cantidad de cobre que se perdi en el proceso:
-0.1 -0.15 -0.2 -0.25 -0.3
Por lo tanto: Placa 1
-0.35 -0.4 -0.45 -0.5 y = 0.1761x - 0.7183 R = 0.9788
Por lo tanto: Pendiente = 0.1761 Intercepto = -0,7183 Se sabe que: m = 1/n Despejamos: n = 1/m n = 1/0.1761 = 5,679 Placa 2 Por lo tanto: Placa 1
Placa 3
Tabla 4. Perdida en la corrosin de cobre a 400, 450 y 600C. Tiempo (min) 90 90 90 Temperatura 400 500 600 Perdida de cobre (g) 0.0540 0.1684 0.4774
-0,7181 x 5,679 = log Kn -4,078 = log Kn Se le saca antilogaritmo a ambos lados y se tiene que: Kn = 8,356 x10-5 Y5,685 = 8,356 x10-5 * t Tabla 3. Datos obtenidos para la corrosin del cobre a 400, 450 y 600C. Placa T ( de C) cobre 1 400 2 3 Peso inicial (g) 9,7543 Peso Corrosin final (g) Cu2O (g) 9,6935 5,2627 0,0608 0,5375
A continuacin se calcula el G para cada uno de las distintas temperaturas, se mostraran los clculos para la reaccin a 400 C, para las temperaturas de 500 y 600 C solo deben cambiarse las variables de temperatura (solo se mostrara el resultado): Para la temperatura a 400C = 673.15 K
500 11,0117 10,8221 0,1896 600 5,8002
Con la estequiometria se puede determinar la cantidad de cobre que se perdi en el proceso:
cinetica de la corrosion a diferentes T
0.000 0 -0.500 -1.000 -1.500 -2.000 -2.500 y = -6032.1x + 6.2298 R = 0.9345 -3.000 -3.500 ln w vs 1 / T Linear (ln w vs 1 / T) 0.0005 0.001 0.0015 0.002
De igual forma para 500 y 600 C Para la temperatura a 500 C (773.15 K)
Para la temperatura a 600 C (873.15 K)
Discusin de resultados
Tabla 5. Datos obtenidos para la grafica de la corrosin del cobre a 400, 500 y 600 C Cu2O (g) T (C)
En 1889. Arrhenius descubri que la dependencia de muchas reacciones como funcin de la temperatura se podra describir mediante la siguiente ecuacin:
W Cu perdid 1/T Ln w o (g) 0,0608 400 673,15 0,054 0,00148 -2,919 Donde k es la constante de rapidez, A es el denominado factor de frecuencia o 0,1896 500 773,15 0,1684 0,00138 -1,781 factor preexponencial, Ea es la energa 0,5375 600 873,15 0,4774 0,00114 -0,739 de activacin (Kj/mol), R es la constante de los gases y T es la temperatura absoluta. La energa de activacin es la mnima cantidad de Grafica 2. Cintica de la corrosin del energa que se requiere para iniciar una cobre a distintas temperaturas (400, reaccin qumica. El factor de 450 y 600C) a un tiempo de 2.5 horas frecuencia, A, representa la frecuencia de las colisiones entre las molculas reactivas. El factor exp(-Ea/RT) representa la fraccin de las colisiones T (K)
moleculares con energa igual o mayor que la energa de activacin, Ea. Debido a que el termino exponencial es un nmero, las unidades de A son las mismas unidades de la constate de rapidez (s-1 para las constantes de rapidez de primer orden; M-1 s-1 para las constantes de rapidez de segundo orden, y asi sucesivamente). Debido a que el factor de frecuencia A esta relacionado con las colisiones moleculares, depende de la temperatura. Sin embargo, en un intervalo limitado de temperatura (50), la variacin predominante de la temperatura est considerada en el trmino exponencial. Al aplicar el logaritmo natural a la ecuacin anterior se obtiene:
diferentes temperaturas, si se conoce Ea. Desde el punto de vista de la ecuacin de Arrhenius, al comprensin completa de los factores que determinan la constante de rapidez de una reaccin requiere que se puedan calcular ambos valores, A y Ea.4 Por lo tanto: m = -0,1761= -Ea/R Calculamos k para la temperatura entre 723.15 y 873.15 K: ( )
De esta manera, un grfico de ln contra 1/T, da lugar a una lnea recta cuya pendiente, que es negativa, es igual a Ea/R, k y A se consideran adimensionales. De manera alternativa, si se conocen las constantes de rapidez k1 y k2 a T1 y T2, se tiene:
Si restamos las obtenemos que: ( )
dos
ecuaciones
La ecuacin anterior nos permite calcular la constante de rapidez a
El cobre es un material que combina buena resistencia a la corrosin, excelente manejabilidad, alta conduccin trmica y elctrica, y atractivas propiedades mecnicas a baja, normal y moderadamente elevadas temperaturas.5 Cuando el metal de cobre (Cu) se coloc a elevadas temperaturas ocurri la corrosin reaccionando el cobre directamente con el oxgeno, en este procedimiento la presin parcial del oxgeno en el aire oxidante es mayor que la presin en equilibrio de descomposicin del xido, este proceso es espontaneo ya que si no fuera no podra ocurrir la oxidacin del metal.
Cuando se realiz el procedimiento en el cual las placas permanecan a una temperatura constante pero variando el tiempo, se pudo observar que a medida que aumentaba el tiempo ocurra una mayor corrosin. La ley cintica que que se obtuvo fue yn = Kn x t = (Y5,685 = 8,356 x10-5 * t). Esto se debe a que los productos de la corrosin formados no introdujeron ningn impedimento al movimiento de iones o electrones, esto ocurre si los productos de corrosin son eliminados de manera inmediata una vez que se forman, lo que implica su evaporacin o fusin. Como se observ los datos obtenidos en los clculos de la energa libre G los valores dieron negativos, lo que nos indica de manera termodinmica que el metal presenta corrosin, se forma una capa de xido en la superficie la cual se quita y se observa que cantidad de cobre se ha perdido. Tanto el cobre como sus aleaciones son utilizados en muchos entornos y aplicaciones, debido a si excelente resistencia a la corrosin, que esta acoplado con una combinacin de otras propiedades deseables, tales como la conductividad trmica y elctrica, la facilidad de fabricacin y de unin, amplia gama de propiedades mecnicas posible y resistencia a la contaminacin biolgica.6 En este caso se observ que la corrosin ocurre por el oxgeno, el cual es un tipo de corrosin que ocurre generalmente en superficies expuestas al oxigeno diatmico disuelto en agua o al aire, se ve favorecido por altas temperaturas u presin elevada, un ejemplo claro de ello son las calderas a vapor. La corrosin en las maquinas
trmicas representa una constante prdida de rendimiento y vida til de la instalacin.7 Conclusiones Se puede concluir que a mayor tiempo de exposicin a una misma temperatura ocurre una mayor corrosin y por ende mas perdida de cobre metalico. Se logr determinar que a una temperatura mayor presenta mayor corrosin. Se determin que la corrosin en los metales se debe a que son sometidos a gases oxidantes con el oxgeno en condiciones altas de temperatura, lo cual provoca que reaccionen directamente con ellos sin la presencia de un electrolito. Se estableci que el G para cada una de las corrosiones a distintas temperaturas fue negativa, lo que nos indica que para que ocurra la corrosin del cobre a altas temperaturas se debe tener un cambio en la energa libre para la formacin de xido de cobre. Preguntas 1. Encontrar la ley oxidacin del cobre Ver hoja de calculos 2. Calcular la energa de activacin del proceso de corrosin a altas temperaturas de los metales Datos insuficientes para realizar los clculos. cinetica de
3. Cules son los factores que influyen en la velocidad de corrosin a altas temperaturas de los metales? R/ Potencial elctrico de los metales: Cuando dos metales estn en contacto a travs de un lquido se produce una corrosin galvnica o electroltica. El grado de corrosin depende fundamentalmente de la diferencia de potencial elctrico existente entre los dos metales en contacto. Cuanto ms bajo (negativo) sea el potencial de un metal, ms fcilmente resultara corrodo; del mismo modo cuando mayor sea la diferencia de potencial entre los dos metales en contacto, tanto mayor ser la corrosin galvnica producida entre ambos, siempre en perjuicio del de menor potencial. Por ejemplo: Metal Potencial elctrico V Na -2.71 Mg -2.38 Al -1.67 Mn -1.05
Velocidad: Un aumento en la velocidad del movimiento relativo entre una solucin corrosiva y una superficie metlica tiende a acelerar la corrosin, influyendo las sustancias oxidantes (oxigeno), lleguen a la superficie que se corroe y a la mayor rapidez con que los productos de la corrosin misma, se retiran. Agentes oxidantes: Los agentes oxidantes que aceleran la corrosin de algunos materiales pueden retrasar la corrosin de otras, mediante la formacin en sus superficies de xidos o capas de oxigeno absorbidos que los hacen ms resistentes a los ataques qumicos. Acidez de la solucin: La velocidad de corrosin de la gran parte de los metales es afectada por el pH. Los metales solubles en acido, como el hierro, el nivel de pH medio (aprox. 4 a10) la velocidad de corrosin est controlada por la velocidad de transporte del oxidante Zn Fe Ni Pb H (generalmente oxgeno disuelto) -0.76 -0.44 -0.25 -0.13 0 a la superficie metlica temperaturas muy altas la velocidad de corrosin aumenta con el incremento de la basicidad.8 4. Cules son los principales mtodos de proteccin contra la corrosin de metales a altas temperaturas? R/ Diseo: El diseo de las estructuras del metal, estas pueden retrasar o incluso eliminar la corrosin. Recubrimientos: Estos son usados para aislar las regiones andicas y catdicas e impiden la difusin del oxgeno o del vapor de agua los cuales son una gran fuente que inicia la corrosin o la oxidacin.
Formacin de pelculas: Los productos insolubles de la corrosin pueden ser completamente impermeables al lquido corrosivo, por eso son totalmente protectores, o impermeables y permitir la corrosin local y general sin obstculos. Las pelculas pueden tener tendencia a absorber la humedad o retenerla, incrementando la corrosin resultante de la exposicin a la atmosfrica o los vapores corrosivos. Temperatura: La corrosin tiende a aumentar al elevar la temperatura ya que esta posee efectos secundarios mediante su influencia en la solubilidad del aire, que es la sustancia ms comn que influye en la corrosin.
Eleccin del material: La primera idea es escoger todo un material que no se corroa en el ambiente considerado. Se pueden utilizar aceros inoxidables, aluminios, cermicas, polmeros (plsticos), FRP, etc. La eleccin tambin debe tomar en cuenta las restricciones de la aplicacin (masa de la pieza, resistencia a la deformacin, al calor, capacidad de conducir la electricidad, etc.). Cabe recordar que no existen materiales absolutamente inoxidables; hasta el aluminio se puede corroer. En la concepcin, hay que evitar las zonas de confinamiento, los contactos entre materiales diferentes y las heterogeneidades en general. Hay que prever tambin la importancia de la corrosin y el tiempo en el que habr que cambiar la pieza (mantenimiento preventivo). Dominio del ambiente: Cuando se trabaja en ambiente cerrado (por ejemplo, un circuito cerrado de agua), se pueden dominar los parmetros que influyen en la corrosin; composicin qumica (particularmente la acidez), temperatura, presin... Se puede agregar productos llamados "inhibidores de corrosin". Un inhibidor de corrosin es una sustancia que, aadida a un determinado medio, reduce de manera significativa la velocidad de corrosin. Las sustancias utilizadas dependen tanto del metal a proteger como del medio, y un inhibidor que funciona bien en un determinado sistema puede incluso acelerar la corrosin en otro sistema. Sin embargo, este tipo de solucin es inaplicable cuando se trabaja en medio abierto (atmsfera, mar, cuenca en contacto con el medio natural, circuito abierto, etc.)
Inhibidores de la corrosin: Es el traslado de los productos qumico que se agrega a una solucin electroltica hacia la superficie del nodo o del ctodo lo cual produce polarizacin. Los inhibidores de corrosin, son productos que actan ya sea formando pelculas sobre la superficie metlica, tales como los molibdatos, fosfatos o etanolaminas, o bien entregando sus electrones al medio. Por lo general los inhibidores de este tipo son azoles modificados que actan sinrgicamente con otros inhibidores tales como nitritos, fosfatos y silicatos. La qumica de los inhibidores no est del todo desarrollada an. Su uso es en el campo de los sistemas de enfriamiento o disipadores de calor tales como los radiadores, torres de enfriamiento, calderas y "chillers". El uso de las etanolaminas es tpico en los algunos combustibles para proteger los sistemas de contencin (como tuberas y tanques).Y adems la inhalacin es mala para los pulmones Se han realizado muchos trabajos acerca de inhibidores de corrosin como alternativas viables para reducir la velocidad de la corrosin en la industria. Extensos estudios sobre IC y sobre factores que gobiernan su eficiencia se han realizado durante los ltimos 20 aos. Los cuales van desde los ms simples que fueron a prueba y error y hasta los ms modernos los cuales proponen la seleccin del inhibidor por medio de clculos tericos.9 Bibliografa 1. http://todoproductividad.blogspot.c om/2011/09/estudiando-lacorrosion-altas.html Revisado 19 de febrero de 2012
2. http://es.wikipedia.org/wiki/Corrosi %C3%B3n. 17 de febrero de 2012 3. Guas de laboratorio fisicoqumica III Cintica de la corrosin a alta temperatura 4. CHANG, R. Fisicoqumica. 3ed. Mxico: Mc Graw Hill, 2008, p. 470471. 5. http://cabierta.uchile.cl/revista/9/ar ticulos/Articulo4.f.html. Revisado 2 octubre 2011. 6. http://www.keytometals.com/Article 16.htm. Revisado 4 - octubre 2011. 7. http://es.wikipedia.org/wiki/Corrosi %C3%B3n#Corrosi.C3.B3n_por_ox. C3.ADgeno. Revisado 1 - octubre 2011. 8. http://www.monografias.com/trabaj os60/corrosion/corrosion2.shtml. Revisado 4 - octubre 2011. 9. http://es.wikipedia.org/wiki/Corrosi %C3%B3n#Protecci.C3.B3n_contra _la_corrosi.C3.B3n. Revisado 6 octubre 2011.
Das könnte Ihnen auch gefallen
- Módulo 7. Episodio 1. Se Tu Propio BiodescodificadorDokument4 SeitenMódulo 7. Episodio 1. Se Tu Propio BiodescodificadorBlankita Saloso67% (3)
- Trastornos Del Deseo SexualDokument93 SeitenTrastornos Del Deseo SexualMilissen Michel Nava VazquezNoch keine Bewertungen
- Equipos de Proteccion y Seccionamiento PCDokument90 SeitenEquipos de Proteccion y Seccionamiento PCJose Nikol Cruz PérezNoch keine Bewertungen
- Test III Psico GerminativoDokument3 SeitenTest III Psico GerminativoNUA GINER100% (2)
- CorrosionDokument4 SeitenCorrosionJennifer Villa100% (1)
- AVIONESDokument4 SeitenAVIONESJennifer VillaNoch keine Bewertungen
- MacromoleculasDokument24 SeitenMacromoleculasJennifer VillaNoch keine Bewertungen
- Hierro en Sulfato de AluminioDokument15 SeitenHierro en Sulfato de AluminioJennifer VillaNoch keine Bewertungen
- For Ga 010 v0 Formato Certificado Recoleccion Residuos SolidosDokument2 SeitenFor Ga 010 v0 Formato Certificado Recoleccion Residuos SolidosLuisa Fernanda Chavarria EspinosaNoch keine Bewertungen
- Trabajo Final Transferencia de Calor Grupo de JoseDokument6 SeitenTrabajo Final Transferencia de Calor Grupo de JoseGabriel LezcanoNoch keine Bewertungen
- Microbiología Primer ParcialDokument353 SeitenMicrobiología Primer ParcialNatySarmientoNoch keine Bewertungen
- Complejo SnareDokument2 SeitenComplejo SnareJavier Eduardo Aravena VelasquezNoch keine Bewertungen
- Evaluación III UNIDAD DANZAS PUEBLOS ORIGINARIOS 2 BÁSICODokument4 SeitenEvaluación III UNIDAD DANZAS PUEBLOS ORIGINARIOS 2 BÁSICOCamila Paz Farias CorreaNoch keine Bewertungen
- Informe HeladoDokument13 SeitenInforme HeladoPam STNoch keine Bewertungen
- Ficha de ReligiónDokument3 SeitenFicha de ReligiónJavier CrisNoch keine Bewertungen
- Microbiología - Wikipedia, La Enciclopedia LibreDokument7 SeitenMicrobiología - Wikipedia, La Enciclopedia LibreReyna MalpasoNoch keine Bewertungen
- f16.Mo18.Pp Formato Iniciativa Comunitaria v4Dokument20 Seitenf16.Mo18.Pp Formato Iniciativa Comunitaria v4Diego MuñozNoch keine Bewertungen
- 1º Informe - Leche y Productos LácteosDokument8 Seiten1º Informe - Leche y Productos Lácteosmadeleyn reyNoch keine Bewertungen
- Bosques de MacroalgasDokument7 SeitenBosques de MacroalgasYaneth MendozaNoch keine Bewertungen
- Erika Informe1 Listo1Dokument22 SeitenErika Informe1 Listo1liliNoch keine Bewertungen
- Bioquímica Estructural (Bloque I)Dokument100 SeitenBioquímica Estructural (Bloque I)juanNoch keine Bewertungen
- Tema27 y 28Dokument10 SeitenTema27 y 28NathaliaMarquezNoch keine Bewertungen
- Tucutunemo Ficha de Reportes 2019 Mes XXXXXDokument404 SeitenTucutunemo Ficha de Reportes 2019 Mes XXXXXCarmen DiazNoch keine Bewertungen
- Nota Urgencias 33Dokument1 SeiteNota Urgencias 33Luis NoriegaNoch keine Bewertungen
- ROSALES ASENSIO Enrique TesisDokument258 SeitenROSALES ASENSIO Enrique TesisAnonymous N5WmOlNoch keine Bewertungen
- Trabajo Final Escrito Sobre Los Fundamentos Del CurriculumDokument5 SeitenTrabajo Final Escrito Sobre Los Fundamentos Del Curriculumclaudia montesNoch keine Bewertungen
- RM 092 2014 Mem DMDokument51 SeitenRM 092 2014 Mem DMalarcon_figmmNoch keine Bewertungen
- Proceso de EnfermeriaDokument2 SeitenProceso de Enfermeriajuanpablo9017Noch keine Bewertungen
- Caso 4 DE NUEVODokument2 SeitenCaso 4 DE NUEVOManuel Martinez0% (1)
- Fiesta Marie Poussepin 2018Dokument10 SeitenFiesta Marie Poussepin 2018Luz KarimeNoch keine Bewertungen
- Guia Etica 3Dokument4 SeitenGuia Etica 3ricardo torresNoch keine Bewertungen
- Cuadro Comparativo Proyecto de VidaDokument2 SeitenCuadro Comparativo Proyecto de VidaCamilo ToroNoch keine Bewertungen
- Cirugía Laparoscópica A Través de Incisión ÚnicaDokument6 SeitenCirugía Laparoscópica A Través de Incisión ÚnicaKarito PérezNoch keine Bewertungen
- Fabricación de Cables de CobreDokument2 SeitenFabricación de Cables de CobreEduardo RomeroNoch keine Bewertungen