Beruflich Dokumente
Kultur Dokumente
Informe 5 Orga
Hochgeladen von
Walter Cadenas VásquezCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Informe 5 Orga
Hochgeladen von
Walter Cadenas VásquezCopyright:
Verfügbare Formate
UNIVERSIDAD NACIONAL DE INGENIERA FACULTAD DE INGENIERA QUMICA Y TEXTIL REA ACADMICA DE INGENIERA QUMICA
LABORATORIO DE QUMICA ORGNICA I QU-325/B
Prctica de Laboratorio N5 Anlisis Conformacional y Configuracional
N de grupo: Integrantes: 35 Cadenas Vsquez, Walter Jess Cspedes Godoy, Anthony Csar Flores Estrada, Fabrizio Alexander Profesora: Ing. Cristina Viza Llenque
Fecha de realizacin de la prctica: Fecha de presentacin del informe:
08 de Mayo del 2013 22 de Mayo del 2013
Anlisis Conformacional y Configuracional
QU325/B
LIMA-PER
CONTENIDO DEL INFORME
Pgina
I.
Objetivos
II.
Fundamento Terico
III.
Resultados
IV.
Observaciones
V.
Conclusiones
VI.
Bibliografa
VII.
Apndice
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
QU325/B
Prctica de Laboratorio N5: Anlisis Conformacional y Configuracional
I.
OBJETIVOS
Reconocer los diferentes tipos de tensiones en las distintas conformaciones de las molculas orgnicas (angular, torsional y de Van der Waals). Identificar las conformaciones notables y relacionarlas mediante una grfica de energa potencial versus ngulo de rotacin. Disear la configuracin de una molcula dado el nombre y viceversa. Analizar la enantiomera de cicloalcanos disustituidos (estereoismeros cis y trans).
II.
FUNDAMENTO TERICO
Anlisis Conformacional Se denomina confrmeros a las diferentes disposiciones espaciales de los sustituyentes, generados por la libre rotacin de los enlaces C-C sp3. De acuerdo a las interacciones y/o tensiones que presenta cada una, presenta mayor o menor energa potencial, establecindose que los confrmeros pueden presentar diferentes niveles de estabilidad y de energa. Entre las tensiones ms importantes tenemos: a) Tensin angular.- Es el factor responsable de elevar la energa potencial de la molcula debido a que el ngulo de enlace se desva de lo que impone la hibridacin, sobreentendiendo que cuanto ms nos desviemos de este ngulo, mayor ser la tensin angular (los cicloalcanos). b) Tensin torsional.- Es el factor que eleva la energa potencial debido al eclipsamiento de los enlaces. Es decir las densidades electrnicas de estos enlaces eclipsados se repelen estricamente y elevan la energa potencial. c) Tensin de Van der Waals.- Es el factor responsable de variar la energa potencial debido a las interacciones de los sustituyentes, que pueden ser de dos tipos: Si los sustituyentes son polares se puede producir fuerzas atractivas por interacciones moleculares, que disminuyen la energa potencial de la molcula.
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
QU325/B
De las infinitas conformaciones solo estudiaremos las notables, las conformaciones eclipsadas que por lo general siempre son de mayor energa y las conformaciones alternadas que por lo general son de menor energa; no obstante dentro de cada una de las conformaciones notables puede haber diferencias. Como la temperatura medio ambiental proporciona entre 15 y 20 kcal/mol como energa cintica media en el etano, por ejemplo, la diferencia de energa entre las conformaciones eclipsada y alternada es de aprox. 3 kcal/mol, entonces se produce libre rotacin por lo que los confrmeros no se pueden separar; lo que sucede con muchas molculas orgnicas. Cicloalcanos En el caso de los cicloalcanos el anlisis conformacional tiene que implicar necesariamente el anlisis de la tensin angular (desviacin al abrir o cerrar el ngulo de la hibridacin de 109,5 en el anillo). La tensin angular en el ciclopropano, por ejemplo, implica desviarnos del ngulo que impone la hibridacin que en el caso del ciclopropano implica que los orbitales no estarn sobre el eje internuclear generando un deficiente grado de solapamiento. Conformaciones del ciclohexano Debido a la libre rotacin de los enlaces simples C-C los ciclohexanos presentan diferentes conformaciones notables: 1. Conformacin Silla.- Es la conformacin ms estable debido a que no tiene tensin angular ni tensin torsional. Solo se pueden analizar interacciones diaxiales 1-3, que al ser tomos de hidrgeno no los consideramos pero en el caso de ser grupos voluminosos se analizan las interacciones estricas. 2. Conformacin Semisilla.- Es la conformacin menos estable debido a que se genera tensin angular y tensin torsional debido a que una parte de la molcula se hace plana. 3. Conformacin bote retorcido.- Despus de la conformacin silla es la ms estable, se genera cuando la conformacin Semisilla libera la tensin angular. 4. Conformacin bote.- Es la conformacin menos estable despus de la semisilla, debido a que tiene cierta tensin torsional y repulsiones estricas por interacciones en asta 1-4. Estereoisomera Es el estudio de los estereoismeros en una relacin dicotmica, como enantimeros o diasteremeros.
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
QU325/B
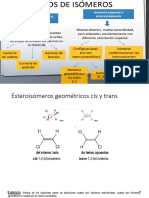
Enantimeros Son los estereoismeros que tienen una relacin objeto - imagen especulada no superponible, y la condicin suficiente y necesaria para que exista la enantiomera es la asimetra de la molcula. Es decir, si la molcula es asimtrica (solo tiene ejes propios de simetra) existirn enantimeros. Si la molcula tiene plano de simetra, centro de simetra o ejes impropios de simetra, el objeto con la imagen especulada se superpone y no existe enantiomera representando ambas relaciones la misma molcula. Diasteremeros Son los estereoismeros que no son enantimeros. Es decir, los estereoismeros que no tienen relacin objeto imagen especular. Por lo general sus propiedades fsicas son diferentes y muchas de sus propiedades qumicas pueden variar. Los diasteremeros requieren la presencia mnima de dos tomos de carbono quiral o de los ismeros cis trans. Forma Meso Son las relaciones objeto imagen especular superponible debido a la presencia de un plano de simetra, representando ambas relaciones la misma molcula. Las formas meso se dan cuando la molcula tiene dos o ms carbonos quirales. Conformacin vs Configuracin en ciclohexanos disustituidos En el caso de ciclohexanos disustituidos las relaciones objeto imagen especular pueden llegar a ser enantiomera conformacional. Es decir, mientras no cambie la conformacin existe la enantiomera. Pero como las 2 conformaciones silla son interconvertibles estas podran lograrse superponer por lo que se dira que no existe enantiomera configuracional. Mejor dicho, este ciclohexano disustituido no presenta enantiomera. El cis-1,2-dimetilciclohexano, presenta enantiomera? Hay relacin objeto imagen especular no superponible, son enantimeros conformacionales. Debido al cambio conformacional estos se logran superponer por lo que realmente no existe enantiomera configuracional. Es decir no son verdaderos enantimeros. El trans-1,2-dimetilciclohexano, presenta enantiomera? Hay relacin objeto imagen especular no superponible, son enantimeros conformacionales. Despus del cambio conformacional estos no logran superponerse, por lo que tambin existe enantiomera configuracional. Es decir, s son verdaderos enantimeros.
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
III. OBSERVACIONES
QU325/B
El cambio de la conformacin silla 1 a silla 2 en el ciclohexano la posicin axial (sea un sustituyente o hidrogeno) pasa a la posicin ecuatorial y viceversa. En la conformacin asta bandera en el ciclohexano; en un asta un sustituyente voluminoso, al momento de juntar poco a poco se observ el acercamiento del grupo metilo y el hidrogeno de los carbonos -1,4 lo cual se puede comparar con el solapamiento de las nubes electrnicas con las molculas de esta conformacin. En la conformacin semisilla del ciclohexano, al momento de formar el plano se sinti las tensiones angulares del modelo que era inestable. En los modelos nbutano e isopentano se observ al grupo voluminoso de conformacin eclipsada a conformacin alternada.
IV.
CONCLUSIONES
Cuando una molcula tiene un solo carbono quiral no existe la posibilidad del plano de simetra por lo que las relaciones objeto imagen especular son enantimeros. Si una molcula tiene ms de 2 carbonos quirales las relaciones objeto imagen especular sern de la forma meso si existe plano de simetra y enantimeros si no existe plano de simetra. A la misma especificacin configuracional le corresponde la misma molcula. A una especificacin configuracional opuesta (RR-SS / RS-SR) le corresponde una relacin objeto - imagen especular, si hay plano de simetra se tratara de las formas meso, que representan la misma molcula y si no hay plano de simetra se tratara de enantiomeros. Los disustituyentes polares como el radical hidroxilo se estabilizan en la posicin gauche pues se genera el enlace puente hidrogeno (con elementos F, O, N), disminuyendo la energa potencial. Si esta interaccin se da dentro de la misma molcula se tratara de un enlace intramolecular, pero si se forma el puente de hidrogeno entre dos molculas cercanas se tratara de una fuerza de atraccin intermolecular.
V.
BIBLIOGRAFA
Qumica Orgnica I UNI Editorial Universitaria-1ra Edicin-2008-Jorge Brea Ore/Enrique Neira Montoya-pag59-92 Qumica Orgnica-Editorial Pearson-5ta Edicion-2010-L.G.Wade, Jr-pag80-100
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
QU325/B
VI.
APNDICE
DOLOMIN TITULO: "Quiralidad en las Drogas Antirreumticas." AUTOR: Kean WF, Lock CJ y Howard-Lock HE. CITA: Lancet 338:1565-1568, Dic 1991. REVISTA: [Chirality in Antirrheumatic Drugs] MICRO: Las propiedades diferenciales de los enantimeros de un frmaco pueden explicar las variaciones en la respuesta al tratamiento y en la susceptibilidad a los efectos adversos. RESUMEN Introduccin El uso de molculas quirales en la prctica clnica puede causar problemas, advierten los autores, ya que distintas formas quirales (enantimeros) pueden tener diferentes actividades biolgicas. Ms del 80% de estas drogas quirales slo estn disponibles como racematos (mezcla de enantimeros), lo cual en algunos casos se debe al elevado costo del mtodo de separacin de los enantimeros. Smbolos de derecha e izquierda Las molculas quirales, explican, se clasifican siguiendo distintos sistemas y mediante diferentes smbolos (+/-, d/l, D/L, R/S). Si una solucin de la sustancia rota el plano de la luz polarizada en el sentido de las agujas del reloj se dice que la rotacin es + o d (dextro) mientras que si lo hace en sentido contrario es - o l (levo). Los trminos D y L se refieren a la configuracin espacial absoluta de la molcula quiral, pero no guardan necesariamente relacin con las propiedades d/l de la molcula. En cambio, el sistema D/L indica la similitud de la molcula con la configuracin espacial de las 2 formas quirales del gliceraldehdo. Los sistemas +/-, d/l y D/L estn cayendo en desuso, comentan, y actualmente la quiralidad de las molculas orgnicas se describe con el sistema S/R. Los tomos quirales de carbono deben ser asimtricos, es decir unidos a 4 grupos qumicos diferentes formando un tetraedro. Para aplicar el sistema S/R, estos grupos son calificados segn el nmero atmico del tomo ligado directamente al carbono y se establece un orden de prioridad decreciente. Si este orden sigue el sentido de las agujas del reloj, el tomo quiral es R, mientras que en caso contrario es S. A su vez, destacan, las configuraciones S y R pueden tener rotacin especfica positiva o negativa.
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
Quiralidad y prctica clnica
QU325/B
Las distintas formas quirales de un frmaco pueden tener propiedades biolgicas y expresiones clnicas diferentes, recalcan los autores. Esto no resulta sorprendente ya que muchas de las molculas biolgicas son quirales y existen en sistemas vivientes slo como uno de los enantimeros. Algunos expertos han sugerido utilizar los trminos eutmero y distmero para referirse a los enantimeros con mayor y menor actividad farmacolgica, respectivamente. El uso del eutmero debera tener ventajas clnicas, especulan, ya que el distmero podra ser metabolizado a toxinas o a productos con acciones farmacolgicas desfavorables, o podra contribuir a los efectos adversos del frmaco o inclusive contrarrestar la accin del eutmero. Por ejemplo, los enantimeros S(-) y R(+) de la talidomida y la mezcla racmica de la misma son igualmente activos como hipnticos, pero los efectos embriotxicos y teratognicos se deben nicamente al metabolismo de la forma S. Penicilamina La importancia de la quiralidad en la reumatologa, sealan los autores, es ilustrada por la penicilamina, un frmaco ampliamente utilizado en la actualidad para tratar la artritis reumatoidea. Se indica slo la forma D(S) de la droga ya que la L(R) y el racemato son mucho ms txicos, produciendo efectos adversos como la neuritis ptica. La toxicidad del enantimero L se debera a su incorporacin a las protenas, apuntan, lo cual no sucede con la forma D puesto que las protenas animales estn formadas exclusivamente por Laminocidos. Aurotiomalato sdico El aurotiomalato sdico, explican los autores, sufre polimerizacin dando un hexmero en el cual el tiomalato se une a 2 tomos de oro a travs del tomo de azufre. El cido tiomlico es quiral, por lo cual si se usa una mezcla racmica del mismo en la fabricacin del aurotiomalato se obtienen 7 hexmeros de distinta quiralidad en las proporciones 1:6:15:20:15:6:1. Aunque puede sintetizarse aurotiomalato a partir de las formas puras d(+) o l(-) de cido tiomlico, sealan, si se mezclan los hexmeros todo (+) y todo (-) se produce un intercambio de ligandos dando la mezcla de 7 hexmeros en las proporciones antes indicadas.
Laboratorio de Qumica Orgnica I
Anlisis Conformacional y Configuracional
Antiinflamatorios no esteroideos
QU325/B
En la prctica clnica slo se usan los anlogos de la S-indometacina, ya que la actividad farmacolgica de esta droga reside casi exclusivamente en ellos. Aunque para muchos antiinflamatorios no esteroideos (AINE) la actividad biolgica de la forma S es mucho mayor que la de la forma R, indican, slo el naproxeno es administrado como forma S pura. La inhibicin de la agregacin plaquetaria alcanza buen nivel con los enantimeros S del flurbiprofen y el naproxeno, pero no con las formas R. Quiralidad y reumatologa clnica Aunque in vitro la actividad antiinflamatoria del S(+)-ibuprofeno es mucho mayor que la de la forma R, comentan, la potencia de ambos enantimeros es similar in vivo. La explicacin para esta discrepancia es una inversin estereoselectiva in vivo de la forma R a la forma S (pero no de la S a la R). Esta inversin ha sido comprobada tambin en el caso de fenoprofeno y el benoxaprofeno, y es probable que ocurra con otros miembros de este grupo. La inversin estereoselectiva puede guardar relacin tambin con algunas formas de toxicidad, sealan los autores. Por ejemplo, el ster tiol-coenzima A formado por los cidos arilpropinicos puede ligarse a triglicridos formando un hbrido que puede alterar el metabolismo de los cidos grasos y la funcin de la membrana plasmtica. El que los cidos S-arilpropinicos no puedan ser invertidos a la forma R potencialmente txica, y que constituyan adems la forma farmacolgicamente activa, sustenta el uso clnico del enantimero S puro. Las interacciones entre drogas quirales y drogas no quirales pueden generar efectos an ms sutiles. La fenilbutazona no es quiral pero inhibe el metabolismo oxidativo de la S-warfarina, que es 5 veces ms potente que la R-warfarina. Comentario: Aunque es improbable que las diferencias entre enantimeros en cuanto a eficacia y toxicidad sean tan notorias como en el caso de la penicilamina y la talidomida, segn el artculo, tales diferencias pueden explicar muchas de las variaciones intrigantes en la respuesta al tratamiento y en la susceptibilidad a los efectos adversos y las interacciones farmacolgicas de estas drogas. Resumen objetivo elaborado por el Comit de Redaccin Cientfica de SIIC en base al artculo original completo publicado por la fuente editorial. Sociedad Iberoamericana de Informacin Cientfica (SIIC) 2002
Laboratorio de Qumica Orgnica I
Das könnte Ihnen auch gefallen
- Notas de AIDADokument184 SeitenNotas de AIDAluisfernandoacNoch keine Bewertungen
- Informe de Laboratorio EstereoquímicaDokument13 SeitenInforme de Laboratorio EstereoquímicaJavier VillarrealNoch keine Bewertungen
- Análisis ConformacionalDokument7 SeitenAnálisis Conformacionalrebeca olivares quispeNoch keine Bewertungen
- ESTEREOQUÍMICADokument88 SeitenESTEREOQUÍMICARicardo Alfonso Trujillo SantillanaNoch keine Bewertungen
- Analisis Conformacional y ConfiguracionalDokument16 SeitenAnalisis Conformacional y ConfiguracionalMiguel Makishi VelásquezNoch keine Bewertungen
- Tema 3 Quimica OrganicaDokument5 SeitenTema 3 Quimica OrganicaClaudia RuizNoch keine Bewertungen
- CONFÓRMEROSDokument24 SeitenCONFÓRMEROSPriscila CruzNoch keine Bewertungen
- Teoria de EnlacesDokument16 SeitenTeoria de EnlacesKevin CHeemsNoch keine Bewertungen
- GC 5 Geometria MolecularDokument7 SeitenGC 5 Geometria MolecularJihmy Ivan MuñozNoch keine Bewertungen
- Química Orgánica - 1 - ML - U3Dokument14 SeitenQuímica Orgánica - 1 - ML - U3Rodrigo Ruiz DíazNoch keine Bewertungen
- JhonDokument25 SeitenJhonRoberto VeluetaNoch keine Bewertungen
- Organica 3 Teoria 2Dokument17 SeitenOrganica 3 Teoria 2Diego Padilla Santos100% (1)
- Unidad 4 Estereoquimica PDFDokument51 SeitenUnidad 4 Estereoquimica PDF6U3RR3R0_-_129Noch keine Bewertungen
- Consulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.Dokument10 SeitenConsulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.BryanAngamarcaNoch keine Bewertungen
- Glosario Químico - Unidad IiDokument7 SeitenGlosario Químico - Unidad IiGenesis CardenasNoch keine Bewertungen
- Geometria Electronica QuimicaDokument10 SeitenGeometria Electronica QuimicaBryanAngamarcaNoch keine Bewertungen
- Tema 4 FisiologiaDokument38 SeitenTema 4 FisiologiamariarafuNoch keine Bewertungen
- Portafolio de Evidencias Quimica Organica - KAOADokument13 SeitenPortafolio de Evidencias Quimica Organica - KAOAKauris OvandoNoch keine Bewertungen
- Quimica Organica TrabajoDokument30 SeitenQuimica Organica TrabajoFanny JacanamijoyNoch keine Bewertungen
- ISOMERIADokument37 SeitenISOMERIADavid AinetNoch keine Bewertungen
- Quimica 3Dokument3 SeitenQuimica 3Michelle ValdezNoch keine Bewertungen
- Guia de Estudio para Estereoquímica - Sistemas Químicos IIDokument9 SeitenGuia de Estudio para Estereoquímica - Sistemas Químicos IIJuan Diego Zapata Monsalve100% (1)
- Conformaciones Del CiclohexanoDokument24 SeitenConformaciones Del CiclohexanoFabian DlcQNoch keine Bewertungen
- Tarea 2 U2Dokument6 SeitenTarea 2 U2DANIELA LOPEZ ROCHANoch keine Bewertungen
- Isomería de Compuestos OrgánicosDokument45 SeitenIsomería de Compuestos OrgánicosLuigui GarciaNoch keine Bewertungen
- IsomeriaDokument3 SeitenIsomeriaRewop WenNoch keine Bewertungen
- Guía Tema 3 (Intensivo)Dokument16 SeitenGuía Tema 3 (Intensivo)annyNoch keine Bewertungen
- Química Practica N °4Dokument15 SeitenQuímica Practica N °4Jade Meza SotoNoch keine Bewertungen
- Geometría MolecularDokument10 SeitenGeometría MolecularRashellNoch keine Bewertungen
- Unidad 1: Teoria Estructural EstereoisomerosDokument13 SeitenUnidad 1: Teoria Estructural EstereoisomerosjosmairychprNoch keine Bewertungen
- Alcanos e Isomeros ConformacionalesDokument20 SeitenAlcanos e Isomeros ConformacionalesPablo BarriosNoch keine Bewertungen
- Sebast Quimica Organica Efectos-Electronicos-Acidos-y-Bases-en-Quimica-OrganicaDokument21 SeitenSebast Quimica Organica Efectos-Electronicos-Acidos-y-Bases-en-Quimica-OrganicaRichard Galindez100% (1)
- ResonanciaDokument11 SeitenResonanciaWalther JesusNoch keine Bewertungen
- Laboratorio 5 de OrganicaDokument14 SeitenLaboratorio 5 de OrganicaJuniorZeladaNoch keine Bewertungen
- Conformaciones de Los Decanos ExposicionDokument6 SeitenConformaciones de Los Decanos Exposicion1477 neverNoch keine Bewertungen
- Evaluacion Diagnostic A Bioquim. IDokument4 SeitenEvaluacion Diagnostic A Bioquim. IMichael HernandezNoch keine Bewertungen
- 1.1.3. - Modelo de Orbitales MolecularesDokument5 Seiten1.1.3. - Modelo de Orbitales MolecularesALANNoch keine Bewertungen
- EstereoquimicaDokument7 SeitenEstereoquimicaYovana RojasNoch keine Bewertungen
- Efecto Mesomérico o de ResonanciaDokument11 SeitenEfecto Mesomérico o de ResonanciaAdriana CarranzaNoch keine Bewertungen
- Practica2 - Actividades PreviasDokument8 SeitenPractica2 - Actividades PreviasfernandaNoch keine Bewertungen
- Enlaces CovalentesDokument6 SeitenEnlaces CovalentesLeidy Johana ReinosaNoch keine Bewertungen
- Practica N6 - Rivera Dolmos Stacy Nicole MariluDokument7 SeitenPractica N6 - Rivera Dolmos Stacy Nicole MariluStacy RiveraNoch keine Bewertungen
- Estereoisomeria EquipoDokument12 SeitenEstereoisomeria Equipojorge460000Noch keine Bewertungen
- Enlaces Sigma y Enlaces PiDokument2 SeitenEnlaces Sigma y Enlaces PiIsrael Cortes100% (3)
- IsómerosDokument19 SeitenIsómerosClemente JoseNoch keine Bewertungen
- Tema 4 Teoría Del Orbital MolecularDokument15 SeitenTema 4 Teoría Del Orbital MolecularVale ITreNoch keine Bewertungen
- IsomeríaDokument23 SeitenIsomeríaUliannys VillegasNoch keine Bewertungen
- EstereoisomeriaDokument7 SeitenEstereoisomeriaReudil A. Minayas ReyesNoch keine Bewertungen
- 5 EstereoquímicaDokument15 Seiten5 Estereoquímicasaulcarvajal23Noch keine Bewertungen
- Estructura Informe Fase 2Dokument14 SeitenEstructura Informe Fase 2GrismaldoMeriñoMezaNoch keine Bewertungen
- Investigacion de HibridacionDokument10 SeitenInvestigacion de HibridacionArmandopoloNoch keine Bewertungen
- Estereoquimica NomenclaturaDokument22 SeitenEstereoquimica NomenclaturaHiri Ch M OlNoch keine Bewertungen
- Sesión 1 - Repaso de Química General 2022Dokument40 SeitenSesión 1 - Repaso de Química General 2022Yankarlo OrdoñezNoch keine Bewertungen
- Química-Conformación de Los Alcanos - Jimena, César y HellenDokument24 SeitenQuímica-Conformación de Los Alcanos - Jimena, César y Hellenitsel murilloNoch keine Bewertungen
- Tarea AC05 ConfiguraciónDokument5 SeitenTarea AC05 ConfiguraciónJESSICA GUADALUPE BANUELOS JIMENEZNoch keine Bewertungen
- Resumen Unidad I.Dokument19 SeitenResumen Unidad I.EstefaniNoch keine Bewertungen
- Orbital MolecularDokument2 SeitenOrbital Molecularap22020071Noch keine Bewertungen
- Isometría en La MedicinaDokument2 SeitenIsometría en La MedicinaAlonso LeonardoNoch keine Bewertungen
- Aminoácidos, Péptidos y ProteínasDokument79 SeitenAminoácidos, Péptidos y Proteínasmario calaguaNoch keine Bewertungen
- T3 2022 - IsomeriaDokument59 SeitenT3 2022 - IsomeriaGisele Ximena AbbateNoch keine Bewertungen
- Biofarmacia Factores Tecnológicos Que Afectan La Respuesta A Los FármacosDokument23 SeitenBiofarmacia Factores Tecnológicos Que Afectan La Respuesta A Los FármacosDilcerCerna60% (5)
- IsómerosDokument19 SeitenIsómerosClemente JoseNoch keine Bewertungen
- SERIE 3 - Estereoquímica y Análisis ConformacionalDokument13 SeitenSERIE 3 - Estereoquímica y Análisis ConformacionalCami FornisNoch keine Bewertungen
- Nociones Fundamentales de La Quimica BioDokument321 SeitenNociones Fundamentales de La Quimica BioKatie MhNoch keine Bewertungen
- IsomeríaDokument20 SeitenIsomeríaenzofagNoch keine Bewertungen
- Carbohidrato Estereoquimica y ReaccionesDokument25 SeitenCarbohidrato Estereoquimica y ReaccionesJohn DanteNoch keine Bewertungen
- Actividad ÓpticaDokument3 SeitenActividad ÓpticaangelNoch keine Bewertungen
- QOI - Tema 5. EstereoquímicaDokument76 SeitenQOI - Tema 5. EstereoquímicaErnesto RuizNoch keine Bewertungen
- Tema 3 - HidrocarburosDokument87 SeitenTema 3 - HidrocarburosMaria Eugenia MamaniNoch keine Bewertungen
- EJERCICIOS - DE - QU - MICA - ORG - NICA - I - 14-20.docx - Filename - UTF-8''EJERCICIOS DE QUÍMICA ORGÁNICA I 14-20Dokument59 SeitenEJERCICIOS - DE - QU - MICA - ORG - NICA - I - 14-20.docx - Filename - UTF-8''EJERCICIOS DE QUÍMICA ORGÁNICA I 14-20Alee 7U70% (1)
- Estero I Some RosDokument20 SeitenEstero I Some Rosnathaly roxana escobar morenoNoch keine Bewertungen
- ISOMERÍADokument6 SeitenISOMERÍAyubetzys tovarNoch keine Bewertungen
- Semana 10 IsomeriaDokument45 SeitenSemana 10 Isomeriaangel gálvez gaona100% (1)
- Carbohidratos Unmsm EnfermeriaDokument91 SeitenCarbohidratos Unmsm EnfermeriaJerry Luis Montoya ArgumedoNoch keine Bewertungen
- Guía de Practicas de Química IIDokument104 SeitenGuía de Practicas de Química IIDimas AkermanNoch keine Bewertungen
- 2019química Orgánica - TEORÍA PDFDokument17 Seiten2019química Orgánica - TEORÍA PDFXiomara Mesa CNoch keine Bewertungen
- Cartel AminoacidosDokument1 SeiteCartel AminoacidosAdriana ReynaudNoch keine Bewertungen
- Isomeria UNERG1.1Dokument14 SeitenIsomeria UNERG1.1Esther ReyesNoch keine Bewertungen
- Guía Ejercicios IsomeríaDokument6 SeitenGuía Ejercicios IsomeríaFrank Honores Barrios100% (1)
- Informe 4Dokument3 SeitenInforme 4Valeria Alexandra jimenez RicoNoch keine Bewertungen
- Cuestionario de OrganicaDokument38 SeitenCuestionario de OrganicaSantiago LópezNoch keine Bewertungen
- Guia CarbohidratosDokument5 SeitenGuia CarbohidratosRoxana ValladaresNoch keine Bewertungen
- Farmaco Quirales (Trabajo Grupal) Q.organicaDokument16 SeitenFarmaco Quirales (Trabajo Grupal) Q.organicaDiana ContrerasNoch keine Bewertungen
- Compuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónDokument11 SeitenCompuestos de Coordinacion: Números de Oxidación de Los Metales en Los Compuestos de CoordinaciónPao AngamarcaNoch keine Bewertungen
- Archivos de Neurociencias: ISSN 0187 - 4705Dokument83 SeitenArchivos de Neurociencias: ISSN 0187 - 4705KEVIN DANIEL ORTEGA FRANCONoch keine Bewertungen
- ESTEREOQUÍMICADokument12 SeitenESTEREOQUÍMICADiana Mayerly SánchezNoch keine Bewertungen
- Clase 1 2019IIDokument59 SeitenClase 1 2019IIKatty Julieth Rangel GutierrezNoch keine Bewertungen