Beruflich Dokumente
Kultur Dokumente
Proteínas asociadas a membranas celulares
Hochgeladen von
L Miguel LunaOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Proteínas asociadas a membranas celulares
Hochgeladen von
L Miguel LunaCopyright:
Verfügbare Formate
UNIVERSIDAD NACIONAL AUTNOMA DE MXICO FACULTAD DE MEDICINA DEPARTAMENTO DE HISTOLOGA. Profesores: Dr. Lecuona Rodrguez Miguel Alejandro. Dra.
Guerrero lvarez Alejandra. Instructor: Dr. Tllez Manrquez Luis Adrin. Alumno.: Luna Lpez Luis Miguel GLOSARIO DE PROTENAS. GRUPO: 1110
MXICO D.F. 12 DE SEPTIEMBRE 2013
PROTENA
FUNCIN Estn asociadas a las membranas plasmticas y sus cadenas de aminocidos no cruzan completamente la membrana plasmtica, tienen varias maneras de asociacin a la membrana plasmtica: a) inserciones que slo ocupan la monocapa externa o la interna, con lo que quedan ancladas a las membranas. Este tipo de asociacin no es frecuente; b) por interacciones elctricas con protenas o lpidos gracias a la atraccin entre cargas positivas y negativas (fuerzas de van der Waals), estas asociaciones son ms dbiles y las protenas pueden abandonar la membrana con cierta facilidad. En realidad son protenas hidrosolubles; c) por unin covalente de la protena con lpidos de membrana o con un cido graso, lo cual hace que aunque la protena no tenga aminocidos hidrfobos se encuentre anclada a la membrana gracias a los cidos grasos que se encuentran insertados en la zona hidrfoba de la membrana. Estas protenas se asocian mucho con el sealamiento del segundo mensajero. Se encuentra embebida en la bicapa fosfolipidica. Existen 2 tipos: - Protenas integrales transmembranosas: us principales funciones son servir como canales transportadores de iones (canales inicos) o molculas polares como acuaporinas, recepcin de seales celulares, anclaje al citoesqueleto, etc. - Protenas integrales no transmembranosas: Posee muchas uniones como enlaces covalente. En general sirven como canales que permiten el paso de sustancias dentro y fuera de la membrana. Desplazamiento de sustancias a travs de uniones especficas soluto-protena. Actividad enzimtica empujando sustancias hacia dentro y fuera de la membrana Transportan activamente ciertos iones, como el Na+, a travs de las membranas. Tambin transportan a travs de las membranas precursores metablicos de macromolculas, como aminocidos y monosacridos. Participan en la formacin de poros hidroflicos, denominados canales de iones, a travs del plasmalema, estos canales pueden controlarse por medio de compuertas y muy pocos carecen de de stas; su activacin se da por medio de: voltaje ,ligandos, mecnicamente (contacto),la protena G .Son incapaces de transportar sustancias contra un gradiente de concentracin. Permiten el reconocimiento y la fijacin localizada de los ligandos en procesos como la estimulacin hormonal, la endocitosis con formacin de vesculas con cubierta y las reacciones con anticuerpos. Casi todos son
PERIFRICAS
INTEGRALES
Bombas
Canales
Receptoras
glucoprotenas integrales y pueden ser de tres tipos: ligados a canales de iones, enzimas y protenas G.
Ligadoras
Fijan el citoesqueleto intracelular a la matrz extracelular. Ejemplo. Familia de las integrinas que vinculan los filamentos de actina del citoplasma con una protena de la matrz extracelular (fibronectina). Las enzimas que se encuentran en la membrana celular desempean una gran variedad de funciones, como por ejemplo: Las adenosina trifosfatas (ATPasas) desempean funciones especficas en el bombeado de iones, la ATP sintetaza y ciertas enzimas digestivas, como las disacaridasas o las dipeptidasas son protenas integrales de la membrana. La funcin de resistencia o funcin estructural de las protenas tambin es de gran importancia ya que las protenas forman tejidos de sostn y relleno que confieren elasticidad y resistencia a rganos y tejidos. Ejemplo de ello es el colgeno del tejido conjuntivo fibroso, reticulina y elastina del tejido conjuntivo elstico. Con este tipo de protenas se forma la estructura del organismo. Son una familia de protenas de pasos mltiples que forman canales y cuya funcin es permitir el paso de agua de un lado de la membrana celular al otro. Algunos de estos canales son transportadores puros de agua, mientras que otros transportan glicerol. Estas acuaporinas discriminan el transporte de las dos molculas mediante las restriccin del tamao del poro. Las acuaporinas son impermeables a los protones por lo que no pueden cruzar el canal, aunque pase con facilidad por las molculas de agua mediante el proceso de configuracin donadoraaceptora. Tambin llamada ciclasa de adenilato. Es una protena transmembranal cuya regin citoplsmica cataliza la transformacin de ATP en AMP cclico, uno de los segundos mensajeros ms comunes. La calmodulina es una protena acdica con cuatro sitios de unin de Ca de alta afinidad. Cuando la concentracinn intracelular de Ca alcanza valores de 10^-6, la unin de calcio a la calmodulina provoca un cambio en la conformacin de la protena. La calmodulina se asocia con una gran variedad de protenas y, en su estado unido a Ca, modula sus actividades. Es un miembro de la familia de protenas que unen Ca, entre las que tambin se encuentra la troponina que provoca la contraccin del msculo esqueltico como respuesta al aumento en la concentracin de calcio. Protena cuya funcin principal es recubrir las vesculas intracelulares. Est formada por tres cadenas pesadas y tres cadenas ligeras, que forman una estructura trirradiada desde un punto central. A esta
Enzimas
Estructurales
ACUAPORINAS
ADENILATOCICLASA CALMODULINA
CLATRINA
estructura se le llama trisquelin. Los trisqueliones se autoensamblan y cubren la porcin citoplasmtica de las vesculas intracelulares. Estas vesculas recubiertas de clatrina se forman, por ejemplo, en los procesos de endocitosis mediada por receptor o en la formacin de lisosomas.
ACTINA
(Del griego aktis = rayo): Protena compuesta por subunidades globulares. Sus filamentos forman parte del citoesqueleto que intervienen en la divisin celular y en estructuras que tienen a su cargo la motilidad. Existe en forma monomrica, globular o polimerizada en microfilamentos que le dan forma a las clulas o a sus prolongaciones, siendo por ese motivo parte del citoesqueleto que, por ser de actina ha sido llamado citoesqueleto de actina . Hay 3 tipos de actina: actina presente en msculos actinas y no musculares. Las molculas de actina tienden a asociarse y disociarse. Adems, la actina efecta sus funciones unindose a otras protenas como: Actinina Fimbrina Filamina Miosina II Miosina V Espectrina y Gelsolina Timosina Protena que contribuye a seleccionar y reunir los complejos adecuados, en regiones especficas de la membrana plasmtica para su transporte hacia el interior de la clula, se une con molculas de clatrina para crear el complejo adaptina-receptor molcula y forman una depresin poco profunda a manera de cresta que recibe el nombre de fosita cubierta que luego se desprende por completo de la membrana por el complejo proteico de la dinamina para convertirse en una vescula cubierta. Es necesaria para la liberacin de vesculas completas de clatrina. Se trata de una GTPasa de gran tamao que contiene tres secuencias capaces de unirse al GTP. En los vertebrados superiores, hay tres genes diferentes que codifican para la dinamina. La dinamina I se expresa en las terminaciones nerviosas, la dinamina II, en numerosos tejidos, y la dinamina II, en el testculo. En condiciones normales, la dinamina forma un complejo con el GTP, complejo que se dispone formando un anillo alrededor del cuello de la vescula y provoca una constriccin. Las molculas pequeas todava pueden entrar por la vescula por el cuello. La dinamina hidroliza el GTP,
ADAPTINA
DINAMINA
se corta el cuello de la vescula y esta se libera al medio intracelular.
FAMILIA SNARE (v, t y cis)
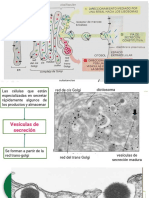
Estas protenas se utilizan en la liberacin de los neurotransmisores de las terminales nerviosas que se realiza en pequeos paquetes, de igual nmero de molculas, estos contienen a los neurotransmisores que son liberados por exocitosis. En las terminales nerviosas se encuentras do grupos de vesculas sinpticas. Un grupo liberales ( se liberan con impulso nervioso) y un grupo de reserva ( se liberan en respuesta a los requerimientos de las clulas). Las vesculas de reserva esta unidas a la actina del citoesqueleto por protenas sinapsinas. La fosforilacin de sinapsina reduce la unin a actina liberando a las vesculas del citoesqueleto y aumentando la cantidad de vesculas disponibles para la fusin con membrana. Por medio de otras protenas llamadas VSs las vesculas se unen a la membrana presinptica, estas requieren la ayuda de otras protenas que predeterminen el destino de las vesculas para ser capturados por receptores, aqu entran las protenas SNARE. Hay dos categoras de SNARES: las v-SNARE localizadas en las VSs y t-SNARES localizadas en la membrana presinpatica. Las protenas SNAREs pueden formar un complejo macromolecular que abraza a las dos membranas atrayndolas en estrecha aposicin para su posterior fusin. Cubre las vesculas de transporte originadas en la red cis-Golgi que retornan al RER. Este transporte retrgrado devuelve al RER las protenas transferidas por error a la red cis-Golgi durante el transporte antergrado normal. Adems, se encarga de mantener el transporte retrgrado entre las cisternas de Golgi. Es responsable del transporte anterogrado y forma las vesiculas del transporte del RER cuyo destino es la CGN. El COP-II cotribuye a la deformacin fsica de las membranas del RER para que aparezcan brotes de curvas muy pronunciadas y a la separacin ulterior de las vesculas de la membrana del RER. La mayor parte de las protenas producidas en el RER utilizan vesculas con cubiertas de COP-II para alcanzar la CGN. Al final del proceso, los componentes de las cubiertas (COP-1 y COP-II) se reciclan hacia su sitio de origen. RIBOFORINAS I y II: Solo se presentan en clulas eucariotas. Glicoprotenas transmembranales localizadas en el retculo endoplasmatico rugoso (RER) Estas actan como subunidades en el complejo oligosacariltran sferasa (OST). Ambas riboforinas desarrollan un papel clave en la unin de ribosomas al RER, as como en los procesos de co- traslacin dependen de esta
COATOMERO (COP-I)
(COP-II)
RIBOFORINAS I y II
interaccin.
CYP-450
El citocromo P-450 monooxigenasa es uno de los principales sistemas enzimticos empleados por el organismo para metabolizar frmacos (aproximadamente, el 90% de los medicamentos utilizados en clnica), as como numerosas sustancias endgenas (esteroides, cidos biliares, prostaglandinas, etc.). Se localiza en el retculo endoplasmico y en las mitocondrias. Este sistema enzimtico est compuesto por dos componentes proteicos: una protena que contiene hierro (hemo-protena) denominada citocromo P-450 y una flavoprotena denominada citocromo P-450 reductasa. La hemoprotena es la responsable de unir y ceder el oxgeno al frmaco, mientras que la reductasa facilita la oxigenacin mediante el transporte de electrones, desde el NADPH al complejo citocromo P-450. En el ser humano el CYP-450 se encuentra en el hgado, rin intestino delgado, glndulas suprarrenales, en menor medida en otros rganos. Existen diversas isoenzimas del CYP-450, existen ms de 200 en la naturaleza, pero solo se han encontrado 40 formas en el ser humano. Entre las isoenzimas ms importantes para el metabolismo de frmacos esta la CYP2D6, la CYP1A2 y las subfamilias CYP2C y CYP3A. La membrana mitocondrial externa posee un gran nmero de porinas, protenas transmembranales de mltiples pasos. Cada porina forma un canal acuoso grande a travs del cual pueden pasar molculas hidrosolubles tan grandes como 10kD. La cardiolipina es un lpido que se encuentra de forma exclusiva en la membrana bacteriana o en la membrana mitocondrial interna dnde constituye alrededor del 20% de la composicin lipdica de la membrana. Una de las principales funciones de la cardiolipina es que sin su presencia en la membrana mitocondrial interna, una gran cantidad de enzimas de la fosforilacin oxidativa no podran desarrollar su funcin correspondiente. Durante el proceso de la apoptosis, o muerte celular programada, se dan una serie de reacciones qumicas entre la cardiolipina y el citocromo c que desencadenan el proceso de la muerte celular. La reaccin ms importante del proceso consiste en que el citocromo c acta como un enzima peroxidasa interactuando especficamente con la cardiolipina para oxidarla. Como resultado de esta reaccin la cardiolipina se desplaza a la membrana mitocondrial externa donde crea un poro en la membrana que permite que el citocromo c salga al exterior de la mitocondria. Protena globular con funcin de catlisis (enzima) que utiliza energa a travs del movimiento de los protones hidrgeno para producir la conversin del ATP en ADP al tiempo que los protones hidrgeno se
PORINAS
CARDIOLIPINA
ATP Sintetasa
combinan con el oxgeno para formar agua. Su funcin depende de la concentracin elevada del protn hidrgeno en la cmara externa de la mitocondria y su gran diferencia de potencial a travs de la membrana interna.
HIDROLASAS CIDAS
Son enzimas hidrolticas caracterizadas por alcanzar un rendimiento ptimo a un pH cido, entre 4 y 5. Se conocen aproximadamente unas 40 hidrolasas cidas diferentes. Su actividad consiste en la degradacin de molculas complejas en otras ms simples mediante la adicin de una molcula de agua. En una idea general, los endosomas que estn destinados a convertirse en lisosomas reciben enzimas lisosmicas neosintetizadas que se orientan a travs del receptor de manosa-6-fosfato. Algunos endosomas tambin estn comunicados con el sistema de transporte vesicular del RER. Esta va permite la entrega constante de enzimas lisosmicas, o hidrolasas, neosintetizadas. Las hidrolasas se sintetizan en el RER en la forma de precursores inactivos, llamados prohidrolasas. Luego, esta protena muy glucosilada de pliega de manera especfica para que forme una regin de seal que queda expuesta en la superficie de la molcula. Esta seal de reconocimiento se crea cuando aminocidos especficos se acercan mucho al plegamiento tridimensional de la protena. La regin de seal en una protena destinada al lisosoma es modificada despus por varias enzimas que aaden manosa-6-fosfato (M-6-P) a la superficie de la prohidrolasa. La M-6-P acta como una diana para las protenas especficas que poseen el receptor de M-6-P. Los receptores de sta estn en los endosomas tempranos y tardos, en los lisosomas y en el aparato de Golgi. El medio cido de los endosomas tardos causa la liberacin de las prohidrolasas desde los receptores de M-6-P. Despus, las prohidrolasas se activan por escisin y por extraccin de los grupos fosfatos de los residuos de manosa. Los chaperones ayudan a otras protenas celulares a la adquisicin de su estado original (mantener la conformacin funcional), a alcanzar su destino final (el retculo endoplsmico o la mitocondria), a resistir la desnaturalizacin producida por los estresores, y a reestablecer su estado primitivo tras la desnaturalizacin parcial. HSC73 realizan la labor de reparar las protenas, o la de protegerlas contra el dao producido por el estrs En eucariotas, una Hsp70 (Hsc73) participa en la degradacin lisosomal de las protenas citoslicas y en la eliminacin de la clatrina de las vesculas cubiertas
MANOSA-6FOSFATO
Protena chaperona de choque trmico (hsc73)
PEROXIDASAS
La peroxidasa (de rbano) es una enzima indicador que se une a un anticuerpo especfico para un antgeno proteico para obtener un ensayo muy especfico y sensible. Tras la unin al antgeno del anticuerpo conjugado con peroxidasa, sta se emplea para crear un producto coloreado que puede medirse y cuya concentracin est relacionada con la cantidad de antgeno contenida en la muestra. El sistema amplifica mucho la seal gracias a la naturaleza cataltica de la enzima. Este ensayo se ha denominado ELISA, las siglas correspondientes a Ensayo por Inmunoabsorcin Ligado a Enzimas. La aplicacin de estos principios se pone de manifiesto en un ensayo para la deteccin de las protenas antignicas de la envoltura del virus de la inmunodeficiencia humana (VIH). La urato oxidasa es una enzima de la clase de las oxidorreductasas, que est presente en varios organismos tanto unicelulares como pluricelulares, notndose sin embargo su ausencia en los seres humanos y en algunos primates, presentndose activa en el catabolismo de las purinas. Esta enzima cataliza la oxidacin del cido rico a 5hidroxiisourato, siendo el producto de la reaccin inestable, y transformndose espontneamente en alantona, tal y como se muestra a continuacin: cido rico + O2 + H2O 5-hidroxiisourato + H2O2 alantona + CO2 El urato oxidasa es una enzima homotetramrica que contiene cuatro sitios activos idnticos situados en la superficie de contacto existente entre sus cuatro subunidades. Se compone de un nmero variable de aminocidos (segn la especie) siendo alrededor de 300 residuos de los mismos, con un peso molecular de unos 33 kDa.
Oxidasas de urato, de cido D-amino.
D-aminocido oxidasa Estas enzimas se localizan en los peroxisomas y generan perxido de hidrgeno. El perxido de hidrgeno es degradado por la catalasa a oxgeno molecular y agua. La D-aminocido oxidasa pertenece a la familia de las flavoprotenas oxidasas debido a que su estructura se encuentra unida al cofactor FlavinAdeninDinucletido (FAD).
CATALASA
La catalasa es una enzima comn encontrada en los seres vivos, cataliza la liberacin de agua y oxgeno a partir de perxido de hidrgeno (H2O2+catalasa=H2o+O2). Es un tetrmero de cuatro cadenas polipeptdicas, cada una larga cadena con 500 aminocidos. Contiene cuatro grupos hemo porfirinicos (hierro) que llevan a la enzima a reaccionar con el perxido de hidrgeno. Protege a la clula de las consecuencias txicas del metabolismo del
oxgeno, se encuentra ampliamente distribuida en el organismo humano, resulta ms elevada en el hgado y los riones, ms baja en el tejido conectivo y los epitelios, y prcticamente nula en el tejido nervioso. A nivel celular se localiza en las mitocondrias y los peroxisomas, excepto en los eritrocitos, donde se encuentra en el citosol.
UBIQUITINA (UBICUITINA)
Presente en los organismos eucariontes. Se encarga de reciclar grupos proteicos apoyndose de enzimas para dirigir a la protena al proteasoma, donde la protena se modificar dependiendo de las necesidades celulares. Son comunes en el ciclo celular, la apoptosis y otros procesos celulares, donde generalmente hay procesos de degradacin debido a la cualidad reguladora de sta.
TUBULINA(alfa y beta)
Protenas dimericas que al ensamblarse forman los organelos no membranosos conocidos como microtbulos (estructuras polimricas alargadas, en gran nmero en los axones de las clulas nerviosas).Cada dmero est constituido por dos polipptidos conocidos como alfa t bulina y beta t bulina en igual proporcin. Dichos dmeros se polimerizan extremo con extremo (cabeza con cola); siendo que lo contactos longitudinales entre los dmeros los relacionan en una estructura lineal conocida como PRTOFILAMENTO. Cada microtbulo posee un extremo minus (que no crece) correspondiente a la alfa t bulina que suele estar incluido en el MTOC (centro organizador de microtubulos) de la clula, mientras que posee un extremo plus (que crece) correspondiente a la beta t bulina, el cual se alarga hacia la periferia de la clula.
TUBULINA (gamma)
Tubulina gamma es un subtipo de t bulina y funciona en el ensamblaje de microtbulos. Se encuentra en el centrosoma donde se une a los microtbulos como parte del complejo referido como "Complejo del anillo de t bulina gamma" Esta protena motora utiliza la energa de la hidrlisis de la adenosina trifosfato (ATP) para moverse a lo largo de la superficie del microtbulo contiguo. Los brazos de dinena aparecen con intervalos de 24 nm en toda la longitud del microtbulo A y se entienden para formar puentes cruzados temporales con el microtbulo B del doblete contiguo. Familia de protenas motoras que median el transporte intracelular antergrado sobre los componentes del citoesqueleto.
DINEINA CINESINA
ACTINA G
Se trata de la actina sin polimerizar, es decir, en forma de monmeros. En soluciones de baja fuerza inica, la actina es un monmero llamado actina G debido a su forma globular. Es una molcula de 375 aminocidos, que a pH fisiolgico se polimeriza y toma la forma fibrosa F que se parece a los filamentos delgados. Tambin llamada actina filamentosa. Es un largo polmero lineal compuesto por la asociacin de molculas de actina globular (actina G) que conforman dos cadenas enlazadas entre s. Da origen a los filamentos delgados junto con las protenas troponina y tropomiosina. Se localiza en las clulas musculares estriadas: 1) Tropomiosina: Mantienen rectilneos los filamentos. 2) Troponina T, I, C: Contraccin muscular. 3) Miosina I y II: motoras. Tambin pueden ser no musculares: 1) Timosina y Profilina: Secuestran la actina en su forma monomrica. 2) Fimbrina, -actina y villina: unin transversal entre microfilamentos. 3) Fodrina: une haces de microfilamentos. 4) Gelsolina: Fragmentan filamentos largos de actina. 5) Filamina: forman enlaces en sitios de entrecruzamiento de filamentos y estabilizan redes tridimensionales gelificadas. Protena de 2 subunidades con una masa de 100,000 Da por subunidad. Funcin: unin de filamentos de actina para haces contrctiles En el interior de cada microvellosidad se encuentran conjuntos de lamentos de actina los que establecen enlaces cruzados con las protenas mbrina y fascina, esta organizacin constituye su ncleo estructural, estos lamentos se unen a la villina ubicada en la punta de la microvellosidad y desde all se extienden a la porcin apical del citoplasma donde interaccionan con la red de lamentos de actina en disposicin horizontal denominada velo terminal. En las prolongaciones celulares que dirigen el movimiento de las clulas y en algunas clulas, en especial en las de los cultivos, pueden conectarse por medio de fascina y formar fascculos citoplasmticos gruesos, las llamadas fibras de estrs. La fimbrina es de forma casi globular y pesa 68 kDa. Se une a la actina (una molcula por cada 10 molculas de actina) para formar haces de filamentos no contrctiles, como lo hace la actina en los contrctiles. La diferencia con la actina es que los puentes de fimbrina dejan los filamentos muy prximos entre s (10-20 nm) y no permiten la interaccin de la miosina. La villina es de aspecto similar a la fimbrina y pesa 95kDa. Es tambin formadora de haces no contrctiles, pero slo con bajas concentraciones de Ca2+ (menoresde 1mM). Con mayores concentraciones tiene el efecto
ACTINA F
Protena fijadora de Actina (ABP) ACTININA ALFA
FASCINA, FIMBRINA Y VILLINA
opuesto, actuando como la gelsolina. Es una protena esencial durante la formacin y el desensamblaje de los filamentos de actina del citoesqueleto, ya que en presencia de ATP y Ca2+, esta segmenta los filamentos de actina y forma un recubrimiento sobre su extremo positivo que impide que estos filamentos se alarguen o polimericen cuando estn ya completos. Forma parte de las protenas formadoras de casquetes en la actina. Es pequea, de aproximadamente 40 KDa, que est adherida al extremo libre del filamento delgado o fino. Esta protena formadora de casquete para la actina, tambin denominada protena de coronacin, mantiene y regula la longitud del filamento de actina sarcomrico. Las variaciones en la longitud de los filamentos finos (como ocurre en las fibras musculares de tipo I y de tipo IIb) afectan la relacin longitud-tensin durante la contraccin muscular y, por ende, influyen sobre las propiedades fisiolgicas del msculo. Forma una red que sostiene la membrana plasmtica. Intervienen en la formacin de enlaces cruzados entre filamentos de actina. Pero no en fascculos Forman una red laminar bajo la membrana celular.
GELSOLINA
TROPOMODULINA ESPECTRINA, ADUCTINA, PROTEINA 4.1 y 4.9
MIOSINA I y II
La miosina I participa en las interacciones citoesqueleto-membranas tales como el transporte de vesculas de membrana. La miosina II lleva acabo la contraccin por cizallamiento de filamentos de actina Es un tipo de miosina. Puede unirse a filamentos de actina y otros componentes citoplasmticos (como vesculas u otros organelos) y moverlos de una posicin de la clula a otra. Se conforma por una subunidad de 150, 000 Da. Las timosinas (p. ej., timosina-4) son protenas que se unen con los monmeros actina-ATP (a menudo llamada actina G) e impiden la polimerizacin. Las protenas con esta actividad se describen como protenas para secuestro de monmeros de actina. Se cree que son las encargadas de mantener la concentracin relativamente alta de actina G en clulas extramusculares (50 a 200 mM). Sin las protenas para secuestro de monmeros, las condiciones en el citoplasma favoreceran la polimerizacin casi completa de los monmeros solubles de actina en filamentos. A causa de su capacidad para unirse con actina G y estabilizar la reserva de monmeros, los cambios en la concentracin o la actividad de las protenas para secuestro de monmeros puede modificar el equilibrio entre monmeros y polmeros en cierta regin de una clula y determinar si en un momento determinado se favorece la polimerizacin o la despolimerizacin.
MIOSINA V
TIMOSINA
FILAMINA
Enlace transversal de filamentos de actina en una red parecida a gel. Masa molecular: 270 000 Da. Dos grupos -queratinas y -queratinas: -queratinas: se encuentra en la capas epidrmica de la piel, las uas y el pelo. Estructura -helicoidal, con enlaces cruzados disulfuros entre residuos de cistina de molculas adyacentes permiten que la estructura adquiera rigidez y resistencia. -queratinas: se encuentran en las fibras de la seda, plumas, garra y picos de reptiles y pjaros. Tienen una estructura secundaria en lamina plegada en conformacin . La vimentina es una protena de filamentos intermedios ms abundante (IF) con una masa molecular de 57 kDa, que forma parte del citoesqueleto de las clulas de los vertebrados La vimentina juega un papel importante en el apoyo y el anclaje de la posicin de los orgnulos en el citosol. La vimentina est unido al ncleo, retculo endoplsmico, mitocondrias y, lateral o terminal. En esencia, vimentina es responsable de mantener la forma celular, la integridad del citoplasma, y la estabilizacin de las interacciones del citoesqueleto. Pertenece al grupo de los filamentos intermedios. Su peso molecular es de 53,000. Esta se encuentra en todos los tipos de clulas musculares. Su funcin es enlazar miofibrillas en msculo estriado (alrededor de discos Z), adems se fija a densidades citoplsmicas en msculo liso. Se localiza en clulas neurolgicas (muy especficamente en astrocitos). Forman filamentos citoplasmticos. Periferina es un tipo de protena de filamento intermedio III se expresa principalmente en las neuronas del sistema nervioso perifrico. Tambin se encuentra en las neuronas del sistema nervioso central que tienen proyecciones hacia las estructuras perifricas, tales como las neuronas motoras espinales. Su tamao, estructura y secuencia/ubicacin es similar a otro tipo III SI protenas como la desmina, vimentina y protena cida glial fibrilar. Al igual que estas protenas, periferina se puede autoensamblar para formar redes filamentosos homopolimerizar, pero tambin puede heteropolimerizar con neurofilamentos en varios tipos neuronales. Esta protena, en los seres humanos es codificada por el gen PRPH.
QUERATINAS
VIMENTINA
DESMINA PROTEINA ACIDA FIBRILAR GLIAL
PERIFERINA SINEMINA PARANEMINA Y
Forman parte de una familia diversa de filamentos citoplasmticos intermedios que modelan su ensamblaje, adems estn presentes en las clulas musculares y son de origen fibroblstico.
Sin embargo, su funcin especfica es poco clara todava, ya que los filamentos intermedios son muy estables.
NEUROFILAMENTOS (L, M y H)
Tipo de filamentos intermedios presentes en las neuronas. Forman el citoesqueleto de axones y dendritas; favorece la formacin del estado de gel del citoplasma, se encarga del enlace transversal para la erza de tensin grande. Miden aproximadamente 10nm de dimetro, desde el punto de vista bioqumico son muy estables y pertenecen a la familia de la citoqueratina. Es una protena que une filamentos intermedios, tiene un peso molecular de 500,000. A medida que las protenas se unen a filamentos intermedios, estos se unen en una red tridimensional que facilita la formacin del citoesqueleto. La plectina une vimentina, en redes intracelulares tridimensionales. Estas se localizan en las uniones celulares llamadas Desmosomas, estas uniones semejan a puntos de soldadura. Las placas de insercin de forma discal se ubican opuestas entre si; en la superficie citoplasmtica de las membranas plasmticas de las clulas epiteliales adyacentes. Cada placa se compone de una serie de protenas de insercin, de las cuales las mejor caracterizadas son las desmoplaquinas y pacoglobinas que se unen a los filamentos intermedios como queratina en la mayora de las clulas epiteliales o desmina en fibras musculares cardiacas; y a protenas de tipo cadherina (desmogleinas y desmocolina) que se proyectan al espacio intracelular entrelazndose a las de la otra clula. Se encuentra en los centrosomas y es responsable de la duplicacin de los mismos. Funciona contrayndose en respuesta a aumentos en la concentracin de Ca2+ citoplsmico y se relaja va fosforilacin mediada por ATP La protena pericentrina acta como protena de anclaje. La pericentrina se encuentra en los centrosomas, orgnulos implicados en la divisin celular y en el ensamblaje de microtbulos. Gen de fusin BCR-ABL o PROTEINA p210 p185 o cromosoma de Filadelfia. (PhiladelPhia) Gen que se forma cuando partes de los cromosomas 9 y 22 se rompen y cambian de posicin. El gen ABL del cromosoma 9 se une al gen BCR del cromosoma 22 para formar el gen de fusin BCR-ABL. El cromosoma 22 alterado que contiene el gen de fusin se llama cromosoma Filadelfia. El
PLECTINAS
DESMOPLAQUINAS Y PLACOGLOBINAS
CENTRINA
PERICENTRINA
PROTEINA p210
gen de fusin de BCR-ABL se encuentra en la mayora de los pacientes con leucemia mielgena crnica (LMC) y en algunos pacientes con leucemia linfoblstica aguda (LLA) o leucemia mielgena aguda (LMA).Dependiendo de la localizacin de la protena p210 Este gen codifica la protena de fusin Bcr-abl. Dependiendo de la ubicacin precisa la protena puede variar desde 185 hasta 210 kDa. Por esta razn bcr-abl es llamado p210 o p185 El gen de la nucleofosmina (NPM1) se encuentra en el cromosoma 5 y codifica para una fosfoprotena nucleolar de 294 aminocidos que se traslada constantemente entre el ncleo, el nucleolo y el citoplasma. Se han identificado algunas funciones como promotor de la biognesis de los ribosomas, respuesta al dao celular, reparacin del ADN, control de la duplicacin del centrosoma durante el ciclo celular, modulacin de la funcin de factores de transcripcin supresores de tumores y regulacin de la funcin y estabilidad de varias protenas nucleares por su propiedad de molcula chaperona. Cada nucleosoma se conforma con un octmero de protenas que se duplica a partir de cada uno de las cuatro histona (H2A, H2B, H3 Y H4) y H1 se encuentra en la regin de unin entre dos nucleosomas. Forman la lmina nuclear, las lminas se encuentran en la periferia del nucleoplasma. La composicin de la lmina se basa en protenas llamadas lminas. Los tres tipos de lminas (A, B y C) estn codificados por 3 genes distintos. Las de tipo A y C se sintetizan a partir del mismo gen, llamado LMNA, por procesamiento alternativo dando lugar a cuatro subtipos: A, A () 10, C1 y C2. Las lminas de tipo B estn codificadas por dos genes distintos: LMNB1 (laminas del subtipo B1) y LMNB2 (lminas de los subtipos B2 y B3, tambin por procesamiento alternativo del gen). Todas las lminas presentan un dominio globular en su extremo Cterminal y otro en el N-terminal. A travs del C-terminal, excepto las lminas C, unen una molcula llamada farnesilo (proceso denominado farnesilacin) que permite el anclaje de las lminas a la membrana nuclear interna. Esta unin permite que se formen dmeros, luego tetrmeros, protofilamentos, filamentos y por ltimo el retculo que constituye la lmina nuclear.
NUCLEOFOSMINA
HISTONAS
LAMINAS A, B y C NUCLEOPORINAS
Interrupciones de la envoltura nuclear en las que se fusionan las
membranas nucleares interna y externa entre s, estableciendo sitios en los que puede comunicarse el ncleo y el citoplasma. En su borde tiene estructuras unidas que en su conjunto se llaman complejo del poro nuclear. Son protenas que se encargan de traer desde fuera del ncleo, el citoplasma, molculas o materiales hacia el interior del mismo. Por ejemplo, la importina . Median el importe citoplasma->ncleo de cargos al reconocer las seales de localizacin nuclear, NLS, que contienen. Las molculas grandes (como las protenas de gran tamao de los complejos macromoleculares) dependen para su paso a travs de los poros de la presencia de una sustancia de seal de adherida, como la secuencia de exportacin nuclear (NES) que se une al ncleo de la exportina y a una molcula de GTP. La exportina es una protena que mueve molculas desde el ncleo al citoplasma. Los complejos de protena-exportina-GTP atraviesan en complejo del poro nuclear hacia el citoplasma donde se hidroliza el GTP y se libera la protena con la NES. El NPC transporta protenas, todas las formas de RNA y las subunidades ribosmicas en su configuracin plegada de complejo. Es la reguladora del movimiento de macromolculas a travs del poro nuclear, esta protena en su formacin y actividad estn reguladas por la unin e hidrlisis de GTP. -Las enzimas que estimulan la hidrlisis del GTP en GDP se localiza en la cara citoplsmica de la envuelta nuclear. -Las enzimas que estimulan el intercambio de GDP por GTP se encuentra en la cara nuclear. Como consecuencia hay una concentracin elevada de RAN/GTP en el ncleo, por tanto esto determina la direccionalidad del transporte nuclear de las protenas de transporte a travs del poro nuclear, controlando la actividad de los receptores. La nucleostemina una protena de descubrimiento reciente que se encuentra en el nuclolo, es una protena fijadora de p53 que regula el ciclo celular y tiene un efecto sobre la diferenciacin de las clulas. Conforme avanza la diferenciacin celular, la concentracin de esta protena disminuye. La presencia de nucleostemina en las clulas malignas podra indicar que desempea un papel en su proliferacin descontrolada.
IMPORTINAS
EXPORTINAS
Protenas RAN
NUCLEOSTEMINA
BIBLIOGRAFA:
Alberts et al (2004). Biologa molecular de la clula. Barcelona: Omega. ISBN 54-282-1351-8.
Lodish et al. (2005). Biologa celular y molecular. Buenos Aires: Mdica Panamericana. ISBN 95006-1974-3. M. Victoria Luque Guilln. ESTRUCTURA Y PROPIEDADES DE LAS PROTENAS Obtenido de: http://www.uv.es/tunon/pdf_doc/proteinas_09.pdf (Consultado el 31/08/2013) -Garrido, Armando; Teijon, Jose Maria. Fundamentos de Bioquimica Estructural. 2 ed. Editorial Tebar, Espaa, 2006, p.p. 124 -Gartner-Hiatt. Texto Atlas de Histologa, 3a ed. McGraw Hill -Ross, Michael H, Wojciech Pawlina. Histologa. Texto y atlas a color con Biologa celular y molecular. Panamericana, 5ta ed. China, 2008:62. -Sociedad Argentina de Histotecnologa [homepage en Internet]. Argentina: Nstor Rodriguez; [consultado el 30 de agosto de 2013]. Disponible en: http://www.ht.org.ar/histologia/NUEVAS%20UNIDADES/unidades/unidad4/contram.htm
-Nelson D. L., Cox M. M. Lehninger. Principios de Bioqumica. 5ta ed. Espaa: Omega; 2009
-Welsch, U. 2010. Histologa. Ed. Mdica Panamericana. 2 ed. Espaa. p.p. 66-67.
-C. Peralta Rodrigo, F.J. Pastor Ruiz, M. Salazar Vallejo. Tratado de Psicofarmacologa bases y aplicacin clnica. Segunda edicin. Madrid. Editorial mdica panamericana. 2009. p.p. 143. -OST complex (OST48, Ribophorin I, Ribophorin II, DAD1), Biomedical and Life Sciences, [pgina web] URL: http://www.springerreference.com/docs/html/chapterdbid/332066.html -Estudio del reordenamiento bcr/abl. Deteccin de la translocacin t (9;22)(q34;q11). Cromosoma Philadelphia [Articulo en PDF] URL: http://www.e-icm.net/files/wwphil.pdf -Maillet M. Transportes citticos. En: Manual Biologa celular. Mxico D.F.: Masson; 2003. p. 45. -Ross, Michael H, Wojciech Pawlina. Histologa. Texto y atlas a color con Biologa celular y molecular. Panamericana, 5ta ed. Buenos Aires, 2008, pp. 83, 37, 116, 317. Jimnez F. Biologa celular y molecular.1 Ed. Mxico: Editorial Pearson;2003; pgs. 284-285
Navarro Lpez C. El citoesqueleto II: Microfilamentos y filamentos intermedios. [Articulo en PDF] URL: http://mural.uv.es/monavi/disco/primero/biologia/Tema24.pdf Karp, Gerald. Biologa Celular y Molecular. 5ta. Edicin, Editorial McGraw Hill, Mxico 2009. p.p. 376 Gartner, Hiat. Texto Atlas de Histologa, 2 ed. McGraw Hill, 2002. Mxico. Guyton, Hall. Tratado de Fisiologa Mdica, 10 ed. McGraw Hill, 2001. Mxico. Bererro M.J.( 2002) The stress proteins. their relationship with tumors, aging and exercise (i) en sitio web femed.es recuperado el 7 de septiembre de 2013 de http://femede.es/documentos/Proteinas_Estres_311_90.pdf Forero, J. (2004) Principales factores en el transporte ncleo-citoplasma en sitio web bioline internacional Revista Colombia Mdica recuperado el 7 de septiembre de 2013 de http://www.bioline.org.br/request?rc04043 Alberts et al (2004). Biologa molecular de la clula. Barcelona: Omega. ISBN 54-282-1351-8 Lodish et al. (2005). Biologa celular y molecular. Buenos Aires: Mdica Panamericana. ISBN 95006-1974-3.
Das könnte Ihnen auch gefallen
- Okprotesis y Ortesis FinalDokument49 SeitenOkprotesis y Ortesis FinalDamián ProblemasNoch keine Bewertungen
- Sist. Respiratorio PropeDokument28 SeitenSist. Respiratorio PropeL Miguel LunaNoch keine Bewertungen
- M6 Tarea2Dokument2 SeitenM6 Tarea2L Miguel LunaNoch keine Bewertungen
- CasosBioeticatarea ContestadoDokument6 SeitenCasosBioeticatarea ContestadoL Miguel LunaNoch keine Bewertungen
- Glándulas salivales parótida sublingual submaxilarDokument14 SeitenGlándulas salivales parótida sublingual submaxilarL Miguel LunaNoch keine Bewertungen
- Semiología del aparato reproductor masculinoDokument37 SeitenSemiología del aparato reproductor masculinoL Miguel Luna100% (2)
- Práctica Número 18. Farmacología Renal. Luna López Luis Miguel.Dokument40 SeitenPráctica Número 18. Farmacología Renal. Luna López Luis Miguel.L Miguel LunaNoch keine Bewertungen
- VErsion Final Imprimiir (Autoguardado)Dokument54 SeitenVErsion Final Imprimiir (Autoguardado)L Miguel LunaNoch keine Bewertungen
- 030 STPS 1993Dokument11 Seiten030 STPS 1993L Miguel LunaNoch keine Bewertungen
- MuscularDokument39 SeitenMuscularFranz mendelevilNoch keine Bewertungen
- Hoja de Trabajo Laboratorio 3Dokument3 SeitenHoja de Trabajo Laboratorio 3Francisco BarriosNoch keine Bewertungen
- Tablas de Macroelementos y MicroelementosDokument9 SeitenTablas de Macroelementos y MicroelementosSantiago VàzquezNoch keine Bewertungen
- Clases FotosintesisDokument27 SeitenClases FotosintesisVicky Olivero MengoNoch keine Bewertungen
- Informe A3 - 2021Dokument6 SeitenInforme A3 - 2021Dayanna MendozaNoch keine Bewertungen
- Taller Oxidación Biológica Final-2020-1Dokument1 SeiteTaller Oxidación Biológica Final-2020-1Fabio Fajardo67% (3)
- Fisiología Vegetal: Células, Soluciones y Nutrición MineralDokument104 SeitenFisiología Vegetal: Células, Soluciones y Nutrición MineralShamikito Moron Rojas100% (1)
- 1 2 MergedDokument4 Seiten1 2 MergedDiana RiveraNoch keine Bewertungen
- Practica Calificada Celula - Biologia 2016Dokument5 SeitenPractica Calificada Celula - Biologia 2016Rosa de AméricaNoch keine Bewertungen
- Gram Positivas Vs Gram Negativas, Microbiologia IIDokument23 SeitenGram Positivas Vs Gram Negativas, Microbiologia IIalgelys zapataNoch keine Bewertungen
- Biologia 1121 EnzimasDokument10 SeitenBiologia 1121 Enzimasnairoby herrera smartNoch keine Bewertungen
- Sobrevivir Al Estrés Cómo Responden Las Plantas A La Falta de Agua PDFDokument10 SeitenSobrevivir Al Estrés Cómo Responden Las Plantas A La Falta de Agua PDFJavier ZRNoch keine Bewertungen
- Teoría de OxidaciónDokument2 SeitenTeoría de OxidaciónZhujey KaztilloNoch keine Bewertungen
- Fosfoproteinas FINALDokument12 SeitenFosfoproteinas FINALBrenda FloresNoch keine Bewertungen
- Bioquimica y El Ciclo de KrebsDokument21 SeitenBioquimica y El Ciclo de KrebsRonal Vásquez BautistaNoch keine Bewertungen
- Resumen Sorting de Proteínas II 2017Dokument3 SeitenResumen Sorting de Proteínas II 2017ELLA NidafeNoch keine Bewertungen
- Trafico Vesicular Intracelular. Alberts Cap 13Dokument8 SeitenTrafico Vesicular Intracelular. Alberts Cap 13Ivonee Perez100% (1)
- Universidad Tecnológica de Santiag1Dokument4 SeitenUniversidad Tecnológica de Santiag1Henrius FeguensNoch keine Bewertungen
- Umbral LacticoDokument3 SeitenUmbral LacticoLuis SixtoNoch keine Bewertungen
- Célula Animal y Célula VegetalDokument2 SeitenCélula Animal y Célula VegetalVictor miguel Mesones CorreaNoch keine Bewertungen
- Sintesis de ADNDokument20 SeitenSintesis de ADNJordan Aguilar88% (8)
- Linfocito T: Célula Clave del Sistema InmuneDokument49 SeitenLinfocito T: Célula Clave del Sistema InmuneAna Deylani BautistaNoch keine Bewertungen
- Composición Química de Las BiomoléculasDokument2 SeitenComposición Química de Las BiomoléculasRICARDONoch keine Bewertungen
- Taller Metabolismo de Proteínas 2.0Dokument3 SeitenTaller Metabolismo de Proteínas 2.0Tomás NavasNoch keine Bewertungen
- Membrana CelularDokument2 SeitenMembrana CelularPierina MeraNoch keine Bewertungen
- Fisiologia de La Hemostasia y Coagulacion SanguineaDokument6 SeitenFisiologia de La Hemostasia y Coagulacion SanguineaYong MondragonNoch keine Bewertungen
- Preguntas Sobre La CélulaDokument5 SeitenPreguntas Sobre La CélulaJenny Castro JaraNoch keine Bewertungen
- Receptor EsDokument27 SeitenReceptor EsLuis CalatayudNoch keine Bewertungen
- Acv IsquemicoDokument32 SeitenAcv Isquemicocharboy36Noch keine Bewertungen
- CUESTIONARIO S3 PatologiaDokument2 SeitenCUESTIONARIO S3 PatologiaMaria Salome Olortegui AceroNoch keine Bewertungen