Beruflich Dokumente
Kultur Dokumente
Electro
Hochgeladen von
JorgeAguilarCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Electro
Hochgeladen von
JorgeAguilarCopyright:
Verfügbare Formate
I. E. S.
"Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 1
ESTRUCTURA EXTRANUCLEAR DEL ATOMO
Tema 6.- Estructura extranuclear del tomo.- Partculas fundamentales. Ideas de Rutherford y
modelo atmico. Espectros atmicos de emisin. Espectro del hidrgeno. Modelo atmico de Bohr.
Carcter ondulatorio de los electrones; orbitales, nmeros cunticos. Configuraciones electrnicas
de los tomos polielectrnicos; principio de exclusin (Pauli); principio de mxima multiplicidad
(Hund).
Tema 6.-Estructura extranuclear del tomo.
6.1.-Partculas fundamentales. 6.1.1.-La conductividad en los gases. 6.1.2.-El electrn. 6.1.3.-
Modelo atmico de Thomson. 6.1.4.-El protn. 6.1.5.-El neutrn.
6.2. Modelo atmico de Rutherford. 6.2.1. Antecedentes: La radiactividad 6.2.2. Experiencia
de Rutherford. 6.2.3. Modelo atmico de Rutherford 6.2.4. Las partculas fundamentales forman los
diversos elementos. 6.2.5. Insuficiencia del modelo de Rutherford.
6.3. Espectros. 6.3.1. Espectro electromagntico de la luz. 6.3.2.-Espectros continuos y
discontinuos. 6.3.3.Espectros de rayos X.
6.4. El espectro del tomo de hidrgeno. 6.4.1. El efecto fotoelctrico.
6.5. Modelo atmico de Bohr. 6.5.1. Dificultades del modelo de Bohr: nuevos nmeros
cunticos. 6.5.2. Orbitas elpticas: nmero cuntico de momento angular. 6.5.3. Efecto Zeeman.
Nmero cuntico magntico. 6.5.4. Spin del electrn. Nmero cuntico de Spin.
6.6. Fsica Cuntica. 6.6.1. Hiptesis de De Broglie. 6.6.2. Principio de incertidumbre de
Heisemberg. 6.6.3. La funcin de ondas: ecuacin de Schrdinger.
6.7. Los nmeros cunticos.
6.8. Configuraciones electrnicas de los tomos polielectrnicos. 6.8.1 Principio de mxima
multiplicidad o de Hund. 6.8.2 Principio de exclusin de Pauli.
6.1. Partculas fundamentales.
Antecedentes de la divisibilidad del tomo.
La hiptesis de la discontinuidad de la materia fue la base del desarrollo de la qumica del siglo
XIX. Gran parte de la fsica del siglo XX se fundamenta en la hiptesis de la discontinuidad de la energa.
El desarrollo de esta hiptesis permiti adentrarse en el conocimiento de la estructura de los tomos.
Los trabajos de Faraday sobre electrlisis haban llevado a intuir una estrecha relacin entre
materia y electricidad y sugirieron que la electricidad misma estaba constituida por partculas materiales.
Los estudios sobre la conductividad elctrica de los gases confirmaron esta hiptesis.
6.1.1. La conductividad en los gases.
Los gases, en condiciones ordinarias, son aislantes, pero a presiones inferiores a 0,01 atm y
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 2
sometidos a elevados voltajes se vuelven conductores y emiten luz. Para estudiar la conductividad de los
gases se utiliza el aparto de descarga de gases. Fig. (6.1). A medida que va disminuyendo la presin del
gas, la conduccin persiste y la luminosidad va disminuyendo. A una presin de 10
-4
atm la pared opuesta
al ctodo empieza a fluorescer y emite una luz amarillo verdosa. Esta fluorescencia es debida a los
impactos que producen sobre el vidrio unos rayos que proceden del ctodo, los rayos catdicos.
6.1.2. El electrn.
En 1.897 Thomson estudi la naturaleza de dichos rayos y demostr las siguientes caractersticas
figuras (6.2 a 6.5):
a) La naturaleza y comportamiento de estos rayos no depende de la naturaleza del gas introducido
en el tubo.
b) Se propagan en lnea recta.
c) Poseen masa, cantidad de movimiento. Son partculas materiales.
d) Se desvan por campos elctricos y magnticos. Por lo tanto tienen carga.
e) La relacin carga/masa (q/m) es muy grande, 1840 veces mayor que la conocida para los iones
de hidrgeno.
Se dedujo que eran partculas materiales de masa mnima, procedentes del ctodo
(independientemente de la naturaleza del ctodo) y cargadas negativamente. ELECTRN.
En 1911 Millikan determin la carga del electrn mediante el experimento de gotas de aceite
cargadas en un condensador.
En 1919 Aston comprob la relacin q/m en un espectrgrafo de masas.
6.1.3. Modelo atmico de Thomson.
Thomson haba demostrado que los electrones eran partculas constituyentes del tomo y puesto
que ste deba ser elctricamente neutro dedujo que deban existir partculas cargadas positivamente. Ya
que la masa de los electrones con respecto a la masa del tomo era muy pequea, la mayor contribucin a
la masa atmica deba corresponder a las partculas cargadas positivamente.
Thomson elabor el primer modelo atmico suponiendo que el tomo era una esfera cargada
positivamente dentro de la cual, como muy pequeos grnulos, se encontraran embebidos los electrones
de manera que la disposicin electrosttica resultara estable y neutra.
Este modelo explicaba los hechos experimentales conocidos como la formacin de iones, la
electricidad esttica, la electrlisis y la corriente elctrica.
6.1.4. El protn.
Cuando se trabaja con un tubo de descarga de gases con el ctodo perforado junto con los rayos
catdicos aparece una nueva radiacin, Fig (6.6) Es una radiacin que se identific bastante ms tarde y
que en esencia presenta las siguientes propiedades:
a) Es una radiacin material que transporta ms masa que los rayos catdicos.
b) Surge de todos los puntos del interior de tubo, esto es, se origina en el seno del gas y no en un
electrodo.
c) Su energa cintica depende de la naturaleza del gas.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 3
d) Est cargada positivamente pues se desva hacia el polo negativo en el interior de un campo
elctrico.
La explicacin que recibieron estos rayos, llamados "rayos positivos" o "rayos canales", es que se
producan al chocar los rayos catdicos con los tomos del gas encerrado en el interior del tubo de
descarga.
En el choque, alguno de los electrones corticales de dichos tomos eran arrancados con lo que se
transformaban en iones positivos. Debido a su carga positiva se dirigan hacia el ctodo.
Cuando el gas en el interior del tubo era hidrgeno se encontr la mayor relacin q/m. Se dedujo
entonces que los rayos positivos eran debido al tomo de hidrgeno sin el electrn. Otra partcula
elemental: el PROTN.
El conjunto de las experiencias en los tubos de descarga de gases nos proporciona valiosos datos
sobre la estructura de la materia:
1) El tomo contiene partculas materiales subatmicas.
2) Algunas de estas partculas, los electrones, tienen carga elctrica negativa. Cada electrn
posee una carga elctrica elemental.
3) Los electrones deben estar situados en la parte exterior del tomo pues se "arrancan" con
bastante facilidad.
4) El resto del tomo tiene carcter positivo y debe estar situado en el interior del ncleo.
5) El tomo es elctricamente neutro, tiene que haber igual nmero de partculas positivas
que negativas.
6.1.5. El neutrn.
Rutherford demostr tericamente en 1920 la necesidad de su presencia en el ncleo como
consecuencia de la exigencia de estabilidad del ncleo.
Dificultad de aislamiento debido a que es una partcula sin carga.
Su existencia fue probada en 1932 por Chadwick al bombardear ncleos ligeros por partculas alfa.
Reaccin nuclear.
4
9
Be +
2
4
He ----->
6
12
C +
0
1
n
Partculas elementales.
Nombre
Smbolos
Carga
relativa
Carga en
Coulombs
masa en
reposo (uma)
aproxim.
masa en
reposo (uma)
Electrn
e, e
-
-1
-1,6 10
-19
1/1840
0,0005486
Protn
p ,p
+
1
1
H
+1
+1,6 10
-19
1
1,00728
Neutrn
n ,
0
1
n
0
0
1
1,00867
El problema de las partculas elementales.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 4
En junio de 1984, el italiano Carlo Rubbia (1934), investigador del CERN de Ginebra, anunci la
identificacin de una nueva partcula, el quark *top+. Este hallazgo puso fin a una de las caceras
cientficas ms largas de este siglo.
Como hemos visto anteriormente, mediada la dcada de los treinta, el nmero de partculas que no
se podan dividir qued reducido a cuatro: electrn, protn, neutrn y neutrino (que ya haba sido
postulado, para explicar ciertos fenmenos radiactivos, en 1933). Aparte se tenan que tener en cuenta las
posibles antipartculas.
Para bien o para mal la cosa no qued ah. Entre los aos cincuenta y los sesenta el nmero de
partculas *elementales+( volva a acercarse al centenar! El protn y el neutrn slo eran los miembros
ms populares de una extensa familia de partculas: los hadrones. Y haba otras familias...
Ahora bien, entre los cientficos que se dedicaban a desentraar la estructura de la materia ha
habido siempre una idea obsesiva: la materia tiene que estar formada por pocas unidades elementales. Se
ha credo siempre que el problema de fondo es el de la combinacin de partculas elementales antes que el
de una gran variedad de partculas.
A mediados de los sesenta el modelo quark vena a aligerar de nuevo la situacin con una reduccin
drstica del nmero de partculas fundamentales a cambio de postular un nivel ms profundo de
organizacin.
El modelo fue propuesto por Murray Gell-Mann y George Zweig del Instituto de Tecnologa de
California. El nombre de quark lo tom Gell-Man de un personaje de la obra de James Joyce Finnegan's
Wake, un personaje que no daba nunca la cara. El modelo postula que los constituyentes elementales de la
materia son unas partculas que se pueden agrupar en dos familias: los quarks y los leptones
QUARK
UP
DOWN
CHARM
STRANGE
TOP
BOTTOM
arriba
abajo
encanta-dor
extrao
cima
fondo
carga
elctrica
+2/3
-1/3
+2/3
-1/3
+2/3
-1/3
Adems , cada quark puede tener tres posibles tipos de una nueva propiedad que se denomina carga
de color para diferenciarla de la carga elctrica. Teniendo en cuenta el color, el nmero de quarks se eleva
a 18 (6x3=18)
LEPTO-
NES
ELEC-
TRON
MUON
TAUON
NEUTRI-
NO ELEC-
TRONICO
NEUTRI-
NO
MUONICO
NEUTRI-
NO TAU-
ONICO
Carga
-1
-1
-1
0
0
0
El panorama actual presenta todas las formas de materia construibles a partir de los 18 quarks y de
los 6 leptones, mientras que se necesitan 12 partculas ms para justificar todas las interacciones
conocidas. Esto hace que el nmero de partculas elementales vuelva a elevarse a 36, a las que hay que
sumar las correspondientes antipartculas. ) Es este nmero demasiado elevado para la sensibilidad de los
cientficos? La confirmacin de la existencia del ltimo quark parece que les debera proporcionar un bien
ganado descanso, aunque, teniendo en cuenta los precedentes, es fcil apostar a que no durar mucho...
6.2. Modelo atmico de Rutherford.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 5
6.2.1. Antecedentes: La radiactividad
En 1896 un ao antes de la experiencias de Thomson con rayos catdicos, Becquerel encontr que
algunos compuestos de uranio emitan radiaciones anlogas a los rayos X. Pens que estas sustancias
emitan radiaciones cuando eran expuestas a la luz ultravioleta, pero despus se comprob que no slo en
esa circunstancia emitan radiaciones, sino que en la oscuridad tambin lo hacan, incluso con ms
intensidad.
Los esposos Curie comprobaron ms tarde que no slo los compuestos de uranio emitan
radiaciones, sino que otros de distintos elementos (polonio, radio, torio) tambin la emitan, y de mayor
intensidad. A esta capacidad que posean algunas sustancias se la llamo radiactividad.
Se comprob que estas radiaciones eran de distinta naturaleza, ya que, al someterlos a la accin de
un campo magntico, haba una que se desviaban, comportndose como un haz de electrones, radiacin ;
otra se desviaba comportndose como partculas cargadas positivamente de mayor masa, radiacin
(ncleos de helio); y otra parte que no se desviaba, radiacin (radiacin electromagntica).
6.2.2. Experiencia de Rutherford.
Rutherford hizo incidir partculas alfa procedentes de un material radiactivo sobre lminas delgadas
de Au, Ag, Al y otros metales; encontr los siguientes hechos (fig 6.7 y 6.8):
- Casi todas las partculas alfa atravesaban la lmina sin sufrir desviacin.
- Aproximadamente una partcula de cada 10.000 se desviaba ligeramente de su trayectoria.
- Un nmero extraordinariamente pequeo de la partculas que llegaban a la lmina,
rebotaban en ella.
"Esto era lo ms increble que me haba ocurrido en mi vida. Tan increble como si un proyectil de
15 pulgadas, disparado contra una hoja de papel de seda, se volviera y lo golpeara a uno"
Conclusiones:
- Atomo vaco.
- El rebote solo se explica si se supone toda la masa concentrada (ncleo) muy pequeo.
- Las grandes desviaciones observadas no podan achacarse a choques elsticos por lo que las
atribuy a fuertes repulsiones electrostticas; es decir, slo son explicables con una concentracin de
carga positiva.
- Electrones situados a distancias relativamente grandes.
6.2.3. Modelo atmico de Rutherford
Consecuentemente con su interpretacin de los resultados experimentales, Rutherford postul la
existencia en el tomo de un pequeo ncleo que encerraba toda la carga positiva y prcticamente toda la
masa del tomo (Fig 6.9).
Clculos de tipo electrosttico permiten evaluar las dimensiones del ncleo, que tiene un dimetro
del orden del fermi (1 fermi = 10
-15
m), es decir, 100.000 veces menor que el dimetro del tomo. El
dimetro de un tomo es del orden del angstrom (1 = 10
-10
m ) (Un campo de ftbol y la cabeza de un
alfiler).
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 6
Los electrones se movan por la corteza.
Como el nmero de protones (Z) es mucho menor que la masa atmica de un elemento
(aproximadamente la mitad), Rutherford tuvo que suponer que en el ncleo haba otras partculas pesadas,
sin carga elctrica, a las que llamo neutrones, y de masa aproximadamente igual a la de los protones.
Tambin hacia falta para explicar la estabilidad del ncleo la existencia de fuerzas nucleares:
fuerza nuclear fuerte y fuerza nuclear dbil. La fuerza nuclear fuerte es de corta distancia y se da entre los
nucleones; a una distancia del orden del fermi esta fuerza es diez veces ms intensa que la fuerza de
repulsin electrosttica entre los protones, a distancias superiores la fuerza electrosttica es superior a la
fuerza nuclear fuerte. La fuerza nuclear dbil da origen a una cierta estabilidad en el ncleo; tambin es de
corto alcance y es la responsable de la radiacin beta, es decir de la transformacin de un neutrn en un
protn y un electrn y la emisin de este ltimo.
6.2.4. Las partculas fundamentales forman los diversos elementos.
Si el tomo est compuesto por tres partculas fundamentales, ) cmo surge de ah la pluralidad de
los diversos elementos?
Un tomo se distingue del de otro elemento precisamente en el nmero de partculas
fundamentales.
Al disponer los elementos del ms ligero al ms pesado, se comprueba que al pasar de uno al
siguiente, el nmero de protones (y, por tanto, el de electrones) aumenta de una en una unidad.
Ejemplos y excepciones en el orden msico. Como estudiaremos posteriormente el orden es el del
nmero de protones.
Un elemento se caracteriza por el nmero de protones que tenga, Z, nmero atmico, como
demostr Moseley en el estudio del espectro discontinuo de rayos X
Z, nmero atmico es el nmero de protones de un tomo en el ncleo.
Cuando dos tomos tienen igual Z pero distinto nmero de neutrones son tomos del mismo
elemento (istopos, ocupan el mismo lugar en el orden de la tabla de periodos).
Ejemplos. Se conocen dos variedades estables de tomos con tres protones:
10 3p, 3n, 3e (A=6)
6
Li
ambos son Li
20 3p, 4n, 3e (A=7)
7
Li
Las dos variedades se diferencian en el nmero de neutrones, N, y, por tanto, en su masa atmica,
que es aproximadamente igual a la suma del nmero de protones y de neutrones. Por ello, el nmero entero
que da esta suma se llama nmero msico A
A = Z + N
A nmero msico es el nmero de nucleones (protones mas neutrones) del ncleo de un
tomo.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 7
Un tomo se simboliza
A
Z
X
Ejemplos
Istopos son tomos que poseen el mismo Z pero distinto A
Esto explica que las masas atmicas de algunos elementos (formados por varios istopos) difieran
bastante de ser nmeros enteros. Por ejemplo, el cloro, formado por dos istopos:
Istopos
Partculas fundamentales
Masa
isotpica
Abundancia
Masa atmica
Cloro-35
17p, 18n, 17e
34,97
75,5%
Cloro-37
17p, 20n, 17e
36,94
24,5%
35,45
Segn se aprecia, la masa atmica de un elemento depende de la abundancia de sus istopos, as
como de las masas isotpicass de cada uno de ellos.
Formacin de iones. Ejemplos.
6.2.5. Insuficiencia del modelo de Rutherford.
- El modelo de tomo de Rutherford estaba en contradiccin con las leyes electromagnticas
clsicas desarrolladas por Maxwell, ya que, segn stas el electrn al girar, tena que emitir energa
radiante con lo que ira perdiendo energa y al final caera sobre el ncleo; por lo tanto era un modelo de
tomo inestable.
- No explicaba los espectros de rayos X y los espectros atmicos, que mostraban claramente el
carcter cuantizante de la energa.
- El efecto fotoelctrico confirm la hiptesis de Planck postulada en el estudio del calor especfico
de los slidos y de la radiacin del cuerpo negro. El modelo de Rutherford no la contemplaba.
- No se conocan los neutrones, por lo que los clculos basados en el modelo de Rutherford son
necesariamente incorrectos.
6.3. Espectros.
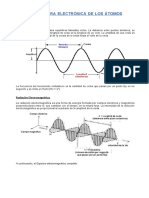
Espectro es el anlisis de las longitudes de onda de una radiacin electromagntica mediante el
espectroscopio.
El espectroscopio consta de una fuente luminosa, prisma separador de la radiacin y cmara
espectroscpica. (Fig 6.10)
6.3.1. Espectro electromagntico de la luz.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 8
Cuando un haz de luz blanca pasa a travs de un prisma Fig(6.11), se dispersa dando lugar a un
conjunto de colores: rojo, naranja, amarillo, verde, azul y violeta y toda la gama de colores intermedios,
formando lo que se denomina el espectro visible. Cada uno de estos colores corresponde a una radiacin
electromagntica de longitud de onda y frecuencia caractersticas . La relacin entre y viene dada
por:
c =
donde c = 3.10
8
ms
-1
es la velocidad de propagacin de la radiacin electromagntica en el vaco.
En realidad el espectro visible constituye una porcin muy reducida del espectro electromagntico.
Espectro electromagntico de la luz. Fig (6.12)
6.3.2. Espectros continuos y discontinuos.
Si un espectro contiene todas las longitudes de onda en un amplio intervalo de ellas, como el
espectro electromagntico, se dice que es continuo. Cuando se excita un gas a baja presin, ste emite
nicamente radiacin de ciertas frecuencias, dando lugar a un espectro de emisin discontinuo, el cual es
caracterstico del gas emisor. Este hecho hace que este espectro sea un mtodo muy utilizado para la
identificacin de las sustancias.
Espectros de emisin y espectros de absorcin. Distinguir.
6.3.3. Espectros de rayos X.
Cuando en un tubo de rayos catdicos se emplea como antictodo (nodo) un metal duro aparece
una radiacin (Fig 6.13), en principio de origen misterioso, que se le llam rayos X.
Caractersticas de estos rayos:
- No son materiales.
- Elevada energa.
- Ionizan los gases.
- Impresionan placas fotogrficas estando ocultas y atraviesan sustancias opacas no muy densas.
(aplicacin mdica).
Cuando se analiz dicha radiacin se pudo observar dos tipos de espectros:
a) Un espectro continuo
El origen de este espectro es debido a la transformacin de la energa cintica de los rayos
catdicos en energa electromagntica, que tiene lugar en el choque en el antictodo. Como la energa
cintica de los rayos catdicos puede tomar cualquier valor (depender de la diferencia de potencial) la
radiacin emitida contiene todas las frecuencias comprendidas entre cero y un valor mximo, espectro
continuo.
b) Un espectro discontinuo formado por unas rayas ntidas superpuesto con el anterior. Este
espectro es caracterstico del elemento qumico que forma el antictodo.
En 1914, Moseley utiliz diversos elementos como antictodo y encontr una relacin entre la
frecuencia de la radiacin y el nmero atmico del elemento.
Esta ecuacin de Moseley jug un papel importante en la clasificacin peridica de los elementos.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 9
6.4. El espectro del tomo de hidrgeno.
A finales del siglo XIX se observ que las frecuencias del espectro discontinuo de un elemento en
estado gaseoso (fig 6.14) se podan agrupar en conjuntos denominados series espectrales y que, en
algunos casos, las frecuencias dentro de una determinada serie podan calcularse a partir de una frmula
emprica sencilla.
La primera de esta series la encontr Balmer en 1885, al estudiar el espectro visible del tomo de
hidrgeno Fig (6.15). A medida que aumenta la frecuencia, las lneas espectrales se aproximan unas a otras
cada vez ms hasta alcanzar el lmite de la serie.
La frmula emprica hallada por Balmer para este serie es:
]
n
1
-
2
1
[ R =
1
=
2 2
Donde n = 3,4,...
En esta expresin aparece la magnitud , que se denomina nmero de ondas = 1 / , e indica el
nmero de longitudes de onda que hay por unidad de longitud.
La constante R se denomina constante de Rydberg y su valor es 1,097 10
7
m
-1
.
Explicar con un grfico ilustrativo la diferencia entre y . Dibujar una onda tranversal cuya sea
de 25 cm y completar cuatro ondas hasta la distancia de 1 m; entonces el nmero de ondas por unidad
de longitud ser 4 ondas/m, es decir, 4 m
-1
, 1/0,25 m.
Adems de la serie de Balmer existen otras series que quedan fuera de la zona visible del espectro.
En dichas series, los nmeros de onda de las lneas espectrales vienen dadas por la ecuacin:
]
n
1
-
n
1
[ R =
1
=
2
2
2
1
Para n
1
= 1 y n
2
= 2,3,4..., los nmeros de onda corresponden a la serie Lyman en el ultravioleta
lejano.
Para n
1
= 2 y n
2
= 3,4,5..., los nmeros de onda corresponden a la serie Balmer en el visible.
Para n
1
= 3 y n
2
= 4,5,6..., los nmeros de onda corresponden a la serie Paschen en el infrarrojo
muy cercano.
Para n
1
= 4 y n
2
= 5,6,7..., los nmeros de onda corresponden a la serie Brackett en el infrarrojo
cercano.
Para n
1
= 5 y n
2
= 6,7,8..., los nmeros de onda corresponden a la serie Pfund en el infrarrojo
cercano.
Las conclusiones a las que podramos llegar despus de los datos experimentales obtenidos en
el estudio de los espectros atmicos seran:
- No se emite cualquier radiacin ni toda la radiacin.
- Cada elemento tiene un espectro de rayos especfico (su "huella dactilar") que sirve para
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 10
identificarlo.
- La radiacin procede del estado excitado del tomo, por lo que es una manifestacin del
elemento en ese estado.
- Cualquier teora que quiera explicar la estructura interna del tomo debe explicar los
espectros atmicos.
6.4.1. El efecto fotoelctrico. Naturaleza corpuscular de la luz.
En 1887, Hertz observ que la intensidad de la descarga elctrica entre dos electrodos metlicos
aumentaba al iluminarlos con luz ultravioleta. Este hecho se explic suponiendo que la luz al incidir sobre
la superficie metlica arrancaba electrones. El fenmeno por el cual los electrones son arrancados de un
metal por efecto de la luz, se denomin efecto fotoelctrico. Los electrones emitidos recibieron el nombre
de fotoelectrones.
Aplicacin de este efecto a clulas fotoelctricas, descripcin y utilidades (Fig 6.16)
Partiendo de la teora de Maxwell que concibe la luz como una onda electromagntica, que como
tal onda, distribuir uniformemente su energa, considerar a ttulo de hiptesis la influencia de la
frecuencia y la intensidad luminosa sobre la emisin de electrones (la cantidad de electrones emitidos por
segundo, su energa cintica, el tiempo que tardarn en ser emitidos...). Ver tambin el efecto de cambiar
de metal.
Las predicciones de la teora de Maxwell, la fsica clsica seran:
a) La energa cintica de los electrones liberados depender de la intensidad de la onda y de la
frecuencia.
b) Existir un tiempo de retardo entre el choque de la luz sobre la superficie y la emisin de los
electrones porque como toda la energa de la luz est distribuida uniformemente en el frente de onda, es
necesario un intervalo de tiempo- menor cuanto mas intensa sea la onda- durante el cual el electrn est
absorbiendo energa de la luz hasta que acumule la suficiente para escapar.
c) Para un metal dado, el efecto fotoelctrico debe ocurrir para cualquier frecuencia de la luz, con
la nica condicin de que la luz sea lo bastante intensa para proporcionar la energa necesaria para
expulsar los electrones.
El estudio experimental del efecto fotoelctrico puso de manifiesto los siguientes hechos:
1 - Para un metal dado, el efecto fotoelctrico slo se presenta por encima de una cierta frecuencia
umbral v
0
, sea cual sea la intensidad luminosa.
2 - Si la frecuencia v se mantiene constante por encima de un valor mnimo v
0
, el nmero de
electrones crece con la intensidad luminosa, pero no ocurre as con la energa cintica de dichos electrones
que se mantiene constante.
3 - La energa cintica de los electrones crece linealmente con la frecuencia v a partir de un valor
umbral v
0
, caracterstico de cada metal de acuerdo con la figura (6.17).
4 - La emisin de electrones superada la frecuencia umbral es prcticamente instantnea.
Figura del resultado de los datos experimentales
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 11
Estos hechos experimentales estaban en contradiccin con lo que predice la Fsica clsica segn la
cual la energa cintica de los electrones liberados dependera de la intensidad de la onda y debiera existir
un tiempo de retardo entre el choque de la luz sobre la superficie y la emisin de electrones, porque como
la energa de la luz est distribuida uniformemente en el frente de onda sera necesario una acumulacin de
energa en el electrn para que pudiera liberarse.
En 1905, Einstein dio una explicacin satisfactoria del efecto fotoelctrico al aplicar las ideas de
Planck sobre la discontinuidad de la energa a la luz misma. Consider a la luz como un corriente de
corpsculos, que denomin fotones, y asign a cada uno de ellos una energa:
E = h v
Y supuso que la energa de cada fotn era capturada por un electrn. Una parte de esta W,
denominada energa de extraccin, se empleaba en arrancar el electrn del metal y el resto le comunicaba
la energa cintica observada.
v
m
2
1
+ W = h
2
max
De acuerdo con el principio de conservacin de la energa:
La energa de extraccin W es la energa necesaria para extraer el electrn sin comunicarle energa
cintica. Si hacemos 1/2 m v
2
max
= 0 en la ecuacin anterior obtenemos:
h v
0
= W
Donde v
0
es la frecuencia umbral, a partir de la cual los electrones adquieren un determinada velocidad.
As pues, la ecuacin puede escribirse:
E
c
= 1/2 m v
2
max
= h v - h v
0
La cual concuerda con la grfica (6.17), obtenida experimentalmente.
Es interesante remarcar que, si bien la teora del efecto fotoelctrico fue un gran apoyo a la teora
de Planck y extendi la hiptesis de la discontinuidad de la energa a la misma radiacin, en cambio,
volvi a resucitar la vieja controversia acerca de la naturaleza de la luz: ) ondulatoria o corpuscular? El
dilema se resolvi admitiendo que la naturaleza de la luz es dual, es decir, algunos fenmenos, tales como
las interferencias y la difraccin deben explicarse con la teora ondulatoria, en cambio, otros, como por
ejemplo el efecto fotoelctrico, deben explicarse con la teora corpuscular.
6.5. Modelo atmico de Bohr.
En 1913 Niels Bohr dio una explicacin satisfactoria del espectro del tomo de hidrgeno,
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 12
constituido por un protn y un electrn. Para ello hizo las siguientes hiptesis:
1 - El electrn se mueve en rbitas circulares estacionaras alrededor del ncleo.
2 - Las nicas rbitas permitidas, estacionarias, son aquellas en las que el momento angular, L, del
electrn es un mltiplo entero de h/2.
L = n h/2
3 - Mientras el electrn se mueve en una rbita permitida, estacionara, no emite energa radiante.
Cuando el electrn pasa de una rbita de energa E
2
a otra de energa E
1
, siendo E
1
< E
2
, emite radiacin
cuya frecuencia viene dada por:
h
E
-
E
=
1 2
Veamos como a partir de estas hiptesis Bohr encontr una expresin para las frecuencias de la
radiacin emitida por el tomo de hidrgeno, que coincida con las frmulas empricas mencionadas
anteriormente.
La fuerza centrpeta que mantiene unido al electrn alrededor del ncleo es debida a la atraccin
electrosttica entre ambos, por lo tanto:
r
v
m
=
r
e
4
1
2
2
2
0
(Ecuacin 6.5)
Donde m es la masa del electrn, e su carga elctrica, v su velocidad alrededor del ncleo y r es el
radio de la rbita.
La segunda hiptesis de Bohr implica:
L = m v r = n h/2
Donde n = 1,2,3... nmero entero.
n r
=
r
;
n
e
m
h
=
r
2
1 n
2
2
0
2
n
De las dos ecuaciones anteriores se deduce que el valor de r viene dado por la expresin:
siendo r
1
el valor del radio de la primera rbita, cuando n = 1. Por tanto los radios de las distintas rbitas
son mltiplos de la primera y depende de n
2
.
En la fig 6.18 se han representado algunas rbitas posibles.
El paso siguiente consiste en calcular el valor de la energa correspondiente a cada rbita permitida.
La energa total del electrn viene dada por la suma de sus energas cintica y potencial:
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 13
r 4
e
-
v
m
2
1
=
E
+
E
= E
0
2
2
p c
El signo menos es debido a que se toma el cero de energa potencial cuando r --> 4. Teniendo en
cuenta la ecuacin (6.5 )
v
m
2
1
= )
r
e
4
1
(
2
1
2
2
0
E
2
1
=
r 4
e
2
1
- =
r
e
4
1
-
r
e
4
1
2
1
= E
p
0
2 2
0
2
0
De donde:
n
E
- =
E
;
n
1
h
8
e
m
- =
E
2
1
n
2 2 2
0
4
n
Sustituyendo r por su valor (ecuacin ), se obtiene:
(Ecuacin 6.6)
Esta expresin demuestra que los valores de la energa total del electrn dependen del nmero
entero n. Dicho nmero n recibe el nombre de nmero cuntico principal.
E
1
es la energa de la primera rbita, cuando n=1. Estudiar la variacin de la energa de las distintas
rbitas y comprobar que cuando n ---> 4 el valor de la energa tiende a cero es decir el electrn no estara
entonces bajo el influjo del ncleo, se habra ionizado.
A los valores de la energa dados por la ecuacin anterior se les denomina niveles de energa del
tomo de hidrgeno y estn representados en la figura (6.19). El nivel ms bajo, E
1
, se llama estado
fundamental y los dems E
2
, E
3
,... estados excitados. Puede observarse que, cuanto mayor es el valor de n,
ms pequeo es el espaciado energtico entre niveles, lo que da lugar a una distribucin casi continua de la
energa.
Teniendo en cuenta la tercera hiptesis de Bohr y la ecuacin (6.6) la frecuencia de la radiacin
emitida cuando el electrn pasa de un estado de energa E
2
a otro de energa E
1
, siendo E
1
< E
2
, viene dado
por la expresin:
]
n
1
-
n
1
[
h
8
e
m
=
h
E
-
E
=
2
2
2
1
3 2
0
4
1 2
]
n
1
-
n
1
[
c
h
8
e
m
=
c
=
1
=
2
2
2
1
3 2
0
4
Si se utiliza el nmero de ondas tenemos:
Esta expresin es anloga a las frmulas empricas dadas anteriormente, y al sustituir en la
ecuacin anterior los valores numricos de las constantes que en ella aparecen obtenemos un valor que
coincide con el valor de la constante de Rydberg calculado experimentalmente por los espectroscopistas,
lo cual constituye un buen apoyo a la hiptesis de Bohr.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 14
Explicacin del espectro del tomo de hidrgeno y del potencial de ionizacin.
n = 2
n = 3
n = 4
n = 5
n =
n = 1
Series espectrales
n = 6
Lyman
Paschen
Balmer
Bracket
Pfund
Espectro
UV Visible Infrarrojo
SERIES: Lyman Balmer Paschen Bracket Pfund
E = h
La teora de Bohr puede ampliarse a sistemas que tienen un solo electrn. El He
+
, helio ionizado, y
el Li
++
, litio doblemente ionizado, son ejemplos de sistemas que se comportan de forma anloga al tomo
de hidrgeno.
DATO: Valores de la constante de Rydberg R
R = 109.678 cm
-1
R = 1,09678 10
7
m
-1
R = 2,18 10
-18
J R = 3,3 10
15
Hz
Nota:
c h =
c
h = h = E
De acuerdo con la ecuacin de Plank:
el valor de la energa se puede expresar en J, Hz, cm
-1
o m
-1
ya que hay una proporcionalidad directa entre
ellos.
6.5.1. Dificultades del modelo de Bohr: nuevos nmeros cunticos.
A pesar del xito inicial del modelo de Bohr pronto se vio que ste no poda explicar los espectros
de elementos con ms de un electrn, debido a que las lneas espectrales aparecan a mayores valores que
los experimentales, y adems si se observaba los espectros con espectroscopios ms potentes aparecan
ms frecuencias de las previstas (dobletes, tripletes). Ello indicaba que deba haber ms niveles energticos
muy prximos.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 15
6.5.2. Orbitas elpticas: nmero cuntico de momento angular.
Sommerfeld ampli la teora de Bohr mediante la consideracin de que la rbita del electrn era
elptica.
Como resultado de esta ampliacin los niveles de energa definidos por el nmero cuntico n, se
desdoblan en subniveles, los cuales se caracterizan por un nuevo nmero cuntico, l, que recibe el nombre
de nmero cuntico de momento angular. Para un valor dado de n los valores que puede tomar l son: 0,
1, 2,.... (n-1).
En el modelo de Sommerfeld el valor del momento angular del electrn viene dado por la
expresin:
2
h
1) + (l l = L
El nmero cuntico l da idea de la excentricidad de la rbita elptica. Fig (6.20)
6.5.3. Efecto Zeeman. Nmero cuntico magntico.
Cuando se obtiene el espectro de un tomo bajo la influencia de un campo magntico externo B, el
nmero de rayas espectrales aumenta. Este efecto se conoce con el nombre de efecto Zeeman. Este puede
explicarse si se supone que el plano de la rbita del electrn nicamente puede tener ciertas orientaciones
respecto a la direccin del campo magntico B. Las orientaciones permitidas son aquellas en las que la
componente del momento angular en la direccin del campo magntico L
z
, toma algunos valores dados por
la expresin:
L
z
= m
l
h/2
Donde m se denomina nmero cuntico magntico y, para un valor dado del nmero cuntico l,
puede tomar los valores:
-l, -(l-1),... -2, -1, 0, 1, 2, ....(l-1), l
El nmero de orientaciones permitidas para un valor determinado de l es (2l+1). En la fig (6.21) se
han representado las posibles orientaciones para l=2.
6.5.4. Spin del electrn. Nmero cuntico de Spin.
Al utilizar un espectroscopio de elevada resolucin y sometido el tomo bajo la influencia de un
campo magntico externo, se observa que las rayas espectrales son dobles. Esta duplicidad se puede
explicar si se supone que el electrn, adems de girar alrededor del ncleo, gira sobre s mismo. En su
movimiento orbital debido a que el electrn es una partcula con carga elctrica, crea un campo magntico.
Pero al girar sobre s mismo tambin se comporta como un pequeo imn cuyo campo magntico, tal como
se ve en la fig (6.22), puede tener sentido igual u opuesto al anterior.
De esta forma en lugar de un nivel de energa hay dos muy prximos. Consecuencia de esto es la
introduccin de un cuarto nmero cuntico de spin s, cuyos valores pueden ser +1/2 y -1/2 en unidades
h/2.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 16
La Figura 6.23 muestra un ejemplo de los desdoblamientos de las lineas espectrales debido a estos
efectos.
2.6. Fsica Cuntica.
A pesar de las sucesivas correcciones del modelo atmico de Bohr, ste se manifestaba insuficiente
para dar explicacin de todos los fenmenos y experiencias atmicos.
La necesidad de introducir, de forma un tanto arbitraria, nuevos nmeros cunticos para poder
explicar los nuevos hechos experimentales mediante la teora original de Bohr, es consecuencia del hecho
de que sta es una aplicacin de las ideas cunticas a la mecnica clsica. Es decir, los principios y leyes
de la escala microscpica se aplican a escala microscpica con algunas correcciones y lo que hemos de
cambiar es el planteamiento del problema, un nuevo "punto de vista" bajo el cual observamos el fenmeno.
Crisis de la fsica clsica
Es necesario por tanto, una teora mejor.
En este apartado estudiaremos el inicio de una teora mucho ms general para la comprensin de la
estructura atmica. Esta teora nace en 1.924 y se denomina mecnica cuntica o mecnica ondulatoria,
cuyas bases son:
- Ecuacin de Planck E = h v
- Hiptesis de De Broglie = h / p
- Principio de incertidumbre de Heisemberg x p h/2
6.6.1. Hiptesis de De Broglie .
Aunque los trabajos de Planck, Einstein, Bohr y otros haban confirmado de manera rotunda la
naturaleza cuntica, discontinua de la luz y de los sistemas atmicos, dichos trabajos slo pudieron ser
considerados como los orgenes de la nueva concepcin de la materia que habra de sustituir a las teoras
clsicas
En efecto, podemos considerar que el establecimiento de la fsica cuntica se inicia en 1924 con los
trabajos de Luis De Broglie, en los que introduce una nueva y atrevida hiptesis consistente en atribuir a
los electrones y, en general, a cualquier objeto, un comportamiento ondulatorio, adems de su evidente
comportamiento corpuscular.
) Cules son los argumentos en favor de la hiptesis de De Broglie?
Si admitimos una cierta simetra en la naturaleza y se ha demostrado que la luz posea
conjuntamente con sus evidentes propiedades, ondulatorias propiedades tpicamente corpusculares; y si
existen objetos materiales, los fotones, con esta doble caracterstica ondulatoria-corpuscular, ) por qu no
concebir la posibilidad de que este mismo se de en cualquier objeto material?
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 17
De Broglie no se limito a enunciar simplemente una hiptesis cualitativa sino que trat de
relacionar las magnitudes caractersticas del movimiento ondulatorio, la frecuencia o la longitud de onda,
con las del corpuscular, cantidad de movimiento. Podemos establecer la relacin para un fotn, a partir de
la energa dada por la ecuacin de Planck E = h v , segn la relatividad E = m c
2
, generalizando despus el
resultado para todos los objetos materiales.
E = h v
= h / p
E = m c
2
Aplicacin:
Determinar la longitud de onda de los siguientes cuerpos comparndola con la de los rayos X (del
orden de 10
-10
m):
a) Una pelota de tenis de 10 g lanzada a 1 m/s
b) Un electrn que sometido a un campo elctrico ha adquirido la velocidad de 6 10
5
m/s (m = 9,1
10
-31
Kg)
La longitud de onda predicha por la hiptesis de De Broglie para el electrn indicado resulta del
orden de 10
-9
m, comparable a la de los rayos X, pudindose, pues, pensar en la posibilidad de detectar su
existencia. Por el contrario, la longitud de onda de los objetos macroscpicos es tan pequea (10
-32
m) que
es imposible detectarla, lo que justifica el hecho de que dichos objetos no muestren comportamiento
ondulatorio.
En 1.927 Davisson y Germer verificaron la hiptesis de De Broglie al estudiar las figuras de
difraccin obtenidas cuando se haca pasar un haz de electrones a travs de una delgada lmina metlica.
Los diagramas debidos a la difraccin de electrones son comparables a los obtenidos en la difraccin de
rayos X. Aplicacin de la difraccin de electrones al microscopio electrnico.
) Cmo se puede interpretar el comportamiento ondulatorio de objetos como los electrones? ) En
qu pueden consistir dichas ondas?
Interpretaciones:
- "onda asociada", gua o piloto de la partcula, con una relacin entre ellas similar a la existente
entre las planchas del "surf" y las olas que la arrastran. No explica la indisoluble unidad entre la onda y la
partcula.
- Reducir el aspecto corpuscular a un efecto puramente ondulatorio, considerando al electrn como
un "paquete de ondas". Sin embargo, un paquete de ondas por muy compacto que sea, se difunde
rpidamente por el espacio desapareciendo cualquier posible comportamiento corpuscular.
- Suponer que los electrones son simples corpsculos y que el comportamiento ondulatorio aparece
debido al gran nmero de ellos. Sin embargo la difraccin observada en los electrones no debera
presentarse al trabajar con un nmero muy reducido de ellos y no es as.
Es decir, todos los intentos de reducir la complejidad onda/corpsculo a un slo efecto fracasaron y
necesitamos una nueva interpretacin: "los electrones o los fotones, por ejemplo, no son ni pequeas bolas
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 18
(partculas) ni pequeas olas (ondas), no es ninguna de las dos, y deben ser absolutamente concebidos
como objetos de tipo nuevo, los cuantones" (Levy-Leblond 1.984).
Por tanto, un cuantn no es ni una partcula clsica ni una onda clsico, que slo son modelos
aproximados que describen el comportamiento de un gran nmero de cuantones, aunque en circunstancias
extremas se asemejen a una partcula y en otras a una onda.
Con la hiptesis de De Broglie se deduce fcilmente el segundo postulado de Bohr al considerar
que la rbitas estables estacionarias son aquellas en que la longitud de la rbita es un mltiplo entero de la
longitud de onda, de esta manera no se "perdera" en el espacio al no tener interferencias con las ondas de
otros electrones por lo que no emitira energa, es decir:
6.6.2. Principio de incertidumbre de Heisemberg.
La mecnica clsica permite, si conocemos la ecuacin del movimiento r
r
= r
r
(t) y el estado de
un sistema en un instante dado, condiciones iniciales, determinar el estado en cualquier otro instante. En
ello reside la base del determinismo clsico, doctrina que afirma que si se conoce el estado presente de un
sistema y su ley de fuerzas es posible predecir con exactitud el resultado de cualquier medida sobre el
mismo.
El carcter ondulatorio del electrn viene asociado cualitativamente a la idea de una cierta
deslocalizacin que impide situar en un punto determinado al electrn e introduce, por tanto, una cierta
indeterminacin en el movimiento que puede seguir el electrn, por lo cual, ste carecer de una
trayectoria absolutamente determinada.
Cuando realizamos alguna medida, siempre existe alguna incertidumbre o error. Ejemplos. No
obstante, esperamos que utilizando instrumentos mas precisos podamos hacer infinitamente pequea la
incertidumbre de la medida.
Ahora bien, segn la mecnica cuntica existe realmente un lmite a la precisin de ciertas
medidas. Este lmite no constituye una restriccin a lo bien que puedan construirse los instrumentos, sino
que es inherente a la naturaleza. Es el resultado de dos factores: la dualidad corpsculo-onda y la
inevitable interaccin entre la cosa observada y el instrumento de observacin.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 19
Ejemplos.
Veamos ahora dnde entra en juego la dualidad corpsculo-onda. Imaginemos un experimento
pensado en el cual intentemos medir con fotones la posicin de un electrn (u otro objeto pequeo),
aunque los razonamientos seran los mismos si utilizramos un microscopio electrnico. De acuerdo con la
teora ondulatoria los objetos se pueden ver con una precisin no mayor que la longitud de onda de la
radiacin utilizada. Por tanto, si queremos una medida precisa de la posicin deberemos utilizar una
longitud de onda corta. Pero sta correspondera a una frecuencia elevada y a una energa elevada ( E = h
v) y cuanto ms energa tengan los fotones mayor cantidad de movimiento podrn comunicar a nuestro
electrn cuano choquen con l. Si se utilizaran fotones de mayor longitud de onda y por tanto menor
energa, el movimiento del electrn no se vera tan afectado, si bien su posicin se conocera con menor
precisin. Vemos, pues, que el acto de observar produce una incertidumbre importante tanto en la posicin
como en la cantidad de movimiento del electrn. Esta es la esencia del principio de incertidumbre
enunciado por Heisenberg en 1927.
Cuantitativamente, podemos realizar un clculo aproximado de la magnitud de este efecto. Si
utilizamos luz de longitud de onda , la posicin se medir con una precisin, como mximo, igual a . Es
decir, la incertidumbre x de la medida de la posicin es
x .
Supongamos que el objeto se puede detectar con un solo fotn (ste es el caso ms favorable;
normalmente sern necesarios muchos fotones). El fotn tiene una cantidad de movimiento p = mv = h / ;
y cuando choque con nuestro objeto le ceder parte de su cantidad de movimiento o toda ella. Por tanto, la
cantidad de movimiento final de nuestro objeto la conoceremos con una incertidumbre
p . h /
ya que no podemos decir de antemano cunta se ceder. El producto de dichas incertidumbres es
Desde luego, las incertidumbres podran ser peores que sta, segn cul sea al aparato. En el
clculo ms preciso efectuado por Heisenberg encontr que, como mximo,
h ) p ( ) x (
x p >= h/4
En el razonamiento anterior puede no quedar claro que el problema no es determinar con precisin
la posicin del electrn, sino que la imposibilidad de determinar simultneamente con precisin absoluta
la posicin x y la cantidad de movimiento p del electrn, y los lmites de precisin vienen dados por las
relaciones de indeterminacin de Heisemberg
Cabe suponer que dicha imprecisin reaparecer en la determinacin de otras magnitudes cuyo
producto tenga las mismas dimensiones que h, como por ejemplo, la energa y el tiempo. Efectivamente
Heisemberg estableci tambin que:
E t >= h/4
Implicaciones de las relaciones de indeterminacin:
- La imposibilidad del conocimiento simultneo de x y p.
- Consecuentemente, el concepto de trayectoria deja de tener sentido.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 20
- El establecimiento de los lmites de validez de la Fsica Clsica (aspecto que desarrollamos
ahora).
Aplicacin:
Determinar la imprecisin en la posicin de:
a) un grano de polvo (10
-8
m de dimetro) que pese 10
-8
Kg y avance a una velocidad de 1,00
0,01 m/s.
b) un electrn (tamao convencional 10
-18
m) que avance con la misma velocidad (m
e
= 9,1 10
-31
Kg)
Qu importancia tendr dicha imprecisin respecto al tamao de ambos?
La indeterminacin para los objetos macroscpicos ( x = 10
-25
m) es absolutamente despreciable
frente al tamao del objeto, al contrario de lo que sucede en los microscpicos ( x = 10
-1
m) que es
billones de veces superior al atribuido experimentalmente. Por ello, el principio de indeterminacin no
juega ningn papel en las medidas de posicin y velocidad a menos que se trate de objetos
microscpicos. De ah que, las relaciones de indeterminacin establecen los lmites ms all de los cuales
no se pueden aplicar los conceptos de la Fsica clsica.
Comentar las siguientes proposiciones sealando hasta que punto pueden considerarse correctas o
incorrectas:
1 - La indeterminacin puede considerarse fruto de la imprecisin de los instrumentos y tcnicas de
medida utilizadas y slo es subsanable en la medida en que dichos instrumentos y tcnicas se perfeccionan.
2 - La indeterminacin es consecuencia del mismo proceso de medida que, como toda interaccin,
perturba aquello que se observa (as para ver a un electrn hay que iluminarlo y al hacerlo se le comunica
energa alterando su estado y modificando su posicin). Segn ello la indeterminacin aparece
indisociablemente unida a la observacin.
Otros ejemplos: medida de la temperatura de pequeas cantidades de lquido; comprobar si en una
habitacin oscura existe una bola de billar y su velocidad disponiendo solamente de bolas de billar para
averiguarlo...
3 - La indeterminacin hace referencia a la propia naturaleza de la materia, que no se presenta en
forma de objetos con contornos absolutamente definidos, que siguen trayectorias perfectamente
determinadas.
Visin mecano-cuntica de los tomos.
La hiptesis de De Broglie al establecer una relacin entre el aspecto corpuscular y el ondulatorio
para todos los objetos fsicos, vena al mismo tiempo a invalidar la leyes clsicas de descripcin del
movimiento y exiga nuevos conceptos y nuevos principios, es decir, una nueva Mecnica, que incluyera la
clsica como caso particular.
Segn la mecnica cuntica, los electrones no existen en las rbitas circulares perfectamente
definidas de la teora de Bohr, sino que estn distribuidos por el espacio, en forma de "nube" de carga
negativa. Se puede calcular la forma y tamao de la nube de electrones para un estado dado del tomo. La
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 21
nube electrnica correspondiente al estado fundamental del hidrgeno tiene simetra esfrica, ver figuras.
Queda claro que la orbita es "difusa". La nube electrnica indica burdamente el "tamao" del tomo; pero
al igual que una nube no tiene una frontera marcada, los tomos no tienen un contorno preciso o un tamao
bien definido.
6.6.3. La funcin de ondas: ecuacin de Schrdinger.
Cmo podra describirse en Fsica clsica el estado de movimiento de una partcula? Y el de una
onda? Por el contrario, cmo podra describirse en Fsica cuntica el estado de, por ejemplo, un electrn?
Dado que los electrones (o los cuantones), no son ni simplemente ondas ni simplemente partculas
es necesaria una nueva descripcin del estado de un sistema cuntico. Para ello Schrdinger introdujo una
funcin que se denomin funcin de ondas o funcin de estado.
Cul es su significado? En s misma, no tiene significado fsico alguno, solamente tiene
significado matemtico de descripcin del estado de un sistema; en cambio s lo tiene su cuadro
2
. De
igual manera que la cantidad variable que caracteriza a las ondas clsicas es su amplitud, cuyo cuadrado es
proporcional a la intensidad, el cuadrado de la funcin de ondas est relacionado con la intensidad de las
ondas de De Broglie; y ya que stas describen el movimiento de una partcula, se puede decir que las
regiones del espacio en las cuales es ms probable encontrar a dicha partcula son aquellas en las que el
valor de
2
es ms grande.
2
significa pues la probabilidad por unidad de volumen de encontrar la partcula en una cierta
regin del espacio.
Por tanto sustituimos el concepto de trayectoria definida por una partcula por el de probabilidad de
localizarla en una determinada regin del espacio.
En 1926 Schrdinger hall la ecuacin que relaciona con las caractersticas de la partcula en
movimiento, la ecuacin de estado o ecuacin de ondas:
E = H
Y as como la ecuacin de Newton, F = m a , nos da en mecnica clsica le evolucin de un
sistema, en cuntica es la ecuacin de Schrdinger.
Al resolverse esta ecuacin compleja, hay diversas funciones posibles (correspondientes a valores
propios de la energa) que son soluciones de esta ecuacin. Y estas soluciones deben cumplir en general
que:
Para valores de la energa E<0, es decir, para estados ligados de la partcula, la ecuacin de
Schrdinger slo presenta soluciones distintas de cero para la funcin de ondas para
determinados valores de la energa, hacindose nula en los dems casos. Estos valores de la
energa estn cuantificados por una serie de nmeros (n , l , m ) que coinciden exactamente con los
valores introducidos en la explicacin de los espectros y que caracterizan, por tanto el estado de un
electrn.
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 22
Por el contrario, para valores de energa E>0, que corresponden a estados no ligados o libres, la
ecuacin de Schrdinger proporciona siempre una solucin distinta de cero para la funcin de
ondas lo que significa que una partcula libre puede tomar cualquier valor de la energa.
La interpretacin fsica del hecho es que, en los estados ligados, la funcin de ondas slo existe
para ciertos valores de la energa, es decir, aparece la discontinuidad en los valores posibles de la energa,
lo cual ya haba sido obtenido por Bohr.
Sin embargo, estos niveles de energa surgen como consecuencia del carcter ondulatorio del
electrn y no ligados a la supuesta existencia de rbitas electrnicas que carecen de sentido.
En efecto, en vez de rbitas, la ecuacin de ondas nos proporciona funciones de onda ,
caracterizadas no por un slo nmero cuntico, como la rbitas de Bohr, sino por tres nmeros (n, l, m )
que nos describen el estado de energa E, el momento angular l, y la tercera componente del momento
angular m
l
. Adems el mdulo al cuadrado de la funcin de ondas nos proporciona la probabilidad de
encontrar al electrn en una determinada zona del espacio. Dichas funciones de estado son los que se
denomina habitualmente orbitales.
El orbital est determinado por nmeros cunticos (n,l,m) y caracterizan el estado del electrn
y, adems, permite calcular la probabilidad de encontrar el electrn
2
a travs de representaciones de
superficies lmites que encierran un 99 % de probabilidad de encontrar al electrn.
En la fig 6.24 se representan las superficies lmites para distintos orbitales.
Las palabras "ocupar", "llenar", "colocar" referidas a los orbitales no se deben tomar literalmente.
Los orbitales no son un juego de cajas colocados rgidamente en una escala de energa. Cuando decimos
que el electrn est en un orbital o estado estamos diciendo simplemente que el electrn est
comportndose de una cierta forma (Mahan 1.977).
6.7. Los nmeros cunticos.
Los nmeros cunticos en la teora atmica de Bohr y en las sucesivas correcciones de la teora
eran nmeros que "cuantificaban" a priori el estado energtico del electrn y que permitan explicar las
desdoblamientos de las lneas espectrales. Por el contrario, en la teora de Schrdinger los nmeros
cunticos son condiciones matemticas que se exigen para resolver la ecuacin de ondas, esto es, aparecen
de forma natural en la resolucin de la ecuacin de ondas.
En la resolucin de la ecuacin de Schrdinger para el electrn del tomo de hidrgeno slo
aparecen tres nmeros cunticos y anteriormente se ha visto la necesidad de introducir un cuarto nmero
cuntico denominado de spn. En el desarrollo de la mecnica ondulatoria ste surge al tener en cuenta los
efectos relativistas.
En las figuras 6. a 6. se da un resumen de los valores permitidos a los cuatro nmeros cunticos,
de las propiedades que determinan (su significado fsico) y la notacin utilizada.
- n es el nmero cuntico principal. Puede tener valores naturales n = 1, 3, 3, 4, etc. Determina el
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 23
"tamao" del orbital y su energa.
Lo introdujo Bohr en su segundo postulado para explicar el espectro atmico del hidrgeno.
- l se denomina nmero cuntico secundario o acimutal. Puede tener valores enteros para cada
valor de n desde 0 hasta n-1.
Determina la "forma" general del orbital y en menor medida la energa. Sera el subnivel de
energa dentro de un nivel.
La forma debe ser entendida como la simetra espacial de la superficie lmite de encontrar el
electrn en una determinada regin del espacio.
Herencia, todava de la antigua terminologa de los espectroscopistas, es comn designar los
orbitales como:
l = 0 --------> orbital s (sharp)
l = 1 --------> orbital p (principal)
l = 2 --------> orbital d (diffuse)
l = 3 --------> orbital f (fundamental)
- m
l
es el nmero cuntico magntico. Puede tomar valores enteros, para cada valor de n y de l,
desde -l hasta +l.
Determina la orientacin espacial del orbital, la direccin de mxima densidad electrnica.
Se denomina magntico porque esta orientacin espacial se acostumbra a definir en relacin a un
campo magntico externo. (efecto Zeeman normal).
Los orbitales con igual n y l y distinto m tienen la misma energa, son degenarados, pero cuando se
aplica un campo magntico externo la interaccin con ste hace que se modifiquen sus energas.
- m
s
es el llamado nmero cuntico de spin ( que en ingls significa giro).
Puede valer slamente +1/2 y -1/2 en unidades de h/2.
Se dice a menudo que representa el sentido de giro del electrn sobre s mismo. Aunque no tiene
sentido que el electrn gire sobre s mismo, se mantiene esta descripcin porque, de ser cierta,
proporcionara los mismos resultados que los observados.
Se introdujo para explicar el efecto Zeeman anmalo.
6.8. Configuraciones electrnicas de los tomos polielectrnicos.
Niveles energticos en tomos polielectrnicos.
Ver figuras.
6.8.1 Principio de mxima multiplicidad o de Hund.
6.8.2 Principio de exclusin de Pauli.
Vamos a considerar cmo se distribuyen los electrones en un tomo polielectrnico (configuracin
electrnica). Se basan en el principio de construccin o de constitucion de Aufbau y en el orden creciente
de los tomos segn su nmero atmico:
"La determinacin de la configuracin de un tomo de nmero atmico Z se establece a
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 24
partir del tomo de nmero atmico Z-1 colocando el electrn adicional diferenciador en el siguiente
orbital atmico disponible".
El orbital atmico disponible se basa en otros tres principios:
1 - Principio de Exclusin de Pauli. "Dos electrones de un tomo no pueden tener sus cuatro
nmeros cunticos iguales" Por lo tanto en un orbital slo caben dos electroens con sus spines apareados.
2 - Principio de mnima energa. El estado fundamental (ms estable) de un electrn en un tomo es
el de menor energa.
La energa de un orbital viene determinada por los tres nmeros cunticos que lo definen n l y m,
pero, en ausencia de un campo magntico externo, slo depende de n y de l. La importancia de n es mayor
que la de l si bien no se debe pensar que l no importa. Para saber cul de los dos orbitales tiene menos
energa, se suman los valores de n y l:
* Un orbital tiene menos energa cuanto ms bajo sea el valor de n+l
* Si dos orbitales tienen el mismo valor de n+l, tiene menos energa aquel que tiene el valor
de n ms pequeo.
A veces, se recurre a diagramas mnemotcnicos que pueden ayudar a escribir los orbitales en el
orden energtico correcto. Figura 6.
3 - Principio de mxima multiplicidad o de Hund. Establece que cuando se llenan orbitales
diferentes que poseen la misma energa (degenerados) como los orbitales p, d f, los electrones
permanecen desapareados al mximo manteniendo sus spines paralelos.
Configuraciones electrnicas. Realizar. Ver figuras.
Explicacin de por qu los niveles energticos son distintos para cada tomo:
o Cada tomo tiene diferente carga nuclear.
o Cada tomo tiene diferente nmero de electrones.
Por lo tanto cada tomo tiene un espectro atmico de emisin caracterstico, su huella dactilar
Algunos enlaces interesantes:
http://eos.cnice.mecd.es/mem2002/quimica/
www.puc.cl/sw_educ/qda1106/CAP2/
www.edu.aytolacoruna.es/aula/fisica/fisicaInteractiva/Ef_Fotoelectrico/TeoriaEF.htm
www.maloka.org/f2000/elements_as_atoms/
perso.wanadoo.es/cpalacio/NumerosCuanticos12.htm
I. E. S. "Sierra de San Quilez" BINFAR QUMICA de 2 Bachillerato TEMA 6 ESTRUCTURA DEL TOMO - 25
http://www.educaplus.org/sp2002/orbita.php
http://www1.ceit.es/Asignaturas/quimica/Curso0/MC+orbitales.htm
http://centros5.pntic.mec.es/ies.victoria.kent/Rincon-C/Simulaci/atomphoton/index.html
http://www.cnnet.clu.edu/quim/Q_3451/modulo1/modulo1e_files/teoria.html
http://micro.magnet.fsu.edu/electromag/java/atomicorbitals/
Das könnte Ihnen auch gefallen
- Equilibrio QuímicoDokument34 SeitenEquilibrio QuímicoRobert100% (5)
- Guia General Modulo 9 Universo NaturalDokument40 SeitenGuia General Modulo 9 Universo Naturalsol0% (1)
- 0000Dokument135 Seiten0000Lizbeth Mar ToNoch keine Bewertungen
- Bioquimica Humana Cardella 2007 PDFDokument327 SeitenBioquimica Humana Cardella 2007 PDFDaisy Jennifer Paulino AriasNoch keine Bewertungen
- Aceites Esenciales Plantas AromáticasDokument10 SeitenAceites Esenciales Plantas AromáticassonesNoch keine Bewertungen
- Ingenieria Bionica y AvancesDokument43 SeitenIngenieria Bionica y AvancesGonzhalo Ramireç ChaveçNoch keine Bewertungen
- Tema 6 Quc3admica Orgc3a1nica SubrayadoDokument14 SeitenTema 6 Quc3admica Orgc3a1nica SubrayadoJorgeAguilarNoch keine Bewertungen
- Aceites EsencialesDokument30 SeitenAceites EsencialesJorgeAguilarNoch keine Bewertungen
- Tema 10 Reactividad Orgc3a1nicaDokument10 SeitenTema 10 Reactividad Orgc3a1nicaJorgeAguilarNoch keine Bewertungen
- Acidos y BasesDokument17 SeitenAcidos y BasesGustavo Adolfo Alcantara RosalesNoch keine Bewertungen
- Ejercicios Equilibrio Químico PDFDokument13 SeitenEjercicios Equilibrio Químico PDFJorgeAguilarNoch keine Bewertungen
- Detergentes PDFDokument63 SeitenDetergentes PDFJorgeAguilarNoch keine Bewertungen
- Nomenclatura de Compuestos Con Grupos Secundarios2Dokument9 SeitenNomenclatura de Compuestos Con Grupos Secundarios2JorgeAguilarNoch keine Bewertungen
- 4-Como Crear Conciencia de ProsperidadDokument19 Seiten4-Como Crear Conciencia de ProsperidadjucegaheNoch keine Bewertungen
- Ciclo de Krebs PDFDokument8 SeitenCiclo de Krebs PDFRudvald Waldo De JesùsNoch keine Bewertungen
- Leyes Ponderales TeoríaDokument0 SeitenLeyes Ponderales TeoríaJorgeAguilarNoch keine Bewertungen
- Capítulo 9. - Geometría Molecular y Teorías de Enlace OKDokument18 SeitenCapítulo 9. - Geometría Molecular y Teorías de Enlace OKJorgeAguilarNoch keine Bewertungen
- Cues1 Val11Dokument268 SeitenCues1 Val11los sabiosNoch keine Bewertungen
- Teñido de PoliésterDokument12 SeitenTeñido de PoliésterJorgeAguilarNoch keine Bewertungen
- ElectroquímicaDokument26 SeitenElectroquímicaJorgeAguilarNoch keine Bewertungen
- Libroquimica EliDokument90 SeitenLibroquimica EliEliana GaticaNoch keine Bewertungen
- Ejercicios TermodinámicaDokument1 SeiteEjercicios TermodinámicaJorgeAguilarNoch keine Bewertungen
- Ejercicios Sobre EnlaceDokument1 SeiteEjercicios Sobre EnlaceJorgeAguilarNoch keine Bewertungen
- Como Ganar Dinero Escribiendo 60 IdeasDokument23 SeitenComo Ganar Dinero Escribiendo 60 IdeasEagle DiseñoNoch keine Bewertungen
- Guía Riesgo Químico en LaboratoriosDokument86 SeitenGuía Riesgo Químico en LaboratoriosGraciela Rodriguez SaenzNoch keine Bewertungen
- Ponencia de Química-Nomenclatura 2005Dokument9 SeitenPonencia de Química-Nomenclatura 2005José AntonioNoch keine Bewertungen
- Tipo de ReaccionesDokument11 SeitenTipo de ReaccionesJorgeAguilarNoch keine Bewertungen
- Proceso de Obtención Del Hierro y Del AceroDokument26 SeitenProceso de Obtención Del Hierro y Del Acerolili_gonzaNoch keine Bewertungen
- Capítulo 8. - Termoquímica - Energía QuímicaDokument19 SeitenCapítulo 8. - Termoquímica - Energía QuímicaJorgeAguilarNoch keine Bewertungen
- Triptico Riesgo Biológico Lab.Dokument2 SeitenTriptico Riesgo Biológico Lab.JorgeAguilar100% (1)
- Teoria de Niels BohrDokument3 SeitenTeoria de Niels Bohrcesar290464Noch keine Bewertungen
- Modelos Atomicos JDokument6 SeitenModelos Atomicos JIveth IzquierdoNoch keine Bewertungen
- Guia 6 El Atomo Modelos Atomicos 10 Quimica GuillermoDokument7 SeitenGuia 6 El Atomo Modelos Atomicos 10 Quimica GuillermoWilliam MontañezNoch keine Bewertungen
- 1ra FICHA DE TRABAJO DE CyT 3° SECUNDARIA. VIRTUALDokument2 Seiten1ra FICHA DE TRABAJO DE CyT 3° SECUNDARIA. VIRTUALeinerplus100% (2)
- Los Modelos AtómicosDokument10 SeitenLos Modelos AtómicosNicolasCenaNoch keine Bewertungen
- Historia de La Química ModernaDokument4 SeitenHistoria de La Química ModernaNicolàs Ortega GarcìaNoch keine Bewertungen
- Modelo Atómico de RutherfordDokument9 SeitenModelo Atómico de RutherfordKevin Ordoñez godinezNoch keine Bewertungen
- Cap 1 Estructura Atomica PDFDokument30 SeitenCap 1 Estructura Atomica PDFJhonny Quispe100% (1)
- PC2 Quim AsesDokument27 SeitenPC2 Quim AsesLoida Salvatierra PantojaNoch keine Bewertungen
- Teoria AtomicaDokument7 SeitenTeoria AtomicaAntonioNoch keine Bewertungen
- Unidad 07 - Estructura AtomicaDokument138 SeitenUnidad 07 - Estructura AtomicaMauri AleNoch keine Bewertungen
- Informe de LaboratorioDokument3 SeitenInforme de Laboratorioandrea caitaNoch keine Bewertungen
- Exposicion Modelos AtomicosDokument14 SeitenExposicion Modelos AtomicosFernandoBPS0% (1)
- Comparacion de Modelos AtomicosDokument5 SeitenComparacion de Modelos AtomicosJulian CuadradoNoch keine Bewertungen
- ACTIVIDAD Semana 23 - 1° C y T PDFDokument7 SeitenACTIVIDAD Semana 23 - 1° C y T PDFDandy Lopez FernandezNoch keine Bewertungen
- Guia 4 - RtasDokument8 SeitenGuia 4 - RtasDiegoNoch keine Bewertungen
- Wuolah Free QUIMICA 2oBACH 1Dokument59 SeitenWuolah Free QUIMICA 2oBACH 1Monica Martínez de diosNoch keine Bewertungen
- Espectros atómicos: radiación electromagnética y estructura internaDokument17 SeitenEspectros atómicos: radiación electromagnética y estructura internarodrigoNoch keine Bewertungen
- Cuadro ComparativoDokument2 SeitenCuadro Comparativojorje antonio morales londoñoNoch keine Bewertungen
- Actividades 1 Modelos AtómicosDokument3 SeitenActividades 1 Modelos AtómicosPaula Alondra López AjúNoch keine Bewertungen
- Que Es Un Átomo y Sus PartesDokument4 SeitenQue Es Un Átomo y Sus PartesAlejandra VargasNoch keine Bewertungen
- GRADO 10 C.NATURALES GUIA No. 1 QUI. TEORIA ATOMICADokument4 SeitenGRADO 10 C.NATURALES GUIA No. 1 QUI. TEORIA ATOMICAWilmarNoch keine Bewertungen
- Modelo Nuclear Del Atomo.Dokument44 SeitenModelo Nuclear Del Atomo.Joselyn OrtegaNoch keine Bewertungen
- Los 14 Acontecimientos Más Importantes de La Historia de La QuímicaDokument5 SeitenLos 14 Acontecimientos Más Importantes de La Historia de La QuímicaEliz HidalgoNoch keine Bewertungen
- Problemario Quimica General AplicadaDokument37 SeitenProblemario Quimica General AplicadaArarat MinaNoch keine Bewertungen
- Guia 2019Dokument217 SeitenGuia 2019LUIS ALBERTONoch keine Bewertungen
- ModelosDokument42 SeitenModelosBriam Arnold Estrella RojasNoch keine Bewertungen
- Trabajo de Quimica Estructura AtomicaDokument28 SeitenTrabajo de Quimica Estructura AtomicaMareglys MarquezNoch keine Bewertungen
- 2 - Fisica de SemiconductoresDokument27 Seiten2 - Fisica de SemiconductoresMatiasNoch keine Bewertungen