Beruflich Dokumente
Kultur Dokumente
Term Odin A Mica
Hochgeladen von
Miguel LópezOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Term Odin A Mica
Hochgeladen von
Miguel LópezCopyright:
Verfügbare Formate
UNIVERSIDAD TCNICA DE AMBATO FACULTAD DE CIENCIA E INGENIERA EN ALIMENTOS CARRERA DE INGENIERIA BIOQUMICA LABORATORIO DE TERMODINAMICA
1. DATOS INFORMATIVOS:
PROFESOR: Ing. Luis Anda INTEGRANTES: Miguel Lpez Diana Villarroel SEMESTRE: QUINTO UNICO BQ FECHA: Ambato 26 de Marzo de 2012
TEMA: UNA CONSTANTE DE VELOCIDAD POR UN MTODO CONDUCTIMTRICO
2. INTRODUCCION:
Para expresar la rapidez de una reaccin qumica de manera cuantitativa se necesita una definicin de la velocidad de reaccin. Tal como se utiliza normalmente este concepto, indica la velocidad de variacin de la concentracin como consecuencia de la reaccin. Considere la reaccin hipottica.
Que tiene lugar en un espacio cerrado. La velocidad instantnea de esta reaccin viene dada por la velocidad de disminucin de la concentracin de A o por la velocidad de aumento de la concentracin de B.
Es prudente aadir que, en relacin a la velocidad de reaccin, estamos hablando de la variacin de concentracin debida a la reaccin. Las concentraciones pueden por supuesto modificarse de otras maneras, por ejemplo aadiendo ms cantidad de una sustancia o diluyendo la mezcla de reaccin con disolvente. Aunque la definicin es ideal para un sistema cerrado, es necesario utilizarla cuidadosamente si el cambio en concentracin de un reactivo incluye contribuciones que no se deben a su participacin en la reaccin del proceso objeto de estudio. Para transformar una proporcionalidad en una ecuacin slo es necesario insertar una constante de proporcionalidad. Al introducir esta constante obtenemos la ecuacin:
Esta constante k,, es una constante de velocidad de orden n*, puesto que n es el orden total de la reaccin. La magnitud de k,, puede considerarse una medida de la rapidez de la reaccin. Considerando la situacin ms simple posible, si las concentraciones de A, B y C fuesen todas iguales a la unidad entonces la velocidad de reaccin sera numricamenteigual a kn: esto ilustra el papel de una constante de velocidad como criterio de la velocidad de reaccin bajo ciertas condiciones. Las dimensiones y unidades de la constante de velocidad merecen una atencin especial. Las dimensiones de concentracin x (tiempo)-'. Puesto que el lado derecho debe tener las mismas dimensiones y el producto, [A]P[B]q[C]^r tiene dimensiones de (concentracin)", se deduce que las dimensiones de la constante de velocidad de orden n son (concentracin) x (tiempo). 3. OBJETIVOS:
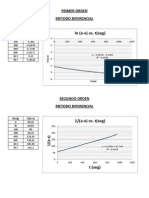
3.1Objetivo General Determinar experimentalmente la constantre de velocidad mediante elk mtodo de conductimetrico 3.2 Objetivos Especficos Interpretar la grafica Kt vrs (Ko-Kt)/t
4. APARATOS Y REACTIVOS: Puente de conductividad Clula de conductividad Tipo de inmersin Termostato Cronmetro Acetato de etilo Hidrxido de sodio.
5. DATOS OBTENIDOS:
T(min) 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 Ko 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 Kt 1370 1170 1065 990 935 893 856 827 801 783 770 758 746 735 728 723 (Ko-Kt)/t 0 40 30,5 25,33 21,75 19,08 17,13 15,51 14,23 13,04 12 11,13 10,4 9,77 9,17 8,63
6. CALCULOS Y RESULTADOS:
7. CONCLUSIONES:
8. BIBLIOGRAFIA:
Aunque el orden de reaccin se define como se ha indicado, basndose en un procedimiento puramente emprico, no es raro encontrar un valor entero positivo. Si n = 1, se dice que la reaccin es de primer orden, si n = 2, se dice que la reaccin es de segundo orden y si n = 0, se dice que la reaccin es de orden cero. Las unidades que resultan para la constante de velocidad en estos y otros casos se muestran en la Tabla l. l, donde se ha utilizado como unidad de concentracin el mol dm-3 , unidad que suele emplearse en los estudios cinticos en disolucin.
9. 10. Efecto de la temperatura sobre las velocidades de reaccin 11. En general, la velocidad de una reaccin qumica aumenta al aumentar la temperatura. Este efecto suele representarse en funcin de la variacin de la constante de velocidad, k, con la temperatura, variacin que a menudo sigue la ecuacin de Arrhenius: 12. 13. Una forma alternativa de esta ecuacin se obtiene tomando logaritmos en ambos miembros. 14.
15. Esta ecuacin implica que el logaritmo de la constante de velocidad sea una funcin lineal del inverso de la temperatura. Este tipo de representaciones suelen denominarse grficos de Arrhemus. 16. Los dos parmetros que aparecen en la Ecuacin (1.45) se suponen independientes de la temperatura. El parmetro A se denomina factor pre-exponencial o factor A y siempre tiene las mismas unidades que la constante de velocidad correspondiente. El otro parmetro, Ea, denominado energa de activacin o, ms precisamente, energa de activacin de Arrhenius, tiene las mismas dimensiones que RT y sus valores habituales estn en el intervalo 50-200 U mol - 1. 17. Evolucin de las tcnicas de seguimiento del avance de la reaccin 18. Las reacciones en disolucin constituyen una gran parte de las reacciones qumicas cuya cintica ha sido objeto de una investigacin detallada.~ El mtodo clsico de seguimiento del avance de una reaccin consiste en retirar alcuotas a tiempos conocidos y congelarlas o tratarlas de manera adecuada para detener la reaccin y determinar entonces la concentracin de uno de los reactivos o de uno de los productos mediante anlisis qumico. 19. Por ejemplo, para la reaccin de hidrlisis alcalina: 20. 21. que tiene lugar a una velocidad razonable en disolucin acuosa con reflujo, pueden retirarse alcuotas de 5 CM3 a intervalos de 10 minutos. La reaccin puede detenerse al introducir estas muestras en recipientes que contienen hielo y agua. La concentracin de ion hidrxido en cada una de ellas se determina fcilmente por valoracin con un cido estndar diluido en presencia de un indicador. 22. Un procedimiento como ste puede fcilmente proporcionar resultados precisos para una reaccin que sea lenta o muy lenta, con un semiperiodo superior a una hora Incluso en estas circunstancias se plantea la cuestin de: en qu medida altera la reaccin la retirada peridica de una alcuota de la mezcla de reaccin? Se introduce alguna sustancia extraa como consecuencia de estas extracciones, aunque sea en cantidades aparentemente despreciables? Se altera la constancia de la temperatura de la mezcla de reaccin al introducir el aparato para extraer la muestra? Esta ltima posibilidad es ms preocupante cuanto ms frecuentes sean las tomas de alcuotas, y tiene an ms importancia en las reacciones rpidas. 23. Otro aspecto problemtico del procedimiento anterior es el tiempo transcurrido desde el comienzo de la reaccin que corresponde en realidad a la medida de la
concentracin de reactivo en la alcuota. Obviamente la extraccin y enfriamiento de la alcuota no son un proceso instantneo y el descenso real de la temperatura no es la cada brusca ideal. Una buena aproximacin para el tiempo de operacin es el punto en que se ha echado la mitad de la alcuota en la mezcla de hielo y agua, pero el tiempo estimado para la muestra est sujeto a un error de varios segundos. Esto subraya la limitacin de la aplicacin del mtodo a reacciones lentas o muy lentas. 24. En algunas reacciones en disolucin es posible aadir reactivos adicionales a la mezcla de reaccin para que se produzca un cambio de color perceptible cuando ha transcurrido la reaccin con una cierta extensin. Por- ejemplo, al estudiar la reaccin de hidrlisis, 25. 26. la adicin de una pequea cantidad de NaOH y un indicador cido-base produce un cambio de color cuando se ha producido suficiente HCI para neutralizar la cantidad de NaOH que se ha aadido. 27. Sin embargo, para que el tiempo correspondiente a este cambio de color sea significativo es necesario que los reactivos aadidos no interfieran, en modo alguno, con la reaccin primaria cuya cintica se desea estudiar. Por lo que respecta al ejemplo anterior, esto significa que el mtodo es vlido slo si la hidrlisis del RCI es estrictamente independiente del pH.-4ste es uno de los motivos por los que el mtodo, que suele denominarse mtodo del reloj, est lejos de ser un mtodo general de seguimiento del avance de la reaccin. 28. El primer ejemplo conocido de estudio detallado del avance de una reaccin qumica es el trabajo de Wilhelmy de 1850 sobre la hidrlisis de la sacarosa en disolucin cida utilizando un polarmetro. Por casualidad, en este estudio se utiliz por primera vez una propiedad fsica de la mezcla de reaccin para seguir el avance de la reaccin, un procedimiento que es la base de las tcnicas modernas utilizadas en el estudio experimental de la cintica qumica. 29. La ecuacin formal para la reaccin qumica estudiada por Wilhelmy es:
30. 31. Puesto que la sacarosa, glucosa y fructosa son todas ellas pticamente activas, los valores del ngulo de rotacin de la luz polarizada son funcin de la concentracin de las tres especies. Mientras que la sacarosa (y = + 66,5') y la glucosa (alfa = + 52,7) son ambas dextrgiras, la fructosa (y = - 92,4') es muy levgira, resultando que, al llevarse
a cabo la reaccin de hidrlisis, el ngulo de rotacin se hace menos positivo, pasa por el valor cero y se hace negativo. Por este motivo, este proceso qumico ha sido frecuentemente denominado, - Inversin de la sacarosa.! Los clculos indican que el ngulo de rotacin cero se alcanza cuando la reaccin ha transcurrido aproximadamente al 86 por ciento del total para completarse. En general, si se conoce el ngulo inicial de rotacin debido slo a la sacarosa, las lecturas posteriores del polarmetro permiten iten conocer con precisin la concentracin de sacarosa que permanece sin reaccionar. 32. Aunque la polarimetra fue la tcnica utilizada por Wilhelmy en sus experimentos de 1850, su aplicacin en el seguimiento del avance de reaccin ha estado muy limitada porque los materiales pticamente activos slo estn implicados en una minora muy pequea de reacciones qumicas. Los estudios de la cintica de las reacciones qumicas, desde 1870 en adelante, se llevaron a cabo en su mayora, extrayendo peridicamente alcuotas para el anlisis qumico. Al hacerse ms asequible la instrumentacin en los laboratorios, a partir de la dcada de 1930, los estudios de cintica qumica se han llevado a cabo, cada vez ms. controlando una propiedad fsica de la mezcla de reaccin. Las tcnicas ms importantes de este tipo se estudian a continuacin con ms detalle. 33. Conductividad elctrica y dilatometria 34. Cuando la reaccin a estudiar implica especies inicas y tiene lugar en un disolvente muy polar, puede ser apropiado seguir su avance por conductimetra. La hidrlisis alcalina de un ster sirve para ilustrar la aplicacin de esta tcnica. 35. 36. Al ir avanzando la reaccin, la conductividad elctrica de la disolucin disminuye porque la conductividad del ion RC02 que se forma es bastante inferior a la del reactivo, ion hidrxido. 37. Para que la Ecuacin (2.19) represente adecuadamente la estequiometra de la reaccin, debe estar inevitablemente presente un contrain como el Na', cuya concentracin permanezca constante e igual a la concentracin inicial del ion OH 38. En este sistema la conductividad especfica K viene dada por:
39. 40. donde c, es la concentracin en mol dm^-3 y Landa sub i es la conductividad inica en S CM2 Mol-1 del ion i presente en la disolucin. Por tanto, la conductividad
especfica, K, se puede expresar en funcin de las concentraciones de los iones OH-, Na+ y RC02 , por ecuaciones anlogas a las de la absorbancia A en la seccin previa, es decir, las Ecuaciones (2.11).a (2.13). 41. Al estudiar conductimtricamente la cintica de una Reaccin como
la (2.19),),es deseable trabajar en condiciones de pseudo-primer orden puesto que en condiciones de segundo orden es muy difcil obtener un valor fiable de K, Sin embargo, es importante que sea el ster y no el hidrxido, el que est presente en exceso, para que la conductividad experimente un cambio relativo importante durante el transcurso de la reaccin de manera que proporcione un valor ms fiable para la constante de velocidad. La ecuacin a utilizar es anloga a la Ecuacin (2.17),
42. 43. donde k' representa la constante de velocidad de primer orden observada. 44. La dilatometra es una tcnica consistente en la medida de las pequeas variaciones del volumen de la disolucin producidas por el avance de la reaccin ha sido muy utilizada, especialmente para seguir el avance en los procesos de polimerizacin por adicin. Su aplicabilidad se basa en que el volumen molar parcial del monmero en disolucin difiere del volumen molar parcial por unidad de monmero del polmero. Sin embargo, las diferencias en los volmenes molares parciales de reactivos y productos suelen ser demasiado pequeas y es necesario hacer medidas muy cuidadosas para que puedan ser utilizadas en cintica. 45. En la prctica, la disolucin se introduce en un recipiente con un tubo capilar en su parte superior, como el mostrado en la Figura 2.1. Un catetmetro permite seguir el desplazamiento del menisco. En un sistema de este tipo, la termostatizacin es necesaria por partida doble, puesto que la temperatura influye tanto en la densidad de la disolucin como la velocidad de la reaccin.
46. 47. La hidrlisis del acetato de etilo:
48. 49. sigue una cintica de segundo orden. Por lo tanto, si las concentraciones iniciales de los reactivos son ambas iguales a c y x es el nmero de moles por litro que han reaccionado al cabo de un tiempo t, entonces
50. 51. cuya integracin conduce a
52. 53. Como se puede ver en la reaccin (a), la conductividad de la disolucin experimenta un descenso acusado debido a la sustitucin por el ion acetato del ion OH-, altamente conductor. Por ello, el curso de esta reaccin puede seguirse conductimtrcamente. Reemplazando las ecuaciones por conductividades, la ecuacin (1) se transforma en
54.
55. donde K, es la conductividad inicial de la disolucin, K, la correspondiente al tiempo t y K- la conductividad cuando la reaccin es completa. De ella se deduce
56. 57. de forma que la constante de velocidad puede calcularse conociendo la concentracin inicial de los reactivos y representando K, frente a 58. APARATOS UTILIZADOS
59.
Das könnte Ihnen auch gefallen
- Silicon ValleyDokument2 SeitenSilicon ValleyMiguel LópezNoch keine Bewertungen
- Silicon ValleyDokument2 SeitenSilicon ValleyMiguel LópezNoch keine Bewertungen
- Term Odin A MicaDokument10 SeitenTerm Odin A MicaMiguel LópezNoch keine Bewertungen
- Primer OrdenDokument1 SeitePrimer OrdenMiguel LópezNoch keine Bewertungen
- Las TelomerasasDokument10 SeitenLas TelomerasasMiguel LópezNoch keine Bewertungen
- Indicadores FinancierosDokument1 SeiteIndicadores FinancierosMiguel LópezNoch keine Bewertungen
- Paper CompostDokument27 SeitenPaper CompostMiguel LópezNoch keine Bewertungen
- La TelomerasaDokument2 SeitenLa TelomerasaMiguel LópezNoch keine Bewertungen
- Datos NodulosDokument1 SeiteDatos NodulosMiguel LópezNoch keine Bewertungen
- ATP AsaDokument6 SeitenATP AsaMiguel LópezNoch keine Bewertungen
- ElenaDokument31 SeitenElenaDavid Jaramillo KlinkertNoch keine Bewertungen