Beruflich Dokumente
Kultur Dokumente
Agente Reductor
Hochgeladen von
Daniel GalindoCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Agente Reductor
Hochgeladen von
Daniel GalindoCopyright:
Verfügbare Formate
Agente reductor Un agente reductor es aquel que cede electrones a un agente oxidante.
Existe una reaccin qumica conocida como reaccin de reduccin-oxidacin, en la que se da una transferencia de electrones. As mismo, la mayora de los elementos metlicos y no metlicos se obtienen de sus minerales por procesos de oxidacin o de reduccin. Una reaccin de reduccin-oxidacin consiste en dos semireacciones: una semireaccin implica la prdida de electrones de un compuesto, en este caso el compuesto se oxida; mientras que en la otra semireaccin el compuesto se reduce, es decir gana los electrones. Uno acta como oxidante y el otro como reductor. Como ejemplos tenemos: Carbn Monxido de carbono Muchos compuestos ricos en carbn e hidrgeno Elementos no metlicos fcilmente oxidables tales como el azufre y el fsforo Sustancias que contienen celulosa, tales como maderas, textiles, etc. Muchos metales como aluminio, magnesio, titanio, circonio Los metales alcalinos como el sodio, potasio, etc. Los hidruros Los azcares reductores
Un agente oxidante o comburente es un compuesto qumico que oxida a otra sustancia en reacciones electroqumicas o de reduccin-oxidacin. En estas reacciones, el compuesto oxidante se reduce. Bsicamente: El oxidante se reduce, gana electrones. El reductor se oxida, pierde electrones. Todos los componentes de la reaccin tienen un nmero de oxidacin. En estas reacciones se da un intercambio de electrones.
PROCEDIMIENTO PARA EL MTODO DE REDOX 1.- Verificar que la ecuacin este bien escrita y completa. 2.- Colocar los nmeros de oxidacin en cada uno de los elementos. 3.- Observar que nmeros de oxidacin cambiaron (un elemento se oxida y uno se reduce). 4.- Escribir la diferencia de nmeros de oxidacin de un mismo elemento. 5.- Multiplicar la diferencia de nmeros de oxidacin por los subndices correspondientes de cada elemento. 6.- Cruzar los resultados 7..- Colocar los resultados como coeficientes en el lugar correspondiente. 8.-Completar el balanceo por tanteo. 9.- Verifica la cantidad de tomos en cada miembro de la ecuacin. 10.-En caso de que todos los coeficientes sean divisibles se reducen a su mnima expresin.
EJEMPLO: 1.- Verificar que la ecuacin este bien escrita y completa.
2.- Colocar los numeros de oxidacin en cada uno de los elementos.
3.- Observar que nmeros de oxidacin cambiaron (un elemento se oxida y uno se reduce).
4.- Escribir la diferencia de nmeros de oxidacin de un mismo elemento.
5.- Multiplicar la diferencia de nmeros de oxidacin por los subndices correspondientes de cada elemento.
6.- Cruzar los resultados
7..- Colocar los resultados como coeficientes en el lugar correspondiente.
8.-Completar el balanceo por tanteo.
9.- Verifica la cantidad de tomos en cada miembro de la ecuacin.
10.-En caso de que todos los coeficientes sean divisibles se reducen a su mnima expresin. (En este caso no son divisibles y quedan de la siguiente manera:)
Das könnte Ihnen auch gefallen
- 23 Ejercicios Sobre IncotermsDokument2 Seiten23 Ejercicios Sobre IncotermsNestor Juarez76% (21)
- Operaciones básicas del proceso, mezclas y disoluciones. QUIE0108Von EverandOperaciones básicas del proceso, mezclas y disoluciones. QUIE0108Noch keine Bewertungen
- Guía para ETS de Ecuaciones DiferencialesDokument22 SeitenGuía para ETS de Ecuaciones DiferencialesDaniel Galindo100% (1)
- Ejercicios Resueltos CapacitoresDokument5 SeitenEjercicios Resueltos CapacitoresJairo Niño100% (4)
- Ejercicios Resueltos CapacitoresDokument5 SeitenEjercicios Resueltos CapacitoresJairo Niño100% (4)
- Diario General Pases Al Mayor y Balanza ComprobacionDokument5 SeitenDiario General Pases Al Mayor y Balanza ComprobacionShawanda Flynn50% (2)
- Sesion de Expresiones AlgebaricasDokument5 SeitenSesion de Expresiones Algebaricasortiz13380% (5)
- Cajero Bancario y ComercialDokument7 SeitenCajero Bancario y Comerciallito_s19@hotmail.com100% (1)
- Last U1 EaDokument5 SeitenLast U1 EaJuanCarlosGonzalezNoch keine Bewertungen
- Balanceo de Ecuaciones Por Metodo de RedoxDokument4 SeitenBalanceo de Ecuaciones Por Metodo de RedoxlupitaNoch keine Bewertungen
- Balanceo de Ecuaciones Por Metodo de RedoxDokument6 SeitenBalanceo de Ecuaciones Por Metodo de RedoxCordero VeintiséisNoch keine Bewertungen
- Balanceo de Ecuaciones Por Metodo de RedoxDokument7 SeitenBalanceo de Ecuaciones Por Metodo de RedoxTere RojasNoch keine Bewertungen
- Taller de Balanceo de Ecuaciones Por RedoxDokument7 SeitenTaller de Balanceo de Ecuaciones Por RedoxLorena Isabel Arancibia CortesNoch keine Bewertungen
- Balanceo de Ecuaciones Por Metodo de RedoxDokument5 SeitenBalanceo de Ecuaciones Por Metodo de RedoxJorge MéndezNoch keine Bewertungen
- Material 2022B1 QUI100 02 151324Dokument33 SeitenMaterial 2022B1 QUI100 02 151324Evelin Sonia Tapia PachecoNoch keine Bewertungen
- 9.-Balanceo de Ecuaciones Por Metodo de RedoxDokument5 Seiten9.-Balanceo de Ecuaciones Por Metodo de RedoxYsauro Ramos LeonNoch keine Bewertungen
- Balanceo de Ecuaciones Por Metodo de RedoxDokument5 SeitenBalanceo de Ecuaciones Por Metodo de RedoxRod Mars LpezNoch keine Bewertungen
- Tema 2. Reducción y OxidaciónDokument5 SeitenTema 2. Reducción y OxidaciónKarina Mara González GómezNoch keine Bewertungen
- Balanceo de Ecuaciones Por Metodo de Redox PDFDokument5 SeitenBalanceo de Ecuaciones Por Metodo de Redox PDFlauraNoch keine Bewertungen
- Material de Lectura Clase 02Dokument4 SeitenMaterial de Lectura Clase 02SalvadorNoch keine Bewertungen
- BALANCEODokument5 SeitenBALANCEOEddy PaceñitoNoch keine Bewertungen
- Apuntes de ElectroquimicaDokument33 SeitenApuntes de ElectroquimicaJuana Juana JuanaNoch keine Bewertungen
- Agente Oxidante y Agente Reductor33Dokument3 SeitenAgente Oxidante y Agente Reductor33Oscar ReyesNoch keine Bewertungen
- INTRODUCCIÓ1Dokument20 SeitenINTRODUCCIÓ1LEONoch keine Bewertungen
- Apuntes de ElectroquimicaDokument33 SeitenApuntes de Electroquimicashirly112Noch keine Bewertungen
- Balanceo de EcuacionesDokument13 SeitenBalanceo de EcuacionesLuis Oliva100% (1)
- IntroducciónDokument25 SeitenIntroducciónMariana Olivos MuñozNoch keine Bewertungen
- CuestionarioDokument2 SeitenCuestionarioDeysi Dorali Reyes InfantesNoch keine Bewertungen
- Ecuaciones RedoxDokument9 SeitenEcuaciones RedoxGuillermo AnchatipanNoch keine Bewertungen
- Reacciones Químicas - QuímicaDokument7 SeitenReacciones Químicas - QuímicaElias CaleiNoch keine Bewertungen
- Informe5 Del Laboratorio de QuimicaDokument31 SeitenInforme5 Del Laboratorio de QuimicaGustavo CentenoNoch keine Bewertungen
- Guia de Quimica - Funiones Quimicas OrganicasDokument5 SeitenGuia de Quimica - Funiones Quimicas OrganicasNayhe CNoch keine Bewertungen
- Ecuaciones RedoxDokument3 SeitenEcuaciones RedoxHector VerdeNoch keine Bewertungen
- Práctica 3 - Química Básica: Oxido-RedoxDokument10 SeitenPráctica 3 - Química Básica: Oxido-RedoxDanielaLopezNoch keine Bewertungen
- Clase 2 RedoxDokument5 SeitenClase 2 RedoxFernando Clemente GarciaNoch keine Bewertungen
- Volumetria RedoxDokument50 SeitenVolumetria Redoxana mercedes cardenasNoch keine Bewertungen
- Balanceo REDOX y Tipos de Reacciones QuímicasDokument5 SeitenBalanceo REDOX y Tipos de Reacciones QuímicasjhonjisNoch keine Bewertungen
- Antologia de Quimica InorganicaDokument30 SeitenAntologia de Quimica InorganicaMiguel AlejandroNoch keine Bewertungen
- Oxdidacion-Reduccion RedoxDokument12 SeitenOxdidacion-Reduccion RedoxAshly De Jesus RodriguezNoch keine Bewertungen
- Reacciones QuimicasDokument12 SeitenReacciones QuimicasAngie LopezNoch keine Bewertungen
- Quimica InorganicaDokument19 SeitenQuimica InorganicaMichelle AguilarNoch keine Bewertungen
- Agente ReductorDokument1 SeiteAgente ReductorrdrysdsNoch keine Bewertungen
- QUIM-102 RedoxDokument16 SeitenQUIM-102 RedoxenukNoch keine Bewertungen
- Balanceo de Ecuaciones Por El Método de RedoxDokument15 SeitenBalanceo de Ecuaciones Por El Método de RedoxJuan BalderasNoch keine Bewertungen
- Reacciones RedoxDokument8 SeitenReacciones RedoxNatalia BalbuenaNoch keine Bewertungen
- Guia de Apoyo para Estudiar Balanceo de EcuacionesDokument2 SeitenGuia de Apoyo para Estudiar Balanceo de EcuacionesJorge MéndezNoch keine Bewertungen
- Química Redox 3er. Curso Plan EspecíficoDokument9 SeitenQuímica Redox 3er. Curso Plan Específicoeliasfidelmartinezesquivel11Noch keine Bewertungen
- U 7 Reacciones QuímicasDokument8 SeitenU 7 Reacciones QuímicasIgnacio LuceroNoch keine Bewertungen
- Guia 10Dokument7 SeitenGuia 10Cristofher MaradiagaNoch keine Bewertungen
- 06 - Ecuaciones QuimicasDokument52 Seiten06 - Ecuaciones QuimicasDiego Garcia100% (1)
- Practica de QuimicaDokument7 SeitenPractica de QuimicaDain DeimosNoch keine Bewertungen
- Oxido ReducciónDokument11 SeitenOxido ReducciónAxel NosekeponerNoch keine Bewertungen
- Práctico N°1Dokument29 SeitenPráctico N°1cordobafede43Noch keine Bewertungen
- 5 Reacciones de Oxido Reduccion 2015Dokument21 Seiten5 Reacciones de Oxido Reduccion 2015G.CNoch keine Bewertungen
- Balanceo Por Redox-Ion ElectrónDokument43 SeitenBalanceo Por Redox-Ion ElectrónDiana OrellanaNoch keine Bewertungen
- Capítulo 6Dokument14 SeitenCapítulo 6Ignacio Rodriguez Robles100% (1)
- Agente OxidanteDokument11 SeitenAgente OxidanteRoberto CaceresNoch keine Bewertungen
- Reacciones de Oxidación-ReducciónDokument3 SeitenReacciones de Oxidación-ReducciónAlejandro BritoNoch keine Bewertungen
- Reporte3 de Quimica Oxido Reduccion 1CV1Dokument10 SeitenReporte3 de Quimica Oxido Reduccion 1CV1AbraYams GuzManNoch keine Bewertungen
- Sem09-Practica 07 - Guía Reacciones de Oxido ReducciónDokument8 SeitenSem09-Practica 07 - Guía Reacciones de Oxido ReducciónDanna Cielo EspinozaNoch keine Bewertungen
- Química IV Común Reacciones de Óxido Reducción Clase 1Dokument17 SeitenQuímica IV Común Reacciones de Óxido Reducción Clase 1Cecilia Maribel Rios GarabitoNoch keine Bewertungen
- Quimica Analítica 3Dokument11 SeitenQuimica Analítica 3Nayroby Vásquez MuñozNoch keine Bewertungen
- 11M27 23 1 E2 S2previos VsbaDokument40 Seiten11M27 23 1 E2 S2previos VsbaBenji ValdezNoch keine Bewertungen
- Reacciones RedoxDokument12 SeitenReacciones RedoxKarla BairesNoch keine Bewertungen
- Practica 2 Analitica Equilibrio Redox PDFDokument11 SeitenPractica 2 Analitica Equilibrio Redox PDFAlysson CamilaNoch keine Bewertungen
- Trabajo de QuimicaDokument5 SeitenTrabajo de Quimicasolo nadieNoch keine Bewertungen
- Oxidacion y ReduccionDokument13 SeitenOxidacion y ReduccionJulio Anthony Aragón HernándezNoch keine Bewertungen
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAVon EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANoch keine Bewertungen
- 1 Movimiento Rectilíneo UniformeDokument9 Seiten1 Movimiento Rectilíneo UniformeDaniel GalindoNoch keine Bewertungen
- Practica de FisicaDokument15 SeitenPractica de FisicaDaniel GalindoNoch keine Bewertungen
- Librerias en Lenguaje CDokument4 SeitenLibrerias en Lenguaje CJorge CopaNoch keine Bewertungen
- TIPOS DE LIBRERÍAS C++Dokument9 SeitenTIPOS DE LIBRERÍAS C++Daniel GalindoNoch keine Bewertungen
- Etica ProfesionalDokument3 SeitenEtica ProfesionalDaniel GalindoNoch keine Bewertungen
- Distribuciones ContinuasDokument21 SeitenDistribuciones ContinuasDaniel GalindoNoch keine Bewertungen
- Feudalism oDokument10 SeitenFeudalism oDaniel GalindoNoch keine Bewertungen
- Documento 06 Funcion ProbabilidadDokument10 SeitenDocumento 06 Funcion ProbabilidadPaulo Johamir OrtaNoch keine Bewertungen
- Banco de Reactivos Segundo ExamenDokument4 SeitenBanco de Reactivos Segundo ExamenDaniel GalindoNoch keine Bewertungen
- TIPOS DE LIBRERÍAS C++Dokument9 SeitenTIPOS DE LIBRERÍAS C++Daniel GalindoNoch keine Bewertungen
- Ejercicios Fase 1Dokument29 SeitenEjercicios Fase 1andresNoch keine Bewertungen
- Banco General para RepetirDokument4 SeitenBanco General para RepetirDaniel GalindoNoch keine Bewertungen
- Discuros para ImprimirDokument2 SeitenDiscuros para ImprimirDaniel GalindoNoch keine Bewertungen
- Distribuciones ContinuasDokument22 SeitenDistribuciones ContinuasDaniel GalindoNoch keine Bewertungen
- Cartas AunjoveningenieroDokument17 SeitenCartas AunjoveningenieroRyuzukiNoch keine Bewertungen
- La Amistad. Alberoni, PDFDokument13 SeitenLa Amistad. Alberoni, PDFStefanía Rubí50% (2)
- Tema 2 1 A 2 4 EYMDokument44 SeitenTema 2 1 A 2 4 EYMMaran Apaza ChampiNoch keine Bewertungen
- Tarea Primer Parcial DinamicaDokument23 SeitenTarea Primer Parcial DinamicaDaniel GalindoNoch keine Bewertungen
- Banco 2Dokument2 SeitenBanco 2Daniel GalindoNoch keine Bewertungen
- Tarea de Fundamentos de PrograDokument7 SeitenTarea de Fundamentos de PrograDaniel GalindoNoch keine Bewertungen
- Equipos de ProgresoDokument2 SeitenEquipos de ProgresoDaniel Galindo0% (1)
- Documento 06 Funcion ProbabilidadDokument10 SeitenDocumento 06 Funcion ProbabilidadPaulo Johamir OrtaNoch keine Bewertungen
- Historia de Visual Basic PDFDokument5 SeitenHistoria de Visual Basic PDFJaimeZambranoNoch keine Bewertungen
- TIPOS DE LIBRERÍAS C++Dokument9 SeitenTIPOS DE LIBRERÍAS C++Daniel GalindoNoch keine Bewertungen
- Metodos de OrdenacionDokument24 SeitenMetodos de OrdenacionDaniel GalindoNoch keine Bewertungen
- Distribucion ContinuaDokument21 SeitenDistribucion ContinuaDaniel GalindoNoch keine Bewertungen
- Cuadro de GestionDokument1 SeiteCuadro de GestionDaniel GalindoNoch keine Bewertungen
- CAUE - Ingeniería EconomicaDokument22 SeitenCAUE - Ingeniería EconomicaAlejandra Luna López100% (1)
- Revista Sobremesa Número 342 Abril 2015Dokument84 SeitenRevista Sobremesa Número 342 Abril 2015towioNoch keine Bewertungen
- Aseguramiento de Calidad. Gestion de ComprasDokument9 SeitenAseguramiento de Calidad. Gestion de ComprasAngie DefredNoch keine Bewertungen
- Análisis de Causa RaízDokument14 SeitenAnálisis de Causa RaízRolas para DiscordNoch keine Bewertungen
- Herramientas Manuales... OkokokDokument3 SeitenHerramientas Manuales... OkokokKatarin de la CruzNoch keine Bewertungen
- Taller Practico Ejercicios Caso 4Dokument9 SeitenTaller Practico Ejercicios Caso 4Carlos Arturo Martínez GarcíaNoch keine Bewertungen
- Caminos Trabajo 1Dokument13 SeitenCaminos Trabajo 1anon_71920229Noch keine Bewertungen
- Modelos de Registro de en AuxiliaresDokument3 SeitenModelos de Registro de en AuxiliaresAlanSunétNoch keine Bewertungen
- Examen Final - Semana 8 - Inv - Primer Bloque-Introduccion A La Economia - (Grupo1)Dokument13 SeitenExamen Final - Semana 8 - Inv - Primer Bloque-Introduccion A La Economia - (Grupo1)Katerin cardenasNoch keine Bewertungen
- Actividad 4 Taller - Unidad 2Dokument2 SeitenActividad 4 Taller - Unidad 2Ingrid Alexandra Fajardo LeónNoch keine Bewertungen
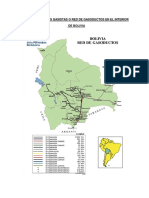
- Gasoductos Existentes en BoliviaDokument18 SeitenGasoductos Existentes en BoliviaKevin Saavedra Gabriel100% (1)
- Eco GestionDokument5 SeitenEco GestionAndres VasquezNoch keine Bewertungen
- Cap. 11Dokument24 SeitenCap. 11JosueNoch keine Bewertungen
- Empresas Certificadas Centroamerica Por PaisDokument18 SeitenEmpresas Certificadas Centroamerica Por PaisCarlos De Gracia Núñez67% (3)
- PR 40 Procedimiento Seguro de Carga y Descarga Camiones.01Dokument7 SeitenPR 40 Procedimiento Seguro de Carga y Descarga Camiones.01Fabiana Piña CastroNoch keine Bewertungen
- Ejecucion de La AuditoriaDokument11 SeitenEjecucion de La AuditoriaAlexandra CaizaluisaNoch keine Bewertungen
- UNIVERSIDAD ANDINA DEL CUSCO TripticoDokument1 SeiteUNIVERSIDAD ANDINA DEL CUSCO Tripticohenry romeroNoch keine Bewertungen
- Cualquiera Puede CocinarDokument3 SeitenCualquiera Puede CocinarjoangelpNoch keine Bewertungen
- Actividad de Transferencia Del Conocimiento Aa3Dokument2 SeitenActividad de Transferencia Del Conocimiento Aa3Mary CardenasNoch keine Bewertungen
- Formato Trabajo Completo SAM-CONAMET 2013Dokument2 SeitenFormato Trabajo Completo SAM-CONAMET 2013juanomoranNoch keine Bewertungen
- Brochure Jetstream 41Dokument17 SeitenBrochure Jetstream 41Gustavo RodriguezNoch keine Bewertungen
- Nic 16-Sección 17Dokument33 SeitenNic 16-Sección 17James CordovaNoch keine Bewertungen
- Presentacion ChequeDokument17 SeitenPresentacion ChequeArmando garcia araujoNoch keine Bewertungen
- Analista de Calidad - 2Dokument2 SeitenAnalista de Calidad - 2ronald baron sanchezNoch keine Bewertungen
- Contabilidad de CostosDokument80 SeitenContabilidad de CostosArielReusMatiasNoch keine Bewertungen