Beruflich Dokumente
Kultur Dokumente
Enlace covalente: teorías, estructuras moleculares y polaridad
Hochgeladen von
Victor Valdés AlvarezOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Enlace covalente: teorías, estructuras moleculares y polaridad
Hochgeladen von
Victor Valdés AlvarezCopyright:
Verfügbare Formate
1.
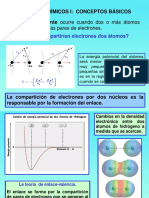
ENLACE COVALENTE
Se produce entre elementos no metlicos, o no metales con el hidrgeno, es decir, entre tomos de electronegatividades semejantes. En este tipo de enlace se comparten electrones entre distintos tomo. Cuando la diferencia de electronegatividad entre los elementos que forman el enlace sea mayor o igual a 1,8 el enlace se puede considerar ionico
1.1.
Teoras del enlace covalente: Teora de Lewis
El enlace covalente consiste en la unin de tomos que mediante la comparticin de pares de electrones adquieren una conguracin elctrica estable, esa conguracin es la de gas noble con 8 electrones en la ltima capa, por eso se dice que cumplen la regla del octete Cuando se escriben las estructuras de Lewis se sitan los electrones para que todos los tomos de la molcula tengan ocho electrones a su alrededor salvo el H que solo tiene 2 Los pares de electrones compartidos son los enlaces que se forman. Se llama covalencia o valencia de un tomo al nmero de electrones compartidos por el Ejemplos
A veces el par de electrones que se comparten en el enlace es suministrado por uno solo de los tomos que forman el enlace, se llama enlace covalente coordinado o dativo
Se llama covalencia o valencia de un tomo al nmero de electrones compartidos por el
1.1.1.
Limitaciones de la Teora de Lewis
1. Existen muchas molculas covalentes que no cumplen la regla del octeto 2. No aporta informacin sobre la energa de enlace, longitud de enlace, ngulos de enlace y geometra de las molculas 3. No contempla los parmetros que dene la Mecnica Cuntica, que es la teora que mejor dene el tomo 1.1.2. Estructuras de Lewis de molculas poliatmicas
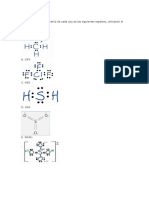
Se sigue el siguiente esquema Hacemos la tabla: n= n total de electrones de valencia que necesitan los tomos para tener estructura de gas noble v=n total de electrones que tienen los tomos en su capa de valencia c=n-v=electrones enlazantes, se divide por dos para calcular los pares enlazantes= enlaces s=v-c= electrones no enlazantes, se divide por 2 para calcular los pares no enlanzantes Ej Molcula de HNO3 H N O O O n= 2 8 8 8 8 =34 v= 1 5 6 6 6 =24 c=n-v=34-24=10=5 pares Enlazantes=5 enlaces s=v-c=24-10=14=7 pares No enlazantes/ pares libres/pares antienlazantes
Molcula HClO H Cl O n= 2 8 8 =18 v= 1 7 6 =14 c=n-v=18-14=4=2 pares Enlazantes=2 enlaces s=v-c=14-4=10=5 pares libres
Molcula: HNO2 H N O O n= 2 8 8 8 =26 v= 1 5 6 6 =18 c=n-v=26-18=8=4 enlaces s=v-c=18-8=10=5 pares libres
Molcula H2 H-H
Molcula Cl2
Molcula: H2 O H H O n= 2 2 8 =12 v= 1 1 6 =8 c=n-v=12-8=4=2 enlaces s=v-c=8-4=4=2 pares libres
1.2.
FORMA GEOMETRICA DE LAS MOLCULAS. TRPECV
Las estructuras de Lewis no describen la geometra de las molculas, por ello surge el mtodo TRPECV ( Teora de la Repulsin de Pares de Electrones de la Capa de Valencia), a partir de las estructuras de Lewis se determina la geometra de la molcula. La forma geomtrica de las molculas viene determinada por el nmero total de pares electronicos (enlazantes y libres) que ocupan los orbitales de valencia del tomo central, los cuales se disponen en el espacio de forma que sea mnima la repulsin entre ellos
Hay que tener en cuenta que las fuerzas repulsivas entre pares libres son mayores que las existentes entre par enlazante y libre y estas, a su vez, mayores que entre pares enlazantes
1.2.1.
Estudio de diferentes molculas
Se sigue el siguiente proceso: 1. Se dibuja la estructura de Lewis 2. Se cuentan los pares de electrones alrededor del tomo central, un enlace doble o triple cuentan como un nico par de electrones 3. Elegimos lals geometra ideal teniendo en cuenta las respulsiones Molcula H2 H-H > geometra lineal Molcula de Cl2 Molcula lineal
Molcula: H2 O H H O n= 2 2 8 =12 v= 1 1 6 =8 c=n-v=12-8=4=2 enlaces s=v-c=8-4=4=2 pares libres Tiene cuatro pares de electrones alrededor del tomo central (el oxgeno), luego su geometra ser tetradrica pero dos de esos cuatro pares son enlaces y los otros dos son pares libres por eso su geometra es:
104,5
La repulsin entre los pares libres hace que el ngulo se cierre un poco y pase de 109 a
Molcula de Amoniaco NH3 N H H H n= 8 2 2 2 =14 v= 5 1 1 1 =8 c=n-v=14-8=6=3 enlaces s=v-c=8-6=2=1 pares libres Tiene cuatro pares de electrones alrededor del tomo central (el nitrgeno), luego su geometra ser tetradrica pero tres de esos cuatro pares son enlaces y el otro es un par libre por eso su geometra es:
cierre un poco, menos que en el agua y pase de 109 a 107 Molcula de HCl H Cl n= 2 8 =10 v= 1 7 =8 c=n-v=10-8=2=1 enlace s=v-c=8-2=6=3 pares libres Molcula lineal H-Cl
La repulsin del par libre hace que el ngulo se
Molculas: CCl4 ; CH4 C H H H H n= 8 2 2 2 2 =16 v= 4 1 1 1 1 =8 c=n-v=16-8=8=4 enlaces s=v-c=8-8=0=0 pares libres Tiene cuatro pares de electrones alrededor del tomo central (el carbono), luego su geometra ser tetradrica, todos ellos son enlaces, por eso su geometra es:
La molcula de CCl4
Molcula de C2 H6 > H3 C-CH3 Es igual que CH4 donde un H ha sido sustituido por un CH3
Molcula BeCl2
Molcula BF3 El tomo central (B) tiene 3 pares de electrones a su alrededor, son los tres enlaces, su geometra es:
Molcula CH3 OH Esta molcula deriva del CH4 donde un H ha sido sustituido por un OH, hay que recordar que el OH viene del H2 O donde se ha sustituido un H por un CH3 Se hace la estructura del CH4 y del H2 O se seala que esta molcula deriva del CH4 donde un H ha sido sustituido por un OH, hay que recordar que el OH viene del H2 O donde se ha sustituido un H por un CH3 y se dibuja
Molcula de Oxgeno O2
Molcula de Dixido de Azufre SO2 S O O n= 8 8 8 =24 v= 6 6 6 =18 c=n-v=24-18=6=3 enlaces s=v-c=18-6=12=6 pares libres
En esta molcula existen estructuras resonantes, esto se produce cuando una molcula puede ser representada por ms de una estructura, ya que el doble enlace S=O puede estar en el oxgeno de la izquierda, todas las maneras de representar a la molcula son equivalentes, se les llama hbridos de resonancia, por eso la forma de la molcula es una combinacin de ambas
Molcula de CO2 C O O n= 8 8 8 =24 v= 4 6 6 =16 c=n-v=24-16=8=4 enlaces s=v-c=16-6=8=4 pares libres
Molcula de C2 H4
Dibujamos la estructura de Lewis Su geometra se determina considerando que cada C tiene 3 enlaces que se distribuyen en el espacio
Molcula: CH2 O C O H H n= 8 8 2 2 =20 v= 4 6 1 1 =12 c=n-v=20-12=8=4 enlaces s=v-c=12-8=4=2pares libres Tenemos el tomo central (C) que tiene dos enlaces simples con los H y un enlace doble con el O, este O es el que tiene los dos pares libres, luego la geometra es tringular plana
Molcula: CH2 O2 > HCOOH Es igual que el CH2 O se sustituye un H por un OH Luego hacemos la estructura del CH2 O como en el caso anterior y despues se considera la sustitucin de un H por un OH, la geometra es la misma
Molcula: CO3 2C O O O n= 8 8 8 8 =32 v= 4 6 6 6 =22+2=24 Se suman 2 electrones a v porque tiene dos cargas negativas c=n-v=32-24=8=4 enlaces s=v-c=24-8=16=8 pares libres El tomo central (C) tiene dos enlaces simples con dos oxgenos y uno doble con otro oxgeno, los pares libre estan en los oxgenos, la geometra es triangular plana Como el doble enlace puede estar en cualquier oxgeno, se produce el fenmeno de resonancia
Molcula: N2
Molcula: HCN H C N n= 2 8 8 =18 v= 1 4 5 =10 c=n-v=18-10=8=4 enlaces s=v-c=10-8=2=1 pares libres El tomo central (C) tiene un enlace triple con el N y un enlace con el H, el par libre est sobre el N, la geometra es lineal
Molcula: C2 H2 C C H H n= 8 8 2 2 =20 v= 4 4 1 1 =10 c=n-v=20-10=10=5 enlaces s=v-c=10-10=0=0 pares libres Los tomos de C estn unidos mediante un triple enlace y tienen otro enlace simple con cada H
Molcula de H3 O+ Se parte de la molcula de agua y se realiza un enlace covalente dativo
Molcula: NH4 + Se parte de la molcula de amoniaco y se realiza un enlace covalente dativo
co, donde el par libre ha sido sustituido por un H
Su geometra es un tetraedro como el amonia-
10
1.3.
SEMEJANZA DE DIVERSAS MOLCULAS
H2 O NH3 BeCl2 HCl CH4 C2 H 6 BF3 CH4 O SO2 C2 H 4 CH2 O CH2 O2 HCN C2 H 2 CO2 SH2 NCl3 BeBr2 HBr CCl4 C2 H5 Cl BCl3 ClCH3 O SeO2 ClC2 H3 ClCHO ClCHO2 ClCN ClC2 H CS2 SCl2 PCl3 BeH2 HI CHCl3 C2 H4 Cl2 BBr3 Cl2 CH2 O Cl2 C2 H2 SeH2 PH3 CH2 Cl2 C2 H3 Cl3 BI3 Cl3 CHO Cl3 C2 H OCl2 PBr3 CHCl3 C2 H2 Cl4 similares similares OF2
CHF3 similares
SiCl4
similares
1.4.
Polaridad del enlace covalente
Cuando se enlazan dos tomos, el elemento ms electronegativo atrae hacia si el par de electrones responsables del enlace, de esta manera sobre uno de los tomos de la molcula hay una densidad de carga negativa (el ms electronegativo) y sobre el otro una densidad de carga positiva
Se crea un dipolo, tal como se ve en la gura Para calcularlo se utiliza la expresin > =qd q d 1D=3,310-30 Cm momento dipolar carga distancia Debye (D) Culombios m
11
1.4.1.
Polaridad de las molculas
La polaridad de los enlaces covalentes produce que las molculas tengan caracter polar, debido a eso se distinguen diferentes casos: 1. En el caso de molculas diatmicas lineales, la polaridad de la molcula coincide con la polaridad del enlace
2. En el caso de molculas poliatmicas, para deducir su polaridad, hay que determinar su geometra
3.
Esto tiene inuencia en la solubilidad, puntos de fusin, ebullicin, estado(slido, lquido o gas) de las diferentes sustancias
12
2.
Propiedades de los compuestos covalentes
Son sustancias moleculares. Los tomos estan asociados formando molculas, su fuerza de unin es mayor que en el caso del enlace inico Generalmente son compuestos gaseosos porque entre las molculas apenas hay fuerzas de cohesin, debido a esto los puntos de fusin y ebullicin de los compuestos covalentes no son muy elevados Son solubles en disolventes apolares como el benceno o el tetracloruro de carbono No son conductores de la electricidad, los electrones estan ligados al enlace, no estan libres Hay que recordar que existen slidos covalentes reticulares, formados por disposiciones indenidas de tomos enlazados covalentemente, el solido entero forma una red gigante. Ejemplos de esto son el diamante y el grato
13
Das könnte Ihnen auch gefallen
- Seguridad en el laboratorio de químicaDokument5 SeitenSeguridad en el laboratorio de químicaJosé Díaz100% (4)
- Ciencias Ambientales - Problemas de Contaminacion Del Aire PDFDokument18 SeitenCiencias Ambientales - Problemas de Contaminacion Del Aire PDFFrank Mucha Lopez89% (19)
- Folleto Quimica General I ESPOL PDFDokument91 SeitenFolleto Quimica General I ESPOL PDFPatoCepedaNoch keine Bewertungen
- Estructuras de Lewis GuiaDokument6 SeitenEstructuras de Lewis Guiaprofe_astrid_alvarezNoch keine Bewertungen
- Actividades Iniciales Tema 13 Quimica Anaya 1 BachDokument3 SeitenActividades Iniciales Tema 13 Quimica Anaya 1 BachEstefania1987265Noch keine Bewertungen
- 04 Excepciones Lewis y Geometria MolecularDokument35 Seiten04 Excepciones Lewis y Geometria MolecularEve ValdesNoch keine Bewertungen
- Enlace Quimico COVALENTE para ImprimirDokument52 SeitenEnlace Quimico COVALENTE para ImprimirAlejandro RecioNoch keine Bewertungen
- Unidad 2 Lección 1 Taller ResonanciaDokument22 SeitenUnidad 2 Lección 1 Taller ResonanciamariaNoch keine Bewertungen
- Teorias de EnlaceDokument18 SeitenTeorias de EnlaceLia Alvarado MNoch keine Bewertungen
- 2 ENLACE QUIMICO. Parte 2 Complemento A La Teoría de Lewis-1 PDFDokument24 Seiten2 ENLACE QUIMICO. Parte 2 Complemento A La Teoría de Lewis-1 PDFAlexa MartinezNoch keine Bewertungen
- c6 Petruc Prop SolDokument8 Seitenc6 Petruc Prop SolMirian VivarNoch keine Bewertungen
- Tema 4 Enlace CovalenteDokument43 SeitenTema 4 Enlace CovalentedanihidalgosnNoch keine Bewertungen
- 1 Enlace QuimicoDokument87 Seiten1 Enlace QuimicoWalker ApazaNoch keine Bewertungen
- 1enlace Quimico QgeDokument59 Seiten1enlace Quimico QgeSANDILY DEYSI PAUCCAR PANIHUARANoch keine Bewertungen
- Enlace QuimicoDokument136 SeitenEnlace QuimicoHenry VelesacaNoch keine Bewertungen
- Egp Química Enlaces 10.15Dokument11 SeitenEgp Química Enlaces 10.15DanellisNoch keine Bewertungen
- Enlaces CovalentesDokument101 SeitenEnlaces CovalentesRobert Velázquez LucianoNoch keine Bewertungen
- EnlacecovalenteDokument64 SeitenEnlacecovalenteSergio QCNoch keine Bewertungen
- Enlace CovalenteDokument6 SeitenEnlace Covalentemaritza loyoNoch keine Bewertungen
- Tema_3_Enlace_químicoDokument12 SeitenTema_3_Enlace_químicohajar.ellouizi1Noch keine Bewertungen
- Uniones Químicas o Enlace QuímicoDokument21 SeitenUniones Químicas o Enlace QuímicoLaura BaezNoch keine Bewertungen
- Enlace CovalenteDokument24 SeitenEnlace CovalenteMiranda De la VegaNoch keine Bewertungen
- KekuleDokument15 SeitenKekuleAdriana CavazosNoch keine Bewertungen
- Enlace químico y estructura molecularDokument16 SeitenEnlace químico y estructura molecularDiegoNoch keine Bewertungen
- Tabla Periódica 2012Dokument39 SeitenTabla Periódica 2012Pochoo AlexNoch keine Bewertungen
- 1-Números CuánticosDokument9 Seiten1-Números CuánticosMayra RodríguezNoch keine Bewertungen
- Tema 1Dokument17 SeitenTema 1jcasares888Noch keine Bewertungen
- Enlace CovalenteDokument6 SeitenEnlace CovalenteDario JiménezNoch keine Bewertungen
- Enlaces QuimicosDokument76 SeitenEnlaces QuimicosGrc MrthNoch keine Bewertungen
- Enlace IonicoDokument37 SeitenEnlace IonicoJangel RMNoch keine Bewertungen
- Enlaces QuímicosDokument27 SeitenEnlaces QuímicosFernando ZuñigaNoch keine Bewertungen
- Folleto Diego MuñozDokument136 SeitenFolleto Diego MuñozRomel ToledoNoch keine Bewertungen
- Enlaces y Sus ConsecuenciasDokument69 SeitenEnlaces y Sus ConsecuenciasDavid LeToNoch keine Bewertungen
- Enlace covalente: compartición de electronesDokument31 SeitenEnlace covalente: compartición de electronesceo_quercusNoch keine Bewertungen
- Capa de Valencia, Lewis, Octeto, Enlace QuímicoDokument52 SeitenCapa de Valencia, Lewis, Octeto, Enlace QuímicoAlexandra SánchezNoch keine Bewertungen
- Geometría y enlaces de moléculasDokument5 SeitenGeometría y enlaces de moléculasmg88mgNoch keine Bewertungen
- Enlace Quimico Completo PDFDokument38 SeitenEnlace Quimico Completo PDFkatherineNoch keine Bewertungen
- EnlaceDokument7 SeitenEnlacechiihackerNoch keine Bewertungen
- Capitulo V Enlace QuimicoDokument26 SeitenCapitulo V Enlace QuimicoLUIS FERNANDO TAPARA QUISPENoch keine Bewertungen
- Clasificacion Enlaces Quimicos (Autoguardado)Dokument57 SeitenClasificacion Enlaces Quimicos (Autoguardado)Nancy FloresNoch keine Bewertungen
- Electrones No EnlazantesDokument26 SeitenElectrones No EnlazantesMassie RivasNoch keine Bewertungen
- Estructuras de LewisDokument17 SeitenEstructuras de LewisEmmanuel CocomNoch keine Bewertungen
- Documento 7Dokument14 SeitenDocumento 7jcasares888Noch keine Bewertungen
- Enlace de ValenciaDokument14 SeitenEnlace de ValenciaMiguel SánchezNoch keine Bewertungen
- Puntos 4-6Dokument4 SeitenPuntos 4-6alejo uribeNoch keine Bewertungen
- Unidad 3 Enlaces QuímicosDokument46 SeitenUnidad 3 Enlaces QuímicosAlexander HernándezNoch keine Bewertungen
- Puntos 4-6Dokument4 SeitenPuntos 4-6alejo uribeNoch keine Bewertungen
- Enlace CovalenteDokument5 SeitenEnlace CovalentelabeitiNoch keine Bewertungen
- Unidad3Dokument21 SeitenUnidad3Jose Raul HolguinNoch keine Bewertungen
- Apuntes Unidad 4. Enlace Covalente y Geometría MolecularDokument19 SeitenApuntes Unidad 4. Enlace Covalente y Geometría Molecularmjlizanco8Noch keine Bewertungen
- Enlace químico y estructura molecularDokument9 SeitenEnlace químico y estructura molecularcristhian rodriguezNoch keine Bewertungen
- Notas Tercer ParcialDokument68 SeitenNotas Tercer ParcialRuiz AlbertoNoch keine Bewertungen
- Estructuras de Lewis, polaridad y estabilidad de moléculasDokument12 SeitenEstructuras de Lewis, polaridad y estabilidad de moléculasAmaro IgnacioNoch keine Bewertungen
- Unidad 3 Enlaces y Estructuras Químicas (Material de Trabajo)Dokument7 SeitenUnidad 3 Enlaces y Estructuras Químicas (Material de Trabajo)michelle de Jesus Perez CorderoNoch keine Bewertungen
- SESION - 7 - Teoría Enlace QuímicoDokument6 SeitenSESION - 7 - Teoría Enlace QuímicohhuataybuNoch keine Bewertungen
- Wa0001.Dokument7 SeitenWa0001.Daniel García TreviñoNoch keine Bewertungen
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaVon EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaBewertung: 5 von 5 Sternen5/5 (1)
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaVon EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaNoch keine Bewertungen
- 6 Modelo Cine TicoDokument12 Seiten6 Modelo Cine TicoVictor Valdés AlvarezNoch keine Bewertungen
- Poder aéreo estratégico y evolución de las Fuerzas ArmadasDokument16 SeitenPoder aéreo estratégico y evolución de las Fuerzas ArmadasVictor Valdés AlvarezNoch keine Bewertungen
- Conf ServidorDokument1 SeiteConf ServidorVictor Valdés AlvarezNoch keine Bewertungen
- AjusteredoxbasicoDokument1 SeiteAjusteredoxbasicoVictor Valdés AlvarezNoch keine Bewertungen
- Manual DesobedienciaDokument57 SeitenManual Desobedienciadv0Noch keine Bewertungen
- Normas Dris para VidDokument195 SeitenNormas Dris para VidSuelos MéxicoNoch keine Bewertungen
- Enlace Ionico SolubilidadDokument7 SeitenEnlace Ionico SolubilidadDaniel Felipe AlbaNoch keine Bewertungen
- Definición de Cetonas y AldehídosDokument7 SeitenDefinición de Cetonas y AldehídosDavid FlorezzNoch keine Bewertungen
- Quimica 2Dokument34 SeitenQuimica 2mrjuegosNoch keine Bewertungen
- Hoja de Seguridad Pino Desinfectante ConcentradoDokument1 SeiteHoja de Seguridad Pino Desinfectante ConcentradoFlor Miluska Borda Vargas100% (1)
- Practica 3 Quimica Basica Esime ZacatencoDokument7 SeitenPractica 3 Quimica Basica Esime Zacatencomago866100% (2)
- Fórmulas y nombres de compuestos inorgánicosDokument7 SeitenFórmulas y nombres de compuestos inorgánicosFernando PérezNoch keine Bewertungen
- Marco Metodológico, Resumen, ConclisionesDokument8 SeitenMarco Metodológico, Resumen, ConclisionesclaudioNoch keine Bewertungen
- Construcción cobertura metálica estadio MoqueguaDokument3 SeitenConstrucción cobertura metálica estadio MoqueguajeancarloNoch keine Bewertungen
- Manual Laboratorio 2018 PDFDokument74 SeitenManual Laboratorio 2018 PDFLuis Fernando PerezNoch keine Bewertungen
- Resultados MayonesaDokument2 SeitenResultados MayonesaCristopher Gabriel Rojas Quiñones100% (1)
- Minerales estratégicos: Cobre, plomo, zinc y másDokument21 SeitenMinerales estratégicos: Cobre, plomo, zinc y másGerson A'hNoch keine Bewertungen
- Informe 1Dokument14 SeitenInforme 1spartanplay 16Noch keine Bewertungen
- Original PetrocasaDokument12 SeitenOriginal PetrocasaYohaira Moscoso100% (1)
- Triptico #1 BioquimicaDokument2 SeitenTriptico #1 BioquimicaOrlando J LezcanoNoch keine Bewertungen
- Prevision 2020 Material de CuracionDokument324 SeitenPrevision 2020 Material de Curacionconstancias imssNoch keine Bewertungen
- Laboratorio 3 ConsultaDokument7 SeitenLaboratorio 3 ConsultaNATHALIA VANESA BELALCAZAR CAICEDONoch keine Bewertungen
- Solubilidad de Compuestos OrgánicosDokument4 SeitenSolubilidad de Compuestos OrgánicosMaría Alejandra OsornioNoch keine Bewertungen
- Mundo Lácteo y Cárnico - Acido Láctico en Productos CárnicosDokument2 SeitenMundo Lácteo y Cárnico - Acido Láctico en Productos CárnicosmonsepackNoch keine Bewertungen
- HT Vencelatex VencedorDokument2 SeitenHT Vencelatex VencedorAlejandro Casimiro CruzNoch keine Bewertungen
- Orgnica 7Dokument3 SeitenOrgnica 7Diego GutierrezNoch keine Bewertungen
- 3 3 ElpapeldelamineríaDokument11 Seiten3 3 ElpapeldelamineríaCésar Cirilo ManzanarezNoch keine Bewertungen
- Trabajo de Poder CaloríficoDokument8 SeitenTrabajo de Poder CaloríficoHenry Gustavo Chaves GutiérrezNoch keine Bewertungen
- Previo de Laboratorio 4Dokument3 SeitenPrevio de Laboratorio 4José IdmeNoch keine Bewertungen
- Practica Reacciones de Aminoacidos y ProteinasDokument2 SeitenPractica Reacciones de Aminoacidos y ProteinasGutslutNoch keine Bewertungen
- Tabla de Valencias OficialDokument2 SeitenTabla de Valencias OficialMiguel BenjiNoch keine Bewertungen
- Balance de materiales en procesos de recuperación de acetonaDokument26 SeitenBalance de materiales en procesos de recuperación de acetonaManu RiosNoch keine Bewertungen
- Taller2 - Genesis Del Suelo-Minerales - Secundarios PDFDokument77 SeitenTaller2 - Genesis Del Suelo-Minerales - Secundarios PDFMeinardo BautistaNoch keine Bewertungen