Beruflich Dokumente
Kultur Dokumente
Lab. Quimicafisica
Hochgeladen von
Manuela MendozaOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Lab. Quimicafisica
Hochgeladen von
Manuela MendozaCopyright:
Verfügbare Formate
Docente: Ing.
JORGE SOLRZANO ARQUEROS Asignatura: LABORATORIO DE QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICAS DE LABORATORIO DEL CURSO DE QUMICA FSICA II
Contenido 1. Volumen Molar Parcial ..................................................................... 3 2. Temperatura Crtica de Solucin .................................................... 15 3. Destilacin Fraccionada.................................................................. 25 4. Diagrama de Equilibrio de Fases de un Sistema Lquido Tricomponente............................................................................... 34 5. Masa Molar de un Soluto No-Volatil .............................................. 41 6. Conductividad Eltrica.................................................................... 45 7. Nmero de Transferencia de un Ion ............................................... 54 8. Cintica de la Reaccin de Descomposicin del Perxido de Hidrgeno ...................................................................................... 60
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N1
VOLUMEN MOLAR PARCIAL
1. Objetivo Determinar los volmenes molares parciales de los constituyentes de una mezcla y estudiar la variacin de los mismos con la concentracin. Se considera para el estudio una solucin binaria de solvente y soluto. 2. Fundamento Terico El volumen total V de una solucin binaria en trminos de los volmenes molares parciales , y nmeros de moles , respectivamente para solvente y soluto, se expresa:
( )
( )
(1.1)
Un mtodo para medir el volumen parcial es determinando el volumen molar aparente , el cual se define: (1.2) en donde, y, (1.3) (1.4)
Siendo y las masas molares de solvente y soluto. el volumen molar del solvente puro, la densidad de la solucin y la densidad del solvente puro. Combinando (1.2), (1.3) y (1.4) obtenemos:
[
Si la masa del solvente As: ,
]
(la molalidad).
(1.5)
(1.6)
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
En la que W es el peso del picnmetro con solucin, Wa peso del picnmetro con solvente (H2O) y W0 peso del picnmetro vaco. La densidad de la solucin se obtiene de (1.7) siendo VP el volumen del picnmetro, que se calcula aplicando (1.8) Donde da es la densidad del agua a la temperatura del experimento. Una vez conocido se puede determinar (
, graficando
vs m. En el es decir
caso de electrolitos se encuentran que
aumenta linealmente con
(1.8) aqu es el volumen molar aparente a dilucin infinita y A una con stante.
Al graficar vs , de la pendiente se obtiene ( / )P, T, n = A. Derivando la ecuacin (1.9) con respecto a m a P, T y n1 constante, resulta
( (
) )
(1.10)
(1.11)
Por otro lado de la ecuacin (1.2) se obtiene
1.12)
De la combinacin de (1.6), (1.11) y (1.12) se obtiene , volumen molar parcial del soluto. El volumen total V de la solucin se determina tambin en base a la ecuacin (1.2) de la cual (1.13) De la ecuacin (1.1)
(1.14)
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
Por ltimo de la combinacin de (1.12), (1.13) y (1.14) el volumen molar parcial del solvente resulta definido en la forma
3. Material y Equipo
(1.15)
Acetona, agua destilada y cloruro de sodio; esptula, matraces volumtricos de 100ml. Papel filtro, picnmetro; pinzas para bureta, pipeta volumtricas de 50ml; termmetro, etc.
4. Procedimiento Se separan 100ml de una solucin acuosa 3-2M de NaCl. Con esta solucin madre se preparan otras soluciones de 1.0, 0.9, 0.8, 0.6, 0.4, 0.2 molar.
Las densidades de las soluciones se determinan con un picnmetro, pudiendo usarse el de Ostwald Sprengel o el de Weld. Las mediciones de pesada deben realizarse cuantitativamente. Se determina el volumen del picnmetro utilizando la densidad del agua destilada y la diferencia de masa entre el picnmetro con agua y vaco (W a - Wo).
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
5. Utilizacin de Datos, Clculos y resultados Tabular los datos detalladamente. Calcular la molalidad (m) de las soluciones a partir de la molaridad (M) y la densidad (d) de las mismas.
( ) ( )
(1.16)
En donde
es la masa molar del soluto.
Calcular el volumen molar aparente de soluto usando la ecuacin (1.6). Graficar (1.15). y determinar (
Calcular y usando las ecuaciones (1.12) y
CLCULOS 1. Datos de la Solucin Madre Tabla 1.1. Datos de Solucin madre Solucin Madre NaCl WNaCl (g) 117.5 Volumen (L) 1 MNaCl (g/mL) 58.44 Molaridad M 2.011
2. Determinacin de la densidad del H2O a temperatura ambiente Tambiente (C) = 28C (Datos de temperatura del H2O a 25C y 30C en tablas) 25 28 30 0.9970 X 0.9956
Por lo tanto la densidad del agua a 28.1 C es 0.99616 g/mL (
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
3. Determinacin de la densidad de las soluciones PICNMETRO #1 WPic. Vaco = 16.6315 g WPic. Agua = 41.3623 g Hallando Vp (Volumen del picnmetro) en la ecuacin (1.8)
Reemplazando Vp en (1.7) para determinar la densidad de la Sol. 0.9 M WPic. Sol. 0.9 M = 42.2250 g
Reemplazando Vp en (1.7) para determinar la densidad de la Sol. 0.8 M WPic. Sol. 0.8M = 42.1745 g
PICNMETRO #2 WPic. Vaco = 15.5449 g WPic. Agua = 40.5239 g Hallando Vp en la ecuacin (1.8)
Reemplazando Vp en (1.7) para determinar la densidad de la Sol. 0.4 M WPic. Sol. 0.4 M = 40.9128 g
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
PICNMETRO #3 WPic. Vaco = 16.5038 g WPic. Agua = 41.5807 g Hallando Vp en la ecuacin (1.8)
Reemplazando Vp en (1.7) para determinar la densidad de la Sol. 0.2 M WPic. Sol. 0.2 M = 41.8007 g
Reemplazando Vp en (1.7) para determinar la densidad de la Sol. 0.6 M WPic. Sol. 0.6M = 42.2185 g
Reemplazando Vp en (1.7) para determinar la densidad de la Sol. 1.0 M WPic. Sol. 1.0M = 42.4026 g
Tabla 1.2. Datos Experimentales para la determinacin de las densidades. PICNMETRO WPic. Vaco (g) 16.6315 WPic. Agua (g) 41.3623 Vp (mL) Molaridad (M) 0.9 N 1 24.8251 0.8 0.4 0.2 N 3 16.5038 41.5807 25.1726 0.6 1.0 WPic. Sol (g) 42.2250 42.1745 40.9128 41.8007 42.2185 42.4026 dsolucin (g/mL) 1.0310 1.0289 1.0117 1.0049 1.0215 1.0288
N 2
15.5449
40.5239
25.0743
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
4. Determinacin de la molalidad (m) de las soluciones Para la solucin 0.2 M, aplicando la ecuacin (1.16)
( Para la solucin 0.4 M ( Para la solucin 0.6 M ( Para la solucin 0.8 M ( Para la solucin 0.9 M ( Para la solucin 1.0 M (
5. Determinacin del volumen molar aparente ,
para las soluciones
Para la solucin 0.2 M, aplicando la ecuacin (1.6) [ ]
Para la solucin 0.4 M [ ]
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
Para la solucin 0.6 M [ ]
Para la solucin 0.8 M [ ]
Para la solucin 0.9 M [ ]
Para la solucin 1.0 M [ ]
6. Graficamos
versus
y determinamos (
Muestra 1 2 3 4 5 6
M 0.2 0.4 0.6 0.8 0.9 1.0
M 0.2014 0.4047 0.6083 0.8145 0.9199 1.0305 15.00 19.74 16.34 17.63 19.85 25.94
0.4488 0.6362 0.7799 0.9025 0.9591 1.0151 versus
Tabla 1.3. Datos para la Grfica 1.1.
LABORATORIO
QUIMICA FISICA II
10
UNIVERSIDAD NACIONAL DE TRUJILLO
7. Aplicamos mtodo de los mnimos cuadrados Tabla 1.4. Datos necesarios para aplicar mtodo de los mnimos cuadrados N x y x^2 x*y 1 2 3 4 5 6 SUMATORIA 0.4488 0.6362 0.7799 0.9025 0.9591 1.0151 4.7416 15 19.74 16.34 17.63 19.85 25.94 114.5 0.201421 6.732
0.404750 12.558588 0.608244 12.743566 0.814506 15.911075 0.919873 19.038135 1.030428 26.331694 3.979223 93.315058
Para la ecuacin de la recta:
Segn la grfica: ( )
8. Calculando y usando las ecuaciones (1.12) y (1.15) respectivamente.
) [ )
(
( )
( ]
(1.12) (1.15)
Para calcular (
, usamos la ecuacin (1.10) cuando )
QUIMICA FISICA II 11
LABORATORIO
UNIVERSIDAD NACIONAL DE TRUJILLO
Determinando para cada mezcla. o Para la solucin 0.2 M, con ( )
Reemplazando en (1.12) o Para la solucin 0.4 M, con ( o Para la solucin 0.6 M, con ( o Para la solucin 0.8 M, con ( o Para la solucin 0.9 M, con ( o Para la solucin 1.0 M, con ( ) ) ) ) )
LABORATORIO
QUIMICA FISICA II
12
UNIVERSIDAD NACIONAL DE TRUJILLO
Determinando para cada mezcla. Si para cada caso y
o Para la solucin 0.2 M, con ( )
Reemplazando en (1.15) [ o Para la solucin 0.4 M, con ( [ o Para la solucin 0.6 M, con ( [ o Para la solucin 0.8 M, con ( [ o Para la solucin 0.9 M, con ( [ ) ] ) ] ) ] ) ] ]
LABORATORIO
QUIMICA FISICA II
13
UNIVERSIDAD NACIONAL DE TRUJILLO
o Para la solucin 1.0 M, con ( [ ) ]
Muestra
M 0.2 0.4 0.6 0.8 0.9 1.0
m 0.2014 0.4047 0.6083 0.8145 0.9199 1.0305
d 1.0049 1.0117 1.0215 1.0289 1.0310 1.0288 15.00 19.74 16.34 17.63 19.85 25.94
0.4488 0.6362 0.7799 0.9025 0.9591 1.0151
17.7356 23.6378 21.0942 23.1313 25.6964 32.1279
18.0588 18.0405 18.0166 17.9881 17.9719 17.9539
1 2 3 4 5 6
Tabla 1.5 Cuadro de resultados finales 6. Conclusiones Con los datos obtenidos en la prctica podemos contrastar con la teora, pues la densidad del solvente puro siempre fue menor que la densidad de la solucin en cada muestra, esto debido a que cuando se mezclan el soluto con el solvente el cual posee mayor densidad, la densidad aumenta cuando estn mezclados. En el experimento se logr determinar los volmenes molares parciales de los constituyentes de la mezcla donde consideramos como solvente al H2O y como soluto al NaCl. Para ello fue necesario graficar la molalidad y volumen molar aparente, logrando as el objetivo. El experimento se realiz con el manejo adecuado de los equipos y materiales, sin embargo tuvimos algunas dificultades en la toma de datos al pesar tanto el solvente puro como las soluciones. Dificultades que se reflejaron al momento de hacer los clculos respectivos para la obtencin de los valores que se requeran para lograr el objetivo.
LABORATORIO QUIMICA FISICA II 14
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N2
TEMPERATURA CRTICA DE SOLUCIN
1. Objetivo Estudiar el equilibrio heterogneo de dos lquidos. Determinar su curva de solubilidad y aplicando la regla de las fases de Gibbs. Se considera para el estudio el sistema Fenol Agua. 2. Fundamento Terico Existen sistemas lquidos parcialmente miscibles cuya solubilidad es alterada con la variacin de la temperatura. Si se grafica la temperatura de solubilidad vs la composicin se obtiene una curva llamada curva de solubilidad o de equilibrio. Algunos sistemas exhiben una temperatura mxima de solucin (temperatura crtica de solucin), por ejemplo agua anilina. Otros exhiben temperatura mnima de solucin, agua trietilamina; otros mxima y mnima, agua nictica; y aun otros ni mxima ni mnima. El sistema Fenol Agua presenta solubilidad mutua con una temperatura mxima de solucin. Si un par lquido con temperatura crtica de solucin alto se encuentra a una temperatura inferior a esta y si existen 2 fases independientes de las cantidades de las 2 fases existentes. Una mayor interpretacin del comportamiento de estos sistemas bajo ciertas condiciones se consigue graficando la temperatura vs la composicin. 3. Material y equipo Agua y fenol (80%), tubos de ensayo pequeos con sus respectivos tapones de corcho; rejilla con asbesto, trpode, mechero, u otro equipo de calentamiento para bao mara; termmetro de 0C a 110C, bureta y vasos de 250ml. 4. Procedimiento Se prepara una solucin acuosa de fenol al 80%, aadiendo 125ml de agua a 500g de fenol tipo reactivo; se agita hasta la obtencin de una solucin homognea. De la solucin madre se vierte a travs de una bureta a 10 tubos de ensayo, volmenes de 10, 9, 8, 7, 6, 5, 4, 3, 2 y 1,25ml; anteriores 0, 1, 2, 3, 4, 5, 6, 7, 8, y 8,75ml de agua destilada. Obtenindose as un intervalo de concentracin de fenol de 10 a 80%. Cada tubo de ensayo con tapn, insertamos un termmetro de 110C dentro de l, y luego lo ponemos a bao mara. Se calienta lentamente el agua, agitando
LABORATORIO QUIMICA FISICA II 15
UNIVERSIDAD NACIONAL DE TRUJILLO
constantemente tubo siempre dentro del bao mara. Cuando el lquido turbio se aclara se anota la temperatura. Se omite el calentamiento manteniendo el tubo dentro del bao, cuando reaparezca la turbidez se anota nuevamente la temperatura que marca el termmetro. Como temperatura de miscibilidad se considera el promedio de las 2 temperaturas, para cada tubo en particular. No calentar las mezclas a temperaturas mayores a 75C ya que pueden descomponerse.
5. Utilizacin de Datos, Clculos y Resultados Tabular los datos detalladamente. Trazar 2 grficas de temperatura composicin, una de temperatura vs porcentaje en peso, y otra de temperatura vs fraccin molar. Indicar las reas (o porciones) que representan una fase y dos fases. De las grficas determinar la temperatura crtica de solucin y comparar el valor con el dado en la bibliografa. Determinar la concentracin y temperatura crtica de solucin usando una extensin de la ley del dimetro rectilneo, obteniendo la media aritmtica de cada lnea de unin entre 2 fases en equilibrio, a las temperaturas de 30, 40, 50 y 60 ; trazar una lnea recta uniendo las medias aritmticas. La concentracin crtica de solucin lo dar el punto de unin de lnea de medias aritmticas y la lnea correspondiente a la temperatura crtica. CLCULOS 1. Determinacin de la densidad del H2O a temperatura ambiente Tambiente (C) = 28,7C 25 28.7 30 0.9970 X 0.9956
LABORATORIO
QUIMICA FISICA II
16
UNIVERSIDAD NACIONAL DE TRUJILLO
Por lo tanto la densidad del agua a 28.7 C es 0.9960 g/mL ( 2. Datos de las mezclas binarias
Tabla 2.1. Volumen de las mezclas binarias y sus temperaturas de solubilidad. N Volumen (mL) Temperatura Solubilidad, C mezcla 1 2 3 4 5 6 7 8 9 10 Sol. Madre 10 9 8 7 6 5 4 3 2 1.25 Agua 0 1 2 3 4 5 6 7 8 8.75 T1 28.5 44 59 64 26 71 76 61 52 30 T2 13.5 45 58 62 50 70 74 65 45 30 TPROM 13.5 44.5 58.5 63 38 70.5 75 63 50.5 30
3. Determinando el %peso y % molar del fenol en cada mezcla Datos necesarios para el clculo de porcentaje molar y en peso de cada muestra Para la mezcla N 1
LABORATORIO
QUIMICA FISICA II
17
UNIVERSIDAD NACIONAL DE TRUJILLO
Para la mezcla N 2 ( )
Para la mezcla N 3 ( )
LABORATORIO
QUIMICA FISICA II
18
UNIVERSIDAD NACIONAL DE TRUJILLO
Para la mezcla N 4 ( )
Para la mezcla N 5 ( )
LABORATORIO
QUIMICA FISICA II
19
UNIVERSIDAD NACIONAL DE TRUJILLO
Para la mezcla N 6 ( )
Para la mezcla N 7 ( )
LABORATORIO
QUIMICA FISICA II
20
UNIVERSIDAD NACIONAL DE TRUJILLO
Para la mezcla N 8 ( )
Para la mezcla N 9 ( )
Para la mezcla N 10 ( )
LABORATORIO
QUIMICA FISICA II
21
UNIVERSIDAD NACIONAL DE TRUJILLO
Tabla 2.2. Porcentaje en peso del fenol y Porcentaje fraccin molar N mezcla 1 2 3 4 5 6 7 8 9 10 Volumen (mL) Sol. Madre 10 9 8 7 6 5 4 3 2 1.25 Agua 0 1 2 3 4 5 6 7 8 8.75 Peso (g) Fenol puro 8.3040 7.4736 6.6432 5.8128 4.9824 4.1520 3.3216 2.4912 1.6608 1.0380 Agua total 2.0760 2.8644 3.6528 4.4412 5.2296 6.0180 6.8064 7.5948 8.3832 8.9745 %peso (fenol) 80 72.29 64.52 56.69 48.79 40.83 32.80 24.70 16.54 10.37 %molar (fenol) 43.37 33.32 25.83 20.04 15.43 11.67 8.55 5.91 3.65 2.17
LABORATORIO
QUIMICA FISICA II
22
UNIVERSIDAD NACIONAL DE TRUJILLO
4. Graficando temperatura de solubilidad versus el %peso y % molar del fenol. Tabla 2.3. Datos para la grfica temperatura de solubilidad Vs %peso del fenol. Tsolubilidad 13.5 44.5 58.5 63 38 70.5 75 63 50.5 30 Ver Grfica 2.1 Tabla 2.3. Datos para la grfica temperatura de solubilidad Vs %molar del fenol. TSolubilidad 13.5 44.5 58.5 63 38 70.5 75 63 50.5 30 Ver Grfica 2.2 %molar 43.37 33.32 25.83 20.04 15.43 11.67 8.55 5.91 3.65 2.17 %peso 80 72.29 64.52 56.69 48.79 40.83 32.8 24.7 16.54 10.37
LABORATORIO
QUIMICA FISICA II
23
UNIVERSIDAD NACIONAL DE TRUJILLO
Clculo del porcentaje de error Temperatura crtica del solucin experimental Toexp = 70.5 C Temperatura crtica terica Toterica = 66 oC
5. Conclusiones En la prctica se trabaj con una solucin de fenol en las grficas obtenidas se pueden distinguir las dos fases de la solucin .es decir las sustancias se encuentran separadas en una solucin no homognea. Debajo de la curva se encuentra en 2 fases (fenol-agua),va incrementando la solubilidad a medida que se eleva la temperatura y fuera de la curva la composicin de las 2 capas se hacen idnticas, y de aqu que los 2 lquidos son completamente miscibles en todas sus proporciones, formndose una sola fase. Al comparar la temperatura critica experimental con la terica se observ que el porcentaje de error es un poco alto (6.82 %) lo cual quiere decir que el experimento se realiz en forma no muy adecuada por lo cual se dice que se tuvo errores como de la medicin de la sustancia (fenol) y del agua, al calentar los tubos de ensayo y adems al tener la solucin totalmente transparente este tardo para que la solucin quedara turbia.
LABORATORIO
QUIMICA FISICA II
24
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N 3
DESTILACIN FRACCIONADA
1. Objetivo Estudiar la separacin de una mezcla lquida binaria por destilacin fraccionada a reflujo total, usando mediciones del ndice de refraccin para determinar la composicin del destilado y residuo. 2. Fundamento Terico La destilacin fraccionada ha permitido enormes adelantos en las operaciones de separacin de materiales por destilacin tales como en la refinacin de petrleo y en la concentracin de istopos, y por consiguiente, un progreso notable en el diseo de equipo para estos fines. La separacin de dos lquidos por simple vaporizacin y condensacin no es efectiva, excepto cuando sus respectivos puntos de ebullicin difieren ampliamente. Una mejor separacin se consigue a base de una serie de destilaciones simples, lo cual sin embargo, es laborioso. Se obtiene el mismo resultado usando una columna de fraccionamiento, dentro de la cual asciende vapor ponindose en contacto con parte del condensado que desciende dentro de la misma. Los componentes menos voltiles se condensan de los vapores ascendentes y los ms voltiles de vaporizan de la fase lquida descendente, por lo que la destilacin a travs de la columna es equivalente a varias destilaciones simples sucesivas. La separacin es mejor, si la mejor parte de vapor condensado en la parte superior de la columna regresa como reflujo. La razn de reflujo se define como la razn de lquido que regresa a la columna a la cantidad de lquido separado como destilado. La temperatura ser ms baja en la parte superior, donde se concentra el componente ms voltil, que en la parte inferior, donde se encuentra en mayor proporcin el componente menos voltil. Si se usan columnas empaquetadas, se consiguen mejor contacto de las fases lquido vapor, pero el empaquetamiento no debe retener una fraccin grande del lote que se destila ya que disminuye el grado de separacin. La efectividad de una columna de destilacin se expresa en trminos de platos tericos. El plato terico se define como una seccin hipottica de columna que produce separacin tal de componentes que el vapor que sale por la parte superior de la seccin tiene la composicin de vapor que est en equilibrio con el lquido que cae por el fondo de la seccin. Una columna formada por un simple tubo de 1cm de dimetro y un metro de alto podra ser equivalente slo a un plato terico, mientras que el mismo tubo relleno de empaquetamiento adecuado puede equivaler a 20 o ms
LABORATORIO QUIMICA FISICA II 25
UNIVERSIDAD NACIONAL DE TRUJILLO
platos tericos. El nmero de platos tericos aumenta al disminuir la relacin de reflujo. Para determinar el nmero de platos tericos debe disponerse de datos de equilibrio lquido (L) vapor (V) de las substancias consideradas para trazar grficas como la de la Fig. 5.1 para el sistema CCl4 C6H6 ; o contar con datos de temperatura (Tb) vs composicin, para trazado de una grfica tal como la de la Fig. 5.2, y en base a la cual se obtiene los datos de la composicin de equilibrio lquido vapor.
Fig. 5.1 Grfica lquido vapor para el sistema CCl4 C6H6, para determinar el nmero de platos tericos.
En la Fig. 5.1., cada lnea vertical representa una etapa de destilacin ideal, su interseccin con la lnea superior determina la composicin del vapor en equilibrio con el lquido, indicado por la interseccin de la lnea vertical con la lnea inferior. Cada lnea horizontal muestra una condensacin completa de todo el vapor para dar un lquido de la misma composicin. El nmero de platos tericos es igual al nmero de escalones verticales 1. La superficie lquido vapor en el matraz de destilacin equivale a un plato terico. El nmero de platos tericos puede variar un poco con la velocidad de entrada del vapor en el fondo de la columna y la velocidad de regreso del lquido.
LABORATORIO
QUIMICA FISICA II
26
UNIVERSIDAD NACIONAL DE TRUJILLO
Fig. 5.2. Diagrama temperatura - composicin para un sistema lquido binario completamente soluble en la fase lquida.
3. Material y equipo Sistemas lquidos: CCl4 C6H6, CCl4 C6H5CH3, etc.; columna Vigreux, columnas empaquetadas (empaquetamiento: conos dobles, salidas de acero inoxidable, hlices de vidrio o bolitas de vidrio), cabeza de destilacin con refrigerante de dedo y termmetro, manta de calentamiento con tela de vidrio y autotransformador variable; probeta graduada de 100 ml, tubos de ensayo pequeos y corchos; refractmetro, soportes, pinzas, mangueras, etc.
LABORATORIO
QUIMICA FISICA II
27
UNIVERSIDAD NACIONAL DE TRUJILLO
4. Procedimiento experimental Se mezclan 10 ml de CCl4 con 40 ml de C6H6 ( 20 ml de CCl4 con 30 ml de C6H5CH3) en el matraz de destilacin, el cual, se calienta con manta de calentamiento controlada con autotransformador variable. El lquido debe hervir vigorosamente hasta que se produzca condensacin en la parte superior de la columna. En caso de que sta sea inundada, se debe disminuir el calentamiento. El refrigerante se instala en una posicin tal que todo el condensado regrese a la columna. Despus de establecerse el equilibrio, tomar las lecturas de temperatura en el termmetro cuando stas sean constantes. Separar muestras de destilado y residuo. Para la coleccin del destilado, el refrigerante debe estar instalado en una posicin tal que permita que el destilado gotee a una probeta graduada. Desechar las tres primeras gotas, y recolectar una muestra de un milmetro para su anlisis respectivo en un refractmetro (Abbe por ejm.) por el brazo lateral del matraz de destilacin separar con una pipeta 1 ml de lquido y guardarlo para su anlisis en el refractmetro (dependiendo de las circunstancias previamente puede quitarse el calentamiento). La eficiencia de la columna determinada en base a estas dos muestras corresponde a la eficiencia de la columna a reflujo total. Se puede repetir el procedimiento con la columna empaquetada para fraccionamiento, la cual requiere mayor tiempo para alcanzar el equilibrio pero se obtiene mayor eficiencia de separacin. O puede usarse tambin una columna de platos de burbujeo. Si se usa la columna empaquetada, la columna y matraz de destilacin se evacan y secan, y se introducen 30 ml de cloroformo y 30 ml de benceno. El condensado de reflujo se ajusta para razn de reflujo 5:1 a 10:1, segn se ha calculado de las velocidades de goteo del refrigerante a reflujo y del tubo de destilacin. El destilado se colecta en una probeta. Despus de cada 3 ml de destilado se toma una muestra de 1 ml en una botellita provista de tapn, y posteriormente a estas muestras se les mide el ndice de refraccin. Se debe llevar un registro del volumen total de lquido destilado y de la lectura del termmetro al tiempo de tomar cada muestra. Tambin se anota el volumen total final del destilado. 5. Utilizacin de Datos, Clculos y Resultados Tabular los datos detalladamente. Los ndices de refraccin del benceno, tetracloruro de metilo y de mezclas de los 2 vs %molar de tetracloruro de metilo, se grafica en papel coordenado. Con la curva obtenida determinar la composicin de una mezcla lquida desconocida por interpolacin del ndice de refraccin. En esta forma se determinan las composiciones del destilado y residuo. Con datos de composicin L V o en base a datos de temperatura (de ebullicin) composicin, trazar la curva de equilibrio.
28
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
Fijar los puntos representativos del destilado y residuo, y proceder a la determinacin del nmero de paltos tericos tal como se ha explicado en la seccin terica. CLCULOS
Para los clculos posteriores usaremos: A: agua (18g/mol) densidad 0,9852 g/mL B: metanol (32g/mol) densidad 0,788 g/mL Tabla 3.1. Datos experimentales, fraccin molar e ndice de refraccin.
Mezcla N 1 2 3 4 5 6 7 8 9 10 V(ml) A B 5 0 4 1 3 2 2 3 1 4 0 5 3.5 1.5 2.5 2.5 1.5 3.5 0.5 4.5
d(g/ml) A 0.9852 0.9852 0.9852 0.9852 0.9852 0.9852 0.9852 0.9852 0.9852 0.9852 B 0.7880 0.7880 0.7880 0.7880 0.7880 0.7880 0.7880 0.7880 0.7880 0.7880
W(g) A 4.9260 3.9408 2.9556 1.9704 0.9852 0 3.4482 2.463 1.4778 0.4926 B 0 0.7880 1.5760 2.3640 3.1520 3.9400 1.1820 1.9700 2.7580 3.5460
Moles (mol) A 0.2737 0.2189 0.1642 0.1095 0.0547 0 0.1916 0.1368 0.0821 0.0274 B 0 0.0246 0.0493 0.0739 0.0985 0.1231 0.0369 0.0616 0.0862 0.1108
Fraccin Molar I.R A 1 0.8989 0.7693 0.5971 0.3572 0 0.8384 0.6897 0.4879 0.1981 B 0 0.1011 0.2307 0.4029 0.6428 1 0.1616 0.3103 0.5121 0.8019 1.3332 1.3320 1.3310 1.3295 1.3280 1.3260 1.3315 1.3300 1.3290 1.3270
Los datos obtenidos en la tabla se determinaron de la siguiente manera para la mezcla 1 Peso de A
Peso de B
Nmero de moles de A
Nmero de moles de B
Fraccin molar de A
LABORATORIO
QUIMICA FISICA II
29
UNIVERSIDAD NACIONAL DE TRUJILLO Fraccin molar de B
Como el compuesto ms voltil es el metanol, entonces, hacemos una grfica Fraccin molar de metanol Vs ndice de Refraccin de la mezcla para hallar las fracciones molares que ms adelante usaremos para hallar el nmero de platos tericos.
Tabla 3.2 Datos de la grfica fraccin molar Vs ndice de refraccin
N 1 2 3 4 5 6 7 8 9 10 Destilado Residuo
Frac. Molar del metanol 0 0.1011 0.2307 0.4029 0.6428 1 0.1616 0.3103 0.5121 0.8019 XD XR
IR 1.3332 1.3320 1.3310 1.3295 1.3280 1.3260 1.3315 1.3300 1.3290 1.3270 1.3270 1.3330
Graficando los datos tabulados de las mezclas (1-10) Ver Grfica 3.1 Obtenemos la fraccin molar para el residuo y el destilado XD = 0.02 XR = 0.82 Hallando la presin del metanol en vapor puro De la bibliografa de YAWS tenemos:
LABORATORIO
QUIMICA FISICA II
30
UNIVERSIDAD NACIONAL DE TRUJILLO
SUSTANCIA CONSTANTES A B C D E Temperatura mnima Temperatura mxima
METANOL 45.6171 -3.2447x10
3
AGUA 29.8605 -3.1522x103 -7.3037 2.4247x10-9 1.809x10-6 273.46 647.13
-1.3988x101 6.6365x10-3 -1.0507x10-13 175.47 512.58
Tabla 3.3 Presiones de vapor del agua y del metanol Con los datos de la Tabla 3.3. Reemplazados en la formula obtenemos los siguientes resultados para temperaturas de 65 a 100 C. Temperatura (C) 65 70 75 80 85 90 95 100 Temperatura (K) 338 343 348 353 358 363 368 373 Presin de vapor para el agua 186.50 232.39 287.47 353.18 431.05 522.80 630.29 755.54 Presin de vapor para el metanol 769.21 933.17 1124.97 1348.12 1606.36 1903.74 2244.57 2633.44
Tabla 3.4 Presiones de vapor a 65 - 100 C para el agua y el metano
Con los datos de la tabla 3.4 Calculamos fraccin molar en el lquido del metanol
Calculando fraccin molar de vapor del metanol
LABORATORIO
QUIMICA FISICA II
31
UNIVERSIDAD NACIONAL DE TRUJILLO
Luego de realizar los clculos para el metanol encontramos los siguientes resultados. Tabla 4.3. Fracciones molares del metanol en el lquido y en el vapor. Fraccin molar en el lquido del metanol X2 0.9842 0.7529 0.5642 0.4089 0.2799 0.1718 0.0803 0.0024 Fraccin molar de vapor del metanol Y2 0.9961 0.9245 0.8351 0.6053 0.5916 0.4303 0.2372 0.0083
Con la Tabla 4.3 Graficamos la Curva de equilibrio para la determinacin del nmero de platos a reflujo total. Ver Grfica 3.2 El nmero de platos tericos obtenidos en la grfica = 4 Se consider trazar la Grfica 3.3. Diagrama Temperatura-Composicin para un sistema lquido binario completamente soluble en fase lquida.
Temperatura (C) 65 70 75 80 85 90 95 100 (Ver Grfica 3.3)
Fraccin molar en el lquido del metanol X2 0.9842 0.7529 0.5642 0.4089 0.2799 0.1718 0.0803 0.0024
Fraccin molar de vapor del metanol Y2 0.9961 0.9245 0.8351 0.6053 0.5916 0.4303 0.2372 0.0083
LABORATORIO
QUIMICA FISICA II
32
UNIVERSIDAD NACIONAL DE TRUJILLO
De la Grfica 3.3 se observa La temperatura de ebullicin del agua = 100C La temperatura de ebullicin del fenol = 66C
6. Conclusiones
Se grafic correctamente el diagrama temperatura composicin para un sistema binario completamente soluble en la fase lquida. De la grfica lquido vapor para el sistema metanol agua se determin el nmero de platos tericos. Finalmente se logr el objetivo de la prctica y como se pudo observar en la columna de destilacin fraccionada hay varias etapas (platos), en las cuales se realiza un intercambio de masa, liquido vapor y as el lquido a destilar salga ms puro, con este fundamento fue posible estudiar la separacin de la mezcla binaria por destilacin fraccionada a reflujo total y adems determinar la composicin del destilado y del residuo.
LABORATORIO
QUIMICA FISICA II
33
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N 4
DIAGRAMA DE EQUILIBRIO DE FASES DE UN SISTEMA LQUIDO TRICOMPONENTE
1. Objetivo Trazar un diagrama de equilibrio de fases para un sistema lquido ternario con 2 componentes originalmente inmiscibles, en base a mediciones experimentales de solubilidad y equilibrio, analizando el diagrama resultante con aplicacin de la regla de las fases de Gibbs. Estos diagramas se usan principalmente en los clculos de los procesos de extraccin con solvente. Para este estudio se considera el sistema Benceno cido Actico Agua, con los componentes inmiscibles benceno y agua, a presin y temperatura ambiente. 2. Fundamento Terico A presin y temperatura constante, las composiciones de mezclas lquidas ternarias pueden representarse en un diagrama coordenado triangular trazado en 2 dimensiones, usndose para tal fin un tringulo equiltero. Cada lado del tringulo representa la composicin de 2 componentes, cada vrtice un componente puro y un punto dentro del tringulo una mezcla ternaria. Si adems de la composicin se involucra otra variable, por ejemplo la temperatura; para determinacin del diagrama de equilibrio la fase se requerir de una tercera dimensin, resultando una figura en el espacio. Si a mezclas binarias de lquidos inmiscibles o parcialmente miscibles, se adiciona un tercer lquido soluble en cada uno de estos, se obtiene un tercer lquido soluble en cada uno de estos, se obtienen mezclas ternarias formando una sola fase o separables en 2 fases (o capas), dependiendo de las concentraciones. Los puntos representativos de las composiciones de las mezclas ternarias comenzando a formar una sola fase, dentro del tringulo equiltero, determinan una curva llamada curva de solubilidad o de equilibrio.
LABORATORIO
QUIMICA FISICA II
34
UNIVERSIDAD NACIONAL DE TRUJILLO
Fig.3.1 Diagrama de equilibrio de fases para un sistema liquido ternario con dos componentes inmiscibles A y B.
Fig. 3.2 Diagrama de Equilibrio de Fases para un sistema lquido ternario con 2 componentes parcialmente miscibles A y B. Esta curva puede pasar por 2 vrtices del tringulo cuando dos de los componentes son inmiscibles inicialmente, caso C6H6 H2O en el sistema C6H6 H2O CH3COOH, Fig. (3.1); o puede interceptar a un lado del tringulo cuando dos de los componentes son parcialmente miscible como H2O y CHCl3 en el sistema CHCl3 HAc H2O. Fig. 3.2.
LABORATORIO
QUIMICA FISICA II
35
UNIVERSIDAD NACIONAL DE TRUJILLO
Todo punto afuera de la curva representa un sistema ternario completamente miscible (una sola fase), y un punto por debajo de la curva un sistema separable en 2 fases. La lnea que une dos puntos de la curva tal como a y b en la Fig. 3.1, se denomina lnea de unin o de reparto, que no es necesariamente paralela a la base o paralela a otra u otras lneas de unin. Se pueden preparar varias mezclas lquidas ternarias separables en 2 capas y obtener varias lneas de reparto, como cd, ef y gh en la Fig. 3.1; las composiciones de las capas respectivas dependen de las composiciones de las mezclas ternarias originales. A medida que se aada el componente miscible (al sistema binario inmiscible o parcialmente miscible) las composiciones de las dos capas conjugadas se tornan ms semejantes una de otra, hasta que se obtiene una sola fase o capa. El punto representativo de la composicin de esta fase nica se denomina punto crtico o de dobles. Las mezclas ternarias de C6H6 HAc H2O forman sistemas de una sola fase a determinados intervalos de concentracin y sistemas de dos fases generalmente concentraciones bajas de cido actico (3). Los componentes C6H6 H2O son inmiscibles originalmente, y el HAc es completamente miscible tanto en C6H6 como en H2O, y a temperatura constante se obtiene un diagrama de fases semejantes al mostrado en la Fig. 3.1. 3. Material y Equipo cido actico glacial, benceno puro, agua destilada, soluciones diluidas de hidrxido de sodio 0,5N, 0,01N y 0,001N; y fenolftalena. Frascos de vidrio de aproximadamente 125ml con tapn de vidrio esmerilado, bureta de 50ml, embudos de decantacin, pipetas de 5ml y bombilla. Equipo de agitacin magntica, soportes y pinzas. Papel coordenado triangular. 4. Procedimiento Experimental a. DETERMINACIN DE LA CURVA DE SOLUBILIDAD Preparar mezclas de benceno y agua (en cantidades adecuadas), con los siguientes porcentajes en peso de benceno: 10, 20, 30, 40, 50, 60, 70, 80 y 90 %; en los frascos de tazn de vidrio esmerilado. Cada mezcla binaria se agita vigorosamente por medio de la agitacin magntica, hasta la aparicin de una dispersin turbia y se titula despus con HAc glacial hasta un punto de muy dbil turbidez; anotar el gasto de HAc glacial, seguir titulando hasta la formacin de una sola fase ntida y nuevamente anotar el gasto de HAc; considerar como gasto de HAc el promedio aritmtico de estos dos gastos. En base a este dato, determinar la composicin de cada mezcla ternaria (en porcentaje en peso o fraccin molar) para el trazado de la curva de solubilidad.
LABORATORIO
QUIMICA FISICA II
36
UNIVERSIDAD NACIONAL DE TRUJILLO
b. DETERMINACIN DE LAS LNEAS DE REPARTO Preparar mezclas ternarias (en cantidades adecuadas) de benceno, cido actico y agua, con las siguientes composiciones en volumen.
%Vol AGUA ACIDO ACETICO 4.5 1 3.5 2 2.5 3 1.5 4
MEZCLA 1 2 3 4
CLOROFORMO 4.5 4.5 4.5 4.5
TOTAL 10 10 10 10
Adicionar cada mezcla a un embudo de decantacin, agitar vigorosamente y dejarlo reposar para permitir la formacin de 2 capas. Separar una cantidad adecuada de cada capa (dependiendo de la cantidad de mezcla original), pesarla y titularla con solucin diluida de NaOH, usando solucin de NaOH de mayor dilucin para la capa bencnica; utilizar como indicador fenolftalena. Determinar el contenido de HAc en cada capa en porcentaje en peso o en fraccin molar, para su representacin en la porcin correspondiente de la curva de solubilidad. 5. Utilizacin de Datos, Clculos y Resultados Tabular los datos detalladamente para facilitar los clculos. Usar las leyes del tringulo equiltero para la fijacin de los puntos representativos de las composiciones de las mezclas ternarias, dentro del mismo. Con las composiciones de las mezclas ternarias de una sola fase (%en peso generalmente), trazar la curva de solubilidad dentro del tringulo equiltero previamente trazado en papel coordenado triangular. Representar los porcentajes en peso de HAc de las capas acuosa y bencnica en las porciones respectivas de la curva de solubilidad y trazar las lneas de reparto uniendo las parejas de puntos con una lnea recta. Estas deben pasar por los puntos representativos de las composiciones globales de las mezclas ternarias originales. Determinar el punto crtico para este sistema ternario. Hacer una discusin del diagrama de equilibrio de fases resultante, aplicando la Regla de las Fases de Gibbs en cada regin del diagrama. CLCULOS 1. Datos de las soluciones Sistema: CHCl3 CH3COOH H2O Tabla 4.1.Propiedades fisicoqumicas de las sustancias a utilizar. M (g/mol) (g/mL) A CHCl3 119.4 1.48 B H2O 18.00 0.9897 C CH3COOH (HAc) 60.05 1.049
LABORATORIO QUIMICA FISICA II 37
UNIVERSIDAD NACIONAL DE TRUJILLO
2. Determinacin de la curva de solubilidad Tabla 4.2. Datos experimentales Volumen de mezclas binarias y HAc. N 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 A 0.3 0.4 0.5 1 2 3 4 5 6 7 8 9 9.3 9.5 9.6 V(ml) B total 9.7 10 9.6 10 9.5 10 9 10 8 10 7 10 6 10 5 10 4 10 3 10 2 10 1 10 0.7 10 0.5 10 0.4 10 ml de HAc gastado al punto de solubilidad 5.0 6.6 7.9 10.5 11.0 11.3 11.8 12.1 10.8 10.5 7.8 7.1 5.3 5.0 4.4
La siguiente tabla se obtiene a partir de los ml de las mezclas binarias (A y B), ml de HAc gastado al punto de solubilidad (C) y las densidades de A, B y C. Tabla 4.3. Peso en gramos y Porcentaje e peso de las soluciones. A 0.4440 0.5920 0.7400 1.4800 2.9600 4.4400 5.9200 7.4000 8.8800 10.360 11.840 13.320 13.764 14.060 14.208
LABORATORIO
PESO (gramos) B C 9.6001 5.2450 9.5011 6.9234 9.4022 8.2871 8.9073 11.015 7.9176 11.539 6.9279 11.854 5.9382 12.378 4.9485 12.693 3.9588 11.329 2.9691 11.015 1.9794 8.182 0.9897 7.448 0.6928 5.560 0.4949 5.245 0.3959 4.616
% peso TOTAL 15.2891 17.0165 18.4293 21.4023 22.4166 23.2219 24.2362 25.0415 24.1678 24.3441 22.0014 21.7577 20.0168 19.7999 19.2199 %A 2.9 3.5 4.0 6.9 13.2 19.1 24.4 29.6 36.7 42.6 53.8 61.2 68.8 71.0 73.9 %B 62.8 55.8 51.0 41.6 35.3 29.8 24.5 19.8 16.4 12.2 9.0 4.5 3.5 2.5 2.1 %C 34.3 40.7 45.0 51.5 51.5 51.0 51.1 50.7 46.9 45.2 37.2 34.2 27.8 26.5 24.0 %TOTAL 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100
38
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
3. Determinacin de las lneas de reparto Datos experimentales Preparamos mezclas ternarias de Cloroformo, cido actico, agua, 10 mL, cada una con las siguientes composiciones de volumen Tabla 4.4. Volumen de mezclas ternarias. N A L-1 L-2 L-3 L-4 4.5 4.5 4.5 4.5 Mezclas ternarias (mL) B 4.5 3.5 2.5 1.5 C 1 2 3 4 TOTAL 10 10 10 10
Tabla 4.5. Peso en gramos y porcentaje en peso de las lneas de reparto. PESO (gramos) A 6.6600 6.6600 6.6600 6.6600 B 4.4537 3.4640 2.4743 1.4846 C 1.0490 2.0980 3.1470 4.1960 TOTAL 12.163 12.222 12.281 12.341 %A 54.8 54.5 54.2 54.0 %B 36.6 28.3 20.1 12.0 % peso %C 8.6 17.2 25.6 34.0 %TOTAL 100 100 100 100
4. Determinando el Peso de HAc en el volumen de capa considerado y el %peso de HAc en cada capa Se dedujo que, estequeomtrico: del siguiente calculo
Para hallar el porcentaje en peso de HAc de la capa acuosa en la lnea de reparto, se tom el siguiente paso: Para L - 1
LABORATORIO
QUIMICA FISICA II
39
UNIVERSIDAD NACIONAL DE TRUJILLO
Para hallar el porcentaje en peso de HAc de la capa clorofrmica en la lnea de reparto, se tom el siguiente paso: Para L - 1
Para las lneas 2, 3 y 4 realizamos el mismo procedimiento Tabla 4.6. Porcentaje en peso de HAc en la capa acuosa y clorofrmica. V(ml) CA L-1 CC CA L-2 CC CA L-3 CC CA CC 3 3 3 3 3 3 2.9 3 W (g) 2.8911 4.0262 2.9253 4.0236 3.0399 3.7813 3.0921 3.7167 Gasto NaOH (0.5N) 17.3 2.10 33.7 8.80 51.1 21.4 59.3 32.4 WHAc(g) 0.5194 0.0631 1.0118 0.2642 1.5343 0.6425 1.7805 0.9728 %W (HAc) 17.9 1.6 34.6 6.6 50.5 16.9 57.6 26.2
L-4
6. Conclusiones Se pudo determinar satisfactoriamente la curva de solubilidad en el sistema lquido tricomponente. Tambin se pudo determinar sus respectivas lneas de reparto (L-1, L-2, L-3, L-4). Hallamos tambin el punto crtico para este sistema ternario graficando los datos obtenidos de los clculos experimentales.
LABORATORIO
QUIMICA FISICA II
40
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N 5
DETERMINACIN DE LA MASA MOLAR DE UN SOLUTO NOVOLATIL
1. Objetivo Determinar la masa molar de un soluto no voltil en base a mediciones experimentales de la elevacin del punto de ebullicin del solvente en solucin de este soluto, usando el termmetro diferencial Beckman. 2. Fundamento Terico En soluciones de solutos no voltiles, la presencia de soluto aumenta el punto de ebullicin del solvente; este incremento o ascenso ebulloscpico se determina por la ecuacin:
(6.1)
Donde R es la constate de los gases, To la temperatura normal de ebullicin del solvente puro. y el calor molar de vaporizacin y nmero de moles de solvente respectivamente, y m la molalidad de la solucin. El trmino entre corchetes es funcin de la naturaleza del solvente y se le denomina constante ebulloscpica del solvente, Ke; y as la ecuacin (6.1) se puede escribir en la forma:
(6.2) La molalidad se da por: (6.3) En la que y son la masa y la masa molar del soluto respectivamente, y masa del solvente (lquido). De la combinacin de (6.2) y (6.3): (6.4) la
LABORATORIO
QUIMICA FISICA II
41
UNIVERSIDAD NACIONAL DE TRUJILLO
La ecuacin (6.4) es la expresin matemtica para la determinacin de la masa molar del soluto , midiendo experimentalmente la elevacin del punto de ebullicin del solvente , causada por la disolucin de gramos soluto en gramos de solvente. 3. Material y Equipo Solventes lquidos como benceno, acetona, etc.; soluto que en ese caso fue urea. Aparato para ascenso ebulloscpico de CottrellChopin con cmara de ebullicin y otros accesorios; refrigerante, termmetro diferencial Beckman, lupa, micromechero, rejilla y gas propano; podra usarse como equipo y medio de calentamiento lmpara de rayos infrarrojos y manta de calentamiento que funciona con electricidad. Prensa para comprimidos, soportes, pinzas, etc. 4. Procedimiento Experimental Calibrar el termmetro Beckman de tal manera que el nivel de hg se site aproximadamente en la mitad inferior de la escala del termmetro a ebullicin normal del solvente puro. Las cantidades de solvente y soluto se fijan de tal forma que se obtenga una solucin diluida. Para el presente experimento se eligen como solvente y soluto urea y paranitrotolueno (p-nitrotolueno), respectivamente. a la cmara de ebullicin conteniendo previamente trocitos de porcelana porosa para regular la ebullicin, se vierten 25 ml de urea; se conecta el termmetro Beckman al aparato de cottrell-chopin, se provee de una refrigeracin adecuada con agua al sistema, y se le suministra calentamiento a la cmara de ebullicin con llama de micromechero en otro dispositivo. Proceder ahora a la toma de lecturas de nivel de hg en la escala del termmetro cada 30 segundos (mnimo 4), cuando la ebullicin es suave, la cual se obtiene por percolacin regular del lquido sobre el bulbo del termmetro. Interrumpir el calentamiento, separar momentneamente el termmetro Beckman, e introducir en la cmara de ebullicin 0.30 gr de p-nitrotolueno; suministrar nuevamente el calentamiento y anotar las lecturas del punto de ebullicin de la solucin en forma anloga a las del solvente puro. Las fluctuaciones de temperatura que pudieran producirse podran deberse a prdidas de vapor de disolvente o cuando el bulbo no est bien cubierto por porciones del percolador. Se deben controlar la presin baromtrica y la temperatura ambiente; el punto de ebullicin es sensible a las variaciones de la presin atmosfrica si la determinacin se efecta por un periodo largo de tiempo. Algunos solutos se asocian en urea a molculas dobles. 5. Utilizacin de datos, clculos y resultados
LABORATORIO
QUIMICA FISICA II
42
UNIVERSIDAD NACIONAL DE TRUJILLO
Tabular los datos detalladamente. remplazar los valores de las masas de solvente y soluto, valor promedio y corregido del ascenso ebulloscpico del solvente proveniente de la medicin experimental, y el valor de la constante ebulloscpico corregida, en la ecuacin (6.4); para determinar la masa molar de soluto m2. Comparar este resultado con el valor dado en la bibliografa, calculando el porcentaje de error. La correccin de la constante ebulloscpico del solvente puede hacerse segn los datos que se indican (3). CLCULOS 1. Datos considerados en la prctica. Tabla 1.1. Datos considerados para el solvente y soluto. (g/mol) Sustancia Ke (C) SOLVENTE SOLUTO Agua (H2O) Urea (CH4N2O) 18.01 60.06 0.52 -
2. Determinacin de la densidad del H2O a temperatura ambiente. Tambiente (C) = 27C (Datos de temperatura del H2O a 25C y 30C en tablas) 25 28 30 0.9970 X 0.9956
Por lo tanto la densidad del agua a 27 C es 0.99644 g/mL ( 3. Determinando el ascenso ebulloscpico terico por la frmula (6.2). Calculando masa terica del solvente (Agua). Si: ( ) ( )
LABORATORIO
QUIMICA FISICA II
43
UNIVERSIDAD NACIONAL DE TRUJILLO
Calculando la molalidad de la solucin con la ecuacin (6.3)
Calculando ascenso ebulloscpico terico Si la constante ebulloscpica del agua es Ke = 0.52
4. Determinando experimentalmente el ascenso ebulloscpico Para el solvente: Para el soluto: Por tablas sabemos que:
Entonces la masa molar terica de la urea es La masa molar experimental ser:
Por lo que observamos, existe un error:
5. Conclusin.Obtuvimos la masa molar de un soluto no voltil (urea) con un margen de error del valor terico de 4.26 %, esto quiere decir que, es muy aceptable el valor y se obtuvo una buena toma de datos.
LABORATORIO
QUIMICA FISICA II
44
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N 6
CONDUCTIVIDAD ELCTRICA
1. Objetivo Medir la conductividad elctrica de soluciones electrolticas acuosas, determinando la constante de la celda utilizada. Se consideran para el estudio electrolitos fuertes y dbiles. 2. Fundamento Terico Cuando se pasa corriente elctrica a travs de una solucin electroltica, la carga elctrica es transportada por el movimiento de aniones y cationes. Si la solucin de electrolito se coloca dentro de una celda conteniendo dos electrodos paralelos de rea A cada uno, separados una distancia , y se encuentra que la resistencia total en la celda es R, la conductividad o conductancia de la solucin electroltica se expresa en la forma: (6.1) Cada solucin electroltica posee una conductividad especfica, Ks, la cual se define: (6.2) Siendo la resistencia especfica o resistividad de la solucin, y se da por:
De donde:
(6.3)
(6.3) En la que: (6.4) K es la constante de la celda, y como lo muestra la ecuacin (4 ) depende de la geometra de la misma. De la combinacin de (6.2), (6.3) y (6.4): (6.5)
LABORATORIO
QUIMICA FISICA II
45
UNIVERSIDAD NACIONAL DE TRUJILLO
Y de (6.1) y (6.5): (6.6) De (6.5): (6.7) La ecuacin (6.7) permite la determinacin de la constante de la celda en trmino de la conductividad especfica y resistencia de la solucin. Por otro lado, se define como conductividad equivalente, : (6.8) Donde C es la concentracin del electrolito en equivalente/Litro de solucin. Midiendo la resistencia de una solucin electroltica cuya conductividad especfica sea conocida, se puede determinar la constante de la celda usando la ecuacin (6.5). Midiendo experimentalmente despus en la misma celda la resistencia de otra y otras soluciones electrolticas, se pueden calcular sus conductividades especficas aplicando la misma ecuacin (6.5) y sus respectivas conductividades equivalentes a travs de la ecuacin (6.8).
Fig. 6.1. Circuito de Puente Wheatstone
La resistencia se mide colocando a la celda en un brazo de circuito de puente usando corriente alterna CA (2) o directa CD (6) este circuito va conectado a un generador de bajo voltaje (caso CA 1000 ciclos/s) y a un dispositivo detector tal como
46
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO
un galvanmetro; como se muestra en la Fig. 6.1. El propsito de usar corriente alterna es evitar polarizacin de los electrodos en la celda de conductividad, lo cual podra conducir a reaccin en los electrodos (1), la celda es de vidrio con electrodos de platino sellados. El generador suministra una corriente de intensidad , la cual se bifurca en A en las intensidades . La corriente de intensidad pasa a travs de las resistencias (solucin electroltica) y la de intensidad pasa a travs de las resistencias . Se miden en el puente wheatstone. Cuando no pasa corriente por el detector, el potencial en el punto B es igual al potencial en el punto D, en estas condiciones se puede escribir: (6.9) (6.10) Combinando las ecuaciones (6.9) y (6.10) se obtiene: (6.11) La ecuacin (11) permite el clculo de las resistencias de la solucin electroltica bajo la siguiente situacin en el puente Wheatstone: razn de ( y un valor de que corresponde a un paso nulo de corriente a travs del detector. 3. Material y Equipo Soluciones acuosas de NaCl 0.01 N 0.02 N de conductividad especfica conocida (para solucin de NaCl 0.01 N, Ks = 0.00140877 ohm-1 cm-1 a 25C); soluciones acuosas de cido actico 0.1 N 0.05 N para determinar su conductividad equivalente; celda de conductividad con electrodos de platino (Pt), solucin saturada de PtCl3; bao de temperatura constante. Puente Wheatstone de resistencia variable o puente universal de Wayne-Kros; generador de corriente de bajo voltaje de aproximadamente 15 voltios, de CA o CD; Conductmetro InoLab WTW; cables de conexin, soportes, pinzas, etc. 4. Procedimiento Experimental Cualquier forma que sea la celda utilizada, se debe recubrir los electrodos con negro de platino, para eliminar algunos efectos de electrlisis. Se prepara la solucin para platinado, mezclando 3 gr de PtCl3 con 100ml de H2O. Se somete a los electrodos a un recubrimiento homogneo con negro de Pt, sumergindolos en la solucin de Pt y usando CD de bajo voltaje de tal manera que slo se produzca un lento desprendimiento de gases (intercambiando las conexiones de los electrodos, cada
LABORATORIO QUIMICA FISICA II 47
UNIVERSIDAD NACIONAL DE TRUJILLO
minuto o ms, a la fuente de CD). Se lava cuidadosamente la celda y los electrodos con agua de conductividad (agua bidestilada con algunas gotas de K2Cr2O7) si no se dispone de agua de conductividad bidestilada en columna de intercambio inico, hervir agua destilada para eliminar gases de CO2 disueltos y guardarla cuando est caliente en un frasco con tapa. Usar esta agua para preparar las soluciones de NaCl 0.01N y 0.02N, y las soluciones de HAc 0.1N o 0.05N. Enjuagar la celda y electrodos varias veces con pequeas porciones de solucin examen. Llenas la celda con una cantidad adecuada de dicha solucin, introducindola en un bao de temperatura constante y conectndola al puente Wheatstone y dems accesorios segn circuito establecido. Proceder a la medicin de la resistencia de la solucin electroltica usando inicialmente la solucin de NaCl 0.01N ( 0.02N, Ks=0.00276 ohm-1cm-1). Despus de seguir las instrucciones de lavado antedichas, proceder a la medicin de la resistencia de otras soluciones electrolticas (HAc 0.05N, etc.) para determinar la conductividad equivalente . El valor de la conductividad es muy sensible a los cambios de temperatura, por lo que la temperatura del bao debe variar dentro de . Se obtienen resultados precisos cuando se usa una celda con electrodos bastante prximos y un generador de CA, pero esto introduce un nmero de problemas ya que entre otros aspectos es necesario considerar y balancear reactantes en el circuito as como las resistencias. Sin embargo con el puente de Wheatstone y galvanmetro los resultados son satisfactorios con generador de CD. 5. Utilizacin de datos, clculos y resultados Tabular los datos detalladamente. Usando la ecuacin respectiva (6.7), calcular la constante K de la celda a partir de la resistencia medida R y datos de conductividad especfica Ks de la solucin de KCl 0.01 0.02 N. Determinar la conductividad equivalente de la solucin de cido actico 0.05 N, con el valor de la constante de la celda y datos de conductividad especfica de esta solucin aplicando la ecuacin (6.8). Discutir los resultados comparndolos con los valores dados en la bibliografa a las mismas condiciones.
LABORATORIO
QUIMICA FISICA II
48
UNIVERSIDAD NACIONAL DE TRUJILLO
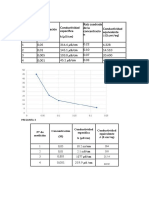
CLCULOS 1. Datos Experimentales Tabla 6.1. Datos experimentales para el Cloruro de Sodio (NaCl) Experimento 1 2 3 4 5 6 Concentracin NaCl (N) 0.05 0.1 0.2 0.4 0.6 1.0 Ks (mS/cm) 0.516 2.130 17.60 37.20 54.10 87.3 T (C) 27.7 27.7 27.6 27.2 27.0 26.7
Tabla 6.2. Datos experimentales para el cido Actico (HAc) Experimento 1 2 3 4 5 6 Concentracin HAc (N) 0.05 0.1 0.2 0.4 0.6 1.0 Ks (S/cm) 354 486 684 951 1127 1434 T (C) 27.2 27.2 27.2 27.2 27.3 27.3
2. Clculo de la conductividad equivalente con la ecuacin (6.8) Conductividad equivalente para NaCl Para 0.05
Para 0.1
Para 0.2
LABORATORIO
QUIMICA FISICA II
49
UNIVERSIDAD NACIONAL DE TRUJILLO
Para 0.4
Para 0.6
Para 1.0
Tabla 6.3. Resultados del clculo de la Conductividad Equivalente del NaCl
Concentracin Ks Experimento Ks (S/cm) NaCl (N) (mS/cm)
Conductividad equivalente ( )
1 0.05 0.516 0.000516 10.320 2 0.1 2.13 0.002130 21.300 3 0.2 17.6 0.017600 88.000 4 0.4 37.2 0.037200 93.000 5 0.6 54.1 0.054100 90.167 6 1 87.3 0.087300 87.300 De datos obtenidos anteriormente se puede observar que la conductividad no disminuye conforme aumenta la concentracin por ello para el ajuste de la recta slo tomaremos los 3 ltimos datos. Tabla 6.4 Datos de la grfica raz cuadrada de la concentracin y la conductividad equivalente Concentracin NaCl Raz cuadrada de la (N) concentracin ( ) 0.4 0.6 1 0.632 0.775 1.000 Conductividad equivalente ( ) 93.000 90.167 87.300
LABORATORIO
QUIMICA FISICA II
50
UNIVERSIDAD NACIONAL DE TRUJILLO
Grfica 6.1 raz cuadrada de la concentracin y la conductividad equivalente
94 Raz cuadrada de la concentracin () 93 92 91 90 89 88 87 86 0.6 0.7 0.8 0.9 1 1.1 Conductividad equivalente ()
y = -15.244x + 102.39 R = 0.9846
Aplicando mtodo de los mnimos cuadrados para el ajuste de la curva x ( ) 0.632 0.775 1.000 2.407 y( ) x2 x*y 58.7760 69.8794 87.3000 215.9554
93.000 0.399424 90.167 0.600625 87.300 1 Sumatorias 270.467 2.000049
Para la ecuacin de la recta:
LABORATORIO
QUIMICA FISICA II
51
UNIVERSIDAD NACIONAL DE TRUJILLO
Por lo tanto tenemos El valor de la conductividad equivalente en disolucin infinita
Conductividad equivalente para HAc Para 0.05
Para 0.1
Para 0.2
Para 0.4
Para 0.6
Para 1.0
Tabla 6.5. Resultados del clculo de la Conductividad Equivalente del HAc
Concentracin Experimento HAc (N) 1 2 3 4 5 6 0.05 0.1 0.2 0.4 0.6 1
Ks (S/cm) 354 486 684 951 1127 1434
Conductividad Ks (S/cm) equivalente ( ) 0.000354 0.000486 0.000684 0.000951 0.001127 0.001434 7.080 4.860 3.420 2.378 1.878 1.434
LABORATORIO
QUIMICA FISICA II
52
UNIVERSIDAD NACIONAL DE TRUJILLO
Tabla 6.6 Datos de la grfica raz cuadrada de la concentracin y la conductividad equivalente del HAc Concentracin HAc (N) 0.05 0.1 0.2 0.4 0.6 1 Raz cuadrada de la concentracin ( ) 0.2236 0.3163 0.4472 0.6325 0.7746 1.0000 Conductividad equivalente ( ) 7.080 4.860 3.420 2.378 1.878 1.434
Grfica6.2 Raz cuadrada de la concentracin y la conductividad equivalente del HAc
8.0
7.0
Conductividad equivalente ()
6.0
5.0
4.0
3.0
2.0
1.0
0.0 0.0 0.2 0.4 0.6 0.8 1.0 1.2 Raz cuadrada de la concentracin ()
LABORATORIO
QUIMICA FISICA II
53
UNIVERSIDAD NACIONAL DE TRUJILLO
Calculando el porcentaje de error Segn la bibliografa la conductividad equivalente en disolucin infinita del NaCl es 126.45 | |
6. Conclusiones Se hallaron las curvas correspondientes para el cido actico y el cloruro de sodio. Por otro lado se pudo hallar el valor de la conductividad equivalente de la solucin de NaCl el cual segn el clculo del porcentaje de error el valor experimental es menor al del valor terico, consideramos que pudo haber sido por el manejo inadecuado de los equipos utilizados.
Debido al manejo inadecuado tanto del equipo como en la preparacin de las soluciones, al medir la conductividad equivalente de las tres primeras muestra (0.05, 0.1 y 0,2N) del NaCl los valores no coincidan con los de las otras tres (0.4, 0.6, 1.0 N) por ello con la finalidad de obtener los resultados esperados se opt trabajar con las 3 ltimas.
LABORATORIO
QUIMICA FISICA II
54
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N 7
NMERO DE TRANSFERENCIA DE UN ION POR EL MTODO DEL LMITE MVIL
1. Objetivo Determinar el Nmero de Transferencia o fraccin de corriente transportada por una especie inica, en base al desplazamiento de la interface entre dos soluciones electrolticas en un ion comn, cuando se pasa corriente elctrica a travs de ellas. Se usan para el estudio las soluciones acuosas de HCl 0,1N (o 0,2N) (conductora) y de CdCl2 (indicadora). 2. Fundamento Terico El mtodo de lmite mvil consiste en mezclar en un tubo capilar graduado dos soluciones electrolticas conteniendo un ion comn que generalmente es el anin. Al pasar corriente elctrica (C.D.) a travs de stas se genera una interface (lmite) mvil, la cual es observable si se adiciona previamente un indicador a la mezcla antedicha; ya que de ser as se establece una diferencia de color entre ambas soluciones separadas por el lmite. Al tubo capilar se le acoplan dos electrodos uno en cada extremo, lo que se conectan a un generador de corriente continua. El paso de la corriente elctrica origina una diferencia de potencial entre ambos electrodos, producindose la migracin de cationes al ctodo y de aniones al nodo.. Designando por AX y BX a los electrolitos de las soluciones conductora e indicadora respectivamente, se puede escribir:
En el lmite los iones positivos de las dos soluciones se mueven en el mismo sentido, y por lo tanto tambin se mueve el lmite. La velocidad del catin de la solucin principal es mayor que la velocidad del catin de la solucin indicadora , y el lmite adquiere la velocidad del catin ms veloz. Si Q es la cantidad de electricidad pasada a travs de las soluciones y V el volumen originado por el desplazamiento del lmite entre 2 posiciones a y b, en el tiempo t el nmero total de equivalentes de iones ser: involucrados en el transporte de electricidad en el volumen V est dado por:
LABORATORIO
QUIMICA FISICA II
55
UNIVERSIDAD NACIONAL DE TRUJILLO
(7.1) Donde es el nmero de transferencia del ion y F la carga de un equivalente. en el volumen V
Por otro lado, el nmero total de equivalentes de iones se expresa en la forma:
(7.2) En la que es la concentracin de iones de solucin. en equivalentes por unidad de volumen
De la combinacin de las ecuaciones (7.1) y (7.2): (7.3) Adems, (7.4)
Donde es la intensidad de la corriente utilizada y el tiempo de suministro de la misma. Relacionando las ecuaciones (7.3) y (7.4) se obtiene: (7.5) La cual se transforma a: (7.6) Si se da en equivalentes de iones de solucin, V en , F en coulombios (F=1 faradio=96490 coulombios), en amperios y t en segundos. La ecuacin (7.6) permite determinar el nmero de transferencia del ion positivo de la solucin principal, midiendo experimentalmente el volumen generado por el desplazamiento del lmite V, la intensidad de corriente , y el tiempo de suministro de corriente t. El producto se determina por integracin grfica.
La experiencia requiere de las siguientes precauciones: 1. La movilidad del ion debe ser mayor que la del ion . 2. La conductancia de la solucin conductora debe ser ligeramente mayor que la conductancia de la solucin indicadora.
LABORATORIO
QUIMICA FISICA II
56
UNIVERSIDAD NACIONAL DE TRUJILLO
3. Se deben evitar altas intensidades de corriente, ya que pueden causar calentamiento, dilatacin y conveccin apreciables del lquido. 4. Mientras el lmite se mueve debe cumplirse:
3. Material y equipo Tubo capilar Graduado de vidrio (0.00513 cm3/divisin) con electrodo de Ag, AgCl (ctodo) preparado previamente y electrodo de Cd (nodo) .Soluciones acuosas de HCl 0.1 o 0.2 N actuando como conductora, y de CdCl2 actuando como indicadora (preparada simultneamente al transcurso del experimento); solucin saturada de KCl e indicador, generador de corriente continua (40 voltios).Cables de conexin y equipo de sujecin como soportes, pinzas, etc. 4. Procedimiento Experimental Se prepara previamente el electrodo de Ag, AgCl, por electrolisis, introduciendo dos electrodos de Ag completamente limpios y conectados a un generador de CC. de bajo voltaje, dentro de una solucin saturada de KCl o solucin de HCl. La electrolisis se efecta hasta que el nodo adquiera una coloracin violeta, siendo ste el electrodo clorurado. Se lava el tubo capilar graduado con solucin de HCl 0,1N conteniendo algunas gotas de violeta de metilo, con el equipo de sujecin adecuado se le fija una posicin vertical, en el extremo inferior del tubo se le inserta el nodo de Cd, y se le llena despus con una cantidad adecuada de HCl 0,1N en el extremo superior se le acopla el ctodo de Ag-AgCl. Ambos electrodos se conectan a los polos respectivos de la fuente CC, de acuerdo a un circuito establecido con el equipo complementario (miliamperio, restato, etc.) de tal manera que la intensidad de la corriente aplicada a la mezcla de las soluciones electrolticas sea menor que 4mA. Al paso de la corriente, se disolver el nodo por migracin de cationes al ctodo y de aniones al nodo, y la superficie lmite entre las soluciones de HCl y de CdCl2 (este ltimo formado por el paso de la corriente) ascender a lo largo del tubo, hacindose perceptible por la diferencia de color de la soluciones. Se procede despus al control de la intensidad de corriente y volumen originado por el desplazamiento del lmite cada minuto; controlando tambin la temperatura y presin ambientes, antes y despus del experimento. Mientras dure el experimento aumentar la resistencia del electrolito. Si se trata de mantener constante la intensidad de corriente, se debe aumentar continuamente el voltaje.
LABORATORIO
QUIMICA FISICA II
57
UNIVERSIDAD NACIONAL DE TRUJILLO
5. Utilizacin de Datos, Clculos y Resultados Tabular los datos de todas las variables medidas .Determinar el producto I*t =Q por integracin grfica. Con los valores de Q y V determinados, calcular el nmero de transferencia del ion H+ aplicando la ecuacin (7.6) hacer una discusin de este resultado comparndola con el valor obtenido de alguna fuente bibliogrfica a la misma temperatura. CLCULOS 1. Datos considerados en la prctica.
Tabla 7.1. Datos considerados para la solucin principal e indicadora. Solucin acuosa PRINCIPAL INDICADORA HCl CdCl2 0.1 0.115452 cm3 Volumen originado por el desplazamiento de lmite
2. Reporte de datos de las mediciones de tiempo e intensidad. Para intervalo de tiempo de 10 minutos seleccionamos por reportar las mejores mediciones de tiempo versus intensidad las que se muestran a continuacin. Tabla 7.2. Datos experimentales de la intensidad y tiempo. Experimento 1 2 3 4 5 6 7 8 9 10 11 Tiempo (minutos) 0 1 2 3 4 5 6 7 8 9 10 Intensidad (mA) 2.50 2.45 2.40 2.35 2.30 2.25 2.20 2.15 2.10 2.05 2.00
LABORATORIO
QUIMICA FISICA II
58
UNIVERSIDAD NACIONAL DE TRUJILLO
3. Determinando por integracin grfica el producto It=Q
Grfica 7.1 Intensidad Vs Tiempo
2.6 2.5 2.4 2.3 2.2 2.1 2 1.9 1.8 0 2 4 6 8 Tiempo (minutos) 10 12 14 16
Intensidad (mA)
Para determinar por integracin grfica la cantidad de electricidad total (Q), consideramos los siguientes clculos.
Hallamos la intensidad de corriente (I), reemplazando datos de la grfica en la siguiente frmula:
LABORATORIO
QUIMICA FISICA II
59
UNIVERSIDAD NACIONAL DE TRUJILLO Tiempo (segundos) 0 60 120 180 240 300 360 420 480 540 600
Intensidad (mA) 0.00250 0.00245 0.00240 0.00235 0.00230 0.00225 0.00220 0.00215 0.00210 0.00205 0.0020
0.002475 0.002425 0.002375 0.002325 0.002275 0.002225 0.002175 0.002125 0.002075 0.002025
60 60 60 60 60 60 60 60 60 60
0.1485 0.1455 0.1425 0.1395 0.1365 0.1335 0.1305 0.1275 0.1245 0.1215 1.35
De los clculos obtenidos anteriormente tenemos Teniendo en cuenta que volumen generado por el desplazamiento del lmite fue 0.115452 cm3 y 1F = 96490C. Calculamos el nmero de transferencias usando la frmula (7.6):
Segn la Tabla 11-2. Nmero de transferencia terico del libro de Maron y Prutton para el HCl (solucin principal).
De la tabla observamos que a 25C la concentracin del HCl es 0.831 Calculamos el porcentaje de error | |
LABORATORIO
QUIMICA FISICA II
60
UNIVERSIDAD NACIONAL DE TRUJILLO
PRCTICA N 8
CNETICA DE REACCIN DE DESCOMPOSICIN DEL PERXIDO DE HIDRGENO
1. Objetivo Determinar los parmetros: orden de la reaccin, las constantes de velocidad de reaccin y por ltimo la energa de activacin en la descomposicin del perxido de hidrgeno (H2O2). 2. Fundamento Terico De acuerdo a nuestros conocimientos de cintica llevada en los cursos de qumica general, sabemos que: La cintica de una descomposicin se rige por medio de una ecuacin, donde en dicha ecuacin intervienen conceptos de velocidad, concentracin, tiempo, etc. ( Donde:
( ) A
(8.1)
Grfica 8.1. Concentracin del H2O2 (mol.L-1) versus tiempo (min)
LABORATORIO
QUIMICA FISICA II
61
UNIVERSIDAD NACIONAL DE TRUJILLO
Cada punto en la grfica representa: ( )
Si la ecuacin (8.1) le aplicamos logaritmo natural a cada extremo, nos queda: ( ) (8.2)
La ecuacin (2) representa una recta Donde: Su pendiente ser igual a n y a una temperatura especfica donde para dicha temperatura hallaremos una constante . Aqu tambin abarca trminos de energa, que en ste caso ser: energa de activacin.
LABORATORIO
QUIMICA FISICA II
62
UNIVERSIDAD NACIONAL DE TRUJILLO
Sabemos que energa de activacin es la energa que necesitan los reactivos para convertirse en productos. Y se mide desde el punto de inflexin del complejo activado hasta el nivel grfico de los reactivos.
La energa de activacin se determina por la siguiente ecuacin:
( )
(8.3)
Donde, (8.3) es la ecuacin de Arrhenius, que usaremos para encontrar la energa de activacin ( ). De la reaccin del obtenemos la siguiente ecuacin qumica: En esta reaccin vemos como 1 mol de es igual a medio mol de , entonces multiplicamos por dos los moles encontrados de para hallar los moles de . Los moles de oxigeno lo hallaremos en el experimento y usaremos la ecuacin de presin parcial: (8.4) Despejando la ecuacin (8.4) para hallar : (8.5) Luego, (8.6)
LABORATORIO
QUIMICA FISICA II
63
UNIVERSIDAD NACIONAL DE TRUJILLO
3. Material y equipo Perxido de hidrogeno, agua, termostato, recipiente de vidrio, pinzas, soporte, termmetro, etc.
Fig.8.1 Esquema del equipo a utilizar en el experimento
4. Clculos y Resultados 1. Datos considerados en la prctica.
Tabla 8.1. Datos iniciales para el perxido de hidrgeno y el cido clorhdrico. Solucin H2O2 HCl (catalizador) Mezcla Volumen considerado (mL) 45 15 60 Normalidad (N) 2.4 Nmero de moles iniciales 0.03969 0.036 -
Este experimento lo dividimos en dos partes: PRIMERA PARTE Se realiz a T = 27C
LABORATORIO
QUIMICA FISICA II
64
UNIVERSIDAD NACIONAL DE TRUJILLO
Tabla 8.2. Datos experimentales para la primera parte del experimento
N Tiempo (s) Volumen en la bureta de gases (mL) T bureta de gases (C) T tubo de reaccin (C) T PROMEDIO (C) T PROMEDIO (K)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39
LABORATORIO
0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 630 660 690 720 750 780 810 840 870 900 930 960 990 1020 1050 1080 1110 1140
17 17.2 17.8 18.6 20.2 21.4 22.8 23.6 25.2 26 28 29 30 31.8 33.8 35.2 36.8 37.4 39.6 41 42.2 43.4 44.4 46 47.4 48.8 50.2 51.2 52.6 55.2 55.8 57.2 58.4 59 60 60.8 61.6 61.8 62
28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.8 28.8 28.8 28.9 28.9 28.9 28.9 28.9
27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27 27
27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.5 27.75 27.75 27.75 27.75 27.75 27.75 27.75 27.75 27.75 27.9 27.9 27.9 27.95 27.95 27.95 27.95 27.95
300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.5 300.75 300.75 300.75 300.75 300.75 300.75 300.75 300.75 300.75 300.9 300.9 300.9 300.95 300.95 300.95 300.95 300.95
QUIMICA FISICA II 65
UNIVERSIDAD NACIONAL DE TRUJILLO
2. Hallando el nmero de moles para O2 y H2O2 con las ecuaciones (8.5) y (8.6) Para aplicar la ecuacin (8.5) se requiere de la presin de vapor de agua a diferentes temperaturas
Para la presin de vapor de agua a 27.5 C, interpolamos
Sabemos que
Si
Determinamos
reemplazando datos en la ecuacin (8.5) ; en el
Consideramos R=62320 mmHg.mL/atm.L y el volumen la diferencia entre tiempo que corresponde. Cuando t = 30 s
Luego, Aplicamos los mismos clculos para los dems datos y obtenemos la siguiente tabla
66
LABORATORIO
QUIMICA FISICA II
UNIVERSIDAD NACIONAL DE TRUJILLO Volumen en la bureta de gases (mL)
Tiempo (s)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39
0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 630 660 690 720 750 780 810 840 870 900 930 960 990 1020 1050 1080 1110 1140
17 17.2 17.8 18.6 20.2 21.4 22.8 23.6 25.2 26 28 29 30 31.8 33.8 35.2 36.8 37.4 39.6 41 42.2 43.4 44.4 46 47.4 48.8 50.2 51.2 52.6 55.2 55.8 57.2 58.4 59 60 60.8 61.6 61.8 62
0 0.20 0.60 0.80 1.60 1.20 1.40 0.80 1.60 0.80 2.00 1.00 1.00 1.80 2.00 1.40 1.60 0.60 2.20 1.40 1.20 1.20 1.00 1.60 1.40 1.40 1.40 1.00 1.40 2.60 0.60 1.40 1.20 0.60 1.00 0.80 0.80 0.20 0.20
0 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.678 731.254 731.254 731.254 731.254 731.254 731.254 731.254 731.254 731.254 731.012 731.012 731.012 730.932 730.932 730.932 730.932 730.932
0.03969 7.8141E-06 2.3442E-05 3.1256E-05 6.2513E-05 4.6885E-05 5.4699E-05 3.1256E-05 6.2513E-05 3.1256E-05 7.8141E-05 3.9070E-05 3.9070E-05 7.0327E-05 7.8141E-05 5.4699E-05 6.2513E-05 2.3442E-05 8.5955E-05 5.4699E-05 4.6885E-05 4.6885E-05 3.9015E-05 6.2424E-05 5.4621E-05 5.4621E-05 5.4621E-05 3.9015E-05 5.4621E-05 1.0144E-04 2.3409E-05 5.4576E-05 4.6780E-05 2.3390E-05 3.8972E-05 3.1178E-05 3.1178E-05 7.7944E-06 7.7944E-06
0.03969 0.039674 0.039627 0.039565 0.039440 0.039346 0.039237 0.039174 0.039049 0.038987 0.038830 0.038752 0.038674 0.038534 0.038377 0.038268 0.038143 0.038096 0.037924 0.037815 0.037721 0.037627 0.037549 0.037424 0.037315 0.037206 0.037096 0.037018 0.036909 0.036706 0.036660 0.036550 0.036457 0.036410 0.036332 0.036270 0.036207 0.036192 0.036176
LABORATORIO
QUIMICA FISICA II
67
UNIVERSIDAD NACIONAL DE TRUJILLO
De la tabla anterior tomamos algunos datos para Graficar CA versus t y hallamos las derivadas en cada punto ( )
Tabla 8.3. Datos para la grfica concentracin A y tiempo t N 1 2 3 4 5 6 7 8 9 10 11 Ver Grfica 8.1. Tiempo Tiempo (s) (min) 0 0.0 30 0.5 60 1.0 90 1.5 120 2.0 150 2.5 180 3.0 210 3.5 240 4.0 270 4.5 300 5.0 CA
Tabla 8.4. Resultado de las derivadas en cada punto N 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Tiempo (s) 0 30 60 90 120 150 180 210 240 270 300 330 360 390 CA 0.6201 0.6183 0.6170 0.6152 0.6118 0.6110 0.6092 0.6076 0.6068 0.6055 0.6045 0.6035 0.6032 0.6029 log CA -0.2075 -0.2088 -0.2097 -0.2110 -0.2134 -0.2140 -0.2152 -0.2164 -0.2170 -0.2179 -0.2186 -0.2193 -0.2195 -0.2198 ( ) Log( )
Con las derivadas y su logaritmo, realizamos la grfica donde hallaremos la constante de velocidad de reaccin.
LABORATORIO
QUIMICA FISICA II
68
UNIVERSIDAD NACIONAL DE TRUJILLO
SEGUNDA PARTE Se realiz a T = 35C Tabla 8.5. Datos experimentales para la segunda parte del experimento.
N Tiempo (s) Volumen en la bureta de gases (mL)
T bureta de gases (C) T tubo de reaccin (C) T PROMEDIO (C)
T PROMEDIO (K)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 630 660 690
14.4 14.6 18.1 22.4 24.6 27.8 32 35.8 40 43.6 48.4 55 57.2 59 63.8 70 72.4 76.2 77.6 81.2 83.2 85.4 87 87
29 29 29 29 28.8 28.8 28.8 28.7 28.7 28.7 28.7 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5 28.5
35.8 35.8 35.5 35.5 35.2 35.2 35.2 35.1 35.1 35.1 35.1 35.1 35.1 35 35 35 35 35 34.9 34.9 34.9 34.9 34.9 34.9
32.4 32.4 32.25 32.25 32 32 32 31.9 31.9 31.9 31.9 31.8 31.8 31.75 31.75 31.75 31.75 31.75 31.7 31.7 31.7 31.7 31.7 31.7
305.4 305.4 305.25 305.25 305 305 305 304.9 304.9 304.9 304.9 304.8 304.8 304.75 304.75 304.75 304.75 304.75 304.7 304.7 304.7 304.7 304.7 304.7
LABORATORIO
QUIMICA FISICA II
69
UNIVERSIDAD NACIONAL DE TRUJILLO
Aplicamos los mismos clculos que para la parte 1 y obtenemos la siguiente tabla
N Tiempo (s) Volumen en la bureta de gases (mL)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 630 660 690
14.4 14.6 18.1 22.4 24.6 27.8 32 35.8 40 43.6 48.4 55 57.2 59 63.8 70 72.4 76.2 77.6 81.2 83.2 85.4 87 87
0 0.20 3.50 4.30 2.20 3.20 4.20 3.80 4.20 3.60 4.80 6.60 2.20 1.80 4.80 6.20 2.40 3.80 1.40 3.60 2.00 2.20 1.60 0.00
722.71 722.71 723.26 723.26 723.54 723.54 723.54 723.73 723.73 723.73 723.73 723.93 723.93 724.03 724.03 724.03 724.03 724.03 724.13 724.13 724.13 724.13 724.13 724.13
0.03969 7.5945E-06 1.3307E-04 1.6349E-04 8.3745E-05 1.2181E-04 1.5988E-04 1.4474E-04 1.5997E-04 1.3712E-04 1.8282E-04 2.5153E-04 8.3845E-05 6.8621E-05 1.8299E-04 2.3636E-04 9.1495E-05 1.4487E-04 5.3388E-05 1.3728E-04 7.6269E-05 8.3896E-05 6.1015E-05 0.0000E+00
0.03969 3.9675E-02 3.9409E-02 3.9082E-02 3.8914E-02 3.8671E-02 3.8351E-02 3.8061E-02 3.7741E-02 3.7467E-02 3.7102E-02 3.6598E-02 3.6431E-02 3.6294E-02 3.5928E-02 3.5455E-02 3.5272E-02 3.4982E-02 3.4875E-02 3.4601E-02 3.4448E-02 3.4280E-02 3.4158E-02 3.4158E-02
De la tabla anterior tomamos algunos datos para Graficar CA versus t y hallamos las derivadas en cada punto ( )
LABORATORIO
QUIMICA FISICA II
70
UNIVERSIDAD NACIONAL DE TRUJILLO
Tabla 8.6. Datos para la grfica concentracin A y tiempo t N 1 2 3 4 5 6 7 8 9 10 11 Ver Grfica 8.3. Tiempo Tiempo (s) (min) 0 0.0 30 0.5 60 1.0 90 1.5 120 2.0 150 2.5 180 3.0 210 3.5 240 4.0 270 4.5 300 5.0 CA
Tabla 8.7. Resultado de las derivadas en cada punto N 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Tiempo (s) 0 30 60 90 120 150 180 210 240 270 300 330 360 390 CA 0.6201 0.6183 0.6170 0.6152 0.6118 0.6110 0.6092 0.6076 0.6068 0.6055 0.6045 0.6035 0.6032 0.6029 log CA -0.2075 -0.2088 -0.2097 -0.2110 -0.2134 -0.2140 -0.2152 -0.2164 -0.2170 -0.2179 -0.2186 -0.2193 -0.2195 -0.2198 ( ) Log( )
Con las derivadas y su logaritmo, realizamos la grfica donde hallaremos la constante de velocidad de reaccin. Ver Grfica 8.4.
LABORATORIO
QUIMICA FISICA II
71
UNIVERSIDAD NACIONAL DE TRUJILLO
La grfica da una ecuacin de una lnea recta:
De la ecuacin de equivalencia, tenemos: ( Igualando hallamos )
LABORATORIO
QUIMICA FISICA II
72
Das könnte Ihnen auch gefallen
- Ingeniería química. Soluciones a los problemas del tomo IVon EverandIngeniería química. Soluciones a los problemas del tomo INoch keine Bewertungen
- Informe 3 Volumenes ParcialesDokument16 SeitenInforme 3 Volumenes ParcialesLuis Antony Lorenzo GonzalesNoch keine Bewertungen
- Problemas resueltos de Hidráulica de CanalesVon EverandProblemas resueltos de Hidráulica de CanalesBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Volumen Parcial MolarDokument10 SeitenVolumen Parcial Molarsimon j ochoa aNoch keine Bewertungen
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSVon EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Estudio del flujo de líquidos a través de un orificioDokument16 SeitenEstudio del flujo de líquidos a través de un orificioManuela MendozaNoch keine Bewertungen
- Guías de laboratorio de resistencia de materialesVon EverandGuías de laboratorio de resistencia de materialesNoch keine Bewertungen
- Reporte Practica 2 Destilacion DiferencialDokument12 SeitenReporte Practica 2 Destilacion DiferencialLuis Daniel Gil Pacheco100% (1)
- Volumen Molar Parcial2Dokument17 SeitenVolumen Molar Parcial2Centro Estudiantes Química UChileNoch keine Bewertungen
- Flujo de fluidos e intercambio de calorVon EverandFlujo de fluidos e intercambio de calorBewertung: 1 von 5 Sternen1/5 (1)
- LOP-002 Refraccion en Liquidos - Virtual PDFDokument5 SeitenLOP-002 Refraccion en Liquidos - Virtual PDFLUIS FERNANDO TAPARA QUISPENoch keine Bewertungen
- Reporte N°10Dokument9 SeitenReporte N°10PIERO MATIAS HERRERA SUAREZNoch keine Bewertungen
- Indice de RefraccionDokument15 SeitenIndice de RefraccionSusana Zárate RuizNoch keine Bewertungen
- 3° Determinacion de Volumen Molar Parcial WuuuDokument21 Seiten3° Determinacion de Volumen Molar Parcial WuuuraulNoch keine Bewertungen
- Volúmenes molares parciales soluciones electrolitosDokument7 SeitenVolúmenes molares parciales soluciones electrolitosAlberto RamírezNoch keine Bewertungen
- Viscosidad de LiquidosDokument13 SeitenViscosidad de LiquidosJofreddy A. AngelesNoch keine Bewertungen
- Informe Fisico Quimica II - Volumenes Molares ParcialesDokument14 SeitenInforme Fisico Quimica II - Volumenes Molares ParcialesDaniel Villavicencio RamosNoch keine Bewertungen
- Interpolación y aproximación de funciones químicasDokument3 SeitenInterpolación y aproximación de funciones químicasMateo HerreñoNoch keine Bewertungen
- Análisis granulométrico por hidrometría de una arenaDokument12 SeitenAnálisis granulométrico por hidrometría de una arenaAndres MariñoNoch keine Bewertungen
- Viscosidad de líquidos: efecto de la concentración y temperaturaDokument13 SeitenViscosidad de líquidos: efecto de la concentración y temperaturaJofreddy A. AngelesNoch keine Bewertungen
- Informe Equilibrio Etanol-AguaDokument18 SeitenInforme Equilibrio Etanol-AguaFrank Cesar Delgado MontalvoNoch keine Bewertungen
- Trabajo IrrigaciobesDokument15 SeitenTrabajo IrrigaciobesarnaldocubaNoch keine Bewertungen
- Practica 7 Componente Practico FisicaDokument15 SeitenPractica 7 Componente Practico FisicanataNoch keine Bewertungen
- Informe #6 Práctica #7 Mecánica de Suelos 1 ING-481-02 Pedro José Pagán Paulino 17-2181.Dokument14 SeitenInforme #6 Práctica #7 Mecánica de Suelos 1 ING-481-02 Pedro José Pagán Paulino 17-2181.Miguel AlmonteNoch keine Bewertungen
- Propiedades parciales molares agua-etanolDokument11 SeitenPropiedades parciales molares agua-etanoldiego muñoz arellanoNoch keine Bewertungen
- Informe de FisicoquimicaDokument13 SeitenInforme de FisicoquimicaSergio QuentaNoch keine Bewertungen
- Medidas experimentales de física mecánicaDokument13 SeitenMedidas experimentales de física mecánicaValeria CasanovaNoch keine Bewertungen
- Fuerza presión placa sumergidaDokument6 SeitenFuerza presión placa sumergidajeanNoch keine Bewertungen
- Diagrama de Fases-Sistema BinarioDokument11 SeitenDiagrama de Fases-Sistema Binariopmori92Noch keine Bewertungen
- Practica 1 Fisica 2Dokument6 SeitenPractica 1 Fisica 2manuelhernandez7710Noch keine Bewertungen
- Cuestionario Quimica Practica 4Dokument4 SeitenCuestionario Quimica Practica 4lauraNoch keine Bewertungen
- LOP-002 Refraccion en Liquidos - VirtualDokument8 SeitenLOP-002 Refraccion en Liquidos - VirtualSilence EngelNoch keine Bewertungen
- Informe Lab Hidrometria (Barrios, Muñoz y Sanchez)Dokument11 SeitenInforme Lab Hidrometria (Barrios, Muñoz y Sanchez)juana sanchezNoch keine Bewertungen
- Tabulación de Datos y ResultadosDokument6 SeitenTabulación de Datos y ResultadosAnthony VillalobosNoch keine Bewertungen
- OFIVCIALDokument21 SeitenOFIVCIALMichael WilsonNoch keine Bewertungen
- Transferencia de Masa y Cinética CombinadaDokument9 SeitenTransferencia de Masa y Cinética Combinadaestefa0116Noch keine Bewertungen
- Informe Entalpía de Mezclas de Fluidos BinariosDokument7 SeitenInforme Entalpía de Mezclas de Fluidos BinariosDalíAsesoríasNoch keine Bewertungen
- REFRACTOMETRIADokument25 SeitenREFRACTOMETRIABellos Isla del SolNoch keine Bewertungen
- Informe Practica de Laboratorio 7 Y 8 DEL 7 de ABRIL 2018Dokument28 SeitenInforme Practica de Laboratorio 7 Y 8 DEL 7 de ABRIL 2018orlando rodriguez castroNoch keine Bewertungen
- Informe Final. Practica No 1 Analisis de NucleosDokument22 SeitenInforme Final. Practica No 1 Analisis de NucleosLorena SalcedoNoch keine Bewertungen
- Taller Diseño IIcorte 3Dokument14 SeitenTaller Diseño IIcorte 3Andrés Pernett GomezNoch keine Bewertungen
- Determinación densidad cuerpos método ArquímedesDokument10 SeitenDeterminación densidad cuerpos método ArquímedesMerinoAlvanNoch keine Bewertungen
- Practica 2Dokument11 SeitenPractica 2diego muñoz arellanoNoch keine Bewertungen
- MA207 L6 B404 G2 HenostorzaDokument9 SeitenMA207 L6 B404 G2 HenostorzaVicuchin A MilNoch keine Bewertungen
- Lab Analisis Grafico y T. Error1Dokument11 SeitenLab Analisis Grafico y T. Error1gabrielugo lugoNoch keine Bewertungen
- Difusión MolecularDokument11 SeitenDifusión MolecularTania HoneyNoch keine Bewertungen
- Anova InformeDokument6 SeitenAnova Informejhon rosales astoNoch keine Bewertungen
- P8LQ14 Hernandez Hernandez Deissy JovitaDokument10 SeitenP8LQ14 Hernandez Hernandez Deissy JovitaDey HzNoch keine Bewertungen
- Practica de FiltracionDokument8 SeitenPractica de FiltracionYrvin Narro LucanoNoch keine Bewertungen
- Guia #6 Informe Construccion de Una Curva de Calibracion de DensidadesDokument9 SeitenGuia #6 Informe Construccion de Una Curva de Calibracion de DensidadesLina CristianoNoch keine Bewertungen
- ING QUÍMICA UNI NAL PERÚ VOLÚMENES PARCIALESDokument12 SeitenING QUÍMICA UNI NAL PERÚ VOLÚMENES PARCIALESJhony Guiller Mamani MachacaNoch keine Bewertungen
- Informe de DifusiónDokument33 SeitenInforme de DifusiónBilly Joe Bolivar YactayoNoch keine Bewertungen
- Informe Filtro PrensaDokument5 SeitenInforme Filtro PrensaMiguel Peña OsorioNoch keine Bewertungen
- Lab Quiimica Fisica IIDokument73 SeitenLab Quiimica Fisica IIGustavo Paredes Lavado100% (1)
- Amonolisis de Succinato ParraDokument8 SeitenAmonolisis de Succinato ParraErika TurnerNoch keine Bewertungen
- Volumen Molar ParcialDokument9 SeitenVolumen Molar ParcialVanessa CastroNoch keine Bewertungen
- Laboratorio de Aforador de CaudalesDokument10 SeitenLaboratorio de Aforador de Caudalesalfmike DumarNoch keine Bewertungen
- Informe 1Dokument9 SeitenInforme 1DORIS HELENA GUTIÉRREZ LONDOÑONoch keine Bewertungen
- Determinaciones refractométricas en alimentosDokument5 SeitenDeterminaciones refractométricas en alimentosIsaac MonroyNoch keine Bewertungen
- Programa GMM 2022Dokument20 SeitenPrograma GMM 2022Manuela MendozaNoch keine Bewertungen
- Lima - Perú, Setiembre 2018Dokument28 SeitenLima - Perú, Setiembre 2018Manuela MendozaNoch keine Bewertungen
- La Reactividad Materia PrimaDokument1 SeiteLa Reactividad Materia PrimaManuela MendozaNoch keine Bewertungen
- Preparación LechadaDokument1 SeitePreparación LechadaManuela MendozaNoch keine Bewertungen
- CatálogoDokument14 SeitenCatálogoManuela MendozaNoch keine Bewertungen
- Diseño Mascarilla de CobreDokument5 SeitenDiseño Mascarilla de CobreManuela MendozaNoch keine Bewertungen
- Procedimiento para La Conexión Del Tanque Criogenico Al IcpDokument2 SeitenProcedimiento para La Conexión Del Tanque Criogenico Al IcpManuela MendozaNoch keine Bewertungen
- BFFC 36 Af 1Dokument1 SeiteBFFC 36 Af 1Manuela MendozaNoch keine Bewertungen
- 7 Libros para Tu Fortaleza MentalDokument9 Seiten7 Libros para Tu Fortaleza MentalManuela MendozaNoch keine Bewertungen
- La Reactividad Materia PrimaDokument1 SeiteLa Reactividad Materia PrimaManuela MendozaNoch keine Bewertungen
- Cal Procesos MinerosDokument1 SeiteCal Procesos MinerosManuela MendozaNoch keine Bewertungen
- Cal CaracterísticasDokument1 SeiteCal CaracterísticasManuela MendozaNoch keine Bewertungen
- CaratulaDokument8 SeitenCaratulaManuela MendozaNoch keine Bewertungen
- Cal viva: reactividad y usosDokument3 SeitenCal viva: reactividad y usosManuela MendozaNoch keine Bewertungen
- Memoria 2016 PDFDokument47 SeitenMemoria 2016 PDFEfrain Alave ChoqueNoch keine Bewertungen
- Red de JóvenesDokument3 SeitenRed de JóvenesManuela MendozaNoch keine Bewertungen
- Memoria 2016 PDFDokument47 SeitenMemoria 2016 PDFEfrain Alave ChoqueNoch keine Bewertungen
- INTRODUCCIÓNDokument16 SeitenINTRODUCCIÓNManuela MendozaNoch keine Bewertungen
- Normas Basicas de Un EnsayoDokument4 SeitenNormas Basicas de Un EnsayoRoberto RodriguezNoch keine Bewertungen
- Mineria ODSDokument48 SeitenMineria ODSManuela MendozaNoch keine Bewertungen
- Tintes prehispánicos de AméricaDokument0 SeitenTintes prehispánicos de AméricaDaniel VargasNoch keine Bewertungen
- Peru 2030 La Visión Del Perú Que Queremos y Los 17 ODSDokument93 SeitenPeru 2030 La Visión Del Perú Que Queremos y Los 17 ODSneyser alayoNoch keine Bewertungen
- Normas Basicas de Un EnsayoDokument4 SeitenNormas Basicas de Un EnsayoRoberto RodriguezNoch keine Bewertungen
- Ebook Universia MXDokument31 SeitenEbook Universia MXBroncoNoch keine Bewertungen
- PDFDokument43 SeitenPDFCarlos Trejo GuerraNoch keine Bewertungen
- Ing - Quimica Manuela MendozaDokument1 SeiteIng - Quimica Manuela MendozaManuela MendozaNoch keine Bewertungen
- Aportaciones AlqimistasDokument8 SeitenAportaciones Alqimistas5614784Noch keine Bewertungen
- ConvocatoriaDokument12 SeitenConvocatoriaManuela MendozaNoch keine Bewertungen
- OdsDokument40 SeitenOdsAlejandra SnchezNoch keine Bewertungen
- Aplik Vol 3Dokument31 SeitenAplik Vol 3Manuela MendozaNoch keine Bewertungen
- Estructura Avance COMPLETO de Informe de Monitoreo de Calidad Del AguaDokument67 SeitenEstructura Avance COMPLETO de Informe de Monitoreo de Calidad Del AguaMiluska CaceresNoch keine Bewertungen
- Unidad 9 PetrofDokument26 SeitenUnidad 9 Petrofjuan gonzalesNoch keine Bewertungen
- Medida de la conductividad eléctrica de disolucionesDokument8 SeitenMedida de la conductividad eléctrica de disoluciones雪花Noch keine Bewertungen
- Notas Del Curso y Series de Problemas 16887Dokument76 SeitenNotas Del Curso y Series de Problemas 16887adnil1402Noch keine Bewertungen
- Esquema de Un Trabajo de InvestigaciónDokument20 SeitenEsquema de Un Trabajo de Investigaciónjose homero carranza bustamanteNoch keine Bewertungen
- Ley de KohlrauschDokument13 SeitenLey de KohlrauschJorge Luna100% (1)
- Catalog 2Dokument23 SeitenCatalog 2Diego FrancoNoch keine Bewertungen
- Hi 9811-51Dokument5 SeitenHi 9811-51MarcelaNoch keine Bewertungen
- Determinación de conductividades molaresDokument11 SeitenDeterminación de conductividades molarescristian espinozaNoch keine Bewertungen
- CONDUCTIMETRIADokument10 SeitenCONDUCTIMETRIAAnita PaulaNoch keine Bewertungen
- Informe Modelo Conceptual Del Sistema Acuifero ChilcaDokument28 SeitenInforme Modelo Conceptual Del Sistema Acuifero ChilcaJuan VilaNoch keine Bewertungen
- Fundamentos ElectroanaliticaDokument81 SeitenFundamentos ElectroanaliticaHéctor LópezNoch keine Bewertungen
- Conductimetría: valoración de una mezcla de ácido fuerte y débilDokument30 SeitenConductimetría: valoración de una mezcla de ácido fuerte y débilKariEspinozaNoch keine Bewertungen
- Estados de oxidación, reacciones REDOX y electroquímicaDokument3 SeitenEstados de oxidación, reacciones REDOX y electroquímicaCarmen HernandezNoch keine Bewertungen
- Wasserlab MicromaticDokument31 SeitenWasserlab MicromaticFelix AsimeNoch keine Bewertungen
- Parte 13 Conductividad de Electrolitos PDFDokument26 SeitenParte 13 Conductividad de Electrolitos PDFErik Ariel LauraNoch keine Bewertungen
- 02 LABORATORIO N°2 - Conductividad Soluciones IónicasDokument2 Seiten02 LABORATORIO N°2 - Conductividad Soluciones IónicasKariEspinozaNoch keine Bewertungen
- Examen Parcial 1, 20-2. Conduct., Coulomb. y Voltamperometría.Dokument9 SeitenExamen Parcial 1, 20-2. Conduct., Coulomb. y Voltamperometría.Marisol CGNoch keine Bewertungen
- CONDUCTIVIDADDokument4 SeitenCONDUCTIVIDADPegyNoch keine Bewertungen
- Titulación ConductimétricaDokument14 SeitenTitulación ConductimétricachinozkarNoch keine Bewertungen
- Electroquímica IndustrialDokument149 SeitenElectroquímica Industrialjean pierreNoch keine Bewertungen
- Control de Calidad Del Agua Grado de ReactivoDokument5 SeitenControl de Calidad Del Agua Grado de ReactivoLuis Angel Dominguez MartinezNoch keine Bewertungen
- 30248010B V06.16 SevenCompact Brochure Es LRDokument20 Seiten30248010B V06.16 SevenCompact Brochure Es LRJaderNoch keine Bewertungen
- Osmosis InversaDokument23 SeitenOsmosis InversaVeronica Tatiana GutierrezNoch keine Bewertungen
- Ets de Fisicoquímica FarmacéuticaDokument3 SeitenEts de Fisicoquímica FarmacéuticaÁngel LeonNoch keine Bewertungen
- (ACV-S06) Laboratorio #3 Simulador Conductividad de Soluciones IónicasDokument5 Seiten(ACV-S06) Laboratorio #3 Simulador Conductividad de Soluciones Iónicasjesus carhuachinNoch keine Bewertungen
- Marco Teorico Lab 7Dokument2 SeitenMarco Teorico Lab 7teresaNoch keine Bewertungen
- Conductv UnmsmDokument24 SeitenConductv UnmsmBrenda wen :PNoch keine Bewertungen
- Parámetros de calidad del aguaDokument20 SeitenParámetros de calidad del aguaSaryth Darianna Cardenas FNoch keine Bewertungen
- La Química en La Imprenta Tinta y Papel PDFDokument24 SeitenLa Química en La Imprenta Tinta y Papel PDFaldanramos100% (1)