Beruflich Dokumente
Kultur Dokumente
Transporte y almacenamiento de oxígeno por hierro en proteínas
Hochgeladen von
Tania Flores McCartneyOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Transporte y almacenamiento de oxígeno por hierro en proteínas
Hochgeladen von
Tania Flores McCartneyCopyright:
Verfügbare Formate
El hierro como transporte y almacenamiento de oxgeno Abstrac Introduccin El hierro es el elemento nmero 26 de la tabla peridica y tiene una configuracin
electrnica [Ar]3d64s2. Sus estados de oxidacin ms importantes son +II y +III. El hierro tiene varias funciones biolgicas tales como procesos de transferencia electrnica, activacin de oxgeno y nitrgeno, transporte y almacenamiento de oxgeno; debido a que este metal tiene una afinidad para los tomos electronegativos como el oxgeno, nitrgeno y sulfuro, estos tomos se encuentran en los centros de unin del hierro en las macromolculas. Puede considerarse que el hierro en el organismo se encuentra formando parte de 2 compartimientos: uno funcional, formado por los numerosos compuestos, entre los que se incluyen la hemoglobina, la mioglobina, la transferrina y las enzimas que requieren hierro como cofactor o como grupo prosttico, ya sea en forma inica o como grupo hemo, y el compartimiento de depsito, constituido por la ferritina y la hemosiderina, que constituyen las reservas corporales de este metal. En el cuerpo humano es el metal de transicin ms abundante (de 4.2 a 6.1 g) y existe con dos estados de oxidacin: ferroso (Fe2+) y frrico (Fe3+). Las principales protenas en donde se encuentran se enlistan en la tabla 1. Protena Funcin Mioglobina Almacenamiento de O2 Hemoglobina Transporte de O2 Transferrina Transporte de Fe Ferritina Almacenamiento de Fe Citocromo c Transporte de electrones Citocromo c oxidasa Transformacin O2H2O Citocromo P450 Activacin e incorporacin de oxgeno Protenas Fe-S Transporte de electrones Ribonucletico reductasa Transformacin ARNADN Catalasa Metabolismo de H2O2 Peroxidasas Metabolismo de H2O2 Tabla 1. Principales protenas de Fe en un humano adulto. La mioglobina y la hemoglobina constituyen el 80% del total de las protenas debido a su importancia fisiolgica que se relaciona principalmente con su capacidad de unirse al oxgeno molecular por lo que lo transportan y almacenan. Tanto la mioglobina como la hemoglobina son metaloproteinas que contienen al grupo hemo que es una molcula plana y est conformada por el Fe como centro metlico unido a cuatro piezas cclicas de cuatro carbonos y un nitrgeno, llamadas pirrol, unidas entre s por puentes alqulicos de un carbono o metilenos. El ion Fe2+ tiene posibilidad de formar 6 enlaces de coordinacin de los cuales, cuatro estn enlazados con los nitrgenos de los anillos pirrlicos que forman la porfirina, su quinto ligando que est constituido por un nitrgeno de un anillo imidazol (pentagonal, con
tres carbonos y dos nitrgenos), procedentes del aminocido histidina, que se sita a 2,7 del plano del macroanillo. Los seis ltimos electrones del ion ferroso ocuparan los 5 orbitales atmicos 3d degenerados de acuerdo a la ley de Hund, sin embargo esta degeneracin se altera debido a los tipos de ligandos. Segn su disposicin espacial estarn afectados dos orbitales atmicos, el d(x2-y2) por estar dirigidos sus lbulos en el sentido de aproximacin de los pares electrnicos no enlazantes del nitrgeno de los pirroles, en el momento de la coordinacin y el d(z2) por la accin en un nico sentido del par electrnico del nitrgeno del imidazol. El esta distorsin es pequea debido al carcter duro de la base pirrol, al estar estabilizados en la nube aromtica del anillo por lo que no existe suficiente energa para producir un desdoblamiento por lo que se trata de un complejo de alto espn.
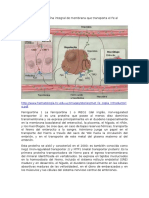
Mioglobina La mioglobina es una hemoprotena monomrica encontrada principalmente en el tejido muscular donde sirve como sitio de almacenamiento intracelular para el oxgeno. Durante perodos de privacin de oxgeno la oximioglobina libera el oxgeno almacenado que se utilizara en los procesos metablicos.
Hemoglobina
Das könnte Ihnen auch gefallen
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaVon EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaBewertung: 5 von 5 Sternen5/5 (1)
- Mapa MetabolicoDokument1 SeiteMapa MetabolicoTANIA LORENA SANTOS ROJASNoch keine Bewertungen
- Nutrición y rutas metabólicas claveDokument56 SeitenNutrición y rutas metabólicas claveXavi EscobarNoch keine Bewertungen
- Bacterias Quimiolitótrofas Del Hierro y AzufreDokument4 SeitenBacterias Quimiolitótrofas Del Hierro y AzufreManu Jiménez García100% (3)
- Ciclo de KrebsDokument15 SeitenCiclo de KrebsMiguel Angel Rodas Herrera100% (2)
- 2019 Integración y Regulación Del Metabolismo A PDFDokument70 Seiten2019 Integración y Regulación Del Metabolismo A PDFPaola MichaelNoch keine Bewertungen
- Cofactores Enzimas (Metales)Dokument12 SeitenCofactores Enzimas (Metales)JOSE ENoch keine Bewertungen
- Informe Hierro 40Dokument7 SeitenInforme Hierro 40zoeNoch keine Bewertungen
- Importancia Biológica de Las MetaloproteinasDokument2 SeitenImportancia Biológica de Las MetaloproteinaslauraNoch keine Bewertungen
- Cofactores Enzimáticos Inorgánicos y OrganicosDokument22 SeitenCofactores Enzimáticos Inorgánicos y OrganicosAdolfo La Roche100% (1)
- Trabajo de Investigacion Formativa OrganometalicaDokument8 SeitenTrabajo de Investigacion Formativa OrganometalicaGabrielitha Keit SanzNoch keine Bewertungen
- 2 Compuestos de Coordinacion en Sistema BiologicosDokument7 Seiten2 Compuestos de Coordinacion en Sistema BiologicosChristian Tuni100% (1)
- MioglobinaDokument20 SeitenMioglobinaFernando ChamorroNoch keine Bewertungen
- Citocromo C: transportador electrónico claveDokument10 SeitenCitocromo C: transportador electrónico claveItzel RiveroNoch keine Bewertungen
- El metabolismo del hierro en el organismoDokument4 SeitenEl metabolismo del hierro en el organismoAntony Barboza GalvezNoch keine Bewertungen
- Informe Del HierroDokument5 SeitenInforme Del Hierrozoe100% (1)
- Bioelementos MIADokument18 SeitenBioelementos MIACEBA Raúl Paredes EspinozaNoch keine Bewertungen
- HOPKINDokument26 SeitenHOPKINxioniNoch keine Bewertungen
- Metabolismo Del HierroDokument27 SeitenMetabolismo Del HierroLuis Antonio García RomeroNoch keine Bewertungen
- Exposicion BioquimicaDokument8 SeitenExposicion BioquimicaGisell OrtegaNoch keine Bewertungen
- CofactoresDokument3 SeitenCofactoresmaryprafloNoch keine Bewertungen
- Bioquímica Del Hierro - PicazoOlmosGerardoDokument4 SeitenBioquímica Del Hierro - PicazoOlmosGerardoGerardo PicazoNoch keine Bewertungen
- Metales de TransiciónDokument3 SeitenMetales de TransiciónEddys Buri100% (2)
- Hemoglobina ClaseDokument31 SeitenHemoglobina ClaseMarcos RosalesNoch keine Bewertungen
- Resumen de AnatomíaDokument20 SeitenResumen de AnatomíaEsther ManzanoNoch keine Bewertungen
- HemocianinaDokument1 SeiteHemocianinaCarlo ChacaltanaNoch keine Bewertungen
- Metabolismo Del Grupo Hemo PDFDokument9 SeitenMetabolismo Del Grupo Hemo PDFInes Maria MantillaNoch keine Bewertungen
- T4 MioglobinaDokument2 SeitenT4 MioglobinaRocio Jímenez PerezNoch keine Bewertungen
- Enlace IónicoDokument12 SeitenEnlace IónicoAngel GonzálezNoch keine Bewertungen
- Almacenamiento Del HierroDokument2 SeitenAlmacenamiento Del HierroJoshue MurrietaNoch keine Bewertungen
- FerroportinaDokument4 SeitenFerroportinaAriel Lòpez VelazquezNoch keine Bewertungen
- Características Generales de PorfirinasDokument4 SeitenCaracterísticas Generales de PorfirinasEdgar Carreon MoralesNoch keine Bewertungen
- Exposicion Del HierroDokument7 SeitenExposicion Del HierroGisell OrtegaNoch keine Bewertungen
- AlcanosDokument10 SeitenAlcanosbanban15018Noch keine Bewertungen
- Mioglobina y HemoglobinaDokument8 SeitenMioglobina y HemoglobinakarenNoch keine Bewertungen
- Hierro en Las PlantasDokument7 SeitenHierro en Las PlantasRaul Bacuilima AucapiñaNoch keine Bewertungen
- TransaminasasDokument20 SeitenTransaminasasEsmeralda Condori CairaNoch keine Bewertungen
- Grafito CarbonoDokument14 SeitenGrafito CarbonoUchiha JuanNoch keine Bewertungen
- Características Del CarbonoDokument3 SeitenCaracterísticas Del CarbonoJosé GarciaNoch keine Bewertungen
- Informe Zinc y HierroDokument10 SeitenInforme Zinc y HierroJean PoolNoch keine Bewertungen
- Metal Oen ZimasDokument14 SeitenMetal Oen ZimasDavid Tritono Di BallastrossNoch keine Bewertungen
- Cuestionario y VocabularioDokument2 SeitenCuestionario y VocabularioVilma Zeballos HuamaniNoch keine Bewertungen
- 2023 t01 Bioelementos Biomoleculas InorgDokument21 Seiten2023 t01 Bioelementos Biomoleculas InorgPako SimarroNoch keine Bewertungen
- Hemo ProteinDokument34 SeitenHemo ProteinJohn E Valencia100% (1)
- Introducción Hierro Hem y No HemDokument17 SeitenIntroducción Hierro Hem y No HemYubissa MGNoch keine Bewertungen
- Exposicion Inorganica - CalcogenosDokument28 SeitenExposicion Inorganica - CalcogenosJaneth RodriguezNoch keine Bewertungen
- El átomo de carbono y sus tiposDokument8 SeitenEl átomo de carbono y sus tiposDianne BrigitteNoch keine Bewertungen
- HierroDokument4 SeitenHierroRicardo Avila Ceja0% (1)
- Cabrerasuarez-Dayannamarlen M14S2AI4Dokument20 SeitenCabrerasuarez-Dayannamarlen M14S2AI4Joseph Manuel Blanco EspinozaNoch keine Bewertungen
- Carpeta de Evidencias BiologíaDokument26 SeitenCarpeta de Evidencias BiologíaHannaNoch keine Bewertungen
- Preparación y caracterización de complejos de hierro mediante titulación con permanganato de potasioDokument6 SeitenPreparación y caracterización de complejos de hierro mediante titulación con permanganato de potasiohruizc89Noch keine Bewertungen
- Monografia Anemia FerropenicaDokument42 SeitenMonografia Anemia FerropenicaDiego PacherresNoch keine Bewertungen
- 1 - Bioelementos y Biomoleculas BuenoDokument80 Seiten1 - Bioelementos y Biomoleculas Buenome gustan los seres humanos :3Noch keine Bewertungen
- Tarea Elementos QuimicosDokument14 SeitenTarea Elementos Quimicoschepe_13Noch keine Bewertungen
- Etados de OxidaciónDokument7 SeitenEtados de Oxidaciónnjy yjytjNoch keine Bewertungen
- Seminario Del HierroDokument8 SeitenSeminario Del HierroJuan Carlos Tenecora QuitoNoch keine Bewertungen
- Quimica BioinorgánicaDokument34 SeitenQuimica BioinorgánicaLeoNoch keine Bewertungen
- Metabolismo Energetico BacterianoDokument72 SeitenMetabolismo Energetico BacterianoHanael Perez CastañedaNoch keine Bewertungen
- UreaDokument8 SeitenUreaCRESPONoch keine Bewertungen
- Taller Organometalica - Cabrera DiazDokument4 SeitenTaller Organometalica - Cabrera DiazAlvaro Cabrera DiazNoch keine Bewertungen
- Hematología R - Tarea2Dokument8 SeitenHematología R - Tarea2chrissng21Noch keine Bewertungen
- Metabolismo Del HierroDokument5 SeitenMetabolismo Del Hierrogiovanna ramosNoch keine Bewertungen
- Bioinorgánica Del HierroDokument8 SeitenBioinorgánica Del HierroJuan Wilfredo Hernandez Diaz75% (4)
- Boutique de plata IPNDokument190 SeitenBoutique de plata IPNTania Flores McCartneyNoch keine Bewertungen
- Halogenos Segunda ParteDokument13 SeitenHalogenos Segunda ParteTania Flores McCartneyNoch keine Bewertungen
- Hemoderivados 1Dokument13 SeitenHemoderivados 1Tania Flores McCartneyNoch keine Bewertungen
- Calculo transferencia calor problemasDokument37 SeitenCalculo transferencia calor problemasTania Flores McCartneyNoch keine Bewertungen
- Calculos Caída de PresiónDokument7 SeitenCalculos Caída de PresiónTania Flores McCartneyNoch keine Bewertungen
- Reactores Con Recirculacion Desviacion Al Comportamiento IdealDokument3 SeitenReactores Con Recirculacion Desviacion Al Comportamiento IdealTania Flores McCartneyNoch keine Bewertungen
- Abstract oDokument40 SeitenAbstract oTania Flores McCartneyNoch keine Bewertungen
- Clase 2 FebreroDokument3 SeitenClase 2 FebreroTania Flores McCartneyNoch keine Bewertungen
- A de CalidadDokument26 SeitenA de CalidadTania Flores McCartneyNoch keine Bewertungen
- ANODIZACIÓNDokument7 SeitenANODIZACIÓNTania Flores McCartneyNoch keine Bewertungen
- LUF Previo 2Dokument3 SeitenLUF Previo 2Tania Flores McCartneyNoch keine Bewertungen
- Manual de Quimica Oranica 2Dokument56 SeitenManual de Quimica Oranica 2tsukinogaara100% (11)
- Luf 4. 29-04-2015Dokument15 SeitenLuf 4. 29-04-2015Tania Flores McCartneyNoch keine Bewertungen
- 2) Marco Cartesiano de Mano Derecha. Martes 5 de Agosto de 2014Dokument6 Seiten2) Marco Cartesiano de Mano Derecha. Martes 5 de Agosto de 2014Tania Flores McCartneyNoch keine Bewertungen
- 3) Distancia Euclidiana. Jueves 7 de Agosto de 2014Dokument7 Seiten3) Distancia Euclidiana. Jueves 7 de Agosto de 2014Tania Flores McCartneyNoch keine Bewertungen
- Lab Eq. y Cin Prop Coligativas Electrolitos FuertesDokument14 SeitenLab Eq. y Cin Prop Coligativas Electrolitos FuertesTania Flores McCartneyNoch keine Bewertungen
- Diagramas 6Dokument3 SeitenDiagramas 6Tania Flores McCartneyNoch keine Bewertungen
- Examen de FenomenosDokument1 SeiteExamen de FenomenosTania Flores McCartneyNoch keine Bewertungen
- Prac 3 Ácido-BaseDokument9 SeitenPrac 3 Ácido-BaseTania Flores McCartneyNoch keine Bewertungen
- Puntos FijosDokument4 SeitenPuntos FijosTania Flores McCartneyNoch keine Bewertungen
- Los Nódulos PolimetálicosDokument3 SeitenLos Nódulos PolimetálicosTania Flores McCartneyNoch keine Bewertungen
- DL50 CafeínaDokument3 SeitenDL50 CafeínaTania Flores McCartneyNoch keine Bewertungen
- Fundamentos de AdministraciónDokument1 SeiteFundamentos de AdministraciónTania Flores McCartneyNoch keine Bewertungen
- Puntos FijosDokument4 SeitenPuntos FijosTania Flores McCartneyNoch keine Bewertungen
- Apuntes Quimica 2.1Dokument2 SeitenApuntes Quimica 2.1Tania Flores McCartneyNoch keine Bewertungen
- Examen de TemaAlcanosGposFuncDokument1 SeiteExamen de TemaAlcanosGposFuncTania Flores McCartneyNoch keine Bewertungen
- Equilibrio entre fases: regla de Gibbs, diagrama de fases y ecuación de ClapeyronDokument4 SeitenEquilibrio entre fases: regla de Gibbs, diagrama de fases y ecuación de ClapeyronTania Flores McCartneyNoch keine Bewertungen
- Práctica 03Dokument5 SeitenPráctica 03Enzo YaelNoch keine Bewertungen
- 6 Centrifugas PDFDokument18 Seiten6 Centrifugas PDFCristhian Ruidias CrisantoNoch keine Bewertungen
- Quimica Bioinorganica Del Hierro 1Dokument66 SeitenQuimica Bioinorganica Del Hierro 1Edward Ernesto Asencios BuriackNoch keine Bewertungen
- CuestionarioDokument5 SeitenCuestionarioMaríaGabrielaOrellanaNoch keine Bewertungen
- Taller Bioquimica #1-2020Dokument3 SeitenTaller Bioquimica #1-2020Alexander Echeverri RuizNoch keine Bewertungen
- Perfil lipídico elevado en paciente de 41 añosDokument1 SeitePerfil lipídico elevado en paciente de 41 añosDeywin Ernesto Garcia MegoNoch keine Bewertungen
- Organizador MembranaDokument13 SeitenOrganizador MembranaLuis Fernando Llacta CiprianoNoch keine Bewertungen
- 2219 Linea Liquida EspDokument12 Seiten2219 Linea Liquida EspJoel ChayaNoch keine Bewertungen
- Trigliceridos-Csc 8Dokument16 SeitenTrigliceridos-Csc 8CG Angel MiguelNoch keine Bewertungen
- Pau Bio Lipidos Soluciones 2019Dokument9 SeitenPau Bio Lipidos Soluciones 2019Samplex EANoch keine Bewertungen
- La Insulina y GlucagónDokument5 SeitenLa Insulina y GlucagónCamila angeles velázquez0% (1)
- CUESTIONARIODokument5 SeitenCUESTIONARIOPau MesaNoch keine Bewertungen
- Taller EnzimasDokument4 SeitenTaller EnzimasPaulaNoch keine Bewertungen
- p6. Cinética EnzimáticaDokument4 Seitenp6. Cinética EnzimáticaNORA PILAR NINAJA MAMANINoch keine Bewertungen
- CUESTIONARIO ProteinasDokument3 SeitenCUESTIONARIO ProteinasMaríaFernandaNoch keine Bewertungen
- Historia de La Ondulacion PermanenteDokument6 SeitenHistoria de La Ondulacion PermanenteJireh CuartetoNoch keine Bewertungen
- Nutrición Humana: Cálculo de computo aminoacídico y digestibilidadDokument13 SeitenNutrición Humana: Cálculo de computo aminoacídico y digestibilidadMathii arosticaNoch keine Bewertungen
- TEMA 45 Beta-OxidaciónDokument4 SeitenTEMA 45 Beta-OxidaciónAkimitaNoch keine Bewertungen
- Catabolismo GlucidosDokument3 SeitenCatabolismo GlucidosAna Garcia MartínezNoch keine Bewertungen
- PLASMINOGENODokument2 SeitenPLASMINOGENOQUIMICO CLINICO WILLIANS SANCHEZNoch keine Bewertungen
- Diferencias Entre La Omega 3, 6 y 9Dokument3 SeitenDiferencias Entre La Omega 3, 6 y 9Orlando Fabian TorresNoch keine Bewertungen
- TAREA Unidad 1-2 QC1Dokument2 SeitenTAREA Unidad 1-2 QC1coraly rodriguezNoch keine Bewertungen
- s11 - Lectura - Laboratorio 10Dokument23 Seitens11 - Lectura - Laboratorio 10Abby Valderrama CochachinNoch keine Bewertungen
- Bioquimica de La Carne-BorradorDokument15 SeitenBioquimica de La Carne-BorradorShaskia AlavaNoch keine Bewertungen
- Rutas MetabolicasDokument5 SeitenRutas MetabolicasAna Isabel Martinez MenorNoch keine Bewertungen
- Catalogo HamburguesaDokument2 SeitenCatalogo HamburguesaÁLVARO FRANCISCO FUENZALIDA PÉREZNoch keine Bewertungen
- Tema 15. Biosíntesis de Ácidos GrasosDokument22 SeitenTema 15. Biosíntesis de Ácidos Grasosnestors89Noch keine Bewertungen
- Póster Aparato de GolgiDokument1 SeitePóster Aparato de GolgiPaty RaazNoch keine Bewertungen