Beruflich Dokumente
Kultur Dokumente
VOLUMETRIA Complexometrico
Hochgeladen von
Richard Cadillacs JaimesOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
VOLUMETRIA Complexometrico
Hochgeladen von
Richard Cadillacs JaimesCopyright:
Verfügbare Formate
2013
.-Autores:
Wheymerdt Sthalim Silva Guevara,
Richard Jaimes Cordova
.-Profesor: Ana Rufs
.-Fecha de ejecucin:15/05/2013
VOLUMETRIA POR FORMACION
DE COMLPPEJOS
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
Objetivos
En la primera parte de este laboratorio podremos determinar la:
Valoracin de la disolucin de EDTA.
Y en la segunda parte lograremos:
Determinar la dureza total de agua potable, por titulacin con EDTA.
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
RESUMEN TECNICO:
Para poder determinar la dureza del agua, primero debemos determinar la molaridad de la solucin
de EDTA. Calculamos la masa terica de este a utilizar, y masamos el patrn primario (el
procedimiento est realizado ms abajo), en la experiencia utilizamos una disolucin de buffer o
tampn o amortiguador que es la mezcla en concentraciones relativamente elevadas de un cido
dbil y su base conjugada. Tienen la propiedad de mantener estable el pH de una disolucin frente a
la adicin de cantidades relativamente pequeas de cidos o bases fuertes. Este hecho es de vital
importancia, ya que una pequea cantidad de cido o base desplaza levemente el equilibrio cido-
base dbil, lo cual tiene una consecuencia menor sobre el pH.
Realizamos una muestra y una contra muestra para poder obtener la molaridad del EDTA que se
aproxime ms al real que es 0.05M.
Una vez conocida la molaridad del EDTA, realizamos la experiencia para conocer las partes por
milln (ppm) del agua potable con un volumen gastado de EDTA, las reacciones utilizadas estn
dadas de un mol es a un mol.
La dureza del agua se debe a la presencia de sales disueltas en agua, los iones metlicos ms
comunes en el agua potable son el Ca
+2
y el Mg
+2
y algn otro compuesto, los cuales constituyen la
dureza total del agua. Aqu dejo la clasificacin de la dureza del agua.
Tipos de agua ppm de
CaCO
3
(mg/L)
Agua blanda 17
Agua levemente dura 60
Agua moderadamente dura 120
Agua dura 180
Agua muy dura >180
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
PROCEDIMIENTOS:
Valoracin de la disolucin de EDTA:
Determinacin de la dureza total del agua:
Mida 100ml. de
agua potable y
vierta en matraz
Erlenmeyer.
Determine la masa
del patrn primario
(MgSO
4
x7H
2
O).
Vierta la masa en
un matraz
Erlenmeyer y diluya
con agua hasta
100ml.
Agregue 5ml de
disolucin de buffer
o tampn de PH 10.
Con una esptula
agregue aprox. 5mg
de indicador NET
al matraz
Erlenmeyer.
Valore con la disolucin de
EDTA que contiene la
bureta, hacia el matraz
hasta observar un cambio
de color.
Agregue 5ml. de
disolucin de buffer
de PH igual a 10.
Agregue aprox. 5mg.
de NET con la
esptula.
Valore con la
disolucin de EDTA
con molaridad
conocida desde la
bureta
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
DATOS Y CALCULOS DE RESULTADOS:
I.- VALORACION DEL EDTA (hallar su concentracin aprox= 0,05)
Datos tomados :
- Masa de MgSO
4
:
Muestra 1: 0,2541gr
Muestra 2: 0,250gr
- Volumen gastado de EDTA cuando se alcanza un equilibro en el matraz de
Erlenmeyer
Muestra 1: 22,8 ml 0,0228L
Muestra 2: 23,9ml 0,0239L
Calculo moles de
Muestra1:
mol
Muestra2:
mol
Calculo moles de EDTA :
Para el clculo de los moles de EDTA tendremos en consideracin la ecuacin
equilibrada y la relacin que existe entre la cantidad de moles necesarios para que
reaccione totalmente con los moles de MgSO
4
por lo tanto tenemos:
nmoles de EDTA =n moles de MgSO
4
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
Para la muestra 1:
n moles =
Para la muestra 2:
n moles =
Calculo de la Molaridad de EDTA en la disolucin:
Sabiendo los moles y el volumen utilizado para lograr el equilibrio en la disolucin
hallamos la molaridad usando la formula:
Para la muestra 1:
C1 =0,045M
Para la muestra 2:
C2 = 0,042M
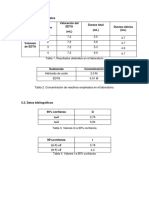
muestra Masa
MgSO
4
n moles MgSO
4
n moles EDTA Volumen
gastado
Concentracin
EDTA
1 0,2541gr
mol 1,013167
mol
22,8ml 0,045M
2 0,250gr
mol 1,015022
mol
23,9ml 0,043M
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
Valor promedio de la concentracin
MUESTRA 1 MUESTRA 2 PROMEDIO MUESTRA
CONCENTRACION 0,045M 0,043M 0,044M
II.- DETERMINACION DE LA DUREZA DEL AGUA POR MEDIO DE LA VALORACION
DEL CaCO
3
Tomando el EDTA ya valorado en la experiencia I realizamos la valoracin del CaCo
3
disolucin EDTA en agua potable del sector de Conchali
Datos tomados :
Volumen agua potable = 100ml
Concentracin Molar promedio del EDTA = 0,045M
MUESTRA1
Volumen gastado EDTA = 10,6 ml
MUESTRA2
Volumen gastado EDTA = 11,3 ml
Calculo moles de EDTA
Teniendo en cuenta las formulas usadas en la experiencia I de este laboratorio
podemos decir:
MUESTRA1:
n moles EDTA = 0,045mol/litros 0,0106L
n moles EDTA =0,000477mol
MUESTRA2:
n moles EDTA = 0,045mol/litros 0,0113L
n moles EDTA =0,0005085mol
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
Calculo moles de CaCO
3
En esta reaccin la proporcin de moles es 1:1 por ende la cantidad de moles del
EDTA es igual a la cantidad de moles del carbonato de calcio
Por lo tanto: n de moles CaCO
3
= n moles de EDTA
MUESTRA1:
n moles CaCO
3
= 0,000477mol
MUESTRA2:
n moles CaCO
3
= 0,0005085mol
Como deseamos calcular la concentracin del CaCO
3
en ppm primero encontraremos
la cantidad de masa que hay en 100ml de muestra de agua potable por lo que la
cantidad masa estar dada por el producto entre la cantidad de moles y su peso
molecular
Calculo de la masa del CaCO
3
MUESTRA 1:
MUESTRA 2:
Calculo de la concentracin de CaCO
3
en ppm:
Para la muestra 1 Como en 100ml hay 47,7mgr de CaCO3 entonces en un
litro tendran que haber 477mgr quedando la relacin como sigue:
CaCO3 en agua potable 477mgr /L = 477ppm
Para la muestra 2 Como en 100ml hay 50,85mgr de CaCO3 entonces en un
litro tendran que haber 508,5mgr quedando siguiente relacion:
CaCO3 en agua potable 508,5 mgr /L = 508,5ppm
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
Muestra Volumen
gastado EDTA
N moles de
CaCO3
Masa CaCO3 Concentracin
(ppm)
Muestra1 10,6ml 0,000477mol 477ppm
Muestra2 11,3ml 0,0005085mol 508,5ppm
CONCLUSIONES:
El EDTA es un valorante muy empleado en Qumica Analtica no slo
porque forma complejos con la mayora de los iones metlicos, sino porque tambin
tienen estabilidad suficiente para llevar a cabo valoraciones, Adems la
Estequiometria de todos los complejos de EDTA es 1:1, lo que simplifica notablemente
los clculos numricos en las valoraciones.
Al realizar estas experiencias tuvimos un poco de complicaciones con el NET ya que este
presentaba un poco de problemas para poder determinar la concentracin exacta del EDTA, la
cual nos servir para calcular la cantidad de CaCo3 en ppm y ver asi la dureza que presenta el
agua con la que estamos trabajando.
El punto final de la titulacin se observar con facilidad si no se agrega NET en
exceso. La solucin al comienzo de la titulacin deber ser rosa plido y llegaremos a
un equilibro de moles cuando este se torna color azul plido o azulado.
Hallamos La concentracin en ppm de carbonato de calcio con la finalidad de poder saber a que
tipo de agua pertenece nuestra muestra: agua muy dura, agua dura, blanda y asi saber que
decisin tomar para mejorarla y tomar agua ms sana
RECOMENDACIONES:
Una vez agregado el buffer titule rpidamente y evitar as la precipitacin de carbonato de
calcio.
Agregue lentamente las ltimas gotas de titulante dado que la reaccin es de cintica lenta.
Si la solucin se torna incolora o azul muy plido en las cercanas del punto final, agregar una
mnima cantidad de indicador por que la variacin puede ser brusca.
Titular hasta que la solucin sea azul. No titular al color del blanco ya que el indicador se
descompone con el tiempo, variando su color.
Universidad de Santiago de chile
Departamento de ingeniera Civil en minas
BIBLIOGRAFIA:
Anlisis Qumico Cuantitativo. D. Harris. Grupo Ed. Iberoamerica.1992
Fundamentos de qumica analtica .D. Skoog y D.West.ED. Reverte.
Gua de laboratorio qumica analtica.
Das könnte Ihnen auch gefallen
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadVon EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNoch keine Bewertungen
- Formulaciones Detergentes BiodegradablesDokument309 SeitenFormulaciones Detergentes BiodegradablesAngel SanchezNoch keine Bewertungen
- Control Optimo de La Inhibición y Estabilización deDokument81 SeitenControl Optimo de La Inhibición y Estabilización deGuiver Suarez V.100% (2)
- Determinar La Dureza Total Del AguaDokument9 SeitenDeterminar La Dureza Total Del AguaKarina PeñaNoch keine Bewertungen
- Laboratorio 6 - Dureza Del AguaDokument17 SeitenLaboratorio 6 - Dureza Del AguaCami TotoyNoch keine Bewertungen
- Formulas PDFDokument54 SeitenFormulas PDFleisssa100% (2)
- Informe N°03 Dureza-Del-AguaDokument15 SeitenInforme N°03 Dureza-Del-AguaEricka Anais Arellano Acuña0% (1)
- Tratamiento de Aguas en Hospitales y ClinicasDokument88 SeitenTratamiento de Aguas en Hospitales y ClinicascheuqueleivaNoch keine Bewertungen
- Laboratorio ComplexDokument10 SeitenLaboratorio ComplexAlmendra CarolinaNoch keine Bewertungen
- Practica 7 - Determinacion de La Dureza Del AguaDokument5 SeitenPractica 7 - Determinacion de La Dureza Del AguaAnika Godoy KennedyNoch keine Bewertungen
- Práctica 8 Equipo 7Dokument10 SeitenPráctica 8 Equipo 7karen lhzNoch keine Bewertungen
- EdtaDokument7 SeitenEdtaFernanda MedinaNoch keine Bewertungen
- Informe 5 AnaliticaDokument10 SeitenInforme 5 AnaliticaLemon TeaNoch keine Bewertungen
- Práctica 10 Química AnaliticaDokument8 SeitenPráctica 10 Química AnaliticaMarco CervantesNoch keine Bewertungen
- Práctica 3. Determinación de DurezaDokument16 SeitenPráctica 3. Determinación de DurezaJULIAN MONTES GONZALEZNoch keine Bewertungen
- Informe 4 AnaliticaDokument10 SeitenInforme 4 AnaliticaAnonymous m4yPB5XNoch keine Bewertungen
- Informe #8Dokument4 SeitenInforme #8Mateo Martínez ValenciaNoch keine Bewertungen
- ExperimentoDokument9 SeitenExperimentoanon-331445100% (2)
- LAB#8Dokument7 SeitenLAB#8eveNoch keine Bewertungen
- DurezasDokument2 SeitenDurezasAndres Leonardo Gonzalez RojasNoch keine Bewertungen
- Laboratorio 1 Determinacion de La Dureza TotalDokument21 SeitenLaboratorio 1 Determinacion de La Dureza TotalChelito AnguloNoch keine Bewertungen
- Informe de DurezaDokument13 SeitenInforme de DurezaLinita Torres CardenasNoch keine Bewertungen
- Laboratorio de Procesos Industriales ProfDokument10 SeitenLaboratorio de Procesos Industriales ProfChoque FrancoNoch keine Bewertungen
- Dureza TotalDokument6 SeitenDureza Total4DFJUNTO100% (1)
- Trabajo Práctico N°5 - AnalíticaDokument5 SeitenTrabajo Práctico N°5 - AnalíticaZoe SpamerNoch keine Bewertungen
- Ácido - Base y ComplejometríaDokument12 SeitenÁcido - Base y Complejometría5 ntenidoNoch keine Bewertungen
- Volumetría Por Formacion de CompejosDokument9 SeitenVolumetría Por Formacion de CompejosCristian Zavala GodoyNoch keine Bewertungen
- Determinacion Dureza Del AguaDokument13 SeitenDeterminacion Dureza Del AguaDayAnnya Isa P. Claure100% (1)
- Guías de TPDokument41 SeitenGuías de TPevamaisanoNoch keine Bewertungen
- Protocolo de Analisis Determinacion Dureza en Agua Potable MafeDokument5 SeitenProtocolo de Analisis Determinacion Dureza en Agua Potable MafeMariafernanda SotomonteNoch keine Bewertungen
- Informe 4 ANALITICADokument14 SeitenInforme 4 ANALITICAWalter Salazar SandiNoch keine Bewertungen
- Determinacion de La Dureza Del AguaDokument9 SeitenDeterminacion de La Dureza Del AguaLesly VilchezNoch keine Bewertungen
- Informe-Complejometria y Dureza Del AguaDokument4 SeitenInforme-Complejometria y Dureza Del AguaCarlos Morales CocolitoNoch keine Bewertungen
- Calidad Del Agua Potable de La Ciudad de La PazDokument8 SeitenCalidad Del Agua Potable de La Ciudad de La PazGrover Condori JimenezNoch keine Bewertungen
- Cuantificación de La Dureza en Agua Mineral.Dokument6 SeitenCuantificación de La Dureza en Agua Mineral.Luis RuizNoch keine Bewertungen
- Practica 4 Juanvi A.QDokument11 SeitenPractica 4 Juanvi A.Qpau castillaNoch keine Bewertungen
- Practica 2b - Dureza Del AguaDokument6 SeitenPractica 2b - Dureza Del AguaFátima RieraNoch keine Bewertungen
- Estandarizacion Solucin EdtaDokument6 SeitenEstandarizacion Solucin Edtajuancho roisNoch keine Bewertungen
- Trabajo Avellano TODODokument77 SeitenTrabajo Avellano TODOMikel MendiaNoch keine Bewertungen
- Guia ComplejometriaDokument4 SeitenGuia ComplejometriaJulian AmadoNoch keine Bewertungen
- Informe de Laboratorio Dureza TotalDokument15 SeitenInforme de Laboratorio Dureza TotalRodrigo Andres Alarcón FranchiniNoch keine Bewertungen
- Indice Langelier TerminadoDokument15 SeitenIndice Langelier Terminadoflavio diazNoch keine Bewertungen
- INFORME 4 CuantitativaDokument7 SeitenINFORME 4 CuantitativaShedenka Mishel Perez LluscoNoch keine Bewertungen
- Volumetria Por Complejos EnviDokument7 SeitenVolumetria Por Complejos EnviAnonymous DVQUhsLWPsNoch keine Bewertungen
- Informe Dureza Del AguaDokument4 SeitenInforme Dureza Del AguaJoha SalazarNoch keine Bewertungen
- Informe de Determinacion de CalcioDokument7 SeitenInforme de Determinacion de CalcioMiguel Perez AymaNoch keine Bewertungen
- PRACTICA 8 Calidad de AguaDokument6 SeitenPRACTICA 8 Calidad de AguaFranzNoch keine Bewertungen
- Informe Ingenieria Ambiental Laboratorio Dureza PDFDokument11 SeitenInforme Ingenieria Ambiental Laboratorio Dureza PDFAlejandro Vargas CortesNoch keine Bewertungen
- Acidez Alcalinidad y Dureza - Laboratorio 1Dokument10 SeitenAcidez Alcalinidad y Dureza - Laboratorio 1h412Noch keine Bewertungen
- Informe EdtaDokument8 SeitenInforme EdtaJorge RomeroNoch keine Bewertungen
- Dureza de AguaDokument2 SeitenDureza de AguaBryan Gabriel Peralta VidalNoch keine Bewertungen
- Práctica No.1quimica AnaliticaDokument13 SeitenPráctica No.1quimica AnaliticaLeonardo De la CruzNoch keine Bewertungen
- Informe 12 - Dureza Cálcica y Total - González, Elizabeth - Paralelo 101Dokument8 SeitenInforme 12 - Dureza Cálcica y Total - González, Elizabeth - Paralelo 101Elizabeth González DíazNoch keine Bewertungen
- Practica 10 EdtaDokument13 SeitenPractica 10 EdtaFrancisco CastilloNoch keine Bewertungen
- Guia de Laboratorio Alcalinidad Acidez DurezaDokument3 SeitenGuia de Laboratorio Alcalinidad Acidez Durezaheider manuelNoch keine Bewertungen
- Análisis Cuantitativo de Analitos Con Base en Equilibrios de Formación de ComplejosDokument3 SeitenAnálisis Cuantitativo de Analitos Con Base en Equilibrios de Formación de ComplejosGabriela Pietra Santa100% (1)
- PH, Acidez, Alcalinidad y DurezaDokument14 SeitenPH, Acidez, Alcalinidad y DurezaNicolás Duque GardeazábalNoch keine Bewertungen
- G6 - Lab 01 - Dureza y STDDokument12 SeitenG6 - Lab 01 - Dureza y STDDiana Estefania Sanchez LazaroNoch keine Bewertungen
- Determinacion de La Dureza Del AguaDokument3 SeitenDeterminacion de La Dureza Del AguaWalter Alvarez OspinoNoch keine Bewertungen
- Dureza Del Agua Volumetria-ComplexometriaDokument7 SeitenDureza Del Agua Volumetria-ComplexometriaJenny QuingaNoch keine Bewertungen
- Practica - 7 Volumetria de ComplejosDokument5 SeitenPractica - 7 Volumetria de ComplejosNafracla22Noch keine Bewertungen
- Protocolo de Determinación de Dureza PDFDokument11 SeitenProtocolo de Determinación de Dureza PDFJavier Andres Ardila OspinaNoch keine Bewertungen
- Informe #7 Valoraciones Por Formación de ComplejosDokument5 SeitenInforme #7 Valoraciones Por Formación de ComplejosLinaRodriguez0126Noch keine Bewertungen
- Informe Determinacion de Dureza Del AguaDokument5 SeitenInforme Determinacion de Dureza Del AguaIvanAconchaNoch keine Bewertungen
- IEA PmpaAnexo3 PDFDokument23 SeitenIEA PmpaAnexo3 PDFElvis Justo Choquegonza GomezNoch keine Bewertungen
- Manual Controlar H Flash y Sistemas Anexos Cap 1 FinalDokument160 SeitenManual Controlar H Flash y Sistemas Anexos Cap 1 FinalLeandro Meneses Becerra100% (1)
- Corrosión e Incrustaciones en Los Sistemas de Distribución de Agua Potable Revisión de Las Estrategias de ControlDokument11 SeitenCorrosión e Incrustaciones en Los Sistemas de Distribución de Agua Potable Revisión de Las Estrategias de ControlreyNoch keine Bewertungen
- Serv. Auxiliares - Portafofio EvidenciasDokument25 SeitenServ. Auxiliares - Portafofio EvidenciasFabian BarreteroNoch keine Bewertungen
- Preinforme 06 - Análisis Químico PDFDokument4 SeitenPreinforme 06 - Análisis Químico PDFCristian Humberto Badillo AgredoNoch keine Bewertungen
- HPSU Compact v5 Manual de Instalación 0116Dokument88 SeitenHPSU Compact v5 Manual de Instalación 0116Carlos CastilloNoch keine Bewertungen
- Corrosión en Agua DulceDokument11 SeitenCorrosión en Agua DulceOmar Morteo100% (1)
- Memoria Regular Pozo Tajo AbiertoDokument17 SeitenMemoria Regular Pozo Tajo AbiertoCarlos Alberto Cruzado BlancoNoch keine Bewertungen
- Niveles de Duresa de AguaDokument2 SeitenNiveles de Duresa de AguaJunior BardalezNoch keine Bewertungen
- Titulacion Con Edta de Ca2Dokument4 SeitenTitulacion Con Edta de Ca2Andres Felipe Reyes OrtegaNoch keine Bewertungen
- Laboratorio Nº10 Determinación de La Dureza Del AguaDokument14 SeitenLaboratorio Nº10 Determinación de La Dureza Del AguaAdorian FārNoch keine Bewertungen
- Determinación de La Dureza Del AguaDokument9 SeitenDeterminación de La Dureza Del AguaAnonymous 28dbytNoch keine Bewertungen
- Dureza Del Agua InformeDokument4 SeitenDureza Del Agua InformeCarlos LancherosNoch keine Bewertungen
- Resumen Analitca 2do ParcialDokument9 SeitenResumen Analitca 2do Parcialtotojul1Noch keine Bewertungen
- CUESTIONARIO y RecomendacionesDokument5 SeitenCUESTIONARIO y RecomendacionesgersonNoch keine Bewertungen
- Informe de AlcalinidadDokument8 SeitenInforme de AlcalinidadRönāldö Sena Jr.Noch keine Bewertungen
- Usos de Cal en Agua PotableDokument6 SeitenUsos de Cal en Agua PotableCarlos GomezNoch keine Bewertungen
- Tratamiento QuimicoDokument7 SeitenTratamiento QuimicoWill CabasNoch keine Bewertungen
- Segundo Parcial TSDIDokument23 SeitenSegundo Parcial TSDIAlejandro Sandoval GuillénNoch keine Bewertungen
- Universidad Central Del EcuadorDokument11 SeitenUniversidad Central Del EcuadorJuanCarlosCajamarcaChaucaNoch keine Bewertungen
- Los Metales de Los Grupos 1 - Quimica InorganicaDokument21 SeitenLos Metales de Los Grupos 1 - Quimica InorganicafredgccNoch keine Bewertungen
- Tratamiento de Agua para Calderas - Ing. MarisolDokument3 SeitenTratamiento de Agua para Calderas - Ing. MarisolYaser MenesesNoch keine Bewertungen
- Hoja de Ejercicios Aqii 2019Dokument2 SeitenHoja de Ejercicios Aqii 2019Alejandra Pamela Rodriguez Lopez100% (1)
- Contaminación Hidrica CarapariDokument71 SeitenContaminación Hidrica CarapariMaricarmen Pantoja BarriosNoch keine Bewertungen