Beruflich Dokumente
Kultur Dokumente
Velocidad de Lixiviacion de Sulfuros
Hochgeladen von
ksteyon0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
44 Ansichten4 SeitenCopyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
44 Ansichten4 SeitenVelocidad de Lixiviacion de Sulfuros
Hochgeladen von
ksteyonCopyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 4
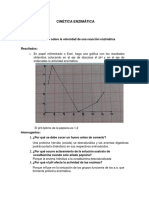
VELOCIDAD DE LIXIVIACION DE SULFUROS
La calcosina lixivia rpidamente bajo condiciones de lixiviacin. La bornita y covelina lixivian
mucho ms lentamente. La lixiviacin comercial nunca se basa en bornita o covelina.
La calcopirita es difcilmente tocada por la solucin de lixiviacin, se cree que:
a) El Fe es lixiviado antes que el Cu en CuFeS
2
, dejando una capa pasiva de CuS
2
b) Despus de la lixiviacin del Cu del CuS
2
se deja una capa de azufre elemental.
c) Combinado estos productos, las capas inhiben fuertemente en la velocidad de la lixiviacin
de la calcopirita.
La calcopirita no se lixivia en las condiciones oxidantes suaves de lixiviacin en pilas. Puede, sin
embargo, ser lixiviado bajo condiciones ms fuertes oxidantes. Esto ha llevado al estudio extensivo
en la lixiviacin de concentrados de calcopirita como alternativa a la fundicin.
Las condiciones ptimas de lixiviacin son:
(a) montones uniformes del aglomerado ptimo que mantienen su permeabilidad a lo largo de su
vida
(b) las condiciones de lixiviacin que optimicen la actividad bacteriana (-3O "C, pH -2, 5-10 kg
H
2
S0
4
/m
3
de lixiviante, no orgnicos)
(c) uniforme, aplicacin lixiviante m
3
kour/m
2
) sobre la superficie de la pila sin agrupacin
(d) diseado del montn de base impermeable en pendiente inferior al 5% con un sistema
eficiente de recogida embarazada solucin de lixiviacin
(e) Temperatura de almacenamiento dinmico adecuado, siempre en las regiones fras de refinado
de calefaccin, tubos aislantes y cubriendo los montones con malla de polmero o lmina.
El lixiviante se aadi a travs de una red de tuberas de polmero equidistantes y emisores de
gota o aspersores en la parte superior de la pila. Su velocidad de adicin se trata de lo-* m3 de
lixiviante por hora y por m2 de superficie de la pila. Esta baja tasa impide la puesta en comn de
lixiviante sobre la superficie de la pila (que permite la libre circulacin del aire en el montn).
Aspersores y los emisores de goteo se utilizan casi por igual. Rociadores (Wobblers) tienen la
ventaja de distribuir uniformemente la solucin en grandes reas. Emisores de goteo requieren
poco mantenimiento y evitar una excesiva evaporacin y enfriamiento.
El lixiviante casi siempre entra en la pila a temperatura ambiente. En las zonas fras se puede
calentar para aumentar la tasa de extraccin de Cu
++
.
ANALISIS DE LAS REACCIONES METAL / SOLUCION
Existen tres mtodos para efectuar la reduccin de los iones metlicos y lograr precipitar un metal,
estos son:
- El primer mtodo es la aplicacin de un potencial externo, el cual debe ser ms negativo
que el respectivo potencial de media celda. Ocurrir la reduccin del ion metlico, dando
por resultado la depositacin del metal sobre la superficie de un electrodo metlico por
electrolisis, lo que es la base del proceso de electroobtencin o electrowinning.
- Un segundo mtodo ocurre cuando un ion metlico en solucin, M
1
+z1,
se pone en
contacto con otro metal, M
2
, cuyo potencial es mas electronegativo. Esto da como
resultado la depositacin de M
1
sobre M
2
y es conocido como reduccin por contacto,
precipitacin galvnica o proceso de cementacin.
- El tercer mtodo para reduccin de metales que se encuentran en solucin, M
1
+z1,
consiste
en utilizar hidrogeno como reductor, o procesos de precipitacin con gases.
En el primer caso, se tiene la electrolisis, o proceso de electro-obtencin. Sobre este
procedimiento de recuperacin, se puede decir que es el mtodo ms directo y fcil de
comprender, ya que para vencer l potencial de precipitacin requerido para este metal en
particular (segn se puede desprender de la siguiente tabla), se utiliza un potencial elctrico
mucho mayor e impuesto desde el exterior del sistema.
En cuando al segundo caso, correspondiente a l reduccin por contacto o proceso de
cementacin, se puede decir que el proceso est representado por la ecuacin general:
En la siguiente figura se puede apreciar que cada metal es potencialmente susceptible de ser
reducido por cualquier otro metal que muestre un potencial de media celda ms negativo que el
de l. En el lenguaje comn esta propiedad se denomina escala de nobleza de los metales. As se
dice que un metal ser ms noble que otro si al estar disuelto el primero, ste se precipita en
presencia del segundo. As, por ejemplo, el cobre disuelto puede ser reducido, y precipita como
Cu en presencia del fierro, porque el potencial de equilibrio estndar de este ltimo es ms
negativo que el del cobre.
Los sistemas o procesos comerciales ms importantes que aplican este principio son:
Por ltimo, el gas hidrogeno es capaz de reducir vario metales (a aquellos cuyo potencial estndar
es positivo y mayor que cero) porque su potencial de media celda tiene un valor de E=0, por
definicin ya que es usado como referencial para indicar el potencial de todos los dems. Esto se
seala con la indicacin SHE o potencial referido al electrodo de hidrogeno. Entonces el H
2
acta
favorablemente hasta valores altos de pH, aunque en esos casos pueden aumentar las dificultades
debido a la formacin de superficies pasivas producidas por precipitacin qumica de xidos e
hidrxidos.
Das könnte Ihnen auch gefallen
- Clasificacion de Rocas IgneasDokument17 SeitenClasificacion de Rocas IgneasAngel Hiran Zavaleta LunaNoch keine Bewertungen
- Operaciones Sólido - Fluido 2014 Cap 1-2Dokument108 SeitenOperaciones Sólido - Fluido 2014 Cap 1-2ksteyon100% (1)
- Clasificación de Las Rocas ÍgneasDokument28 SeitenClasificación de Las Rocas ÍgneasksteyonNoch keine Bewertungen
- Aplicaciones Ley de FickDokument2 SeitenAplicaciones Ley de Fickksteyon67% (3)
- PELLETIZACIONDokument10 SeitenPELLETIZACIONksteyonNoch keine Bewertungen
- Ley Boyle de Un Gas IdealDokument3 SeitenLey Boyle de Un Gas IdealksteyonNoch keine Bewertungen
- Filones y Minerales Filonianos, Depositos Hipotermales, Mesotermales y Epitermales.Dokument5 SeitenFilones y Minerales Filonianos, Depositos Hipotermales, Mesotermales y Epitermales.ksteyon100% (8)
- Postulados. Teoría Cinética de Los Gases.Dokument2 SeitenPostulados. Teoría Cinética de Los Gases.ksteyon86% (7)
- Codigo de Ética Del Estudiante de Ingeniería Química MetalúrgicaDokument7 SeitenCodigo de Ética Del Estudiante de Ingeniería Química MetalúrgicaksteyonNoch keine Bewertungen
- Proyecto - Secuenciador Automatico - Grupo 5Dokument39 SeitenProyecto - Secuenciador Automatico - Grupo 5Saray Esther Chumbes ManzanoNoch keine Bewertungen
- Adicción A Las Redes Sociales en JóvenesDokument29 SeitenAdicción A Las Redes Sociales en JóvenesSolange Manzanita SolpatataNoch keine Bewertungen
- Autoescala de Ansiedad de ZungDokument2 SeitenAutoescala de Ansiedad de ZungALexandraNoch keine Bewertungen
- Marc, La Sucia Rata - Jose Sbarra PDFDokument287 SeitenMarc, La Sucia Rata - Jose Sbarra PDFHernan Benjamin Elgueta VallejosNoch keine Bewertungen
- Ciclo de OttoDokument19 SeitenCiclo de OttoPepeNoch keine Bewertungen
- Articulo Parkison PDFDokument13 SeitenArticulo Parkison PDFByron ManuelNoch keine Bewertungen
- Mantenimiento de La Salud en El Adulto 27 - 07 - 21Dokument40 SeitenMantenimiento de La Salud en El Adulto 27 - 07 - 21joseee nnesstaresNoch keine Bewertungen
- UreaDokument41 SeitenUreaFernanda MartinezNoch keine Bewertungen
- Exposicion Del Origen Del Universo GriegoDokument17 SeitenExposicion Del Origen Del Universo GriegoJuan David VerdugoNoch keine Bewertungen
- Por Una ApuestaDokument10 SeitenPor Una ApuestaXavi DavilaNoch keine Bewertungen
- Práctica Elaboración de VelasDokument2 SeitenPráctica Elaboración de VelasJessica Pinta AuquiNoch keine Bewertungen
- La AdultezDokument20 SeitenLa AdultezyajairaNoch keine Bewertungen
- Confort InteriorDokument24 SeitenConfort InteriorJessica Molina HuarcayaNoch keine Bewertungen
- Día de Muertos: Elementos Del AltarDokument3 SeitenDía de Muertos: Elementos Del AltarManuel EspinozaNoch keine Bewertungen
- Cuadro Comparativo de Las Memorias Breves - Sergio Alejandro Torres SalasDokument2 SeitenCuadro Comparativo de Las Memorias Breves - Sergio Alejandro Torres SalasDiana MartinezNoch keine Bewertungen
- Variedades 610Dokument8 SeitenVariedades 610Mónica LozaNoch keine Bewertungen
- Dermatitis SeborreicaDokument24 SeitenDermatitis SeborreicaRafael Cruz MNoch keine Bewertungen
- Informe Práctica 4 BioquímicaDokument5 SeitenInforme Práctica 4 BioquímicaJUAN DANIEL RUELAS HUAMANNoch keine Bewertungen
- Dust BowlDokument2 SeitenDust BowlLSAelKstiloPrzNoch keine Bewertungen
- Explicaciones A La Adherencia Al Uso de Audifono 2Dokument7 SeitenExplicaciones A La Adherencia Al Uso de Audifono 2Valerie DayaneNoch keine Bewertungen
- Vargas Leonel 26848886 Palencia Carlos 26526347 Mary Belén SánchezDokument48 SeitenVargas Leonel 26848886 Palencia Carlos 26526347 Mary Belén SánchezLeonel VargasNoch keine Bewertungen
- Pautas de Mantención ScoopDokument11 SeitenPautas de Mantención ScoopPepeTRBKNoch keine Bewertungen
- Glosario de Valores 3Dokument3 SeitenGlosario de Valores 3francysNoch keine Bewertungen
- Investigacion de VendajesDokument34 SeitenInvestigacion de Vendajeseliromo100% (1)
- Jarabe Casero para La TosDokument1 SeiteJarabe Casero para La TosGiselle Sanzana RojasNoch keine Bewertungen
- Toma y Transporte Muestras 2021Dokument60 SeitenToma y Transporte Muestras 2021Karen MartinezNoch keine Bewertungen
- Sitemas de Explosivos PDFDokument1 SeiteSitemas de Explosivos PDFAnderson Brayan Gaspar RomeroNoch keine Bewertungen
- AceitesDokument79 SeitenAceitesNicole Flores PomalequeNoch keine Bewertungen
- Jumbo 10A PGIRSDokument2 SeitenJumbo 10A PGIRSLivington GabrielNoch keine Bewertungen
- Beneficio FunerarioDokument7 SeitenBeneficio Funerarioajcz1978Noch keine Bewertungen