Beruflich Dokumente
Kultur Dokumente
Solubilidad y Termodinamica
Hochgeladen von
JhonGy20Originalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Solubilidad y Termodinamica
Hochgeladen von
JhonGy20Copyright:
Verfügbare Formate
Solubilidad y termodinmica
Diez, Danellys
1
Universidad Autnoma de Chiriqu, Facultad de Ciencias Naturales y Exactas, Departamento
de Qumica, QM-L 360. Informe 7.
1
dnnii-@hotmail.com
Resumen
La solubilidad de un compuesto se refiere a la cantidad de soluto que ser
disuelta de una cantidad dada de solvente. La energa libre de Gibbs, es
una funcin de estado extensiva con unidades de energa, que da la condicin
de equilibrio y de espontaneidad para una reaccin qumica. Por otro lado la
entropa es una magnitud fsica que permite determinar la parte de la energa
que no puede utilizarse para producir trabajo, En esta experiencia se determin
la energa de Gibbs, la entalpia, la entropa y la Keq; en esta experiencia
examinamos el equilibro de reaccin, la solubilidad y constantes
termodinmicas a partir de la reaccin de NaNO
3
con agua y KCl con agua,
donde se midi la temperatura 6 veces y 45 veces respectivamente cada vez
que se daba la aparicin de cristales. Los resultados obtenidos para la entalpa
fue de 32,49 kJ/mol para el NaNO
3
y 35,43 kJ/mol para el KCl.
Resultados
Tabla 1. Resultados obtenidos para la H, G, S y Keq de NaNO
3
Volumen
(L)
T (K) 1/T (K) K ln K G
kJ/mol
H
kJ/mol
S
J/molK
0,011 342 0,00292 10,7 2,37 -6,74 32,49 114,7
0,0135 329 0,00304 8,72 2,16 -5,90 32,49 116,7
0,0165 327 0,00306 7,14 1,96 -5,33 32,49 115,6
0,02 325 0,00308 5,89 1,77 -4,78 32,49 114,7
0,022 323 0,00309 5,35 1,67 -4,48 32,49 114,5
0,024 319 0,00313 4,91 1,59 -4,21 32,49 115,1
Tabla 1. Resultados obtenidos para la H, G, S y Keq de KCl.
Volumen
(L)
T (K) 1/T (K) K ln K G
kJ/mol
H
kJ/mol
S
J/molK
0,011 337 0,00297 12,2 2,50 -7,00 35,43 125,9
0,013 330 0,00303 10,3 2,33 -6,39 35,43 126,7
0,016 327 0,00306 8,38 2,12 -5,76 35,43 125,9
0,018 324 0,00309 7,45 2,01 -5,41 35,43 126,1
0,019 323 0,00308 7,06 1,95 -5,23 35,43 125,9
Cuadro 3. Porcentajes de error de H de
NaNO3 y KCl
% de error de
H kJ/mol del
NaNO
3
% de error de
H kJ/mol del
KCl
58,49 105,9
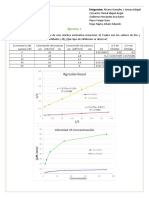
Grfico 1. ln K vs 1/T de NaNO
3
Grfico 2. ln K vs 1/T de NaNO
3
Discusin de Resultados
En la calorimetra se mide el cambio
en la temperatura de un lquido,
relacionando a continuacin el
cambio en la temperatura como
cambios de energa trmica en el
calormetro. (Atkins, 2006).
En la cuadro 1 y cuadro 2 se
muestra los valores calculados
experimentalmente y estos fueron
comparados con el valor reportado
en la teora medidos a los 25C
20,5 J/mol para H de disolucin de
NaNO
3
y 35,100 J/mol para KNO
3
y
17,2 J/mol para H de disolucin de
KCl.
Al diluir la disolucin, disminuye la
temperatura a la que cristaliza el
slido, es decir ln K es
inversamente proporcional a la
temperatura. Entonces, si se
aumenta la temperatura, la K ser
mayor, lo cual significa que habr
ms productos (iones) presentes
que reactivos (slido). Esto significa
que la solubilidad de la sustancia
ser mayor conforme aumente la
temperatura.
El modelo se ajusta al sistema
debido a que:
Las reacciones de la disolucin de
la NaNO
3
y KCl son exotrmicas,
debido al valor negativo de la
entalpa de cristalizacin. Los
valores positivos de la entropa de
cristalizacin muestra la disminucin
de la entropa en el entorno y como
los valores de la energa libre de
gibbs son mayores de 0 podemos
decir que este proceso es
espontaneo.
y = -3910x + 13.859
R = 0.8702
0
0.5
1
1.5
2
2.5
3
0.0029 0.003 0.0031 0.0032
l
n
K
1/T (K)
ln K vs 1/T
y = -4263.6x + 15.186
R = 0.9509
0
0.5
1
1.5
2
2.5
3
0.00295 0.003 0.00305 0.0031 0.00315
l
n
K
1/T (K)
ln K vs 1/T
La diferencia entre las entalpas
seria por el tamao de los iones de
los reactivos utilizados para la
disolucin.
Tambin se observa que dicho
proceso de disolucin es exotrmico
por la siguiente razn: la solubilidad
de la sustancia crece conjuntamente
con el aumento de la temperatura.
En este sentido se verifica la
afirmacin hecha por (Chang,2002)
: si la atraccin soluto-disolvente es
mayor que la atraccin disolvente-
disolvente y que la atraccin soluto-
soluto, el proceso de disolucin es
exotrmico.
Segn, Costa, 2005, la energa libre
de Gibbs es la energa liberada por
un sistema para realizar trabajo til
a presin constante. Este seala a
la vez que para determinar si un
proceso es o no espontneo, hay
que tomar en consideracin la
variacin de la entalpa y de la
entropa.
Obtuvimos errores de 58,49 y7
105,9 y estos fueron consecuencia
de errores de medicin, perdida de
disolvente por evaporacin y
diferencia de las condiciones
iniciales de presin en las que se
lleva a cabo la disociacin.
Conclusin
En esta prctica utilizamos
variables termodinmicas para
determinar el comportamiento de la
reacciones de disolucin del NaNO
3
y KCl.
Con los valores obtenidos en este
laboratorio podemos decir que las
disoluciones son exotrmicas, y son
espontneas a altas temperaturas.
Podemos ver que las
concentraciones del soluto
dependen en gran medida de la
cantidad de solvente ya que a
mayor cantidad de solvente menor
ser la temperatura de disolucin
del soluto.
Los porcentajes de error fueron de
58,49 y 105,9 para NaNO
3
y KCl
respectivamente, lo que indica que
el modelo se ajusta al sistema.
Bibliografa
Atkins,J. Principios de
Qumica los caminos del
descubrimiento. Editorial
Mdica Panamericana.
Espaa.2007.
Hougen, O. Principios de los
procesos qumicos. Editorial
9 Reverte, S.A. Espaa.
1982.
Busch, R. Qumica,
fundamentos experimentales.
Editorial Reverte, S.A.
Espaa. 1974.
Ritter, H; Introduccin a la
Qumica. Editorial Revert,
S.A. Espaa. 1956
Chang, R. Qumica General.
(2002). Editorial McGraw-Hill,
Mxico
Costa, J. Qumica Fsica,
Universidad de Barcelona,
Espaa, 2005.
Das könnte Ihnen auch gefallen
- Practica 5 Aumento en El Punto de EbullicionDokument9 SeitenPractica 5 Aumento en El Punto de EbullicionMaría de los Ángeles Moreno CoronadoNoch keine Bewertungen
- Ejercicios de Porcentaje en Masa y Porcentaje VolumenDokument8 SeitenEjercicios de Porcentaje en Masa y Porcentaje Volumenjennyjony100% (3)
- Adsorción Del Ácido Acético Sobre El Carbón ActivadoDokument5 SeitenAdsorción Del Ácido Acético Sobre El Carbón ActivadoJean Pierre Paredes Tocas0% (1)
- Ejercicios de BioquímicaDokument4 SeitenEjercicios de BioquímicaJomara González100% (1)
- Fundamento Del Balance de EnergiaDokument31 SeitenFundamento Del Balance de EnergiaRafael Torres de la CoronaNoch keine Bewertungen
- Manual de Practicas Cinetica Quimica PDFDokument17 SeitenManual de Practicas Cinetica Quimica PDFXochitl ArellanoNoch keine Bewertungen
- Practica de Laboratorio, Espejos de PlataDokument1 SeitePractica de Laboratorio, Espejos de PlataSerena Méndez LLanquetruNoch keine Bewertungen
- Subtema 2.3 Practica de Metodos de Velocidad de Reaccion 2Dokument9 SeitenSubtema 2.3 Practica de Metodos de Velocidad de Reaccion 2Adán Fonseca HernandezNoch keine Bewertungen
- Practico 5 de Propiedades ColigativasDokument11 SeitenPractico 5 de Propiedades Coligativasyordy puñaNoch keine Bewertungen
- Extracción de Una Solución Enzimática de InvertasaDokument1 SeiteExtracción de Una Solución Enzimática de InvertasaNicolas Cerna VasquezNoch keine Bewertungen
- NORMA Oficial Mexicana NOM 110 SSA1 1994Dokument7 SeitenNORMA Oficial Mexicana NOM 110 SSA1 1994jaguarNoch keine Bewertungen
- Equipos Utilizados en FiltraciónDokument12 SeitenEquipos Utilizados en FiltraciónCarlos Alberto Luna SaldañaNoch keine Bewertungen
- Equilibrio Líquido-LíquidoDokument10 SeitenEquilibrio Líquido-LíquidoKatherine EspitiaNoch keine Bewertungen
- Determinacion de Conductividad en LiquidosDokument2 SeitenDeterminacion de Conductividad en LiquidosPameNoch keine Bewertungen
- L11 Informe Grupo 3 BQ1 2020-2Dokument16 SeitenL11 Informe Grupo 3 BQ1 2020-2DavidOchoaNoch keine Bewertungen
- Quimica Coloidal S 11. Proteccion de Coloides.Dokument25 SeitenQuimica Coloidal S 11. Proteccion de Coloides.Guadalupe Montes TorreblancaNoch keine Bewertungen
- Destilación Método Doble Efecto-GuiaDokument23 SeitenDestilación Método Doble Efecto-GuiaLinaSofiaNoch keine Bewertungen
- Desviaciones A La Ley de BeerDokument13 SeitenDesviaciones A La Ley de BeerAlvaro Etcheverry0% (1)
- Problemas KDokument4 SeitenProblemas KROSARIOMARTINEZ25Noch keine Bewertungen
- Reporte 2 - Propiedades y Reactividad de Los AlcoholesDokument17 SeitenReporte 2 - Propiedades y Reactividad de Los AlcoholesLigia FletesNoch keine Bewertungen
- Practica 4 Capacidad CalorificaDokument4 SeitenPractica 4 Capacidad CalorificaAlexander Pinzon100% (1)
- Encapsulado AlimentosDokument127 SeitenEncapsulado AlimentosAngeloNoch keine Bewertungen
- Reporte PolimerizaciónDokument6 SeitenReporte PolimerizaciónMaría José Rosales RealNoch keine Bewertungen
- Factor GravimétricoDokument4 SeitenFactor GravimétricoMarco Antonio Ordinola SandovalNoch keine Bewertungen
- Informe 4 FQII - Factor de Van T HoffDokument13 SeitenInforme 4 FQII - Factor de Van T HoffLeonardo SerranoNoch keine Bewertungen
- Aajr Rep P2 Opu2Dokument8 SeitenAajr Rep P2 Opu2Jenny AlvaradoNoch keine Bewertungen
- Practica Nc2ba 3 PardeamientoDokument7 SeitenPractica Nc2ba 3 PardeamientoVictor Rodriguez100% (1)
- Reporte 2 - Calor de ReaccionDokument23 SeitenReporte 2 - Calor de ReaccionWilliams Sacalxot100% (2)
- Practica 14Dokument4 SeitenPractica 14Pau FlurscheimNoch keine Bewertungen
- Reporte TitulacionDokument14 SeitenReporte TitulacionFanny SantiNoch keine Bewertungen
- Calor Diferencial de SoluciónDokument4 SeitenCalor Diferencial de SoluciónLuis Cifuentes IINoch keine Bewertungen
- QG Ibq1 Equipo#10 Pract#11 Cinética QuímicaDokument16 SeitenQG Ibq1 Equipo#10 Pract#11 Cinética QuímicaSandra Jocelyn Martínez AcevedoNoch keine Bewertungen
- Control de Calidad de Alimentos EnlatadosDokument6 SeitenControl de Calidad de Alimentos EnlatadosDenisse Gonzalez ColungaNoch keine Bewertungen
- Desplazamiento de Equilibrio Quimico Con Efecto en La TemperaturaDokument8 SeitenDesplazamiento de Equilibrio Quimico Con Efecto en La TemperaturaCindy Guliana Hernandez Arguello100% (1)
- Determinacion de Las Propiedades de Un FluidoDokument11 SeitenDeterminacion de Las Propiedades de Un FluidoCesar OrozcoNoch keine Bewertungen
- Informe EQUILIBRIO LÍQUIDODokument6 SeitenInforme EQUILIBRIO LÍQUIDOJhon Alexander HurtadoNoch keine Bewertungen
- Discusión en Balance de EnergiaDokument2 SeitenDiscusión en Balance de EnergiaMáárlóón SááTtNoch keine Bewertungen
- Diagrama de Flujo Polarografia TerminadoDokument1 SeiteDiagrama de Flujo Polarografia TerminadoJonathan UrbinaNoch keine Bewertungen
- Práctica #7 InmovilizaciónDokument5 SeitenPráctica #7 InmovilizaciónSandra MedinaNoch keine Bewertungen
- PrácticaDokument7 SeitenPrácticaDulce Mariah MárquezNoch keine Bewertungen
- Práctica #2 - Equilibrio Líquido-VaporDokument13 SeitenPráctica #2 - Equilibrio Líquido-VaporJose de la BarreraNoch keine Bewertungen
- CarbohidrasasDokument5 SeitenCarbohidrasasNICKOL KRISTINE RAMOS CUBANoch keine Bewertungen
- 6 Lih + 2 Bcl3 B2H6 + 6 LiclDokument2 Seiten6 Lih + 2 Bcl3 B2H6 + 6 LiclWilfredoRivera100% (1)
- Analisis Microbiologico Del HuitlacocheDokument2 SeitenAnalisis Microbiologico Del HuitlacocheConcepcion Bautista100% (1)
- Calor de Vaporización ModificadoDokument23 SeitenCalor de Vaporización ModificadoLina TorresNoch keine Bewertungen
- NMX-F-320-S-1978 Determinacion de Fosfatos en Embutidos PDFDokument4 SeitenNMX-F-320-S-1978 Determinacion de Fosfatos en Embutidos PDFAcqua LabNoch keine Bewertungen
- La Vitamina E Del Aceite de PalmaDokument15 SeitenLa Vitamina E Del Aceite de PalmaAgustinaNoch keine Bewertungen
- Reporte 1Dokument7 SeitenReporte 1GeorginaNoch keine Bewertungen
- Determinación de Azúcares Reductores Por El Método DNSDokument9 SeitenDeterminación de Azúcares Reductores Por El Método DNSlindaNoch keine Bewertungen
- Extracción de CafeínaDokument5 SeitenExtracción de CafeínaRoberto Muñoz100% (1)
- Propiedades ColigativasDokument8 SeitenPropiedades ColigativasJesusSainte CHNoch keine Bewertungen
- Isotermas de Adorsión.Dokument8 SeitenIsotermas de Adorsión.96884643*50% (2)
- Transferencia de Masa en Deshidratacion OsmoticaDokument17 SeitenTransferencia de Masa en Deshidratacion OsmoticaAnonymous iIaMAfVNoch keine Bewertungen
- Extraccion Acido BaseDokument10 SeitenExtraccion Acido Basepurity_corey0% (1)
- Mayonesa y ReologiaDokument3 SeitenMayonesa y ReologiaJAIR CRUZ CASTILLO100% (1)
- Práctica Número 5 Cinetica de Una ReacciónDokument9 SeitenPráctica Número 5 Cinetica de Una ReacciónKarina OvalleNoch keine Bewertungen
- PRACTICA NO 5 CONDENSACION ALDOLICA (Recuperado Automáticamente)Dokument7 SeitenPRACTICA NO 5 CONDENSACION ALDOLICA (Recuperado Automáticamente)david mateusNoch keine Bewertungen
- Cinetica LactasaDokument122 SeitenCinetica LactasaalvarezriNoch keine Bewertungen
- Nutrición de LevadurasDokument5 SeitenNutrición de LevaduraskakaNoch keine Bewertungen
- Informe FQ 7 (1) .Docx Solubilidad y TermodinámicaDokument4 SeitenInforme FQ 7 (1) .Docx Solubilidad y TermodinámicaAighself100% (1)
- Reporte 2 Solubilidad Del KNO3Dokument6 SeitenReporte 2 Solubilidad Del KNO3DAVID CEDEÑONoch keine Bewertungen
- Rec92 Refineria Gualberto Villarroel - Trab FinalDokument35 SeitenRec92 Refineria Gualberto Villarroel - Trab FinalDemian Roman92% (12)
- Hidrodinamica Mec. FluidosDokument16 SeitenHidrodinamica Mec. FluidosBraiian HdezNoch keine Bewertungen
- NTC 62 B.A. Método para Determinar El Contenido de Potasio en Vinos Empleando Tetrafenilboruro de SodioDokument6 SeitenNTC 62 B.A. Método para Determinar El Contenido de Potasio en Vinos Empleando Tetrafenilboruro de SodioAndrea ArevaloNoch keine Bewertungen
- Protocolo Nacional de Sistemas de Monitoreo Continuo de EmisionesDokument30 SeitenProtocolo Nacional de Sistemas de Monitoreo Continuo de EmisionesMiva VidCaNoch keine Bewertungen
- Clasificación de Suelos 4849Dokument6 SeitenClasificación de Suelos 4849A̤ṳs̤b̤e̤l̤ PCNoch keine Bewertungen
- Disoluciones 2020 - EjerciciosDokument5 SeitenDisoluciones 2020 - EjerciciosFla TossoliniNoch keine Bewertungen
- Cuaderno-De-Informe-Soldadura RELLENO Oficial.1Dokument8 SeitenCuaderno-De-Informe-Soldadura RELLENO Oficial.1Maria SitcherNoch keine Bewertungen
- Calculos para El MotorDokument2 SeitenCalculos para El MotorDavid SanchezNoch keine Bewertungen
- Actividad - Unidades Químicas de Masa I - 5to - 3 BimDokument1 SeiteActividad - Unidades Químicas de Masa I - 5to - 3 BimJosephNoch keine Bewertungen
- Tarea #1 Acero Estructural - Jose Daniel Muñoz Esquivel 7-BDokument12 SeitenTarea #1 Acero Estructural - Jose Daniel Muñoz Esquivel 7-BDany MuñozNoch keine Bewertungen
- Emisividad PIROMETROSDokument3 SeitenEmisividad PIROMETROSKaren VásconezNoch keine Bewertungen
- Lab 3. Medicion de Caudal Con Aforador RBCDokument3 SeitenLab 3. Medicion de Caudal Con Aforador RBCAndrea GFloresNoch keine Bewertungen
- Ingenieria de La Produccion TAREA - 2Dokument7 SeitenIngenieria de La Produccion TAREA - 2Alejo Moncayo ValleNoch keine Bewertungen
- Problemas MRUDokument4 SeitenProblemas MRUsegundomedioNoch keine Bewertungen
- Pintura Epoxica GrisDokument4 SeitenPintura Epoxica GrispablitochoaNoch keine Bewertungen
- SDSXL740HTSPAINESDokument15 SeitenSDSXL740HTSPAINESPablo Andres Espin MartinNoch keine Bewertungen
- Tipos de Agua Según Su Procedencia y UsoDokument4 SeitenTipos de Agua Según Su Procedencia y UsoJose Juarez AlquizarNoch keine Bewertungen
- Ciclo de Refrig Compresor Scroll y Aceites y Temperaturas PDFDokument49 SeitenCiclo de Refrig Compresor Scroll y Aceites y Temperaturas PDFWilson DuranNoch keine Bewertungen
- Graphene CHITOSANDokument12 SeitenGraphene CHITOSANAhbdi TorresNoch keine Bewertungen
- El Producto-Semana 2 IntegradorDokument35 SeitenEl Producto-Semana 2 IntegradorEliana FloresNoch keine Bewertungen
- Biologia Celular UVM - 9na Practica LaboratorioDokument6 SeitenBiologia Celular UVM - 9na Practica LaboratorioEdgarNoch keine Bewertungen
- Microzonificación Sísmica de LimaDokument55 SeitenMicrozonificación Sísmica de LimaljromanrNoch keine Bewertungen
- NanomaterialesDokument5 SeitenNanomaterialesTomas Castro D SantosNoch keine Bewertungen
- Formulacion Quimica 3esoDokument17 SeitenFormulacion Quimica 3esoMarcelo MonjeNoch keine Bewertungen
- Propiedades Coligativas de Las Soluciones PDFDokument29 SeitenPropiedades Coligativas de Las Soluciones PDFGina Gabriel Vera100% (1)
- Documento PDFDokument1 SeiteDocumento PDFJunior Francisco Enamorado CaballeroNoch keine Bewertungen
- Laboratorio 2 Calor Específico de Sólidos-1 D y JDokument11 SeitenLaboratorio 2 Calor Específico de Sólidos-1 D y JSoledad SanchezNoch keine Bewertungen
- Ficha Técnica Manómetro HONGQi MC 2900 PSIDokument7 SeitenFicha Técnica Manómetro HONGQi MC 2900 PSIOperaciones Smith ServicesNoch keine Bewertungen
- Enlace Ionico y Tamaño de IonesDokument8 SeitenEnlace Ionico y Tamaño de IonesKarla Hernandez Perez100% (1)