Beruflich Dokumente
Kultur Dokumente
Propiedades termodinámicas de sustancias puras y ecuaciones de estado
Hochgeladen von
astroboyatlasOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Propiedades termodinámicas de sustancias puras y ecuaciones de estado
Hochgeladen von
astroboyatlasCopyright:
Verfügbare Formate
UNIDAD I - PROPIEDADES TERMODINMICAS DE SUSTANCIAS PURAS
TAREA
Equipos 1 y 3
VALOR: 30%
FECHA DE ENTREGA: UN DA HBIL ANTES DE EXAMEN
FECHA PROGRAMADA DE EXAMEN: 9 de Marzo de 2012
A: TEMA DE INVESTIGACIN:
TEMA: Evaluacin de propiedades termodinmicas de sustancias puras por correlaciones empricas
(Ecuacin de Clapeyron, Ecuacin de Antoine, Ecuacin de Wagner) y ecuaciones de estado (Ecuacin de
estado del gas ideal, Ecuacin de van der Waals, Ecuacin de estado de Redlich Kwong, Ley de los estados
correspondientes)
B: RESOLVER LOS SIGUIENTES PROBLEMAS:
1. Un matraz contiene una mezcla de helio y nitrgeno. La presin total es de 800 mm Hg y la temperatura de
35 C. Si se saca el helio, la presin disminuye a 400 mm Hg y el peso del matraz disminuye a 2 gr. Cul es la
fraccin mol original de cada uno de los componentes de la mezcla? Cul es el volumen del matraz?
2. Calcule la presin ejercida por 74.8 gr de etano en un recipiente de 200 cm 3 a 37.5 oC, sabiendo que la
presin crtica es de 48.2 atm. y la temperatura crtica es de 305.4 oK. Utilizando:
a).- la ecuacin de los gases ideales.
b).- la ecuacin de los gases reales.
3. Para el agua lquida a 25C, = 2.07 x 10-4 K-1 y = 4.50 x10-5 atm-1. La densidad puede tomarse como
1.0 g / cm3. Un mol de agua lquida se comprime isotrmicamente a 25 C, de 1 atm a 1000 atm. Calcule el
cambio de entropa S.
4. Un gas hipottico obedece la ecuacin de estado: P (V nb) = nRT, donde b es una constante. Para este
gas, obtenga:
a) El coeficiente de dilatacin trmica.
b) El coeficiente de compresibilidad isotrmica.
c) La variacin de la presin con respecto a la temperatura con el volumen constante.
5. A 25C, se llena completamente con agua un recipiente rgido y sellado. Si la temperatura aumenta en 10C,
Qu presin se producir en el recipiente? Para el agua a 25C, = 2.07 x 10-4 K-1 , = 4.50 x10-5 atm-1.
6. Se aumenta la temperatura de un mol de oro macizo de 25 C a 100 C a presin constante. El
Cp = 23.7 + 0.00519 T, expresado en (J/mol K). Calcule S para esta transformacin. Exprese el resultado en
J/mol K.
7. A 300 K, un mol de agua lquida, cuyo volumen molar es de 18 cm 3/mol es sometido a un aumento isotrmico
de presin desde 100 KPa hasta 1 000 KPa. Calcular su G y exprese el resultado en J/mol.
8. Para el benceno (C6H6) a
25oC y 1 atm,
se tienen los siguientes datos: = 0.8804 g/cm3,
o
-4
-1
-5
Cpm = 132 J / mol K, = 1.7 x 10 K y = 4.7 x10 atm-1. Calcule:
a) (U/T)V
b) Cv. Exprese el resultado en cal / gramo oK
c) (U/V)T
d) (H/T)P
e) (H/P)T
f) (S/T)V
g) (S/V)T
h) (S/T)P
i) (S/P)T
9. Cul ser el punto de fusin del hielo a 100 atm de presin, si su calor de fusin es de 6.009 KJ/mol, la
densidad del hielo es de 0.922 g/cm3 y la densidad del agua es de 1.0 g/cm3.
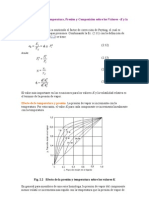
10. La presin de saturacin y la entalpa de vaporizacin del refrigerante 12 cuya frmula es: [CCl 2 F2 ], a 20C
son de 5.673 bar y 140.9 KJ / Kg , respectivamente. Calcular la presin de saturacin a 0C
11. La presin de vapor de CO2 slido es 58.5 KPa a 188 K y de 15 KPa a 198 K. Calcule el calor de
sublimacin y la temperatura de sublimacin a 1 atm.
12. Para el agua, dadas las temperaturas y presiones de vapor,
T/ C
15
20
25
30
35
P / mmHg
12.79
17.54
23.76
31.82
42.18
a) Calcular el calor de vaporizacin para este intervalo de temperaturas.
b) Estime la presin de vapor si la temperatura es de 37 C
c) Con estos datos, estime el punto de ebullicin normal del agua.
40
55.32
45
71.88
Das könnte Ihnen auch gefallen
- Práctica Sal de Mohr 1Dokument9 SeitenPráctica Sal de Mohr 1Luis CampuzanoNoch keine Bewertungen
- TallerDokument9 SeitenTallerJohan RojasNoch keine Bewertungen
- Reporte 6 de Quimica OrganicaDokument20 SeitenReporte 6 de Quimica OrganicaDustin AxelNoch keine Bewertungen
- Cuestiones y Problemas Del Tema 6: Equilibrio QuímicoDokument21 SeitenCuestiones y Problemas Del Tema 6: Equilibrio QuímicoBlueStorsNoch keine Bewertungen
- Calcular La Presión Osmótica A 27 ºC Producida Por Una Disolución Acuosa de Sacarosa C12H22O11 Cuya Concentración Es de 18 GDokument1 SeiteCalcular La Presión Osmótica A 27 ºC Producida Por Una Disolución Acuosa de Sacarosa C12H22O11 Cuya Concentración Es de 18 GLuis AngelNoch keine Bewertungen
- Análisis GravimetricoDokument14 SeitenAnálisis GravimetricoOscar E RS100% (1)
- Soluciones BinariasDokument4 SeitenSoluciones BinariaslalalaNoch keine Bewertungen
- CalorimetríaDokument13 SeitenCalorimetríaKevinLagunaNoch keine Bewertungen
- Unidades 1Dokument50 SeitenUnidades 1Adolf MarNoch keine Bewertungen
- Taller de ElectroquímicaDokument5 SeitenTaller de ElectroquímicaPaula HerreraNoch keine Bewertungen
- Sintesis y Estudio de Isómeros de EnlaceDokument14 SeitenSintesis y Estudio de Isómeros de EnlaceLuisk Vesga100% (1)
- Volumetría RedoxDokument21 SeitenVolumetría RedoxMelanie De los RíosNoch keine Bewertungen
- Informe 0, Bioquímica.Dokument6 SeitenInforme 0, Bioquímica.Fernanda RodriguezNoch keine Bewertungen
- Problemario U2Dokument6 SeitenProblemario U2JUAN GERARDO CIGARROA RENDONNoch keine Bewertungen
- Introducción: Química Analítica Cualitativa Se Centra en Identificar LaDokument76 SeitenIntroducción: Química Analítica Cualitativa Se Centra en Identificar LaJhonatan FloresNoch keine Bewertungen
- E2208004 6 Taller Smog FotoquimicoDokument8 SeitenE2208004 6 Taller Smog FotoquimicoRaul GranadosNoch keine Bewertungen
- Control de calidad en la Escuela Superior Politécnica de ChimborazoDokument10 SeitenControl de calidad en la Escuela Superior Politécnica de ChimborazoSamantha Villa OtavaloNoch keine Bewertungen
- Tarea 2. Sistemas BinariosDokument4 SeitenTarea 2. Sistemas BinariosMontsZs G-oNoch keine Bewertungen
- Calor de combustión y poder caloríficoDokument13 SeitenCalor de combustión y poder caloríficodiana perdomoNoch keine Bewertungen
- Problemario #2 GVDMDokument9 SeitenProblemario #2 GVDMMonse González ValenciaNoch keine Bewertungen
- Usos Del Diagrama de EllinghamDokument2 SeitenUsos Del Diagrama de EllinghamAreli Noriega CamachoNoch keine Bewertungen
- K.L Informe 1-Volumen Molar ParcialDokument23 SeitenK.L Informe 1-Volumen Molar Parcialespe1240% (1)
- Problemas Tema 8Dokument6 SeitenProblemas Tema 8CHOLOSIMEONENoch keine Bewertungen
- Análisis Instrumental Curvas EspectralesDokument6 SeitenAnálisis Instrumental Curvas EspectralesIsrael VegaNoch keine Bewertungen
- 04 Ejercicios Red OxDokument16 Seiten04 Ejercicios Red OxEduard RomeroNoch keine Bewertungen
- Manual Met Cuanti P1 y P2Dokument36 SeitenManual Met Cuanti P1 y P2Esteban RicoNoch keine Bewertungen
- Analisis Quimico - Tercera SemanaDokument18 SeitenAnalisis Quimico - Tercera SemanaYudithMontalvoRamirezNoch keine Bewertungen
- Problemas A Resolver PDFDokument41 SeitenProblemas A Resolver PDFAda ArenasNoch keine Bewertungen
- EquilibrioionicoDokument11 SeitenEquilibrioionicoElizabeth BecerraNoch keine Bewertungen
- Reglas Cahn Ingold PrelogDokument7 SeitenReglas Cahn Ingold Prelogbanana0714100% (1)
- BalanceDokument8 SeitenBalanceAlex Pascual ToapantaNoch keine Bewertungen
- Informe #03 Isomeros GeometricosDokument7 SeitenInforme #03 Isomeros GeometricosJoHana BolañosNoch keine Bewertungen
- PRACTICO 5 EstereoquímicaDokument2 SeitenPRACTICO 5 Estereoquímicaariel yana morga0% (1)
- EX PARCIAL QU114 2005 2aDokument1 SeiteEX PARCIAL QU114 2005 2aLuis Fernando Chalco RamosNoch keine Bewertungen
- Tema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Dokument17 SeitenTema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Alan YañezNoch keine Bewertungen
- Propiedades y compuestos del grupo 15Dokument37 SeitenPropiedades y compuestos del grupo 15ErikaRubioloNoch keine Bewertungen
- (QO2) Práctica 2 - Síntesis de Anaranjado de MetiloDokument5 Seiten(QO2) Práctica 2 - Síntesis de Anaranjado de MetiloYomara CollaguazoNoch keine Bewertungen
- 11solubilidad 1Dokument21 Seiten11solubilidad 1Miguel RomeroNoch keine Bewertungen
- Obtención de bromuro n-butiloDokument8 SeitenObtención de bromuro n-butiloQuique RosasNoch keine Bewertungen
- PaperDokument9 SeitenPapersergio valverdeNoch keine Bewertungen
- Informe N°11 CALOR DE SOLUBILIDADDokument14 SeitenInforme N°11 CALOR DE SOLUBILIDADangiehuangalNoch keine Bewertungen
- Ejercicios 2Dokument10 SeitenEjercicios 2Bruce Luis VEGA HASSINGERNoch keine Bewertungen
- Segundo Examen Departamental BME - 2013-2014Dokument7 SeitenSegundo Examen Departamental BME - 2013-2014JMGHNoch keine Bewertungen
- 2010 - PROBLEMAS CLASE 2010 Página WebDokument7 Seiten2010 - PROBLEMAS CLASE 2010 Página Webph0714Noch keine Bewertungen
- Determinacion de BicarbonatosDokument3 SeitenDeterminacion de BicarbonatosCgamez 123Noch keine Bewertungen
- PRACTICA 2 OrganicaDokument13 SeitenPRACTICA 2 OrganicaMichel Ramirez0% (1)
- Cuestionario 1 FQIIDokument4 SeitenCuestionario 1 FQIIBryan BautistaNoch keine Bewertungen
- Celdas Galvánicas y Su TermodinámicaDokument8 SeitenCeldas Galvánicas y Su TermodinámicaMiguel Jiménez FloresNoch keine Bewertungen
- Bare Module CostDokument11 SeitenBare Module CostYris RosarioNoch keine Bewertungen
- Informe Fisicoquímica-Laboratorio 2Dokument7 SeitenInforme Fisicoquímica-Laboratorio 2Heidy Montes GalarzaNoch keine Bewertungen
- Ramerca - Ejercicios Equilibrio QuimicoDokument35 SeitenRamerca - Ejercicios Equilibrio QuimicoDeiby DuarteNoch keine Bewertungen
- Unidad 1 Energía Asociada A Los Cambios QuímicosDokument124 SeitenUnidad 1 Energía Asociada A Los Cambios QuímicosSendy GarciaNoch keine Bewertungen
- PROBLEMARIO VolumetríaDokument5 SeitenPROBLEMARIO VolumetríaVerónica LópezNoch keine Bewertungen
- Momento1 Grupo 12Dokument25 SeitenMomento1 Grupo 12TCOAndres15 xNoch keine Bewertungen
- Practica 10-DinitracionDokument12 SeitenPractica 10-DinitracionCarlos F. López H.Noch keine Bewertungen
- Serie 3 Equilibrio Quimico 4540Dokument2 SeitenSerie 3 Equilibrio Quimico 4540Yassel4Noch keine Bewertungen
- Trabajo de LibroDokument204 SeitenTrabajo de LibroJoshmanAndréValarezoReyesNoch keine Bewertungen
- Problemas de FasesDokument7 SeitenProblemas de FasesIván0% (1)
- Calor de Neutralización (Fisicoquimica 1)Dokument4 SeitenCalor de Neutralización (Fisicoquimica 1)gerson velezNoch keine Bewertungen
- U I V3Dokument1 SeiteU I V3Riix Teken CarmonaNoch keine Bewertungen
- 003Dokument16 Seiten003astroboyatlasNoch keine Bewertungen
- Des ArrolloDokument25 SeitenDes ArrolloastroboyatlasNoch keine Bewertungen
- 003Dokument16 Seiten003astroboyatlasNoch keine Bewertungen
- Proysaba Jjavi 2Dokument130 SeitenProysaba Jjavi 2astroboyatlasNoch keine Bewertungen
- R 36732Dokument9 SeitenR 36732Fernando Sanchez LeonNoch keine Bewertungen
- Teoria PresaDokument18 SeitenTeoria PresaSaul Villca ChoquecallataNoch keine Bewertungen
- Calor - Métodos CalorimétricosDokument3 SeitenCalor - Métodos CalorimétricosPaco97Noch keine Bewertungen
- CLASE 3 - 2019 - I Materia, Sus EstadosDokument14 SeitenCLASE 3 - 2019 - I Materia, Sus Estadosjgonzales_323696Noch keine Bewertungen
- Propiedades Coligativas ResumenDokument10 SeitenPropiedades Coligativas ResumenKarla Patricia Barrientos LópezNoch keine Bewertungen
- S06 - M05 - PPT - Temperatura y Dilatacion - eDokument27 SeitenS06 - M05 - PPT - Temperatura y Dilatacion - eSebastian Villanueva CastromonteNoch keine Bewertungen
- Ciclo Brayton RegenerativoDokument5 SeitenCiclo Brayton Regenerativodavid quinterosNoch keine Bewertungen
- Equilibrio químico: iones cromato y dicromato, efectos de la concentración y temperaturaDokument4 SeitenEquilibrio químico: iones cromato y dicromato, efectos de la concentración y temperaturahpdam2Noch keine Bewertungen
- Taller 3 Medio Martes 21 MtaDokument4 SeitenTaller 3 Medio Martes 21 Mta5211241Noch keine Bewertungen
- Calor y TemperaturaDokument3 SeitenCalor y TemperaturaMichael AcostaNoch keine Bewertungen
- Taller 03 y 04 PDFDokument2 SeitenTaller 03 y 04 PDFandy vargasNoch keine Bewertungen
- Informe Difusion-MolecularDokument34 SeitenInforme Difusion-MolecularJenny Ojeda CastillonNoch keine Bewertungen
- Ejercicios Propuestos de Hidrostática Primera ParteDokument3 SeitenEjercicios Propuestos de Hidrostática Primera ParteJulio Cesar Barradas GutierrezNoch keine Bewertungen
- Informe 1 de Hidraulica de Canales AbierDokument20 SeitenInforme 1 de Hidraulica de Canales AbierWilder Jesus LunaNoch keine Bewertungen
- Mecánica de Suelos UMinutoDiosDokument2 SeitenMecánica de Suelos UMinutoDiosAngie BecerraNoch keine Bewertungen
- Resueltos TP1 Al TP5Dokument69 SeitenResueltos TP1 Al TP5mmalelaroccaNoch keine Bewertungen
- Sesion 10Dokument17 SeitenSesion 10JACINTO WILLCAMASCCONoch keine Bewertungen
- S5 Termoquímica Entalpia y EntropiaDokument18 SeitenS5 Termoquímica Entalpia y EntropiaManuel Posada quinterosNoch keine Bewertungen
- Maquinas y Equipos Termicos - Ing ElectromecanicaDokument9 SeitenMaquinas y Equipos Termicos - Ing ElectromecanicaElvis TuriNoch keine Bewertungen
- Sintesis TermodinamicaDokument6 SeitenSintesis TermodinamicaKarla TorresNoch keine Bewertungen
- PsicrometriaDokument50 SeitenPsicrometriaDeisy Alicia Yañez JhonsonNoch keine Bewertungen
- Fisica 5to - Parte 7 - CalorDokument15 SeitenFisica 5to - Parte 7 - CalorAisha FrankNoch keine Bewertungen
- TubingDokument31 SeitenTubingMaria Ines Lombardo100% (1)
- DiagramasDokument5 SeitenDiagramasAngel Trejo SegoviaNoch keine Bewertungen
- Termo I Investigacion Sustancia Puras FinalDokument10 SeitenTermo I Investigacion Sustancia Puras FinalKevin Patricio AsanzaNoch keine Bewertungen
- Nivel II - Guia de Estudio Nro 2 - Flexion Simple Flexion PuraDokument15 SeitenNivel II - Guia de Estudio Nro 2 - Flexion Simple Flexion PuraAugusto ArdissinoNoch keine Bewertungen
- Tesis OchoaDokument134 SeitenTesis Ochoadavid esteban BarraNoch keine Bewertungen
- Silabo de Mecanica de FluidosDokument5 SeitenSilabo de Mecanica de FluidosRomario CapilloNoch keine Bewertungen
- Instituto Tecnológico de TlalnepantlaDokument15 SeitenInstituto Tecnológico de TlalnepantlaCheche BarriosNoch keine Bewertungen
- Danfoss NoviembreDokument52 SeitenDanfoss NoviembreLoubet RosaritoNoch keine Bewertungen
- Capitulo4 PDFDokument25 SeitenCapitulo4 PDFninaquillaNoch keine Bewertungen