Beruflich Dokumente
Kultur Dokumente
Perovskitas LMO
Hochgeladen von
Jhon David Cueltan SolarteOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Perovskitas LMO
Hochgeladen von
Jhon David Cueltan SolarteCopyright:
Verfügbare Formate
Sntesis de una perovskita (LaMnO3) por el mtodo cermico.
Kelly Garca, Lorena Lpez
Departamento de Qumica
Facultad de Ciencias Exactas y Naturales
Resumen: En la prctica se realiz la sntesis de la perovskita (LaMnO
3
) mediante el mtodo
cermico con La
2
O
3
y MnO
2
. Se determin el porcentaje de Mn presente en la muestra , el cual fue
de 21.08% El contenido de los iones manganeso Mn(III) y Mn(IV) fue determinado por titulacin
redox, la muestra se disolvi en una solucin estndar de sulfato ferroso en exceso y por titulacin
con permanganato de potasio se determina el exceso de Fe(II).
Palabras claves: mtodo cermico, absorcin atmica, titulacin.
Abstract:
In practice, synthesis was performed of the perovskite (LaMnO3) by the method with La2O3 and
MnO2 ceramic. The percent of Mn present in the sample, which was 21.08% The content of
manganese ions Mn (III) and Mn (IV) was determined by redox titration, the sample is dissolved in
a standard solution of ferrous sulfate excess and by titration with potassium permanganate is
determined excess Fe (II).
Keywords: ceramic method, atomic absorption titration.
INTRODUCCIN
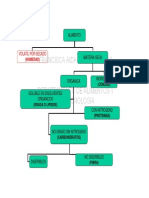
Las manganitas son una amplia familia de
materiales cermicos cristalinos (fig 1), cuya
estequiometria general es ABO
3
, donde A es
el catin mayor y, B el menor. Cuando el
tomo B es substituido por Manganeso estos
compuestos adquieren el nombre de
manganitas. Las manganitas tienen una
composicin qumica: A1-xBxMnO
3
; donde
las posiciones A pueden ser ocupadas por
iones alcalinos, alcalinotrreos o tierras raras
y las posiciones B estn ocupadas
generalmente por un metal de transicin.
Estos compuestos constituyen una de las
estructuras ms bsicas e importantes, que
proporcionan versatilidad y un amplio
potencial de aplicaciones tecnolgicas, tales
como sensores, imanes permanentes,
catalizadores, pigmentos, etc[1-2].
Recientemente se ha puesto atencin en sus
propiedades magnticas y elctricas,
especialmente en la magneto resistencia
colosal (GMR) [3-4], y en la posibilidad de
usarla como material para la fabricacin de
ctodos en las celdas de combustible de xido
slido [5]. La fabricacin de ctodos a partir
de polvos de manganitas de lantano dopadas
con Ca es de suma importancia para el
correcto desempeo de stas celdas, debido a
que poseen conductividad mixta, tanto inica
como electrnica con altos valores para esta
ltima. Adicionalmente, si se emplea el
mtodo adecuado de conformado (metalurgia
de polvos), se puede conseguir un flujo
controlable de oxgeno molecular a travs del
ctodo, en funcin de su grado de porosidad
que depende de las condiciones de
compactacin y sntesis de los polvos [6].
Estudios anteriores a este trabajo muestran
que el proceso mecano-qumico es un mtodo
capaz de sintetizar cermicos avanzados a
partir de mezclas de xidos precursores, para
el caso particular de este estudio, manganita
de lantano, LaMnO
3
, LM. [7].
Fig 1.
PROCEDIMIENTO
SNTESIS
1.Se pes 1,70 g de La
2
O
3
y 0,90 g de MnO
2
,
y se macero combinando los dos oxidos
Se llev a la mufla a 1000C durante 48 horas
DETERMINACIN DE Mn EN LA
MUESTRA
1. Una porcin 50 mg se transfiri a un
matraz Erlenmeyer de 500 ml
2. se disolvi en una mezcla de 15 ml
de HNO
3
conc. y 5 ml de H
2
O
2
. 30%
3. se aadi despus (H
2
SO
4
3 ml)
mediante la liberacin desde una
pipeta colocada en contacto con la
superficie interior del matraz. La
mayor parte del perxido se elimin
entonces al calentar el matraz hasta
que los vapores de SO
3
eran visibles.
4. Despus de enfriar la mezcla, se
aadieron lentamente 50 ml de HNO
3
3% .
5. El matraz se sumergi en un bao de
hielo
6. se aadi 0,5 g de bismutato de
sodio.
7. Despus se aadi 50 ml de solucin
fra 3% de HNO3.
8. El Exceso NaBiO
3
se elimin por
filtracin de la solucin con succin
9. El residuo se lava con 3% de HNO3
fro para eliminar la adhesin cido
permangnico, que posteriormente se
recolectaron en el matraz de
filtracin.
10. se aade sulfato ferroso amnico (25
ml de 0,05 N) al matraz para reducir
la totalidad de la cido
permangnico.
El exceso de hierro ferroso se valora
entonces con 0.05 N KMnO
4
hasta que se
obtiene un color rosa permanente. Varias
determinaciones de ttulo se hicieron por el
procedimiento anterior usando cantidades
idnticas de HNO
3
, H
2
SO
4
, H
2
0
2
, sulfato de
amonio ferroso y NaBiO
3
tal como se utiliza
anteriormente durante el anlisis de la
muestra.
1. La muestra pulverizada (100 mg ) se
transfiere a un matraz Erlenmeyer de
125 ml
2. se disolvi en 20,0 ml de 0,05 N
sulfato de amonio ferroso, que
contiene 5% de H
2
SO
4
en volumen.
3. La solucin se dej reposar varias
horas o durante la noche para la
disolucin completa de la muestra.
4. El poder de oxidacin de Mn (III) y
Mn (IV) se expresa en trminos de
miliequivalentes de Fe (II) se
determina por valoracin por
retroceso del exceso de Fe (II) con
0.1 N KMnO
4
.
RESULTADOS y DISCUSIONES
Mn%= (26,1 3,1) x 0,05 x 0,0110 x 100%
0,06
= 21,08%
Tericamente el porcentaje de manganeso
debi ser de 22,7%
Con anterioridad se realiz la valoracin de
15ml de FeSO4.7H20 a 0,1M utilizando
KMnO
4
0,1N, determinando que el volumen
requerido de permanganato en la titulacin
fue de 14.7ml. mientras que el valor teorico
para esta titulacin es de 15ml.
Porcentaje de error en la titulacion
Cuando se adiciono el sulfato de hierro a la
perovskita ya era conocida la cantidad
requerida de titulante para este volumen de
sulfato de hierro. Posteriormente al realizar la
nueva titulacin con LaMnO
3
. La cantidad
de titulante disminuyo de 15ml requeridos a
13,2ml de KMnO
4
ya que al contener en la
perovskita un ion Mn(III) este reacciono
oxidando una pequea cantidad del hierro
determinada por la diferencia entre el
volumen requerido para la titulacin en
blanco requerida y la titulacin hecha
posteriormente.
Con esto se obtuvo que el porcentaje de
manganeso total en la muestra fue de 10,78%,
con un error del 2% igualmente. Este dato fue
similar al obtenido por el mtodo de absocion
atmica
Se determin el poder de oxidacion de
manganeso (III) y (IV) expresando segn los
miliequivalentes de el Fe(II) dados por la
titulacin .
La frmula utilizada fue:
( ) ()
Donde
A: ml de KMnO
4
para valorar Fe(II)
(volumen original de la solucin de hierro)
B: ml de KMnO
4
para titular el exceso de Fe
II
C: concentracin de KMnO
4
El poder de oxidacin de la muestra fue de
0,18 = ()en miliequivalentes
Por ltimo el potencial de oxidacin de la
muestra fue utilizado para despejar las
cantidades de Mn(III) Y Mn(IV)
comparndolas con el resultado terico que se
debi obtener de manganeso.
() () ()
()
%Mn(III)
() % Mn(IV)
La cantidad de Mn(III) fue mayor que la
cantidad de Mn(IV) en la muestra.
Este resultado a pesar de ser comparado con
el terico excedi a este.
Segn la literatura en este tipo de perovskita
el porcentaje de Mn(IV) es mnimo, por lo
cual se deduce que el porcentaje de Mn(III)
es el correcto y que el error es encontrado en
el Mn(IV).
Conclusiones:
La baja pureza de la sal se debe al
mtodo de sntesis utilizado ya que el
mtodo cermico presenta mltiples
desventajas, como inseguridad de la
obtencin de productos puros debido
a la incompatibilidad de los xidos
simples.
La estructura cristalina tipo
perovskita puede ser distorsionada a
conveniencia mediante la eleccin de
los elementos que la constituyen, la
variacin de temperatura o de
presin.
La variacin en el contenido de
diferentes estados de oxidacin para
el manganeso, puede variar segn la
perovskita sintetizada, y segn las
condiciones en las cuales se sintetizo.
el porcentaje elevado de Mn(IV)
compensa las cargas faltantes o
sobrantes al adicionar otros
compuestos .por lo cual la perovskita
LaMnO
3
al no contener muchos de
estos iones resulta ser de las mas
estables.
REFERENCIAS BIBLIOGRAFICAS
[1] Voorhoeve RJH, Johnson DW, Remeika
JP, Gallagher PK. Science. 1977; 195: 827-
833.
[2] Zhang Q, Saito F. Journal of Alloys and
Compounds. 2000; 297: 99-103.
[3] Urushibara A, Moritomo Y, Arima T,
Asamitsu A, Kido G, Tokura Y. Physical
Review B. 1995; 51 (20): 14103-14109.
[4] Coey JMD, Viret M, von Molnr S.
Advanced in Physics. 1999; 48 (2): 167-293.
[5] Kindermann L, Das D, Nickel H, Hilpert
K,
[6] Appel CC, Poulson FW. J. Electrochem.
Soc. 1997; 144 (2): 717-720.
[7] Corts Escobedo CA, Snchez-De Jess
F,
Bolarn Mir AM, Muoz-Saldaa. J. Physica
Status Solidi(c). 2007; 4 (11): 4054-4063.
[8] Bolarn AM, Snchez F, Palomares S,
Aguilar JA, Torres-Villaseor G. Journal of
Alloys and Compounds. 2007; 436: 335-340.
Das könnte Ihnen auch gefallen
- Guitarra PDFDokument14 SeitenGuitarra PDFZAHID YASELGANoch keine Bewertungen
- Determinacion de Cenizas TotalesDokument21 SeitenDeterminacion de Cenizas Totalesaraceli_ga_saNoch keine Bewertungen
- India YaraDokument24 SeitenIndia YaraXSECRET666Noch keine Bewertungen
- Decreto 0585 02 de Abril de 2018Dokument13 SeitenDecreto 0585 02 de Abril de 2018Jhon David Cueltan SolarteNoch keine Bewertungen
- PH Vs Ácidez DornicDokument2 SeitenPH Vs Ácidez DornicJhon David Cueltan SolarteNoch keine Bewertungen
- El Cuajo Carlos Ramirez de ChileDokument9 SeitenEl Cuajo Carlos Ramirez de ChilecarlosoricoNoch keine Bewertungen
- Mercury Instruments - TecnologíaDokument3 SeitenMercury Instruments - TecnologíaJhon David Cueltan SolarteNoch keine Bewertungen
- Métodos Normalizados para El Análisis de Aguas Potables y Residuales.Dokument100 SeitenMétodos Normalizados para El Análisis de Aguas Potables y Residuales.Jhon David Cueltan Solarte100% (2)
- Lab #4. Guia Analisis de Alcoholes Por CromatografíaDokument4 SeitenLab #4. Guia Analisis de Alcoholes Por CromatografíaJhon David Cueltan SolarteNoch keine Bewertungen
- Reporte de Practia 5. Equipo 3Dokument10 SeitenReporte de Practia 5. Equipo 3Arthur PendragónNoch keine Bewertungen
- Ejercicios de Balanceo de Ecuaciones QuimicasDokument3 SeitenEjercicios de Balanceo de Ecuaciones Quimicas1977dianaNoch keine Bewertungen
- Determinación de Hipoclorito y Vitamina C Por Volumetría de Oxido1Dokument19 SeitenDeterminación de Hipoclorito y Vitamina C Por Volumetría de Oxido1Nicole GilNoch keine Bewertungen
- Informe Química N°4 OBTENCION DE ISOMEROSDokument8 SeitenInforme Química N°4 OBTENCION DE ISOMEROSCamilo GaravitoNoch keine Bewertungen
- Manual de Verificador de Gas 2021 Rl-Cons-1Dokument52 SeitenManual de Verificador de Gas 2021 Rl-Cons-1jersson antonioNoch keine Bewertungen
- Balanceo Ión Electrón en Medio AcidoDokument3 SeitenBalanceo Ión Electrón en Medio AcidoJorge Méndez100% (1)
- Preguntas Icfes ElectroquimicaDokument3 SeitenPreguntas Icfes ElectroquimicaAnonymous p52NJPskSz43% (7)
- Protocolo para AutismoDokument44 SeitenProtocolo para AutismoAndre3893100% (3)
- Proceso de BiotransformaciónDokument12 SeitenProceso de BiotransformaciónlouisedeblackNoch keine Bewertungen
- Introduccion A La Nomenclatura de Compuestos InorganicosDokument10 SeitenIntroduccion A La Nomenclatura de Compuestos InorganicosFidel Morales100% (3)
- Laboratorio 6 Quimica 2Dokument3 SeitenLaboratorio 6 Quimica 2Merelin Piña RodriguezNoch keine Bewertungen
- Repaso de QuímicaDokument5 SeitenRepaso de QuímicaErendira Alavez MonjarasNoch keine Bewertungen
- Análisis de Falla CalderasDokument13 SeitenAnálisis de Falla CalderasFuentes Cristhian JohnNoch keine Bewertungen
- Problemas SOBRE BIOENERGÉTICADokument2 SeitenProblemas SOBRE BIOENERGÉTICAPaula Báez SolanoNoch keine Bewertungen
- Autonoma Tomas Frìas Uatf Informe CorrectoDokument15 SeitenAutonoma Tomas Frìas Uatf Informe CorrectoVICTOR JANCKO FERNANDEZNoch keine Bewertungen
- 2 Plan de Leccion QUIMICA DEL FUEGO PDFDokument31 Seiten2 Plan de Leccion QUIMICA DEL FUEGO PDFIsabel Bracamonte0% (1)
- Guía 2. Nomenclatura Hidróxidos-ÁcidosDokument7 SeitenGuía 2. Nomenclatura Hidróxidos-ÁcidosSergio Pinzon SerranoNoch keine Bewertungen
- Presentacion Laboratorio # 3 Nomenclatura de Compuestos InorganicosDokument26 SeitenPresentacion Laboratorio # 3 Nomenclatura de Compuestos InorganicosJorge LopezNoch keine Bewertungen
- Taller UNIDAD 3. Metabolismo MicrobianoDokument4 SeitenTaller UNIDAD 3. Metabolismo MicrobianoAndres NietoNoch keine Bewertungen
- Procesos UnitariosDokument4 SeitenProcesos UnitariosAida SaucedaNoch keine Bewertungen
- ESTEQUIOMETRIADokument20 SeitenESTEQUIOMETRIAmarilynvillegas8434Noch keine Bewertungen
- Corrosion Galvanica en Un Par Hierro-Cobre yDokument42 SeitenCorrosion Galvanica en Un Par Hierro-Cobre yFernando López100% (1)
- ADA 1. Glosario de Química AnalíticaDokument65 SeitenADA 1. Glosario de Química AnalíticaAriel Fuente100% (1)
- Unidad - 4 - Conservacion de La Masa y Energía - PARTE-1Dokument26 SeitenUnidad - 4 - Conservacion de La Masa y Energía - PARTE-1Daniel MendozaNoch keine Bewertungen
- Programa Analitico 3° QuimicaDokument6 SeitenPrograma Analitico 3° QuimicaDiana Lozano50% (2)
- Que Es Una Ecuacion Redox para Quinto de SecundariaDokument5 SeitenQue Es Una Ecuacion Redox para Quinto de SecundariaMarcia PereiraNoch keine Bewertungen
- Taller 4 TEV406Dokument9 SeitenTaller 4 TEV406NataliaNoch keine Bewertungen
- Modulo 1 Procedimientos TecnicosDokument83 SeitenModulo 1 Procedimientos TecnicosLeandro PueblasNoch keine Bewertungen
- Volumetrias y Volumetria de PrecipitacionDokument51 SeitenVolumetrias y Volumetria de PrecipitacionC'Denisse PalominoNoch keine Bewertungen