Beruflich Dokumente
Kultur Dokumente
Bases Fuertes y Debiles
Hochgeladen von
Wilmer Pinto0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
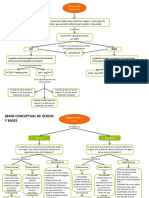
45 Ansichten15 Seiten- Una base fuerte se disocia completamente en agua, liberando iones hidroxilo. Algunos ejemplos son el hidróxido de potasio, sodio y bario.
- Existen varias teorías sobre ácidos y bases, como las de Arrhenius, Brønsted-Lowry y Lewis, que definen ácidos y bases de diferentes formas.
- La fuerza de un ácido o base depende de su constante de disociación. Ácidos y bases fuertes se disocian casi completamente en agua.
Originalbeschreibung:
Copyright
© © All Rights Reserved
Verfügbare Formate
DOC, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument melden- Una base fuerte se disocia completamente en agua, liberando iones hidroxilo. Algunos ejemplos son el hidróxido de potasio, sodio y bario.
- Existen varias teorías sobre ácidos y bases, como las de Arrhenius, Brønsted-Lowry y Lewis, que definen ácidos y bases de diferentes formas.
- La fuerza de un ácido o base depende de su constante de disociación. Ácidos y bases fuertes se disocian casi completamente en agua.
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOC, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
45 Ansichten15 SeitenBases Fuertes y Debiles
Hochgeladen von
Wilmer Pinto- Una base fuerte se disocia completamente en agua, liberando iones hidroxilo. Algunos ejemplos son el hidróxido de potasio, sodio y bario.
- Existen varias teorías sobre ácidos y bases, como las de Arrhenius, Brønsted-Lowry y Lewis, que definen ácidos y bases de diferentes formas.
- La fuerza de un ácido o base depende de su constante de disociación. Ácidos y bases fuertes se disocian casi completamente en agua.
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOC, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 15
En qumica, una base fuerte es aquella que se disocia cuantitativamente en disolucin
acuosa, en condiciones de presin y temperatura constantes. Una reaccin de este tipo
viene dada por:
para bases hidroxlicas, y
para bases no hidroxlicas.
Algunos ejemplos de bases, ordenadas de ms a menos !uertes:
"#$, hidrxido de potasio
%a&#$'
(
, hidrxido de bario
)s#$, hidrxido de cesio
*a#$, hidrxido de sodio
+r&#$'
(
, hidrxido de estroncio
)a&#$'
(
, hidrxido de calcio o cal apagada
,i#$, hidrxido de litio
-b#$, hidrxido de rubidio
$ay otras bases !uertes no hidroxlicas, cuya !uer.a se entiende seg/n la segunda
reaccin mostrada antes. Algunos ejemplos notables son:
n0%u,i, n0butil0litio
)
1
$
23
,i*, diisopropilamiduro de litio o ,4A
*a*$
(
, amiduro de sodio
*a$, hidruro de sodio
5E6A 22: 7)84#+ 9 %A+E+.
8*5-#4U))8:*.
5E#-;A+ 7)84#0%A+E. )#6<A-A)8:*.
=UE->A -E,A58?A 4E 7)84#+ 9
%A+E+
" 4E AU5#<-#5:,8+8+ 4E, A@UA.
)#*)E5# 4E p$.
)7,)U,# 4E, p$ 4E 7)84#+ 9 %A+E+ E*
48+#,U)8:*
$84-:,8+8+. )7,)U,# 4E, p$ 4E +A,E+ E* 48+#,U)8:*
A48+#,U)8#*E+ -E@U,A4#-A+B.
?A,#-A)8#*E+ 7)84#0%A+E. 8*48)A4#-E+.
INTRODUCCIN.
Equilibrio qumico
ECU8,8%-8# 8:*8)#
Electrolitos
TEORAS CIDO BASE. COMPARACIN.
D Lavoisier &2EEE': #bserv que sustancias como S y P en combinacin con O, y en
disolucin acuosa, daban lugar a sustancias cidas. <ens que el responsable era el
oxgeno, al que le llam principio acidificante.
D Davy &2F2G': #bserv que el HCl &cido muritico' era cido y no tena oxgeno,
luego dedujo que el hidrgeno era el responsable de la acide..
D Arrhenius &2FFE': Teora de la disociacin electroltica inica: )uando los
electrolitos &cidos, bases y sales' se disuelven en
, se disocian en partculas cargadas: O!"S.
: Equilibrio inico.
#cido: +ustancia que en disolucin acuosa, libera iones hidrgeno
%ase: +ustancia que en disolucin acuosa libera iones hidroxilo
*eutrali.acin:
D $ran%lin &2HGI': Estudi el sistema del amonaco
. +i el disolvente no era agua:
D &r'nsted y Lo(ry &2H(J':
#cido: 5oda especie capa. de ceder protones.
&ase: 5oda especie capa. de aceptar protones.
)eaccin: 5rans!erencia de protones.
+urge la idea de cido0base conjugados.
%rKnsted deca que los disolventes pueden actuar, tanto de cido como de base:
,as sustancias pueden actuar como cidos o como bases, dependiendo de la
sustancia a la que se les en!rente.
&r'nsted llam a los cidos y a las bases P)OTOLTOS, y al sistema cido0base,
SST"*A P)OTOL+TCO.
tanto los cido como las bases pueden estar cargados posit. o negat.
,as sustancias que pueden actuar tanto como cido como base, se llaman
A!$OLTOS, A!$,T")OS o A!$P),TCOS.
D ,eLis &2HJF':
*o todas las reaccines cido0base implicaban trans!erencia de protones, y sin embargo,
si se !ormaba siempre un enlace covalente dativo.
#cido: +ustancia que puede aceptar un par de electrones de otros grupos de tomos, para
!ormar un enlace covalente dativo.
&ase: +ustancia que tiene pares de electrones libres, capaces de ser compartidos para
!ormar enlaces covalentes dativos.
+on cidos de ,eLis:
)ationes sencillos:
+ustancias con orbitales incompletos:
.
COMPARATIVA DE TEORAS:
TEORA ARRHENIUS BRNSTED LEWIS
Def- cido
)ede
en
)ede )aptador de
Def- .ase
)ede
en
Acepta )ededor de
!eutrali/acin
=ormac. de
5rans!er. de
=orm. enl. cov. dat.
"cuacin
Limitacin +lo disol. acuosas
+lo trans!. de
5eora general
Arrhenius0&r'nsted1 &comparacin'
D 7cidos: %rKnsted amplia el concepto de cido a sustancias cargadas.
D %ases: %rKnsted amplia el concepto de base a sustancias que no son hidrxidos.
D %rKnsted amplia su teora a disoluciones no acuosas
.
FUERZA REATIVA DE CIDOS ! BASES.
D )onstantes de disociacin
7cido !uerte: AquMl que tuviese gran tendencia a ceder un protn.
%ase !uerte: AquMlla que tuviese gran tendencia a captar un protn.
#CDOS1
2 litro de disolucin muy diluida
)uanto mayor sea
, ms disociado estar el cido &ms !uerte ser el cido'.
&AS"S1
)onstante de autoprotlisis del agua.
Estudiemos el par
EFECTO NIVEADOR DE DISOVENTE "O DIFERENCIADOR#.
+e disocian en agua, prcticamente en un 2GGN: 7cidos !uertes.
El
ejerce un e!ecto di!erenciador entre el ,
, y el H$.
El
ejerce un e!ecto nivelador entre el H y el H&r.
+i utili.amos un disolvente menos bsico que el agua:
El Ac$ ejerce e!ecto di!erenciador entrte los tres.
+i utili.amos un disolvente ms bsico que el agua:
El
ejerce e!ecto nivelador entre los tres.
A travMs de la utili.acin de varios disolventes, se ha podido establecer la !uer.a
de los cidos, por orden de !uer.a, que en
no se distinguan debido a su gran !uer.a:
CONSTANTE DE AUTOPROTISIS DE A$UA.
<roducto inico del agua &depende de la 5O.'.
T234C5 (G (I JG IG 1G
Disolucin neutra-
D APadimos un cido:
4isolucin cida.
CONCEPTO DE pH.
S'rensen busc una !orma de trabajar con n/meros ms sencillos para las
concentraciones de
El concepto de p$ se usa tambiMn para otro tipo de concentraciones:
4isolucin cida
Q disolucin neutra
Q disolucin bsica
.
CCUO DE pH.
D pH de cido fuerte:
D pH de .ase fuerte:
D pH de cido d6.il:
+i ocurre:
D pH de .ase d6.il:
%IDRISIS.
#cidos diprtidos:
D
D
slo tenemos en cuenta el primer equilibrio, el segundo, es despreciable.
CCUO DE pH DE SAES.
,as sales se disocian completamente &excepto aquMllas que mantiene equilibrios de
solubilidad, y que no veremos en este tema'Q seg/n los iones en que se disocian
provengan de cidos o bases, !uertes o dMbiles, procederemos de la misma !orma que en
clculo del pH de cidos o bases.
DISOUCIONES RE$UADORAS.
VAORACIONES CIDO&BASE.
+i queremos conocer la concentracin de una sustancia &elemento o compuesto', en una
muestra problema, podemos acudir a un proceso de medida cuantitativa que se llama
7ALO)AC,! o 7OL8*"T)+A.
$ay tres tipos de volumetras:
7cido0base.
#xidacin0reduccin.
<recipitacin o de !ormacin de complejos.
#CDO0&AS" O D" !"8T)AL9AC,!:
$acemos reaccionar un cido con una base o viceversa.
El punto en el cual las concentraciones de cido y base son equivalentes &se neutrali.an
el uno al otro completamente', se llama punto !inal de la valoracin o P8!TO
"ST":8O*;T)CO.
En ese punto o punto de equivalencia, el cambio de pH es muy brusco.
INDICADORES.
+e utili.an para determinar el punto de equivalencia. ,os hay de dos tipos:
$sicos
:umicos
,os indicadores cido0base son cidos o bases dMbiles que cambian de color dentro de
un pequePo intervalo de pH. +uelen ser sustancias orgnicas, muy solubles en agua y
estables qumicamente.
<ara que se vea uno u otro color, la relacin entre la !orma bsica y la !orma cida ha de
ser
.
6edio cido:
6edio bsico:
6edio neutro:
a'
b'
c'
)o<o fenol
Das könnte Ihnen auch gefallen
- Soluciones AmortiguadorasDokument23 SeitenSoluciones AmortiguadorasJose Javier de Paz OlavarruethNoch keine Bewertungen
- CN Grado 9° - Periodo 3Dokument22 SeitenCN Grado 9° - Periodo 3Neyla Janneth Moreno GonzálezNoch keine Bewertungen
- Reporte 2 Tabla Periodica Operaciones SimplesDokument11 SeitenReporte 2 Tabla Periodica Operaciones SimplesDaniel Juarez Serrano100% (1)
- Tarea de QuímicaDokument6 SeitenTarea de QuímicaLuis De La TorreNoch keine Bewertungen
- INFORME de QuimiDokument10 SeitenINFORME de QuimiDarkray XestremeNoch keine Bewertungen
- TITULACIONDokument16 SeitenTITULACIONShe GiNoch keine Bewertungen
- Anteproyecto-Quimica-Analitica.-Titulacion PotenciometricaaDokument8 SeitenAnteproyecto-Quimica-Analitica.-Titulacion PotenciometricaaIraiz Styles HoranNoch keine Bewertungen
- 04 Ácidos y BasesDokument6 Seiten04 Ácidos y Basesromina rodriguezNoch keine Bewertungen
- Sales de Acidos Hidracidos 2.0Dokument12 SeitenSales de Acidos Hidracidos 2.0Mitzy RamosNoch keine Bewertungen
- Informe Nº1 Titulación Ácido Base - Química AnáliticaDokument13 SeitenInforme Nº1 Titulación Ácido Base - Química AnáliticaCristina nicol Saldaña vasquezNoch keine Bewertungen
- Laboratorio 6 Solubilidad Y Enlace Químico 1.-Introducción.Dokument5 SeitenLaboratorio 6 Solubilidad Y Enlace Químico 1.-Introducción.Ramiro PoquechoqueNoch keine Bewertungen
- IndiceDokument7 SeitenIndiceRudith MartinezNoch keine Bewertungen
- Guia Lab 6Dokument3 SeitenGuia Lab 6Alberto Gutiérrez QuispeNoch keine Bewertungen
- 15 Ácidos y BasesDokument12 Seiten15 Ácidos y BasesÁlvaro Maldonado SantiagoNoch keine Bewertungen
- Acidez de Los Cationes MetalicosDokument7 SeitenAcidez de Los Cationes MetalicosLordEcsedNoch keine Bewertungen
- Marco Teórico AnalíticaDokument6 SeitenMarco Teórico Analíticafrancisco medelNoch keine Bewertungen
- Curso TRATAMIENTO DE AGUA PARA CALDERASDokument49 SeitenCurso TRATAMIENTO DE AGUA PARA CALDERASMJZENoch keine Bewertungen
- QUI2BAC Tema 4 Equilibrios Acido-Base ResumenDokument32 SeitenQUI2BAC Tema 4 Equilibrios Acido-Base ResumenTrish' VaswaniNoch keine Bewertungen
- Cuestionario Nº1 y 2 Tema El AguaDokument6 SeitenCuestionario Nº1 y 2 Tema El AguaFaviolita ArauzNoch keine Bewertungen
- LABORATORIODokument13 SeitenLABORATORIOAndrea QuispeNoch keine Bewertungen
- Ácido SalicílicoDokument5 SeitenÁcido SalicílicopabloNoch keine Bewertungen
- CruzMartinez Yareli M15S1AI1Dokument8 SeitenCruzMartinez Yareli M15S1AI1Rudith MartinezNoch keine Bewertungen
- Presentación 1Dokument13 SeitenPresentación 1Jose Arturo Ramírez KingNoch keine Bewertungen
- Efecto Del Ion ComunDokument7 SeitenEfecto Del Ion ComunGisela ArmendarizNoch keine Bewertungen
- Acido BaseDokument8 SeitenAcido BaseDeivis DcNoch keine Bewertungen
- UNIDAD 3 - Química INDDokument69 SeitenUNIDAD 3 - Química INDJonathan Ramiro Grijalva herreraNoch keine Bewertungen
- Actividad Experimental 4Dokument12 SeitenActividad Experimental 4Jesus Yair Cruz AguilarNoch keine Bewertungen
- Cinematica 3esoDokument15 SeitenCinematica 3esoLuis Ñiquen QuesquenNoch keine Bewertungen
- UNIDAD 11. - CarbohidratosDokument57 SeitenUNIDAD 11. - CarbohidratosJackyABxDNoch keine Bewertungen
- Teorías Ácido-Base Equilibrios Ácido-Base. Contenido 1 EDITADODokument110 SeitenTeorías Ácido-Base Equilibrios Ácido-Base. Contenido 1 EDITADOMaría Del Carmen Velasco ChipreNoch keine Bewertungen
- Actividad Experimental 4Dokument10 SeitenActividad Experimental 4Jesus Yair Cruz AguilarNoch keine Bewertungen
- Determinación de PH y Soluciones Buffers PDFDokument42 SeitenDeterminación de PH y Soluciones Buffers PDFWendy GarcíaNoch keine Bewertungen
- Guia Titulacion Acido BaseDokument16 SeitenGuia Titulacion Acido BaseBiblio ScribNoch keine Bewertungen
- Sesión 7 Reacciones Acido BaseDokument32 SeitenSesión 7 Reacciones Acido BaseVane Cristobal LoayzaNoch keine Bewertungen
- Informe 6Dokument13 SeitenInforme 6Harold Ivan Niño CuevasNoch keine Bewertungen
- Pre Lab 1 AQIDokument13 SeitenPre Lab 1 AQIJavier Alejandro Contreras PachecoNoch keine Bewertungen
- Determinación de PH Con Pigmento Vegetal: Trabajo ExperimentalDokument3 SeitenDeterminación de PH Con Pigmento Vegetal: Trabajo ExperimentalCelso SelvasNoch keine Bewertungen
- Estudio Comparativo Del Comportamiento de Àcidos y Bases Fuertes y Dèbiles."Dokument11 SeitenEstudio Comparativo Del Comportamiento de Àcidos y Bases Fuertes y Dèbiles."micanel12Noch keine Bewertungen
- Informe Acidos y BasesDokument3 SeitenInforme Acidos y BasesANDERSON RUBIO CLEVESNoch keine Bewertungen
- Potencia de Oxidación (Eh) y Grado de Acidez (PH), Diagrama de Eh y PH .Alteraciones Hidrotermales y Su Relación Con El Eh y PHDokument33 SeitenPotencia de Oxidación (Eh) y Grado de Acidez (PH), Diagrama de Eh y PH .Alteraciones Hidrotermales y Su Relación Con El Eh y PHRaul AmaruNoch keine Bewertungen
- Equilibrio Ácido BaseDokument17 SeitenEquilibrio Ácido Basejosefaaa100% (1)
- RezaGonzalez Luis Miguel M14S3AI5Dokument9 SeitenRezaGonzalez Luis Miguel M14S3AI5Laura FloresNoch keine Bewertungen
- INFORME N°8 Sales Hidratadas.Dokument13 SeitenINFORME N°8 Sales Hidratadas.Melody TovarNoch keine Bewertungen
- p6 QuimicaDokument16 Seitenp6 QuimicaBrandon Daniel Bobadilla LopezNoch keine Bewertungen
- Ácidos, Bases y SalesDokument26 SeitenÁcidos, Bases y SalesHugo de la TorreNoch keine Bewertungen
- Laboratorio 8Dokument12 SeitenLaboratorio 8Crystal WoodwardNoch keine Bewertungen
- Lchavez PRUT TN1Dokument5 SeitenLchavez PRUT TN1Gustavo ChavezNoch keine Bewertungen
- Laboratorio Quimica Practica 10Dokument14 SeitenLaboratorio Quimica Practica 10Gabriela Sulca DelgadoNoch keine Bewertungen
- Post TareaDokument17 SeitenPost TareaSandra Villanueva BayonaNoch keine Bewertungen
- Clase de CienciasDokument27 SeitenClase de CienciasEnero RoceroNoch keine Bewertungen
- Polisacaridos PDFDokument17 SeitenPolisacaridos PDFBrian CeballosNoch keine Bewertungen
- Informe 6Dokument9 SeitenInforme 6Cristián Angel Mamani GutiérrezNoch keine Bewertungen
- Hidrolisis SalesDokument7 SeitenHidrolisis Salesfrankys200Noch keine Bewertungen
- Modulo 3. Semana8. Equilibrio Quimico Soluciones AcuosasDokument12 SeitenModulo 3. Semana8. Equilibrio Quimico Soluciones AcuosasLiz TrujilloNoch keine Bewertungen
- Monografia de Equilibrios Acido BaseDokument18 SeitenMonografia de Equilibrios Acido BaseRALHP LEONARDO RUIZ QUISPENoch keine Bewertungen
- Universidad de CartagenaDokument8 SeitenUniversidad de CartagenaDanielSandovalNoch keine Bewertungen
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadVon EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNoch keine Bewertungen
- Problemas resueltos de Química Analítica CuantitativaVon EverandProblemas resueltos de Química Analítica CuantitativaBewertung: 5 von 5 Sternen5/5 (3)
- Síntesis de para NitroanilinaDokument2 SeitenSíntesis de para NitroanilinaCristobal Cruz Cabrera100% (1)
- Un Nucleósido Es Una Molécula Monomérica Orgánica Que Integra Las Macromoléculas de Ácidos Nucleicos Que Resultan de La Unión CovalbiologiaparcialerDokument21 SeitenUn Nucleósido Es Una Molécula Monomérica Orgánica Que Integra Las Macromoléculas de Ácidos Nucleicos Que Resultan de La Unión CovalbiologiaparcialerJulian Armando Pernett CeballosNoch keine Bewertungen
- Apunte Físico Química - Equilibrio IónicoDokument34 SeitenApunte Físico Química - Equilibrio IónicoFelipe Ignacio Jorquera AguilarNoch keine Bewertungen
- Alcoholes, Aldehidos y Cetonas PDFDokument25 SeitenAlcoholes, Aldehidos y Cetonas PDFLucero Lachos80% (5)
- Practica 4toDokument6 SeitenPractica 4toMiguel Daza MoscosoNoch keine Bewertungen
- Mapa Conceptual de PH, Acido y BaseDokument3 SeitenMapa Conceptual de PH, Acido y BaseDiz Mart Alexis60% (30)
- Alcanos, Alquenos y AlquinosDokument3 SeitenAlcanos, Alquenos y AlquinosRamonNoch keine Bewertungen
- NomenclaturasDokument7 SeitenNomenclaturasIvan NaranjoNoch keine Bewertungen
- Mecanismos de ReacciónDokument7 SeitenMecanismos de ReacciónrafaelticNoch keine Bewertungen
- LECCION 8 Compuestos ÓrganoMetálicosDokument12 SeitenLECCION 8 Compuestos ÓrganoMetálicosLuis Carlos AndradeNoch keine Bewertungen
- Apuntes Biologia 2º 2011Dokument281 SeitenApuntes Biologia 2º 2011Isabel Alvarez Garcia100% (1)
- Hidrólisis Ácido AcetilsalicílicoDokument6 SeitenHidrólisis Ácido AcetilsalicílicojhoanaNoch keine Bewertungen
- Metales AlcalinotérreosDokument7 SeitenMetales AlcalinotérreosEzeq Morales MartiNoch keine Bewertungen
- Compuestos Inorganicos Del SueloDokument6 SeitenCompuestos Inorganicos Del SueloAngelica RomeroNoch keine Bewertungen
- Guia Enlace Quimico 10Dokument6 SeitenGuia Enlace Quimico 10lucia100% (1)
- Practica 1 Reacciones de AdicionDokument5 SeitenPractica 1 Reacciones de AdicionOdalhyz CabreraNoch keine Bewertungen
- Reacciones de Aminoácidos y ProteínasDokument1 SeiteReacciones de Aminoácidos y ProteínasClaudiaNoch keine Bewertungen
- LibroFisicaQuimica4 ESO.29Dokument136 SeitenLibroFisicaQuimica4 ESO.29Arsenio Toston CalabozoNoch keine Bewertungen
- Solidos CristalinosDokument6 SeitenSolidos Cristalinospruebprueba145Noch keine Bewertungen
- AlquenosDokument4 SeitenAlquenosbrayblansNoch keine Bewertungen
- Estrategias CatalíticasDokument20 SeitenEstrategias CatalíticasjoselynNoch keine Bewertungen
- Vidrios y CristalesDokument31 SeitenVidrios y CristalesJorge Ysmael Rodríguez FernándezNoch keine Bewertungen
- Practica No. 6 Equilibrio de ComplejosDokument5 SeitenPractica No. 6 Equilibrio de ComplejosJames Cantillo BernalNoch keine Bewertungen
- Química de Las DrogasDokument20 SeitenQuímica de Las Drogascharlybad86Noch keine Bewertungen
- Expo Olefinas 120606212042 Phpapp02Dokument44 SeitenExpo Olefinas 120606212042 Phpapp02Danny Lugo100% (1)
- Dif 4Dokument11 SeitenDif 4Ricardo GarciaNoch keine Bewertungen
- 4.1.1 HidrocarburosDokument8 Seiten4.1.1 HidrocarburosJosé CandiaNoch keine Bewertungen
- Ejercicios PropuestosDokument16 SeitenEjercicios PropuestosJennifer Silva BedoyaNoch keine Bewertungen
- Enlace CovalenteDokument13 SeitenEnlace CovalenteDamn Lord YeahNoch keine Bewertungen
- Redes CristalinasDokument6 SeitenRedes CristalinasnayemiauNoch keine Bewertungen