Beruflich Dokumente
Kultur Dokumente
Roteiros de Práticas EAD PDF
Hochgeladen von
Leonardo PhillipsOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Roteiros de Práticas EAD PDF
Hochgeladen von
Leonardo PhillipsCopyright:
Verfügbare Formate
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 01 - QUMICA INORGNICA I
REAES QUMICAS E FATORES QUE AS INFLUENCIAM
Prof Cleide Riccio
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
01 REAO QUMICA E FATORES QUE AS INFLUENCIAM
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/_____________
OBJETIVOS:
Atravs deste experimento o aluno firmar os seus conhecimentos tericos.
a) Caracterizar as evidncias e prever as ocorrncias de reaes qumicas;
b) Realizar reaes qumicas diversas, equacion-las e classific-las;
c) Determinar os agentes oxidante e redutor nas reaes de oxirreduo;
d) Diferenciar os meios cido e bsico fazendo uso de papel de tornassol.
e) Identificar gases pelo seu cheiro caracterstico.
f) Distinguir processos endotrmicos dos exotrmicos;
g) Verificar a influncia de alguns fatores na velocidade de reaes qumicas.
INTRODUO TERICA: Os fenmenos so transformaes sofridas pela matria e
podem ser divididos em fsicos e qumicos. sabido que a Qumica a cincia da
transformao onde as substncias se transformam em outras, isto , sofrem reaes qumicas
e so representadas por meio de equaes qumicas devidamente balanceadas onde:
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
REAGENTES PRODUTOS
(um ou mais) (um ou mais)
Essa seta indica transformao
Acima ou abaixo da seta indicam-se as condies de ocorrncia da reao com as simbologias:
A = calor; = luz; ; cat = catalisador; aq = meio aquoso;
Se ocorrer formao de um precipitado = + ou (s)
- Se ocorrer desprendimento gasoso = |
- Se for reao reversvel = duas setas em sentidos contrrios
- Quando necessrio especifica-se a temperatura e a presso.
A representao grfica e abreviada de uma reao qumica pode ser pela equao
qumica geral ou, quando envolver ons, por uma equao inica e inica lquida ou
simplificada.
REAO: nitrato de chumbo II (aq) reage com cloreto de sdio (aq) resultando em
cloreto de chumbo II (s) e nitrato de sdio (aq).
Equao geral: Pb (NO
3
)
2
+ 2 NaCl PbCl
2
+ + 2NaNO
3
Equao inica: Pb
2+
. 2NO
3
-
+ 2Na
+
. 2Cl
-
PbCl
2 (s)
+ 2Na
+
.2NO
3
-
Equao inica lquida (ou simplificada): Pb
2+
+ 2Cl
-
PbCl
2 (s)
Note que neste caso inclui apenas as espcies qumicas que esto envolvidas diretamente (ou
efetivamente) na reao.
As reaes esto classificadas segundo alguns critrios como:
= eletricidade
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
I .Quanto ao calor envolvido: endotrmicas e exotrmicas.
II. Quanto velocidade da reao: rpidas e lentas
III.Quanto reversibilidade: reversveis e irreversveis.
IV.Quanto ao estado fsico de reagentes e produtos: homogneas e heterogneas.
V.Quanto variao de complexidade (tipos de reaes): adio ou sntese (total e parcial),
decomposio ou anlise, deslocamento, dupla troca (de neutralizao, de precipitao, com
formao de substncia voltil, com formao de cido ou base fraca) e oxirreduo.
Algumas REAES DE DECOMPOSIO recebem nomes especiais pirlise ou calcinao
(por ao do calor), fotlise (por ao da luz), eletrlise (por ao da eletricidade).
A reao de hidrlise salina a reao da gua com os ctions/ou nions fracos do sal gerando
ons H
+
(aq)
e/ou OH
-
(aq)
. Pode-se, a partir da, prever qualitativamente o pH da soluo aquosa do
sal. Assim, temos a hidrlise salina do nitrato de zinco (sal de cido forte e base fraca):
Eq. Geral: Zn(NO
3
)
2
+ 2H
2
O
A
Zn(OH)
2
+ + 2HNO
3
Eq. inica: Zn
2+
. 2NO
3
-
+ 2H
2
O
A
Zn(OH)
2
+ + 2H
+
. 2NO
3
-
Eq. Inica simplificada: Zn
2+
+ 2H
2
O
A
Zn(OH)
2
++2H
+
(sol. resultante: cida)
A velocidade de uma reao determinada com base no tempo que se leva para o consumo dos
reagentes e/ou na formao dos produtos como superfcie de contato (quanto maior mais rpida
ser a reao), energia luminosa (provoca ou favorece a reao), catalisador (acelera a
velocidade da reao), temperatura (aumento o nmero de choques) etc.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
MATERIAL
VIDRARIAS E ACESSRIOS REAGENTES
Bquer de 25 ml (02) /100 ou 150 mL (01) Mrmore em p e em pequenos pedaos
Pipetas graduadas de 5 mL - 05 Sol. 1 mol/l de hidrxido de sdio
Proveta de 5ml/10 ml - 03 Sol. 1 mol/l, 6 mol/L de cido Sulfrico
Erlenmeyer de 125 ou 250 ml - 01 Sol. 1 mol/l de nitrato de prata
Tubo de ensaio - 15 Sol. 2,0 mol/l de cloreto de amnio
Estante para tubos de ensaio Sol. a 20% m/v de cloreto de ferro III
Pina de madeira Sol. 0,1 mol/l de nitrato de chumbo II
Basto de vidro - 02 Sol. 1 mol/l de cromato de potssio
Esptula - 01 Sol. 0,1 mol/l de permanganato de potssio
Conta-gotas - 05 Sol. 0,1 mol/l de Dicromato de potssio
Termmetro - 02 lcool Etlico PA
Papel de tornassol vermelho
Papel de tornassol azul
Papel de filtro qualitativo
Lamparina
Fsforo
OBSERVAES: ANOTE TUDO O QUE VOC OBSERVAR.
Para todos os experimentos verifique se ocorre variao de temperatura e qualquer mudana
na mistura.
ATENO: No manuseie nenhuma substncia diretamente com as mos e lave-as sempre
ao trmino da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas
- Utilize bombonas apropriadas para descartes.
- Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
PROCEDIMENTO
PARTE A.
1) Num tubo de ensaio colocar uma pequena poro de mrmore em p (~ 0,4 g) e acrescentar
4 ml de cido Sulfrico 6 mol/l. Colocar imediatamente uma tira de papel de tornassol azul
molhado com gua na boca do tubo. Abanar a boca do tubo e sentir o odor. Repetir o
procedimento com um pedao de mrmore. Verificar qual das reaes ocorreu mais rapidamente.
2) Num tubo de ensaio colocar 2 ml da soluo de Cloreto de Amnio 2 mol/l e 2 ml de soluo
de Hidrxido de Sdio 1 mol/l. Colocar imediatamente uma tira de papel de tornassol azul
vermelho molhado com gua na boca do tubo. Abanar a boca do tubo e sentir o odor. Se
necessrio,
aquecer o tubo em banho-maria.
2.1) Ao tubo anterior adicionar 1 ml de nitrato de prata 1 mol/l.
2.2) Dividir o contedo do tubo em 2.1 em dois tubos de ensaio. Deixar um no escuro
(dentro de um armrio) e o outro colocar luz do sol por ~ 15 minutos.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
PARTE B
3) Num tubo de ensaio colocar 1 ml de sol. de nitrato de chumbo II 1 mol/l e 1 ml de sol. de
cromato de potssio 1 mol/l .Observe o que acontece.
4) Num tubo de ensaio colocar 1 ml de soluo de Hidrxido de Sdio 1mol/l e 1ml de soluo.
de cido Sulfrico 1 mol/l.
PARTE C
5) Num tubo de ensaio colocar 1 ml de soluo de Permanganato de Potssio 0,1 mol/l e 1 ml
de soluo de cido Sulfrico 6 mol/l.
6) Colocar 5 ml de soluo de Dicromato de potssio 1 mol/l e 5 ml de cido Sulfrico 1 mol/l
em um erlenmeyer. Adicionar 5 ml de lcool Etlico e aquecer cuidadosamente. Observar.
Retirar do aquecimento e abanar a boca do tubo de forma a sentir leves odores.
PARTE D
7) Tomar dois bqueres de 50 ml, colocar em cada um deles 10 ml de gua destilada e
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
7) Tomar 2 beckeres de 25 ml, aquecer um deles at fervura. Acrescentar a cada um 10 gotas de
sol. a 20% m/v de cloreto de ferro III.Observar e anotar.
GUA FRIA GUA QUENTE
QUESTIONRIO
1) Quais foram as evidncias de que ocorreu algum fenmeno?
2) O que se faz minimamente necessrio para duas substncias reagirem?
3) possvel se visualizar a ocorrncia de uma reao qumica por 4 maneiras. Cite-as. E quando
isto no possvel, como saber se a reao ocorre?
4) Na PARTE D houve reao ao se adicionar a soluo salina na gua fria? Por qu? E na gua
quente? Escreva a equao qumica da reao que ocorreu na forma geral, inica e inica lquida (ou
simplificada). A partir da conclua: o meio resultante cido, bsico ou neutro? Por qu? possvel
chegar a essa concluso sem utilizar o mecanismo da reao que voc efetuou (chegando equao
simplificada)? Explique.
5)Quais fatores voc citaria como relevantes nas velocidades da reaes qumicas aqui realizadas?
Exemplifique-as.
6) A reao 6 realizada na PARTE C refere-se ao chamado bafmetro. Explique como ele funciona.
7)Equacione (devidamente balanceadas) todas as reaes envolvidas nos experimentos.Classifique-as
quanto variao de complexidade. Determine os agentes oxidante e redutor daquelas que forem de
oxirreduo. Qual voc verificou serem endotrmicas e exotrmicas?
REFERNCIAS
Mdulo da disciplina.
RUSSELL, JB. Qumica Geral 2. Editora McGraw-Hill Ltda.: So Paulo, 1982.
http://www2.fc.unesp.br/lvq/exp06.htm
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 02 - QUMICA INORGNICA I
CARACTERIZAO DAS FUNES QUMICAS
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
02 Caracterizao das funes Qumicas
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
INDICADORES CIDO-BASE / FORA DOS CIDOS
OBJETIVOS:
Identificar o carter cido ou bsico de alguns reagentes; analisar o carter cido/base de
alguns materiais de uso comercial; observar o comportamento de alguns indicadores em
relao aos meios cido, bsico e neutro, verificar e analisar o valor de pH de algumas
solues; atravs do uso de indicadores, mostrar uma viragem, usando substncia voltil;
descrever operacionalmente o que se entende por fora de um cido; interpretar a reao dos
cidos com o magnsio; relacionar com os graus de ionizao a fora dos cidos em reao
com o magnsio.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
INTRODUO TERICA: INDICADORES CIDO-BASE / FORA DOS CIDOS
Pode-se dizer que os cidos e as bases so substncias que apresentam caracteres
opostos ao se observar as suas propriedades funcionais; j os xidos (e os sais) podem
apresentar carter cido ou bsico dependendo dos seus elementos constituintes.
Esta acidez ou basicidade pode ser identificada por meio da mudana de cor de certas
substncias denominadas indicadores cido-base que so substncias, em geral orgnicas,
fracamente cidas ou fracamente bsicas, que se ionizam (ou se dissociam) no meio
apresentando uma colorao quando no-ionizada e outra colorao quando ionizada, isto ,
mudam gradualmente de cor em diferentes valores de pH.
Esquema bsico: HInd + OH
-
Ind
-
+ H
2
O (para um indicador cido)
Cor A Cor B
Ind OH + H
+
Ind
+
+ H
2
O (para um indicador bsico)
Cor C Cor D
Normalmente, a medida do pH de uma soluo aquosa pode ser feita com o auxlio de um
peagmetro aparelho que mede a condutividade eltrica da soluo e que possui uma escala
graduada em valores de pH - ou de um indicador cido-base (solues e pequenas tiras de papel
embebida num indicador ou numa mistura de indicadores).
O papel indicador universal ou papel de pH uma tira de papel embebida em misturas de
diversos indicadores cuja cor varia gradativamente, e possui uma escala numrica para valorar A
acidez ou basicidade de uma soluo (ou um material), cujos valores vo de zero at 14 e o valor
mdio (pH = 7) indica um meio neutro. Assim temos:
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Aumento da acidez aumento da basicidade
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Entre os diversos indicadores pode-se citar alm do papel indicador universal, papel de
tornassol (vermelho e azul), solues de fenolftalena, alaranjado de metila (Metilorange),
azul de Bromotimol, vermelho de metila, vermelho neutro, Timolftalena, negro de
eriocromo, etc. Vrias substncias e solues podem ser analisadas por esse mtodo, desde
que sua colorao no interfira na do indicador (quando em soluo).
A fora dos cidos determinada por sua capacidade de se ionizar em soluo aquosa.
Isso depende, entre outras coisas, do grau de ionizao da ligao entre o tomo de hidrognio
e o restante da molcula. Diz-se que um cido forte quando mais de 50% est ionizado, isto
, se ioniza quase que totalmente quando dissolvidos em gua; quando se ioniza entre 5% e
50% considerado moderado ou mdio; quando se ioniza abaixo de 5% considerado fraco,
isto , sua ionizao mnima.
ATENO:
- No manuseie nenhuma substncia diretamente com as mos e lave-as sempre ao trmino
da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento gasoso
e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas , utilize bombonas apropriadas para
descartes.
Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
MATERIAIS:
VIDRARIAS E ACESSRIOS REAGENTES
Vidro de relgio Vinagre comercial
Tubos de ensaio - 05 Magnsio em raspas
Pipeta de 2 ou 5 mL - 02 Soluo 1 mol/l de cido sulfrico
Proveta de 25 mL ou 50 mL - 05 Soluo 1 mol/l de cloreto de sdio, 1 mol/l de cloreto
de amnio, 1 mol/l de bicarbonato de sdio, 1 mol/l de
cloreto de Potssio
Erlenmeyer de 125 mL - 03 Soluo 0,1 mols/l de hidrxido de sdio
Basto de vidro Creme dental branco
Folhas de papel ofcio Fenolftalena 0,5% alcolico ; Metilorange 0,1%
Fita adesiva Azul de Bromotimol 0,04% alcolico
Piscete - 01 Sabo lquido
Bolas de borracha (Bexiga)- 03 Vinagre, gua sanitria, refrigerante incolor.
Conta-gotas 05 Papis de tornassol azul e vermelho,
Funil de vidro (pequeno) Papel indicador universal (papel de pH)
Papel de filtro, Lacto-purga,
Bquer de 50 mL e de 100 mL
01 de cada
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
PROCEDIMENTO
PARTE A : FORA DOS CIDOS
1)Tome trs erlenmeyer de 50 ml, rotule com o nome do cido abaixo e coloque dentro de cada
frasco 10 ml do cido indicado na TABELA A - cido Sulfrico, cido Actico e cido
Ntrico.
2)Infle, moderadamente, 3 bales de borracha. Repita a operao trs vezes, para tornar os
bales menos resistentes. Feito isso, deixe os bales vazios.
3) Pese trs pores de magnsio, cada uma com aproximadamente 0,3 g. ou uma pequena
poro na ponta da esptula, envolva cada poro num papel de filtro, frouxamente..
4) Deixe cair dentro do frasco o pacotinho de magnsio, prenda imediatamente o balo na
boca do erlenmeyer e prenda firmemente com uma fita adesiva ou um atilho. Cuide para que
no haja escapamento de gs.
5) Agite um pouco os frascos para que o magnsio entre em contato com o cido.
6) Anote o que se observa.
7) Faa observaes da altura do balo de borracha, em cada um dos tempos indicados na
TABELA A.
8) Enquanto espera a passagem do tempo realize os experimentos abaixo.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
PARTE B: ACIDEZ E BASICIDADE DO H
2
SO
4
E NAOH ATRAVS DE
INDICADORES
Proceder conforme descrito abaixo e anotar suas observaes na TABELA B.
1) Em 5 vidros de relgios colocar 3 gotas de H
2
SO
4
1 mol/l e 1 a 2 gotas da soluo
indicadora anotada na TABELA B. Duas das pores utilizar para fazer testes com os papis
de tornassol. Observar as cores. Com o papel indicador universal determinar o valor de pH de
cada soluo e anotar.
2) Em cinco vidros de relgio colocar 3 gotas de NaOH 1 mol/l e 1 a 2 gotas da soluo
indicadora anotada na TABELA B. Duas das pores utilizar para fazer testes com os papis
de tornassol. Observar as cores. Com o papel indicador universal determinar o valor de pH de
cada soluo e anotar.
3) Reservar para uso como comparativo para os experimentos seguintes.
PARTE C: ACIDEZ E BASICIDADE DE ALGUNS PRODUTOS COMERCIAIS
Ser dividido por equipe sendo que, deve ser mostrado s outras equipes os resultados
obtidos, para que completem a TABELA C.
PARTE D: SANGUE DO DIABO
1) Com o auxlio do basto de vidro, triture o comprimido de lacto-purga no bquer.
2) Acrescente 20 ml de gua e agite o sistema.
3)Filtre o sistema, recolhendo a soluo resultante no erlenmeyer.
4)Adicione 2 gotas de hidrxido de amnio P.A. soluo no erlenmeyer e observe.
5) Borrife com um conta gotas, em um pedao de pano ou papel algumas gotas de soluo
preparada.
Deixe o Sistema em repouso e observe. Anote.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
PARTE E: TESTANDO A ACIDEZ / BASICIDADE DE SOLUES SALINAS
1) Coloque em vidro de relgio 1 ml de cada soluo citada na TABELA E.
2) Determine o pH de cada soluo.
3) Adicione uma a duas gotas de vermelho de metila na mistura. Anote a cor.
PARTE F: TESTANDO O CREME DENTAL
1) Colocar 50 ml de gua destilada em um bquer e acrescentar a medida de 1 esptula de
creme dental. Agitar bem, at dissolver.
2) A seguir, dispor 4 bqueres em fila e colocar, em cada um, aproximadamente, 10 ml da
soluo de creme dental preparada.
3) Acrescentar 3 a 5 gotas de azul de bromotimol em cada bquer e anotar a cor da soluo
obtida.
4) No primeiro bquer, gotejar (ir contando o nmero de gotas adicionadas) cido Sulfrico at
ocorrer uma mudana permanente na cor da soluo. Anotar as cores observadas e o nmero de
gotas na TABELA D.
5) Proceder da mesma maneira nos outros bqueres substituindo o cido sulfrico por vinagre,
refrigerante contando sempre o nmero de gotas adicionadas para uma mudana permanente de
cor.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
FICHA DE RESULTADOS
TABELA A FORA DOS CIDOS
CIDOS
H
2
SO
4
HNO
3
CH
3
COOH
TEMPO
1 minuto
3 minutos
6 minutos
10 minutos
20 minutos
CONCLUSO:_______________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
TABELA B - ACIDEZ E BASICIDADE DO H
2
SO
4
E NAOH ATRAVS DE
INDICADORES
INDICADOR COR PRTICA TERICA (pesquisar)
Meio cido Meio bsico Meio cido Meio bsico
Fenolftalena
Metilorange
Azul de bromotimol
Tornassol azul
Tornassol Vermelho
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
CONCLUSO: TABELA B
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
TABELA C - ACIDEZ E BASICIDADE DE ALGUNS PRODUTOS COMERCIAIS
PRODUTO
COMERCIAL
COR DO
PRODU
TO
INDICADORES
Fenolftalena Azul de
Bromotimol
Metilorange
Papel de
tornassol
pH
Verm.
azul
Vinagre
gua
sanitria
gua da
torneira
Sabo
Liquido
Refrigerante
Concluso:_____________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
TABELA D - TESTANDO O CREME DENTAL
BQUER
Cor c/ azul de
bromotimol
cido
Sulfrico
Vinagre Refrigerante
cor gotas cor gotas cor gotas
01 -------- -------- -------- --------
02 -------- -------- -------- --------
03 -------- -------- -------- --------
CONCLUSO:________________________________________________________________
____________________________________________________________________________
____________________________________________________________________________
____________________________________________________________________________
TABELA E TESTANDO A ACIDEZ/BASICIDADE DE SOLUES SALINAS
CONCLUSO:______________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
SOLUO
NaCl NH
4
Cl KCl NaHCO
3
pH
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
QUESTIONRIO
1)Ordene os trs cidos usados, de acordo com a fora deles na reao com o magnsio. Explique
essa ordem de acordo com a teoria de Bronsted-Lowry.
2)Em qumica, a fora dos cidos depende do grau de ionizao. Para os cidos usados nesta
experincia, os graus de ionizao so, respectivamente, H
2
SO
4
(0,64), Vinagre (0,013), Voc
observa alguma relao entre estes valores e a intensidade das reaes dos cidos com o magnsio?
Comente.
3) Qual o principal componente de cada produto comercial abaixo (nome e frmula) ou que serviu
como referencial para o experimento realizado:
a) vinagre; b) gua sanitria; c) amonaco; d) suco de limo e) sabo em pedra; f) leite de magnsia.
g) sal de frutas h) refrigerante; i) antiferrugem.
4)Quando lavamos uma roupa com gua sanitria a mo fica lisa e escorregadia. Dos produtos
comerciais trabalhados (PARTE C) quais voc escolheria para neutralizar o efeito desse produto em
sua mo? Por qu?
5)Qual o principal cido que garante a acidez ao estmago? Qual o pH atingido? Dos produtos
comerciais trabalhados (PARTE C) quais voc escolheria para combater a acidez excessiva? Por
qu?
6)Por que a lacto-purga foi usada no experimento (PARTE D)?
7)Na PARTE F qual dos materiais teve que ser adicionado em maior quantidade para causar as
mudanas de cor? E qual em menor quantidade? Por qu?
8)As solues salinas, afinal, so neutras? Explique e exemplifique.
9)Defina zona ou faixa de viragem de um indicador. Quais os 2 requisitos desejveis para os
indicadores cido-base? Identifique 2 indicadores cidos e dois bsicos.
10)Como se faz a medida de pH de uma soluo?
11)A alterao de cor da fenolftalena, de incolor para rosa, deve-se a um aumento ou reduo de
pH? Explique.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
12) Ao se dissolver o creme dental branco em gua ocorreu uma reao qumica do seu
componente NaHCO
3
. Escreva a equao devidamente balanceada. O meio resultante apresenta
pH maior, menor ou igual a sete? Justifique.
TABELA INDICADORES
REFERNCIAS
Mdulo da disciplina.
RUSSELL, JB. Qumica Geral 2. Editora McGraw-Hill Ltda.: So Paulo, 1982.
http://www2.fc.unesp.br/lvq/exp06.htm
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 03 - QIMICA GERAL II
CINTICA QUMICA EFEITO DA TEMPERATURA
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
03 Cintica Qumica Efeito da temperatura
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
Professor(a): Viviana Maria da Silva Rocha
1. OBJETIVOS
Verificar a influncia da temperatura sobre a velocidade de uma reao.
Relacionar o efeito da temperatura com os pressupostos da teoria das colises.
2. FUNDAMENTAO TERICA
A cintica qumica fornece informaes de grande importncia sobre como
molculas, tomos ou ons interagem uns com os outros O ideal seria seguir cada partcula ao
longo de uma reao e, enquanto tcnicas mais sofisticadas so otimizadas, podemos usar
outras, mais simples, como observar a formao de produtos, ou o desaparecimento de
reagentes, durante um intervalo de tempo.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
De um modo geral possvel afirmar que a velocidade de uma reao aumenta com a
temperatura, entretanto, este aumento varia muito de reao para reao. A dependncia entre
a velocidade de uma reao e a temperatura foi descoberta por Arrhenius, em 1889 e
conhecida como equao de Arrhenius:
No qual, A o fator de frequncia, R, a constante dos gases ideais e T, temperatura absoluta.
A Equao de Arrhenius relaciona a velocidade de reao com a temperatura atravs da
Energia de Ativao, que corresponde quantidade mnima de energia necessria para iniciar
uma reao qumica.
De acordo com a equao de Arrhenius, o valor da constante de velocidade k aumenta com a
temperatura. Isto significa que um aumento da temperatura deve produzir um aumento da velocidade
da reao, o que usualmente, observado. Em qualquer temperatura deve existir uma distribuio, a
distribuio de Maxwell-Boltzmann, de energias cinticas moleculares numa substncia, e a
temperaturas mais elevadas essa distribuio se desloca no sentido de se ter maior nmero de
molculas rpidas e menos molculas lentas. (Lembrem da Vdeo Aula).
A equao de Arrhenius til porque expressa a relao quantitativa entre temperatura,
energia de ativao e constante de velocidade. O seu emprego mais til reside na
determinao da energia de uma reao, partindo de medidas de velocidade a diferentes
temperaturas.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Se a energia de ativao for elevada, a velocidade de reao muito sensvel variao de
temperatura, por exemplo, as reaes em fase gasosa, que s ocorrem a temperaturas
elevadas. Em contrapartida, as reaes que ocorrem nos seres vivos e as reaes enzimticas,
necessitam de baixa energia de ativao e so possveis temperatura ambiente.
ATENO
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas, utilize bombonas apropriadas para
descartes.
Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro).
EQUIPAMENTOS
Placa de aquecimento
Geladeira
VIDRARIAS
3 bqueres 100 ml
REAGENTES
3 comprimidos efervescentes (preferencialmente vitamina C)
PROCEDIMENTO
1. Separe 3 bqueres e numere-os de 1 a 3;
2. No bquer 1 coloque 100 ml de gua gelada;
3. No bquer 2 coloque 100 ml de gua temperatura ambiente;
4. No bquer 1 coloque 100 ml de gua quente;
5. Adicione, simultaneamente aos trs bqueres, um comprimido efervescente;
6. Observe e anote o que acontece em cada sistema.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
DADOS E RESULTADOS
Relatar o que foi observado na prtica e discutir os resultados obtidos de acordo com os
princpios tericos envolvidos.
QUESTIONRIO
1. Explique como a temperatura altera o comportamento das espcies no sistema reacional?
2. Justifique como um aumento de 10C na temperatura pode duplicar a velocidade de uma reao,
sendo que este acrscimo aumenta a freqncia de colises em apenas 2%.
3. Por que a panela de presso diminui o tempo de cozimento dos alimentos?
REFERNCIAS
Mdulo da disciplina.
RUSSELL, JB. Qumica Geral 2. Editora McGraw-Hill Ltda.: So Paulo, 1982.
http://www2.fc.unesp.br/lvq/exp06.htm
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 4 - CINTICA QUMICA EFEITO DO CATALISADOR
Professor(a): Viviana Maria da Silva Rocha
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
04 Cintica Qumica Efeito Do Catalisador
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
1.OBJETIVOS
Verificar a influncia de um catalisador sobre a decomposio do perxido de hidrognio.
Correlacionar este efeito a prticas do cotidiano.
2.FUNDAMENTAO TERICA
medida que uma reao qumica se processa as concentraes das espcies presentes no
meio reacional so alteradas. Assim, com o passar do tempo, enquanto a concentrao dos
reagentes diminui, a dos produtos aumenta. A partir da variao da concentrao das espcies
presentes no meio reacional, possvel calcular a velocidade com que a reao ocorre. A
velocidade das reaes objeto de estudo da cintica qumica e sofre influncia de fatores
como temperatura, presena de um catalisador, superfcie de contato e concentrao de
reagentes.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Os catalisadores so espcies que alteram a velocidade de uma reao qumica sem serem
consumidos durante o processo. Catalisadores so amplamente empregados em processos
industriais mas tambm atuam em reaes metablicas do organismo. As enzimas so os
principais catalisadores biolgicos.
ATENO:
- No manuseie nenhuma substncia diretamente com as mos e lave-as sempre ao trmino
da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento gasoso
e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas , utilize bombonas apropriadas para
descartes.
Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
VIDRARIAS
3 bqueres 100 ml
REAGENTES
Perxido de hidrognio (gua oxigenada 10 volumes)
Fermento biolgico fresco
Batata inglesa
.PROCEDIMENTO
Numere os 3 bqueres
Adicione 30 ml de perxido de hidrognio em cada um dos bqueres;
No bquer 2 acrescente aproximadamente 2 g (1 colher de ch) de fermento biolgico fresco;
No bquer 3 Adicione pequenos pedaos de batata;
Observar e anotar o que acontece nos 3 bqueres.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
4.DADOS E RESULTADOS
Relatar o que foi observado na prtica, bem como discutir os resultados obtidos.
5. QUESTIONRIO
1. Qual a diferena entre fermento qumico e fermento biolgico?
2. A velocidade da reao a mesma nos trs bqueres? Justifique.
3. Quais espcies catalisam a reao no bquer contendo fermento e batata?
4. Por que comum utilizar gua oxigenada na limpeza de feridas?
5. A reao qumica que ocorreu no experimento a mesma que ocorre na limpeza de feridas
com gua oxigenada. Escreva a equao qumica desta reao.
6. Explique de que forma o catalisador altera a velocidade de uma reao qumica.
6.REFERNCIAS
Mdulo da disciplina.
Braathen, P. C. et al. Entalpia de decomposio do perxido de hidrognio
. Disponvel em <http://qnesc.sbq.org.br/online/qnesc29/10-EEQ-6106.pdf> acesso em
24/07/2010.
RUSSELL, JB. Qumica Geral. Editora McGraw-Hill Ltda.: So Paulo, 1982.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 5 - CINTICA QUMICA SUPERFCIE DE CONTATO
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
05 Cintica Qumica Efeito DA SUPERFICIE DE CONTATO
Catalisador
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
Prof Viviana Maria da Silva Rocha
1.OBJETIVOS
Verificar como a superfcie de contato dos reagentes altera a velocidade de uma reao.
2.FUNDAMENTAO TERICA
As reaes qumicas ocorrem com velocidades diferentes, podendo ser alteradas por
modificao de algumas caractersticas dos reagentes e/ou produtos. A velocidade de uma
reao depende, entre outros fatores, das propriedades qumicas, da temperatura e da
concentrao dos reagentes e produtos. Quando numa reao qumica um dos reagentes se
encontra no estado slido, o tamanho das partculas um dos fatores que controla a
velocidade da reao. Como as partculas pequenas apresentam uma rea maior do que uma
partcula grande, considerando a mesma massa, a diminuio do tamanho da partcula
aumenta a superfcie de contato e, consequentemente, a velocidade da reao. Por exemplo,
mais fcil atear fogo em pequenos pedaos de papel que em pedaos grandes.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ATENO:
- No manuseie nenhuma substncia diretamente com as mos e lave-as sempre ao trmino
da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento gasoso
e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas , utilize bombonas apropriadas para
descartes.
Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
VIDRARIAS
2 bqueres 100 ml
REAGENTES
2 comprimidos efervescentes (preferencialmente vitamina C)
MATERIAIS DIVERSOS
Grau de Porcelana e Pistilo
PROCEDIMENTO
1.Numere dois bqueres;
2.Coloque 100 ml de gua no bquer 1 e no bquer 2;
3.Triture um dos comprimidos efervescentes com o auxlio de um pistilo;
4.Adicione, simultaneamente, o comprimido triturado no bquer 1 e o comprimido inteiro no
bquer 2.
Observe e anote o que acontece em ambos os bqueres.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
DADOS E RESULTADOS
Relatar o que foi observado na prtica, discutindo os resultados obtidos de acordo com os
princpios tericos envolvidos.
5.QUESTES
1. O que acontece quando trituramos um dos comprimidos efervescentes?
2. De que forma a triturao influencia na velocidade do processo?
3. Explique detalhadamente a forma como a superfcie de contato promove uma alterao na
velocidade das reaes.
4. De que forma a superfcie de contato afeta o tempo de cozimento dos alimentos?
6.REFERNCIAS
Mdulo da disciplina.
RUSSELL, JB. Qumica Geral 2. Editora McGraw-Hill Ltda.: So Paulo, 1982.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 6 - INORGNICA II
DENSIDADE COMO PROPRIEDADE CARACTERSTICA
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
06 Densidade como propriedade caracterstica
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
INTRODUO
As propriedades dos materiais so agrupadas em qumicas e fsicas. As propriedades qumicas
descrevem uma transformao qumica, tal como a interao de uma substncia com outra, ou a
transformao de uma substncia em outra. As propriedades fsicas no envolvem qualquer
mudana na composio ou identidade
da substncia, isto , so propriedades que podem ser observadas e medidas sem modificao de
sua composio como ex: Temperatura (T), presso (p), cor e densidade (d) .
Definies e conceitos:
D = m/v - A densidade absoluta tambm uma propriedade especfica, isto , cada substncia
pura tem uma densidade prpria, que a identifica e a diferencia das outras substncias.
A densidade relativa - de um material a relao entre a sua densidade absoluta
e a densidade absoluta de uma substncia estabelecida como padro. No clculo da densidade
relativa de slidos e lquidos, o padro usualmente escolhido a densidade
absoluta da gua, que igual a 1,000 kg dm-3 (equivalente a 1,000 g cm-3) a 4C
dado por = (H2 O , 4C) .
d = / 0
A densidade uma propriedade fsica importante e pode ser utilizada para distinguir um material
puro de um impuro (ou de ligas desse metal), pois a densidade dos materiais que no so puros
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
(misturas) uma funo da sua composio. Ela tambm pode ser utilizada na identificao e no
controle de qualidade de um determinado produto industrial, bem como ser relacionada com a
Concentrao de solues. Densidade de um slido pode ser determinada pesando-o
cuidadosamente e em seguida determinando seu volume.
Se o slido apresentar uma forma irregular (o que torna impossvel medir suas dimenses), o
volume poder ser determinado utilizando um mtodo de deslocamento. Basicamente,
determina-se a massa de uma amostra do slido e ento transfere-se quantitativamente
essamassa para um instrumento volumtrico graduado apropriado (ex: proveta ou bureta),
parcialmente cheio com gua (ou em algum lquido no qual o slido no flutue).
O slido deslocar um volume de lquido igual ao seu volume.
ATENO:
- No manuseie nenhuma substncia diretamente com as mos e lave-as sempre ao trmino
da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento gasoso
e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas , utilize bombonas apropriadas para
descartes.
Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
VIDRARIA
Proveta graduada de 100 ml
DIVERSOS
Papel toalha
Placa de cobre
Placa de Nquel ou 4 moedas de 1 real
EQUIPAMENTO
Balana
PROCEDIMENTO
Em uma proveta de 100 ml coloque gua at cerca de 80 ml .
Em seguida pese a moeda de um real e/ ou a placa de cobre .
Adicione as moedas e observe que haver deslocamento da gua. Anote.
Calcule o Volume subtraindo o V2 do V1 ( conforme a ilustrao acima) e obter o volume
do metal imerso.Calcule a Densidade utilizando a formula: D = M / V
Confirme na tabela o valor da densidade.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Tabela - Densidades aproximadas de algumas substncias
REFERNCIAS
Mdulo da disciplina.
RUSSELL, JB. Qumica Geral 2. Editora McGraw-Hill Ltda.: So Paulo, 1982.
http://www2.fc.unesp.br/lvq/exp06.htm
Substncia
Densidade ( g cm-3)
lcool 0,79
Alumnio 2,7
Lato 8,4
Cobre 8,9
Vidro 2,6
Ouro 19,3
Ferro 7,9
Mercrio 13,6
Nquel 8,9
Platina 21,4
Porcelana 2,4
gua 1,0
Estanho 7,26
Prata 10,5
Ao inoxidvel 7,9
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 7 - FSICO-QUMICA II
EQUILBRIO QUMICO NA GUA MINERAL GASEIFICADA EFEITO DA
TEMPERATURA
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
07 Cintica Qumica Equilbrio qumico na gua mineral
gaseificada
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
Professora: Gesa Tavares
OBJETIVOS
1.Observar o equilbrio qumico do dixido de carbono (CO
2
) em gua mineral gaseificada,
utilizando indicador cido-base.
2.Verificar a influncia da temperatura (e de forma indireta, da concentrao) sobre o
equilbrio qumico.
3.Relacionar o efeito da temperatura e da concentrao com o princpio de Le Chatelier.
FUNDAMENTAO TERICA
As reaes qumicas tendem a avanar para um estado de equilbrio dinmico, no qual
reagentes e produtos esto presentes e onde eles no mostram mais tendncia em sofrer
modificaes lquidas. Em alguns casos, a concentrao dos produtos no sistema reacional em
equilbrio to maior do que a concentrao dos reagentes residuais, que, para todos os fins
prticos, a reao est completa. Em outros casos, a mistura em equilbrio tem
concentraes significativas de reagentes e de produtos.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
O equilbrio responde a alteraes na presso, na temperatura e nas concentraes dos
reagentes e produtos. O Princpio de Le Chatelier prev que o equilbrio de um sistema
reacional tender a se deslocar no sentido endotrmico se elevarmos a temperatura, pois esse
o sentido que absorve o calor fornecido (o efeito que se ope ao aumento da temperatura a
absoro da energia como calor). Inversamente, o equilbrio se deslocar no sentido
exotrmico se a temperatura for diminuda, pois esse o sentido que repe o calor retirado (o
efeito oposto reduo da temperatura o desprendimento de energia como calor). Essas
concluses podem ser resumidas do seguinte modo:
Reaes exotrmicas: a elevao da temperatura favorece os reagentes.
Reaes endotrmicas: a elevao da temperatura favorece os produtos.
Um aumento da concentrao de uma das substncias participantes desloca o equilbrio no
sentido da reao que produz uma diminuio da concentrao dessa substncia, portanto, no
sentido da reao em que tal substncia consumida. Uma diminuio da concentrao
desloca o equilbrio no sentido da reao que produz um aumento de sua concentrao,
portanto, no sentido da reao em que tal substncia formada.
ATENO: No manuseie nenhuma substncia diretamente com as mos e lave-as sempre
ao trmino da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas
- Utilize bombonas apropriadas para descartes.
- Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
EQUIPAMENTOS
Placa de aquecimento
Geladeira
VIDRARIAS
Bquer de 100 ml (ou recipiente de vidro)
Basto de vidro
REAGENTES
gua mineral gaseificada gelada
Azul de bromotimol (soluo)
MATERIAIS DIVERSOS
Conta-gotas
Termmetro (opcional)
PROCEDIMENTO
1. Coloque 50 ml da gua gaseificada gelada no bquer;
2. Adicione 3 gotas do indicador e homogeneze com o auxlio do basto de vidro.
Observe a colorao e anote;
3. Aquea o bquer com a gua na placa de aquecimento (at 90C). Observe a colorao (de
acordo com o aumento da temperatura) e anote.
DADOS E RESULTADOS
Relatar o que foi observado na prtica e discutir os resultados obtidos de acordo com os
princpios tericos envolvidos.
QUESTES
1. Explique como a temperatura e a concentrao altera o comportamento das espcies no
sistema reacional.
2. Porque a gua muda de cor?
3. Uma gua mineral sem gs ter o mesmo comportamento de uma gua mineral gaseificada?
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
4. Em bebidas refrigerantes comumente adicionado CO
2
(g) em excesso, e desta forma o
comportamento ser igual ao da gua gaseificada?
5. possvel utilizar qualquer indicador neste experimento?
REFERNCIAS
Mdulo da disciplina.
RUSSELL, JB. Qumica Geral 2. Editora McGraw-Hill Ltda.: So Paulo, 1982.
http://www2.fc.unesp.br/lvq/exp06.htm
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 8 - QUMICA ANALITICA I
VOLUMETRIA CIDO-BASE
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
08 DETERMINAO DA CONCENTRAO DO VINAGRE
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
Professora: Manuela de Santana Santos
OBJETIVOS
Determinar a porcentagem (teor) de cido actico no vinagre, realizando a titulao de um
cido fraco com uma base forte.
FUNDAMENTAO TERICA
O vinagre um produto resultante da fermentao de certas bebidas alcolico,
particularmente do vinho. Um processo em que micro-organismos da espcie Mycoderrna
aceti transformam o lcool etlico em cido actico. Aps a fermentao, o vinho fica com
cerca de 4 a 5% de cido actico, recebendo ento o nome vinagre que significa vinho
azedo.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
O teor de cido actico no vinagre determinado atravs da volumetria, um mtodo de
anlise qumica quantitativa que se fundamenta na medida do volume de soluo de um
reagente necessrio para efetuar determinada reao. Nesse caso empregada a tcnica da
titulao.
No presente experimento, se far a titulao de uma certa quantidade de vinagre com uma
soluo padro de hidrxido de sdio 0,100 N, como mostra a Equao 1. Ser utilizada uma
soluo de fenolftalena como indicador, para se determinar o ponto final da reao.
ATENO: No manuseie nenhuma substncia diretamente com as mos e lave-as sempre
ao trmino da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas
- Utilize bombonas apropriadas para descartes.
- Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
VIDRARIAS
1pipeta volumtrica de 10 mL
1pipeta volumtrica de 20 mL
1balo volumtrico de 100 mL
3 erlenmeyer de 125 mL
1 bureta de 25 m/L
REAGENTES
Fenolftalena
Soluo padro de NaOH (0,1M)
Vinagre comercial
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
MATERIAIS DIVERSOS
1garra para bureta
1suporte universal
PROCEDIMENTO
1.Pipetar 10 ml de vinagre para um balo volumtrico de 100 mL;
2.Completar o volume de 100 ml do balo volumtrico, com gua destilada, homogeneizando
a soluo;
3.Pipetar 20 ml dessa soluo para um erlenmeyer de 125 mL e adicionar 40 ml de gua e 2 a
3 gotas de fenolftalena.
4.Preencher a bureta de 25 ml com a soluo de NaOH;
5.Titular a soluo de vinagre com a soluo de NaOH, at o aparecimento de uma leve
colorao rosa, que persista por 30 segundos aps agitao;
6.Anotar o volume de NaOH gasto (V
1
= _____ ml);
7.Repita essa operao e anote a medio do volume da soluo de NaOH
(V
2
= _ ml, V
3
= ___ ml).
Faa a anlise em duplicata
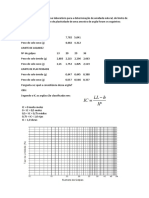
CLCULO DO TEOR DE ACIDEZ DO VINAGRE:
Teor = V(mL) x Mreal x MM x 100 = %
m x 1000
Onde V = volume em ml da soluo de NaOH usado nas titulaes com o vinagre;
M real = molaridade NaOH encontrada na mdia ; MM = massa molar do cido actico (60 g/mol) e m
= massa do vinagre utilizado, a calcular (diludo).
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Para calcular a massa de vinagre presente na alquota de 20 mL da amostra diluda inicialmente,
temos:
10 mL vinagre ----------- 100 mL de gua
X ---------- 20 mL de gua
X = 2,0 mL vinagre
E densidade do vinagre = 1,010 g/cm
3
,:
D = M / V
8.QUESTES
1.Qual a cor da fenolftalena em meio cido? E em meio bsico?
2.Para que foi usada a fenolftalena nessa anlise?
3.Se uma pessoa ingere 50 mL de vinagre numa salada, quantos gramas de cido actico
a pessoa ingeriu? (Considere: densidade do vinagre = 1,1 g/mL; teor CH
3
COOH = 5%
em massa.)
REFERNCIAS
Mdulo da disciplina.
BACCAN, N., Qumica Analtica Quantitativa Elementar, 3 edio, Editora Edgard
Blucher, 2001.
Vdeo aula. Modelo de clculos de titulao.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 9 QUMICA ANALTICA II
Volumetria de complexaro - Determinao de Clcio em amostras de
gua.
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
9 Qumica analtica 1 - determinao de clcio em amostras
de gua.
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
FUNDAMENTAO TERICA
A titulao de ons metlicos em que o titulante um agente complexante chamada de
titulao complexomtrica, bastante til para determinar um grande nmero de metais. A
titulao com formao de complexos ou complexomtrica, compreende as reaes que
envolvem um on metlico e um agente ligante multidentado com formao de um complexo
suficientemente estvel. Esse conjunto formado por um on metlico e seus grupos
associados (ligantes) chamado de on complexo.
O EDTA , de longe, o agente Quelante mais utilizado em Qumica Analtica, podendo
praticamente todos os elementos da tabela peridica ser analisados com EDTA, quer direta
quer indiretamente. Devido ao elevado nmero de grupos complexantes (2 nitrognios e 4
oxignios) o EDTA assim como os outros agentes quelantes, reage sempre na proporo de
1:1 com ons metlicos, sem formar nenhum tipo de composto intermedirio.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Na complexao de ons metlicos com EDTA, a sua espcie ativa o on y
-4
, cuja
concentrao depende do pH. Pois, somente em soluo nitidamente alcalina o EDTA se
encontra presente predominantemente na forma de on y
-4
, com o aumento da concentrao
de on de hidrognio, cai concentrao da espcie y
-4
, ou seja, a concentrao do on y
-4
diminui com o decrscimo do pH.
Alm do titulante (EDTA), certas substncias presentes em soluo podem formar
complexos com ons metlicos e, como consequncia, competir com a reao bsica da
titulao.
ATENO: No manuseie nenhuma substncia diretamente com as mos e lave-as sempre
ao trmino da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas
- Utilize bombonas apropriadas para descartes.
- Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
OBJETIVO
Determinar o teor de clcio em amostras de gua mineral empregando volumetria de
complexao.
PROCEDIMENTO
Determinao do Ca
2+
em amostras de gua
a) Pipetar 100 ml da gua a ser analisada, transferir para um erlenmeyer de 250 ml e
adicionar gotas da soluo tampo pH 10 (indicado pelo professor) e verificar o pH que
deve estar em 10 .
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
b) Adicionar 2 gotas de indicador metlico, neste caso o negro de eriocromo-T amostra e
agitar at completa dissoluo.
c) Titular lentamente com a soluo de EDTA 0,01 mol/L com agitao constante at
mudana da colorao de violeta para azul (observar a primeira alterao de cor e se for
preciso adicionar mais uma gota de EDTA).
d) Anotar o volume gasto e repetir o procedimento com uma nova alquota da amostra.
CLCULOS
%Ca = 40,08 x Volume do EDTA(2) x [EDTA] x 100 / m AMOSTRA
.
Obs.: O tampo deve ser adicionado antes do indicador negro de eriocromo-T, para que a
pequena quantidade de ferro presente na amostra precipite na forma de hidrxido de ferro,
impedindo sua reao com o indicador. Se este procedimento no for adotado, o indicador
ser bloqueado, j que o ferro forma um complexo muito estvel com o indicador.
REFERNCIAS
ACCAN Qumica Analtica Quantitativa Elementar, pags: 102 a 117, 203 a 212, 227 e 228.
HARRIS, Daniel C. Anlise Qumica Quantitativa, 6 edio 2005, pgs 250 a 270.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 10 - QUMICA ANALTICA I1
VOLUMETRIA DE OXI-REDUO - Determinao da concentrao de H
2
O
2
em
soluo de gua oxigenada:
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
10 VOLUMETRIA DE OXI-REDUO
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
INTRODUO
A volumetria de oxirreduo baseada em reaes onde h transferncia de eltrons.
Nesta reao existem espcies oxidantes (removem eltrons) e espcies redutoras (doam
eltrons):
Ared + Boxi Aoxi + Bred
onde:
Ared espcie redutora: Ared Aoxi + e
-
Boxi espcie oxidante: Boxi + e
-
Bred
O perxido de hidrognio usualmente encontrado na forma de uma soluo aquosa,
denominada "gua Oxigenada", contendo cerca de 6%, 12% ou 30% de perxido de
hidrognio (H
2
O
2
), frequentemente chamada de "20 volumes", "40 volumes" e "100
volumes", respectivamente. Esta terminologia baseada no volume de oxignio que
liberado quando a soluo decomposta por aquecimento. Assim, 1 mL de gua oxigenada
a "100 volumes" produzir 100mL de oxignio medidos na CNTP.
A concentrao de H
2
O
2
em gua oxigenada normalmente determinada pelos mtodos:
permanganometria e iodometria.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
PERMANGOMETRIA:
Usa-se como soluo padro uma soluo de KMnO
4
. Quando a soluo padro de KMnO
4
adicionada a uma soluo de H
2
O
2
, acidificada com cido sulfrico diludo, ocorre a seguinte
reao qumica:
2 MnO
4
-
+ 5 H
2
O
2
+ 6 H
+
2 Mn
2+
+ 8 H
2
O + 5O
2
.
Essa reao a base do mtodo permanganomtrico de anlise e o ponto final da titulao
percebido pela colorao rsea permanente por alguns segundos, que ocorre devido ao
excesso de MnO4-, portanto neste mtodo no h adio de indicador.
Iodometria:
Consiste em tratar a soluo de H
2
O
2
com excesso de KI e titular o iodo liberado com soluo
padro de Na
2
S
2
O
3
. Neste mtodo emprega-se ons MoO
4
2-
como catalisador na primeira
etapa do processo e amido como indicador especfico, que formar um complexo de adsoro
com o iodo. O fundamento do mtodo pode ser representado por:
MoO
4
2-
H
2
O
2
+ 2I
-
+ 2 H
+
I
2
+ 2 H
2
O
I
2
+ I (excesso) I
3
-
I
3
-
+ amido I
3
-
-amido (complexo azul)
2 S
2
O
3
2-
+ I
3
-
-amido S
4
O
6
2-
+ 3I
-
+ amido
(azul) (incolor) .
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ATENO: No manuseie nenhuma substncia diretamente com as mos e lave-as sempre
ao trmino da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas
- Utilize bombonas apropriadas para descartes.
- Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
OBJETIVOS
Determinao do grau de pureza de H
2
O
2
em uma soluo de gua oxigenada empregando
uma soluo de KMnO
4
previamente padronizada.
PROCEDIMENTO
Determinao da concentrao de H
2
O
2
em soluo de gua oxigenada:
Preparao da soluo amostra
Transferir 5,00 mL de gua oxigenada 30 volumes (9%) para um balo volumtrico de 250,0
mL. Completar o volume com gua destilada e homogeneizar. Esta a soluo amostra que
ser empregada nos procedimentos permanganomtricos e iodomtricos.
Mtodo da Permanganometria
Pipetar 20,00 mL da soluo amostra para um erlenmeyer de 250 mL.
Adicionar 10 mL de soluo de H
2
SO
4
1:5 v/v. Agitar e titular com soluo padro de KMnO
4
0,1 N at colorao levemente rsea, porm permanente por alguns segundos.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
CLCULO
Dados ;
Densidade da gua oxigenada = 1,45 g/l
MM DO KMnO4 = 170,18
X = V gasto de KMnO4 x C x 170,18 / V
X = teor de
H2O2
g/l
C = Conc. KMnO4
MM = MM KMno4
V = volume de H
2
O
2
pipetado e diludo a 1000 ml
Y = X / 10 x d
Y = teor de H
2
O
2
em %
X = conc. de KMnO
4
em g/l
d = densidade do H
2
O
2
REFERNCIAS
BACCAN Qumica Analtica Quantitativa Elementar, pags.: 191 202
SKOOG, A.D., WEST, D., HOLLER, F.J., CROUCH, R.S., Fundamentos de Qumica
Analtica, 8 ed., Norte Americana. So Paulo: Pioneira Thomsom Learning, 2006.
MILLER, J. C. & MILLER, J. N., Estatstica para Qumica Analtica, 2a ed., Addison-Wesley
Iberoamericano, E
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
ROTEIRO N 11 - Inorgnica II
Estudo qumico dos compostos de Alumnio
Ncleo de Educao a Distncia NEAD /
EXPERINCIA N
O
11 Reatividade dos compostos de alumnio
PLO____________DATA DO EXPERIMENTO __/__/__
ALUNOS______________________/____________________/______________
FUNDAMENTAO TERICA
O alumnio o elemento metlico mais abundante na crosta terrestre, apesar de ser encontrado
como bauxita, um xido hidratado impuro (Al
2
O
3
xH
2
O). At o sculo XIX, o alumnio era
uma raridade. Entretanto, atualmente ele obtido em larga escala atravs de eletrlise.
Em suma, o alumnio um elemento de carter metlico, reativo, leve, resistente, anfotrico,
com uma superfcie que se apassiva devido formao de uma pelcula de Al
2
O
3
quando
exposto ao ar. J o boro um metalide duro, com propriedades de metal pronunciadas.
ATENO: No manuseie nenhuma substncia diretamente com as mos e lave-as sempre
ao trmino da prtica.
- No coloque o nariz diretamente na boca de recipientes em que haja desprendimento
gasoso e, sim, abane levemente para sentir leves odores.
- No misture os materiais dos tubos ao terminar a prtica.
- No descarte na pia os resduos gerados nas prticas
- Utilize bombonas apropriadas para descartes.
- Durante as prticas faa uso dos EPIS (Jaleco, luvas e sapato de couro)
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Parte I Estudo da reatividade do alumnio metlico
1.Separe trs tubos de ensaio: tubo A, tubo B e tubo C;
2.Adicione um pequeno pedao de papel de alumnio ( alumnio granulado) nos trs tubos de
ensaio;
3.Ao tubo A, adicione gua destilada e duas gotas de fenolftalena;
4.Ao tubo B, adicione 1 mL de cido sulfrico 1 mol/L;
5.Ao tubo C, adicione 1 mL de hidrxido de sdio 1 mol/L
6.Observe as reaes.
PARTE II TRATAMENTO DE GUA
1.Em um bquer, prepare uma soluo de gua barrenta;
2.Numere 04 bequeres;
3.Distribua a soluo preparada no item anterior igualmente nos 04 bequeres;
4.Nos bqueres 2, 3 e 4 adicione 2mL de soluo de sulfato de alumnio saturada(Al
2
(SO
4
)
3
);
5.Somente ao bquer 3 adicione 2mL de cido clordrico 1M;
6.Somente ao bquer 4 adicione um pouco de xido de clcio (CaO);
7.Mea o pH das solues em todos os bqueres;
8.Observe em qual bquer haver uma decantao em maior velocidade.
REFERNCIA
- A. M. V. Viveiros, C. R. Martins, F. M. Alves, J. P. L. Cedraz, S. F. Lbo; Departamento de
Qumica Geral e Inorgnica - UFBA; Roteiro de Aula Prtica: Por que alguns elementos so
oxidantes e outros so redutores?; Salvador, 1997.
- Chemical Education Material Study; Qumica: uma cincia experimental; Volume 1,
Livraria Editora Ltda.; So Paulo,1967, p 107.
- L.V. Quagliano, L.M. Vallarino; Qumica; Guanabara Dois; Rio de Janeiro, 1985, p 220.
- J.B. Russel; Qumica Geral; McGrawHill; So Paulo, 1981, p 177.
- E.A. de Oliveira; Aulas Prticas de Qumica; Editora Moderna LTDA.; So Paulo, 1993, p
81.
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
UNIVERSIDADE DO ESTADO DA BAHIA UNEB
AUTORIZAO: DECRETO N92937/86, DOU 18.07.86 RECONHECIMENTO: PORTARIA N909/95, DOU 01.08.95
COORDENAO DA UNIVERSIDADE ABERTA DO BRASIL DA UNEB
PORTARIA N. 0264/2009, PUBLICADA NO D.O.E. DE 07 e 08/02/2009
Das könnte Ihnen auch gefallen
- Materiais de Construção Mecânica 3Dokument20 SeitenMateriais de Construção Mecânica 3fabiofambhNoch keine Bewertungen
- Lista de Exercício 1 PDFDokument2 SeitenLista de Exercício 1 PDFArtur CasteloNoch keine Bewertungen
- FMEA SistemaDokument6 SeitenFMEA Sistemamarcelokyamamoto100% (1)
- 05-08 Tabela Salão e ConsumidorDokument3 Seiten05-08 Tabela Salão e ConsumidorThalita ToméNoch keine Bewertungen
- Rima Cargas Pesadas ComperjDokument63 SeitenRima Cargas Pesadas ComperjCentro de Documentação Técnica e Científica de Maricá - CDTCMNoch keine Bewertungen
- Tratamento de EfluentesDokument96 SeitenTratamento de EfluentesPaulo Roberto de CarvalhoNoch keine Bewertungen
- Catalogo Canal de Drenagens FuminasDokument8 SeitenCatalogo Canal de Drenagens FuminasKassioRodriguesNoch keine Bewertungen
- Lista de Exercícios Quimica OrgânicaDokument6 SeitenLista de Exercícios Quimica OrgânicaSem fins fan AlêNoch keine Bewertungen
- Agentes AntiestáticosDokument23 SeitenAgentes AntiestáticosAndré Luís Aganeti0% (1)
- 6ano Atividade 02Dokument2 Seiten6ano Atividade 02Vivian HarrizvivianNoch keine Bewertungen
- Modelo Relatório - Introdução Ao LaboratórioDokument4 SeitenModelo Relatório - Introdução Ao LaboratórioOuvinte de Bom GostoNoch keine Bewertungen
- Exper 7 DifusãoDokument3 SeitenExper 7 DifusãoMarina Vieira de OliveiraNoch keine Bewertungen
- Apostila de Hidráulica PDFDokument240 SeitenApostila de Hidráulica PDFAntonio_S_LimaNoch keine Bewertungen
- Cap 1 - Nomenclatura ResumoDokument42 SeitenCap 1 - Nomenclatura Resumosofis2013Noch keine Bewertungen
- Sw01 Dlrilt Cspgcc028bp 4630 OpDokument67 SeitenSw01 Dlrilt Cspgcc028bp 4630 OpLuís Fernando OliveiraNoch keine Bewertungen
- Aula 1Dokument3 SeitenAula 1gambetzNoch keine Bewertungen
- Cosméticos Depilatórios e Pós-Depilação Epilação Questões ComentadasDokument7 SeitenCosméticos Depilatórios e Pós-Depilação Epilação Questões ComentadasMárcia R Alves100% (3)
- Os Dados Obtidos No Laboratório para A Determinação de Umidade NaturalDokument4 SeitenOs Dados Obtidos No Laboratório para A Determinação de Umidade NaturalWendel MeloNoch keine Bewertungen
- QuestionárioDokument1 SeiteQuestionárioangelocarlosNoch keine Bewertungen
- Texto 9 Translocação de FotoassimiladosDokument9 SeitenTexto 9 Translocação de FotoassimiladosBrunno SantosNoch keine Bewertungen
- TCC - Patologias ConstrutivasDokument24 SeitenTCC - Patologias ConstrutivasLeandro Santana FerreiraNoch keine Bewertungen
- Apostila de Eletricidade Modulo I PDFDokument74 SeitenApostila de Eletricidade Modulo I PDFmarcelo rojas100% (4)
- Simbolos ISADokument15 SeitenSimbolos ISAanon-484829100% (5)
- M Aquinas VaporDokument3 SeitenM Aquinas VaporIsac Manuel100% (1)
- CoulometriaDokument8 SeitenCoulometriaGrace FernandesNoch keine Bewertungen
- Massa MolarDokument10 SeitenMassa MolarsegecsNoch keine Bewertungen
- Preparo Haletos de AlquilaDokument16 SeitenPreparo Haletos de AlquilaEd GomesNoch keine Bewertungen
- Subsequentes CompletaklkDokument24 SeitenSubsequentes CompletaklkLucas de Paula PorcenoNoch keine Bewertungen
- Ficha Formativa 4 - 9ano (Classificação Materiais)Dokument4 SeitenFicha Formativa 4 - 9ano (Classificação Materiais)Adelaide SantosNoch keine Bewertungen
- Acetileno PDFDokument9 SeitenAcetileno PDFFerreira SouzaNoch keine Bewertungen