Beruflich Dokumente
Kultur Dokumente
Cap 1
Hochgeladen von
Isabella QuevedoOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Cap 1
Hochgeladen von
Isabella QuevedoCopyright:
Verfügbare Formate
Cap.1.
- Introduccin 1
INGENIERIA DE LA REACCION QUIMICA
FUNDAMENTOS Y TIPOS DE REACTORES
Las reacciones qumicas a nivel industrial (procesos unitarios) son las operaciones que
tienen por objeto redistribuir los tomos de las especies reactivas para formar los
productos de la reaccin.
Las transformaciones qumicas clsicas incluyen todas las que involucran interacciones entre
molculas, aunque pueden extenderse a las provocadas por los catalizadores enzimticos (bioqumicas),
interacciones entre radiacin y molculas (fotoqumicas), y transferencias entre conductores electrnicos
e inicos (electroqumicas). Pueden distinguirse tambin los sistemas homogneos y los heterogneos
(tales como los catalticos, reacciones fluido-slido y fluido-fluido).
Las reacciones qumicas son por lo general las etapas ms significativas de los
procesos, y las que deciden su viabilidad econmica; la conjugacin de los factores
puramente econmicos y los aspectos qumicos y fsicos del problema constituye la
parte de la ingeniera ms genuina del ingeniero qumico, denominada diseo de
reactores qumicos.
As, la "Ingeniera de la Reaccin Qumica" es la disciplina que, por si sola, hace que la
Ingeniera Qumica tenga una entidad propia dentro de la Ingeniera; el estudio de la operacin
unitaria qumica tiene una importancia central en el curriculum del ingeniero qumico pues
constituye el corazn de todos los sistemas de proceso (no olvidemos que siempre estar
presente en cualquier proceso qumico -junto con las correspondientes etapas fsicas que en su
caso la acompaen- y que aunque el reactor sea un item menor en los costes de capital, su
operacin determina frecuente y decisivamente la carga, tamao y configuracin de los equipos
y operaciones asociadas de preparacin, acondicionamiento y separacin).
La Ingeniera de la Reaccin Qumica es una disciplina valiosa para la optimizacin,
sobre todo en combinacin con los procesos de alta tecnologa, aunque no necesariamente
con los productos de alto valor aadido; la razn puede ser simple: en producir estos ltimos, el
cuello de botella est en la ciencia, los escalamientos son pequeos y la eficiencia no es crtica
debido a los altos mrgenes de beneficio. Aunque esta situacin puede cambiar con la
competitividad o ampliacin de las producciones actuales, lo que es claro es que la ingeniera
de la reaccin qumica es una disciplina conectada especialmente con los procesos industriales
ms bsicos. Otras tendencias son su orientacin hacia los procesos y su ligazn ms fuerte
con la qumica y dinmica de fluidos, la produccin flexible, reaccin y separacin combinadas,
sistemas expertos, etc. Junto a los principios bsicos, solo es posible ensear normalmente
algunos desarrollos bien elegidos y valiosos; aunque desde un punto de vista en que la
ingeniera de la reaccin qumica es una disciplina madura, ms importante que un desarrollo
mayor de los principios, resulta su aplicacin a las nuevas tecnologas.
El texto incluye una introduccin a los reactores qumicos (conceptos fundamentales y cintica
qumica aplicada), y cuatro grandes temas que tratan del anlisis de sus diferentes tipos y operaciones
(reactores ideales, rgimen no estacionario, reacciones mltiples, flujo no ideal y sistemas heterogneos).
Se suponen los conocimientos de cintica qumica bsica, dedicados a la teora y al clculo cuantitativo
de la reactividad qumica, esencial para el diseo, control y optimizacin de los reactores industriales.
Cap.1.- Introduccin 2
La Operacin Unitaria Qumica
La Ingeniera de las reacciones qumicas se ocupa del diseo y operacin de los aparatos
donde se llevan a cabo las transformaciones qumicas a escala industrial: reactores qumicos;
puede decirse que es la disciplina que cuantifica la influencia de los fenmenos de transporte y
la cintica, para relacionar el funcionamiento de los reactores con las condiciones y variables
de entrada:
Funcionamiento del reactor = f (entrada, cintica, contacto)
Para este cometido se requieren la qumica, termodinmica y cintica, mecnica de fluidos y fenmenos de
transporte, fsica, bioqumica, etc. El rendimiento, selectividad o produccin pueden considerarse medidas del
funcionamiento, mientras que la alimentacin y condiciones operativas constituyen las variables de entrada. La
mecnica de fluidos simples o multifsicos determina el contacto, mientras la descripcin cintica relaciona la velocidad
de reaccin con las variables intensivas como concentraciones, temperatura, presin, actividad del catalizador, etc.
Entonces, la ingeniera de las reacciones qumicas es la metodologa para sistemas qumicos reactivos, donde es
preciso escalar y operar industrialmente las causas-efectos observadas en los laboratorios, que permite tratar de un
modo unificado cualquier problema de reaccin independientemente de su naturaleza qumica o industria especfica.
Todo esto implica, en un sentido amplio, la seleccin de la forma y tamao de los
reactores, su modo de operacin, materiales constructivos, accesorios y tcnicas de control,
con vistas a optimizar el funcionamiento desde los puntos de vista de la economa, el medio
ambiente y la seguridad, dentro de un proceso qumico-industrial.
El diseo del reactor qumico adecuado incluye la eleccin de tres variables bsicas: el
tipo de reactor, su tamao y las condiciones de funcionamiento; los datos precisos para tal
eleccin son fundamentalmente dos: la escala de la operacin, y la termodinmica y cintica de
la reaccin qumica :
- Termodinmica: la fuerza impulsora de las reacciones es la diferencia de
entalpas libres entre los estados inicial y final, cuyo valor nos indica si la
reaccin es posible (Gr<0) y la extensin en que se produce (Gr=-RTln K).
- Aspectos cinticos: la reactividad depende de la diferencia de entalpas libres
entre los estados inicial y activado (barrera de energa, Gr
=-RTln k), e indica
la velocidad con que el sistema avanza hacia el equilibrio.
En primer lugar, pueden considerarse los cambios de composicin y efectos trmicos
(determinados por la estequiometra y termodinmica), y a continuacin el aspecto cintico,
cuya caracterstica distintiva es la interaccin entre la velocidad de la reaccin qumica, la
transferencia de materia, la transmisin de calor y el flujo de fluidos, que tienen lugar en
muchas ocasiones simultneamente.
En el estudio de las transformaciones qumicas industriales debe considerarse tanto el
desarrollo de modelos cinticos a partir de los fenmenos de transporte (que permitan expresar
la velocidad en funcin de las variables del sistema), como los modelos de reactores (por
integracin de los balances de materia, energa y momento, teniendo en cuenta los tipos de
flujo y fases presentes).
Aunque el empleo de computadoras, mtodos numricos y programacin es de gran utilidad para
enfrentar los principios bsicos de la ingeniera de las reacciones qumicas con los problemas prcticos
reales, no deben olvidarse los riesgos de una excesiva sofisticacin matemtica que pierda el contacto
con la realidad (e.g. modelos muy complejos, asumiendo un conocimiento preciso de la cintica, algo que
rara vez sucede en la prctica industrial); debe buscarse un compromiso entre el nivel ptimo de ciencia e
ingeniera y las prcticas demasiado simplistas, donde el escalamiento se basa muchas veces en la
semejanza de velocidades espaciales y los mrgenes de seguridad.
Cap.1.- Introduccin 3
Tipos de reactores qumicos
Los reactores qumicos se clasifican tpicamente segn la dinmica del flujo, geometra, fases
presentes y el rgimen trmico. De acuerdo con el primer criterio los sistemas pueden ser
discontinuos o continuos, segn que el proceso se realice por cargas o con flujo ininterrumpido
de alimentacin y descarga (tambin existen reactores semicontinuos); atendiendo al segundo
criterio los reactores se dividen en dos grandes tipos:
- Tanques agitados: recipientes en general cilndricos, empleados para operaciones
discontinuas (batch) o continuas (CSTR) con mezcla.
- Reactores tubulares: normalmente cilindros alargados de gran longitud relativa a su
dimetro, empleados en operaciones continuas (TFR).
Las funciones de un reactor para que en su seno se lleven a cabo las reacciones qumicas de
un modo apropiado pueden resumirse en tres:
1) Proporcionar el tiempo de contacto necesario entre los reactivos, y catalizadores en su
caso: el tiempo que permanece un elemento reaccionante en el reactor se denomina
tiempo de residencia, parmetro que est determinado por la fluidodinmica del sistema, y
por la posibilidad de mezcla o difusin; su conocimiento es determinante en el tamao del
reactor para una produccin y conversin dadas, as como para prever diferencias en los
productos obtenidos a causa de las distribuciones en los tiempos de residencia.
Los reactores ideales son aquellos en que el tiempo de residencia es igual para todos los elementos
(lo cual solo es rigurosamente cierto para reactores discontinuos).
En los reactores reales existe una dispersin de tiempos de permanencia; este fenmeno ocurre en
todos los sistemas continuos (tubulares y tanques agitados), aunque pueden hacerse aproximaciones
tericas considerndolos ideales (reactores de flujo de pistn, y de mezcla completa); sin embargo,
excepto en los primeros, siempre existen tiempos de residencia diferentes del fluido a lo largo de los
caminos de flujo en el reactor, aunque en los ltimos con una distribucin estadstica perfectamente
determinada).
2) Facilitar la mezcla de las fases presentes en la reaccin: la mezcla puede producirse de
modo natural, provocada por la propia fluidodinmica del reactor como ocurre en las
reacciones gaseosas, o bien se produce de forma forzada, con ayuda de agitacin o
mezcladores estticos como ocurre normalmente en sistemas condensados.
Los reactores homogneos son aquellos donde los reactivos, inertes y/o catalizadores se hallan en
la misma fase (lquido en reactores tipo tanque o fluido en los tubulares).
Los reactores heterogneos involucran dos o ms fases reactivas (gas-slido, lquido-gas, slido-
lquido o lquido-lquido), de contacto en torres o reactores agitados. Los reactivos o catalizadores
slidos se disponen en forma de lechos: fijos (reposicin discontinua), o lechos mviles y fluidizados
(con posible transporte neumtico y regeneracin), a travs de los cuales se mueve la fase fluyente;
tambin se emplean tanques de suspensin de lodos (agitados), emulsiones lquidas y borboteo de
gases.
3) Suministrar o eliminar calor al sistema: la termodinmica nos proporciona la informacin
necesaria respecto a la energa absorbida o desprendida durante la reaccin, magnitud que
debe conocerse para efectuar el diseo adecuado; en su caso, debe hacerse uso de los
conocimientos sobre transmisin de calor, para el diseo de los dispositivos de calefaccin
o refrigeracin.
Los reactores isotrmicos son aquellos donde la operacin transcurre a temperatura constante,
mientras que en los adiabticos lo que se restringe es todo intercambio de calor; cuando no existe
ninguna de ambas restricciones se habla en general de reactores no isotrmicos, y en particular se
llaman programados cuando se controla el intercambio trmico para producir una pauta definida de
temperaturas.
Cap.1.- Introduccin 4
Tamao, disposicin y condiciones de operacin
El dimensionamiento de los reactores depende del flujo de produccin deseado y el tiempo de
residencia necesario para alcanzar la conversin en el mismo; la variable de diseo normalmente utilizada
es el tiempo espacial (cociente entre volumen de reactor y flujo volumtrico de alimentacin), que coincide
con el tiempo medio de residencia cuando la densidad de la mezcla permanece constante.
La disposicin puede ser de reactor nico o sistemas mltiples de reactores en serie (cascada) o
en paralelo (batera).
= V/Vo (tm) = Vi/Vo (serie) V/Vo = Vi/Voi (paralelo)
Las condiciones operativas del reactor incluyen variables de composicin (reactivos, disolventes,
catalizadores, aditivos, inertes), el rgimen de temperatura y la presin (reactores no isobricos, prdidas
de carga, gases no ideales), la dispersin o agitacin (tipo de mezcla, potencia disipada, friccin), as
como otros aspectos de diseo como el bombeo, intercambio de calor, venteo, seguridad, etc.
A continuacin se resumen algunas caractersticas generales de los reactores discontinuos y de
los dos tipos bsicos de reactores continuos:
CARACTERISTICAS DE LOS REACTORES QUIMICOS
Reactores discontinuos Reactores continuos
Vo Cn-1,Tn-1 Vo
dV C1,T1
reactor batch cascada de tanques agitados reactor tubular
Sistemas cerrados (con acumulacin)
Tanques generalmente con agitacin [composicin: f(t)]
isotrmicos y a volumen constante
Estado final [equilibriof(t)]:
mxima conversin
(Gmin compatible con la termodinmica)
Sistemas abiertos:
Reactores tipo tanque agitado: composicin: f(n)
Reactores tubulares (ideales): composicin: f(x)
-con diferencias de velocidad o temperatura radiales: f(x,y,z)
-en rgimen transitorio (alimentacin o intercamb. calor): f(t)
Estado final [estacionariof(t)]: mxima conversin
(Gmin compatible con termodinmica y el estado de flujo)
Producciones limitadas (< 2 kt/ao)
o aplicaciones de laboratorio (obtencin de datos cinticos)
Verstiles, bajo costo, pequeos, instrumental externo
escaso, procesos en primera etapa de desarrollo
Grandes producciones, mucho ms especficos, mayor costo
de capital (RT>RCTA), Automatizacin de funcionamiento y
control: mejor rendimiento, constancia del proceso, calidad
del producto, costes operativos y mano de obra (>10 kt/ao)
Dentro de los reactores semicontinuos se incluyen los tipos de flujo no estacionario donde el volumen o la composicin
varan (operaciones continuas de tanques no estacionarios)
V C,T
V
1
Vn
G Estados
vs. + estacionario
x equilibrio +
Cap.1.- Introduccin 5
Reactores continuos tipo tanque agitado.-
Son sistemas en una o ms etapas que se alimentan desde el primer tanque de forma que el tiempo
de mezcla uniforme sea muy inferior al tiempo medio de residencia. La conversin en cada etapa depende del
volumen de los tanques, de la concentracin y de los ordenes y constantes cinticas.
Se emplean fundamentalmente para reacciones en fase lquida, procesos con borboteo de gas, o
reactores de fase slida dispersa (catalizadores en suspensin, y produccin de slidos). En alguna ocasin
puede emplearse para reacciones gaseosas, donde la agitacin se logra por la forma del recipiente o la
disposicin tangencial de las toberas.
Ventajas.- Son ms baratos (trabajan a presin atmosfrica); facilidad de apertura y limpieza; es ms
fcil regular la temperatura (mayor rea externa o interna de refrigeracin); proporcionan agitacin donde es
conveniente, y evitan la formacin de puntos calientes (debido a la agitacin).
Por su facilidad de limpieza, se emplean en industrias orgnicas donde hay deposiciones slidas o resinosas:
sulfinaciones, nitraciones, polimerizaciones, etc (para explosivos, plsticos, cauchos sintticos,...).
Por la posibilidad de agitacin, se emplean en reacciones con partculas slidas suspendidas o con lquidos
inmiscibles (ej. nitracin del benceno o tolueno); tambin permiten mantener burbujas de gas en fase lquida.
Inconvenientes.- La composicin vara de un tanque a otro de modo discontinuo, de tal forma que el
descenso de concentracin de los reactivos hace que, a igual composicin inicial del alimento, la velocidad
media de reaccin sea inferior a la del reactor tubular (por ello para igual produccin su volumen ser mayor).
Por otra parte, existe la probabilidad finita de que parte del reactivo no se transforme por encontrar la salida
antes de reaccionar (prdida por recirculacin); para minimizar este efecto se disponen tanques en serie, y se
hace uso de la agitacin continua con objeto de evitar una canalizacin casi directa entre la entrada y salida.
Reactor tipo tanque agitado
Cap.1.- Introduccin 6
Reactores tubulares.-
Son sistemas continuos donde existe movimiento estacionario de alguno o todos los reactivos, en
una direccin espacial, sin mezcla inducida de los elementos del fluido; el modo de flujo hace que, a diferencia
de los tanques agitados, la composicin vare de forma continua en dicha direccin.
Se emplean fundamentalmente para reacciones en fase gas, aunque tambin con fluidos y slidos.
Los diseos concretos presentan mltiples variantes, funcin principalmente de las necesidades de catlisis o
los requerimientos de intercambio trmico.
Tubos vacos.- Utilizados para procesos homogneos, donde el reactor est vaco, a excepcin del fluido
reaccionante (ej. oxidacin de monxido a NO2, cloraciones como la del etileno a DCE, sulfonacin de olefinas con tubos
simples de ms de 1 km, etc). El intercambio de calor se realiza mediante tubos sencillos encamisados, o reactores de
carcasa y tubos).
Tubos rellenos.- Utilizados en procesos heterogneos, donde el reactor est lleno de catalizador u otros slidos en
forma de lechos fijos (circulacin de fluido a travs de partculas slidas), mviles (donde el slido puede recircularse
continuamente por un recipiente anexo), o fluidizados (con transporte neumtico por gas o lquido). Ejemplos de estos
reactores se dan en los altos hornos (lecho slido de mineral), la sntesis de amoniaco y metanol (clsicos multitubulares),
oxidacin del dixido de azufre (lechos mltiples de bandejas superpuestas en la lnea de flujo), platformado (cilindros
concntricos perforados entre los que se ubica el catalizador, con corriente de gas transversal), hidrogenacin del benceno
(catalizador con goteo lquido frente a una corriente de gas hidrgeno ascendente), gasificacin del carbn y calcinaciones
(lechos mviles y arrastrados, o rotatorios), craqueo cataltico (en lecho fluido), etc.
Otro tipo de diseo que satisface la definicin general del reactor tubular, aunque la composicin no vare en la
direccin del flujo y no emplee tubos, son las cintas transportadoras donde un lecho mvil de slido reacciona con una
corriente de gas que lo atraviesa (es en esencia un reactor tubular en la direccin del flujo del gas, perpendicular al
movimiento del slido); se emplean para procesos como la preparacin de la carga del alto horno, sinterizacin del xido de
zinc, etc.
La aproximacin para estimar el comportamiento del reactor tubular es la hiptesis de `flujo de pistn
(en cualquier seccin transversal la velocidad y propiedades del fluido composicin, presin y temperatura- son
uniformes). En el caso ideal cada elemento de fluido posee igual tiempo de residencia, y como la composicin
vara de forma gradual, el reactor en cierto modo equivale a uno discontinuo (microreactores en movimiento).
El modelo se cumple bien para gases, pero existen diversos factores que provocan desviaciones y alteran las
propiedades del efluente.
Gradientes de velocidad.- Son consecuencia de la viscosidad, que
hace que la velocidad del fluido sea menor cerca de las paredes que en el
centro del reactor, produciendo cambios del tiempo de residencia en los
elementos radiales del fluido. Este efecto tiene una importancia menor que los
otros, y en todo caso es ms significativo en tubos vacos y rgimen laminar; en
los reactores rellenos el perfil en una seccin recta tiende al de pistn, debido a
las superficies slidas donde la velocidad se anula (cerca de la pared el relleno
es menos compacto y aparecen las formas tpicas de la figura).
Gradientes trmicos.- Se deben al calor de reaccin o al intercambio
calorfico del reactor. Los debidos al avance del proceso (longitudinales), no
afectan al flujo de pistn (en los sistemas refrigerados suele producirse un
sobrecalentamiento inicial a causa de la elevada velocidad de reaccin). Los
gradientes radiales se originan como consecuencia de la resistencia trmica del
fluido y dan origen a puntos calientes en el centro del reactor, que suelen tener
efectos nocivos (por ejemplo subproductos). De ser significativos, son la causa
principal de desviacin del flujo de pistn, por la sensibilidad de la velocidad de
reaccin con la temperatura; pueden limitarse reduciendo el dimetro del tubo,
provocando la mezcla del fluido, o con serpertines internos.
Difusin.- La difusin entre elementos del fluido tiene como orgenes
los gradientes de concentracin (difusin molecular), el desplazamiento al azar
del fluido (turbulenta) y los gradientes de temperatura (convectiva). Puede ser
longitudinal o radial, siendo esta ms importante y muy relacionada con los
gradientes trmicos, aunque su efecto es disminuir la diferencia de tiempos de
residencia. La primera reduce el tiempo medio y aumenta su intervalo, por tanto
aleja al sistema de la idealidad (la direccin del gradiente longitudinal de
concentraciones es tal que la difusin tiende a transportar los reactivos hacia la
salida ms rpidamente que lo que corresponde a su velocidad de paso).
Como resumen, en un reactor tubular existen gradientes de concentracin, temperatura y tiempos de residencia;
pero siempre que sea posible considerar que la temperatura es constante en la seccin recta, la difusin y la elongacin del
perfil de velocidades son poco significativos para afectar la validez de la hiptesis de flujo de pistn, salvo que el reactor sea
muy corto en relacin a su dimetro. El error debido al gradiente trmico es particularmente significativo en reactores de
lecho fijo donde la refrigeracin deba realizarse a travs de las paredes; por ello requieren a menudo mtodos empricos.
Flujo
de pistn
Flujo
laminar
Flujo
turbulento
Reactor
con relleno
temp.adiabtica mxima
T
operacin refrigerada
L
Reactores refrigerados para
reaccines exotrmicas
Efectos de la difusin radial
y longitudinal sobre un
gradiente de concentracin
rad. long
Cap.1.- Introduccin 7
Lechos fluidizados.-
Son reactores continuos fluido-slido donde un lecho de partculas encerradas en un cilindro vertical
es fluidizado por una corriente lquida o gaseosa ascendente, con una velocidad suficiente (superior a la de
sedimentacin) para mantenerlas suspendidas y en movimiento, sin llegar su arrastre neumtico fuera de la
zona de fluidizacin. La fase slida (reactivo o catalizador) puede fluir y extraerse continuamente a travs de
un rebosadero para su recirculacin y/o regeneracin.
Se usan principalmente en reacciones catalizadas por slidos (ej. craqueo de hidrocarburos, FCC), o
reacciones slido-gas (tostacin de sulfuros, etc).
Sus principales ventajas derivan del movimiento rpido y desordenado de la mezcla, que logran una
uniformidad de la temperatura, evitando aparicin de las zonas calientes como suele ocurrir en los lechos fijos.
Por otro lado, facilitan la regeneracin continua de los catalizadores, cuando pierden su eficacia o sufren
deposiciones (ej. carbonosas del craqueo), mientras que en reactores de lecho fijo son necesarios tanques de
reserva para su renovacin peridica.
Como inconvenientes, la dificultad de eliminar calor sin interferir en la fluidizacin (una posible
solucin es introducir un fluido diluyente con la alimentacin, aunque esto disminuye la velocidad de reaccin).
A veces se produce una pulverizacin progresiva de la fase slida, con prdida de lecho por arrastre de polvo.
El cambio de escala presenta dificultades, por lo que suelen utilizarse a pequeas escalas.
El diseo no tiene en general un modelo terico de clculo vlido como los dos anteriores, por lo que
deben basarse de forma realista en experimentos. Ninguno de los dos modelos ideales es aplicable
rigurosamente, ya que presenta un comportamiento intermedio entre ambos:
- no es un modelo de flujo de pistn, pues existe un cierto grado de retromezcla debido a la
agitacin del slido suspendido.
- tampoco es de mezcla perfecta, pues esta no llega a producirse en toda su extensin.
Otras complicaciones derivan de la formacin de burbujas en lechos fluidizados, aunque existen diseos para
evitar las zonas muertas: aumentos directos de la seccin o mandriles (para disminuir la velocidad del gas, con
aumento de la conversin hasta un 10%), tubos horizontales u otros obstculos (rompedores de burbujas), etc.
Productos Aumento directo de la seccin
agotamiento tamao de (sin tubos)
de la reaccin burbujas
(con tubos)
fase slida
fluidizacin
altura
Mandril Tubos horizontales
tamao burbujas
Reactivos (fase fluida) altura
vs<v<va
Cap.1.- Introduccin 8
Mtodos rpidos aproximados de diseo (Apend. Reactores Qumicos, Ref. de Cap.2- p.13, p443)
Se disean segn las fases presentes, tiempos de residencia, temperatura, presin, agitacin, resistencia a la
corrosin, etc, empleando cuatro tipos bsicos: tanques agitados, tubos largos vacos, columnas cortas rellenas
y lechos fluidizados, para compaginar las necesidades de la reaccin con los reactores adecuados (tipo de
flujo, volumen, relacin de aspecto y nmero de tubos, superficie de transmisin y materiales).
- Para un diseo preliminar no es necesaria la cintica o mecanismo de la reaccin, pero debe determinarse
con un experimento las condiciones de reaccin, geometra del reactor, conversin y rendimiento.
- Debe calcularse el calor de reaccin por unidad de tiempo o volumen del reactor para estimar la capacidad
necesaria de intercambio de calor.
- Segn la reaccin y la transferencia de masa o calor, la mezcla deseada puede ser intensa o nula, en cuyo
caso se requieren dispositivos mecnicos y materiales ms o menos complejos.
- Los materiales constructivos pueden ser convencionales (acero), salvo si existen problemas de corrosin
importantes (cermicos, con mayores limitaciones de forma, tamao y transmisin de calor).
Reacciones homogneas
Fase gaseosa.- El reactor consiste normalmente en mltiples tubos vacos que operan en continuo, con
reacciones rpidas (<1s), velocidades de flujo altas y efectos calorficos elevados (generalmente
endotrmicos); la transmisin de calor es mala, la temperatura bastante alta y el flujo turbulento (en pistn).
Tubos de acero inoxidable de dimetro 2 pulgadas y longitud 20 pies, densidad de flujo msico de
gas 3000 lb/pie
2
h, cada de presin 0,2 lb/in
2
pie. Calentamiento por radiacin (18000 Btu/pie
2
h) o
por conveccin con gases calientes (4000 Btu/pie
2
h), coeficiente global de intercambio de calor o
refrigeracin 5 Btu/pie
2
hF, temperatura de seguridad por rotura de los tubos para el acero 1200F
(depende de la presin interna) e.g. pirlisis de hidrocarburos
Fase lquida.- Recipientes por cargas o reactores continuos nicos y en series de 2 a 4 unidades.
Recipientes bien agitados: turbina y cortacorrientes, potencia 2 hp/1000 gal, coef. de transmisin
de calor al encamisado o serpentn 150 Btu/pie
2
hF, o cambiador externo si necesidad excesiva
Reactores tubulares: para reacciones lentas y poco calor de reaccin, con flujo laminar, tubo largo
y fcil control de la presin y temperatura; con reacciones ms rpidas o exotrmicas es necesario
el flujo turbulento con una velocidad 5 pies/s, coef. 25 Btu/pie
2
hF y prdida 0,7/D(in) lb/in
2
pie (a
veces se conecta en serie con un tanque agitado, con mejor transmisin de calor, para las primeras
y rpidas fases de la reaccin (e.g. polimerizacin en continuo del estireno)
Reacciones heterogneas
Lquido-lquido.- Se necesita una buena dispersin y transmisin de calor, por lo que se usan recipientes
con turbina y cortacorrientes, por cargas o continuos.
Consumo 5 hp/1000 gal, U=150 Btu/pie
2
hF, prever una cmara exterior de separacin de fases o
una centrfuga para una rpida separacin (e.g. nitracin de tolueno)
Lquido-gas.- Tanques agitados con turbina y cortacorrientes, o bien torres de absorcin en modo continuo.
10 hp/1000 gal para lquidos no gasificados y una velocidad de 0,2 pies/s (gases solubles), 0,1 si se
absorben un 50% y 0,05 para los poco absorbibles, U=100 Btu/pie
2
hF, suponer que la fraccin del
volumen reaccionante que es gas es 0,20 (e.g. oxidacin de p-xileno a cido tereftlico)
Slido-lquido.- Agitado discontinuo o continuo (turbina, rompecorrientes), o columna de relleno continua.
10 hp/1000 gal, relacin longitud/dimetro: 2, U=100 Btu/pie
2
hF, coeficiente de transferencia de
la masa lquida kL=3,5 pie/h; con catalizador fino 5 lbslido/pie
3
suspensin (e.g. arenas con cidos)
Slido-gas.-
Tubos pequeos rellenos y gas circulante: dimetro 1,5 in, partculas 0,2 in, prdida de carga<15%
G=1000 lb/pie
2
h a p.atm, p/l=15 inH2O/piet.relleno, ntubos=0,1F (lb/h), U=15 Btu/pie
2
hF (e.g VC)
Lecho grande adiabtico: calor sensible del gas y diluyentes, distribucin del gas / Lechos mviles
Lechos fluidizados: velocidad del gas 0,5 pie/s, mezcla perfecta, U=50 Btu/pie
2
hF, p/pielecho=0,3
lb/in
2
(puede requerirse gran cantidad de gas, dimensionado de soplantes), longitud supletoria para
expansin y receptculo de slidos: 100%, elutriacin: 0,01 lb/pie
2
s (prever ciclones y filtros)
Slido-lquido-gas.-
Reactor agitado: 10 hp/1000 gal, cortacorrientes al mximo, U=100 Btu/pie
2
hF, L/D=2, velocidad
del vapor 0,05-0,2 pie/s, slidos 5 lb/pie
3
, fraccin de gas en la suspensin 0,2 (hcs con CO/H2)
Lecho de goteo: diseo anlogo a torres de absorcin G=1000 lb/pie
2
/h (3 pie/s), L=1500 lb/pie
2
h
el calor de reaccin debe ser pequeo (e.g. hidrodesulfuracin)
Cap.1.- Introduccin 9
Estequiometra de las reacciones qumicas.-
Las ecuaciones estequiomtricas de cualquiera de las reacciones qumicas (k) que puedan tener lugar en
una mezcla homognea de sustancias (Ai), puede representarse en forma de ecuaciones lineales (con
coeficientes negativos para los reactivos, positivos para productos, y nulos para inertes): kiAi = 0
El tratamiento matricial de estas ecuaciones permite determinar el conjunto mximo de reacciones representativas, y
sus combinaciones lineales. El n de reacciones independientes de un conjunto considerado viene dada por el rango o
caracterstica de la matriz (orden del mayor determinante no nulo), y puede obtenerse por reduccin de Gauss-Jordan.
Si en un sistema cerrado se produce una sola reaccin qumica, basta una variable
independiente para representar las transformaciones producidas, normalmente la conversin referida al
reactivo limitante inicial (que es usualmente el de mayor valor, aumentando su aprovechamiento con
exceso de los otros reactivos): xi = (ni0 ni)/ni0 nj = nj0 (j/i)ni0xi
Para sistemas con cambio de volumen de la mezcla reaccionante, las expresiones de concentracin deben
tener en cuenta los coeficientes de expansin. En algunos casos puede admitirse una relacin lineal con la conversin,
como ocurre con las reacciones gaseosas ideales a presin y temperatura constantes: V= V0 (1+ xi) = (nx=1 -n0)/n0
La relacin entre concentracin y conversin de reactivo limitante, para el caso ms general con gases reales
y densidad, temperatura y presin variables, resulta: Ci/Ci0 = (T0/T)(P/P0)(Z0/Z)(1-xi)/(1+xi)
Con reacciones mltiples se emplea la extensin de la reaccin [=(ni-ni0)/i] por la dificultad de establecer un
reactivo limitante para cada una, cuando los hay comunes: ni = ni0 + kik V=V0 [1+k(k/n0iki)]
Para un tratamiento general de la estequiometra qumica puede emplearse el algoritmo de Smith
y Missen
1
, que considera sistemas cerrados con especies qumicas Ai (en diferentes estados), formadas
por sus elementos constituyentes (Eg) en proporciones atmicas gi ; siendo N y B los vectores de nmero
de moles de las especias y los elementos, se cumplen las ecuaciones matriciales: N = B y
T
= 0 ,
siendo
T
la transpuesta de coeficientes de uno de los posibles conjuntos de reacciones independientes
representativas de las transformaciones, que puede determinarse con la ltima ecuacin, a partir de la
matriz de frmulas del sistema , aplicando el mtodo de Gauss-Jordan:
b a
p
Z I
0 0
=
Ejemplo.- Oxidacin del amoniaco con aire :
1
Smith, W.R. y Missen, R.W.: Chemical Reaction Equilibrium Analysis, theory and algorithms, John Wiley (1982), Cap.2.
Para la reduccin se dividen todos los
elementos de la primera fila por el primero (de
modo que aparezca un 1), salvo que sea 0 (en
cuyo caso se intercambia esta fila o columna por
otra). A continuacin se resta la primera fila a
las otras, multiplicada previamente por el primer
elemento de cada una (de forma que toda la
columna salvo el primer elemento sea 0).
Se repite el procedimiento con el 2
elemento de la 2 fila, y sucesivos, hasta que las
filas restantes sean ceros, con lo que se obtiene
el rango de la matriz (p).
En este caso p=3 (matriz de frmulas),
y k=i-p=3 (n mx. de reacciones). Una matriz
estequiomtrica completa puede construirse
con:
k
T
I
Z
=
siendo Ik una submatriz identidad (k*k), y Z otra de
orden p*(i-p).
Las tres ecuaciones qumicas independientes
son:
NO + O2 = NO2
2/3 NH3 + 5/6 O2 = 2/3 NO + H2O
2 NO = N2 + O2
NH3 O2 NO NO2 H2O N2
N 1 0 1 1 0 2
H 3 0 0 0 2 0
O 0 2 1 2 1 0
NH3 O2 NO NO2 H2O N2
N 1 0 1 1 0 2
H 0 0 -3 -3 2 -6
O 0 2 1 2 1 0
NH3 NO O2 NO2 H2O N2
N 1 1 0 1 0 2
H 0 1 0 1 -2/3 2
O 0 1 2 2 1 0
NH3 NO O2 NO2 H2O N2
N 1 0 0 0 2/3 0
H 0 1 0 1 -2/3 2
O 0 0 1 1/2 5/6 -1
0 -2/3 0
-1 2/3 -2
-1/2 -5/6 1
1 0 0
= 0
0 1 0
NH3,
NO,
O2,
NO2,
H2O,
N2
x
0 0 1
Cap.1.- Introduccin 10
Termodinmica qumica.-
Dado que la gran mayora de las reacciones qumicas se llevan a cabo a presin constante, el
calor puesto en juego coincide con la variacin de entalpa de la reaccin, que puede evaluarse con los
calores normales de formacin o combustin de las sustancias. El efecto de la temperatura puede
calcularse con los calores especficos y latentes, mientras que la correccin debida a la presin es
despreciable para sistemas condensados y gases ideales; para gases reales es preciso disponer de
ecuaciones de estado (y de forma prctica con el principio de los estados correspondientes). Por ltimo,
quedara por evaluar los efectos de mezcla, que en este caso son poco importantes para sistemas
gaseosos, aunque puede no ocurrir lo mismo en fases condensadas (calores de mezcla o disolucin), si
bien se dispone de pocos datos de los mismos.
Hr= ii (i : entalpa molar parcial en las condiciones de reaccin)
Hr= i [ Hfi + CpidT + i + (H-H)i ]
(H/p)T = V T(V/T)p = -(RT
2
/p)(z/T)p pV=z(pr,Tr,zc)RT
en funcin de las condiciones reducidas e integrando: -1/Tc(H/p)Tdp= (H-H)/Tc = RTr
2
(z/Tr)Prd(lnPr)
La constante de equilibrio se deduce del criterio de variacin nula de la energa libre en un
sistema a presin y temperatura constante, junto con las expresiones del potencial qumico y el clculo de
las energa libre standard (1 atm):
Gr= ii = 0 -Gr = i (i -i
o
) [dG= Vdp]T i -i
o
= RTln(fi/fi
o
)
Gr = RT ln ( ai
i
)
Ka = e
- Gr/RT
Gr= HT TST
[S/T]p = CP /T ST = i (S298,i +[CPi /T]dT)
Como ejemplo, se aplicar a la reaccin de sntesis del amoniaco [ N2(g)+3/2H2(g) = NH3(g)] a 300C y 600 atm, cuyo
calor de reaccin medido experimentalmente es de 14240 kcal/kmol. El clculo con datos termoqumicos tabulados es:
Hr= i[Hfi+ CpidT+(H-H)i]=-14188 (<0,4%).
Para el equilibrio: Gr=-9093-25,672T+7,735TlnT-4,28110
-3
T
2
+0,40710
-6
T
3
, y Ka(600K)=0,0434.
i Hf CP kcal/kmolK Tc/K Pc/at Zc (H-H)/Tc S298K
NH3 +1 -11040 5,92+8,96310
-3
T-1,76410
-6
T
2
405,5 111,3 0,243 4,7 46,01
N2 - 0 6,46+1,38910
-3
T-0,06910
-6
T
2
126,2 33,5 0,291 -0,14 45,77
H2 -3/2 0 6,95-0,19610
-3
T+0,47610
-6
T
2
33,3 12,8 0,304 0,00 31,21
i
-11040 -7,735+8,56310
-3
T-2,4410
-6
T
2
iTCi[(H-H)/TC]i : -1915 -23,69
Para determinar la composicin en equilibrio deben relacionarse actividades y concentraciones.
Para sistemas gaseosos (fi = YiiP): Ka = KYK
P
i
; expresin que precisa el clculo de coeficientes de
fugacidad de sustancias puras, como las integrales de la ecuacin de estado generalizada [ln=(z-
1)dlnPr]Tr entre el estado ideal (P=0,=1) y el real, que se resumen en grficas y tablas (Pr,Tr,zc). Como K
depende de la presin, esta influye sobre el equilibrio an en el caso que i=0.
Ej.- Sntesis a 600K y 500atm; por interpolacin en tablas: NH3=0,743; N2=1,05; H21,0 (K:0,707); KY=Ka/KP
i
=30,7;
resolviendo para mezcla inicial estequiomtrica: xe = 0,8436 (YNH3:0,730; YN2:0,067; YH2:0,203)
Para sistemas lquidos, la aproximacin anterior puede servir con fin orientativo, pero no existen
relaciones relativamente generales debido a las desviaciones de la idealidad de muchas mezclas lquidas
(sobre todo los solutos no moleculares). En general, la actividad se relaciona con la molalidad (ai=imi), y
para electrolitos se utiliza su valor inico medio (m
i : (m+
+
+m-
-
)
1/(+ + -)
, pero no se dispone de suficientes
datos sobre coeficientes de actividad, por lo que los clculos suponiendo K
1 solo son aproximativos.
Para sistemas heterogneos, como las reacciones en fase gaseosa en presencia de lquidos o
slidos puros, las actividades de estos componentes puede considerarse la unidad (el estado standard
coincide prcticamente con la fase condensada); y lo mismo ocurre para reacciones en fase lquida en
presencia de slidos puros.
Ej.- CaCO3(s)=CO2(g)+CaO(s), Ka(T)=aCO2aCaO/aCaCO3 YCO2CO2P PCO2 (a pres. bajas y temp. altas, 1);
as puede calcularse la temperatura de descomposicin a 1 atm: 861C.
En sistemas con reacciones mltiples, si la mezcla reaccionante puede considerarse ideal, el
clculo de Hr y de KY para cada reaccin es independiente de la simultaneidad de las otras reacciones,
llegndose entonces a un conjunto de ecuaciones no lineales: (KY)k = Yi
ki
, siendo las fracciones
molares Yi funciones de la composicin inicial y de las conversiones de las reacciones qumicas
independientes que tienen lugar en el sistema.
Cap.1.- Introduccin 11
Cintica qumica aplicada.-
Las reacciones qumicas pueden estar afectadas tanto por la propia cintica intrnseca como por la
transferencia de masa, de forma que el modelo de velocidad depende de las etapas determinantes en el
mecanismo de los procesos: si el paso controlante es la reaccin qumica (tpico en sistemas homogneos) la
cintica viene dada por la ley de accin de masas; mientras que si la etapa lenta est relacionada con el
transporte msico (lo que suele ocurrir en los procesos heterogneos) el modelo estar determinado por la
velocidad de transferencia de materia.
La ley de accin de masas representa la expresin de la velocidad de reaccin como
funcin de la composicin y de la temperatura:
v(C,T) = rA /Vt= f{k(T)Ci
}
donde k(T) suele expresarse por la ecuacin de Arrhenius, y f(C) en funcin de unos ordenes de reaccin (i)
y de la concentracin de las especies (que puede relacionarse con la conversin del reactivo limitante).
Considerando la ecuacin generalizada (bidireccional-reversible y presencia de inertes), con reactivo
limitante A :
aA + bB = rR + sS v = v1 v2 = k1 CA
CB
k2 CR
p
CS
q
kj(T)= Aje
-Ej/RT
Ci=ni/V ni= no (Xio i/AXAox) V=nRT/p= Vo (1+x)
= (V1-Vo)/Vo = (n1/no)(T1/To)(po/p1)-1
En funcin de todo lo anterior, los datos necesarios son la composicin de la alimentacin (Coi), los coeficientes
estequiomtricos, factores de frecuencia, energas de activacin y rdenes de reaccin. El ltimo trmino se emplea para
corregir las variaciones de densidad de la mezcla durante la reaccin, especialmente importante en los casos de procesos
gaseosos no equimolares, no isotrmicos o no isobricos (p.e. con caidas de presin); en la ltima igualdad se supone que
las variaciones de temperatura y presin pueden relacionarse con la conversin de forma proporcional (lineal). Cuando la
densidad permanece prcticamente constante (=0), la expresin para el reactivo limitante se reduce a: C=C0(1-x).
Las constantes cinticas de reaccin son experimentales, aunque si puede predecirse la
velocidad mxima correspondiente a la reaccin controlada por la transferencia de masa :
- en reacciones fluido-slido heterogneas (irreversibles, de 1
er
orden), la velocidad aparente (k)
puede relacionarse con la transferencia de masa (kD) y la cintica en la superficie (kS); si esta es
muy alta, el proceso est controlado por la difusin y k puede estimarse a partir de kD y del rea
por unidad de volumen (a).
1/k= 1/kS + 1/kDa (=B/
)
kD vara con la velocidad de rotacin ; con ensayos a varios regmenes de
agitacin (Re), la ordenada en el origen representara la contribucin
qumica (cte), y la pendiente se relaciona con la constante de difusin.
- para reacciones instantneas irreversibles (con mezcla perfecta), la constante de velocidad
puede expresarse en funcin de los coeficientes de difusin del reactivo limitante y en exceso
(D1,D2), el dimetro de colisin ( 5), el nmero de Avogadro (N) y la concentracin de
reactivo en exceso (C2): k= 4(D1+D2)NC2
- reacciones determinadas por la mezcla: depende de los coeficientes de difusin (Di 10
-5
cm
2
/s)
y el tamao medio de la mezcla (en agitaciones rpidas, l 30 m): k= 4(D1+D2)/l
2
10
4
s
-1
Los coeficientes de transferencia (kD=D/) vienen dados por el coeficiente de difusin (D) y espesor de pelcula ().
Para gases: kD 1 cm/s (D 0,1 cm
2
/s; 1 mm), y para lquidos: kD 10
-3
cm/s (D 10
-5
cm
2
/s; 100 m).
Se resumen algunos rdenes de magnitud de velocidad y factores de frecuencia, para distintas
reacciones y mecanismos, aunque en la prctica es mucho mejor usar bases de datos y experimentales.
Tipo Velocidad/ dm
3
mol
-1
s
-1
Molecularidad y factor preexponencial (A)
rpida, HCl+NaOH 10
11
unimoleculares 10
13
-10
14
s
-1
media, CO2+NaOH 1,2410
4
bimoleculares 10
14
-10
15
cm
3
mol
-1
s
-1
lenta, AcMe+NaOH 4,710
1
trimoleculares 10
15
-10
16
cm
6
mol
-2
s
-1
El valor bimolecular de A se aplica a la interaccin de 2 tomos;
para especies ms complejas puede ser mucho menor (pA, factores estricos tomo-molcula p:10
-1
-10
-3
y molculas p:10
-4
-10
-6
). En reacciones en solucin los efectos del disolvente son importantes.
1/k (T=cte)
___)_
1/Re
Cap.1.- Introduccin 12
Mtodos experimentales e interpretacin de datos cinticos
El estudio experimental de la cintica de reaccin se realiza tpicamente en las dos fases
siguientes: primero, se analiza la influencia de la composicin sobre la velocidad de reaccin a
temperatura constante (para obtener los rdenes de reaccin y la constante de velocidad), y en
segundo lugar, se mide la variacin de las constantes cinticas con la temperatura (se determina
la energa de activacin y el factor pre-exponencial o de frecuencia en la ecuacin de Arrhenius).
Los reactores experimentales pueden ser discontinuos o continuos (tanques agitados y
reactores de flujo tubular), y el anlisis matemtico de los datos obtenidos puede ser de tipo
diferencial o integral.
La medida de las concentraciones durante la reaccin puede realizarse por muestreo esttico o
anlisis dinmico, en forma directa u observando la variacin de determinadas propiedades con el tiempo
(presin, absorbancia, conductividad, ndice de refraccin, constante dielctrica, etc).
Los sistemas experimentales ms sencillos y habituales son reactores discontinuos de
laboratorio, donde se aaden los reactivos y se estudia la variacin de concentracin de la especie
qumica de control con el tiempo.
Para estudiar cinticas gaseosas en discontinuo puede
emplearse un recipiente termostatado con la mezcla reactiva, provisto
de un dispositivo manomtrico para medir la variacin de presin
durante la reaccin a volumen constante (p-po=mh); la concentracin
de reactivo o producto se relaciona con la variacin de presin total y
con la estequiometra de la reaccin segn: Ci= Cio i/p/RT, que
puede representarse frente al tiempo de reaccin.
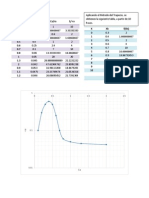
Para interpretar los datos experimentales concentracin vs tiempo, por el mtodo diferencial, puede
obtenerse la pendiente (que nos proporciona la velocidad de reaccin en cada punto, vA=dCA/dt), y con los
valores vACA se calcula la constante de velocidad suponiendo el orden de reaccin hasta no observar
variacin sistemtica de la constante. Una variacin de este mtodo es el de las velocidades iniciales.
El mtodo integral consiste en probar las ecuaciones integradas de velocidad, representando las
funciones de concentracin resultantes frente al tiempo, para distintos rdenes de reaccin (n:0-3), hasta
obtener sistemticamente la mejor correlacin lineal (coeficiente de regresin: 1,00); entonces puede
obtenerse la constante cintica, y el periodo de semireaccin: t=(2
n-1
-1)/k(n-1)C0
n-1
y t=ln2/k (n=1).
Cuando tenemos cinticas con mltiples rdenes de reaccin, estos pueden `aislarse manteniendo
concentraciones en exceso y calculando las pseudo-constantes cinticas [ vA= -1/adCA/dt= kCA
CB
= kCA
] ;
tambin puede calcularse el orden total n si la proporcin de concentraciones es constante [ v= k(b/a)
CA
+
].
Un mtodo directo -aplicable a cualquier reaccin monodireccional y a las reversibles de 1
er
orden- se basa en
que la relacin de tiempos para dos conversiones solo depende del orden de reaccin:
tx1/tx2 = [(1-x1)
1-n
-1]/ [(1-x2)
1-n
-1]; tx1/tx2 =ln(1-x1)/ln(1-x2) (n=1)
donde x es la conversin (monodireccional) o la aproximacin al equilibrio (reversible), funcin de la concentracin o
cualquier propiedad lineal con la misma: x= (Po-P)/(Po-P). Solo es precisa una relacin para determinar n, aunque
conviene usar otra como confirmacin:
n -1 0 0,5 1 2 3
t3/4/t1/2 1,25 1,50 1,71 2 3 5
t2/3/t1/3 1,60 2 2,30 2,71 4 6,40
po
T
_
_h
V
METODO DIFERENCIAL:
METODO INTEGRAL:
A v= k CA = CAo -kt
v= kCA ln CAo/CA = kt
v= kCA
n
1/CA
n-1
= 1/CAo
n-1
+ (n-1)kt
A+bB v= kCACB ln CB/CA = ln CBo/CAo + (CBo-bCAo)kt
A rR (CRo=0) v= k1CA -k2CR ln (CAo-CAe)(CA/CAe) = k1/(1-CAe/CAo)t
A+B R+S v= k1CACB -k2CRCS ln [xAe-xA(2xAe-1)]/[xAe-xA]= 2k1(1/xAe-1)CAot
(CAo=CBo; CRo=CSo=0)
reactor d=cte [t=dCA/v] ; dcte [t=-dCA/v(1+CA/CAo)]
CA
v=-dC/dt
t
v
v=f(C),kC
n
CA
v
f(C)
lg v
__)n
lg k
lg C
dC/f(C)
v=f(C)
t
Cap.1.- Introduccin 13
Las cinticas pueden tambin deducirse con experimentos continuos, que emplean el
tiempo de residencia en lugar del de contacto.
Para reacciones lquidas en continuo pueden utilizarse los tanques agitados, donde la velocidad de
reaccin estacionaria, para diferentes composiciones de la alimentacin, se obtiene directamente midiendo la
concentracin de estado estacionario y el tiempo de residencia en el reactor: vA= (CAo -CA)/ .
Pueden emplearse asimismo reactores tubulares diferenciales, calculando el promedio de variacin
de la conversin en un elemento de volumen suficiente: vA= lim
V0 FAoxA/V ; cuando no es posible este
procedimiento cabe realizar el anlisis al reactor integral (V=FAo xA/vA), aunque requiere probar los modelos
cinticos hasta obtener el volumen del reactor resolviendo la ecuacin.
Las expresiones cinticas para reacciones mltiples se estudian en el tercer captulo;
para reacciones en serie o paralelo de primer
orden (irreversibles), se deduce:
A R S CA= CAoe
-k1t
topt=ln(k2/k1)/(k2-k1) CRmax=CAo(k1/k2)
k2/k2-k1
A R , S CA= CAoe
-(k1+k2)t
(CR-CRo)/(CS-CSo)= k1/k2
En el caso de reacciones heterogneas (con etapas fsicas y qumicas), la identificacin del
rgimen cintico se realiza experimentalmente modificando de forma independiente las distintas variables
que intervienen y midiendo la variacin de velocidad resultante; as, unos efectos significativos de la
agitacin en la fase fluida o la temperatura, indicaran en cada caso que la resistencia controlante es la
transferencia de masa o la reaccin qumica.
En cuanto a la adsorcin superficial, el modelo ms sencillo de equilibrio puede describirse por la
isoterma de adsorcin de Langmuir, donde la fraccin de centros ocupados viene dada por la relacin
entre la cantidad de adsorbato y la mxima posible por unidad de masa de slido: = q/qo = Kp((1+Kp).
Mecanismos de reaccin
Aunque no suele ser objetivo de la cintica aplicada, la interpretacin de los modelos de velocidad
permite tambin elucidar los mecanismos de la reaccin. Por ejemplo, la cintica de formacin de fosgeno
en condiciones alejadas del equilibrio es:
Cl2 + CO COCl2 v= kCCOCCl2
3/2
Mecanismo:
1) Cl2 2Cl rpida K1=CCl
2
/CCl2
2) Cl + CO COCl rpida K2=CCOCl/CClCCO
3) COCl + Cl COCl2 + Cl lenta vg= v-v= k3CCOCl CCl2 -k3CCOCl2CCl
v= k3 K2 K1
CCO CCl2
3/2
k= k3 K2 K1
(reaccin directa)
v= k3 K1
CCl2
CCOCl2 k= k3 K1
(r. inversa) K=k/k= K2K3
La reaccin global es la suma de las etapas 2 y 3 ; la 1 solo es necesaria para proporcionar
tomos de cloro (iniciacin) ; la inversa es autocataltica pues el cloro aumenta su velocidad.
Bases de datos cinticos
Los datos cinticos no estn fcilmente tabulados en la bibliografa, por la gran variedad de
reacciones y condiciones existentes.
Debe acudirse generalmente a una bsqueda minuciosa en revistas de Abstracts y en las fuentes
primarias de investigacin, archivos de las compaas o informes.
Tambin existen algunas bases de datos estructuradas y datos bsicos sobre velocidades
espaciales y condiciones de los reactores comerciales, aunque no son profusas ni estructuradas. Tambin
se han publicado revisiones peridicas sobre cintica aplicada e ingeniera de las reacciones qumicas.
2
2
Base de datos cinticos NIST, A320 Physics Building, Gaithersburg, MD 20889-0001, Chem.Eng.Prog. 91(11),31 (1995);
Chemical reactor data, Chem.Eng. p.79 Oct.14 (1985); Database (gas kinetics), Chem.Eng.Prog. 85(11),85 (1989);
Annual reviews, Ind. & Eng. Chem.
Das könnte Ihnen auch gefallen
- Actividades de Limpieza de Proveedor para La Cabina de Waxing y PinturaDokument1 SeiteActividades de Limpieza de Proveedor para La Cabina de Waxing y PinturaIsabella QuevedoNoch keine Bewertungen
- Presentación 1Dokument3 SeitenPresentación 1Isabella QuevedoNoch keine Bewertungen
- Reactores Estimulo ImpulsoDokument7 SeitenReactores Estimulo ImpulsoIsabella QuevedoNoch keine Bewertungen
- Primera Sesion CteDokument8 SeitenPrimera Sesion CteIsabella QuevedoNoch keine Bewertungen
- A5 CersDokument8 SeitenA5 CersIsabella QuevedoNoch keine Bewertungen
- Actividades de Limpieza de Proveedor para La Cabina de Waxing y PinturaDokument1 SeiteActividades de Limpieza de Proveedor para La Cabina de Waxing y PinturaIsabella QuevedoNoch keine Bewertungen
- Acuerdo 685Dokument2 SeitenAcuerdo 685jorgeluis2011Noch keine Bewertungen
- Estructuras QuimicasDokument4 SeitenEstructuras QuimicasIsabella QuevedoNoch keine Bewertungen
- Reactores, Tarea 1Dokument1 SeiteReactores, Tarea 1Isabella QuevedoNoch keine Bewertungen
- Ejercico 2Dokument2 SeitenEjercico 2Isabella QuevedoNoch keine Bewertungen
- Producciòn de Acido AceticoDokument13 SeitenProducciòn de Acido AceticoIsabella QuevedoNoch keine Bewertungen
- Problemas de Balance UltimtareaDokument5 SeitenProblemas de Balance UltimtareaIsabella Quevedo100% (1)
- ReaccionDokument1 SeiteReaccionIsabella QuevedoNoch keine Bewertungen
- IsomerosDokument7 SeitenIsomerosIsabella QuevedoNoch keine Bewertungen
- Evalucacion de La Nom 017Dokument34 SeitenEvalucacion de La Nom 017Isabella QuevedoNoch keine Bewertungen
- SECADODokument2 SeitenSECADOIsabella QuevedoNoch keine Bewertungen
- ConceptDokument4 SeitenConceptErick SxsxNoch keine Bewertungen
- Sensores de PHDokument22 SeitenSensores de PHIsabella QuevedoNoch keine Bewertungen
- CentrifugacionDokument12 SeitenCentrifugacionIsabella QuevedoNoch keine Bewertungen
- M5 Chapter9 SpanishDokument24 SeitenM5 Chapter9 Spanishthelatino1Noch keine Bewertungen
- EcuacionesDokument14 SeitenEcuacionesjvelosoaNoch keine Bewertungen
- Identificacion de Riesgos Del Equipo de ProtecciónDokument7 SeitenIdentificacion de Riesgos Del Equipo de ProtecciónIsabella QuevedoNoch keine Bewertungen
- Identificacion de Riesgos Del Equipo de ProtecciónDokument7 SeitenIdentificacion de Riesgos Del Equipo de ProtecciónIsabella QuevedoNoch keine Bewertungen
- 09 CentrifugaciónDokument6 Seiten09 CentrifugaciónLuis Carlos Quinto CuzcanoNoch keine Bewertungen
- A.prog MicroDokument6 SeitenA.prog MicroIsabella QuevedoNoch keine Bewertungen
- Intercambiador de Coraza y TuboDokument37 SeitenIntercambiador de Coraza y TuboAndre_81Noch keine Bewertungen
- Temario de Reactores QuimicosDokument1 SeiteTemario de Reactores QuimicosIsabella QuevedoNoch keine Bewertungen
- BiodiselDokument9 SeitenBiodiselIsabella QuevedoNoch keine Bewertungen
- Absorción de GasesDokument9 SeitenAbsorción de GasesIsabella QuevedoNoch keine Bewertungen
- Propiedades Compuestos Reklaitis. BuenoDokument379 SeitenPropiedades Compuestos Reklaitis. BuenoDiego BastarracheaNoch keine Bewertungen
- Ejercicios TermodinámicaDokument16 SeitenEjercicios Termodinámicawolfran58Noch keine Bewertungen
- Naturaleza Del FuegoDokument14 SeitenNaturaleza Del FuegoMarvelis GarciaNoch keine Bewertungen
- Practica Segundo Parcial Fis102Dokument9 SeitenPractica Segundo Parcial Fis102cristhianabdiasjaimesNoch keine Bewertungen
- Guia Fisica Octavo GradoDokument3 SeitenGuia Fisica Octavo GradoYuliana JineteNoch keine Bewertungen
- Ganancias de Calor InternasDokument8 SeitenGanancias de Calor Internasmarcela pineda100% (1)
- Ensayo Equilibrio TermodinamicoDokument10 SeitenEnsayo Equilibrio TermodinamicoAb GuzmanNoch keine Bewertungen
- Balance Térmico (Invierno)Dokument5 SeitenBalance Térmico (Invierno)pauvengNoch keine Bewertungen
- Calorimetría PDFDokument7 SeitenCalorimetría PDFEliel OtamendiNoch keine Bewertungen
- Informe de Laboratorio No 6 UaoDokument4 SeitenInforme de Laboratorio No 6 UaoJuancarl000zzzNoch keine Bewertungen
- Lista de Ejercicios 6 (F2) 22Dokument1 SeiteLista de Ejercicios 6 (F2) 22Sofia Lizbeth Andrade OlaguivelNoch keine Bewertungen
- Bia ExamenesDokument130 SeitenBia ExamenesAurora ZszsNoch keine Bewertungen
- Introducción Aleaciones y Diagramas de Fase PDFDokument23 SeitenIntroducción Aleaciones y Diagramas de Fase PDFFelipe LedezmaNoch keine Bewertungen
- R - Tema 6 Cambios Físicos y Químicos.Dokument6 SeitenR - Tema 6 Cambios Físicos y Químicos.Jess Gálvez C.Noch keine Bewertungen
- Secuencia Didactica Residencia 2021 Tercer Año Calorimetría.Dokument16 SeitenSecuencia Didactica Residencia 2021 Tercer Año Calorimetría.micaela gazzollaNoch keine Bewertungen
- El Siguiente Artículo TieneDokument36 SeitenEl Siguiente Artículo Tienekewall lalta RamirezNoch keine Bewertungen
- Calor de Fusión Del HieloDokument3 SeitenCalor de Fusión Del HieloCarlitos TapiaNoch keine Bewertungen
- PARCIAL 1 - Fenomenos de TransporteDokument4 SeitenPARCIAL 1 - Fenomenos de TransporteJuan Rodríguez Carbonell0% (1)
- Bustion IndustrialDokument302 SeitenBustion IndustrialDarwin Toribio PosadasNoch keine Bewertungen
- Labo Pavimentos Ensayo de Penetracion (Ablandamiento)Dokument5 SeitenLabo Pavimentos Ensayo de Penetracion (Ablandamiento)Roger OvandoNoch keine Bewertungen
- Operaciones Unitarias Agroindustriales I PDFDokument27 SeitenOperaciones Unitarias Agroindustriales I PDFthander2010Noch keine Bewertungen
- 11-Radio Crítico de Aislación PDFDokument21 Seiten11-Radio Crítico de Aislación PDFangus a.Noch keine Bewertungen
- Curso de Proyectista Instalador de Energía SolarDokument16 SeitenCurso de Proyectista Instalador de Energía SolarAnto VerduNoch keine Bewertungen
- Seleccion de Problemas de Termodinamica ALTO AzcapotzalcoDokument82 SeitenSeleccion de Problemas de Termodinamica ALTO Azcapotzalcomagtd100% (1)
- Transferencia de CalorDokument1 SeiteTransferencia de CaloryanelaNoch keine Bewertungen
- Manual de EmbutidosDokument15 SeitenManual de EmbutidosPaula Leiva GarciaNoch keine Bewertungen
- Tecnologia de SelladoDokument3 SeitenTecnologia de SelladoCarlos GilNoch keine Bewertungen
- Proyecto SteamDokument3 SeitenProyecto Steamapi-655570012Noch keine Bewertungen
- TECNOLOGíA DEL TERMOFIJADODokument4 SeitenTECNOLOGíA DEL TERMOFIJADOWilder Huamán Oscco67% (3)
- EjemplosDokument25 SeitenEjemplosLyo LopezNoch keine Bewertungen