Beruflich Dokumente
Kultur Dokumente
Apuntes Equilibrios Termodinámicos
Hochgeladen von
Jar RSCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Apuntes Equilibrios Termodinámicos
Hochgeladen von
Jar RSCopyright:
Verfügbare Formate
INGENIERA QUMICA
APUNTES DE EQUILIBRIOS TERMODINMICOS
ELABORADO POR:
DR. JULIAN CRUZ OLIVARES
jcruzo@uaemex.mx
jcruzolivares@gmail.com
FEBRERO - JULIO 2013
UNIVERSIDAD
AUTNOMA DEL
ESTADO DE MXICO
FACULTAD DE QUMICA
NDICE
PRESENTACIN
INTRODUCCIN
Unidad de competencia I
Equilibrio termodinmico de componentes puros
Los equilibrios termodinmicos y la ingeniera de los procesos qumicos 3
Comportamiento PVT de sustancias puras 16
Ecuacin de Clausius Clapeyron 20
Fugacidad (f) y coeficiente de fugacidad(|) 22
Condiciones de equilibrio usando ecuaciones de estado 36
Unidad de competencia II
Equilibrio termodinmico de sistemas ideales
Propiedades molares parciales 43
Equilibrio lquido vapor de sistemas ideales 48
Puntos de burbuja y de roco de sistema ideales 57
Evaporacin instantnea o destilacin flash 60
Unidad de competencia III
Equilibrio termodinmico de sistemas reales
Coeficiente de actividad () 65
Equilibrio Lquido Vapor de sistemas reales 74
Algoritmos para el clculo de Burb P, Roco P, Burb T, Roco T y Flash PT 76
Sistemas azeotrpicos 80
Bibliografa
PRESENTACIN
La Unidad de Aprendizaje (UA) de Equilibrios Termodinmicos pertenece al rea
sustantiva y pretende que el estudiante se capacite en la determinacin de las
condiciones de equilibrio de componentes puros y de sistemas multicomponentes, lo
cual constituye una de las bases del quehacer profesional del ingeniero qumico sobre
todo; de aquellos que estn orientados a la ingeniera de procesos; su importancia
estriba en que representa la base fundamental del conocimiento termodinmico de los
procesos qumicos industriales. Las herramientas que se utilizan para lograr las
competencias de esta UA son de gran aplicacin en el desarrollo de la ingeniera de las
operaciones de separacin y procesos unitarios. Los conocimientos y actitudes, pero
sobre todo las habilidades que se promueven en esta UA, son propios para adquirir el
criterio ingenieril que se requiere en un egresado.
Para cubrir el contenido de esta UA de aprendizaje se requiere la consulta de varias
referencias bibliogrficas. Y aunque en la actualidad existe una amplia disponibilidad de
informacin, el consumo de tiempo para organizarla y los recursos que hay que pagar
para obtenerla siguen siendo elevados. Es por esto que la generacin de informacin
propia, clasificada y adaptada al programa de estudios de cada unidad de competencias
y programa acadmico, seguir siendo una opcin con altos beneficios para toda la
comunidad.
Los apuntes de equilibrios termodinmicos que se presentan en este documento, son
el resultado de la experiencia de numerosos cursos impartidos, junto con las valiosas
aportaciones de muchos de mis alumnos, que atinadamente han hecho para mejorarlos
constantemente.
INTRODUCCIN
En termodinmica, el trmino de equilibrio se emplea no solo para denotar la ausencia
de cambio, sino tambin la ausencia de cualquier tendencia hacia un cambio a escala
macroscpica. As, un sistema en equilibrio es aquel que existe bajo condiciones tales
que no hay ninguna tendencia para que se presente un cambio de estado.
En los procesos qumicos industriales se obtienen productos que difieren en la
naturaleza qumica de las materias primas utilizadas. Una planta qumica comprende
diferentes tipos de operaciones, como reacciones qumicas, separacin de productos,
separacin de fases, entre otras, que se realizan ya sea por lotes o en forma continua.
Algunas operaciones de transferencia de materia (Difusin, smosis inversa,
Permeacin, Separaciones cromatogrficas, Electrodilisis, etc.) son operaciones de No
equilibrio, por lo tanto el mximo grado de separacin alcanzable no se puede predecir
a partir de las propiedades termodinmicas de las especies. Sin embargo, para las
operaciones de interfase (Condensacin, Destilacin, Vaporizacin flash, Absorcin,
Extraccin, Secado, etc.) las fases se ponen en contacto en etapas. Si se deja suficiente
tiempo de contacto en la etapa, las especies qumicas se distribuirn en las fases de
acuerdo con las consideraciones termodinmicas del equilibrio.
El equipo industrial no siempre consta de etapas (tales como platos en una columna)
que representan etapas de equilibrio. Con frecuencia en un solo contacto se alcanza
solamente una fraccin del cambio desde las condiciones iniciales hasta el estado de
equilibrio.
Desde el punto de vista del anlisis de los procesos industriales, los ingenieros sabemos
que todos los procesos qumicos se ven afectados por las propiedades fisicoqumicas
de las sustancias y del medio con el que se ponen en contacto.
Las variables de las cuales depende un proceso son:
*Caractersticas de las sustancias
*Estado fsico de las sustancias
*Condiciones de Presin y Temperatura
*Composicin
En ingeniera qumica, las dos disciplinas que se encargan del estudio de los procesos
fisicoqumicos son:
1) Fenmenos de Transporte
a) Calor: La transferencia de calor se lleva a cabo del punto de mayor
temperatura al de menor temperatura.
PROCESO
FISICOQUMICO
Entrada Salida
Energa
Medio
Figura 1. Un sistema en equilibrio puede describirse como aquel que tiene un balance exacto
Impacto
Ambiental
b) Masa: La transferencia de masa se lleva a cabo del punto de mayor
concentracin al de menor concentracin.
c) Momentum: La transferencia de cantidad de movimiento sucede gracias
a un gradiente de presin. A mayor altura mayor presin, as como
mayor energa potencial.
Los procesos se llevan a cabo debido a un gradiente y terminan cuando se alcanza una
condicin de equilibrio.
2) Termodinmica
a) Entropa. En equilibrio, AS = 0, si no se controla el proceso, la energa
contina creciendo
b) Energa libre de Gibbs. Si AG es negativo, se lleva a cabo el proceso o
reaccin.
La presencia de un cambio en el sistema que no est en equilibrio, depende de la
resistencia y de la fuerza impulsora.
UNIDAD DE COMPETENCIA 1
EQUILIBRIO
TERMODINMICO DE
COMPONENTES PUROS
CRITERIOS DE EQUILIBRIO Y LA SEGUNDA LEY DE LA TERMODINMICA
Considerando un sistema multicomponente
t es el tiempo y Y representa cualquier variable medible que pemita darle seguimiento
al proceso Y=f(t). La dinmica del proceso est regida por los fenmenos de
transferencia:
( )
( ) ...
...
f
t
Y
f
dt
dY
=
c
c
=
Prcticamente el proceso termina cuando se alcanza una condicin de equilibrio
termodinmico que no es funcin de t. Este punto marca los lmites termodinmicos,
de ah que no existan conversiones del 100% en las reacciones qumicas ni procesos
totalmente eficientes, porque prcticamente es imposible rebasar el lmite
termodinmico (condiciones de equilibrio).
Del sistema multicomponente anterior podemos decir que en el equilibrio
termodinmico tendremos:
| o
T T = Potencial trmico
| o
P P = Potencial mecnico
| | | |
| o
i i
x x = Es potencial pero No es un indicador de equilibrio
Fase | [x
i
|
]
T
|
, P
|
Dinmica
del
Proceso
Y
t
Equilibrio
Equilibrio
Fase o [x
i
o
]
T
o
, P
o
Cuando el sitema no est en equilibrio existen potenciales de cambio que llevan a cabo
el proceso hasta el equilibrio.
AT = 0 potencial trmico
AP = 0 potencial mecnico
AC
i
= 0 potencial qumico
CRITERIOS DE EQUILIBRIO TERMODINMICO
Las condiciones que deben cumplirse en cualquier sistema en equilibrio, se llaman
Criterios de Equilibrio y constituyen la base de las relaciones completas entre las
diversas propiedades de un sistema en equilibrio.
AT = 0,
| o
T T =
AP = 0,
| o
P P =
A
i
= 0,
| o
i i
=
La segunda ley de la termodinmica nos dice que:
0 > AS
= A 0 S Para los procesos reversibles (en el equilibrio)
> A 0 S Para los procesos irreversibles
Para la termodinmica, el estado de equilibrio es un proceso reversible porque
microscpicamente no es ms que fuerzas que se compensan mutuamente.
Entonces otro criterio de equilibrio es AS = 0
Por lo tanto, buscaremos manipular a la entropa en trminos de variables medibles, las
variables que podemos manipular son: T, P y composicin: AS = f(T, P, composicin)
Aunque no existe esta funcin, se pueden hacer los clculos indirectamente a partir de
otras propiedades por medio de las relaciones de Maxwell.
La propiedad termodinmica que relaciona estas tres variables (T, P y composicin) es
la Energa Libre de Gibbs (G).
(13)
1
=
+ =
k
i
i i
dn SdT VdP dG
i
= potencial qumico del componente i
n
i
= nmero de moles del componente i
En general;
0 > AS (proceso espontneo)
0 s AG (el proceso se puede llevar a cabo en la direccin propuesta)
En el equilibrio; dG = 0
(14) 0
1
= + =
=
k
i
i i
dn SdT VdP dG
Y como las condiciones de equilibrio son:
dP = 0 dT = 0
La ecuacin 14 nos queda:
(15) 0
1
=
=
k
i
i i
dn
Para un sistema de dos fases (o y |)
0
1 1 1
= + =
= = =
k
i
i i
k
i
i i
k
i
i i
dn dn dn
| | o o
Haciendo un balance de masa en un sistema cerrado
o |
| o
i i
i i
dn dn
dn dn
=
=
El cambio es de la misma magnitud en sentido opuesto
( )
( ) 0
0
1
1 1
=
= +
=
= =
i
k
i
i i
k
i
i i
k
i
i i
dn
dn dn
| o
o | o o
| o
i i
=
Otro criterio de equilibrio (potencial qumico)
TERMODINMICA DEL EQUILIBRIO DE UN COMPONENTE PURO
Si un profesor preguntara a sus alumnos de termodinmica Cmo se encuentra el agua
a 40C?, el ms atrevido contestara que tibia y en fase lquida. Porque el osado alumno
estara suponiendo que la presin a la cual se encuentra dicha agua, es la atmosfrica.
Sin embargo; si la presin a la cual se encuentra el agua referida por el profesor, fuese
de 7.35 kPa el agua estara en equilibrio con su vapor y si la presin fuese inferior a sta,
estara en fase vapor.
Si ahora el compuesto no es el agua, sino el alcohol cetlico y tuviera necesidad de
comprarlo, Cmo lo solicitara, en kilogramos o en litros?
Cuando se est familiarizado con algunos compuestos de uso comn, es fcil saber el
estado de agregacin de stos en condiciones ambientales. Pero cuando no, se
requiere informacin del equilibrio de fases de dicho compuesto para caracterizarlos.
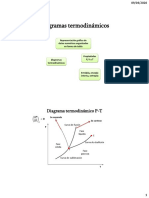
La informacin mnima necesaria puede ser el diagrama de fases Presin Temperatura
(PT) donde se identifiquen las coordenadas del punto triple (pt) y del punto crtico (pc).
Para saber el estado fsico del compuesto representado en la figura 1 a Presin (P) y
Temperatura (T) dadas, las posibilidades seran:
1. Si T<T
pt
el compuesto puede estar como Slido, como Vapor o en Equilibrio
Slido Vapor.
Para definir la fase con mayor precisin se debe evaluar la condicin de P-T en el
equilibrio correspondiente.
Por ejemplo a la T dada se evala la presin de saturacin (P
sat
) como slido y
luego comparamos:
Si P > P
sat
se trata de un slido
Si P < P
sat
se trata de un vapor
Si P = P
sat
se trata de un equilibrio slido vapor
A
Pt
B
D
C
Pc
P
T
Fig. 1 Representacin esquemtica del diagrama de fases PT de un componente puro
P
c
P
pt
T
pt
T
c
Slido
Lquido
Vapor
2. Si T > T
pt
el compuesto puede estar como Slido, como Lquido, como Vapor, en
Equilibrio Slido Lquido o en Equilibrio Lquido Vapor.
Usando la P como indicador:
Si P > P
sat
el compuesto puede estar como Slido, como Lquido, como Vapor, en
Equilibrio Slido Lquido o en Equilibrio Lquido Vapor.
Si P < P
sat
implica que es un vapor.
Para definir con precisin la fase hay que determinar las condiciones de los
equilibrios SL y LV.
A la T dada calculamos con la ecuacin del equilibrio L-V la P
sat
.
Si P < P
sat
se trata de un vapor
Si P > P
sat
se trata de un lquido
Si P = P
sat
se trata de un equilibrio lquido vapor
A la T dada calculamos con la ecuacin del equilibrio S-L la P
sat
.
Si P > P
sat
se trata de un slido
Si P
sat
ELV < P < P
sat
ESL se trata de un lquido
Si P = P
sat
se trata de un equilibrio slido lquido.
COMPORTAMIENTO PVT DE SUSTANCIAS PURAS
Podemos representar cualquier estado de un sistema de un componente por un punto
en un diagrama de dos dimensiones P-T, donde cada punto corresponde a una
temperatura y presin definidas. Este diagrama se denomina diagrama de fases.
La lnea A B, es la curva de sublimacin, que separa las regiones slida y
gaseosa, y representa la presin de vapor de un slido puro.
En B C, se localiza la curva de vaporizacin, que separa las regiones gaseosa y
lquida, y podemos encontrar representada la presin de vapor del lquido puro
a temperaturas mayores a las de su punto triple.
En B D, se encuentra el equilibrio slido lquido, representado por la curva de
fusin, que separa las regiones slidas y lquida y representa el equilibrio slido
lquido.
Figura 1. Diagrama de fases PT de una sustancia pura
Las tres lneas antes mencionadas, convergen en el punto triple. El punto triple es
aquel en el que el slido, lquido y vapor estn en equilibrio mutuo a una temperatura y
presin definida. El punto triple del agua se usa como referencia para la escala de
temperaturas termodinmicas.
De acuerdo con la regla de las fases, (F = 2 - t + N, donde t es el nmero de fases y N el
nmero de especies qumicas); el punto triple es invariable.
El Punto C es el punto crtico (P
c
, T
c
), que representa la mayor temperatura y presin
para las que una especie qumica pura pueda existir en equilibrio vapor - lquido.
En general, una fase se considera como lquida si puede vaporizarse por disminucin de
presin a temperatura constante, mientras que se considera vapor si puede
condensarse mediante una reduccin de la temperatura a presin constante.
El comportamiento del equilibrio lquido vapor es lineal, pero a diferencia de la
mayora de los compuestos: para el agua este comportamiento tiene una ligera
pendiente negativa, dado que el volumen en la fase slida es mayor que en la fase
lquida, esta es la razn tambin por la cual el hielo flota en el agua.
Fig. 2 Diagrama de fases P-T del agua pura
ANALSIS DE LOS DIFERENTES EQUILIBRIOS DE UNA SUSTANCIA PURA
EN UN DIAGRAM P-H
L V
h h H = A
Calor latente
En geral para cualquier sustancia:
Fusin V S V
H H H A > A > A
P
H
P
C
H
L
H
V
Equilibrio | - o
P
P
2
Fase | (L)
dP
P
1
Fase o (V)
T
T
1
T
2
dT
De la segunda ley de la termodinmica sabemos que;
T
Q
S = A
Adems en el equilibrio
0 = = SdT VdP dG
Entonces para las dos fases y
dT S S dP V V
dT S dT S dP V dP V
dT S dP V dT S dP V
) ( ) (
| o | o
| o | o
| | o o
=
=
=
Para todos los estados de transicin, esta ltima ecuacin escrita de la forma
) (
) (
| o
| o
V V
S S
dT
dP
=
Se conoce como ECUACIN DE CLAPEYRON
ECUACIN DE CLAUSIUS-CLAPEYRON
Particularmente para el equilibrio V-L, la ecaucin de Clapeyron es:
) (
) (
L V
L V
V V
S S
dT
dP
=
Donde
T
H
T
Q
S S S
o| o|
| o o|
A
= = = A
;
T
Q
S S S
VL
L V VL
= = A
;
T
h h
T
H
Q
L V VL
VL
=
A
=
T
h h
S S S
L V
L V VL
= = A
Obtenindose la ecuacin de la forma:
) (
L V
L V
V V T
h h
dT
dP
=
Consideraciones prcticas del sistema V L:
- A condiciones por debajo del punto crtico:
V L V V L
V V V V V ~ <<
- El vapor es un gas ideal:
P
RT
V RT PV
V
= =
- Para AT reducidas:
. . Cte H Cte h h
vap L V
~ A ~
De acuerdo con las consideraciones anteriores, se obtiene
V
vap
TV
H
dT
dP A
=
;
) / ( P RT T
H
dT
dP
vap
A
= ;
2
T
P
R
H
dT
dP
vap
A
=
2
T
dT
R
H
P
dP
vap
A
=
Esta ltima expresin se conoce com Ecuacin de Clausius Clapeyron
Suponiendo H
vap
independiente de la temperatura e integrando dicha ecuacin sin
lmites, se obtiene la expresin de una lnea recta:
C
T R
H
P
vap
+
A
=
1
ln
Esquemticamente:
Con el valor de la pendiente de la grfica es posible conocer el -AH
vap
, es decir; la
cantidad de calor necesaria para que una unidad de masa de la sustancia cambie de
fase de L-V.
Si la integracin de la ecuacin de Clausius Clapeyron se hace entre los lmites: P1, T1 y
P2, T2, manteniendo la consideracin del H
vap
independiente de la temperatura, la
expresin que se obtiene es:
R
H
m
vap
A
=
Ln P
(1/T) ;[K]
|
|
.
|
\
|
A
=
|
|
.
|
\
|
2 1 2
1
1 1
T T R
H
P
P
Ln
vap
Si P
2
= 1 atm, T
2
es la temperatura de ebullicin normal del lquido (T
b
) y entonces:
b
vap vap
RT
H
RT
H
LnP
A
+
A
=
Esta ecuacin permite calcular la presin de vapor en equilibrio con el lquido para una
sustancia pura a una temperatura dada.
Anlisis de Equilibrio S-L:
P
Fase | (S)
P
2
dP
P
1
Fase o (L)
T
1
T
2
T
dT
| o
| o
V V
S S
dT
dP
=
;
S L
S L
V V
S S
dT
dP
=
;
T
H
T
Q
S S S
SL SL
S L SL
A
= = = A
T
h h
T
H
S
S L SL
SL
=
A
= A
;
= = A
T
h h
S S S
S L
S L SL
) (
S L
S L
S V T
h h
dT
dP
=
Consideraciones:
) (
.
.
L S
fusin
fusin
h h H
Cte H
Cte V
A
~ A
= A
Para encontrar AH de diversas sustancias, se hace uso del concepto de punto triple,
como se muestra en el siguiente ejemplo.
PRESIN DE VAPOR O PRESIN DE SATURACIN
La presin de vapor es la presin ejercida por un componente puro en equilibrio a
cualquier temperatura cuando coexisten la fase lquida y vapor. Cada punto de presin
y temperatura conforman el equilibrio Lquido Vapor. Este equilibrio se extiende
desde el punto triple hasta el punto crtico.
La presin ejercida sobre una mezcla slido-vapor tambin se llama presin de vapor
pero normalmente slo est disponible en tabas de datos experimentales para
compuestos comunes que subliman. En este caso, cada punto de presin y
temperatura conforman el equilibrio Slido Vapor. Este equilibrio termina en el punto
triple.
ln(T
1
/T
2
)
P
S L
fusin
V V
H
m
A
=
Mtodos para determinar la presin de vapor
Mtodos de Correlacin
Ecuacin de Clapeyron
La ecuacin de Clapeyron (Ec. 1) puede aplicarse tanto al equilibrio L V como al S V
2
T
dT
R
H
P
dP A
=
(1)
Para el equilibrio L V se conoce como ecuacin de Clausius Clapeyron (Ec. 2)
2
T
dT
R
H
P
dP
vap
A
=
(2)
Suponiendo H
vap
independiente de la temperatura e integrando sin lmites, se obtiene
la expresin de una lnea recta:
v l
vap
sat
C
T R
H
P
+
A
=
1
ln
(3)
Para el equilibrio S V la ecuacin correspondiente es:
2
T
dT
R
H
P
dP
sub
A
=
(4)
Suponiendo H
sub
independiente de la temperatura e integrando sin lmites, se obtiene
la expresin de una lnea recta:
v s
sub
sat
C
T R
H
P
+
A
=
1
ln
(5)
PR10. El sistema formado por cloroformo (1) y Agua (2) tienen un comportamiento que puede
describirse perfectamente por la ley de Raoult. La presin de vapor de los componentes puros
est dada por la ecuacin de Antoine:
()
()
A B C
cloroformo 6.95465 1130.966 226.282
agua 8.1076 1750.286 23.000
Determine el punto de ebullicin usando el diagrama de fases y el mtodo analtico a una
presin de 558 mmHg.
Solucin:
Usando la ecuacin de Antoine obtenemos para cada componente:
Agua
T
b
= 91.5 C
Cloroformo
T
b
= 52.038 C
Mtodo grfico.
Presiones de vapor para cloroformo y agua
Temperatura Presin de vapor, mmHg
x
i
y
i
C cloroformo agua
52.038 558 102.31 1 1
62.038 780.92 164.13 0.64 0.89
72.038 1068.54 255.33 0.37 0.71
82.038 1432.66 386.28 0.16 0.42
91.5 1858.92 558 0 0
T
x1,y1
Diagrama T,xy del sistema Cloroformo(1)/Agua(2)
T,x
T,y
y1
x1
Diagrama x1,y1 del sistema Cloroformo (1)/Agua (2)
Mtodo Analtico.
x
1
=0.5
P=558 mmHg
( )( )
kPa P
C T x T x T
T T
x x
P
P
sat
sat
712 . 4123
5 . 0 2404 . 0 5 . 0
726 . 76
240373 . 0
5585 . 72
1 0 exp
552 . 218
74 . 2548
170 . 230
70 . 3885
7324 . 13 3872 . 16 exp
5 . 0 5 .. 0
558
2
12
*
2 2
*
1 1 0
22
12
22 12 22 2 12 1
2
=
+
=
=
= + =
= =
(
+
+
+
=
+
=
+
=
o
o
o
o o o o
8162 . 0
726 . 76
247 . 125 ) 5 . 0 (
247 . 125 1
7553 . 67
247 . 125
2252 . 0
7553 . 67 ' '
247 . 125
5 . 0 ) 2252 . 0 )( 5 . 0 (
726 . 76
2252 . 0
3593 . 67 552 . 218
712 . 123 ln 7324 . 17
34 . 2548
ln
1
2
12
2
12
2
= =
=
=
=
=
=
=
+
=
=
=
=
y
kPa sat P
C T
kPa P
C T
kPa P
C C
P A
B
T
sat
sat
i sat
i
i
o
o
PR11. Para el sistema formado por Acetonitrilo (1) y Nitrometano (2) tienen un
comportamiento que puede describirse perfectamente por la ley de Raoult. La presin de
vapor de los componentes puros est dada por las ecuaciones de Antoine:
a) Prepare el diagrama de fases [P, (x, y)] a una temperatura de 75C
b) Dibuje el diagrama de fases [T, (x,y)] a 70kPa de presin.
c) Determine Burb P, Roco P, Burb T, y Roco T
Solucin:
a) Tomando en cuenta que para el componente 1: y
1
P = x
1
P
1
0
y para el componente 2: y
2
P =
x
2
P
2
0
, sumamos las ecuaciones y finalmente tendramos que:
( )
0
2
0
2
0
1 1
P P P x P + =
que es la ecuacin de una lnea recta. Para obtener y
1
ocupamos:
P
P x
y
0
1 1
1
=
Con estas ecuaciones, se obtienen los resultados para resolver el primer inciso, de tal
forma que:
xi 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
P(kPa) 41.98 46.103 50.226 54.349 58.472 62.595 66.718 70.841 74.964 79.087 83.21
yi 0 0.1805 0.3313 0.4593 0.5692 0.6647 0.7483 0.8822 0.8880 0.9469 1.0
209 ) (
64 . 2972
2043 . 14 ) ( ln
224 ) (
47 . 2945
2724 . 14 ) ( ln
0
2
0
1
+
=
+
=
C T
kPa P
C T
kPa P
b) Para el diagrama T
xy
a 70 kPa
Tomamos en cuenta que: segn la ecuacin (10)
T
1
sat
= 69.84C
a 70kPa
T
2
sat
= 89.59C
Calculamos los datos mediante:
P
P x
y
P P
P P
x
i
0
1 1
0
2
0
1
0
2
1
=
=
P
x1,y1
Diagrama P,xy del sistema Acenotrilo(1)/Nitrometano(2)
P,x1
P,y1
Mediante las ecuaciones presentadas en el primer inciso, obtenemos los siguientes
resultados:
T
sat
(C) X y P
1
sat
(kPa) P
2
sat
(kPa)
69.84 1 0.9998 69.99 34.789
70 0.9895 0.9947 70.37 34.80205
75 0.67965 0.8078 83.207 41.98
80 0.41416 0.5788 97.842 50.317
85 0.1846 0.3018 114.4496 59.936
88 0.06128 0.1098 125.435 66.381
89.58 0.00013 0.00024 131.5462 69.9916
T
x1,y1
Diagrama T,xy del sistema Acetonitrilo(1)/Nitrometano(2)
T,x1
T,y1
Para determinar las condiciones de equilibrio:
- Burb P
x
1
= 0.6; T = 75C.
Sustituyendo en las siguientes frmulas:
sat sat
P x P x P
21 2 1 1
+ =
P
P x
y
sat
1 1
1
=
Obtenemos estos resultados:
grficamente analticamente
P 67 66.7
y
1
0.72 0.748
- Roco P
y
1
= 0.6; T= 75C. De acuerdo a las frmulas:
sat
sat sat
P
P y
x
P
y
P
y
P
1
1
1
2
2
1
1
1
=
+
=
Los resultados son:
Grficamente Analticamente
P 62 59.74
x
1
0.45 0.427
- Burb T
X
1
= 0.6; P = 70 kPa
La secuencia para obtener los resultados es de la siguiente forma:
( )( )
kPa P
C T x T x T
T T
x x
P
P
sat
sat
397 . 44
4 . 0 9611 . 1 6 . 0
70
96113 . 1
736 . 77
1 0 exp
209
64 . 2972
224
47 . 2945
2043 . 14 2724 . 14 exp
4 . 0 6 . 0
70
2
12
*
2 2
*
1 1 0
22
12
22 12 22 2 12 1
2
=
+
=
=
= + =
= =
(
+
+
+
=
+
=
+
=
o
o
o
o o o o
Con la presin de saturacin obtenida, se calcula T:
747 . 0
70
17886 . 87 ) 6 . 0 (
17886 . 87
4229 . 76
2317 . 44
97095 . 1
43 . 76 ' '
24378 . 44
4 . 0 ) 97023 . 1 )( 6 . 0 (
70
97023 . 1
52 . 76 209
397 . 44 ln 2043 . 14
64 . 2972
ln
1
1
*
*
2
12
2
12
2
= =
= =
=
=
=
=
=
+
=
=
=
=
y
kPa P
P
P
C T
kPa P
C T
kPa P
C C
P A
B
T
sat
i
k
sat
sat
i
sat
i
i
o
o
o
Por lo tanto,
Grficamente Analticamente
T 77 76.42
y
1
0.8 0.747
- Roco T
y
1
= 0.6; P = 70 kPa
La secuencia de los clculos que se deben realizar se da de la siguiente forma:
|
|
.
|
\
|
+
|
|
.
|
\
|
=
22
2
12
1 *
2
o o
y
P
y
P P
Tomamos
en cuenta
que, como
ya se haba
mencionad
o,
22
= 1.
C T
kPa P
C T
kPa P
C
C
T
kPa P
T T
C T
y
y
P P
T y T y T
sat
sat
sat sat
=
=
=
=
=
=
=
=
=
(
+
+
+
=
= + =
|
|
.
|
\
|
+ =
+ =
5737 . 79
565 . 49
947593101 . 1
5737 . 79
55858727 . 49
9481796 . 1
493185 . 79 209
ln 2043 . 14
64 . 2972
4162 . 49
961131581 . 1
209
64 . 2972
224
4547 . 29
2043 . 14 2724 . 14 exp
736 . 77 ) 58 . 89 )( 4 . 0 ( ) 84 . 69 )( 6 . 0 (
*
2
12
*
2
12
2
12
0
2
12
1
2
2 2 1 1 0
o
o
o
o
Con las ecuaciones de Antoine y Raoult:
435 . 0
6 . 0
532452 . 96
*
1
*
1
= =
=
P
P
y
kPa P
DESTILACIN FLASH
PR12. Se alimenta una mezcla lquida de n-hexano y n-octano; dicha mezcla contiene 60% en mol
de n-hexano y se vaporiza la mitad de la alimentacin en una cmara flash a 1 atm. Calcule las
composiciones de las corrientes de salida.
Tabla 1. Datos de equilibrio del n-hexano en fraccin molar:
x
n-hex
1.000 0.684 0.400 0.190 0.045 0.000
y
n-hex
1.000 0.928 0.780 0.535 0.178 0.000
Con los datos de la tabla 1, se realiza el diagrama para n - hexano:
1) Primero se localiza el porcentaje en mol que contiene la alimentacin ( x = 0.60)
2) Se traza la lnea con la pendiente que se vaporiza de la alimentacin, + = 0.5, ya que la
pendiente es m = -1.
3) De acuerdo al diagrama, Y
vap
= 0.79 y X
liq
= 0.42
De acuerdo a lo anterior, las composiciones son:
1 0
1
X = 0.6
1
2
3
3
X = 0.42
Y = 0.79
z = 0.6
P
T
y
n hex
= 0.79
y
n oct
= 0.21
x
n hex
= 0.42
x
n oct
= 0.58
PR13. Ahora suponga que se vaporiza el 60% de la alimentacin encuentre las composiciones
del equilibrio. y
i
y las x
i
.
Tomando en cuenta que + = 0.6, sustituyendo en la pendiente:
66667 . 0
6 . 0
4 . 0
6 . 0
6 . 0 1
= |
.
|
\
|
= |
.
|
\
|
= m
Por lo que, de acuerdo al diagrama, se encuentran las siguientes composiciones:
Y
vap
= 0.75 X
liq
= 0.38
y
n hex
= 0.75 x
n hex
= 0.38
y
n oct
= 0.25 x
n oct
= 0.62
COEFICIENTE DE ACTIVIDADAD
PR14. A partir de datos de EVL (tres primeras columnas) de la tabla 11.2 se han
obtenido: Los coeficientes de actividad (
1
y
2
), los parmetros de la ecuacin de
Margules (A
12
y A
21
) y la ecuacin de la energa de Gibbs en exceso para el sistema
metiletilcetona (1)/ tolueno(2) a 50C
PR15. Para el sistema binario etanol/iso-octano a 50C.
Se tiene:
84 . 9 ; 17 . 21
2 1
= =
.
Determine:
a)
'
21
'
12
, A A
de las ecuaciones de Van Lar.
b)
21 , 12
A A
para las ecuaciones de Wilson.
c) Utilizando la ecuacin de la ley de Raoult modificada, realizar la grfica (curva de equilibrio
x
1
,y
1
) utilizando los valores de obtenidos a partir de las ecuaciones de Van Lar y a partir de
la ecuacin de Wilson.
Van Lar:
2
1
'
12
2
'
21 '
21 2
2
2
'
21
1
'
12 '
12 1
1 ln
1 ln
|
|
.
|
\
|
+ =
|
|
.
|
\
|
+ =
x A
x A
A
x A
x A
A
=
1
'
12
ln A
si x
1
=0;
=
2
'
21
ln A
si x
2
=0
Ley de Raoult modificada:
P
p x
y
*
1 1 1
1
=
o bien;
*
2 2 2
*
1 1 1
*
1 1 1
1
p x p x
p x
y
+
=
T C
B
A p
+
=
*
ln Constantes de Antoine de Smith, Van Ness, pp.529
kPa e p 4919 . 29
50 45 . 226
49 . 3674
6758 . 16
*
1
=
|
.
|
\
|
+
=
T C
B
A p
+
=
*
10
log A=6.93637, B=1335.779, C=213.022
kPa
mmHg
Pa
mmHg p 063 . 8
760
10 * 013 . 1
49 . 60
50 022 . 213
779 . 1335
93637 . 6
5
10
*
2
=
|
|
.
|
\
|
=
|
.
|
\
|
+
=
x
1
1
2
P(x
1
1
p
1
*
+ x
2
21
p
2
*
) y
1
0.0 21.17 - 0
0.1 10.1235 1.0388 37.29 0.79
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
0 0.2 0.4 0.6 0.8 1
y
x
Etanol(1)/iso-octano(2)
0.2 5.562 1.1539 40.09 0.81
0.3 3.4383 1.3537 37.87 0.80
0.4 2.3502 1.6604 35.58 0.77
0.5 1.7504 2.1116 34.125 0.75
0.6 1.4029 1.7651 33.67 0.74
0.7 1.1975 3.7070 33.49 0.73
0.8 1.0789 5.0637 33.37 0.75
0.9 1.01818 7.0189 32.42 0.82
1.0 9.839 - -
Como se ve en el grfico no existe equilibrio ideal entre y y x. No se cumple la regla de para
cada valor de x existe un valor de y, ya que los valores de y se repiten; por ejemplo y=0.75.
Wilson:
12 21 2
21 12 1
1 ln ln
1 ln ln
A + A =
A + A =
12 21
21 12
ln 1 28645 . 2
ln 1 05258 . 3
A A =
A A =
El mtodo ms fcil es por prueba y error
25 . 0
1 . 0
21
12
= A
= A
x
1
x
2
1
2
P y
1
0 1.0 21.17 1.000 8.063 -
0.1 0.9 6.60 1.054 27.11 0.71
0.2 0.8 3.75 1.1617 29.96 0.722
0.3 0.7 3.18 1.3107 35.81 0.792
0.4 0.6 1.9990 1.5107 30.78 0.763
0.5 0.5 1.63 1.784 31.22 0.77
0.6 0.4 1.38 2.1745 31.43 0.7772
0.7 0.3 1.21 2.7648 31.66 0.7785
0.8 0.2 1.10 3.7386 31.98 0.79
0.9 0.1 1.028 5.5697 31.77 0.81
1.0 0 1.000 9.8384 29.78 0.85
CONDICIONES DE EQUILIBRIOS DE SISTEMAS REALES
PR16. Para el sistema 2-propanol(1)/agua(2), los siguientes valores de los parmetros de la
ecuacin de Wilson son:
92 . 76
98 . 437
1
12
=
=
V
a
mol cm V
mol cal a
/ 07 . 18
/ 0 . 1238
3
2
21
=
=
Adems, se tienen las siguientes ecuaciones de Antoine, donde T est en K y P en kPa.
kPa p
kPa p
38 . 47
13 . 46 15 . 353
44 . 3816
2887 . 16 exp
59 . 92
54 . 53 15 . 353
2 . 3640
678 . 16 exp
*
2
*
1
=
|
.
|
\
|
=
=
|
.
|
\
|
=
Utilizando la ecuacin de Raoult modificada, determine las condiciones de equilibrio del punto
de burbuja, BURB P, a 353.15K y x1=0.25.
Solucin:
7292 . 0 exp
1258 . 0 exp
21
2
1
21
12
1
2
12
= |
.
|
\
|
= A
= |
.
|
\
|
= A
RT
a
V
V
RT
a
V
V
Al sustituir estos valores se obtiene:
( ) ( )
( ) ( )
( ) ( ) ( ) 1743 . 0 4168 . 0 25 . 0 7292 . 0 25 . 0 75 . 0 ln ln
7535 . 0
7292 . 0 25 . 0 75 . 0
7292 . 0
1258 . 0 75 . 0 25 . 0
1258 . 0
75 . 0 1258 . 0 75 . 0 25 . 0 ln ln
2
1
= + =
=
|
|
.
|
\
|
|
|
.
|
\
|
+
+
+ + =
1244 . 2
1
= 1904 . 1
2
=
Como
1 = u
i
, entonces: ( ) ( ) ( ) ( ) kPa P 47 . 91 38 . 47 1904 . 1 75 . 0 59 . 92 1244 . 2 25 . 0 = + =
Con:
P
p x
y
i
i i i
i
u
=
*
462 . 0 538 . 0
2 1
= . = y y
PR17. Para el sistema 2-propanol(1)/agua(2), los siguientes valores de los parmetros de la
ecuacin de Wilson son:
92 . 76
98 . 437
1
12
=
=
V
a
mol cm V
mol cal a
/ 07 . 18
/ 0 . 1238
3
2
21
=
=
Adems, se tienen las siguientes ecuaciones de Antoine, donde T est en K y P en kPa.
kPa p
kPa p
38 . 47
13 . 46 15 . 353
44 . 3816
2887 . 16 exp
59 . 92
54 . 53 15 . 353
2 . 3640
678 . 16 exp
*
2
*
1
=
|
.
|
\
|
=
=
|
.
|
\
|
=
Utilizando la ecuacin Gama Phi, determine las condiciones de equilibrio del punto de
burbuja, BURB P, a 353.15K y x1=0.25.
Solucin:
Primero calculamos
1
y
2
ij
Tc
ij
Pc
ij
Vc
ij
Zc
ij
w
ij
Tr
ij
B B Bij
11 508.3 47.62 220.00 0.248 0.668 0.6947 -0.6728 -0.6552 -985.48
22 647.1 220.55 55.90 0.229 0.345 0.5457 -1.0292 -2.0503 -423.56
12 573.51 94.90 119.83 0.2385 0.506 0.6157 -0.8338 -1.1797 -719.20
( ) ( ) ( ) mol cm / 36 . 29 56 . 423 48 . 985 20 . 719 2
3
12
= = o
( ) ( ) ( )
( )
( ) ( ) ( )
( )
99339 . 0
15 . 353 8314
36 . 29 538 . 0 47 . 91 38 . 47 47 . 91 56 . 423
exp
00018 . 1
15 . 353 8314
36 . 29 462 . 0 47 . 91 59 . 92 47 . 91 48 . 985
exp
2
2
2
1
=
|
|
.
|
\
|
+
= u
=
|
|
.
|
\
|
+
= u
Se obtiene la P mediante:
i
i i i
p x
P
u
=
*
kPa P 74 . 91
99339 . 0
38 . 47 * 1904 . 1 * 75 . 0
00018 . 1
59 . 92 * 1244 . 2 * 25 . 0
= |
.
|
\
|
+ =
kPa P 27 . 0 47 . 91 74 . 91 = = A
Ahora:
P
p x
y
i
i i i
i
u
=
*
464 . 0
74 . 91 * 99339 . 0
38 . 47 * 1904 . 1 * 75 . 0
536 . 0
74 . 91 * 00018 . 1
59 . 92 * 1244 . 2 * 25 . 0
2
1
= =
= =
y
y
PR18. Determine el punto de burbuja (Burb P) de una mezcla lquida equimolar de 2-propanol
(1)/agua (2) a 90C. Utilice la ecuacin gamma-phi como relacin de equilibrio y la ecuacin de
Wilson para estimar .
Datos para la ecuacin de Wilson
mol
cm
V
mol
cm
V
mol
cal
a
mol
cal
a
3
2
3
1
21
12
07 . 18
92 . 76
1238
98 . 437
=
=
=
=
|
.
|
\
|
A
|
.
|
\
|
A
RT
a
V
V
RT
a
V
V
21
2
1
21
12
1
2
12
exp
exp
sat
iPi xi iP yi
phi gamma Ec
| =
.
T=90C=363.45 K
x
1
=0.5
x
2
=0.5
1
=1
2
=1
Utilizando ecuacin de Antoine
P
sat
1
=137.089 kPa P
sat
2
=70.121 kPa
Ec. De Wilson
5602 . 1
2874 . 1
7655 . 0
1280 . 0
2
1
21
12
=
=
= A
= A
ij Tcij Pciji Vcij Zcij wij Trij Bo B Bij
12
11 508.3 47.62 220 0.248 0.602 0.7144 -0.6398 -0.3673 -904.09
22 647.1 220.55 55.90 0.229 0.345 0.5612 -0.9805 0.-1.8074 -321.28
12 573.51 44.90 119.84 0.2385 0.507 0.6332 0.7937 -1.0333 -662. 27.664
Iteracin P (kPa) y
1
y
2
*
1
2
1 142.943 0.617 0.383 0.998 0.991
2 143.62 0.616 0.384 0.9979 0.9917
3 143.589 0.616 0.384 0..9979 0.9917
4 143.549 0.616 0.384 0.9979 0.9917
PR19. Determine el punto de roco (Roco P) de una mezcla en fase vapor de composicin
y1=0.60 de 2-propanol (1)/agua (2) a 90C. Utilice la ecuacin gamma-phi como relacin de
equilibrio y la ecuacin de Wilson para estimar .
T=100 C=373.15 K
y
1
=0.6 y
2
=0.4
Utilizando ecuacin de Antoine
P
sat
1
=198.045 kPa P
sat
2
=101.826 kPa
Valores iniciales
1
=1
2
=1
1
=1
2
=1
Con P=143.323 kPa
x
1
=0.434 x
2
=0.566
988 . 0
999 . 0
5076 . 201
3862 . 1
4326 . 1
8016 . 0
1301 . 0
2
1
2
1
21
12
=
=
=
=
=
= A
= A
|
|
P
Iteracin x
1
x
2
x
1
x
2
2
1 0.426 0.573 0.426 0.574 1.4026 1.4199
2 0.435 0.560 0.437 0.563 1.3803 1.4374
3 0.442 0.553 0.444 0.556 1.3731 1.4563
4 0.449 0.546 0.451 0.549 1.3535 1.46
5 0.451 0.544 0.453 0.547 1.3498 1.4633
6 0.452 0.543 0.454 0.546 1.3480 1.465
7 0.452 0.542 0.455 0.545 1.346 1.4666
8 0.453 0.542 0.455 0.545 1.346 1.4666
P-Panterior>10
-3
P=202.528 kPa
1
=0.9985
2
=0.9876
Iteracin x
1
x
2
x
1
x
2
2
1 0.455 0.538 0.458 0.542 1.341 1.4716
2 0.4580.457 0.537 0.460 0.540 1.3372 1.4749
3 0.45890.4582 0.5354 0.4612 0.5388 1.3350 1.4769
4 0.45930.4589 0.5346 0.4619 0.5381 1.3338 1.4781
5 0.4593 0.5342 0.4623 0.5377 1.3331 1.4788
P-Panterior>10
-3
P=202.528 kPa
1
=0.9982
2
=0.9875
Iteracin x
1
x
2
x
1
x
2
2
1 0.4624 0.5374 0.4625 0.5375 1.3328 1.4791
P-Panterior>10
-3
P=203.889 kPa
1
=0.9982
2
=0.9875
Iteracin x
1
x
2
x
1
x
2
2
1 0.4626 0.3374 0.4627 0.5373 0.3326 1.4793
PR20. Determine el punto de burbuja (Burb T) de una mezcla lquida equimolar de 2-propanol
(1)/agua (2) a 74.46 kPa. Utilice la ecuacin gamma-phi como relacin de equilibrio y la ecuacin
de Wilson para estimar .
a P= 74.46 kPa y x
1
=0.5
De las ecuaciones de Antoine:
T
sat
1
=347.87 K T
sat
2
=364.739 K
To=(xiT
sat
i
)=(0.5*347.87)+(0.5*364.739)=356.305 K
P con Antoine a To
P
sat
1
=105.09 kPa P
sat
2
=53.761 kPa
K T
P
sat
j
sat
j
698 . 346
249 . 36
571 . 1
298 . 1
741 . 0
127 . 0
2
1
21
12
=
=
=
=
= A
= A
1 2
P
sat
1
70.807 69.796
P
sat
2
36.250 35.7335
y
1
0.617 0.617
y
2
0.382 0.383
1
0.9985 0.9982
2
0.9938 0.9937
12
0.1244 0.1243
21
0.7056 0.7044
1
1.3137 1.3142
2
1.5877 1.5883
P
sat
j
35.7336 35.7127
T (K) 346.339 346.325
PR21. Determine el punto de roco (Roco T) de una mezcla equimolar en fase vapor de 2-
propanol (1)/agua (2) a 150kPa. Utilice la ecuacin gamma-phi como relacin de equilibrio y la
ecuacin de Wilson para estimar .
P=150 kPa
y
1
=0.5 y
2
=0.5
1
=1
2
=1
1
=1
2
=1
P
sat
j
=113.376 kPa T=376.329 K
P
sat
1
=221.553 kPa P
sat
2
=113.375 kPa
x
1
=0.3446 x
2
=
0.6585
12
=0.1308
21
=0.8129
1
=1.6031
2
=1.2932
1
=1.018
2
=0.9955
P
sat
j
=82.106 kPa T=367.361 K
P
sat
1
=160.516 kPa P
sat
2
=82.107 kPa
x
1
=0.3446 x
2
=
0.6585
12
=0.1308
21
=0.8129
1
=1.6031
2
=1.2932
1
=1.0027
2
=0.9913
ij Trij B
o
B Bij
12
11 0.740 -0.6 -0.47 -810.1
22 0.582 -0.920 -1.54 -354.1
12 0.656 -0.745 -0.87 -598.8 -7.4
Iteracin x
1
x
2
x
1
x
2
12
21
2
1 o.2922 0.7002 0.2944 0.7056 0.1308 0.7807 1.7938 1.1479
2 0.2612 0.7888 0.2488 0.7512 0.8129 0.9913 2.0590 1.1838
3 0.2275 0.7649 0.2292 0.7708
2.1855 1.1679
4 0.2142 0.7793 0.215 0.785 2.2894 1.1466
5 0.2046 0.7897 0.2058 0.7942 2.3630 1.1369
6 0.1983 0.7965 0.1993 0.8007 2.4185 1.1308
7 0.1937 0.8008 0.1948 0.8052 2.4586 1.1257
8 0.1906 0.8044 0.1916 0.8024 2.4881 1.1225
9 0.1883 0.8067 0.1892 0.8108 2.5108 1.1201
10 0.1866 0.8084 0.1875 0.8125 2.5271 1.1184
11 0.1854 0.8096 0.1863 0.8137 2.5388 1.1173
12 0.1845 0.8104 0.1854 0.8146 2.5476 1.1164
13 0.1839 0.8111 0.1848 0.8152 2.5535 1.1158
14 0.1835 0.8115 0.1844 0.8156 2.5575 1.1154
15 0.1832 0.8118 0.1841 0.8159 2.5605 1.1151
16 0.1830 0.8120 0.1839 0.8161 2.5625 1.1149
17 0.1828 0.8122 0.1837 0.8163 2.5645 1.1147
18 0.1828 0.8123 0.1837 0.8163 2.5645 1.1147
P
sat
j
=81.69 kPa T=367.22325 K
P
sat
1
=159.701 kPa P
sat
2
=81.690 kPa
1
=1.0024
2
=0.9912
Iteracin X
1
X
2
X
1
X
2
12
21
2
1 0.1836 0.8164 0.1836 0.8164 0.1289 0.7803 2.5667 1.1147
2 0.1834 0.8164 0.1834 0.8166 2.5687 1.1145
3 0.1833 0.8165 0.1833 0.8167 2.5697 1.1144
P
sat
j
=81.674Pa
T=367.22 K=94.07 C
PR22. Determine las condiciones de equilibrios del Flash PT, cuando se alimenta una mezcla
equimolar de 2-propanol (1)/agua (2) a 100C y 200kPa. Utilice la ecuacin gamma-phi como
relacin de equilibrio y la ecuacin de Wilson para estimar .
ij Tcij Pciji Vcij Zcij Wij Trij Bo B Bij
12
11 508.3 47.62 220 0.248
0.60
2
0.7225 -0.6269
-
0.5346
-873.2558
22 647.1 220.55 55.90 0.229
0.34
5
0.567
5
-0.9616 -1.7133 -379.1761
12 573.51 44.90 119.84
0.238
5
0.50
7
0.640
3
-0.7782 -0.9797 -640.0734 -27.915
P=200 kPa
P
sat
1
=198.045 kPa y P
sat
2
=101.326 kPa
Proco=185.52 kPa y P burb=205.53 kPa
Si se aplica el mtodo.
V
F
F
V
=
=
=
1
PR23. Determinar las condiciones del punto azeotrpico del sistema 2propanol(1)/agua(2) a
80C.
A partir de las ecuaciones de Antoine y de Wilson a 353.15K tenemos:
1
2
12
21
92.59
47.38
0.1258
0.7292
sat
sat
P kPa
P kPa
=
=
A =
A =
1
2
10.422
3.287
=
=
Se calcula la volatilidad relativa:
x
1
x
2
y
1
y
2
2
K
1
K
2
V
1 1 1 1 1 0.9902 0.5066 1
2 0.3384 0.6616 0.5 0.5 1.6342 1.2925 0.9990 0.9881 1.6198 0.6627 0.6756
3 0.3524 0.6476 0.5708 0.4292 1.5893 1.8185 0.9991 0.9879 1.5754 0.6726 0.6587
4 0.3623 0.6373 0.5714 0.4286 1.5588 1.3259 0.9991 0.9879 1.545 0.680 0.6450
5 0.37 0.63 0.5716 0.4284 1.5380 1.3362 0.9991 0.9879 1.5243 0.6852 0.6347
6 0.3752 0.6248 0.5719 0.4281 1.5237 1.3436 0.9991 0.9879 1.5101 0.6890 0.6275
7 0.3788 0.6212 0.5720 0.4280 1.5140 1.3488 0.9991 0.9879 1.5005 0.6947 0.6228
8 0.3812 0.6188 0.572 0.428 1.5077 1.3523 0.9991 0.9879 1.4942 0.6935 0.6196
9 0.3828 0.6172 0.572 0.428 1.5035 1.3546 0.9991 0.9879 1.4901 0.6947 0.6175
10 0.3838 0.6162 0.5719 0.4281 1.5009 1.3561 0.9991 0.9879 1.4875 0.6954 0.6159
11 0.3845 0.6155 0.5719 0.4280 1.4997 1.3571 0.9991 0.9879 1.4857 0.6959 0.6148
12 0.3850 0.6150 0.572 0.428 1.4978 1.3578 0.9991 0.9879 1.4844 0.6963 0.6142
13 0.3854 0.6146 0.572 0.428 1.4968 1.3584 0.9991 0.9879 1.4839 0.6966 0.6136
0.3856 0.6144 0.512 0.428
( )
1
12
0
20.37
x
o
=
=
( )
1
12
1
0.595
x
o
=
=
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
0
Por lo que se concluye que el azetropo si existe.
Haciendo la ecuacin 3 igual a 1 (para el azetropo) se obtiene:
1
2
0.5117
az
az
= (5)
Para el azetropo las ecuaciones de Wilson son:
( )
12 21
1 1 2 12 2
1 2 12 2 1 21
az az az az
az az az az
Ln Ln x x x
x x x x
| |
A A
= + A +
|
+ A + A
\ .
(6)
( )
12 21
2 2 1 21 2
1 2 12 2 1 21
az az az az
az az az az
Ln Ln x x x
x x x x
| |
A A
= + A
|
+ A + A
\ .
(7)
Adems
2 1
1
az az
x x = (8)
Resolviendo simultneamente las ecuaciones 5, 6, 7 y 8 obtenemos:
1
0.7173
az
x =
Para el azetropo
1 1
az az
x y = , entonces:
1 1
99.83
az sat
az
P P kPa = =
P
V
V
L
V
V
T
f(V)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
1
Vemos entonces que es necesario tener al volumen de forma explcita, por lo tanto; o
despejamos al volumen de la ecuacin de estado o manipulamos la ecuacin del coeficiente de
fugacidad para que quede en funcin del volumen, optaremos por la segunda alternativa;
Para Van der Waals la ecuacin del coeficiente de fugacidad es:
( ) ( )
V
P
RT
P
RT
Z LnZ dV
V
RT
P
RT
Ln
=
=
+ |
.
|
\
|
=
}
2
1
3 ...... .......... 1
1
2
1
|
Sustituyendo (1) e integrando la parte integrable
( )
V
V
RTLnV
V
a
b V RTLn I
dV
V
RT
V
a
b V
RT
I
+ =
|
.
|
\
|
=
} 2
Para eliminar el trmino
V
V
a
V
b V
RTLn I
+
|
.
|
\
|
=
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
2
( )
0
1
0
=
|
.
|
\
|
= =
|
.
|
\
|
=
|
.
|
\
|
V
b V
Lim
V b V Lim ;
V
b V
Lim
V
a
Lim
V
V V
V
Por lo que;
V
a
V
b V
RTLn I +
|
.
|
\
|
=
Entonces sustituyendo en la ecuacin 3
La ecuacin 4 no es dimensionalmente homognea, por lo que es necesario el siguiente
tratamiento matemtico. El factor de compresibilidad (Z) esta dado por:
RT
PV
Z =
y entonces;
P
ZRT
V = .....................................(5)
( )
( )
( ) ( ) 4 ........ .......... 1
1
1
+ |
.
|
\
|
=
+ |
.
|
\
|
=
+ |
.
|
\
|
=
Z LnZ
RTV
a
b V
V
Ln Ln
Z LnZ
RTV
a
V
b V
Ln Ln
Z LnZ
RTV
a
V
b V
Ln Ln
|
|
|
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
3
que al sustituirlo en la ecuacin de Van der Waals (1):
( )
( )
( )
2 2
2
2 2
2
2
2 2
2
RT Z
aP
RT
bP
Z
P
P
RT Z
aP
RT
bP
Z
P
RT
RT
P
P
RT Z
a
b
P
ZRT
RT
P
P
ZRT
a
b
P
ZRT
RT
P
|
.
|
\
|
=
=
(
(
(
(
(
|
.
|
\
|
(
(
(
(
|
.
|
\
|
=
Sea:
( )
2
y
RT
aP
A
RT
bP
B = =
entonces;
( ) ( )
( ) 0
2 2 3
2 2
2
= +
=
=
B Z AP PZ BPZ PZ
B Z PA PZ Z B Z P
Z
AP
B Z
P
P
Dividiendo entre P y agrupando
( ) 0 1
2 3
= + + AB AZ Z B Z
......................(6)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
4
de la literatura se sabe que;
Tc
T
Tc
P
P
Pc
Pc
RTc
b
Pc
Tc R
a
r
=
=
=
=
8
64
27
2 2
Por lo que;
r
r
r
r
T
P
B
T
P
A
8
1
64
27
2
=
=
.................(7)
Todas estas expresiones son adimensionales.
Sustituyendo el volumen por
P
ZRT
V =
y los valores de
2
64
27
r
r
T
P
A = y
r
r
T
P
B
8
1
=
en la
ecuacin (4), obtenemos:
( )
( ) 1
1
2 2
+
|
.
|
\
|
=
+
|
.
|
\
|
|
|
|
|
.
|
\
|
=
Z LnZ
T ZR
aP
RT
bP
Z
P
RT
P
RTZ
Ln Ln
Z LnZ
P
ZRT
RT
a
b
P
ZRT
P
ZRT
Ln Ln
|
|
( )
( ) ( )
( ) ( ) ) 8 ....( .......... .......... 1
1
1
B Z Ln
Z
A
Z Ln
Z LnZ
Z
A
B Z Ln LnZ Ln
Z LnZ
Z
A
B Z
Z
Ln Ln
=
+ =
+ |
.
|
\
|
=
|
|
|
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
5
Esta ecuacin 3, es adimensional y nos permite calcular el coeficiente de fugacidad
utilizando la ecuacin de estado de Van der Waals
c) A partir de condiciones de referencia
Ejemplo 2. Calcular la fugacidad y el coeficiente de fugacidad para el agua a 500C y
5000kP, tomando como referencia la presin de 1kPa y 500C de temperatura.
Solucin:
A T cte RTdLnf dG =
Y entonces
dG
RT
dLnf
1
=
integrando desde el estado de referencia T
*
= 500C y
P
*
=1kPa y si recordamos que a presiones bajas y temperaturas altas se puede
considerar comportamiento ideal, entonces
* *
P f =
( )
( )
*
*
* *
,
,
1
1
1
* * *
G G
RT P
f
Ln
G G
RT
Lnf Lnf
dG
RT
dLnf
P T
P T
f
f
=
|
.
|
\
|
=
=
} }
Sabemos que TS H G = y
* * *
TS H G = entonces
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
6
( ) ( ) | |
|
|
.
|
\
|
=
|
.
|
\
|
(
|
|
.
|
\
|
|
.
|
\
|
= |
.
|
\
|
(
|
|
.
|
\
|
|
.
|
\
|
=
|
.
|
\
|
=
|
.
|
\
|
*
*
*
*
*
*
* *
*
* *
*
1
1
1
1
S
T
H
S
T
H
R P
f
Ln
S
T
H
S
T
H
R P
f
Ln
T
TS H
T
TS H
R P
f
Ln
TS H TS H
RT P
f
Ln
( ) ) 9 ......( .......... .......... ..........
1
*
*
*
(
|
|
.
|
\
|
= |
.
|
\
|
S S
T
H H
R P
f
Ln
De la literatura Smith 5. Ed. Pgina 768, a 500C y 1kPa considerando a estas
condiciones el vapor de agua se comporta como gas ideal tenemos:
K kg kJ S
kg kJ H
=
=
/ 9612 . 10
/ 2 . 3489
*
*
y a 500C y 5000 kPa
K kg kJ S
kg kJ H
=
=
/ 977 . 6
/ 7 . 3433
K kg kJ S
kg kJ H
=
=
/ 9612 . 10
/ 2 . 3489
*
*
Sustituyendo en la ecuacin (9) y utilizando los valores de 8.314 kJ/KgmolK para R y 18
kg/kgmol para el peso molecular del agua, tenemos:
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
7
( )
9543 . 0
5000
61 . 4771
61 . 4771
1
61 . 4771
47 . 8 9612 . 10 977 . 6
773
2 . 3489 7 . 3433
314 . 8
18
*
*
*
= = =
=
=
=
=
(
|
.
|
\
|
=
|
P
f
kPa f
kPa P
P
f
P
f
Ln
d) A partir de Correlaciones Generalizadas
Para calcular los valores de | Ln a partir de los datos del factor de compresibilidad
se tiene:
( ) ) .......( .......... ..........
P
dP
Z Ln
P
1 1
0
}
= |
La integracin se hace a T y composicin constante
Para el factor de compresibilidad Pitzer desarroll la siguiente correlacin:
'
wZ Z Z + =
0
Donde
'
Z y Z
0
son funciones complejas de T
r
y P
r
y w es el factor
acntrico
Sustituyendo
r c r c
dP P P d y P P P = =
en la ecuacin (1), tenemos:
( ) ) .......( .......... ..........
P
dP
Z Ln
r
P
r
r
2 1
0
}
= |
Donde la integral se hace a T
r
constante
Sustituyendo Z por
'
wZ Z Z + =
0
en la ecuacin (2), obtenemos:
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
8
( )
r
r
P P
'
r
r
P
dP
Z w
P
dP
Z Ln
r t
} }
+ =
0 0
0
1 |
que puede escribirse tambin como:
) ...( .......... .......... wLn Ln Ln
'
3
0
| | | + =
donde ( )
r
r
P
P
dP
Z Ln
r
}
=
0
0 0
1 | y ( )
r
r
P
' '
P
dP
Z Ln
r
}
=
0
1 |
Sacando el antilogaritmo a la ecuacin (3), resulta:
( )( ) ) .....( .......... ..........
w
'
4
0
| | | =
( )
r r
o
P T f y y
'
= | |
Tabla E.13 y E.14 Smith 5 Ed.
LAS PROPIEDADES RESIDUALES Y LOS EQUILIBRIOS TERMODINMICOS
La definicin general para las propiedades residuales est dada por:
gi
M M M =
*
Donde M es el valor de cualquier propiedad termodinmica extensiva, como: V, U, H, S
o G
Para la energa libre de Gibbs
gi
G G G =
*
Donde G es el valor de la energa libre de Gibbs y G
gi
es el valor de la energa libre de
Gibbs para un gas ideal a la misma P y T.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
9
Para el volumen;
( ) 1
Como;
*
*
*
=
=
=
=
=
Z
P
RT
V
P
RT
P
ZRT
V
P
ZRT
V
P
RT
V
V V V
gi
gi
Partiendo de la entidad matemtica que dice:
dT
RT
dG
RT RT
G
d
2
1 1
|
.
|
\
|
y como para un componente
TS H G
SdT VdP dG
=
=
Entonces substituyendo en la ecuacin anterior; tenemos:
) .( .......... .......... ..........
2
a dT
RT
H
dP
RT
V
RT
G
d
|
.
|
\
|
Que para un gas ideal nos queda;
) .( .......... .......... ..........
2
b dT
RT
H
dP
RT
V
RT
G
d
gi gi gi
|
|
.
|
\
|
Restando (b) menos (a), resulta:
) .( .......... .......... ..........
2
* * *
c dT
RT
H
dP
RT
V
RT
G
d
|
|
.
|
\
|
a T = cte
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
10
dP
RT
V
RT
G
d
* *
|
|
.
|
\
|
Como; ( ) 1
*
= Z
P
RT
V
( ) ) .........( .......... .......... .......... 1
*
d
P
dP
Z
RT
G
d
|
|
.
|
\
|
Integrando desde P = 0 hasta P y aceptando que cuando P = 0,
0
*
=
RT
G
( ) ) .........( .......... .......... .......... 1
0
*
e
P
dP
Z
RT
G
P
}
=
Derivando con respecto a T
}
|
.
|
\
|
c
c
=
(
(
(
(
(
c
|
|
.
|
\
|
c
P
P
P
P
dP
T
Z
T
RT
G
0
*
de la ecuacin ( c )
P
T
RT
G
T
RT
H
(
(
(
(
c
|
.
|
\
|
c
=
*
Sustituyendo
) ...( .......... .......... ..........
0
*
f
P
dP
T
Z
T
RT
H
P
P
}
|
.
|
\
|
c
c
=
Restando (f) menos ( e); obtenemos la entropa residual a T=cte.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
11
RT
G
RT
H
R
S
* * *
=
( ) ) .........( .......... 1
0 0
*
g
P
dP
Z
P
dP
T
Z
T
R
S
P P
P
} }
|
.
|
\
|
c
c
=
Los datos de
P
T
Z
|
.
|
\
|
c
c
deben de provenir de datos PVT experimentales o las dos
integrales de las ecuaciones (e) y (f) se evalan numricamente o con ayuda de
mtodos grficos.
Si aplicamos la definicin de propiedad residual a la entalpa, obtenemos
gi
H H H =
*
y entonces
gi
H H H + =
*
Como
dT Cp H H
T
T
gi gi
}
+ =
0
0
*
0
0
H dT Cp H H
T
T
gi
+ + =
}
Si aplicamos la definicin de propiedad residual a la entropa, obtenemos
* gi
S S S = y entonces
* gi
S S S = +
Como
0
0
0
P
P
RLn
T
dT
Cp S S
T
T
gi gi
+ =
}
*
0
0
0
S
P
P
RLn
T
dT
Cp S S
T
T
gi
+ + =
}
T
0
y P
0
son condiciones de referencia.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
12
CLCULO DE AH
vap
A PARTIR DE PROPIEDADES RESIDUALES
( ) ( )
L V L
i
V
i
H H H H H H H = = A
La parte residual se calcula con ecuaciones de estado
}
|
.
|
\
|
c
c
+ =
V
V
i
dV P
T
P
T
RT
Z
RT
H H 1
1
Para Van der Waals
2
V
a
b V
RT
P
=
b V
R
V
a
b V
RT
T T
P
V
= |
.
|
\
|
c
c
= |
.
|
\
|
c
c
2
V
V V V V
V
V
a
dV aV dV
V
a
dV
V
a
b V
RT
b V
R
T dV P
T
P
T
= = =
(
|
.
|
\
|
|
.
|
\
|
=
(
|
.
|
\
|
c
c
} } } }
2
2 2
Puede verse que
0
0
=
V
a
Lim
V
Entonces
V
a
V
a V
=
Por lo tanto
RTV
a
Z
V
a
RT
Z
RT
H H
i
=
|
.
|
\
|
+ =
1
1
1
y como
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
13
P
ZRT
V
RT
PV
Z = =
( )
2
1
RT Z
aP
Z
RT
H H
i
=
y adems
( )
2
RT
aP
A =
Z
A
Z
RT
H H
i
=
1
) ....( .......... .......... .......... 1 h
Z
A
Z RT H H
i
|
.
|
\
|
=
Clculo de P
0
y AH
vap
a temperatura constante de un componente puro con una
ecuacin de estado
1) Van der Waals
2
V
a
b V
RT
P
=
Criterio de equilibrio
L V
| | =
( )
c
r
c
r
r
r
r
r
T
T
T
P
P
P
T
P
B
T
P
A
AB AZ B Z Z
=
=
=
=
= + +
8
1
64
27
) 1 ..( .......... .......... .......... 0 1
2
2 3
( ) ) 2 ..( .......... .......... .......... 1
Z
A
B Z Ln Z Ln = |
) 3 ........( .......... .......... .......... 1
|
.
|
\
|
=
Z
A
Z RT H H
i
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
14
Algoritmo
i) Proponer una P. Variamos P para cada iteracin
ii) Obtener las races de la ec. 1. La mayor es Z
V
y la menor es Z
L
iii) Sustituir en la ec. 2. Determinar
V L
| | y
iv) Si
V L
| | =
OK, o por lo menos
6
10 * 1 -
s
V L
| |
v) Calcular
i
H H para el lquido y para el vapor, con la ec. 3
vi) Si
V L
| | =
Proponer otra P, hasta que
V L
| | =
2) Soave Redlich - Kwong
( ) b V V
a
b V
RT
P
+
=
o
( ) 0
2 2 3
= + AB Z B B A Z Z
o
2
42748 . 0
r
r
T
P
A =
r
r
T
P
B 08664 . 0 =
( ) | |
2
1 1
r w
T f + = o
2
176 . 0 574 . 1 48 . 0 w w f
w
+ =
( ) B Z Ln
B Z
Z
Ln
B
A
Z Ln
|
.
|
\
|
+
+ = 1 |
|
.
|
\
| +
(
Z
B Z
Ln
dT
da
a
T
B
A
Z
RT
H H
1 1
*
( ) | |
r
r w
w
T
T f
f
dT
da
a
T
+
=
1 1
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
15
Ejemplo:
Determine P
0
y AH
vap
para el CO
2
a 240K utilizando la ecuacin de estado de Van der
Waals y compare los resultados con los reportados en la literatura para este
compuesto.
CO
2
a 240K
Smith 5 edicin. Apndice D
Tr (K) Pc (bar) w Zc Vc (cm3/mol)
304.2 73.83 0.224 0.274 94
1) Van der Waals
1 2 3 4 5 6 7
P 50 30 27 26 26.5 026.45 26.47
Pr 0.6772 0.406 0.3657 0.3521 0.3589 0.3583 0.3585
Tr 0.7889 0.7889 0.7889 0.7889 0.7889 0.7889 0.7889
A 0.46 0.275 0.2478 0.2392 0.2438 0.2428 0.2430
B 0.1073 0.0644 0.0579 0.0579 0.0567 0.0568 0.0568
ZL 0.16 0.0984 0.0886 0.0855 0.0864 0.0871 0.0878
Zmix 0.4736i 0.252
Zv 0.4736i 0.7139 0.7548 0.7661 0.7597 0.7619 0.7754
L
0.7298 0.7987 0.8196 0.8035 0.8155 0.8136
v 0.7880 0.8086 0.8153 0.8115 0.8127 0.8125
lv-
L
l 0.0582 0.0099 0.0043 0.0087 0.00028 0.001
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
16
Despus de proceso iterativo:
@ 240 K, la Psat=26.47 bar
(H-H
*
)
v
=RT(Z-1-A/Z)
=(8.314J/molK)(240 K)(0.7754-1-(0.2430/0.7754))
=-1073.48 J/mol
(H-H
*
)
L
= RT(Z-1-A/Z)
=(8.314J/molK)(240 K)(0.08780.2430/0.0878))
=-7342.63 J/mol
Hvap=Hv-H
L
= -1073.48-(-7342.63)=6269.15 J/mol
2) Soave-Redlich-Kwong
1 2 3 4
P 12.83 12.69 12.82 12.83
Pr 0.17378 0.17188 0.173642 0.1738
fw 0.82285 0.82375 0.82285 0.8228
1.1925 1.19267 1.19267 1.1923
A 0.14234 0.14081 0.142248 0.1423
B 0.01909 0.01888 0.01907 0.0191
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
17
Zv 0.86093 0.862641 0.861021 0.8610
Z
L
0.02856 0.028243 0.028523 0.02859
v 0.8806 0.8790 0.877787 0.88887
L
0.88748 0.8880 0.878969 0.881677
lv-
L
l 0.009 0.009 0.001 0.007
Despus de proceso iterativo:
@ 240 K, la Psat=12.83 bar
(H-H
*
)
v
=RT(Z-1-A/Z)
=(8.314J/molK)(240 K)( 0.8610-1-(0.1423/0.8610))
=-607.134 J/mol
(H-H
*
)
L
= RT(Z-1-A/Z)
=(8.314J/molK)(240 K)( 0.02859-1-(0.1423/0.02859))
=-18897.8 J/mol
Hvap=Hv-H
L
= 607.134 J/mol-(-18897.8 J/mol)=18290.7
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
18
UNIDAD DE COMPETENCIA 2
EQUILIBRIO
TERMODINMICO DE
SISTEMAS IDEALES
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
19
Propiedades molares parciales
Las propiedades de equilibrio de las disoluciones se describen mediante funciones de
estado tales como P, T, U, S, G y H. El problema bsico de la teora termodinmica de
disoluciones es conocer cmo dependen estas funciones de la composicin de las
mismas.
Para una solucin ideal
=
i i
M x M
donde M representa cualquier propiedad molar de
la mezcla y xi la fraccin molar del componente i.
Las observaciones experimentales muestran que
=
i i
M x M por lo que significa que
hay un efecto de mezclado. Lo cual se debe a las caractersticas de las sustancias, sobre
todo de aspectos como la solubilidad y el efecto calorfico.
La respuesta termodinmica a estas observaciones es:
a) H de solucin, calor de solucin (- exotrmico, + endotrmico)
H de mezclado, calor de mezclado
b) Propiedad molar parcial
i i
n n T P
i
i
M M
n
nM
M
i j
=
|
|
.
|
\
|
c
c
=
= , ,
........................................(1)
Volumen molar parcial
A B
Figura 2.1 Efecto de mezclado
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
20
Consideremos una disolucin que contiene na moles de a y nb moles de b. Supongamos que
el volumen V de la disolucin es tan grande que la adicin de un mol de a o de b no cambia la
concentracin en forma apreciable. Aadimos entonces, a temperatura y presin constante, un
mol de a a esta gran cantidad de disolucin y medimos el incremento de volumen resultante.
Este incremento de volumen por mol de a se llama volumen molar parcial de "a" a la presin,
temperatura y composicin dadas. Se escribe:
i
k
i
j n P T
i
dn
n
V
dV
i
=
=
|
|
.
|
\
|
c
c
=
1
, ,
......................................(8)
donde
) ,..., , , (
3 2 1 i
n n n n f V =
nb P T
a
a
n
V
V
, ,
|
|
.
|
\
|
c
c
=
..................................................(9)
Una razn para introducir esta funcin es que el volumen de una disolucin no es simplemente
la suma de los volmenes de los componentes individuales. Sin embargo, los volmenes
molares parciales s son aditivos. En efecto, a temperatura y presin constante, el volumen de
la disolucin es una funcin homognea de primer grado en na y nb:
V = V(na, nb).
Si se le aplica el teorema de Euler para funciones homogneas resulta que:
......................(10)
En donde las derivadas parciales, segn la ecuacin (9), no son ms que los volmenes molares
parciales de los componentes a y b.
Por tanto:
b b a a
V n V n V + =
.........................................................(11)
En forma general, el volumen molar parcial de la solucin se puede escribir como:
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
21
=
=
k
i
i i
V x V
1
...........................................................(12)
Experimentalmente se pueden obtener V midiendo la densidad.
Mtodo de los interceptos o de las tangentes (mezcla binaria).
Al sustituir el volumen molar promedio de la
solucin, representada por la ecuacin (12), en la definicin de volumen molar parcial, dada por
la ecuacin (9), tenemos que:
.......................................(13)
Aplicando la regla de la cadena, y teniendo en cuenta que el volumen promedio solo es funcin
de x
2
, resulta:
...........(14)
...........(15)
La ecuacin (15) permite el clculo grfico del volumen molar parcial, dado que muestra que la
tangente a la curva en cada punto x
2
tiene como ordenada en el origen el volumen molar
parcial correspondiente a dicho punto V
1
(x
2
). Cuando esta curva ha sido representada por una
funcin analtica, la obtencin de V
1
es inmediata usando la ecuacin (14).
En el caso de la representacin de mezcla V ( V
1
*
V
1(a)
*
) frente a x
2
, el mtodo utilizado es el de
las intersecciones que debe demostrarse en una de las cuestiones propuestas.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
22
*
1
V = Volumen molar del componente puro (1).
*
2
V = Volumen molar del componente puro (2).
) ( 1 a
V
= Volumen molar del componente (1) en solucin cuando x = a.
) ( 2 a
V
= Volumen molar del componente (2) en solucin cuando x = a.
Si se dibuja la tangente a esta curva en un punto de composicin b, de las intersecciones de
esta tangente con los ejes wa = 1 y wb = 1 obtenemos los volmenes especficos parciales, Ve,a y
Ve,b, respectivamente, tomando en cuenta que w representa la fraccin peso de cada
componente.
X1, 2
V
2
*
V
2(a)
X = a
V
V
1
*
V
1(a)
*
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
23
Equilibrio lquido vapor de sistemas ideales
Mezclas Binarias Vapor Lquido
Cuando se analizan mezclas binarias mantenemos, tpicamente un parmetro constante. Por
ejemplo, podemos fijar la composicin del vapor o del lquido y mostrar la conducta presin
temperatura del punto de roco o del punto de burbuja, respectivamente, pero en muchas
aplicaciones prcticas lo ms comn es que se lleven a cabo ya sea a temperatura constante o
presin constante y pueden describirse adecuadamente por diagramas, tales como los que se
muestran a continuacin.
Fig. 2.2 Diagramas temperatura composicin y presin composicin de mezclas binarias
Los puntos A, B, C y D representan la conducta de los componentes puros; las lneas
horizontales entre las lneas de equilibrio de vapor y lquido conectan composiciones en
equilibrio con valores dados de temperatura y presin. Se puede construir a partir de stas un
diagrama adicional de x en funcin de y a temperatura o presin constante que aparecera
tpicamente como la figura 2.3, donde la lnea segmentada representa la recta x = y.
Fig. 2.3 Composicin del vapor en funcin del lquido en una mezcla binaria a P o T constante.
Ley de Raoult
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
24
La relacin
A
A
A
x
P
P
=
|
|
.
|
\
|
*
...................(1)
Indica que la presin de vapor de un componente voltil en una mezcla es una fraccin de la
porcin de vapor del lquido puro.
La Ley de Raoult se cumple para lquidos de estructura similar, donde no hay mucha diferencia
de las interacciones moleculares entre ellos.
As mismo, las relaciones de condensacin y vaporizacin entre el lquido y el vapor se pueden
representar por:
En estado de equilibrio, la velocidad de vaporizacin es igual a la de condensacin, entonces:
A A
P k kx ' = ...................(2)
Despejando:
A A
x
k
k
P
'
= .....................(3)
Si:
Velocidad de vaporizacin = k x
A
Velocidad de condensacin = k P
A
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
25
*
'
; 1
A k
k
A
P x = =
............(4)
Por lo tanto, al sustituir tenemos que:
*
A A A
P x P =
.................(5)
Un equilibrio de fases implica que las mismas sustancias qumicas estn presentes en diferentes
fases. La presin de vapor, Pv, es la presin de equilibrio de un sistema que tiene dos fases
presentes, una de las cuales es un gas o vapor. En el caso de la presin de vapor de un lquido A,
el sistema puede ser representado en la forma siguiente:
) ( ) ( l g
A A
Para un lquido puro A
*
en equilibrio con su vapor, se cumple:
Para una mezcla de lquidos voltiles A y B, el potencial qumico de A es:
|
|
.
|
\
|
+ =
0
*
0
) (
*
ln
P
P
RT
A
A
g
A
) (
*
) (
*
g
A
l
A
=
(Porque estn en equilibrio)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
26
En el caso particular del equilibrio de dos fases de una misma sustancia pura, se supondr que
dicho equilibrio se lleva a cabo a la misma temperatura y presin constante del medio exterior
que circunda al sistema. De esta forma, es posible valerse de la funcin de Gibbs G(T,P) para
este propsito, y en consecuencia, el proceso debe ocurrir sin variacin de la energa libre de
Gibbs, por lo que:
) ( ) (
0
l g
G G G = = A
...................(1)
Utilizando la Ley de Raoult:
*
p x P y
i i
=
........................................(2)
Y teniendo en ceunta al potencial qumico,
L
i
V
i
=
, tenemos que:
i
L
i
L
i
i
V
i
V
i
x RT G
y RT G
ln
ln
+ =
+ =
...........................(3)
Igualando ambas relaciones en (3):
x RT G y RT G
L
i i
V
i
ln ln + = +
............(4)
Despejando, obtenemos la relacin:
|
.
|
\
|
+ =
0
0
) (
ln
P
P
RT
A
A g A
A l A
A
A
l A l A
x RT
P
P
RT ln ln
*
) (
*
*
) ( ) (
+ =
|
|
.
|
\
|
+ =
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
27
i i
V
i
L
i
x RT y RT G G ln ln =
( ) ( )
i
i V
i
L
i
x
y
RT P T G P T G ln , , =
........(5)
Considerando despreciable la influencia de la presin sobre las propiedades del lquido: La
energa libre de Gibbs en la fase lquida evaluada a T y P del sistema es igual a la energa libre de
Gibbs de la fase lquida evaluada a T del sistema pero a la presin de vapor del lquido puro (P
*
).
) , ( ) , (
*
p T G P T G
L
i
L
i
=
....................(6)
SdT VdP dG = a T constante y para un gas ideal:
VdP dG
gi
= ..........................................(7)
Despejando:
P
RT
V RT PV = =
Considerando que el vapor de nuestro sistema es un gas ideal:
P
RT
V
V
=
dP V dG
V V
i
=
dP
P
RT
dG
V
i
= ................................................................................(8)
Integrando desde P hasta P
*
.
( ) ( )
P
p
RT P T G p T G
V
i
V
i
*
*
ln , , =
.....................................................(9)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
28
Sustituyendo (5) en (9):
( ) ( )
i
i L
i
V
i
x
y
RT P T G P T G ln , , =
........................................................(10)
( ) ( )
P
p
RT
x
y
RT P T G p T G
i
i L
i
V
i
*
*
ln ln , , =
|
|
.
|
\
|
...........(11)
Agrupando:
|
|
.
|
\
|
=
P
p
RT
x
y
RT
i
i
*
ln ln ............................................................(12)
Aplicando antilogaritmos:
e
P
p
x
y
i
i
|
|
.
|
\
|
=
*
ln ln |
P
p
x
y
i
i
*
= ..................................(13)
La ley de Raoult es la regla ms sencilla para describir el equilibrio de fases, pero es fiable solo
en un nmero limitado de mezclas reales ya que solo a presiones inferiores a 10 atm es
razonable suponer que los gases forman soluciones idelaes aunque los componentes puedan
no ser ideales en las condiciones de trabajo.
La ley de Raoult, como puede verse en la siguiente figura proporciona un patrn de referencia
con el cual se puede comparar el equilibrio lquido vapor. Las lneas segmentadas representan
predicciones obtenidas de las ley de Raoult y la lnea slida corresponde a una solucin no ideal
( ) ( )
P
p
RT
x
y
RT P T G p T G
i
i L
i
V
i
*
*
ln ln , , = +
Ley de Raoult
*
p x P y
i i
=
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
29
tpica. Ambos componentes muestran una desviacin positiva de la ley de Raoult, lo cual
implica que los coeficientes de actividad de ambos lquidos son mayores de la unidad.
Fig. 2.4 Comparacin de la ley de Raoult con una mezcla binaria no ideal tpica.
Otra regla lineal frecuentemente usada para soluciones no ideales es ley de Henry, que
usualmente se escribe como
P y P H x
i i i i
= =
donde H
i
es la constante de la ley de Henry para el componente i.
Aunque ni la ley de Henry ni la ley de Raoult son aplicables generalmente en todo el intervalo
de la composicin se les usa frecuentemente para describir soluciones no ideales diluidas. En
particular la ley de Henry se usa para describir el soluto, mientras que la ley de Raoult se aplica
al disolvente.
Para el equilibrio lquido vapor se define para cada especie i un llamado valor K (o relacin de
equilibrio vapor lquido), que viene dado por
i
i
i
x
y
K =
Siendo y = fraccin molar en la fase de vapor y x = fraccin molar en la fase lquida. Es decir,
existen dos valores K, uno para cada fase lquida en equilibrio con la nica fase de vapor. Por lo
tanto
I
i
i
I
i
x
y
K =
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
30
II
i
i
II
i
x
y
K =
Para el equilibrio lquido lquido se define un coeficiente de distribucin K
D
(o relacin de
equilibrio lquido lquido) para cada especie por
II
i
I
i
Di
x
x
K =
Estas relaciones de equilibrio son funciones de la temperatura, de la presin y de las
composiciones de las fases.
Cuando solamente se trasfiere un pequeo nmero de especies entre las fases, las
composiciones de las fases en equilibrio se pueden representar grficamente en diagramas de
dos dimensiones. A tales diagramas de equilibrio se pueden aplicar directamente
procedimientos de diseo mediante construcciones grficas sin necesidad de recurrir a las
relaciones de equilibrio. Por otra parte, los procedimientos de diseo se formulan tambin en
funcin de relaciones de equilibrio, que habitualmente se expresan mediante ecuaciones
analticas adecuadas para uso de calculadoras y computadoras.
En las operaciones de separacin vapor lquido, un ndice de la separabilidad relativa de dos
especies qumicas i y j viene dado por la volatilidad relativa que se define como la relacin de
sus valores de K.
j
i
ij
K
K
= o
El nmero de etapas tericas que se requiere para separar dos especies hasta un deseado
grado depende de manera importante de este ndice. Cuanto mayor es el alejamiento de la
volatilidad relativa con respecto al valor de la unidad, menor es el nmero de etapas de
equilibrio que se requieren para un determinado grado de separacin.
Para las operaciones de separacin lquido lquido se puede definir un ndice anlogo,
denominado selectividad relativa , definido como la relacin de los coeficientes de
distribucin.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
31
j D
i D
ij
K
K
= |
Aunque tanto
ij
o
como
ij
|
varan con la temperatura, la presin y las composiciones de las
fases, en muchos procedimientos de diseo aproximado se admite que stos ndices son
constantes para un determinado problema de separacin.
Puntos de burbuja y de roco de sistema ideales
Procedimiento para determinar las condiciones de equilibrio (burb p, rocio p, burb t y roco t)
para sistemas multicomponentes.
1) BURB P, se conocen {x
k
} y T, se determinan {y
k
} y P
Como la ley de Raoult dice que:
N k P x P y
k k k
.... 3 , 2 , 1
*
= = ........................(1)
Entonces
=
k
k k
P x P
*
.......................................................(2)
Una vez que se ha calculado P por la ecuacin (2), se obtiene cada {y
k
} por la ley de Raoult.
2) ROCO P, se conocen {y
k
} y T, se determinan {x
k
} y P
De la ecuacin de Raoult:
N k
P
P y
x
k
k
k
...... 3 , 2 , 1
*
= =
........................(3)
y
P
y
P
k k
k
|
|
.
|
\
|
=
*
1
|
|
.
|
\
|
=
k k
k
P
y
P
*
1
.....................................................(4)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
32
Una vez calculada P por la ecuacin (4), cada {x
k
} se obtiene por la ecuacin (3).
3) BURB T, se conocen {x
k
} y P, se determinan {y
k
} y T
Se parte de la ecuacin (2) escrita de la siguiente forma:
=
*
*
*
i
k
k i
P
P
x P P
...........................................(5)
Donde i es un elemento seleccionado arbitrariamente del conjunto {k}, tomando en cuenta que
generalmente se elige al ltimo componente de la mezcla.
La solucin P
i
*
da:
=
k
ki k
i
x
P
P
o
*
............................................(6)
Donde:
*
*
i
k
P
P
= o
.........................................................(7)
Cuando las presiones de vapor estn dadas por la ecuacin de Antoine:
i
i
k
k
i k ki
C T
B
C T
B
A A
+
+
+
= o ln ...............(8)
Con la solucin de la ecuacin (8) se inicia un proceso iterativo cuyo valor inicial de T es el
obtenido de la siguiente ecuacin:
=
k
k k
T x T
*
0
..............................................(9)
T
k
*
Se obtiene de las ecuaciones de Antoine, haciendo P
k
*
= P.
Con la ecuacin (6) se obtiene P
k
*
que se introduce en la ecuacin de Antoine para mejorar el
valor de T con:
i
i i
i
C
P A
B
T
=
*
ln
................................(10)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
33
Esta secuencia de clculos se repite hasta que T ya no presenta un cambio significativo entre
dos iteraciones consecutivas. Los valores finales de P
k
*
se obtienen de la ecuacin de Antoine y
los valores de {y
k
} mediante la ecuacin de Raoult.
4) ROCIO T, se conocen {y
k
} y P, se determinan {x
k
} y T
Los clculos de roco T son parecidos a los de burb T. La ecuacin (4) se escribe de la siguiente
forma:
|
|
.
|
\
|
=
k k
i
k
i
P
P
y
P
P
*
*
*
.....................................(11)
O bien, de la siguiente forma:
|
|
.
|
\
|
=
k
ki
k
i
y
P P
o
*
..................................(12)
De nuevo se inicia un proceso iterativo a partir de la ecuacin (12), ahora con un valor inicial de
temperatura que se obtiene con:
=
k
sat
k k
T y T
0
...................................(13)
Con la ecuacin (12) se calcula P
i
*
y de la ecuacin (10) se obtiene un valor mejorado de T, con
el que se repiten los clculos, hasta la convergencia. Finalmente se evala P
k
*
por Antoine y
por Raoult se calcula el valor final de {x
k
}.
Evaporacin instantnea o destilacin flash
La evaporacin instantnea es una aplicacin del EVL. El nombre lo recibe del hecho de que un
lquido, a una presin igual o mayor que su presin en el punto de burbuja se evapora
instantneamente (flashes), es decir, se evapora parcialmente cuando la presin se reduce
por debajo de la presin del punto de burbuja (por ejemplo al pasar por una vlvula),
produciendo un sistema de dos fases de vapor y lquido en el equilibrio.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
34
Regla de la descripcin
El nmero de variables independientes, que es el nmero de variables a emplear, debe de ser
igual al nmero de variables que pueden manejarse por construccin o controlarse durante la
operacin. Tales variables son:
1) Variables independientes de construccin
a) Volumen de la columna (determinado por la geometra)
2) Variables de operacin
a) Presin de alimentacin
b) Temperatura de alimentacin
c) Caudal de alimentacin
d) Composicin
Ecuaciones que forman el modelo matemtico de una columna flash.
Ecuacin Nm. de Ecuaciones
Balance de materia
( ) ( ) ( )V y L x F z
i i i
+ =
V L F + =
C-1
1
Fig. 2.5 Cmara flash continua de una sola etapa.
V,y
i
,T
V
,P
V
,H
V
L,x
i
,T
L
,P
L
,H
L
F,z
i
,T
F
,P
F
,H
F
Q
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
35
Balance de energa ( ) ( ) ( )V H L H F H
V L m
+ =
1
Equilibrio entre fases ( )
i i i
x K y =
C
Equilibrio mecnico
L V
P P =
1
Equilibrio trmico
L V
T T =
1
Composiciones en cada corriente
=1
i
z
=1
i
y
=1
i
x
1
1
1
# de ecuaciones
2C+6
El sistema cuenta con (2C+6) ecuaciones y (3C+10) variables: F, V, L, T
F
, T
V
, T
L,
P
F
, P
V,
P
L,
Q y C
valores de z
i
, y
i
, x
i
.
Grados de Libertad = Nmero de Variables Totales Nmero de Ecuaciones
| = (3C+10) (2C+6) = (C+4)
Generalmente las variables de alimentacin son conocidas: F, T
F
, P
F
y (C-1) valores de z
i
, es decir
(C+2) variables. Quedan entonces dos variables adicionales a ser especificadas. De acuerdo de
cul sea ese par de variables especificado, se generan diversos tipos de problemas que
requerirn diversos procedimientos de clculo.
Donde C es el nmero de componentes.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
36
Mtodo grfico para mezclas binarias
Balance de masa global: V L F + = .....................................................................(1)
Balance de masa por componente:
( ) ( ) ( )V y L x F z
i i i
+ =
...................................(2)
Despejando L de (1) V F L = .........................................................................(3)
Substituyendo (3) en (2):
( ) ( )( ) ( )V y V F x F z
i i i
+ =
Realizando operaciones:
( ) ( ) ( ) ( )V x V y F x F z
i i i i
=
...............................(4)
Agrupando:
( ) ( )V x y F x z
i i i i
=
i i
i i
x y
x z
F
V
= ...........................Regla de la palanca
Si: + =
F
V
.........Fraccin vaporizada (cantidad de vapor respecto a la alimentacin)
Dividiendo (4) entre F:
i i i i
x
F
V
y
F
V
x z
|
.
|
\
|
|
.
|
\
|
=
Sustituyendo :
( )
i i i
x y z + = + 1
..........................................................(5)
Substituyendo (5) entre + y despejando
i
i
i
x
z
y
|
.
|
\
|
+
+
+
=
1
..........................................................(6)
La ecuacin (6) es la de una lnea recta donde la pendiente es:
|
.
|
\
|
+
+
=
1
m
Cuando:
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
37
0 = + ;
= m
y tenemos un punto de burbuja, lquido saturado.
1 = + ; 0 = m y tenemos un punto de roco, vapor saturado.
1 0 < + < ; < < m 0 y tenemos una mezcla lquido vapor.
Flash para multicomponentes:
Balance global: V L F + = ....................................................(1)
Balance parcial:
( ) ( ) ( )V y L x F z
i i i
+ =
...................................(2)
Relacin de equilibrio:
( )
i i i
x K y =
..................................................(3)
Substituyendo (1) y (3) en (2)
( ) ( ) ( )
i i i i
x V F x K V z F + =
..............................(4)
Ecuacin (4) entre F y agrupando y despejando:
y
x
1
1
0
=0
=1
=0.5
V,y
i
L,x
i
F,z
i
P
T
P
v
< P < P
b
@ T
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
38
( ) 1 1 + +
=
i
i
i
K
z
x .............................................(5)
Sustituyendo (5) en (3):
( ) 1 1 + +
=
i
i i
i
K
z K
y .............................................(6)
En la corriente superior:
=1
i
y
...........................................................(7)
En la corriente inferior:
=1
i
x
.............................................................(8)
Substituyendo (6) en (7) se puede conocer resolviendo la ecuacin (9), con el Solver
Equation, por prueba y error o por el mtodo de Newton.
( )
=
+ +
1
1 1
i
i i
K
z K
........................................(9)
Si se elige el mtodo de Newton, entonces hacemos la diferencia de las ecuaciones (7) y (8),
tenemos:
( )
( ) ( )
0
1 1 1 1
=
|
|
.
|
\
|
+ +
|
|
.
|
\
|
+ +
= +
i
i
i
i i
K
z
K
z K
f
( )
( )
( )
0
1 1
1
1
=
+ +
= +
=
C
i i
i i
K
K z
f
............................(10)
( )
( )
( ) | |
= + +
= +
C
i
i
i i
K
K z
f
1
2
2
'
1 1
1
.............................(11)
( )
( )
k
k
k k
f
f
+
+
+ = +
+
'
1
.......................................(12)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
39
UNIDAD DE COMPETENCIA 3
EQUILIBRIO TERMODINMICO DE
SISTEMAS REALES
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
40
Coeficiente de actividad ( )
Propiedades en exceso
As como para los gases la f y el | se relacionan con la energa de Gibbs residual para determinar
las desviacin respecto del comportamiento de un gas ideal.
RTdLnP dG
gi
= (1)
RTdLnf dG = (2)
|
.
|
\
|
=
P
f
RTdLn dG dG
gi
(3)
| RTdLn dG
R
=
(4)
Para las soluciones lquidas las propiedades que miden las desviaciones del comportamiento de
una solucin ideal se llaman propiedades en exceso (M
E
).
id E
M M M = (5)
donde M
E
es una propiedad en exceso y representa la diferencia entre el valor de la propiedad
real y el que tendra si fuese solucin ideal a las mismas T, P y composicin.
Si M = G
id E
G G G = (6)
que para el componente i en una mezcla
id
i i i
E
G G G = (7)
Si recordamos que en una solucin ideal el potencial qumico del componente i es igual a la
energa molar de Gibbs del componente i, es decir;
i j
n P T
i
i
id
i
n
G
G
=
|
|
.
|
\
|
c
c
= =
, ,
(8)
y adems
Coeficiente de actividad ( )
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
41
Propiedades en exceso
As como para los gases f y | se relacionan con la energa libre de Gibbs residual para
determinar la desviacin respecto del comportamiento de un gas ideal.
.1
..2
Para las soluciones lquidas las propiedades que miden las desviaciones del
comportamiento de una solucin ideal se llaman propiedades en exceso (M
E
)
donde M
E
es una propiedad en exceso y representa la diferencia entre el valor de la
propiedad real y el que tendra si fuese solucin ideal a las mismas T, P y composicin.
Si
que para el componente en una mezcla
id
i i i
E
G G G = 7
Si recordamos que en una solucin ideal el potencial qumico del componente i es igual
a la energa molar de Gibbs del componente i, es decir;
i j
n P T
i
i
id
i
n
G
G
=
|
|
.
|
\
|
c
c
= =
, ,
..8
Y adems
Entonces
i i
id
i RTLnx G G + = 10
Y
i i
id
i RTLnx G G = ..11
Sabiendo que
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
42
Y que para el componente i en solucin
i
i f RTdLn G d =
.12
Al integrar la ecuacin (12) a T y P constantes par un cambio en el componente desde
su estado puro donde
i
i G G =
y
i i
f f =
hasta su estado en solucin a una fraccin
molar x
i
} }
=
i
i
i
i
G
G
f
f
i
i f dLn RT G d
.13
i
i
i
i
f
f
RTLn G G = 14
La diferencia entre la ecuacin (14) y la ecuacin (11) es:
|
|
.
|
\
|
=
i i
i
i
id
i
f x
f
RTLn G G 15
El lado izquierdo de esta ecuacin es la energa en exceso parcial de Gibbs, la relacin
adimensional
i i
i
f x
f
recibe el nombre de coeficiente de actividad del componente i en la
solucin y est representada por el smbolo
i
. As, por definicin,
i i
i
i
f x
f
= ..16
i
i
E
RT G ln = 17
O
i
i
E
Ln
RT
G
= ..18
Para una solucin ideal 0 = i G y entonces
1 =
i
por lo que
i i i
f x f =
19
Esta expresin se conoce como regla de Lewis/Randall.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
43
Como
RT
G i
E
es una propiedad parcial con respecto a
RT
G
E
por la ecuacin (18) se ve que
i
Ln
tambin es una propiedad parcial con respecto a
RT
G
E
por lo que:
Aplicando los conceptos de propiedades molares parciales.
( )
j
n T P
i
i
n
nM
M
, ,
(
c
c
=
.20
= i
i
M x M .21
0 =
i
i
M d x (T, P constantes)22
Se obtienen las siguientes relaciones importantes
( )
j
n T P
i
E
i
n
RT nG
Ln
, ,
/
(
c
c
=
23
=
i i
E
Ln x
RT
G
24
0 =
i i
dLn x (T, P constantes)25
La utilidad de estas ltimas ecuaciones se debe a que los valores de
i
se pueden obtener
experimentalmente para los datos de equilibrio vapor lquido (EVL).
Coeficiente de actividad a partir de datos EVL
Para un sistema que est en EVL a T y P dadas
Si se toman muestras de ambas fases, es posible determinar las fracciones molares {y
i
} y {x
i
}.
El coeficiente de fugacidad y el coeficiente de actividad para el componente sern:
Vapor
T, P, {y
i
}
Lquido
T, P, {x
i
}
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
44
P y
f
P
f
i
V
i
V
i
i
= = | .26
i i
L
i
i
f x
f
= ..27
y como el sistema esta en equilbrio
L
i
V
i
f f
=
.28
P y f x
i i i i i
|
=
29
Los exponentes v y l se han omitido aqu, sobreentendindose de que
i
|
se refiere a la fase vapor y que
i
y f
i
son propiedades de la fase lquida.
La fugacidad del componente en la fase lquida est dada por:
( )
(
(
=
RT
P P V
P f
sat
i
l
i
sat
i
sat
i i
exp |
30
El exponencial se conoce como factor de Poynting.
Substituyendo la ecuacin (30) en la ecuacin (29) y resolviendo para
i
se obtiene:
sat
i i
i i
i
P x
P y u
= .31
donde
( )
(
(
= u
RT
P P V
sat
i
l
i
sat
i
i
i
exp
|
|
..32
A bajas presiones la fase vapor se suele considerar como gas ideal en donde 1
= =
sat
i i
| | y el factor de
Poynting difiere solo en algunas milsimas de la unidad. De ah la consideracin de que
1 = u
i
introduce poco error en el EVL a baja presin y de esta manera la ecuacin para calcular el coeficiente de
actividad se reduce a:
sat
i i
i
i
P x
P y
= .33
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
45
que tambin puede escribirse de la siguiente forma;
sat
i i i i
P x P y = 34
a la ecuacin (34) se le conoce como ley de Raoult modificada.
Las desviaciones de la idealiad en sistemas binarios son de dos tipos
a) Desviacin positiva de la ley de Raoult
b) Desviacin negativa de la ley de Raoult
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
46
Modelos termodinmicos del coeficiente de actividad
El uso de modelos de coeficiente de actividad en la fase lquida permite representar el comportamiento
no ideal de la mezclas a presiones bajas. Estos modelos solo se aplican a la fase lquida, por ello es
necesario utilizar una ecuacin de estado para representar la fase vapor.
1) Margules
Es un modelo emprico de uso comn para el comportamiento de las soluciones
| |
| |
2 21 12 21
2
1 2
1 12 21 12
2
2 1
) ( 2 ln
) ( 2 ln
x A A A x
x A A A x
+ =
+ =
donde A
12
y A
21
se conocen como parmetros binarios de las ecuaciones de Margules y pueden calcular
como:
21 21
12 1
ln
ln
A
A
=
=
donde
1
y
2
son los coeficientes de fugacidad a dilucin infinita de los componentes 1 y 2
respectivamente.
2) Van Laar
2
1
'
12
2
'
21 '
21 2
2
2
'
21
1
'
12 '
12 1
1 ln ; 1 ln
|
|
.
|
\
|
+ =
|
|
.
|
\
|
+ =
x A
x A
A
x A
x A
A
=
1
'
12
ln A
cuando x
1
= 0
=
2
'
21
ln A
cuando x
2
= 0
Tanto las ecuaciones de Margules como las de Van Laar son casos particulares de un tratamiento muy
general basado en funciones racionales, es decir, en ecuaciones para G
E
expresadas mediante relaciones
polinomiales.
Con ambas ecuaciones se logra una gran flexibilidad para ajustar los datos EVL para sistemas binarios. Sin
embargo, como tienen escasa fundamentacin terica no se pueden utilizar para sistemas
multicomponentes; adems, no incorporan la dependencia explcita de sus parmetros respecto a la
temperatura.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
47
3) Wilson
Los desarrollos tericos modernos de la termodinmica molecular sobre el comportamiento de
soluciones lquidas se basan el concepto de composicin local. En una solucin lquida, la composicin
local, difiere de la composicin global de la mezcla; se supone que toma en cuenta el ordenamiento de
corto alcance y orientaciones moleculares no al zar, debido a las diferencias de los tamaos moleculares
y a las fuerzas intermoleculares. El concepto fue introducido por G.M. Wilson en 1964 con un modelo de
comportamiento de la solucin al que desde entonces se le llam ecuacin de Wilson.
( ) ( )
21 1 2 2 12 2 1 1
A + A + = x x Ln x x x Ln x
RT
G
E
|
|
.
|
\
|
A +
A
A +
A
A + =
|
|
.
|
\
|
A +
A
A +
A
+ A + =
21 1 2
21
12 2 1
12
1 21 1 2 2
21 1 2
21
12 2 1
12
2 12 2 1 1
) ln( ln
) ln( ln
x x x x
x x x
x x x x
x x x
|
.
|
\
|
= A
|
.
|
\
|
= A
RT
a
V
V
RT
a
V
V
21
2
1
21
12
1
2
12
exp
exp
12 21 2
21 12 1
1 ln ln
1 ln ln
A + A =
A + A =
Los modelos de composicin local son adecuados para la mayor parte de las necesidades en ingeniera ya
que se pueden generalizar a sistemas multicomponentes implcitamente, sin la introduccin de ms
parmetros que los requeridos para describir los sistemas binarios consecutivos.
Para sistemas multicomponentes la ecuacin de Wilson se escribe de la siguiente forma:
A =
j
ij j
i
i
E
x Ln x
RT
G
A
A
A =
k
j
kj j
ki k
j
ij j i
x
x
x Ln Ln 1
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
48
Donde
1 = A
ij
para i = j.
4) NRTL
El xito de la ecuacin de Wilson en la correlacin de datos EVL impuls el desarrollo de modelos
alternos de composicin local; el ms notable es la ecuacin de Renon y Prausnitz conocida como NRTL
(Non Random Two Liquids) y la ecuacin de Abrams y Prausnitz conocida como UNIQUAC. Un
importante desarrollo posterior, basado en la ecuacin UNIQUAC, es el mtodo UNIFAC, en el que se
calculan los coeficientes de actividad mediante las contribuciones de los diferentes grupos funcionales
que constituyen las molculas en una solucin.
12 1 2
12 12
21 2 1
21 21
2 1
G x x
G
G x x
G
RT x x
G
E
+
+
+
=
t t
( )
( )
(
(
+
+
|
|
.
|
\
|
+
=
(
(
+
+
|
|
.
|
\
|
+
=
2
21 2 1
21 21
2
12 1 2
12
12
2
1 2
2
12 1 2
12 12
2
21 2 1
21
21
2
2 1
ln
ln
G x x
G
G x x
G
x
G x x
G
G x x
G
x
t
t
t
t
) exp(
) exp(
21 21
12 12
ot
ot
=
=
G
G
RT
b
RT
b
21
21
12
12
=
=
t
t
21 21 12 2
12 12 21 1
ln
ln
G
G
t t
t t
+ =
+ =
Equilibrio Lquido Vapor de sistemas reales
Ecuacin de Raoult modificada
y
i
P = x
i
i
P
i
sat
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
49
Es una relacin de equilibrio apropiada para determinar el equilibrio lquido vapor a presiones bajas y
moderadas. En tales condiciones se supone que la fase vapor se comporta como gas ideal. En ella solo se
toman en cuenta las desviaciones respecto a la solucin idealizada en la fase lquida mediante la
insercin del coeficiente de actividad en la ley de Raoult.
Los clculos de punto de burbuja y de punto de roco hechos con esta ecuacin son nicamente un poco
ms complejos que los mismos clculos realizados con la ley de Raoult.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
50
Ecuacin Gamma Phi
La ecuacin de la ley de Raoult modificada incluye el coeficiente de actividad para explicar la no idealidad
de la fase lquida, pero se limita por la suposicin de la idealidad de la fase vapor, la cual se supera por la
introduccin del coeficiente de fugacidad de la fase vapor.
y
i
i
P = x
i
i
P
i
sat
Esta relacin de equilibrio aunque es relativamente ms compleja, se aplica con gran xito para cualquier
sistema lquido vapor. Se reduce a la ley de Raoult cuando
i
=
i
= 1 y a la ley de Raoult modificada
cuando
i
=1.
Procedimiento para determinar
i
]
Para una mezcla binaria tenemos:
+
Los dems parmetros se obtienen con:
Clculos de los puntos de burbuja y de roco usando la ecuacin Gamma Phi
Como estos clculos implican un proceso iterativo se recomienda programarlos en la computadora. Los
algoritmos son los siguientes:
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
51
Fig. 3.1 Algoritmo para el clculo de BURB P
Lea T, {x
i
}, que son constantes.
Ajuste todas las
i
=1.
Evale {P
i
sat
}, {
i
}.
Calcule P con la Ec. (A)
Calcule {y
i
} con la Ec. (B).
Evale {
i
}
Calcule P
con la Ec. (A)
Es P < ?
SI
Imprima P, {yi}
No
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
52
Fig. 3.2 Algoritmo para el clculo de ROCO P
Lea T, {y
i
}, que son constantes.
Ajuste todas las
i
=1 y
i
=1
Evale {P
i
sat
}. Calcule P con la Ec. (C). Calcule
{x
i
} con la Ec. (D). Evale {
i
}. Calcule P con la
Ec. (C).
Evale {
i
}
Calcule {x
i
} con la Ec. (D).
Normalice los valores de
x
i
. Evale {
i
}.
Es cada
i
< ?
Si
Calcule P
con la Ec. (C)
Es P < ?
Si
Imprima P, {x
i
}
No
No
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
53
Fig. 3.3 Algoritmo para el clculo de BURB T
Lea P, {x
i
}, que son constantes.
Ajuste todas las
i
=1.
Calcule {T
i
sat
}. Calcule T con la
Ec. (E). Evale {P
i
sat
},{
i
}.
Identifique la especie j. Calcule
P
j
sat
con la Ec. (F) Calcule T con
la Ec. (G)
Evale {P
i
sat
}. Calcule {y
i
} con la
Ec, (B). Evale {
i
}, {
i
}. Calcule
P
j
sat
con la Ec. (F) Calcule T con
la Ec. (G)
Es T < ?
Si
Imprima T, {y
i
}
No
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
54
Fig. 3.4 Algoritmo para el clculo de ROCO T
Clculos de vaporizacin instantnea (Flash) usando la ecuacin Gamma Ph
Lea P, {y
i
}, que son constantes.
Ajuste todas las
i
=1 y
i
=1
Calcule {T
i
sat
}. Calcule T con la Ec. (H). Evale {P
i
sat
}.
Identifique la especie j. Calcule P
j
sat
con la Ec. (I)
Calcule T con la Ec. (G)
Evale {P
i
sat
}, {
i
}. Calcule {x
i
} con la Ec. (D). Evale
{
i
}. Calcule P
j
sat
con la Ec. (I). Calcule T con la Ec.
(G).
Evale {P
i
sat
}, {
i
}
Calcule {x
i
} con la Ec. (D). Normalice los
valores de x
i
. Evale {
i
}
Es cada
i
< ?
Si
Calcule P
j
sat
con la Ec. (I). Calcule T con la
Ec. (G).
Es T < ?
SI
Imprima T, {x
i
}
NO
NO
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
55
Lea T, P, {z
i
}, constantes
Calcule ROCO P con {y
i
}={z
i
},
Calcule BURB P con {x
i
}={z
i
},
Es P
roco
< P < P
burbuja
?
Estime, {
i
}, {
i
},
Evale K
i
con la Ec. (J). Evale F y dF/d
con las Ecs. (K) y (L). Encuentre por el
mtodo de Newton. Evale {x
i
} con la Ec,
(M) y {y
i
} con la Ec, (N). Evale, {
i
}, {
i
}.
Son , cada x
i
y cada y
i
< ?
Imprima , {x
i
}, {y
i
}
Fig. 3.5 Algoritmo para el clculo de FLASH PT ()
No
Alto
Si
Si
No
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
56
Conjunto de ecuaciones referenciadas en las figuras 3.1 a 3.5
A.
B.
C.
D.
E.
F.
)(
G.
H.
I.
J.
K.
)
(
L.
[(
)]
M.
)
N.
Sistemas azeotrpicos
Las desviaciones de la ley de Raoult se manifiestan con frecuencia en la formacin de azetropos,
especialmente para especies con diferente estructura qumica que tienen temperaturas de ebullicin prximas.
Los azetropos son mezclas lquidas que exhiben temperaturas de ebullicin mximas o mnimas y que
corresponden, respectivamente, a desviaciones negativas o positivas de ley de Raoult. Para un azetropo las
composiciones del vapor y del lquido son idnticas. Si solamente existe una fase lquida se dice que la mezcla
forma un azetropo homogneo; si hay ms de una fase lquida el azetropo es heterogneo.
Las siguientes figuras ilustran la conducta de T y P en funcin de la composicin de los azetropos.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
57
Fig. 3.6 Diagrama de un azetropo de temperatura
de ebullicin mnima
Fig. 3.7 Diagrama de un azetropo
de temperatura de ebullicin mxima
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
58
La conducta de un azetropo con temperatura de ebullicin mnima se encuentra considerablemente
ms a menudo que la de temperatura de ebullicin mxima en los sistemas que normalmente interesan a
los ingenieros. El sistema ter isoproplico alcohol isoproplico es un ejemplo de azetropo de punto de
ebullicin mnimo. Tal conducta se debe a las fuerzas intermoleculares de repulsin, que hacen que cada
componente se comporte casi como si fuera puro y no parte de una mezcla.
Los sistemas azeotrpicos de punto de ebullicin mximo, tale como el sistema acetona cloroformo,
generalmente envuelven efectos de solvatacin. Durante la mezcla de estos compuestos se desprende
calor, debido a la liberacin de energa en el proceso de disolucin.
Un azetropo se comporta en forma muy parecida a la de un componente puro en que su transicin
desde la fase lquida la fase vapor (o viceversa) ocurre a presin y temperatura constantes y sin variacin
en la composicin de ninguna de las fases durante el proceso de vaporizacin.
En sistemas en los cuales se conoce la composicin del azetropo a temperatura y presin dadas, es
sencillo evaluar los coeficientes de actividad en la composicin azeotrpica, con las siguientes
ecuaciones simplificadas:
o
A
L
A
P
P
=
o
B
L
B
P
P
=
Como las presiones de vapor son funciones de la temperatura, el conocimiento de slo la temperatura y
la presin a las cuales se presenta el azetropo es suficiente para evaluar
L
A
y
L
B
. Sin embargo,
debe recordarse que es generalmente una funcin de la composicin y, por tanto, es de limitado valor
en conocimiento de sin conocer la composicin a la cual se aplica. Si se conoce la composicin del
azetropo, se puede usar esta informacin para evaluar las constantes empricas de las ecuaciones de
Van Laar o de Margules para obtener alguna estimacin de la dependencia de , respecto de la
concentracin a los valores dados de presin y temperatura. (Cruz-Olivares J. 2009.)
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
59
Procedimiento para determinar el punto azeotrpico a temperatura constante
Primero se determina si existe o no el azetropo a las condiciones dadas. La condicin para que el
azetropo exista es que la volatilidad relativa de la especie 1 a la especie 2 sea igual a 1, es decir:
1
1 1
12
2
2
2
1
y
K x
y
K
x
o = = = 1
ya que en un azetropo x = y.
A presiones bajas la Ley de Raoult modificada se puede utilizar para describir perfectamente el EVL
sat
i i i i
y P x P = 2
sat
i i i
i
y P
x P
= 2a
Substituyendo en la ecuacin 1, obtenemos
1 1
12
2 2
sat
sat
P
P
= 3
Bajo las siguientes condiciones la ecuacin 3 se convierte en la ecuacin 4
Cuando:
1 2 1 1
0, 1 y = x
= =
Cuando:
1 1 2 2
1, 1 y = x
= =
( )
1
1 1
12
0
2
sat
sat x
P
P
o
=
= 4a
( )
1
1
12
1
2 2
sat
sat x
P
P
o
=
= 4b
Si uno de los valores obtenidos de las ecuaciones 4a o 4b es < 1 y el otro es > 1 entonces el azetropo
existe, porque
12
o es una funcin continua de
1
x y debe pasar a travs de del valor de 1.0 para alguna
composicin intermedia.
Equilibrios Termodinmicos.
M en C. Julin Cruz Olivares
60
BIBLIOGRAFA
CruzOlivares, J, BarreraPichardo, J.F. y SolsSegura, L.M. (2005). Manual de Prcticas de Laboratorio
de Fisicoqumica. Facultad de Qumica, UAEM.
Henley, E.J. y Seader, J.D. (2000). Operaciones de Separacin por Etapas de Equilibrio en Ingeniera
Qumica. Revert. Mxico.
Himmelblau, D. M. (2003). Principios Bsicos y Clculos en Ingeniera Qumica. 6 Ed. Prenrice-Hall.
Mxico.
Prausnitz, J.M., Lichtenthaler, R.N. y Gomes de Azevedo, E. (2000). Termodinmico Molecular de los
Equilibrios de Fases. 7. Ed. Prentice Hall.
Smith, J.M., Van Ness, H.C. y Abbott, M.M. (2005). Introduccin a la Termodinmica en Ingeniera
Qumica. 7. Ed. Mc Graw Hill. Mxico.
Das könnte Ihnen auch gefallen
- Simplificar programa PLC usando marcasDokument6 SeitenSimplificar programa PLC usando marcaslorenzo2501Noch keine Bewertungen
- Funcion de ForzamientoDokument4 SeitenFuncion de ForzamientoSantiago RiveraNoch keine Bewertungen
- LEY DE RAOULT Y SUS APLICACIONES EN SOLUCIONES IDEALESDokument2 SeitenLEY DE RAOULT Y SUS APLICACIONES EN SOLUCIONES IDEALESLuxecitaVicenteNoch keine Bewertungen
- Apuntes Temas 2 9 FisicoquimicaDokument127 SeitenApuntes Temas 2 9 FisicoquimicaVilchis Barajas Uriel100% (1)
- Bioseparaciones MecanicasDokument3 SeitenBioseparaciones MecanicasAndrea JimenaNoch keine Bewertungen
- Informe 3 Estudio Del Perfil de Flujo en Un Reactor de Lecho Empacado y Su Posterior Evaluacion en La Saponificacion de Acetato de EtiloDokument9 SeitenInforme 3 Estudio Del Perfil de Flujo en Un Reactor de Lecho Empacado y Su Posterior Evaluacion en La Saponificacion de Acetato de EtiloPaola Brito SierraNoch keine Bewertungen
- Taller Unidad 2. Matemáticas para El Análisis de Sistemas de ControlDokument3 SeitenTaller Unidad 2. Matemáticas para El Análisis de Sistemas de ControlIngrid Gómez GarzónNoch keine Bewertungen
- Modelos de TurbulenciaDokument2 SeitenModelos de Turbulenciatete9999Noch keine Bewertungen
- Manual Herramienta - Reactor BatchDokument12 SeitenManual Herramienta - Reactor BatchSebastian GaitanNoch keine Bewertungen
- Calculos Evaporacion Flash PDFDokument7 SeitenCalculos Evaporacion Flash PDFCristofer Sebastian Bustos ColladoNoch keine Bewertungen
- Transferencia de Masa Infografia - Huanca Puma KatlynDokument2 SeitenTransferencia de Masa Infografia - Huanca Puma KatlynPEDRO FERNANDO ALEXANDER LAURA QUISPENoch keine Bewertungen
- Balance de MateriaDokument23 SeitenBalance de MateriaDaniel Moroco RiveraNoch keine Bewertungen
- 04 Introduccion Al Uso de Simulador Coco I-2021Dokument14 Seiten04 Introduccion Al Uso de Simulador Coco I-2021Eugenia Zurita GalarzaNoch keine Bewertungen
- Práctica 4 Dilatometria Laboratorio Integral IiDokument13 SeitenPráctica 4 Dilatometria Laboratorio Integral IiRodolfo Luis LimónNoch keine Bewertungen
- Reactores Unidad 3Dokument8 SeitenReactores Unidad 3DavidRomanNoch keine Bewertungen
- Reactores químicos heterogéneos HOMOGÉNEOSDokument7 SeitenReactores químicos heterogéneos HOMOGÉNEOSMarcos PérezNoch keine Bewertungen
- Diagramas termodinámicos PVTDokument6 SeitenDiagramas termodinámicos PVTRamiro Biscardi AlvarezNoch keine Bewertungen
- Curva de solubilidad HCCl3-CH3COOH-H2ODokument14 SeitenCurva de solubilidad HCCl3-CH3COOH-H2OSteevenRafaelPinargoteNoch keine Bewertungen
- Unidad 10 FluidizaciónDokument70 SeitenUnidad 10 FluidizaciónGilberto MartínezNoch keine Bewertungen
- Reactor So3Dokument50 SeitenReactor So3williamyc7Noch keine Bewertungen
- Informe 2 Qca FisicaDokument5 SeitenInforme 2 Qca FisicaMatilde Santibáñez MéndezNoch keine Bewertungen
- Ensayo Equilibrio TermodinámicoDokument8 SeitenEnsayo Equilibrio Termodinámicocgarcía_906651Noch keine Bewertungen
- Tipos de Torres de EnfriamientoDokument11 SeitenTipos de Torres de EnfriamientoUrslan Scray KrepersNoch keine Bewertungen
- Examen de ReactoresDokument3 SeitenExamen de ReactoresBeatriz AlmanzaNoch keine Bewertungen
- Introduccion Simulador de Procesos - HYSYSDokument33 SeitenIntroduccion Simulador de Procesos - HYSYSManuelNoch keine Bewertungen
- Método de la vida media para determinar el orden de reacciónDokument3 SeitenMétodo de la vida media para determinar el orden de reacciónAranzazú LópezNoch keine Bewertungen
- Secado FinalDokument6 SeitenSecado FinalCarlos OxedaNoch keine Bewertungen
- Reporte sobre transferencia de momentum en sistemas de tuberíasDokument21 SeitenReporte sobre transferencia de momentum en sistemas de tuberíasAldo Reda Muñoz NavarroNoch keine Bewertungen
- Catalizadores Solidos PDFDokument31 SeitenCatalizadores Solidos PDFEzeqiel Pedro Romero RamírezNoch keine Bewertungen
- Conduccion Con Reaccion QuimicaDokument10 SeitenConduccion Con Reaccion QuimicaRodríguez Arellano Heidi SamantaNoch keine Bewertungen
- CuevasGarcíaHugo 3402Dokument11 SeitenCuevasGarcíaHugo 3402David AlmarazNoch keine Bewertungen
- Diseño planta producción etilbenceno 80,000 ton/díaDokument34 SeitenDiseño planta producción etilbenceno 80,000 ton/díaIsberto MartínezNoch keine Bewertungen
- Problema 5.25 Bien ResueltoDokument4 SeitenProblema 5.25 Bien ResueltoNancy FloresNoch keine Bewertungen
- Determinación coeficiente difusión acetona aireDokument13 SeitenDeterminación coeficiente difusión acetona aireVaaLe GarciiaNoch keine Bewertungen
- Fenómenos de Transporte 6Dokument21 SeitenFenómenos de Transporte 6Kevin MolinaNoch keine Bewertungen
- Ejercicio para Punto Extra PDFDokument30 SeitenEjercicio para Punto Extra PDFJonathan AlonsoNoch keine Bewertungen
- BioDokument17 SeitenBioRosa Vasquez100% (1)
- Conveccion Natural Al AireDokument1 SeiteConveccion Natural Al AireStrokes LemusNoch keine Bewertungen
- Practica No.3 Lab Operaciones Unitarias.Dokument9 SeitenPractica No.3 Lab Operaciones Unitarias.Maria Del Carmen Esquivel AriasNoch keine Bewertungen
- Expo de Coca 6Dokument6 SeitenExpo de Coca 6KevinEricksonSilvaIsidroNoch keine Bewertungen
- Curvas características de bombas centrífugas en serie y paraleloDokument29 SeitenCurvas características de bombas centrífugas en serie y paraleloJesus David OcandoNoch keine Bewertungen
- Transformadores TrifasicosDokument15 SeitenTransformadores TrifasicosAnthony BeltranNoch keine Bewertungen
- El Comportamiento Dinámico de Un Sensor de Presión Puede Expresarse Como Una Función de Transferencia de Primer Orden Que Relaciona El Valor de Medición PM Con La Presión RealDokument1 SeiteEl Comportamiento Dinámico de Un Sensor de Presión Puede Expresarse Como Una Función de Transferencia de Primer Orden Que Relaciona El Valor de Medición PM Con La Presión RealivanNoch keine Bewertungen
- Sistema binario mezcla completaDokument3 SeitenSistema binario mezcla completaLuis FabianNoch keine Bewertungen
- Análisis dimensional y cálculos para agitaciónDokument8 SeitenAnálisis dimensional y cálculos para agitaciónakamaruNoch keine Bewertungen
- Sistemas Multicomponentes 2Ay2BDokument37 SeitenSistemas Multicomponentes 2Ay2BTania FloresNoch keine Bewertungen
- Qué Es Un Reactor QuímicoDokument5 SeitenQué Es Un Reactor QuímicoteresaNoch keine Bewertungen
- Ayo Practica2Dokument11 SeitenAyo Practica2HernanGascaEstradaNoch keine Bewertungen
- Control Estadístico de Datos KitDokument14 SeitenControl Estadístico de Datos Kitblanca daniela amador ramirezNoch keine Bewertungen
- Regimen Laminar, de Transicion y TurbulentoDokument4 SeitenRegimen Laminar, de Transicion y TurbulentoDíaz FernandoNoch keine Bewertungen
- Sensor Piezoeléctrico para La Medición de PresiónDokument8 SeitenSensor Piezoeléctrico para La Medición de PresiónFreddy Jesus Ingaruca OrihuelaNoch keine Bewertungen
- Proceso Difusivo de Una Particula Esferica No EstacionarioDokument45 SeitenProceso Difusivo de Una Particula Esferica No EstacionarioMarquinho LsNoch keine Bewertungen
- Fundamento Teórico de Control de NivelDokument15 SeitenFundamento Teórico de Control de NivelLUIS PERCY100% (1)
- Modelado de Un Separador FlashDokument18 SeitenModelado de Un Separador FlashI. RodriguezNoch keine Bewertungen
- Practica Reactor Quimico IIDokument25 SeitenPractica Reactor Quimico IILeslieRinconNoch keine Bewertungen
- Practica 1Dokument7 SeitenPractica 1Masword HRNoch keine Bewertungen
- Actividad Experimental 3 - ReynoldsDokument12 SeitenActividad Experimental 3 - ReynoldsLin SANoch keine Bewertungen
- Espectrofotómetro de Transformada de FourierDokument4 SeitenEspectrofotómetro de Transformada de FourierCésar Augusto Núñez DonadoNoch keine Bewertungen
- SQ Pharo 300 Manual - Es - 2013 - 04 PDFDokument452 SeitenSQ Pharo 300 Manual - Es - 2013 - 04 PDFcobramcNoch keine Bewertungen
- 5 3 02Dokument61 Seiten5 3 02Yunuem Reyes ZoteloNoch keine Bewertungen
- Reporte 1Dokument6 SeitenReporte 1Jar RSNoch keine Bewertungen
- DODokument17 SeitenDOJar RSNoch keine Bewertungen
- Antropologia Cultura Relativismo Cultural Etnocentrismo Universales Culturales y Cambio CulturaDokument16 SeitenAntropologia Cultura Relativismo Cultural Etnocentrismo Universales Culturales y Cambio CulturaNATALIA NATALINoch keine Bewertungen
- Tarea - Barrera Rodríguez-Rodríguez D.lc. Azcare-RomeroSuárezDokument10 SeitenTarea - Barrera Rodríguez-Rodríguez D.lc. Azcare-RomeroSuárezJar RS100% (1)
- Datos Práctica1 ReactoresDokument3 SeitenDatos Práctica1 ReactoresJar RSNoch keine Bewertungen
- Ciclo Ericsson Terminado 1Dokument11 SeitenCiclo Ericsson Terminado 1Jar RSNoch keine Bewertungen
- Torres Empacadas Con Platos Solución ConcentradasDokument4 SeitenTorres Empacadas Con Platos Solución ConcentradasJar RSNoch keine Bewertungen
- Presentacion CursoDokument7 SeitenPresentacion CursoJar RSNoch keine Bewertungen
- Problema Calor 1 Rk4 Rk2 Euler AnaliticaDokument2 SeitenProblema Calor 1 Rk4 Rk2 Euler AnaliticaJar RSNoch keine Bewertungen
- Torres de Enfriamiento .Reporte No. 06Dokument12 SeitenTorres de Enfriamiento .Reporte No. 06Jar RSNoch keine Bewertungen
- Análisis de pérdida de carga en tuberías para flujos turbulentos y laminaresDokument8 SeitenAnálisis de pérdida de carga en tuberías para flujos turbulentos y laminaresKevin ChavarriaNoch keine Bewertungen
- Balance de energía para evaporación de jugo de tomateDokument16 SeitenBalance de energía para evaporación de jugo de tomateMilagros Orellana RosalesNoch keine Bewertungen
- Aire Acondicionado - INTERNATIONALDokument48 SeitenAire Acondicionado - INTERNATIONALtavaelromo84100% (1)
- CalorimetriaDokument3 SeitenCalorimetriaDk MontesNoch keine Bewertungen
- Laboratorio 2Dokument8 SeitenLaboratorio 2Maycol Gutierrez MontesinosNoch keine Bewertungen
- Diseño estructural y análisis sísmico de muros no estructuralesDokument3 SeitenDiseño estructural y análisis sísmico de muros no estructuralesOscarNoch keine Bewertungen
- Banco de RefrigeracionDokument3 SeitenBanco de RefrigeracionBriggitte Stephany Ortiz SanchezNoch keine Bewertungen
- Canales Abiertos para la Conducción de AguaDokument21 SeitenCanales Abiertos para la Conducción de AguaWilson Lozano SilvaNoch keine Bewertungen
- Solicitacion Por Fatiga 1Dokument89 SeitenSolicitacion Por Fatiga 1Sergio BaldiviesoNoch keine Bewertungen
- 1.2 - Transición Vitrea en Los Polímeros-2020 ADokument32 Seiten1.2 - Transición Vitrea en Los Polímeros-2020 AMayte Olenka Miranda BandaNoch keine Bewertungen
- Flujo multifásico en tuberías: Propiedades físicas de los fluidos y correlacionesDokument30 SeitenFlujo multifásico en tuberías: Propiedades físicas de los fluidos y correlacionesDiana del SolarNoch keine Bewertungen
- Preinforme FricciónDokument8 SeitenPreinforme FricciónJuliana Castro WariNoch keine Bewertungen
- Psicrometria ExposicionDokument30 SeitenPsicrometria ExposicionJaime G V RiquezNoch keine Bewertungen
- Pet Sil Cas 2019Dokument57 SeitenPet Sil Cas 2019Karol Fiorella Silupù VegaNoch keine Bewertungen
- 1er Parcial Semestre II 2008pDokument1 Seite1er Parcial Semestre II 2008palexauberNoch keine Bewertungen
- Mecanica de FluidosDokument33 SeitenMecanica de Fluidosracso4242Noch keine Bewertungen
- TranferenciaDokument22 SeitenTranferenciaAdriana Ochoa0% (1)
- Diagrama de Moody para cálculo de pérdidas de cargaDokument10 SeitenDiagrama de Moody para cálculo de pérdidas de cargaFabricio TocasNoch keine Bewertungen
- Apuntes de Huesca de Mecanica Del Medio ContinuoDokument136 SeitenApuntes de Huesca de Mecanica Del Medio ContinuoAh_Kin100% (2)
- Informe de ReactoresDokument6 SeitenInforme de ReactoresGuido Ronald RoqueNoch keine Bewertungen
- Refrigeración domésticaDokument246 SeitenRefrigeración domésticaWilliam AvilesNoch keine Bewertungen
- Equilibrio Liquido LiquidoDokument16 SeitenEquilibrio Liquido LiquidoFranklin Quispe MoyaNoch keine Bewertungen
- Peralta Surco HermesDokument121 SeitenPeralta Surco HermesRoxana MendezNoch keine Bewertungen
- Método de Deformaciones AngularesDokument15 SeitenMétodo de Deformaciones AngularesJose Chingay Nicolas0% (3)
- MANCHA FELIPE JHON LEYTHER Examen de Resistencia de Materiales 1Dokument8 SeitenMANCHA FELIPE JHON LEYTHER Examen de Resistencia de Materiales 1Jhon Leyther Mancha FelipeNoch keine Bewertungen
- Presentación 1Dokument52 SeitenPresentación 1Jefferson Heli Reyes CardenasNoch keine Bewertungen
- GLOSARIODokument13 SeitenGLOSARIONestor Omar Heredia RodriguezNoch keine Bewertungen
- Determinación del número de Reynolds en un flujo de fluidoDokument14 SeitenDeterminación del número de Reynolds en un flujo de fluidoRuso Villanueva Jose AlonsoNoch keine Bewertungen
- Lou Derrame de Líquidos - Lab08Dokument10 SeitenLou Derrame de Líquidos - Lab08Evangeline Darius VanzzetiNoch keine Bewertungen