Beruflich Dokumente
Kultur Dokumente
Estudo Dirigido VII
Hochgeladen von
johnnylarah0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
63 Ansichten2 SeitenEste documento apresenta perguntas e respostas sobre enzimas. Aborda tópicos como a definição de enzimas e co-fatores enzimáticos, classificação de enzimas, como enzimas afetam o equilíbrio químico, a relação entre energia de ativação e velocidade da reação, os modelos de funcionamento enzimático, as definições de Km, Kcat e constante de especificidade, os tipos de inibição enzimática e como afetam Km e Vmax, e o pH ótimo
Originalbeschreibung:
Estudo Dirigido VII
Copyright
© © All Rights Reserved
Verfügbare Formate
PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenEste documento apresenta perguntas e respostas sobre enzimas. Aborda tópicos como a definição de enzimas e co-fatores enzimáticos, classificação de enzimas, como enzimas afetam o equilíbrio químico, a relação entre energia de ativação e velocidade da reação, os modelos de funcionamento enzimático, as definições de Km, Kcat e constante de especificidade, os tipos de inibição enzimática e como afetam Km e Vmax, e o pH ótimo
Copyright:
© All Rights Reserved
Verfügbare Formate
Als PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
63 Ansichten2 SeitenEstudo Dirigido VII
Hochgeladen von
johnnylarahEste documento apresenta perguntas e respostas sobre enzimas. Aborda tópicos como a definição de enzimas e co-fatores enzimáticos, classificação de enzimas, como enzimas afetam o equilíbrio químico, a relação entre energia de ativação e velocidade da reação, os modelos de funcionamento enzimático, as definições de Km, Kcat e constante de especificidade, os tipos de inibição enzimática e como afetam Km e Vmax, e o pH ótimo
Copyright:
© All Rights Reserved
Verfügbare Formate
Als PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 2
Estudo Dirigido VII Curso de Vero 2011
Prof. Heberth de Paula
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
O que so enzimas?
O que um co-fator enzimtico?
Como podemos classificar as enzimas?
Por que uma enzima no afeta o equilbrio?
Qual a relao existente entre G e equilbrio qumico?
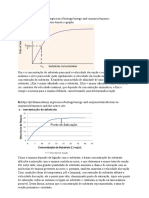
De onde vem a energia necessria para que haja a reduo da energia de ativao e consequente aumento
da velocidade?
Qual o problema do modelo chave-fechadura de funcionamento enzimtico?
Defina Km de uma enzima.
Qual a principal limitao do Km?
Defina Kcat de uma enzima.
Defina constante de especificidade de uma enzima.
Diferencie uma inibio competitiva de uma no-competitiva. Inclua na sua resposta como Km e Vmax so
afetados por cada uma.
Por que as enzimas possuem um pH timo de trabalho? Responda bioquimicamente.
Esse documento est disponvel em: www.hdpaula.co.cc
Estudo Dirigido VI Curso de Vero 2011
Respostas comentadas
Prof. Heberth de Paula
14. O que so enzimas?
a. So catalizadores biolgicos.
15. O que um co-fator enzimtico?
a. Componentes qumicos adicionais (geralmente no-proteicos) requeridos para que a catlise
acontea. Os co-fatores podem ser co-enzima ou ons metlicos, tambm so conhecidos como
grupos prostticos.
16. Como podemos classificar as enzimas?
a. De acordo com a reao que elas catalisam: Oxidorredutase, transferase, hidrolase, liase, isomerase
e ligase.
17. Por que uma enzima no afeta o equilbrio?
a. Porque como qualquer catalisador, ela atua diminuindo a energia de ativao da reao apenas.
Ento o equilbrio no afetado, bem como a entalpia (G).
18. Qual a relao existente entre G e equilbrio qumico?
a. Quanto menor G, mais deslocado para a direita estar a transformao qumica, ou seja, aps
atingir o equilbrio, observa-se mais produto que reagente. O contrrio tambm verdadeiro.
19. De onde vem a energia necessria para que haja a reduo da energia de ativao e consequente aumento
da velocidade?
a. Rearranjo das ligaes covalentes decorrentes da ligao do substrato enzima. Formao de
interaes fracas enzima-substrato, formando o complexo ES que estvel.
20. Qual o problema do modelo chave-fechadura de funcionamento enzimtico?
a. A quantidade de energia necessria para produzir a transformao aps a ligao enzima-substrato
seria pelo menos igual a energia de ativao, no constituindo, portanto, uma vantagem.
21. Defina Km de uma enzima.
a. Concentrao de substrato onde a velocidade de transformao igual a metade da velocidade
mxima que a enzima consegue transformar. uma medida de especificidade enzimtica.
22. Qual a principal limitao do Km?
a. Quando a reao processada em mais de uma etapa, ele no reflete as etapas limitantes da
reao.
23. Defina Kcat de uma enzima.
a. Descreve a velocidade limitante de processos que acontecem em mais de uma etapa. Se uma
transformao tiver 3 etapas, com a etapa limitante sendo a segunda, Kcat = K 2. Reflete tambm o
nmero de molculas de substrato transformados por unidade de tempo com a enzima trabalhando
em Vmax.
24. Defina constante de especificidade de uma enzima.
a. a razo entre Km e Kcat. Quanto maior for o Kcat, maior a eficincia cataltica. Alm disso, Kcat
pode ser utilizado como constante de velocidade quando a concentrao de substrato for muito
menor que Km.
25. Diferencie uma inibio competitiva de uma no-competitiva. Inclua na sua resposta como Km e Vmax so
afetados por cada uma.
a. Competitiva: Semelhana qumica substrato-inibidor. No afeta Vmax, somente Km. Nocompetitivo. Inibidor se liga ao stio alostrico. Afeta Vmax e Km.
26. Por que as enzimas possuem um pH timo de trabalho? Responda bioquimicamente.
a. A variao do pH altera a protonao das cadeias laterais dos aa, afetando estruturas 3/4 e
tambm interferindo na formao do complexo ES.
Esse documento est disponvel em: www.hdpaula.co.cc
Das könnte Ihnen auch gefallen
- Questionário Enzimas (Respondido)Dokument2 SeitenQuestionário Enzimas (Respondido)rodolpho almeidaNoch keine Bewertungen
- 3 - Resumo EnzimasDokument7 Seiten3 - Resumo Enzimasiagogama28Noch keine Bewertungen
- EstudoDirigido EnzimasDokument2 SeitenEstudoDirigido EnzimasSharon SantanaNoch keine Bewertungen
- Aula 6 - Cinética EnzimáticaDokument35 SeitenAula 6 - Cinética EnzimáticaYURI MARTINS NUNESNoch keine Bewertungen
- Lista de Exercícios de Enzimas e Introdução A Cinética EnzimáticaDokument4 SeitenLista de Exercícios de Enzimas e Introdução A Cinética EnzimáticaThiagoNoch keine Bewertungen
- Lista Exercícios 2-1Dokument2 SeitenLista Exercícios 2-1monicasenraNoch keine Bewertungen
- Cinética Enzimática - Aulas 6 e 7Dokument2 SeitenCinética Enzimática - Aulas 6 e 7cadimogirlNoch keine Bewertungen
- CataliseDokument10 SeitenCataliseJean FranciscoNoch keine Bewertungen
- Gabarito - Lista de Exercícios EnzimasDokument10 SeitenGabarito - Lista de Exercícios EnzimasNaraiane dos SantosNoch keine Bewertungen
- Cinética Enzimática: Factores que afectamDokument14 SeitenCinética Enzimática: Factores que afectamAniceto BuckNoch keine Bewertungen
- Resolução Prova Bioquimica UFMGDokument4 SeitenResolução Prova Bioquimica UFMGWilza GomesNoch keine Bewertungen
- 1667264024822+lista de ExercíciosDokument5 Seiten1667264024822+lista de ExercíciosIsabelle SousaNoch keine Bewertungen
- Questionário enzimas: Fatores e tipos de inibiçãoDokument9 SeitenQuestionário enzimas: Fatores e tipos de inibiçãoRaffael Batista MarquesNoch keine Bewertungen
- Aula 7 Cinetica EnzimaticaDokument3 SeitenAula 7 Cinetica EnzimaticaAndréia AnschauNoch keine Bewertungen
- Bioquímica T2 Grupo 05 ED 06Dokument9 SeitenBioquímica T2 Grupo 05 ED 06Lucas SantosNoch keine Bewertungen
- Cinética Química - Processos Cinéticos ElementaresDokument6 SeitenCinética Química - Processos Cinéticos ElementaresVirginia Maria RamalhoNoch keine Bewertungen
- Cinética Enzimática: Velocidade de reação em função das concentrações dos substratosDokument23 SeitenCinética Enzimática: Velocidade de reação em função das concentrações dos substratosLarisse SalvadorNoch keine Bewertungen
- Atividade 2 - TA514Dokument5 SeitenAtividade 2 - TA514DanielPiauNoch keine Bewertungen
- Exercícios de Bioquímica sobre EnzimasDokument3 SeitenExercícios de Bioquímica sobre EnzimasCintia Barroso67% (3)
- ENZIMASDokument18 SeitenENZIMASCarine De FreitasNoch keine Bewertungen
- Cap 02 Caracterização de Um (Bio-) Catalisador - FUnd Da BiocatáliseDokument17 SeitenCap 02 Caracterização de Um (Bio-) Catalisador - FUnd Da BiocatáliseRailson Magalhães de OliveiraNoch keine Bewertungen
- Relatorio Cinética Enzimática Da InvertaseDokument20 SeitenRelatorio Cinética Enzimática Da InvertaseJoaninha Faria100% (2)
- Aula 3 - Enzimas 1Dokument37 SeitenAula 3 - Enzimas 1Mateus RibeiroNoch keine Bewertungen
- Exercicios Cinetica Com RespostasDokument4 SeitenExercicios Cinetica Com Respostasgabrielcosta124loudNoch keine Bewertungen
- Lista 5 - EnzimasDokument5 SeitenLista 5 - EnzimasRodrigo NobreNoch keine Bewertungen
- Enzimas: catalisadores biológicosDokument9 SeitenEnzimas: catalisadores biológicosFelipe RostirollaNoch keine Bewertungen
- Lista de ExercíciosDokument7 SeitenLista de ExercíciosPoliana SenaNoch keine Bewertungen
- 2wDokument7 Seiten2wAbdi ShukuruNoch keine Bewertungen
- Enzimas: Definição, Estrutura e FunçãoDokument31 SeitenEnzimas: Definição, Estrutura e FunçãoShadow FunnyNoch keine Bewertungen
- NSC 4 Cinética QuímicaDokument36 SeitenNSC 4 Cinética Químicaguilhermesantospires006Noch keine Bewertungen
- Solução EDOs cinética reações stiffDokument10 SeitenSolução EDOs cinética reações stiffPATRICK SOUZA DE ALENCARNoch keine Bewertungen
- Cinética Química: Fatores que Alteram a Velocidade de ReaçãoDokument6 SeitenCinética Química: Fatores que Alteram a Velocidade de ReaçãoJean QueirozNoch keine Bewertungen
- Estudo da cinética enzimática da catalaseDokument13 SeitenEstudo da cinética enzimática da catalaseAmanda CarolinaNoch keine Bewertungen
- Avaliação bioquímica enzimas glicose hexoquinaseDokument7 SeitenAvaliação bioquímica enzimas glicose hexoquinaseBeatriz SouzaNoch keine Bewertungen
- Cinética QuímicaDokument11 SeitenCinética QuímicaJoão Pedro Araújo LimaNoch keine Bewertungen
- Prática #5 - Catálise Enzimática Via FotocolorimetriaDokument6 SeitenPrática #5 - Catálise Enzimática Via FotocolorimetriaLuan de Souza BarrosoNoch keine Bewertungen
- Estudo dirigido sobre catálise na UFMTDokument5 SeitenEstudo dirigido sobre catálise na UFMTvinicius Silva alvesNoch keine Bewertungen
- Cinética enzimática em placa de 96 poçosDokument15 SeitenCinética enzimática em placa de 96 poçosLucas MoreiraNoch keine Bewertungen
- Lista EnzimasDokument7 SeitenLista EnzimasyotkndNoch keine Bewertungen
- Cinética EnzimáticaDokument47 SeitenCinética EnzimáticaDébora Barros100% (1)
- Estudo Dirigido Enzimas - Lic 2016 - RespondidoDokument3 SeitenEstudo Dirigido Enzimas - Lic 2016 - RespondidoErick SaraivaNoch keine Bewertungen
- Estudo Dirigido IV - EnzimasDokument2 SeitenEstudo Dirigido IV - EnzimasDaniel MarquesNoch keine Bewertungen
- Velocidade Das Reações Químicas. Estudo Da Velocidade Das ReaçõesDokument1 SeiteVelocidade Das Reações Químicas. Estudo Da Velocidade Das ReaçõesGina ManhoqueNoch keine Bewertungen
- UFRRJ Lista de Exercícios BioquímicaDokument4 SeitenUFRRJ Lista de Exercícios BioquímicaLuana MedeirosNoch keine Bewertungen
- Cinetica QuímicaDokument33 SeitenCinetica QuímicaDanny Cuadros UrbanoNoch keine Bewertungen
- Enzimas são proteínas catalisadoras biológicasDokument40 SeitenEnzimas são proteínas catalisadoras biológicasAna Paula Silva CruzNoch keine Bewertungen
- Estudo Dirigido - EnzimasDokument3 SeitenEstudo Dirigido - EnzimasbghnhNoch keine Bewertungen
- Aula Particular BioquímicaDokument9 SeitenAula Particular BioquímicaMarcela Lima de BritoNoch keine Bewertungen
- EnzimasDokument24 SeitenEnzimasKaene MendesNoch keine Bewertungen
- ENZIMASDokument5 SeitenENZIMASMaria Eduarda Matos BarbosaNoch keine Bewertungen
- Bioquímica: Catálise enzimáticaDokument12 SeitenBioquímica: Catálise enzimáticaJoice CruzNoch keine Bewertungen
- Cinética EnzimáticaDokument17 SeitenCinética EnzimáticaGabriel SoaresNoch keine Bewertungen
- Perguntas Bioquimica Apoio Ao EstudoDokument44 SeitenPerguntas Bioquimica Apoio Ao EstudoDaniela AlvesNoch keine Bewertungen
- Conferencia 12 Biocatalizadores PortuguesDokument59 SeitenConferencia 12 Biocatalizadores PortuguesJoaquim JosephNoch keine Bewertungen
- Bioquímica Das Enzimas PDFDokument24 SeitenBioquímica Das Enzimas PDFCeiça FernandesNoch keine Bewertungen
- Atividade 3 - EnzimasDokument3 SeitenAtividade 3 - EnzimasAna JúliaNoch keine Bewertungen
- EnzimasDokument9 SeitenEnzimasFernando GabrielNoch keine Bewertungen
- RESUMO I - Enzimas 1 - TURMA BDokument3 SeitenRESUMO I - Enzimas 1 - TURMA BJorge JuniorNoch keine Bewertungen
- En ZimasDokument60 SeitenEn ZimasEricaNoch keine Bewertungen
- Fórmulas e Cálculos para Eletricidade e Eletrônica - volume 1Von EverandFórmulas e Cálculos para Eletricidade e Eletrônica - volume 1Bewertung: 5 von 5 Sternen5/5 (5)
- FN 13Dokument50 SeitenFN 13johnnylarahNoch keine Bewertungen
- Aula 2 - Trichomonas e GiardiaDokument20 SeitenAula 2 - Trichomonas e GiardiajohnnylarahNoch keine Bewertungen
- Fármacos endovenosos para indução anestésicaDokument10 SeitenFármacos endovenosos para indução anestésicaKaren KalineNoch keine Bewertungen
- Volume e Composição Dos Liquidos CorporaisDokument36 SeitenVolume e Composição Dos Liquidos CorporaisjohnnylarahNoch keine Bewertungen
- Aula 4 - Resposta Imune Adaptativa - Apresentaçao de AntígenoDokument35 SeitenAula 4 - Resposta Imune Adaptativa - Apresentaçao de AntígenojohnnylarahNoch keine Bewertungen
- AULA 2 - Trypanosoma CruziDokument23 SeitenAULA 2 - Trypanosoma CruzijohnnylarahNoch keine Bewertungen
- Imunidade mediada por células e humoralDokument39 SeitenImunidade mediada por células e humoraljohnnylarahNoch keine Bewertungen
- Sistema MuscularDokument56 SeitenSistema MuscularjohnnylarahNoch keine Bewertungen
- Sistema DigestivoDokument36 SeitenSistema DigestivojohnnylarahNoch keine Bewertungen
- Sistema Cardiovascular 2 Circulação Pressão (Salvo Automaticamente)Dokument42 SeitenSistema Cardiovascular 2 Circulação Pressão (Salvo Automaticamente)johnnylarahNoch keine Bewertungen
- Sistema NervosoDokument48 SeitenSistema Nervosojohnnylarah100% (1)
- Digestivo - Digestão e AbsorçãoDokument27 SeitenDigestivo - Digestão e AbsorçãojohnnylarahNoch keine Bewertungen
- Sistema RespiratórioDokument39 SeitenSistema RespiratóriojohnnylarahNoch keine Bewertungen
- Sistema Cardiovascular 2 Circulação PressãoDokument27 SeitenSistema Cardiovascular 2 Circulação PressãojohnnylarahNoch keine Bewertungen
- Sistema Endócrino - IntroduçãoDokument24 SeitenSistema Endócrino - IntroduçãojohnnylarahNoch keine Bewertungen
- Aula 1 Introdução - FisioDokument17 SeitenAula 1 Introdução - FisiojohnnylarahNoch keine Bewertungen
- Sistema RenalDokument62 SeitenSistema RenaljohnnylarahNoch keine Bewertungen
- Sistema Digestivo SecreçõesDokument22 SeitenSistema Digestivo SecreçõesjohnnylarahNoch keine Bewertungen
- Exercicios Do Capitulo 16Dokument21 SeitenExercicios Do Capitulo 16Caio Atta100% (1)
- Sistema CardiovascularDokument38 SeitenSistema CardiovascularjohnnylarahNoch keine Bewertungen
- Sistema Cardiovascular 2 Circulação Pressão (Salvo Automaticamente)Dokument42 SeitenSistema Cardiovascular 2 Circulação Pressão (Salvo Automaticamente)johnnylarahNoch keine Bewertungen
- Compostos Aromáticos IIDokument44 SeitenCompostos Aromáticos IIjohnnylarahNoch keine Bewertungen
- Transporte Celular e HomeostasiaDokument53 SeitenTransporte Celular e HomeostasiajohnnylarahNoch keine Bewertungen
- PráticaTeórica EletrocardiogramaDokument25 SeitenPráticaTeórica EletrocardiogramajohnnylarahNoch keine Bewertungen
- Lista de Exercícios 1 - FisioDokument2 SeitenLista de Exercícios 1 - FisiojohnnylarahNoch keine Bewertungen
- Lista de Exercícios 1 - FisioDokument2 SeitenLista de Exercícios 1 - FisiojohnnylarahNoch keine Bewertungen
- RESSONÂNCIADokument22 SeitenRESSONÂNCIAjohnnylarahNoch keine Bewertungen
- Aldeídos e Cetonas IIDokument64 SeitenAldeídos e Cetonas IIjohnnylarahNoch keine Bewertungen
- Aromáticos: Estabilidade e Reatividade do BenzenoDokument26 SeitenAromáticos: Estabilidade e Reatividade do BenzenojohnnylarahNoch keine Bewertungen
- Aldeídos e cetonas: propriedades e reaçõesDokument58 SeitenAldeídos e cetonas: propriedades e reaçõesjohnnylarahNoch keine Bewertungen
- Biologia - Sistema Endócrino..Dokument32 SeitenBiologia - Sistema Endócrino..Thaina Nascimento de MacedoNoch keine Bewertungen
- Mulheres na docência de História da UCSDokument43 SeitenMulheres na docência de História da UCSCaroline CapelliniNoch keine Bewertungen
- Boleto 738973-Abr2023Dokument2 SeitenBoleto 738973-Abr2023Kaliene Emanuely Aires Costa VianaNoch keine Bewertungen
- Performance como linguagem: uma arte de rupturaDokument89 SeitenPerformance como linguagem: uma arte de rupturaAgah Natã100% (1)
- Simone de BeauvoirDokument11 SeitenSimone de BeauvoirRita MonteiroNoch keine Bewertungen
- Apostila MexicanaDokument34 SeitenApostila MexicanaJosé CarlosNoch keine Bewertungen
- Sindrome de X FragilDokument2 SeitenSindrome de X FragilausendanunesNoch keine Bewertungen
- ACFrOgBlNKJXACvHBRXZ4-mZwBtMFZ6Wb2c4OZRAczG2fDVkdPx5A6mu3OUsWnXrIF9fYBuwLYdS2dtt0LJ8c UJTUWvwLWi wjnniTXZmMZ-RElVucLBKsZ2QXb6JM 2Dokument9 SeitenACFrOgBlNKJXACvHBRXZ4-mZwBtMFZ6Wb2c4OZRAczG2fDVkdPx5A6mu3OUsWnXrIF9fYBuwLYdS2dtt0LJ8c UJTUWvwLWi wjnniTXZmMZ-RElVucLBKsZ2QXb6JM 2silas lopesNoch keine Bewertungen
- Evolução histórica da sustentabilidade na arquitetura e urbanismoDokument9 SeitenEvolução histórica da sustentabilidade na arquitetura e urbanismoDaiane SantanaNoch keine Bewertungen
- Leis dos VentiladoresDokument6 SeitenLeis dos VentiladoresAlvaro BenattiNoch keine Bewertungen
- Lubrificantes Utilizados Nos Equipamentos Hyster, Yale e Utilev.Dokument1 SeiteLubrificantes Utilizados Nos Equipamentos Hyster, Yale e Utilev.Fábio Kelly SantanaNoch keine Bewertungen
- NternacionaisDokument17 SeitenNternacionaisPatMaioneseNoch keine Bewertungen
- Unção do Espírito SantoDokument5 SeitenUnção do Espírito SantoPauloNoch keine Bewertungen
- The Witcher D&D.en - PTDokument106 SeitenThe Witcher D&D.en - PTCleiton SousaNoch keine Bewertungen
- A Vicência e o ovo especialDokument2 SeitenA Vicência e o ovo especialBruna SousaNoch keine Bewertungen
- Promoção PizzaDokument8 SeitenPromoção PizzaMaranata HortolândiaNoch keine Bewertungen
- Lucifuge RofocaleDokument46 SeitenLucifuge RofocaleZilarra Katu Schlange100% (1)
- Iniciação Dos 7 Raios PDFDokument45 SeitenIniciação Dos 7 Raios PDFJosé lourenco100% (6)
- CPM CaldeirariaDokument51 SeitenCPM CaldeirariaFábio LeiteNoch keine Bewertungen
- Histórico e áreas da Psicologia do EsporteDokument11 SeitenHistórico e áreas da Psicologia do Esporte935513Noch keine Bewertungen
- 1 Avaliação de Ciências - 4º Ano - 1º BimestreDokument2 Seiten1 Avaliação de Ciências - 4º Ano - 1º BimestreVera Lucia Aparecida Trindade Dias100% (5)
- Avaliando Impactos Sociais com Métodos ExperimentaisDokument9 SeitenAvaliando Impactos Sociais com Métodos ExperimentaisGracinha Oliveira100% (5)
- 1.1. Gestão Corrente e Gestão Estratégica Características Das Decisões EstratégicasDokument10 Seiten1.1. Gestão Corrente e Gestão Estratégica Características Das Decisões Estratégicasfarida100% (1)
- Licantropos: Habilidades e Poderes de uma Raca MalditaDokument4 SeitenLicantropos: Habilidades e Poderes de uma Raca MalditaBruno FallerNoch keine Bewertungen
- PDF Da Aula 03 DIREITO APLICADO AO AGRONEGOCIODokument31 SeitenPDF Da Aula 03 DIREITO APLICADO AO AGRONEGOCIOGEONoch keine Bewertungen
- Recomeçar é dar uma nova chance a si mesmoDokument1 SeiteRecomeçar é dar uma nova chance a si mesmoprofselmaNoch keine Bewertungen
- Questionário Alimentação SaudávelDokument2 SeitenQuestionário Alimentação SaudávelMartaAndreiaSousaNoch keine Bewertungen
- Apresentação da Ciência MentalDokument50 SeitenApresentação da Ciência MentalEdna Pereira70% (10)
- Cenários Da Saúde Brasileira: Um Olhar EpidemiológicoDokument185 SeitenCenários Da Saúde Brasileira: Um Olhar EpidemiológicoEditora Pimenta CulturalNoch keine Bewertungen
- Fispq Alcool Liq Q-Ótimo 46°Dokument12 SeitenFispq Alcool Liq Q-Ótimo 46°KLEVERSONNoch keine Bewertungen