Beruflich Dokumente
Kultur Dokumente
Grados Gay Lussac y Cinetica Enzimatica
Hochgeladen von
Adrian GarayCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Grados Gay Lussac y Cinetica Enzimatica
Hochgeladen von
Adrian GarayCopyright:
Verfügbare Formate
Petroqumica II
Tarea #5
Garay Gutirrez Adrian Josu
Grados Gay-Lussac
Los grados Gay-Lussac es la medida de alcohol contenida en volumen, es
decir, la concentracin de alcohol contenida en una bebida.
Debido a sus propiedades para disolver otras sustancias qumicas, el alcohol
etlico es utilizado como materia prima en diversos productos tales como
perfumes, drogas, plsticos y licores. Los grados Gay-Lussac sirven para
indicar el contenido de alcohol en una sustancia expresado en volumen; por
ejemplo, en un vino tinto que por lo general marca de 11% a 16% de alcohol, el
porcentaje indica cuanto del vino es alcohol. Al multiplicarlo por el contenido de
la botella se obtiene la cantidad de mililitros de alcohol etlico contenidos en
total, por ejemplo, una botella de 750 ml con 14GL, contiene 750 * 14 / 100 =
105 ml de alcohol etlico en la botella.
Formula matemtica
La frmula matemtica para calcular el volumen de alcohol en una bebida es:
Volumen Total X Grados Gay-Lussac / 100
Cintica enzimtica
La cintica enzimtica estudia la velocidad de las reacciones qumicas que son
catalizadas por las enzimas. El estudio de la cintica y de la dinmica qumica
de una enzima permite explicar los detalles de su mecanismo cataltico, su
papel en el metabolismo, cmo es controlada su actividad en la clula y cmo
puede ser inhibida su actividad por frmacos o venenos o potenciada por otro
tipo de molculas.
Las enzimas, en su mayora, protenas con la capacidad de manipular otras
molculas, denominadas sustratos. Un sustrato es capaz de unirse al sitio
activo de la enzima que lo reconozca y transformarse en un producto a lo largo
de una serie de pasos denominados mecanismo enzimtico. Algunas enzimas
pueden unir varios sustratos diferentes y/o liberar diversos productos, como es
el caso de las proteasas al romper una protena en dos polipptidos.
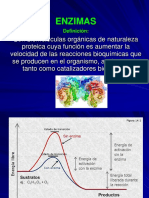
Curva de progreso de una reaccin enzimtica. La pendiente representa, en el
perodo inicial, la velocidad de la reaccin. La zona de la meseta representa el
equilibrio de la reaccin (no confundir con la saturacin).
El conocimiento adquirido acerca de la estructura de las enzimas ha sido de
gran ayuda en la visualizacin e interpretacin de los datos cinticos. Por
ejemplo, la estructura puede sugerir cmo permanecen unidos sustrato y
producto durante la catlisis, qu cambios conformacionales ocurren durante la
reaccin, o incluso el papel en particular de determinados residuos
aminocidos en el mecanismo cataltico. Algunas enzimas modifican su
conformacin significativamente durante la reaccin, en cuyo caso, puede ser
crucial saber la estructura molecular de la enzima con y sin sustrato unido (se
suelen usar anlogos que se unen pero no permiten llevar a cabo la reaccin y
mantienen a la enzima permanentemente en la conformacin de sustrato
unido).
Los mecanismos enzimticos pueden ser divididos en mecanismo de nico
sustrato o mecanismo de mltiples sustratos. Los estudios cinticos llevados a
cabo en enzimas que solo unen un sustrato, como la triosafosfato isomerasa,
pretenden medir la afinidad con la que se une el sustrato y la velocidad con la
que lo transforma en producto. Por otro lado, al estudiar ni una enzima que une
varios sustratos, como la dihidrofolato reductasa, la cintica enzimtica puede
mostrar tambin el orden en el que se unen los sustratos y el orden en el que
los productos son liberados.
Das könnte Ihnen auch gefallen
- Trabajo Final PolietilenoDokument28 SeitenTrabajo Final PolietilenoAdrian GarayNoch keine Bewertungen
- Isohexano usosDokument2 SeitenIsohexano usosAdrian GarayNoch keine Bewertungen
- Tarea 5Dokument5 SeitenTarea 5Adrian GarayNoch keine Bewertungen
- El Arte de La Imprudencia ProfesionalDokument2 SeitenEl Arte de La Imprudencia ProfesionalAdrian GarayNoch keine Bewertungen
- Diseño de Planta JoletDokument70 SeitenDiseño de Planta JoletAdrian GarayNoch keine Bewertungen
- Resumen 1er Parcial Organica 2Dokument3 SeitenResumen 1er Parcial Organica 2Adrian GarayNoch keine Bewertungen
- Ecuacion de La ContinuidadDokument9 SeitenEcuacion de La ContinuidadIQ1992Noch keine Bewertungen
- Examen Final - Fisiologia - t2Dokument20 SeitenExamen Final - Fisiologia - t2VALERIA MILENNE ASCOY RODRIGUEZNoch keine Bewertungen
- Examen de Primer Parcial de Biologia Version 1 1s 2014Dokument4 SeitenExamen de Primer Parcial de Biologia Version 1 1s 2014FernandoNoch keine Bewertungen
- Transtornos de Hipersensibilidad Pato SemDokument9 SeitenTranstornos de Hipersensibilidad Pato SemkiaraNoch keine Bewertungen
- Mapa Comparativo Virus y BacteriasDokument2 SeitenMapa Comparativo Virus y Bacteriassuzette diazNoch keine Bewertungen
- Sinapsis y Tipos de SinapsisDokument12 SeitenSinapsis y Tipos de Sinapsistyrone_orozcoNoch keine Bewertungen
- CLASE TEORICA 10 SISTEMA DIGESTIVO - 3 PPTMDokument29 SeitenCLASE TEORICA 10 SISTEMA DIGESTIVO - 3 PPTMAnahi CaizaNoch keine Bewertungen
- Resumen Funciones Reproductoras y Hormonales MasculinasDokument4 SeitenResumen Funciones Reproductoras y Hormonales MasculinasGerald Bellot EscobarNoch keine Bewertungen
- Membranas biológicas: estructura y funcionesDokument26 SeitenMembranas biológicas: estructura y funcionesOscar PNoch keine Bewertungen
- Cáncer y Respuesta Inmune Power PointDokument18 SeitenCáncer y Respuesta Inmune Power PointJuan Jose Rodríguez GarecaNoch keine Bewertungen
- TEMA 4 Aminoácidos y Proteínas Farma Emma 2018-2019Dokument54 SeitenTEMA 4 Aminoácidos y Proteínas Farma Emma 2018-2019RaniaBenFatmaNoch keine Bewertungen
- Teoria CelularDokument4 SeitenTeoria CelularjafapeNoch keine Bewertungen
- Sarcodinos ComensalesDokument26 SeitenSarcodinos ComensalesMiguel RivadeneiraNoch keine Bewertungen
- Tarea 4 TincionDokument2 SeitenTarea 4 TincionmarkNoch keine Bewertungen
- Apéndices FilamentososDokument51 SeitenApéndices FilamentososAdael AdarNoch keine Bewertungen
- Enzimas: definición, estructura, clasificación y funciónDokument53 SeitenEnzimas: definición, estructura, clasificación y funciónNelson BeltranNoch keine Bewertungen
- Biosíntesis de Nucleótidos de PirimidinaDokument3 SeitenBiosíntesis de Nucleótidos de PirimidinaJose Matthew Rivas MoralesNoch keine Bewertungen
- Practica de Laboratorio 2Dokument6 SeitenPractica de Laboratorio 2Estefania Rojas RayoNoch keine Bewertungen
- Casos Clínicos de Bioquímica Molecular (Colera)Dokument6 SeitenCasos Clínicos de Bioquímica Molecular (Colera)Criss2720Noch keine Bewertungen
- Simulación PA modelo HHDokument8 SeitenSimulación PA modelo HHbryanNoch keine Bewertungen
- Estructuras y rutas metabólicas bioenergéticasDokument6 SeitenEstructuras y rutas metabólicas bioenergéticasOscar ReyesNoch keine Bewertungen
- El Proceso InflamatorioDokument4 SeitenEl Proceso InflamatorioFio Margarit Ramos PozoNoch keine Bewertungen
- Clase 2 - Bacterias Estructura FisiologicaDokument47 SeitenClase 2 - Bacterias Estructura FisiologicaAlex Ostos AlvaNoch keine Bewertungen
- Biologia. - Curtis 7 Ed. Célula. Tejidos.Dokument23 SeitenBiologia. - Curtis 7 Ed. Célula. Tejidos.laura garciaNoch keine Bewertungen
- CLC Laboratorios - Documentos - 268385932092022Dokument2 SeitenCLC Laboratorios - Documentos - 268385932092022keimal silvaNoch keine Bewertungen
- Indagación de Saberes PreviosDokument9 SeitenIndagación de Saberes PreviosCamila Urquiza100% (1)
- Bacterias Gram PositivasDokument18 SeitenBacterias Gram PositivasSedano VaniaNoch keine Bewertungen
- Estructura, función y propiedades de cromosomas, genes, ADN y ARNDokument13 SeitenEstructura, función y propiedades de cromosomas, genes, ADN y ARNErick NemhirNoch keine Bewertungen
- Corrimiento Electroforético de DnaDokument8 SeitenCorrimiento Electroforético de DnaMiguel Angel Rodas HerreraNoch keine Bewertungen
- Control Del Ciclo CelularDokument16 SeitenControl Del Ciclo Celulartonatiuh salazarNoch keine Bewertungen
- CITOCINASDokument38 SeitenCITOCINASJeannelle SotoNoch keine Bewertungen