Beruflich Dokumente
Kultur Dokumente
Laboratorio 6 JAIRO YANES
Hochgeladen von
Wilberto YanesCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Laboratorio 6 JAIRO YANES
Hochgeladen von
Wilberto YanesCopyright:
Verfügbare Formate
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
JAIRO YANES
14.492.057
SECCIN EI
LABORATORIO DE QUMICA GENERAL
PRCTICA N 6
DETERMINACIONES VOLUMTRICAS:
Determinar experimentalmente la concentracin de una solucin aplicando tcnicas de
anlisis volumtrico.
OBJETIVOS ESPECFICOS DE LA PRCTICA
1.- Determinar la concentracin de una disolucin de NaOH de concentracin 0,1 mol/l
mediante la valoracin con HCl.
2.- Diferenciar el punto de equivalencia y el punto inicial de una valoracin.
3.- Elaborar una grfica de valoracin cido-Base a partir de datos experimentales.
4.- Usar indicadores para determinar el punto final de una titulacin.
5.- Determinar error de valoracin.
6.- Determinar porcentaje de error en la concentracin de la solucin preparada en la
prctica anterior.
PARTE EXPERIMENTAL
Materiales:
Bureta de 250 ml.
Pipeta graduada de 10 ml.
Pipeta volumtrica de 10 ml.
Pipeta volumtrica de 25 ml.
Erlenmeyer de 250 ml.
Soporte universal.
Cilindro graduado.
Sustancias:
Agua destilada.
NaOH (disolucin problema)
HCl (disolucin patrn a 0,1 mol/l)
Fenolftalena en disolucin alcohlica al 1%
PRE LABORATORIO
Anlisis Volumtrico: Mtodo de anlisis qumico dispuesto para determinar la
concentracin de una disolucin previamente preparada, de la cual solo se conoce su
concentracin aproximada.
Solucin Patrn: La solucin patrn es una matrz en la cual el analito de inters est en
una concentracin conocida terica y experimentalmente.
Solucin Problema: Tambin conocida como solucin medio en la cual el analito
(molcula de inters) se encuentra con una concentracin constante pero desconocida y
que se puede ajustar generalmente a un mtodo lineal para obtener su concentracin.
Neutralizacin: Es un reaccin qumica en la cual hay un intercambio de protones entre
un cido fuerte con una base fuerte un cido dbil con una base fuerte y produce una
constante de disociacin que se relaciona con el pH.
Solucin Stock: Es una solucin donde est contenido el analito de inters con una
concentracin que permite la preparacin de diversas soluciones patrn.
Indicador: Sustancia natural o sinttica que aadida a una muestra sobre la que se desea
realizar el anlisis produce un cambio fsico que es apreciable por los sentidos
(generalmente, un viraje de color). Este cambio en el indicador se produce debido a que
durante el anlisis se lleva a cabo un cambio en las condiciones de la muestra e indica el
punto final de la valoracin.
Los indicadores ms usados son:
Indicador de pH, detecta el cambio del pH.
Indicador redox, un indicador qumico de titulacin redox.
Indicador complejomtrico, un indicador qumico para iones metlicos en
complejometra.
Indicador de precipitacin, utilizado para valoraciones de precipitacin o solubilidad,
generalmente gravimetras.
Punto de Equivalencia, Punto Final y Error de Valoracin: El punto de equivalencia o
punto estequiomtrico, de una reaccin qumica se produce durante una valoracin
qumica cuando la cantidad de sustancia valorante agregada es estequiomtricamente
equivalente a la cantidad presente del analito o sustancia a analizar en la muestra, es decir
reacciona exactamente con ella. En algunos casos, existen mltiples puntos de
equivalencia que son mltiplos del primer punto de equivalencia, como sucede en la
valoracin de un cido diprtico. Un grfico o curva de valoracin muestra un punto de
inflexin en el punto de equivalencia. Un hecho sorprendente sobre la equivalencia es que
en una reaccin se conserva la equivalencia de los reactivos, as como la de los productos.
El punto final (similar, pero no idntico que el punto de equivalencia) se refiere al punto
en que el indicador cambia de color en una valoracin de colorimetra.
La diferencia entre ambos se llama error de valoracin y debe ser lo ms pequea posible.
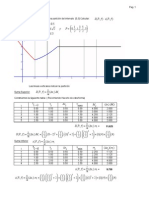
CURVA DE VALORACIN DEL CIDO DIPRTICO: Representacin grfica del valor pH y la
abundancia relativa de las diferentes especies qumicas presentes.
Punto de equivalencia: valor del pH: La fenolftalena es un indicador de pH que en
disoluciones cidas permanece incoloro, pero en presencia de disoluciones bsicas toma
un color rosado con un punto de viraje entre pH=8,0 (incoloro) a pH=9,8 (magenta o
rosado). Sin embargo en pH extremos (muy cidos o bsicos) presenta otros virajes de
coloracin; en la cual la fenolftalena en disoluciones fuertemente bsicas se torna
incolora, mientras que en disoluciones fuertemente cidas se torna naranja.
Antes de iniciar la valoracin se debe elegir un indicador de pH adecuado segn el punto
de equivalencia previsto de la reaccin. El punto de equivalencia se corresponde con el
valor terico de la valoracin, pero en la prctica no es posible saberlo con exactitud. En
dicho punto habrn reaccionado cantidades estequiomtricas de ambos reactivos, y el pH
de dicho punto depende de la fuerza relativa del cido y la base empleados. Para conocer
dicho valor se pueden emplear las siguientes reglas:
Un cido fuerte reacciona con una base fuerte para formar una disolucin neutra (pH = 7).
Un cido fuerte reacciona con una base dbil para formar una disolucin cida (pH <7).
Un cido dbil reacciona con una base fuerte para formar una disolucin bsica (pH> 7).
Acidimetra obteniendo aadiendo una disolucin valorante de NaOH desde una bureta.
Cuando un cido dbil reacciona con una base dbil, la disolucin en el punto de
equivalencia ser bsica, si la base es ms fuerte que el cido, y ser cida, si el cido es
ms fuerte que la base. Si ambos son de igual fuerza, entonces el pH de equivalencia ser
neutro. Sin embargo, los cidos dbiles no se valoran normalmente frente a bases dbiles,
porque el cambio de color mostrado por el indicador suele ser rpido, y por lo tanto muy
difcil de ver con claridad por el observador.
El punto final es el punto en que se detiene la valoracin, por ejemplo, tras el viraje de
color del indicador. Este cambio producido en la disolucin permite establecer
experimentalmente el punto final de la valoracin.
El punto final debe coincidir lo ms exactamente posible con el punto de equivalencia. La
diferencia entre ambos puntos constituye el error de valoracin, que es propio del
mtodo (indicador empleado, uso de reactivos impuros, etc), y no debemos confundirlo
con los errores accidentales debidos a manipulaciones o medidas de volumen
defectuosas.
Das könnte Ihnen auch gefallen
- Incendios EstructuralesDokument28 SeitenIncendios EstructuralesJuan ReynagaNoch keine Bewertungen
- Fisica 2 ElectrostaticaDokument23 SeitenFisica 2 ElectrostaticaLucas PanzardiNoch keine Bewertungen
- Curso PDF de BateriaDokument72 SeitenCurso PDF de Bateriaisidrolara25Noch keine Bewertungen
- Ejercicios de AnaliticaaDokument13 SeitenEjercicios de Analiticaanelly100% (1)
- Capítulo 6Dokument2 SeitenCapítulo 6Wilberto YanesNoch keine Bewertungen
- La Era Prehistórica de La MúsicaDokument32 SeitenLa Era Prehistórica de La MúsicaWilberto YanesNoch keine Bewertungen
- Laboratorio Química 1 GeneralDokument4 SeitenLaboratorio Química 1 GeneralWilberto YanesNoch keine Bewertungen
- Graph SpanishDokument71 SeitenGraph Spanisheber_mermaNoch keine Bewertungen
- Laboratorio 5 JAIRO YANESDokument5 SeitenLaboratorio 5 JAIRO YANESWilberto YanesNoch keine Bewertungen
- Laboratorio 5 JAIRO YANESDokument5 SeitenLaboratorio 5 JAIRO YANESWilberto YanesNoch keine Bewertungen
- Pertenencia LaboralDokument11 SeitenPertenencia LaboralWilberto YanesNoch keine Bewertungen
- 5.1.integral DefinidaDokument9 Seiten5.1.integral DefinidaWilberto YanesNoch keine Bewertungen
- SolucionesDokument13 SeitenSolucionesWilberto YanesNoch keine Bewertungen
- Liderazgo y EmpatíaDokument10 SeitenLiderazgo y EmpatíaWilberto YanesNoch keine Bewertungen
- Laboratorio 5 Wilberto YanesDokument9 SeitenLaboratorio 5 Wilberto YanesWilberto YanesNoch keine Bewertungen
- Laboratorio 2 WILBERTO YANESDokument5 SeitenLaboratorio 2 WILBERTO YANESWilberto YanesNoch keine Bewertungen
- Laboratorio 2 JAIRO YANESDokument5 SeitenLaboratorio 2 JAIRO YANESWilberto YanesNoch keine Bewertungen
- Graph SpanishDokument71 SeitenGraph Spanisheber_mermaNoch keine Bewertungen
- Manual MP3Dokument7 SeitenManual MP3Wilberto YanesNoch keine Bewertungen
- Obtención de La Sal en Galera ZambaDokument15 SeitenObtención de La Sal en Galera ZambaJhonnathan VillacisNoch keine Bewertungen
- Deficiencia de G6P-DeshidrogenasaDokument49 SeitenDeficiencia de G6P-DeshidrogenasaCésar AmcNoch keine Bewertungen
- CROMATOGRAFIADokument6 SeitenCROMATOGRAFIAJuan Lopez HernándezNoch keine Bewertungen
- Gu1a Lab3FDokument112 SeitenGu1a Lab3FseNoch keine Bewertungen
- Cuestionario MIDokument3 SeitenCuestionario MIandresinho1993Noch keine Bewertungen
- Procedimiento Limpieza Manual Lamina AlfajorDokument6 SeitenProcedimiento Limpieza Manual Lamina AlfajorNicolás Vera MacíasNoch keine Bewertungen
- Tesis - Introducción de Conceptos de Química Verde en Educación SecundariaDokument202 SeitenTesis - Introducción de Conceptos de Química Verde en Educación SecundariaMario MartinNoch keine Bewertungen
- Especificaciones Técnicas - Estaciones Distritales de RegulacionDokument45 SeitenEspecificaciones Técnicas - Estaciones Distritales de RegulacionJorgeNoch keine Bewertungen
- Cual Es La Importancia de Los Minerales en El SueloDokument23 SeitenCual Es La Importancia de Los Minerales en El SueloEduardoHernandez100% (1)
- 1 HibridacionDokument40 Seiten1 HibridacionMiguel Angel VcNoch keine Bewertungen
- Análisis del grado de desempeño PG en mezclas asfálticasDokument22 SeitenAnálisis del grado de desempeño PG en mezclas asfálticasAlberto EscobarNoch keine Bewertungen
- Teoría de DestilaciónDokument18 SeitenTeoría de DestilaciónNicolás Villagrán100% (1)
- Taller Secuencias Discursivas IIDokument2 SeitenTaller Secuencias Discursivas IINicolas Alonso Suarez RodriguezNoch keine Bewertungen
- 2 - Bombas VolumetricasDokument16 Seiten2 - Bombas VolumetricasJavito GomezNoch keine Bewertungen
- Bombas Rotodinamicas1Dokument24 SeitenBombas Rotodinamicas1Jack CcanmedNoch keine Bewertungen
- Las Plantas - KellyDokument16 SeitenLas Plantas - KellymaryNoch keine Bewertungen
- Especificaciones Obras de Captación BarrancaDokument94 SeitenEspecificaciones Obras de Captación BarrancaAnderson Taipe HurtadoNoch keine Bewertungen
- Guia LAB 4 - Equilibrio de Fuerzas y Fuerzas FricciónDokument4 SeitenGuia LAB 4 - Equilibrio de Fuerzas y Fuerzas FricciónWalter Carranza0% (1)
- Trabajo de Campo (Entrevistas)Dokument7 SeitenTrabajo de Campo (Entrevistas)Belèn HernandezNoch keine Bewertungen
- Balanceo DinámicoDokument5 SeitenBalanceo DinámicoMiryam Ysabel Romero Mendez0% (1)
- Análisis estructural con matricesDokument137 SeitenAnálisis estructural con matricesJessica Laurente SantosNoch keine Bewertungen
- Data Sheet IMAN de Neodimio S 10 10 NDokument4 SeitenData Sheet IMAN de Neodimio S 10 10 NIsrael MontielNoch keine Bewertungen
- Calicatas Informe GrupalDokument18 SeitenCalicatas Informe GrupalCinthia mamaiNoch keine Bewertungen
- Principios de Riego y DrenajeDokument6 SeitenPrincipios de Riego y Drenajejesusse1Noch keine Bewertungen
- Deshidratacion de Gas Natural Con Cribas MolecularesDokument22 SeitenDeshidratacion de Gas Natural Con Cribas MolecularesGREYS YENDIRA SALAS TOLA0% (1)
- Informe del monitoreo del recurso hídrico de Risaralda 2016Dokument16 SeitenInforme del monitoreo del recurso hídrico de Risaralda 2016ELENA ESTEFANIA PELAEZ GRISALESNoch keine Bewertungen
- Proyecto AireDokument22 SeitenProyecto AireCESAR ANDRES MONTES CASTELLANOSNoch keine Bewertungen