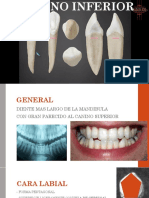
Beruflich Dokumente
Kultur Dokumente
ISOENZIMAS
Hochgeladen von
FreyyyyBmCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
ISOENZIMAS
Hochgeladen von
FreyyyyBmCopyright:
Verfügbare Formate
ISOENZIMAS
Las isoenzimas son marcadores bioqumicos mas eficientes que los descriptores
morfolgicos, ya que, por lo general, permiten distinguir genotipos homocigticos de
los heterocigticos, pues una de sus caractersticases la de presentar codominancia
Las isoenzimas o isozimas son enzimas que difieren en la secuencia de aminocidos,
pero que catalizan la misma reaccin qumica. Estas enzimas suelen mostrar diferentes
parmetros cinticos (i.e. diferentes valores de KM), o propiedades de regulacin
diferentes. La existencia de las isoenzimas permite el ajuste del metabolismo para
satisfacer las necesidades particulares de un determinado tejido o etapa del desarrollo.
En bioqumica, las isoenzimas son isoformas (variantes estrechamente relacionadas) de
las enzimas. En muchos casos, son codificadas por genes homlogos que han divergido
con el tiempo. Aunque de forma estricta, las aloenzimas representan enzimas de
diferentes alelos de un mismo gen y las isoenzimas representan enzimas de diferentes
genes cuyos productos catalizan la misma reaccin, los dos trminos se suelen usar
indistintamente.
Un ejemplo de una isoenzima es la glucoquinasa, una variante de hexoquinasa que no
es inhibida por la glucosa-6-fosfato. Sus diferentes funciones de regulacin y su menor
afinidad por la glucosa (en comparacin con otros hexoquinasas), le permiten tener
diferentes funciones en las clulas de determinados rganos, como el control de la
liberacin de insulina por las clulas beta del pncreas, o la iniciacin de la sntesis
de glucgeno por las clulas del hgado. Ambos procesos deben ocurrir solamente
cuando la glucosa es abundante, u ocurre algn problema.
Isoenzimas (y aloenzimas) son variantes de la misma enzima. A menos que sean
idnticas
en
cuanto
a
sus
propiedades
bioqumicas,
por
ejemplo,
sus sustratos y cintica enzimtica, pueden ser diferenciados por ensayos bioqumicos.
Sin embargo, estas diferencias suelen ser sutiles (particularmente entre las aloenzimas
que a menudo son variantes neutrales). Esta sutileza es de esperar, debido a que dos
enzimas que difieran considerablemente en sus funciones no es probable que sean
identificadas como isoenzimas.
Mientras que las isoenzimas pueden ser casi idnticas en cuanto a su funcionamiento,
pueden diferir en otros aspectos. En particular, las sustituciones de aminocidos que
cambian la carga elctrica de la enzima (por ejemplo, la sustitucin de cido
asprtico con cido glutmico) son fciles de identificar por electroforesis en gel, y esto
constituye la base para el uso de las isoenzimas como marcadores moleculares.
LACTATO DESHIDROGENASA(LDH)
La lactato deshidrogenasa, o LDH es una enzima catalizadora que se encuentra en
muchos
tejidos
del
cuerpo,
pero
su
presencia
es
mayor
en
corazn, hgado, riones, msculos, glbulos rojos, cerebro y pulmones.
Corresponde a la categora de las oxidorreductasas, dado que cataliza una
reaccin redox, en la que el piruvato es reducido a lactato gracias a la oxidacin
de NADH a NAD+. Dado que la enzima tambin puede catalizar la oxidacin
del hidroxibutirato, ocasionalmente es conocida como Hidroxibutirato Deshidrogenasa
(HBD).
Participa en el metabolismo energtico anaerobio, reduciendo el piruvato (procedente
de la gluclisis) para regenerar el NAD+, que en presencia de glucosa es el sustrato
limitante de la va glucoltica.
Los vertebrados, en algunos tejidos o tipos celulares, obtienen la mayor parte de su
energa del metabolismo anaerobio (toda en el caso de eritrocitos dado que carecen
de mitocondrias).
La lactato deshidrogenasa (140 kDa) est formada por 4 subunidades, cada una de
unos 35 kDa. Se conocen tres tipos de subunidades: H (LDHB), M (LDHA) y X (LDHC),
que presentan pequeas diferencias en su secuencia de aminocidos. Los tipos H y M
pueden asociarse independientemente para formar tetrmeros, dando lugar a cinco
isoenzimas
(isoformas:
modificaciones
post-traduccionales
de
la
enzima),
correspondientes a las cinco combinaciones posibles, cada una de las cuales se
encuentra preferentemente en determinados tejidos y puede identificarse mediante
electroforesis.
LDH-1 (H4): en el corazn y eritrocitos.
LDH-2 (H3M): en el sistema retculoendotelial y leucocitos.
LDH-3 (H2M2): en los pulmones.
LDH-4 y 5: en el hgado.
Se utiliza para evaluar la presencia de lesiones en los tejidos. La LDH2 en personas
normales es el mayor constituyente del LDH total.
Cuando algUn tejido que contiene LDH se encuentra lesionado vierte ms cantidad de
LDH a la sangre por ello aparece elevada ante cualquier lesin de corazn, hgado,
riones, msculo, etc.
Cuando hay un problema de isquemia en el miocardio con lesin del msculo aparece la
LDH-2 ms elevada que la LDH-2, se eleva a las 24 horas hasta las 72 horas, hace pico
Tras el infarto cardiaco a los 3 4 das para volver a la normalidad a los 10 - 14 das. Si
la isquemia cardiaca no ha lesionado el msculo (infarto) la LDH aparece normal.
Valores normales de LDH en suero
Niveles normales de LDH en
115 a 225 UI/L
adultos
Niveles de LDH-1
del 17 al 27 %
Niveles de LDH-2
del 27 al 37 %
Niveles de LDH-3
del 18 al 25 %
Niveles de LDH-4
del 3 al 8 %
Niveles de LDH-5
del 0 al 5 %
En estos valores puede haber ciertas diferencias por la tcnica o por criterios de
normalidad propios de laboratorios concretos, a veces en el rango de valores y otras
veces por las unidades a las que se hace referencia.
Valoracin de resultados anormales
Los niveles aumentados de LDH pueden indicar:
Accidente cerebro vascular
Anemia hemoltica, megaloblstica, perniciosa
Dao muscular
Enfermedades autoinmunes
Hepatitis, cirrosis
Hipotensin
Infarto de miocardio
Infarto intestinal
Infarto pulmonar, embolismo, neumona
Infarto renal
Linfomas
Mononucleosis infecciosa
Neoplasias
Pancreatitis
CREATIN KINASA (CPK)
Creatin Kinasa (CK) , tambien conocida como Creatin fosfoquinasa (CPK) es otro
ejemplo de isoenzimas cuyo estudio es util para el diagnostico. Hay tres isoenzimas de
CK formadas cada una por la combinacion de diferentes subunidades:
La creatininfosfoquinasa puede presentarse en forma de 3 isoenzimas que se
diferencian en su estructura. La CPK-1 CPK-BB, es la predominante en el tejido
cerebral y en el pulmn. La CPK-2 tambin llamada CPK-MB es la de origen cardiaco, y
la CPK-3 CPK-MM que es la de origen muscular esqueltico.
La aparicin de CPK elevada en el suero sugiere lesiones en el corazn, en el cerebro o
en los msclos esquelticos. Dependiendo del isoenzima de CPK elevado podemos
diferenciar cul es el tejido afectado.
La CPK-MB se eleva a las 3 a 6 horas y vuelve a la normalidad a las 12 a 48 horas tras
un infarto de miocardio. Por ello se realizan mediciones secuenciales para ver la
evolucin.
La CPK-MB no suele aparecer elevada si el dolor torcico es por una angor (angina de
pecho) un embolismo pulmonar o por una insuficiencia cardiaca congestiva.
La CPK-BB aparece elevada si hay dao en el tejido cerebral o en caso de infarto
pulmonar por un embolismo.
La CPK-MM es la isoenzima ms abundante en la medida total de la CPK en personas
sanas, si se eleva se debe a lesiones del msculo esqueltico o por ejercicio fsico muy
intenso.
Valores normales de CPK en suero
Niveles normales de isoenzimas CPK en suero:
CPK 1-BB
del 0 al 100 % de la CPK
CPK 2-MB
del 0 al 5% de la CPK
CPK 3-MM
0 % de la CPK
Valoracin de resultados anormales
Los niveles aumentados de CPK-1 -BB en la sangre pueden indicar:
Cncer de cerebro
Infarto cerebral
Tratamientos de electroconvulsin
Hemorragias subaracnoidea
Convulsiones
Infarto pulmonar
Los niveles aumentados de CPK-2 -MB en la sangre pueden indicar:
Arritmias ventriculares
Isquemia o infarto cardiaco
Electrocucin
Tratamiento de desfibrilacin cardiaca
Tras intervenciones de corazn
Los niveles aumentados de CPK-3 -MM en la sangre pueden indicar:
Convulsiones
Distrofia muscular
Inyecciones mltiples intramusculares
Miositis
Traumatismos musculares
Tras una electromiografa (Electromiograma)
Rabdomiolisis
Tras ciruga
Tras ejercicio intenso
Das könnte Ihnen auch gefallen
- AdiponectinaDokument1 SeiteAdiponectinaromiraffin09Noch keine Bewertungen
- Introducción Al Metabolismo de Los AminoácidosDokument27 SeitenIntroducción Al Metabolismo de Los AminoácidosmadeleynecyNoch keine Bewertungen
- Bioquimica de Aparato DigestivoDokument8 SeitenBioquimica de Aparato DigestivoDesiret Sanchez50% (2)
- AdipocinasDokument2 SeitenAdipocinasadriana gonzalez esparzaNoch keine Bewertungen
- Introduccion A La Bioquimica 1.5Dokument14 SeitenIntroduccion A La Bioquimica 1.5Belén Chamorro SevillaNoch keine Bewertungen
- S300 EsDokument5 SeitenS300 EsbinsjuniorNoch keine Bewertungen
- Isiologia Del Metabolismo de La Proteinas PDFDokument19 SeitenIsiologia Del Metabolismo de La Proteinas PDFRosario Laguna100% (1)
- Prostaglandinas y TromboxanosDokument21 SeitenProstaglandinas y TromboxanosDilcerCernaNoch keine Bewertungen
- Evaluacion Analitica Del Metabolismo de Carbohidratos: Tecnólogo Médico Esp. Laboratorio Clínico y Anatomía PatológicaDokument64 SeitenEvaluacion Analitica Del Metabolismo de Carbohidratos: Tecnólogo Médico Esp. Laboratorio Clínico y Anatomía Patológicavalentinatay100% (1)
- AntígenosDokument26 SeitenAntígenosAngel OchoaNoch keine Bewertungen
- Rúbrica de Biología Celular JejeDokument3 SeitenRúbrica de Biología Celular JejeJUAN ESTEBAN VALENCIA JAIMESNoch keine Bewertungen
- Vías de Transducción Intracelular de SeñalesDokument8 SeitenVías de Transducción Intracelular de SeñalesCristina PazmiñoNoch keine Bewertungen
- Hormesis PDFDokument7 SeitenHormesis PDFTomás JordánNoch keine Bewertungen
- Bromatología - Proteinas (Esquemas)Dokument7 SeitenBromatología - Proteinas (Esquemas)Jhonny LópezNoch keine Bewertungen
- Efectos Metabólicos de La InsulinaDokument39 SeitenEfectos Metabólicos de La Insulinaloviled100% (1)
- Clasificación de AnemiasDokument1 SeiteClasificación de AnemiasnotengoNoch keine Bewertungen
- Potencial Toxicologico Del CamoteDokument6 SeitenPotencial Toxicologico Del CamoteROXANA SARAVIA ORTIZNoch keine Bewertungen
- TRABAJO DE ENZIMAS (Exposición de Teoría)Dokument23 SeitenTRABAJO DE ENZIMAS (Exposición de Teoría)Lindbergh Valera GavilánNoch keine Bewertungen
- Síntesis de NucleótidosDokument3 SeitenSíntesis de NucleótidosAnonymous guhIUozNoch keine Bewertungen
- 1.tolerancia InmunologicaDokument6 Seiten1.tolerancia InmunologicaOtto Junior Rodriguez LopezNoch keine Bewertungen
- Fisiologia Semana #13Dokument53 SeitenFisiologia Semana #13Emerson Requelme CabreraNoch keine Bewertungen
- Células Procariotas DiapositivasDokument7 SeitenCélulas Procariotas DiapositivasK' Ivonne López100% (1)
- 1.4.efecto de Los Agentes Fisicos Sobre La Vida MicrobianaDokument2 Seiten1.4.efecto de Los Agentes Fisicos Sobre La Vida MicrobianagrupoeunpaNoch keine Bewertungen
- Membrana CitoplasmáticaDokument13 SeitenMembrana CitoplasmáticaJack Serna LavadoNoch keine Bewertungen
- GlucosaDokument6 SeitenGlucosaapoliman01Noch keine Bewertungen
- Complejo Mayor de HistocompatibilidadDokument5 SeitenComplejo Mayor de HistocompatibilidadFabiana Posligua MolinaNoch keine Bewertungen
- BiologiaFERMENTACIÓN ALCOHÓLICA METABOLISMO ANAEROBIODokument6 SeitenBiologiaFERMENTACIÓN ALCOHÓLICA METABOLISMO ANAEROBIOTEFANoch keine Bewertungen
- Embarazo MúltipleDokument26 SeitenEmbarazo MúltipleMemo Camacho100% (1)
- 7.agentes Biológicos AntimicrobianosDokument27 Seiten7.agentes Biológicos AntimicrobianosMupita Torres0% (1)
- CARBOHIDRATOSDokument90 SeitenCARBOHIDRATOSAnnel ValenzuelaNoch keine Bewertungen
- Caso Clínico Cólera PDFDokument24 SeitenCaso Clínico Cólera PDFchrriiss100% (1)
- Enfermedades Metabólicas HereditariasDokument64 SeitenEnfermedades Metabólicas HereditariasCheyi SilvaNoch keine Bewertungen
- 16 Metabolismo de CarbohidratosDokument21 Seiten16 Metabolismo de CarbohidratosDianaNoch keine Bewertungen
- Seminario 3°P Eq6 Parte2Dokument24 SeitenSeminario 3°P Eq6 Parte2Cesia RiveraNoch keine Bewertungen
- Fragilidad CapilarDokument2 SeitenFragilidad CapilarArianna ValarezoNoch keine Bewertungen
- Agonistas y Antagonistas ColinérgicosDokument20 SeitenAgonistas y Antagonistas ColinérgicosKevin victor Carbajal CarhuaricraNoch keine Bewertungen
- Triptico SOBRE SALMONELOSIS-1Dokument2 SeitenTriptico SOBRE SALMONELOSIS-1Pedro ParaguacutoNoch keine Bewertungen
- 1.1 Formacion de OrinaDokument5 Seiten1.1 Formacion de Orinacopepina0% (1)
- Procedimientos para La Toma, Transporte y Manejo de MuestrasDokument5 SeitenProcedimientos para La Toma, Transporte y Manejo de MuestrasAnge̺l̪̮̟̭̪̺o S͉̹̝̼ͥͩͫ͞ḁ͈̰̪ͅlazarNoch keine Bewertungen
- Anomalías en El Metabolismo de Los Lípidos.Dokument4 SeitenAnomalías en El Metabolismo de Los Lípidos.Emny EcNoch keine Bewertungen
- Constitucion AnatomicaDokument3 SeitenConstitucion AnatomicaFrancisco GuillotNoch keine Bewertungen
- Glucolípidos y Ceras Exposición Equipo Diego, Andrea y MontseDokument10 SeitenGlucolípidos y Ceras Exposición Equipo Diego, Andrea y MontseMontse FloresNoch keine Bewertungen
- Sintesis, Transporte y Excrecion de ColesterolDokument4 SeitenSintesis, Transporte y Excrecion de ColesterolPao Condo HidalgoNoch keine Bewertungen
- PRACTICA 2 Curva de Tolerancia A La GlucosaDokument6 SeitenPRACTICA 2 Curva de Tolerancia A La GlucosaalexisNoch keine Bewertungen
- t9 MV - Togavirus - RubeolaDokument50 Seitent9 MV - Togavirus - RubeolaAnge M. H. DávilaNoch keine Bewertungen
- Sindrome de Mala AbsorcionDokument3 SeitenSindrome de Mala AbsorcionEbbi DvNoch keine Bewertungen
- Síndrome de AddisonDokument7 SeitenSíndrome de Addisonronald martinez100% (1)
- ERRORES INNATOS DEL METABOLISMO DE LOS LDokument42 SeitenERRORES INNATOS DEL METABOLISMO DE LOS Lmarie1690Noch keine Bewertungen
- Vitaminas y Su Funcion Como EnzimasDokument10 SeitenVitaminas y Su Funcion Como EnzimasZayko Simplemente MasivoNoch keine Bewertungen
- Tema 1 EnzimasDokument25 SeitenTema 1 EnzimasCristhian Macalupú ArismendizNoch keine Bewertungen
- Enfermedades Causadas Por Enterobacterias PDFDokument11 SeitenEnfermedades Causadas Por Enterobacterias PDFKaren LoorNoch keine Bewertungen
- Bomba Sodio GlucosaDokument6 SeitenBomba Sodio GlucosaLau CaraveoNoch keine Bewertungen
- Deficiencia Selectiva IgaDokument12 SeitenDeficiencia Selectiva IgaValenciaErikNoch keine Bewertungen
- Tóxicos Naturales de Origen VegetalDokument8 SeitenTóxicos Naturales de Origen VegetalEli Valdés BernalNoch keine Bewertungen
- Capítulo 14. Lípidos, Lipoproteínas y Patología Cardiovascular.Dokument21 SeitenCapítulo 14. Lípidos, Lipoproteínas y Patología Cardiovascular.YunierValderramaNoch keine Bewertungen
- Distribucion de FarmacosDokument3 SeitenDistribucion de FarmacosFabio Andrés Vargas Sanabria100% (1)
- Generalidades de BacteriasDokument2 SeitenGeneralidades de BacteriasKarla FragosoNoch keine Bewertungen
- 6-Pruebas de Función RenalDokument37 Seiten6-Pruebas de Función RenalDenia EstradaNoch keine Bewertungen
- ISOENZIMASDokument8 SeitenISOENZIMASKaren Vega Velasquez100% (3)
- Resumen Cap 10 BiocaDokument5 SeitenResumen Cap 10 Biocadavid sifuentesNoch keine Bewertungen
- Antropocentrismo y La Pintura de Da VinciDokument10 SeitenAntropocentrismo y La Pintura de Da VinciFreyyyyBmNoch keine Bewertungen
- Fleischner Society Glossary of Terms For Thoracic Imaging - En.esDokument26 SeitenFleischner Society Glossary of Terms For Thoracic Imaging - En.esFreyyyyBm100% (1)
- Clostridium TetaniDokument12 SeitenClostridium TetaniFreyyyyBmNoch keine Bewertungen
- BlatomicosisDokument8 SeitenBlatomicosisFreyyyyBmNoch keine Bewertungen
- Chlamydia TrachomatisDokument37 SeitenChlamydia TrachomatisFreyyyyBmNoch keine Bewertungen
- Antropocentrismo y La Pintura de Da VinciDokument10 SeitenAntropocentrismo y La Pintura de Da VinciFreyyyyBmNoch keine Bewertungen
- 03 Gastroenterologia PDFDokument31 Seiten03 Gastroenterologia PDFFreyyyyBmNoch keine Bewertungen
- PULSODokument11 SeitenPULSOFreyyyyBmNoch keine Bewertungen
- Evaluación Final Inca Kola .2Dokument10 SeitenEvaluación Final Inca Kola .2WHILZON VICTOR HERNANDEZ QUISPENoch keine Bewertungen
- Defensa Civil 200 Casas PDFDokument21 SeitenDefensa Civil 200 Casas PDFMeryMirandaChalcoNoch keine Bewertungen
- Resiliencia EmocionalDokument190 SeitenResiliencia EmocionalMiguel Carvajal ReyesNoch keine Bewertungen
- Teorías Sobre El Origen de La VidaDokument5 SeitenTeorías Sobre El Origen de La VidaMayrani VenturaNoch keine Bewertungen
- La Salud y La Educación Universitaria en El Marco ConstitucionalDokument35 SeitenLa Salud y La Educación Universitaria en El Marco ConstitucionalAlejandroMendez86% (22)
- Dispositivos en ConmutaciónDokument7 SeitenDispositivos en ConmutaciónMarily Hincapie AguirreNoch keine Bewertungen
- Masas QuebradasDokument5 SeitenMasas QuebradasHenry RamosNoch keine Bewertungen
- Candela Super Ficha TécnicaDokument7 SeitenCandela Super Ficha TécnicaDaniel CastilloNoch keine Bewertungen
- El Manejo de Paciente Violento y CombativoDokument28 SeitenEl Manejo de Paciente Violento y CombativoJ. de Jesús Pérez M.100% (2)
- Relacion Entre El Clima Organnizacional, Satisfacción Laboral y Engagement en Una Empresa de Transporte y Monitoreo de Residuos Sólidos en Lima 2017Dokument116 SeitenRelacion Entre El Clima Organnizacional, Satisfacción Laboral y Engagement en Una Empresa de Transporte y Monitoreo de Residuos Sólidos en Lima 2017Alexander Carrasco PérezNoch keine Bewertungen
- Practica 3 Sensibilidad GeneralDokument4 SeitenPractica 3 Sensibilidad GeneralRemigio Rodríguez A.Noch keine Bewertungen
- GUIA # 2 Ciencias Exactas Grado SeptimoDokument18 SeitenGUIA # 2 Ciencias Exactas Grado SeptimoAmoblink CarilinNoch keine Bewertungen
- Libro Digital La Ventana 4 14 Por Luis Bush PDFDokument32 SeitenLibro Digital La Ventana 4 14 Por Luis Bush PDFNailil Boneca100% (1)
- Canino InferiorDokument30 SeitenCanino InferiorJosué SajidNoch keine Bewertungen
- Humedal La VacaDokument14 SeitenHumedal La VacaMichelle GarciaNoch keine Bewertungen
- KIELBASADokument14 SeitenKIELBASACarlos Alberto ZambranoNoch keine Bewertungen
- Prueba de Impulso Cefálico PDFDokument8 SeitenPrueba de Impulso Cefálico PDFNelsonRyusakiLorcaNoch keine Bewertungen
- Cardellino Dohne Origen DesarrolloDokument162 SeitenCardellino Dohne Origen DesarrolloCesar AlarconNoch keine Bewertungen
- CC - Cenm PDFDokument268 SeitenCC - Cenm PDFCristina Garcia100% (3)
- Gustavo - Gutierrez - IE 4Dokument6 SeitenGustavo - Gutierrez - IE 4Gustavo Gutierrez100% (1)
- Modulo3 Calentamiento Crudo PDFDokument72 SeitenModulo3 Calentamiento Crudo PDFNancho SarayNoch keine Bewertungen
- Prieto 2021Dokument146 SeitenPrieto 2021jacky jazzNoch keine Bewertungen
- 2 Dinámicas Isla DesiertaDokument2 Seiten2 Dinámicas Isla DesiertaRodrigo Moraleja de la IglesiaNoch keine Bewertungen
- 102338INTRODER Tema 08Dokument14 Seiten102338INTRODER Tema 08Antonio CalvoNoch keine Bewertungen
- Examen Hse-SupervisoresDokument3 SeitenExamen Hse-SupervisoresDanielNoch keine Bewertungen
- Registro MantenimientosDokument4 SeitenRegistro MantenimientosCarmita CalvachiNoch keine Bewertungen
- Diferencias Entre Tipos de ELISA - Abyntek BiopharmaDokument1 SeiteDiferencias Entre Tipos de ELISA - Abyntek BiopharmaDariforiNoch keine Bewertungen
- Proyecto de Comision Higiene y Salud EscolarDokument4 SeitenProyecto de Comision Higiene y Salud EscolarYuli AlboresNoch keine Bewertungen
- Análisis de Seguridad en El TrabajoDokument7 SeitenAnálisis de Seguridad en El TrabajoSantiago SalazarNoch keine Bewertungen
- Larranaga Ignacio - San FranciscoDokument21 SeitenLarranaga Ignacio - San Franciscoohiyeza100% (1)