Beruflich Dokumente
Kultur Dokumente
Equilibrio Líquido-Vapor
Hochgeladen von
Jeniffer GonzálezOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Equilibrio Líquido-Vapor
Hochgeladen von
Jeniffer GonzálezCopyright:
Verfügbare Formate
INSTITUTO POLITCNICO NACIONAL
Escuela Superior de Ingeniera
Qumica e Industrias Extractivas
Departamento de Ingeniera Qumica Industrial
Academia de Fisicoqumica
Laboratorio de Termodinmica del equilibrio de fases
Prctica 4
Equilibrio lquido-vapor de una solucion no ideal a baja presin
Grupo: 2IM37
Gonzlez Alva Jeniffer Jocelyn
Profesor:
Ing. Rodolfo de la Rosa Rivera
Mxico D.F a 10 de diciembre de 2015
Laboratorio de Termodinmica del equilibrio de fases
I.
OBJETIVOS GENERALES
1.- Preparar una serie de soluciones de cloroformo(1) y metanol(2); medir a cada una su temperatura de
burbuja y la composicin de los vapores, a presin atmosfrica.
2.- A partir de los datos experimentales, determinar el coeficiente de actividad (i) de cada componente en
cada solucin.
3.- Investigar el modelo de solucin (Margules o Van Laar) al que se ajusta el sistema.
4.- Corroborar el punto 3, elaborando los clculos correspondientes y comparando los resultados con los
datos experimentales.
II.
INTRODUCCIN TERICA
1.- Ecuacin de equilibrio lquido-vapor.
Cuando un sistema multicomponente se encuentra en equilibrio en dos o ms fases, se cumple:
a).- La temperatura de todo el sistema es uniforme y constante (equilibrio trmico).
b).- La presin en todo el sistema es uniforme y constante (equilibrio mecnico).
c).- El potencial qumico y por lo tanto la fugacidad parcial de cada componente es el mismo en cada una de las
fases (equilibrio termodinmico).
Para el caso en que las fases que forman el sistema en equilibrio sean las fases lquida y vapor, la fugacidad
parcial de cada componente en esas fases est dado por las expresiones:
Fase lquida:
l
sat
sat
fi i x i i P1 F .P. i
Fase vapor:
vap
fi i yi P
Igualando ambas expresiones, se obtiene la ecuacin general de equilibrio lquido-vapor (mtodo Gamma-phi).
i y i P i xi i sat Pi sat F .P. i
F .P. i i , i sat
Si el sistema se encuentra a presiones bajas (
= 1), y si los componentes del sistema son de
constitucin qumica semejante i = 1, la ecuacin general de equilibrio lquido- vapor adquiere su forma ms
simple posible conocida como Ley de Raoult.
y i P xi Pi
sat
2.- Variables de un sistema en equilibrio.
Las variables de un sistema multicomponente en equilibrio est formado por las composiciones en fraccin mol
que tiene cada componente en cada una de las fases adems de la temperatura y la presin; o sea:
Variables de la fase vapor:
Prctica 4
C-1
2
Laboratorio de Termodinmica del equilibrio de fases
Variables de la fase lquida: C - 1
Temperatura y presin:
Total de variables:
2
2C
Donde C es el nmero de componentes del sistema.
La regla de las fases de Gibbs es una expresin que nos da el nmero de grados de libertad (nmero de
variables o datos) para que un sistema est definido (que fsicamente exista):
F=C-+2
Para el caso de un problema de equilibrio lquido-vapor ( (nmero de fases) = 2 ) se observa que se debe
conocer como mnimo una cantidad de datos igual al nmero de componentes (C), siendo los dems las
incgnitas.
3.- Problemas de equilibrio lquido-vapor (ELV).
En la prctica, se puede encontrar una gran variedad de problemas de ELV, todos, sin embargo pueden ser
clasificados en cinco tipos bsicos:
Problema ELV
Puntos de burbuja
Nombre
Datos
Incgnitas
temperatura de
presin, comp. fase
temperatura
burbuja
lquida
comp. fase vapor
temperatura, comp.
presin, comp. fase
fase lquida
vapor
presin, comp. fase
temperatura, comp.
vapor
fase lquida
temperatura, comp.
presin, comp. fase
fase vapor
lquida
presin de burbuja
temperatura de roco
Puntos de roco
presin de roco
evaporacin
temperatura, presin y
instantnea (flash)
comp. global
La ecuacin de equilibrio a presiones moderadas se escribe:
sat sat
i y i P i xi i Pi
... y a presiones bajas se reduce a:
Prctica 4
comp. fase lquida y
vapor, (frac.
Vaporizada)
Laboratorio de Termodinmica del equilibrio de fases
yi P i xi Pi
sat
Expresin conocida como ley de Raoult modificada.
1.- Modelos de solucin de mezclas binarias.
Puesto que las propiedades de la fase lquida son insensibles a cambios moderados de presin; la presin (P),
T(Psat), xi,yi son cantidades susceptibles de ser medidas experimentalmente. Si este es el caso para una
solucin dada, entonces el coeficiente de actividad de cada componente de la solucin puede obtenerse del
experimento. En la prctica esto es lo que se hace, los datos de i obtenidos se ajustan a ecuaciones
matemticas empricas o semiempricas como las de Margules , Van Laar y otras.
Ecuacin de Margules:
ln 1 x2 A12 2 x1 ( A21 A12 )
2
ln 2 x1 A21 2 x 2 ( A12 A21 )
2
Ecuaciones de Van Laar:
ln 1
ln 2
A12
A12 x1
1
A21x2
A21
A21x2
1
A12 x1
Conocidas las expresiones para obtener las i de un componente en una mezcla dada, estas pueden ser usadas
para la solucin de problemas de EVL a condiciones no experimentadas, lo cual es un logro de la
termodinmica.
2.- Modelos de solucin en mezclas multicomponentes.
Como consecuencia del anlisis de datos de ELV experimentales existentes para sustancias de constitucin
qumica semejante en solucin con otra de referencia, se ha podido observar el efecto que cada grupo qumico
constituyente de la sustancia tiene sobre el comportamiento de la solucin.
Prctica 4
Laboratorio de Termodinmica del equilibrio de fases
A la luz de esta idea, una solucin se considera como una mezcla de ''grupos'' y no como mezcla de sustancias.
Esto ha permitido predecir los valores para los coeficientes de actividad que una sustancia tiene en solucin
para la que no se tienen datos experimentales, basndose nicamente en el conocimiento de la constitucin
qumica de la sustancia.
III.
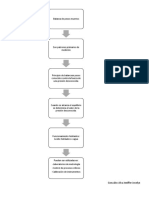
DESARROLLO EXPERIMENTAL
Preparar
Preparar
soluciones
soluciones
cloroformo(1)metanol(2)
Repetir
para cada
cada
Repetir para
solucin
solucin
Medir
Medir ndice
ndice de
de
refraccin
Graficar n vs x1
(curva de
calibracin)
calibracin)
Tomar
del
Tomar muestra
muestra del
condensado
condensado
Calentar
Calentar la
la primer
primer
solucin
solucin hasta
hasta
ebullicin
ebullicin
(temperatura
(temperatura de
de
burbuja)
Medir
ndice de
de
Medir ndice
refraccin a
refraccin
a
temperatura
temperatura
ambiente
IV.
CLCULOS
Obtencin de la curva de calibracin
a) Preparacin de las soluciones y medicin de su ndice de refraccin
Datos
x1
x 2=1x 1
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
1.3268
1.3467
1.3651
1.3813
1.3941
1.4051
1.4145
1.4238
1
0.9
0.8
0.7
0.6
0.5
0.4
0.3
Prctica 4
Laboratorio de Termodinmica del equilibrio de fases
0.8
0.9
1.0
1.4312
1.4383
1.4440
ideal
Clculo de
0.2
0.1
0
y
id =x 11.4440+ x21.3268
=id
id
1.3268
1.3385
1.3502
1.3619
1.3736
1.3854
1.3971
1.4088
1.4205
1.4322
1.4440
0
0.0082
0.0149
0.0194
0.0205
0.0197
0.0174
0.0150
0.0107
0.0061
0
Grado de Refraccin vs Xl1
1.46
1.44
1.42
1.40
x ---id 1.38
1.36
1.34
1.32
0.0
0.1
0.2
0.3
0.4
0.5
Xl1
x
Prctica 4
id
0.6
0.7
0.8
0.9
1.0
Laboratorio de Termodinmica del equilibrio de fases
Vs X1
0.0250
0.0200
0.0150
0.0100
0.0050
0.0000
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
X1
b) Ajuste de los datos experimentales a la expansin de Redlich-Kister por minimos cuadrados.
Dado:
0=[ x 1x 2[ A +B ( x 1x 2 ) +C ( x 1x 2 ) ] y ( x 1x 2 ) ]
0=[ x 1x 2[ A +B ( x 1x 2 ) +C ( x 1x 2 ) ] y ( x 1x 2 )( x1 x2 ) ]
0=[ x 1x 2[ A +B ( x 1x 2 ) +C ( x 1x 2 ) ] y ( x 1x 2 )( x1 x2 ) ]
2
A=0.0794
B=0.0226
3
C=1.74451 0
Comparacin de los valores experimentales y los ajustados con la ecuacin de Redlich-Kister
aj= x 1x 2[ 0.07940.0226 ( x 1x 2 ) +0.0017 ( x 1x 2 )
aj
0
0.0088
0.0149
0.0186
0.0201
0.0198
0.0179
0.0148
0.0106
0.0056
Prctica 4
]]
Laboratorio de Termodinmica del equilibrio de fases
0
ajust - Vs x1
0.0250
0.0200
0.0150
-- ajust
ajust
0.0100
0.0050
0.0000
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
X1
Uso de la ecuacin de la curva de calibracin para obtener la composicin de los vapores
Dado:
x 1x 2
0.07940.0226 ( x1 x2 ) + 0.0017
1.4132=1.444 x 1+ 1.3268 x 2 + x 1x 2
x 1+ x 2=1
x 1=0.5795
x 2=0.4205
Tabla de datos experimentales
i
x1
con
y1
1
2
0
0.1
1.3268
1.3385
59
55
1.3268
1.3723
0
0.2443
Prctica 4
Laboratorio de Termodinmica del equilibrio de fases
3
4
5
6
7
8
9
10
11
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
1.3502
1.3619
1.3736
1.3854
1.3971
1.4088
1.4205
1.4322
1.4440
53
51
50
48
47.5
47
48
49
55
1.3917
1.4073
1.4132
1.4272
1.4198
1.4224
1.4243
1.4293
1.4440
0.3828
0.5196
0.5795
0.6232
0.6531
0.6843
0.7079
0.7737
1.0
Diagrama de fases T vs x y
61
59
57
55
Temperatura 53
51
49
47
45
0
0.2
0.4
0.6
0.8
1.2
X1 Y1
temp
temp
X 1-Y 1 V s X 1
1.2
1
0.8
X1-Y1
0.6
0.4
0.2
0
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
X1
X1
y1
Determinacin del valor de los parmetros del modelo de Margules por el mtodo del punto azeotrpico
Datos del azetropo
Prctica 4
Laboratorio de Termodinmica del equilibrio de fases
t=47
x 1=0.67 7
P=78
A 1=13.7324
B 1=2548.74
C 1=218.552
C 2=239.5
B1
=62.4587
t+ C 1
B2
=48.3989
t +C 2
Psat 1=e A 1
Psat 2=e A 2
y 1=
P
=1.2488
Psat 1
y 2=
P
=1.6116
Psat 2
Dado:
( y 1 ) =x 22[ A 12+2X 1( A 21 A 12 ) ]
( y 2 ) =x 12[ A 21+2X 2 ( A 12A 21 )]
x 1=0.67 7
x 2=1x 1=0.323
Encontrar A12 y A21
A 12=0.6559
A 21=1.7445
Calculos tericos de la temperatura de burbuja
Prctica 4
10
A 2=16.5785
B 2=3638.27
Laboratorio de Termodinmica del equilibrio de fases
A 1=13.7324
B 1=2548.74
C 1=218.552
C 2=239.5
P=78 KPa
Clculos para:
x 1=0.9
x 2=0.1
t 1=
B1
C 1=53.2936
A 1 ( P)
t 2=
B2
C 2=58.1871
A 2 ( P)
t=x 1t 1+ x 2t 2=53.7829
B1
=79.3252
t+ C 1
B2
=64.9212
t +C 2
Psat 1=e A 1
Psat 2=e A 2
)
)
1=e [ x 22[ A 12+2X 1( A 21 A 12 ) ] ]=1.0265
2=e [ x 12[ A 21+2X 2( A 12 A 21 ) ] ]=3.4441
y 1=
1x 1Psat 1
=0.9395
P
y 2=
2x 2Psat 2
=0.2867
P
S= y 1+ y 2=1.2262
Para
t=56
Psat 1=e A 1
Prctica 4
B1
=85.5526
t+ C 1
11
A 2=16.5785
B 2=3638.27
Laboratorio de Termodinmica del equilibrio de fases
Psat 2=e A 2
B2
=71.2539
t +C 2
1=e [ x 22[ A 12+2X 1( A 21 A 12 ) ] ]=1.0265
2=e [ x 12[ A 21+2X 2( A 12 A 21 ) ] ]=3.4441
y 1=
1x 1Psat 1
=1.0133
P
y 2=
2x 2Psat 2
=0.3146
P
S= y 1+ y 2=1.3279
S 2=S
1
=48.8525
( St 2t
2S 1 )
t=t 2+ ( 1S 2 )
B1
=66.753
t+ C 1
B2
=52.5131
t +C 2
Psat 1=e A 1
Psat 2=e A 2
)
)
1=e [ x 22[ A 12+2X 1( A 21 A 12 ) ] ]=1.0265
2=e [ x 12[ A 21+2X 2( A 12 A 21 ) ] ]=3.4441
y 1=
1x 1Psat 1
=0.7906
P
y 2=
2x 2Psat 2
=0.2319
P
S= y 1+ y 2=1.0225
Prctica 4
12
Laboratorio de Termodinmica del equilibrio de fases
1
=48.3258
( St 2t
2S 1 )
t=t 2+ ( 1S 2 )
B1
=65.5088
t+ C 1
B2
=51.3143
t +C 2
Psat 1=e A 1
Psat 2=e A 2
)
)
1=e [ x 22[ A 12+2X 1( A 21 A 12 ) ] ]=1.0265
2=e [ x 12[ A 21+2X 2( A 12 A 21 ) ] ]=3.4441
y 1=
1x 1Psat 1
=0.7759
P
y 2=
2x 2Psat 2
=0.2266
P
S= y 1+ y 2=1.0025
V.
RESULTADOS
TABLA DE RESULTADOS CALCULADOS
x1
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1
t
58.18
54.95
51.97
49.73
48.29
47.52
47.19
47.13
47.32
48.32
53.19
y1
0
0.215
0.384
0.503
0.581
0.631
0.662
0.685
0.713
0.775
1.0
TABLA DE DATOS EXPERIMENTALES
texp
59
55
53
Prctica 4
y1exp
0
0.2443
0.3828
13
Laboratorio de Termodinmica del equilibrio de fases
51
50
48
47.5
47
48
49
55
0.5196
0.5795
0.6232
0.6531
0.6843
0.7079
0.7737
1.0
Diagrama de fases T vs x-y
61
59
57
55
53
Temperatura
51
49
47
-0.2
45
0
0.2
0.4
0.6
0.8
1.2
X1,Y1exp,X1,Y1
temp
VI.
temp
temp.t
temp.t
CONCLUSIONES
En esta prctica se prepar una serie de soluciones de cloroformo y metanol, y a partir de
datos experimentales, que fueron la temperatura de burbuja y el ndice de refraccin, se
realizaron los diversos clculos que requera la prctica, como son el coeficiente de actividad
y su composicin determinando previamente que modelo de solucin utilizar (Margules o Van
Laar) en este caso se us el de Margules, al realizar los clculos correspondientes, se
Prctica 4
14
Laboratorio de Termodinmica del equilibrio de fases
comprararon con los experimentales, por lo cual se obtuvieron las diferentes grficas antes
mostradas.
VII.
BIBLIOGRAFA
1.- Wark Kenneth & E. Richards Donald Termodinmica 6 edicin; Ed. Mc. Graw Hill;
Madrid 2001.
2- Criado Sancho Manuel & Casas Vsquez Jos Termodinmica Qumica y de los
Procesos Irreversibles 2 edicin; Ed. Pearson Addison Wesley; Madrid 2004. 3.- REID,
Robert C y SHERWOOD, Thomas K. propiedades de los gases y lquidos. Unin tipogrfica
editorial hispano-americana. Mxico.1968.
Prctica 4
15
Das könnte Ihnen auch gefallen
- Practica 3 TermoDokument13 SeitenPractica 3 TermoJeniffer GonzálezNoch keine Bewertungen
- Termo III (Práctica 3)Dokument33 SeitenTermo III (Práctica 3)Jesus Vazquez60% (5)
- p5 Reposicion ReDokument41 Seitenp5 Reposicion ReAreli AltamiranoNoch keine Bewertungen
- Practica 3Dokument7 SeitenPractica 3Garcia Barrera EuniceNoch keine Bewertungen
- II InformeDokument11 SeitenII InformeAnyelTorresNoch keine Bewertungen
- 2PM32 Practica 5 E5 RecuperacionDokument32 Seiten2PM32 Practica 5 E5 RecuperacionDaniel Quevedo GonzálezNoch keine Bewertungen
- Practica 4 TEFDokument12 SeitenPractica 4 TEFBenji ValdezNoch keine Bewertungen
- Copia de Práctica 3 y 4 - EH 2015Dokument26 SeitenCopia de Práctica 3 y 4 - EH 2015angelriosvazquez08Noch keine Bewertungen
- Laboratorio Construccion Diagramas 2017 IDokument5 SeitenLaboratorio Construccion Diagramas 2017 IRonaldo OrihuelaNoch keine Bewertungen
- Praticatermo 3 y 4Dokument11 SeitenPraticatermo 3 y 4Miguel Llorente RamirezNoch keine Bewertungen
- Determinación del punto azeotrópico HCl-H2ODokument18 SeitenDeterminación del punto azeotrópico HCl-H2OBrendaJhocelynNoch keine Bewertungen
- Práctica 4 Termodinámica Del Equilibrio de FasesDokument17 SeitenPráctica 4 Termodinámica Del Equilibrio de FasesViedka ZepedaNoch keine Bewertungen
- Flash Adiabatic oDokument26 SeitenFlash Adiabatic oFranlo VizcarraNoch keine Bewertungen
- 2PM32 Practica 4 E5 RecuperacionDokument28 Seiten2PM32 Practica 4 E5 RecuperacionDaniel Quevedo GonzálezNoch keine Bewertungen
- Practida Ley RaoultDokument29 SeitenPractida Ley RaoultBerenice Abichuela Rivera LunaNoch keine Bewertungen
- Instituto Politecnico NacionalDokument8 SeitenInstituto Politecnico NacionalPandiitap Emoxiitap NeniitapNoch keine Bewertungen
- Equilibrio Líquido Vapor en Un Sistema No IdealDokument5 SeitenEquilibrio Líquido Vapor en Un Sistema No IdealAnonymous ykiLcGa4wNoch keine Bewertungen
- EQUILIBRIO DE MEZCLAS MULTICOMPONENTE Y SIMULACIÓNDokument28 SeitenEQUILIBRIO DE MEZCLAS MULTICOMPONENTE Y SIMULACIÓNDylan Gonzales MuñozNoch keine Bewertungen
- Raoult Modificada 4 1Dokument14 SeitenRaoult Modificada 4 1Arturo0% (1)
- Equilibrio Líquido-VaporDokument16 SeitenEquilibrio Líquido-VaporrborbollavNoch keine Bewertungen
- Practica 6 Lab SSFDokument12 SeitenPractica 6 Lab SSFAndie Flores0% (1)
- Ley de Raoult y Equilibrio Líquido-VaporDokument4 SeitenLey de Raoult y Equilibrio Líquido-VaporpepitaNoch keine Bewertungen
- Informe Sistema Binario Equilibrio Liquido-VaporDokument13 SeitenInforme Sistema Binario Equilibrio Liquido-VaporWilliam PabonNoch keine Bewertungen
- Informe #9 - Fisicoquimica AIIDokument14 SeitenInforme #9 - Fisicoquimica AIIdhalyzsilvaNoch keine Bewertungen
- Destilación intermitente de agua-metanolDokument23 SeitenDestilación intermitente de agua-metanolRamon Cruz MamaniNoch keine Bewertungen
- Op1 Pre1Dokument5 SeitenOp1 Pre1FernandoNoch keine Bewertungen
- Informe Práctica #3 Punto de BurbujaDokument5 SeitenInforme Práctica #3 Punto de BurbujaDiego Nicolas ManceraNoch keine Bewertungen
- Diagrama Txy para una mezcla binaria de Metanol-CloroformoDokument6 SeitenDiagrama Txy para una mezcla binaria de Metanol-CloroformoLina marcela unriza garciaNoch keine Bewertungen
- Pre Informe 13Dokument5 SeitenPre Informe 13Laura Vanessa Ramirez ArbelaezNoch keine Bewertungen
- Equilibrio de Fase Líquido - VaporDokument28 SeitenEquilibrio de Fase Líquido - VaporIvan TorresNoch keine Bewertungen
- Informe N°9 Diagrama de FasesDokument25 SeitenInforme N°9 Diagrama de FasesLuis AbantoNoch keine Bewertungen
- Laboratorio 5 Regla de Fases UNMSMDokument27 SeitenLaboratorio 5 Regla de Fases UNMSMsimpatico0070% (1)
- Ejemplo de Metodo-Unifac Reporte 1Dokument7 SeitenEjemplo de Metodo-Unifac Reporte 1chavaNoch keine Bewertungen
- Laboratorio 6Dokument18 SeitenLaboratorio 6Ximena Nicole Mori SáenzNoch keine Bewertungen
- Lab1 - Eq Liq Vapor - SistemaBinario PDFDokument4 SeitenLab1 - Eq Liq Vapor - SistemaBinario PDFnyaurzNoch keine Bewertungen
- PsdsimpDokument6 SeitenPsdsimpJósmar Jesús PérezNoch keine Bewertungen
- Marco Teórico PetroDokument8 SeitenMarco Teórico PetroEstefany Vania Nina ZuritaNoch keine Bewertungen
- Lab Procesos Quimicos TD1Dokument36 SeitenLab Procesos Quimicos TD1Eduardo BeltranNoch keine Bewertungen
- Practica 2 Balance de Energia en Estado Inestable Mezclado No Ideal Intermitente de SolucionDokument6 SeitenPractica 2 Balance de Energia en Estado Inestable Mezclado No Ideal Intermitente de SolucionSusette Diaz0% (1)
- Modelación de equilibrios termodinámicos con UNIQUACDokument11 SeitenModelación de equilibrios termodinámicos con UNIQUACJuan David Hoyos BohorquezNoch keine Bewertungen
- PRACTICA NO.1 EditadaDokument12 SeitenPRACTICA NO.1 Editada202027497.iquiNoch keine Bewertungen
- Anexo - Tarea 3Dokument11 SeitenAnexo - Tarea 3Stiben Salgado BillegasNoch keine Bewertungen
- Equilibrio químico y destilación de mezclas binarias y ternariasDokument37 SeitenEquilibrio químico y destilación de mezclas binarias y ternariasCARMENZANoch keine Bewertungen
- Informe Eq. Liq-VapDokument19 SeitenInforme Eq. Liq-VapHernán Gallardo FloresNoch keine Bewertungen
- Preguntas de Fenomenos de TrasporteDokument28 SeitenPreguntas de Fenomenos de TrasporteingrossNoch keine Bewertungen
- INFORME1Dokument9 SeitenINFORME1Kevin Anthony Oré MaldonadoNoch keine Bewertungen
- Simulación triple efecto evaporaciónDokument9 SeitenSimulación triple efecto evaporaciónChristian VerdeNoch keine Bewertungen
- Informe Líquido Vapor UnmsmDokument16 SeitenInforme Líquido Vapor UnmsmJoselyn Matias BrañezNoch keine Bewertungen
- Reglas de FaseDokument21 SeitenReglas de FaseZezy BlueNoch keine Bewertungen
- Cálculos Regla de FasesDokument23 SeitenCálculos Regla de FasesElias TejedaNoch keine Bewertungen
- Equilibrio líquido vapor de una mezcla binariaDokument6 SeitenEquilibrio líquido vapor de una mezcla binariaAngie HernándezNoch keine Bewertungen
- Informe Lab FisicoquimicaDokument40 SeitenInforme Lab FisicoquimicaCARMENZA100% (1)
- Informe 1. EXTRACCION LIQ LIQDokument37 SeitenInforme 1. EXTRACCION LIQ LIQDarvich GomezNoch keine Bewertungen
- Ingeneria Quimica ComputacionalDokument18 SeitenIngeneria Quimica ComputacionalMirellea AndurayNoch keine Bewertungen
- Ley de Raoult ModificadaDokument4 SeitenLey de Raoult ModificadaMauricio RamirezNoch keine Bewertungen
- Raoult 2019Dokument10 SeitenRaoult 2019Brhayan LópezNoch keine Bewertungen
- Fisicoquimica LeyesDokument10 SeitenFisicoquimica LeyesBryam Molina CerronNoch keine Bewertungen
- FQ Metalurgica Guia Lab ExtensoDokument23 SeitenFQ Metalurgica Guia Lab ExtensoCarlo Bastidas JaimesNoch keine Bewertungen
- Psicometría. Principios básicos y protocolos experimentales diversosVon EverandPsicometría. Principios básicos y protocolos experimentales diversosNoch keine Bewertungen
- Instituto Politécnico NacionalDokument1 SeiteInstituto Politécnico NacionalJeniffer GonzálezNoch keine Bewertungen
- Instituto Politécnico NacionalDokument6 SeitenInstituto Politécnico NacionalJeniffer GonzálezNoch keine Bewertungen
- EstapsicoDokument16 SeitenEstapsicoJeniffer GonzálezNoch keine Bewertungen
- Practica 3 Secador RotatorioDokument9 SeitenPractica 3 Secador RotatorioJeniffer GonzálezNoch keine Bewertungen
- Evaporador simple efecto: presión vapor, temperaturas, masas y eficienciasDokument4 SeitenEvaporador simple efecto: presión vapor, temperaturas, masas y eficienciasJeniffer GonzálezNoch keine Bewertungen
- Evaporación Triple EfectoDokument10 SeitenEvaporación Triple EfectoJeniffer GonzálezNoch keine Bewertungen
- Evaporación Múltiple EfectoDokument6 SeitenEvaporación Múltiple EfectoJeniffer GonzálezNoch keine Bewertungen
- NORMADokument20 SeitenNORMAJeniffer GonzálezNoch keine Bewertungen
- Proceso de Elaboración de LevadurasDokument7 SeitenProceso de Elaboración de LevadurasJeniffer GonzálezNoch keine Bewertungen
- Proceso de Elaboración de LevadurasDokument7 SeitenProceso de Elaboración de LevadurasJeniffer GonzálezNoch keine Bewertungen
- Practica 3 Diagrama y GraficaDokument2 SeitenPractica 3 Diagrama y GraficaJeniffer GonzálezNoch keine Bewertungen
- Practica 3 Secador RotatorioDokument9 SeitenPractica 3 Secador RotatorioJeniffer GonzálezNoch keine Bewertungen
- Secador de CharolasDokument2 SeitenSecador de CharolasJeniffer GonzálezNoch keine Bewertungen
- Termopares y receptor eléctrico IPNDokument3 SeitenTermopares y receptor eléctrico IPNJeniffer GonzálezNoch keine Bewertungen
- NORMADokument20 SeitenNORMAJeniffer GonzálezNoch keine Bewertungen
- Diagrama Pesos MuertosDokument2 SeitenDiagrama Pesos MuertosJeniffer GonzálezNoch keine Bewertungen
- Practica 7 CRONTOLADOR PROPORCIONALDokument4 SeitenPractica 7 CRONTOLADOR PROPORCIONALJeniffer GonzálezNoch keine Bewertungen
- Practica 4 Placa de OrificioDokument3 SeitenPractica 4 Placa de OrificioJeniffer GonzálezNoch keine Bewertungen
- Diagrama DescriptivoDokument1 SeiteDiagrama DescriptivoJeniffer GonzálezNoch keine Bewertungen
- Introduccion Papa y ManzanaDokument3 SeitenIntroduccion Papa y ManzanaJeniffer GonzálezNoch keine Bewertungen
- Ionización Electrónica-FragmentaciónDokument1 SeiteIonización Electrónica-FragmentaciónJeniffer GonzálezNoch keine Bewertungen
- Diagrama de Las Practicas 678Dokument1 SeiteDiagrama de Las Practicas 678Jeniffer GonzálezNoch keine Bewertungen
- Bases de DiseñoDokument9 SeitenBases de DiseñoJeniffer GonzálezNoch keine Bewertungen
- INTEGRACIÓN NUMÉRICA Metodo Del TrapecioDokument2 SeitenINTEGRACIÓN NUMÉRICA Metodo Del TrapecioJeniffer GonzálezNoch keine Bewertungen
- Historia y Evolución Del CoachingDokument28 SeitenHistoria y Evolución Del CoachingJeniffer GonzálezNoch keine Bewertungen
- Transferencia de Calor. Práctica 1Dokument6 SeitenTransferencia de Calor. Práctica 1Jeniffer GonzálezNoch keine Bewertungen
- Tecnologia de Alimentos 2Dokument31 SeitenTecnologia de Alimentos 2Jeniffer GonzálezNoch keine Bewertungen
- Practica Condensador HorizontalDokument13 SeitenPractica Condensador HorizontalJeniffer GonzálezNoch keine Bewertungen
- Practica SerpentinDokument1 SeitePractica SerpentinJeniffer GonzálezNoch keine Bewertungen
- Datos Practica 4Dokument1 SeiteDatos Practica 4Jeniffer GonzálezNoch keine Bewertungen
- Fundamentos de Estática y DinámicaDokument110 SeitenFundamentos de Estática y DinámicaVicente Guadarrama CastrejónNoch keine Bewertungen
- Problemas de Física Iv Primer ParcialDokument16 SeitenProblemas de Física Iv Primer ParcialLeslie LewisNoch keine Bewertungen
- Ejercicios de funciones reales de variable realDokument3 SeitenEjercicios de funciones reales de variable realPepa PerezNoch keine Bewertungen
- Fallas en Interruptores TermomagnéticosDokument2 SeitenFallas en Interruptores TermomagnéticosMike Estrada0% (2)
- Torque y Cuerpo RigidosDokument45 SeitenTorque y Cuerpo Rigidosraul pintoNoch keine Bewertungen
- Determinación Potenciométrica de La Concentración en Una Disolución de H3PO4Dokument13 SeitenDeterminación Potenciométrica de La Concentración en Una Disolución de H3PO4Camila Valdes0% (1)
- GIROS Geometria DescriptivaDokument14 SeitenGIROS Geometria DescriptivaPresly Barrios MuñozNoch keine Bewertungen
- GeometriaDokument4 SeitenGeometriaGILMER TALANoch keine Bewertungen
- Informe 4. Determinación Experimental Del Vector Resultante de La Suma de Varias Fuerzas Concurrentes.Dokument9 SeitenInforme 4. Determinación Experimental Del Vector Resultante de La Suma de Varias Fuerzas Concurrentes.Laura Paola Rios KattahNoch keine Bewertungen
- Sistema CónicoDokument10 SeitenSistema CónicomuerdejuyeNoch keine Bewertungen
- Discusión #3 OscilacionesDokument19 SeitenDiscusión #3 OscilacionesMarvin Vásquez0% (1)
- Informe de Laboratorio: DetergentesDokument4 SeitenInforme de Laboratorio: DetergentesVilmary Perea Murillo50% (2)
- Generador de Van Der GraffDokument11 SeitenGenerador de Van Der GraffDuverley Alexander Grajales Quintero0% (1)
- Guia Ix Instalaciones Receptoras de BT PDFDokument71 SeitenGuia Ix Instalaciones Receptoras de BT PDFCristina Garcia FlorezNoch keine Bewertungen
- Gary R. Hayek - by El357juanchoDokument23 SeitenGary R. Hayek - by El357juanchoforoNoch keine Bewertungen
- Viscosidad y fluidos no NewtonianosDokument4 SeitenViscosidad y fluidos no NewtonianosLaura RuizNoch keine Bewertungen
- Deformación PlásticaDokument36 SeitenDeformación PlásticaronaldmecNoch keine Bewertungen
- Trabajo Integrador Intercicloecuaciones 1Dokument8 SeitenTrabajo Integrador Intercicloecuaciones 1TatyTorresNoch keine Bewertungen
- Estabilizantes térmicos PVC ecoDokument20 SeitenEstabilizantes térmicos PVC ecocedwNoch keine Bewertungen
- Objetivos de AprendizajeDokument2 SeitenObjetivos de AprendizajeRafael MerlanoNoch keine Bewertungen
- Leyes de Reflexion y Transmicion de OndaDokument4 SeitenLeyes de Reflexion y Transmicion de OndaVanLiNoch keine Bewertungen
- Material Adicional Ayudantia 5 ICE3124Dokument6 SeitenMaterial Adicional Ayudantia 5 ICE3124juantikNoch keine Bewertungen
- Sistemas de Freno en AutomovilesDokument43 SeitenSistemas de Freno en Automovileslord_helix_hell666Noch keine Bewertungen
- Equipo de Perfilaje VerticalDokument9 SeitenEquipo de Perfilaje VerticalAlvaro Arley Cardona GutiérrezNoch keine Bewertungen
- Separata Pre 2Dokument21 SeitenSeparata Pre 2Juan MiguelNoch keine Bewertungen
- Dikoin Ene 2013Dokument176 SeitenDikoin Ene 2013Delfino TarinNoch keine Bewertungen
- Crucigrama (Terminos Del Semestre)Dokument3 SeitenCrucigrama (Terminos Del Semestre)brauliolpNoch keine Bewertungen
- Determinación de Números de Transportel Método HittorfDokument5 SeitenDeterminación de Números de Transportel Método HittorfNicolás Noreña ToroNoch keine Bewertungen
- Diseñoii 3Dokument21 SeitenDiseñoii 3LuisHernandezVelascoNoch keine Bewertungen
- Video-Tutoriales de CinemáticaDokument5 SeitenVideo-Tutoriales de CinemáticaJuan DavidNoch keine Bewertungen