Beruflich Dokumente
Kultur Dokumente
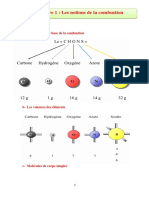
Combustion Exo
Hochgeladen von
Simo El AzaarOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Combustion Exo
Hochgeladen von
Simo El AzaarCopyright:
Verfügbare Formate
Energie chimique de combustion exercices corrigs p320
1. Mots manquants
a. dioxyde de carbone ; de l'eau
b. 5
c. mol ; J.mol1
d. chimique
e. libre ; exothermique
f. 1000 10 000
2. QCM
a. 2 C0H6 (g) + 7 O2 (g) 4 CO2 (g) + 6 H2O (g).
b. Libre de l'nergie.
c. n' = 10,0 mol.
d. %libre = 1,6 106 J.
e. Ils librent de l'nergie lors de leur combustion complte.
Mobiliser ses connaissances
Ractions de combustion (1 du cours)
3.a. C3H8 (g) + 5 O2 (g) 3 CO2 (g) + 4 H2O (g)
b. 2 C6H14 (g) + 19 O2 (g) 12 CO2 (g) + 14 H2O (g)
c. 2 C3H8O (g) + 9 O2 (g) 6 CO2 (g) + 8 H2O (g)
d. 2 C8H18 (g) + 25 O2 (g) 16 CO2 (g) + 18 H2O (g)
e. 2 C12H26 (g) + 37 O2 (g) 24 CO2 (g) + 26 H2O (g)
4. a. Dressons le tableau d'volution correspondant la combustion de la quantit de
matire n d'octane en prsence d'un excs de dioxygne.
l'tat final, l'octane est totalement consomm : n 2 xmax = 0, soit xmax = n / 2.
La quantit de matire de dioxyde de carbone forme par kilomtre est donc :
n' = 16 xmax = 16 (n / 2) = 8 n.
On en dduit la masse m de dioxyde de carbone mis par kilomtre :
m = n' M = 8 n M.
A.N. : m = 8 0,43 44,0 = 1,5 102 g.
b. Le dioxyde de carbone est un gaz effet de serre, son rejet dans l'atmosphre participe
donc au rchauffement climatique
5. La quantit de matire de mthane est : n = m / M.
L'nergie libre par la combustion de la quantit de matire n de mthane est donc :
Elibre = n Em,comb = (m / M) Em,comb
A.N. : Elibre = (32,0 / 16,0) 820 = 1,64 103 kJ.
Energie chimique de combustion exercices corrigs p320
7. L'nergie libre par la combustion de la quantit de matire n de mthanol en prsence
d'un excs de dioxygne est : Elibre = n Em,comb, o Em,comb est l'nergie molaire de
combustion du mthanol.
On en dduit : Em,comb = Elibre / n.
A.N. : Em,comb = (1,7 106) / (2,5 103) = 6,8 102 kJ.mol1.
8. a. La quantit de matire n d'thanol est donne par : n = m / M.
L'nergie libre par la combustion de la masse m d'thanol est donc :
Elibre = n Em,comb = (m / M) Em,comb.
A.N. : Elibre = (1,0 / 46,0) 1,3 103 = 28 kJ.
b. Convertissons en calorie l'nergie libre par la combustion d'une masse m = 1,0 g
d'thanol : Elibre = 28 / 4,18 = 6,7 kcal.
(Valeur proche de celle donne par la table des calories, qui ne donne que des valeurs
entires.)
9. a. On commence par ajuster les nombres stoechiomtriques pour assurer la conservation
des lments carbone et hydrogne ; on crit le nombre stoechiomtrique 2 devant C 2H6
:
2 C2H6 (g) + ... O2 (g) 4 CO2 (g) + 6 H2O (g).
On assure ensuite la conservation de l'lment oxygne :
2 C2H6 (g) + 7 O2 (g) 4 CO2 (g) + 6 H2O (g).
b. On commence par ajuster les nombres stoechiomtriques pour assurer la conservation
des lments carbone et hydrogne ; on crit le nombre stoechiomtrique 1 devant
C6H12, 6 devant H2O :
C6H12 (g) + ... O2 (g) 6 CO2 (g) + 6 H2O (g).
On assure ensuite la conservation de l'lment oxygne :
C6H12 (g) + 9 O2 (g) 6 CO2 (g) + 6 H2O (g).
c. On commence par ajuster les nombres stoechiomtriques pour assurer la conservation
des lments carbone et hydrogne ; on crit le nombre stoechiomtrique 2 devant
C6H12O :
2 C6H12O (g) + ... O2 (g) 12 CO2 (g) + 12 H2O (g).
On assure ensuite la conservation de l'lment oxygne :
2 C6H12O (g) + 17 O2 (g) 12 CO2 (g) + 12 H2O (g).
Das könnte Ihnen auch gefallen
- 4355 - Combustion - V1213Dokument72 Seiten4355 - Combustion - V1213Steve WanNoch keine Bewertungen
- 3938 Combustion Sti2dDokument11 Seiten3938 Combustion Sti2dAchraf MoutaharNoch keine Bewertungen
- Conversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanVon EverandConversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanNoch keine Bewertungen
- COURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFDokument36 SeitenCOURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFKone Ousmane100% (1)
- Risques Construction PDFDokument25 SeitenRisques Construction PDFSimo El AzaarNoch keine Bewertungen
- Rapport de StageDokument32 SeitenRapport de StageTouati Tengour100% (2)
- Etude Et Dimensionnement D'Un Compresseur Pour Un Groupe D'Eau Glacée Pour Proces CevitalDokument104 SeitenEtude Et Dimensionnement D'Un Compresseur Pour Un Groupe D'Eau Glacée Pour Proces Cevitalmourad abbassi100% (2)
- Chapitre 1 Combustion Et CombustibleDokument79 SeitenChapitre 1 Combustion Et CombustibleRyad AsmaNoch keine Bewertungen
- Combustion - Chap 2 PDFDokument18 SeitenCombustion - Chap 2 PDFAlekhya100% (2)
- Examen Combustion M1EN 2021Dokument2 SeitenExamen Combustion M1EN 2021Khaled ChaibNoch keine Bewertungen
- 852 Preparer Entretien27567 PDFDokument32 Seiten852 Preparer Entretien27567 PDFSimo El AzaarNoch keine Bewertungen
- CombustionDokument14 SeitenCombustionamouhcine100% (1)
- CombustionDokument28 SeitenCombustionHoucem Eddine MechriNoch keine Bewertungen
- VF Guide Technique de Lefficacite Energetique Dans Le Secteur TouristiqueDokument88 SeitenVF Guide Technique de Lefficacite Energetique Dans Le Secteur TouristiqueSimo El AzaarNoch keine Bewertungen
- CHAPITRE 2 - Généralités Sur La CombustionDokument23 SeitenCHAPITRE 2 - Généralités Sur La CombustionSamuel DotouNoch keine Bewertungen
- Balle de Riz 1Dokument226 SeitenBalle de Riz 1r;rNoch keine Bewertungen
- Chapitre 2 - EE Dans L'industrie-ChaudièreDokument55 SeitenChapitre 2 - EE Dans L'industrie-Chaudièrees.aliasmNoch keine Bewertungen
- Énergie, Exergie, Économe Thermo-ÉconomieDokument30 SeitenÉnergie, Exergie, Économe Thermo-ÉconomieHamza BaraketNoch keine Bewertungen
- Web Combustions ExDokument7 SeitenWeb Combustions ExJawad HamritiNoch keine Bewertungen
- Cira 2009 Combustions ChaudDokument2 SeitenCira 2009 Combustions Chaudmehdi100% (1)
- Thermochimie 2020-1Dokument3 SeitenThermochimie 2020-1Salima SouhilaNoch keine Bewertungen
- ING Serie Thermochimie. - Derniere VersionDokument5 SeitenING Serie Thermochimie. - Derniere VersionRacha Chellik100% (1)
- Travaux Diriges de ThermodynamiqueDokument8 SeitenTravaux Diriges de ThermodynamiqueBhuvanNoch keine Bewertungen
- Combustion 1Dokument4 SeitenCombustion 1Youssef100% (1)
- TD 1Dokument4 SeitenTD 1Jonas lumbuNoch keine Bewertungen
- Solution - TD3 - Modelisation de La Combustion Dans Les MoteursDokument2 SeitenSolution - TD3 - Modelisation de La Combustion Dans Les Moteurshousam100% (1)
- Suite 2 Chapitre 1 CombustionDokument3 SeitenSuite 2 Chapitre 1 CombustionJerusalem AbrahamNoch keine Bewertungen
- Printing Combustion Et ChaudièreDokument1 SeitePrinting Combustion Et ChaudièreSirineJamoussiNoch keine Bewertungen
- Notions Combustibles Exercices Enonces PDFDokument8 SeitenNotions Combustibles Exercices Enonces PDFHoussam HaddaniNoch keine Bewertungen
- Etude de Cas - CombustionDokument2 SeitenEtude de Cas - CombustionDroidy Space100% (1)
- TD N°1 CombustionDokument4 SeitenTD N°1 CombustionPaul Julbin NJOCK100% (1)
- Devoir SDokument3 SeitenDevoir SMourad MatmourNoch keine Bewertungen
- Chap 1 - IntroductionV1 EtudiantDokument11 SeitenChap 1 - IntroductionV1 EtudiantMohammed NasserNoch keine Bewertungen
- CombustionDokument6 SeitenCombustionArih FadiNoch keine Bewertungen
- 1-Combustion 2020 PDFDokument65 Seiten1-Combustion 2020 PDFAmirah AmiroucheNoch keine Bewertungen
- Cours de CombustionDokument69 SeitenCours de Combustionhamza kadimNoch keine Bewertungen
- TD 7 Combustion PDFDokument3 SeitenTD 7 Combustion PDFAbdulwahab MayasNoch keine Bewertungen
- Syllabus Fours Et Chaudières PDFDokument1 SeiteSyllabus Fours Et Chaudières PDFBeichaNoch keine Bewertungen
- Série de TD 3 Et 4Dokument4 SeitenSérie de TD 3 Et 4Mourad MatmourNoch keine Bewertungen
- Phys Chim 2001Dokument8 SeitenPhys Chim 2001Issam NajibNoch keine Bewertungen
- Polycopies CombustionDokument121 SeitenPolycopies CombustionBAALINoch keine Bewertungen
- Notions Combustibles Exercices Enonces PDFDokument8 SeitenNotions Combustibles Exercices Enonces PDFoverdose500Noch keine Bewertungen
- Cours Fours Et Chaudières - Partie 1Dokument11 SeitenCours Fours Et Chaudières - Partie 1sbj100% (1)
- Ostwald Exercices PDFDokument9 SeitenOstwald Exercices PDFoverdose500Noch keine Bewertungen
- Ef Combustion 2018 Et CorrigéDokument5 SeitenEf Combustion 2018 Et Corrigémalek malakiNoch keine Bewertungen
- Chimie Controle CombustionDokument2 SeitenChimie Controle Combustionimanfekryahmed100% (1)
- TD N°4 HydrocarbureDokument3 SeitenTD N°4 HydrocarbureYoussoupha DiopNoch keine Bewertungen
- La CombustionDokument20 SeitenLa CombustionPaul Julbin NJOCKNoch keine Bewertungen
- PDF Cours Principe de La CombustionDokument3 SeitenPDF Cours Principe de La CombustionAhmed GHATTAB100% (1)
- 09 Combustion Exerc6Dokument5 Seiten09 Combustion Exerc6KHAOULA AJLANENoch keine Bewertungen
- Rendement D'un Four1Dokument2 SeitenRendement D'un Four1Hamza OuniNoch keine Bewertungen
- Calcul Du Rendement Du Chaudiere 02Dokument30 SeitenCalcul Du Rendement Du Chaudiere 02Amine AlouiNoch keine Bewertungen
- Thermo EMSE PDFDokument110 SeitenThermo EMSE PDFTRAORENoch keine Bewertungen
- TD CompressedDokument9 SeitenTD Compressedhalima benaliNoch keine Bewertungen
- Four 1Dokument14 SeitenFour 1Sirine AchichiNoch keine Bewertungen
- Exercices Sur La Combustion de Quelques Carburants (Chapitre 2)Dokument2 SeitenExercices Sur La Combustion de Quelques Carburants (Chapitre 2)romain fokam100% (1)
- Crs Renf Td2 Gaz ParfaitsDokument4 SeitenCrs Renf Td2 Gaz ParfaitsZacaria DiarraNoch keine Bewertungen
- Combustion Et CombustibleDokument52 SeitenCombustion Et CombustibleAbdou EssamyNoch keine Bewertungen
- TD 2 Biomasse 2021 2022Dokument2 SeitenTD 2 Biomasse 2021 2022ToufikNoch keine Bewertungen
- Exercices - EnoncésDokument9 SeitenExercices - EnoncésSaadi Badis100% (1)
- Cycles Combiné - 30 QuestionsDokument13 SeitenCycles Combiné - 30 QuestionsImad BouchaourNoch keine Bewertungen
- Pre CombustionDokument79 SeitenPre Combustionyoussef100% (1)
- Combustion - l3 PropulsionDokument111 SeitenCombustion - l3 PropulsionRamzi TeraiNoch keine Bewertungen
- 1s Ch19 TP Combustion CorrigéDokument1 Seite1s Ch19 TP Combustion Corrigésherkan100% (1)
- Printing Calcul Humidité Et Enthalpie Massique D'un Air HumideDokument2 SeitenPrinting Calcul Humidité Et Enthalpie Massique D'un Air Humidefarah channaNoch keine Bewertungen
- Ferriere ConfDokument41 SeitenFerriere ConfSimo El AzaarNoch keine Bewertungen
- 02 NM NMS Fra2016Dokument16 Seiten02 NM NMS Fra2016Simo El AzaarNoch keine Bewertungen
- DS Hydrau CorrectionDokument9 SeitenDS Hydrau CorrectionSimo El AzaarNoch keine Bewertungen
- 2 Formulaire PAM Coef Perte CH SingDokument6 Seiten2 Formulaire PAM Coef Perte CH SingelvisyaoNoch keine Bewertungen
- 5 ETE EPTA Systemes CO2 - Transcritiques 220310Dokument22 Seiten5 ETE EPTA Systemes CO2 - Transcritiques 220310Jesús CatalanNoch keine Bewertungen
- Kids FR-FR v7.5 PDFDokument12 SeitenKids FR-FR v7.5 PDFhubert.binonNoch keine Bewertungen
- DR Konan Séraphin - Ecosystème Et Pollution - Contenu Cours - 2ieDokument25 SeitenDR Konan Séraphin - Ecosystème Et Pollution - Contenu Cours - 2ieOuedraogo Evariste100% (1)
- Diapo Lifebokks Complet2016Dokument86 SeitenDiapo Lifebokks Complet2016Oussama OuardaniNoch keine Bewertungen
- Moteur ThermiqueDokument29 SeitenMoteur Thermiqueibrahim rabbajNoch keine Bewertungen
- Ta Rechauffement Climatique 1Dokument12 SeitenTa Rechauffement Climatique 1خالد الكتبNoch keine Bewertungen
- Livres D'actualité N°360 C'est MaintenantDokument8 SeitenLivres D'actualité N°360 C'est MaintenantAlain GrandjeanNoch keine Bewertungen
- Sujet Docs Geologie 2018Dokument10 SeitenSujet Docs Geologie 2018SylvainNoch keine Bewertungen
- SCMDokument9 SeitenSCMRy AnNoch keine Bewertungen
- Coca MentosDokument18 SeitenCoca MentosjanimironNoch keine Bewertungen
- Avancer: Vers Un Avenir DurableDokument48 SeitenAvancer: Vers Un Avenir DurableNK5178Noch keine Bewertungen
- Meteo 2011 72 31Dokument11 SeitenMeteo 2011 72 31lsdhfsdhfishNoch keine Bewertungen
- Environnement 1Dokument8 SeitenEnvironnement 1Elbahi DjaalabNoch keine Bewertungen
- Introduction A L'environnementDokument39 SeitenIntroduction A L'environnementChristian AmadouNoch keine Bewertungen
- Domotique KNXDokument28 SeitenDomotique KNXGERARD ArnaudNoch keine Bewertungen
- Changement Climatique Et Sante - BesancenotDokument21 SeitenChangement Climatique Et Sante - BesancenotAllyneellen6Noch keine Bewertungen
- GP - 62 Procédés de DépollutionTD - S6 - Etude de Cas Energies Fossiles Et Combustion PDFDokument2 SeitenGP - 62 Procédés de DépollutionTD - S6 - Etude de Cas Energies Fossiles Et Combustion PDFyousra ZouakNoch keine Bewertungen
- Dictionnaire PEV FRDokument55 SeitenDictionnaire PEV FRAl cali AntdelightNoch keine Bewertungen
- 1 Société Globalement CarbonéeDokument2 Seiten1 Société Globalement Carbonéebenji .971Noch keine Bewertungen
- Bétons: Classification Des Environnements AgressifsDokument14 SeitenBétons: Classification Des Environnements AgressifsananasNoch keine Bewertungen
- Concentrativechartreuse Tri FoldDokument1 SeiteConcentrativechartreuse Tri FoldNadine AbidNoch keine Bewertungen
- Cours Nutrition CellulaireDokument2 SeitenCours Nutrition Cellulaireaminatajeanne keitaNoch keine Bewertungen
- Production de GazDokument11 SeitenProduction de Gazhassaniabdelmadjid7Noch keine Bewertungen
- Les Causes Des Incendies de ForetDokument26 SeitenLes Causes Des Incendies de ForetLasmer ChadiNoch keine Bewertungen
- Elfatace AbirDokument85 SeitenElfatace AbirPíís DGNoch keine Bewertungen
- Low-Tech Lab-Biodigesteur DomestiqueDokument18 SeitenLow-Tech Lab-Biodigesteur DomestiqueAs RandriNoch keine Bewertungen
- Un Eclairage Exterieur Public IntelligenDokument24 SeitenUn Eclairage Exterieur Public IntelligenHyacinthe KOSSI100% (1)