Beruflich Dokumente
Kultur Dokumente
FORMULARIO
Hochgeladen von
Cristian SeCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
FORMULARIO
Hochgeladen von
Cristian SeCopyright:
Verfügbare Formate
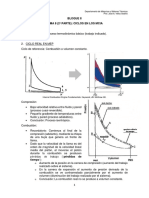
ENERGIA
E. potencial
Ep =m g h
E. cinetica
Ec =
E. mecnica
1
2
1 atm = 760 mmHg
1 atm = 14.7 PSI
1 atm=101.3 KPa
v2
TEMPERATURA
Em = Ep +Ec
Ley de la
conservacin de la
materia E= m
De Fahrenheit a Celsius
MLTIPLOS
SUBMLTIPLOS
c2
EQUIVALENCIAS
d H 2 O=
1g
ml
1 L H 2 O=1 kg H 2 O
1m3 = 1000 L
1cm3 = 1 ml
Factor
Prefijo
Smbolo
Factor
Prefijo
Smbolo
1024
yotta
10-1
deci
1021
zeta
10-2
centi
1018
exa
10-3
mili
1015
peta
10-6
micro
1012
tera
10-9
nano
109
giga
10-12
pico
106
mega
10-15
femto
103
kilo
10-18
atto
102
hecto
10-21
zepto
101
deca
da
10-24
yocto
De Celsius a Fahrenheit
Obtencin:
CH 3 CH 2 OH ZnC l 2 H 2 O+C H 2=C H 2
Radicales alquenlicos: Cn H 2 n1
De Kelvin a Celsius
ALQUINOS: Cn H 2 n2
De Celsius a Kelvin
Combustin:
Cn H 2 n2+
De Kelvin a Fahrenheit
3 n1
O2 nC O2 +( n1)H 2 O
2
Halogenacin: R
C CR+ X 2 FeC l 3 CHX =CHX + X 2 FeC l 3 CH X 2
De Fahrenheit a Kelvin
Obtencin: C
H 3C HX 2+ 2 KOH CH CH +2 H 2 O+2 KX
;
C
H 2 XC H 2 X +2 KOH CH CH +2 H 2 O+2 KX
Nmero de masa atmica:
Radicales alquinlicos: Cn H 2 n3
A=N+Z
RELACIONES CUANTITATIVAS:
Mltiplos y submltiplos decimales
23
1 mol (tomos) = 6.022x 10 tomos
ALCANOS: Cn H 2 n+2
23
1 mol (molculas) = 6.022x 10
Combustin:
Cn H 2 n+2 +
3 n+1
O2 nC O2 +(n+1) H 2 O
2
Obtencin:
Cn H 2 n + H 2 C n H 2n +2
Cn H 2 n2+ 2 H 2 C n H 2 n+2
Radicales alqulicos: Cn H 2 n+1
ALQUENOS: Cn H 2 n
Combustin:
Cn H 2 n +
3n
O nC O2 +n H 2 O
2 2
Halogenacin: C
H 2=C H 2 + X 2 C H 2 X C H 2 X
molculas
23
1 mol (electrones) = 6.022x 10 electrones
Masa Atmica: MAP=
( m1 x a 1 ) + ( m2 x a 2 ) + ( m 3 x a 3 )
a 1+a 2+a 3+
Composicin porcentual=
atomos del elemento x masa atomicadel elemento
peso formula delcompuesto
Formula molecular Factor =
Peso molecular delcompues
peso formula ( formulaempirica )
ESTEQUIOMETRIA
Masa de reactivo
Porcentaje masa en volumen (%m/v)=
molesde reactivo moles de producto masa de producto
masa soluto (g)
x 100
volumen solucion (mL)
Volumen molar: 22.4 L/mol
En condiciones normales: T= 273.15 K y P= 1
atm
Ecuacin de los gases ideales: PV = nRT ; R=
0.082
L atm
mol K
Porcentaje volumen en volumen (%m/v)=
volumen soluto(mL )
x 100
volumen solucion (mL)
Partes por milln (ppm)=
masa soluto (mg)
volumen solucion (L)
Pureza de los compuestos=
cantidad totalmente pura
x 100
cantidad total de sustancia
Rendimiento de una reaccin=
masa soluto( mg)
masa solucion(kg)
CONCENRACIONES DE LAS
SOLUCIONES EN UNIDADES
QUIMICAS
R . real
x 100
R . terico
PRESENTACION FISICA DE LA MATERIA
Molaridad (M)
Ley de Boyle: P1V1 = P2V2
M=
Moles de soluto
L solucin
V 1 V2
=
T1 T 2
M=
%m/n d 10
masa
Ley de Charles:
Ley de Gay Lussac:
P1 P2
=
T1 T2
Ley combinada de los gases=
V 1P1 V 2P2
=
T1
T2
Gas Ideal: PV = nRT; PV =
Normalidad:
Molalidad
m
M RT donde
m= masa del gas(g) y M es la masa molar del
L atm
gas(g/mol). R= 0.082 mol K
CONCENTRACION DE LAS
SOLUCIONES EN UNIDADES FISICAS
Porcentaje masa en masa (%m/m)=
masa soluto (g)
x 100
masa solucion( g)
N=
m=
eqg soluto
vvolumen solucin
moles de soluto
kg de solvente
Fraccin Molar
Xsto=
moles de soluto
moles de soluto+ moles de solvente
Xste=
moles de solvente
moles de soluto +moles de solvente
X soluto+ X solvente= 1
Das könnte Ihnen auch gefallen
- Sensor de Temperatura PT100Dokument9 SeitenSensor de Temperatura PT100Cristian SeNoch keine Bewertungen
- LM35Dokument11 SeitenLM35Cristian SeNoch keine Bewertungen
- Ejemplos MatlabDokument6 SeitenEjemplos MatlabCristian SeNoch keine Bewertungen
- Proceso de AlquilaciónDokument12 SeitenProceso de AlquilaciónCristian SeNoch keine Bewertungen
- Traduccion Reactores EsféricosDokument1 SeiteTraduccion Reactores EsféricosCristian SeNoch keine Bewertungen
- Reseña Histórica de Control AutomáticoDokument3 SeitenReseña Histórica de Control AutomáticoCristian SeNoch keine Bewertungen
- Simulación HYsysDokument3 SeitenSimulación HYsysCristian SeNoch keine Bewertungen
- Practica de Electronica N1-ESPELDokument6 SeitenPractica de Electronica N1-ESPELCristian SeNoch keine Bewertungen
- Algoritmos GenèticosDokument22 SeitenAlgoritmos GenèticosCristian SeNoch keine Bewertungen
- Reglas de Juego AndeanDokument17 SeitenReglas de Juego AndeanCristian SeNoch keine Bewertungen
- TAREA1P3TC2Dokument20 SeitenTAREA1P3TC2Cristian SeNoch keine Bewertungen
- Ejercicios TermoDokument6 SeitenEjercicios TermoCristian Se100% (1)
- Tema 8 - 2 GuionDokument8 SeitenTema 8 - 2 GuiondaniNoch keine Bewertungen
- Taller Quimica MasaDokument3 SeitenTaller Quimica MasaCarolina Ochoa Castro100% (1)
- Serie N°3: Equilibrio de Fases CondensadasDokument3 SeitenSerie N°3: Equilibrio de Fases CondensadasValeska La GloriosaNoch keine Bewertungen
- Industria de Geles - Expo FisicoquimicaDokument31 SeitenIndustria de Geles - Expo FisicoquimicaAny PardoNoch keine Bewertungen
- TematicaexamenDokument16 SeitenTematicaexamenAnibal MembreñoNoch keine Bewertungen
- Organización de La MateriaDokument5 SeitenOrganización de La MateriaMarVynLPacayNoch keine Bewertungen
- 2 - Configuración ElectrónicaDokument5 Seiten2 - Configuración Electrónicanoechura 2do.ANoch keine Bewertungen
- Ley de Dalton LabDokument7 SeitenLey de Dalton LabJuan David ParedesNoch keine Bewertungen
- Maquina de Vapor CaseraDokument12 SeitenMaquina de Vapor CaseraTonantzin GutierrezNoch keine Bewertungen
- Monografía Del AguaDokument19 SeitenMonografía Del Aguaoaaaaaa.12Noch keine Bewertungen
- 200216335-Prelab NoDokument18 Seiten200216335-Prelab Noapi-576334472Noch keine Bewertungen
- Guía FII3 Era EvDokument15 SeitenGuía FII3 Era EvMartínez Zamora Luisa FernandaNoch keine Bewertungen
- Guia 21 - Circuitos de Corrriente ContinuaDokument17 SeitenGuia 21 - Circuitos de Corrriente ContinuaAndres Rodriguez0% (1)
- ESTUDIACIÓNDokument6 SeitenESTUDIACIÓNLeonela Espinoza QuintoNoch keine Bewertungen
- TEMA 3 (1) La Diversidad de La Materia.Dokument1 SeiteTEMA 3 (1) La Diversidad de La Materia.LibertoxNoch keine Bewertungen
- INFORME OBTENCION DEL METANO. Grupo 6Dokument4 SeitenINFORME OBTENCION DEL METANO. Grupo 6Liseth CaballeroNoch keine Bewertungen
- Ficha Tecnica Limpiador Liquido Multiusos D Yilop-2018Dokument2 SeitenFicha Tecnica Limpiador Liquido Multiusos D Yilop-2018DISTRITODO Y MAS MG SAS67% (3)
- Calculo de Los Parametros de Combustion en SitioDokument2 SeitenCalculo de Los Parametros de Combustion en SitioRichardy Gonzalez100% (1)
- Cuestionario de Enlace QuÍmicoDokument4 SeitenCuestionario de Enlace QuÍmicoHerrera Hernandez Erick100% (1)
- Tomo II Cap 2 EndulzamientoDokument62 SeitenTomo II Cap 2 EndulzamientoedwinNoch keine Bewertungen
- DESTILACIÓNDokument7 SeitenDESTILACIÓNSandra Rayo GómezNoch keine Bewertungen
- La Importancia de La Electroquimica, Todo Lo Que Debes SaberDokument3 SeitenLa Importancia de La Electroquimica, Todo Lo Que Debes SaberFRANDY JOEL BOZA PAITANNoch keine Bewertungen
- Taller Semana 6Dokument2 SeitenTaller Semana 6Pedro VelasquezNoch keine Bewertungen
- Informe DesorciónDokument27 SeitenInforme DesorciónChristopher ChuquínNoch keine Bewertungen
- PH Extracciones 3 PDFDokument4 SeitenPH Extracciones 3 PDFDarla SanchezNoch keine Bewertungen
- Naturaleza de LuzDokument32 SeitenNaturaleza de LuzjhuleisyNoch keine Bewertungen
- Adsorción de Líquidos en SólidosDokument15 SeitenAdsorción de Líquidos en Sólidosluisedo -Noch keine Bewertungen
- Folleto de OPTICADokument8 SeitenFolleto de OPTICAarsavaloNoch keine Bewertungen
- Evaporacion HidrologiaDokument7 SeitenEvaporacion HidrologiaRoberth VillafuerteNoch keine Bewertungen