Beruflich Dokumente
Kultur Dokumente
Lista de Exercícios 1
Hochgeladen von
kellegcruzCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Lista de Exercícios 1
Hochgeladen von
kellegcruzCopyright:
Verfügbare Formate
LISTA DE EXERCCIOS 1 - QUMICA ANALTICA
1. GENERALIDADES
Reaes reversveis: podem ocorrer nos dois sentidos;
da esquerda para a direita (sentido 1, direta) e da direita
para a esquerda (sentido 2, inversa).
N2 O 4
1
( g)
2 NO
reao inversa ( v 2 ); v 1 v 2 .
Muita ateno para :
Quando existe o equilbrio ( v 1 v 2 ), as concentraes
das substncias presentes ficam constantes.
No equilbrio h uma dinmica: as duas reaes
continuam ocorrendo, na mesma velocidade.
Para cada equilbrio qumico h uma relao matemtica
de concentraes, chamada constante de equilbrio K.
A constante K igual razo k 1 / k 2 , onde k 1 e k 2
so as constantes de velocidade das reaes direta e
inversa, respectivamente.
Exerccio 01.
Considere o equilbrio qumico gasoso representado
por
numa
temperatura
t(
2 NO
2
o
).
II.
HF
CaO
(s)
+ H2 O
( aq )
III. PC5
( g)
Equilbrio qumico: reaes reversveis onde a
velocidade da reao direta ( v 1 ) igual a velocidade da
( g)
CaCO 3
I.
(s)
+ CO 2
H3 O
( )
( g)
( aq )
+F
( aq )
N2 O 4
Dados os equilbrios descritos abaixo indicar aquele
que inico e heterogneo:
PC3
( g)
IV. AgC
Ag
(s)
+ C 2
( g)
+ C
( aq )
( g)
( aq )
Nos equilbrios qumicos moleculares somente as
substncias gasosas (ou dissolvidas, no caso de solues
aquosas) aparecem na expresso matemtica que fornece
K.
Exerccio 04.
Escrever a expresso matemtica de K para os
equilbrios
I.
PC5
II. CaCO 3
III. H2 O
PC3
( g)
( v)
+C
+ C 2
( g)
CaO
(s)
(s)
(s)
( g)
+ CO 2
CO
( g)
( g)
+ H2
( g)
3. AS CONSTANTES K c E K p : A primeira refere-se s
concentraes molares [
]. A segunda, usada apenas
para reaes gasosas, refere-se s presses parciais dos
componentes.
K p K c (RT ) n( g )
( g)
Nessa
temperatura,
Exerccio 05.
v 1 k 1 [N 2 O 4 ] e v 2 k 2 [NO 2 ] .
2
Escrever
as
expresses
para
Kp
relacionadas ao equilbrio qumico N2 O 4
Pede-se:
(a) O equilbrio acima homogneo ou heterogneo?
___________
(b) Sabendo que a constante de equilbrio dada por
K k 1 / k 2 , qual a relao matemtica entre K e as
NO 2
e
( g)
Kc
2
( g)
concentraes do N2 O 4 e do NO 2 ?
Resp.
Exerccio 06.
Exerccio 02.
Considere o equilbrio qumico gasoso, genrico, dado
Em qual situao K p = K c ?
Resp.
por
x A ( g) + y B
( g)
zC
( g)
+wD
( g)
Escrever a equao matemtica para a constante de
equilbrio K.
4. ASPECTOS QUANTITATIVOS DE K c (E K p ).
2. EQUILBRIOS QUMICOS MOLECULARES E INICOS: nos
ltimos participam ons.
Exerccio 03.
Ao multiplicar a equao qumica por n ( n 0 ) a
constante ficar igual a
Exerccio 09.
Kn .
Numa temperatura t(
SO 2
( g)
1
O2
2
(a) 1 molar
(d) 8 molar
) o equilbrio descrita por
SO 3
( g)
( g)
+ O2
( g)
Em dada temperatura, K c 10 para o equilbrio
2 SO 3
( g)
(c) 4 molar
Exerccio 13.
tem constante de equilbrio K a .
Qual a constante de equilbrio dado por
2 SO 2
(b) 2 molar
(e) 16 molar
( g)
Resp.
(s)
+ CO
2 CO
( g)
( g)
Nessas condies, correto escrever que
2
(a) [CO] 10 [CO 2 ] (b) [2 CO] 10 [CO 2 ]
(c) [CO]
Ao somar duas ou mais equaes qumicas de equilbrio
acha-se uma nova equao qumica do equilbrio cuja
constante dada pelo produto das constantes iniciais.
10 [CO 2 ] (d) [CO] [CO 2 ] 10
Exerccio 14.
Para a reao representada abaixo
Exerccio 10.
2 O3
Sejam os equilbrios
I.
2 A ( g) + B
II. C
( g)
( g)
+B
( g)
( g)
K2 b
( g)
( g)
p (3O
p (2O
(c) p( O
p( O
(a)
qual a constante de equilbrio para
2 A ( g) + 2 B
( g)
a constante K p dada por
K1 a
( g)
3 O2
( g)
(b)
p(2O
p(3O
(d) p( O
p( O
Exerccio 15.
Resp.
A reao entre cido actico e etanol forma equilbrio
qumico com acetato de etila e gua, de acordo com
cido + lcool
Exerccio 11.
A 25 o C , encontraram-se as seguintes concentraes
molares no equilbrio:
[cido]=0,34
[ster]=0,66
[lcool]=0,34
[ H2 O ]=0,66
Para o equilbrio
NH 3
1
N2
2
( g)
( g)
+3 H
2
( g)
Qual a constante K c dessa esterificao?
Resp.
numa certa temperatura, sabe-se que K c x .
Qual o valor da constante de equilbrio para
N2
( g)
+3 H
2 NH
( g)
( g)
ster + gua
?
Exerccio 16.
Resp.
No equilbrio
2
NO
( g)
N2
( g)
+ O2
( g)
5. PROBLEMAS NUMRICOS SIMPLES
em determinada temperatura, sabe-se que:
Exerccio 12.
[ NO ]=0,2 mol/ ; [ N2 ]=[ O 2 ]=0,02 mol/
Para o equilbrio
C 2
( g)
2 C
( g)
Quando no equilbrio, a concentrao de C
igual a 20 mol/ , a do C 2
( g)
Qual o valor de K c para a reao? E K p ?
Resp.
K c 50
( g)
for
ser igual a
6. O PRINCPIO DA FUGA ANTE A FORA, DE LE
CHATELIER: quando um equilbrio qumico sofre alguma
perturbao provocada por agente externo (variao da
presso total, variao da temperatura, adio ou remoo
de algum componente, etc.) ele se desloca para um dos
lados, assumindo uma nova posio de equilbrio.
6.1 EFEITO DA TEMPERATURA (SOB PRESSO CONSTANTE):
o aumento de t favorece a reao com H >0; a
diminuio de t favorece a reao com H <0.
Exerccio 19.
Exerccio 23.
O que ocorre com a constante de equilbrio K p (ou
K c ) na perturbao provocada sobre o equilbrio qumico
mencionado no exerccio anterior?
Resp.
Exerccio 24.
Para a reao representada por
N2
( g)
+3 H
Considere o equilbrio
2 NH
( g)
N2
( g)
sabe-se que H =-22 kcal/mol, a 25 o C e 1 atm.
O que ocorre com as concentraes das substncias
se, nessa presso, a temperatura aumentada?
Resp.
no qual
+3 H
( g)
2 NH
( g)
( g)
H =-22 kcal/mol, a 25 o C . Desejando-se
aumentar o rendimento em NH3 deve-se
(a) aumentar P e diminuir T.
(b) aumentar P e aumentar T.
(c) diminuir P e diminuir T.
(d) diminuir P e aumentar T.
Exerccio 20.
Em relao ao problema anterior, a constante K c do
equilbrio, aumenta, diminui ou no se altera quando a
temperatura passa de 25 o C para 100 o C ?
Resp.
6.3 Efeito da Adio ou da Remoo de Alguns dos
Componentes: a adio de um componente favorece a
reao que consome uma parte do mesmo; a remoo de
um componente favorece a reao que produz uma parte
do mesmo.
Exerccio 25.
Explicar o que ocorre, sob P e T constantes, quando se
adiciona um pouco de C 2 ( g ) ao equilbrio dado por
6.2
EFEITO
CONSTANTE):
DA
PRESSO
TOTAL
(SOB
TEMPERATURA
PC3
o aumento de P favorece a reao com diminuio de V
(diminuio do nmero de mols de gs). A diminuio de
P tem efeito contrrio.
( g)
+ C
2 ( g)
PC5
( g)
Resp.
Exerccio 21.
Para qual reao abaixo, sob T constante, a variao
de P no provoca deslocamento da posio de equilbrio?
(a) N2
+3 H2
( g)
(b) N2 O 4
( g)
(c) H 2
+ I2
( g)
2 NH 3
( g)
2 NO 2
( g)
Exerccio 26.
Considere o grfico a seguir
( g)
( g)
2 HI
( g)
[Cl 2]
[PCl 3]=[Cl 2]
Exerccio 22.
[PCl 3]
Explicar o que ocorre com as quantidades das
substncias PC5 ( g ) , PC3 ( g)
e C 2 ( g )
quando, sob temperatura constante, a presso total sobre
o equilbrio
PC5
aumentada?
Resp.
( g)
PC3
( g)
+ C
[PCl 5]
[PCl 5]
t1
t2
t3
t4
2 ( g)
(a) A reao de equilbrio foi iniciada com PC5
PC3 e C 2 ? ____________________
ou
(b) O equilbrio qumico foi alcanado no instante
_________
(c) Houve uma perturbao no equilbrio no instante
______ provocada pela adio de ______
(d) Um novo equilbrio foi alcanado no instante _______
(e) Comparando as novas concentraes dos
componentes com aquelas antes da perturbao pode-se
constatar que [ PC5 ] aumentou ou diminuiu? [ PC3 ]?
[ C 2 ]?
(f) A constante de equilbrio foi alterada? _______. Por
que?
_______________________________________________
_
Das könnte Ihnen auch gefallen
- Trabalho FinalDokument2 SeitenTrabalho FinalkellegcruzNoch keine Bewertungen
- Lista de Exercicios 1 - BioquimicaDokument1 SeiteLista de Exercicios 1 - BioquimicakellegcruzNoch keine Bewertungen
- Prova Psiquiatria ConcursoDokument2 SeitenProva Psiquiatria ConcursokellegcruzNoch keine Bewertungen
- ARTICULAÇÃODokument15 SeitenARTICULAÇÃOkellegcruzNoch keine Bewertungen
- Lista de Exercicios 1 - BioquimicaDokument1 SeiteLista de Exercicios 1 - BioquimicakellegcruzNoch keine Bewertungen
- Lista de Exercicios 1 - BioquimicaDokument24 SeitenLista de Exercicios 1 - BioquimicakellegcruzNoch keine Bewertungen
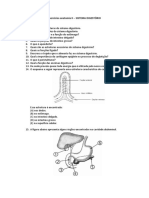
- Atividade Anatomia - Sistema DigestórioDokument2 SeitenAtividade Anatomia - Sistema DigestóriokellegcruzNoch keine Bewertungen
- Prática 1 - Efeito Da Temperatura No Equilibrio QuímicoDokument3 SeitenPrática 1 - Efeito Da Temperatura No Equilibrio QuímicokellegcruzNoch keine Bewertungen
- 1 Lista de Exercicios NutriçãoDokument2 Seiten1 Lista de Exercicios NutriçãokellegcruzNoch keine Bewertungen
- Subs AnatoDokument13 SeitenSubs AnatokellegcruzNoch keine Bewertungen
- Lista de Exercicios 1Dokument2 SeitenLista de Exercicios 1kellegcruzNoch keine Bewertungen
- Unidade 2.1 - Leite e DerivadosDokument42 SeitenUnidade 2.1 - Leite e DerivadoskellegcruzNoch keine Bewertungen
- 1 Exercícios Operações UnitáriasDokument2 Seiten1 Exercícios Operações UnitáriaskellegcruzNoch keine Bewertungen
- Microbiologia - Aula 5 - BiossegurançaDokument4 SeitenMicrobiologia - Aula 5 - BiossegurançakellegcruzNoch keine Bewertungen
- Plano EnsinoDokument2 SeitenPlano EnsinokellegcruzNoch keine Bewertungen
- 02 Teoria Eq. Bernoulli 2003Dokument19 Seiten02 Teoria Eq. Bernoulli 2003Sérgio Filipe MadeiraNoch keine Bewertungen
- XXVIERSBQ Resumo Final1Dokument1 SeiteXXVIERSBQ Resumo Final1kellegcruzNoch keine Bewertungen
- 1 Lista de Exercicios Nutrição PDFDokument2 Seiten1 Lista de Exercicios Nutrição PDFkellegcruzNoch keine Bewertungen
- Lista de Exercícios GravimetriaDokument2 SeitenLista de Exercícios GravimetriakellegcruzNoch keine Bewertungen
- BIOF 06 FluidosDokument28 SeitenBIOF 06 FluidoskellegcruzNoch keine Bewertungen
- Anexo I - Formulario de Solicao de Aula Pratica - Unec (3p)Dokument1 SeiteAnexo I - Formulario de Solicao de Aula Pratica - Unec (3p)kellegcruzNoch keine Bewertungen
- Determinação de CloretosDokument3 SeitenDeterminação de CloretoskellegcruzNoch keine Bewertungen
- Datas Das Provas SubstitutivasDokument2 SeitenDatas Das Provas SubstitutivaskellegcruzNoch keine Bewertungen
- Lista de ExercicioDokument1 SeiteLista de ExerciciokellegcruzNoch keine Bewertungen
- Química Inorgânica I TiagoDokument3 SeitenQuímica Inorgânica I TiagokellegcruzNoch keine Bewertungen
- Lista de ExercicioDokument1 SeiteLista de ExerciciokellegcruzNoch keine Bewertungen
- Capacitação de Recursos Humanos para Atender Ao Pré-Sal: Tendências E PerspectivasDokument16 SeitenCapacitação de Recursos Humanos para Atender Ao Pré-Sal: Tendências E PerspectivaskellegcruzNoch keine Bewertungen
- Fabricação de Produtos Químicos InorgânicosDokument1 SeiteFabricação de Produtos Químicos InorgânicoskellegcruzNoch keine Bewertungen
- Noções de Geologia Aplicada A EngenhariaDokument43 SeitenNoções de Geologia Aplicada A EngenhariaAngelica_RCunhaNoch keine Bewertungen
- Termodinâmica 2Dokument4 SeitenTermodinâmica 2Danilo HenriqueNoch keine Bewertungen
- Inox 410DDokument2 SeitenInox 410DTiago Nascimento0% (1)
- Car Bur AdoresDokument83 SeitenCar Bur AdoresjuanNoch keine Bewertungen
- Potência ElétricaDokument31 SeitenPotência Elétricabruno lima100% (1)
- Check List Pos Manutencao 1Dokument12 SeitenCheck List Pos Manutencao 1fnahas_bh100% (2)
- APR de HospitalDokument3 SeitenAPR de HospitalIvani LopesNoch keine Bewertungen
- Manaual de Ligação Bobina de IgniçãoDokument2 SeitenManaual de Ligação Bobina de IgniçãoHélio Mandeco100% (1)
- Relatório - Determinação Da Atividade Da Peroxidase - Bioquímica de AlimentosDokument5 SeitenRelatório - Determinação Da Atividade Da Peroxidase - Bioquímica de Alimentosrpv12Noch keine Bewertungen
- GamagrafiaDokument81 SeitenGamagrafiaBruniNoch keine Bewertungen
- Terceiro Setimo Dos Três Cavaleiros Da LuzDokument11 SeitenTerceiro Setimo Dos Três Cavaleiros Da LuzWilliam SantosNoch keine Bewertungen
- Treinamento Mycom - CópiaDokument29 SeitenTreinamento Mycom - CópiaEzsilvasilva Silva50% (4)
- Obtenção Do OxigênioDokument4 SeitenObtenção Do OxigênioAndre MatsumotoNoch keine Bewertungen
- Visão Da Medicina Espiritual e Da Medicina Chinesa em Relação Aos Fluidos (CELD) PDFDokument9 SeitenVisão Da Medicina Espiritual e Da Medicina Chinesa em Relação Aos Fluidos (CELD) PDFEdio PintoNoch keine Bewertungen
- Manual Kirby Portugues PDFDokument68 SeitenManual Kirby Portugues PDFTinho MarNoch keine Bewertungen
- Provas UFRJ 1997 Dia1Dokument22 SeitenProvas UFRJ 1997 Dia1shooter_tiranellaNoch keine Bewertungen
- Centrais Equipadas Com Turbinas A Gás. O Ciclo de BraytonDokument23 SeitenCentrais Equipadas Com Turbinas A Gás. O Ciclo de BraytonjotageaNoch keine Bewertungen
- Manutenção Elétrica Predial e IndustrialDokument89 SeitenManutenção Elétrica Predial e IndustrialJOSÉ JAIRO SILVANoch keine Bewertungen
- Apostila de Carga Térmica para Conforto - SacvaDokument26 SeitenApostila de Carga Térmica para Conforto - Sacvanarrima carneiroNoch keine Bewertungen
- Oleo Combustivel Tipo A2 PDFDokument6 SeitenOleo Combustivel Tipo A2 PDFDalisonLageNoch keine Bewertungen
- Programador Riego electrovalvulas8100EZIndoor2010FINAL PDFDokument2 SeitenProgramador Riego electrovalvulas8100EZIndoor2010FINAL PDFtiriclon0% (2)
- A Corrida de Massa No Córrego Guarda-Mão PDFDokument10 SeitenA Corrida de Massa No Córrego Guarda-Mão PDFCarolina FrancoNoch keine Bewertungen
- Manual CardioLight REV017Dokument52 SeitenManual CardioLight REV017Joab Plessim de Abreu100% (1)
- ET-0660.00-5510-762-PPT-030 - E. T. Cabo OpticoDokument19 SeitenET-0660.00-5510-762-PPT-030 - E. T. Cabo OpticoCarlosFerreiraNoch keine Bewertungen
- Aco Inox Segunda ParteDokument11 SeitenAco Inox Segunda ParteFabio OkamotoNoch keine Bewertungen
- TesteDokument4 SeitenTesteMARIA ISABELA ALVES DO NASCIMENTO CAMPOSNoch keine Bewertungen
- TESTE de GEOGRAFIA 8º ANO Agricultura e EnergiaDokument7 SeitenTESTE de GEOGRAFIA 8º ANO Agricultura e EnergiaCarla Carvalho50% (4)
- TCC - CanaDokument20 SeitenTCC - Canaelzhy.marinhoNoch keine Bewertungen
- Os 8 Remédios de DeusDokument7 SeitenOs 8 Remédios de DeusJefferson James Dos SantosNoch keine Bewertungen
- DT 11 TransformadoresDokument218 SeitenDT 11 TransformadoresAdriano Mazotti100% (3)
- Ficha de Avaliação JAN - 4º Ano PORT IDokument8 SeitenFicha de Avaliação JAN - 4º Ano PORT ICidalia Silva76% (17)