Beruflich Dokumente
Kultur Dokumente
Manual de Toma de Muestra Parasitologica - 2016
Hochgeladen von
ChristianGallegosPalermoCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Manual de Toma de Muestra Parasitologica - 2016
Hochgeladen von
ChristianGallegosPalermoCopyright:
Verfügbare Formate
MANUAL DE
PROCEDIMIENTOS PARA
TOMA DE MUESTRA Y
TCNICAS
PARASITOLGICAS.
CHRISTIAN GALLEGOS PALERMO
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Ao de la Consolidacin del Mar de Grau
UNIVERSIDAD ALAS PERUANAS
FILIAL HUANCAYO
TEMA:
MANUAL DE PROCEDIMIENTOS PARA TOMA DE
MUESTRAS Y TCNICAS PARASITOLGICAS.
INTEGRANTES:
GALLEGOS PALERMO, CHRISTIAN.
CARRERA: TECNOLOGIA MEDICA.
CICLO: V CICLO.
CURSO: PARASITOLOGA.
DOCENTE: Lic. T M. Csar Manuel Snchez Alpaca.
PER - 2016
Christian Gallegos Palermo
[1]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[2]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
INTRODUCCIN
La ciencia de la parasitologa tuvo un gran avance a partir del invento del microscopio
y de los descubrimientos de Leeuwenhoek en el siglo XVIII.
La parasitologa es la rama de las ciencias biolgicas que se encarga del estudio de los
parsitos en todos sus aspectos.
Las enfermedades parasitarias han producido a travs de los tiempos ms muertes y
dao econmico a la humanidad que todas las guerras. Generalmente en los pases con poco
desarrollo socioeconmico, las enfermedades causadas por los parsitos se presentan con mayor
frecuencia, esto se favorece por las condiciones climticas y por la falta de medidas higinicas
en los habitantes.
El impacto de las enfermedades parasitarias en el mundo es muy importante, ya que
afectan directamente la salud, la esperanza de vida, y la productividad de millones de personas
y animales.
La prevalencia de las parasitosis est estrechamente vinculada a diferentes fenmenos
climticos, fenmenos demogrficos y al desarrollo socioeconmico de las diferentes zonas del
planeta. No es de extraar que los protozoos y helmintos patgenos sean parte de la vida
cotidiana en los trpicos, sin ser privativos de ellos.
La parasitologa hoy por hoy representa una disciplina de vital importancia en el campo
de accin, el conocimiento de las etiologas de las enfermedades parasitarias marca la pauta
para el desarrollo de nuevas tcnicas de diagnstico y por ende de nuevos tratamientos. A pesar
de los grandes avances en el campo de diagnstico parasitolgico, que incluyen desde tcnicas
inmunolgicas hasta tcnicas endoscpicas, es vital el conocimiento de los aspectos bsicos,
tanto de los parsitos que pueden ser causa de alguna enfermedad para el ser humano, como de
las tcnicas de uso ms comn en el laboratorio de parasitologa encaminadas al diagnstico
clnico.
Los parsitos pueden ser detectados al examinar muestras fecales, orina, sangre,
raspados de piel, diferentes exudados con las diferentes tcnicas, como son: frotis directo,
sedimentacin, flotacin y ELISA, etc.
Con el presente manual se pretende agilizar el desarrollo de las prcticas de la asignatura
de Parasitologa, de una manera que se optimice el tiempo y el aprendizaje. En el presente se
analizan las tcnicas parasitolgicas ms comnmente utilizadas y por ltimo se anexa un
apndice actualizado de los reactivos de uso ms comn en el laboratorio de parasitologa.
Christian Gallegos Palermo
[3]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
HECES
Materia fecal o excremento y/o deposiciones.
Son el conjunto de los desperdicios generalmente slidos (o, casi siempre por algn
padecimiento, a veces tambin lquidos) que genera todo ser viviente como producto final
del proceso de la digestin. Las heces son los restos de los alimentos no absorbidos por el
tubo digestivo (como fibras y otros componentes que no son tiles para el ser en cuestin),
y tambin clulas del epitelio intestinal que se descaman en el proceso de absorcin de
nutrientes, microorganismos, y otras sustancias que no logran atravesar el epitelio intestinal.
CARACTERISTICAS DE LAS HECES
PESO MEDIO POR DIA
250 ( 100-400)
PESO HECES DESECADAS
65
gr.
gr
pH
7-7,5
AGUA
75%
SODIO
35
mEq/l
POTASIO
75
mEq/l
CLORO
73
mEq/l
CALCIO
70-600
mg/24 h
UROBILINGENO
40-280
mg/24 h
ESTERCOBILINA
hasta 250
mg/ dia
NITROGENO FECAL
GRASA FECAL MEDIA
COPROPORFIRINAS
Christian Gallegos Palermo
peso total
<2
gr/dia
gr/dia
100-400
g/24 h
[4]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
ANLISIS COPROLGICO FUNCIONAL
Se estudian las distintas caractersticas de la materia fecal con fines diagnsticos.
ASPECTO MACROSCPICO
a) CONSISTENCIA: Va a depender principalmente de la ingesta de agua, tipo de
alimentacin y del o los procesos patolgicos que puedan estar ocurriendo.
En el recin nacido deposiciones muy lquidas o con mucosidades sugieren una
irritacin del tracto digestivo.
En las diarreas la consistencia es lquida, en cantidad abundante cuando se deben a
patologa intestino delgado y escaso y mucosas si proceden del intestino grueso.
Las deposiciones semiblandas indican un trnsito rpido por el intestino delgado o son
propias de las afecciones pancreticas o biliares.
En el estreimiento son duras, en forma de grandes bolos en la atona, y acintadas en las
obstrucciones mecnicas.
Las deposiciones caprinas son propias de los estados espsticos acentuados.
Mucosas, mucosas sanguinolentas, pastosas, formes, duras, caprinas, grumosas.
Normalmente las heces deben ser cilndricas y con buena consistencia (bien formadas)
para que al ser excretadas mantengan esta forma.
ste parmetro nos puede orientar incluso a la fase en la cual podemos observar a los
protozoarios; si es la fase vegetativa o trofozoto, por lo general los encontramos en
heces lquidas., semilquidas o blandas, mientras que los quistes en heces duras,
pastosas, blandas y rara vez en heces lquidas o semilquidas. Los helmintos, larvas,
huevos, progltides podemos encontrarlos en cualquier tipo de muestra.
ESCALA DE HECES DE BRISTOL
Es una tabla visual de uso en Medicina, destinada a clasificar la forma de las heces
humanas en siete grupos. Fue desarrollada por Heaton y Lewis en la Universidad de Bristol y
se public por primera vez en el Diario escandinavo de gastroenterologa en 1997. La forma de
las heces depende del tiempo que pasan en el colon.
Tipo 1: Trozos duros separados, como nueces, que pasan con dificultad.
Tipo 2: Como una salchicha compuesta de fragmentos.
Tipo 3: Con forma de morcilla con grietas en la superficie.
Christian Gallegos Palermo
[5]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Tipo 4: Como una salchicha; o serpiente, lisa y suave.
Tipo 5: Trozos de masa pastosa con bordes definidos, que son defecados fcilmente.
Tipo 6: Fragmentos blandos y esponjosos con bordes irregulares y consistencia pastosa.
Tipo 7: Acuosa, sin pedazos slidos, totalmente lquida.
Los tipos 1 y 2 indican estreimiento; los 3 y 4 son heces ideales, especialmente el 4, ya que
son los ms fciles de defecar; los tipos 5, 6 y 7 tienden hacia diarrea o clera.
b) ASPECTO: Segn el aspecto las heces pueden ser:
HOMOGNEAS: Cuando no hay diferenciacin entre los componentes que constituyen
la muestra. Ejemplo: heces con caractersticas similares.
Christian Gallegos Palermo
[6]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
HETEROGNEAS: La mayora de las heces son heterogneas, en este tipo de muestra
observamos diferenciacin de textura entre los diferentes elementos que componen la
muestra. Ejemplo: heces con semillas, restos crnicos, restos vegetales, fibras, moco etc.
No debe haber fibras de carnes en las heces normales, su presencia puede indicar que hubo
digestin mecnica incompleta, (masticacin inadecuada) o est alterada la digestin
intraluminal, (deficiencia de tripsina o sndrome de mala absorcin) sta se correlaciona
con el contenido de grasa en las heces.
c) COLOR: La primera vez que los recin nacidos vacan su intestino excretan unas
deposiciones negras, espesas y pegajosas, llamadas meconio. El intestino del recin nacido
no se mueve mientras permanece intratero por lo que se produce un acmulo de bilis que,
al oxidarse, dan a las heces este aspecto tan caracterstico. Suelen expulsarlo durante las
primeras 24 horas de vida, gracias a la accin laxante del calostro, lo cual ayuda a eliminar
la bilirrubina y a evitar la ictericia. Al pasar los das, las heces se tornan verdosas y
posteriormente amarillas.
Las heces son de color pardo de diferente intensidad, este color se debe a la presencia de
urobilina y urobilingeno, formados por las bacterias, como resultado de la reduccin de la
bilirrubina vara de acuerdo a la ingestin de alimentos y medicamentos.
Grasas de color claro pueden indicar una alteracin pancretica.
Blanco: Debido a la ingesta (leche, bario, caoln.) o a la ausencia de bilis fundamentalmente.
Negro un exceso de bilis. Presencia de sangre coagulada presente en el aparato digestivo
(Pastosas - melenas). Por medicamentos (carbn, hierro, bismuto).
Amarillento indican que el paciente sufre una infeccin conocida como giardiasis.
Sndrome de Gilbert. Esta enfermedad est condicionada por brotes de ictericia y de
hiperbilirubinemia y ocurre cuando hay un exceso de bilirrubina en la sangre.
Azules o verdes: ciertas enfermedades o consumir ciertos alimentos. O a la biliverdina.
Rojo: remolacha o a la existencia de hemorragias prximas al ano.
Christian Gallegos Palermo
[7]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
d) OLOR: Es causado por ciertos productos aromticos originados en el intestino, mediante
procesos de fermentacin o putrefaccin que actan sobre hidratos de carbono y protenas.
La imposibilidad de estandarizacin de ste parmetro ha permitido excluirlo de los reportes
y en la actualidad un muy alto porcentaje de laboratorios no lo utilizan.
La experiencia en el rea nos permite sugerir ciertas cosas, por ejemplo:
Heces blandas inodoras: diarrea de origen nervioso o deposiciones de nios de pecho.
Heces con sangre y moco, inodoras: Shigellosis.
Olor muy ftido con reaccin alcalina: putrefaccin en la parte izquierda del colon.
Olor cido (agrio o rancio): presencia de azcares reductores, sobre todo si el pH 5,5.
e) PRESENCIA DE MOCO: En una muestra fecal es anormal y debe reportarse. La mucosa
del colon secreta moco como respuesta a un estmulo nervioso (parasimptico).
Su presencia en las heces es propia de los estados inflamatorios (enteritis y colitis), pero
tambin se presenta en los estados espsticos, an sin Inflamacin.
La presencia de mucus es indicio de irritacin compatible con la existencia de un
parasitismo.
Utilizar un aplicador de madera para buscar la presencia de mucus en la muestra.
Al extender la muestra debemos preferir la parte que tenga moco y / o sangre.
REPORTE: (+), (++), (+++).
Christian Gallegos Palermo
[8]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MOCO TRANSPARENTE Y GELATINOSO: Estreimiento, colitis, esfuerzo excesivo
al defecar, alteraciones emocionales.
MOCO CON SANGRE: Neoplasias, inflamacin del conducto anal, amibiasis aguda.
MOCO CON PUS Y SANGRE: Disentera bacilar, cncer de colon, colitis ulcerativa,
tuberculosis intestinal.
ASPECTO QUIMICO
f) pH: De la materia fecal depende de la dieta y de factores endgenos, una alimentacin rica
en protenas determina alcalinidad, mientras que la abundancia de carbohidratos produce
acidez. En otras palabras, el rango de pH Normal es neutral (que es ligeramente alcalino o
cido). El pH aumenta cuando hay degradacin de las protenas, y disminuye en casos de
malabsorcin de grasas y azcares. Los lactantes tienen heces ligeramente cidas, los que
toman leche no materna, poseen un pH neutral o ligeramente alcalino. Anormalmente, la
reaccin es cida en trastornos digestivos con predominio de los procesos de fermentacin
y alcalina en aquellos con predomino de procesos de putrefaccin.
Si las heces no presentan otras caractersticas patolgicas se pueden considerar como
normal, heces ligeramente cidas (pH 6,5). En otras condiciones, todas heces con pH cido
son patolgicas. Un pH 5,5 sugiere presencia de azcares reductores, a excepcin de los
polisacridos que por lo general dan un pH ligeramente cido.
La medicin de esta prueba tiene gran valor en el estudio de las diarreas agudas en nios
menores de 5 aos; en diarreas por bacterias invasivas el pH generalmente es alcalino, en
diarreas de origen toxico es neutro y en las virales siempre es cido. Este parmetro tiene valor,
slo si la muestra es llevada inmediatamente al laboratorio.
Antes de realizar la prueba, se recomienda mezclar bien las heces y realizar la medicin
una vez que la muestra fecal llegue al laboratorio ya que el pH se modifica rpidamente.
EI pH de las heces se mide corrientemente con un simple papel tornasol o con papel
indicador de pH que seala el pH aproximado.
En la lmina portaobjeto se echa una a dos gotas de suero fisiolgico a lo cual se agrega
con la abatalengua unos gramos de heces. Luego se emplea una tira de papel indicador
universal, sobre el cual se aplica una pequea cantidad de materia fecal, se espera unos minutos
y se compara con la escala de colores.
Vara entre 6,8 y 7,2 dependiendo del rgimen alimenticio. Los valores normales se van a
modificar segn el proceso digestivo.
Christian Gallegos Palermo
[9]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
pH cidos indican EDA de tipo viral, malabsorcin de carbohidratos, grasas.
pH alcalinos indican EDA invasivas, degradacin de protenas, colitis, adenoma velloso,
cncer, etc.
g) THEVENON: Para esta prueba el paciente debe abstenerse de ingerir carnes rojas,
chorizos, morcillas, o vegetales con actividad de peroxidasa como por ejemplo los rbanos
etc., durante por lo menos tres das antes del examen. Las muestras seriadas aumentan la
exactitud del examen.
En la prctica utilizamos dos mtodos para determinar sangre oculta.
PRESENCIA DE SANGRE: No es normal encontrar sangre en las heces. En algunas
patologas podemos encontrarla en dos formas: Sangre fresca y Sangre Oculta. La sangre en las
heces puede provenir de cualquier parte del tracto intestinal, desde la boca hasta el ano.
La sangre fresca sugiere que la sangre proviene de la parte inferior del tracto
gastrointestinal (intestino grueso y recto). Estas heces son rojas o de color marrn y a este
proceso se le denomina HEMATOQUECIA.
Causas comunes de sangrado fresco: Hemorroides, fisuras anales, infeccin intestinal,
inflamacin intestinal, diverticulitis, tumor, plipos o cncer de colon, trauma o cuerpo extrao.
Las heces negras suelen indicar que la sangre proviene de la parte superior del tracto
gastrointestinal que abarca el esfago, el estmago o la primera parte del intestino delgado. La
razn es que la sangre al exponerse a los jugos digestivos adquiere un aspecto tpico de alquitrn
(petrleo). A estas heces negras se les denomina MELENA
Causas comunes de sangrado del tracto G.I superior: Ulceras sangrantes en el estmago
o el duodeno. (Abuso de aspirina, naproxeno, etc.).Gastritis, varices esofgicas, trauma o
cuerpo extrao.
Christian Gallegos Palermo
[10]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
(SANGRE OCULTA EN HECES)
3 ml. de agua destilada
1 gr. de heces (maz).
Se aade 3 gotas de cido actico. Al 50%.
Se aade 1 ml de agua oxigenada.
Se aade de 3 a 5 gotas de piramidn.
Se deja en reposo 3 minutos: para leer.
POSITIVO: Color Violceo.
NEGATIVO: Sin reaccin.
HEMOCCULT, OCCULTEST, HEMA-SCREEN
Son Kit comerciales cuyo principio es el mismo que el anterior, pero con la diferencia
de ser ms prcticos. Consiste en un papel de filtro impregnado con una sustancia orgnica
(guayaco, bencidina, ortotoluidina etc) al cual se le aplica una cantidad de la muestra a
examinar y posteriormente por el lado contrario, se le aade una solucin alcohlica de
perxido de hidrgeno (aprox 2 gotas). Cualquier coloracin azul o violeta se considera positiva
y la lectura debe realizarse inmediatamente porque en algunos casos la coloracin tiende a
desaparecer rpidamente.
Si disponemos en el laboratorio de papel de filtro y piramidn, podemos sustituir la
tcnica en tubo de la siguiente manera:
Impregnamos el papel de filtro (puede ser una tira de aprox. 3 cm de largo x 1cm de ancho
o un pedazo circular) con la solucin de piramidn y esperamos que se seque (pueden
guardarse para ser utilizada posteriormente).
Christian Gallegos Palermo
[11]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Aplicamos muestra de un lado del papel de filtro, esperamos que se seque o incluso se puede
esperar hasta el da siguiente.
Por el otro lado del papel de filtro, agregamos 1 o 2 gotas de un revelador preparado de la
siguiente manera: volmenes iguales de alcohol absoluto y agua oxigenada al 3%, en caso
de no contar con este reactivo, podemos agregar 2 gotas de cido actico, esperamos 2
minutos y agregamos 2 gotas de agua oxigenada.
RESULTADO: Cualquier coloracin azul o violeta se considera positiva y la lectura debe
realizarse inmediatamente porque en algunos casos la coloracin tiende a desaparecer
rpidamente.
NO DEBEMOS REALIZAR LA PRUEBA CON LA TIRA REACTIVA PARA ORINA, YA
QUE ESTA ES MUY SENSIBLE Y OBTENDREMOS FALSOS POSITIVOS. (LOS
ENTEROCOCOS SON PEROXIDASAS POSITIVOS)
h) AZUCARES REDUCTORES: Son aquellos carbohidratos capaces de reducir la sales de
cobre. Tienen importancia ya que su determinacin en heces, orienta al mdico al
diagnstico de la patologa que pueda estar ocurriendo en el tubo digestivo. Entre los
azucares reductores tenemos: Glucosa, Lactosa, fructuosa, Galactosa, Maltosa, Pentosa, Los
azucares de importancia desde el punto de vista gastrointestinal son: Polisacridos, almidn,
monosacridos, glucosa, disacridos, lactosa y sacarosa.
Estos carbohidratos se encuentran en materia fecal cuando existen fallas congnitas o
adquiridas de disacaridasas intestinales o de protenas transportadoras de los monosacridos,
enzimas stas producidas en las vellosidades intestinales.
La Sacarosa no es un azcar reductor, y por esta razn el nombre correcto de la prueba
es carbohidratos fecales y no azcares reductores, pero el uso extendido de esta ltima
terminologa ha llevado a sobrentender que debemos incluir la investigacin de este azcar no
reductor en dicha prueba. Las diarreas osmticas se presentan por fermentacin de los
carbohidratos por virus o bacterias sacarolticas intestinales.
El pH fecal depende en parte de la fermentacin de los azcares. La fermentacin en el
colon de una cantidad normal de carbohidratos y de produccin de cidos grasos explica un pH
normal ligeramente acidificado, pH ligeramente alcalinos, se dan en casos de diarreas secretoras
sin ingesta de alimentos, colitis, adenoma velloso, y posiblemente con el uso de antibiticos.
Christian Gallegos Palermo
[12]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Un pH fecal menor de 6.0 es evidencia sugestiva de malabsorcin de azcares, pH fecales bajos
tambin contribuyen a excoriaciones de la piel de la regin perianal (eritema perianal),
frecuentemente acompaadas de diarrea. La determinacin de sustancias reductoras en la
materia fecal es un test ms confiable la deficiencia de disacaridasa. Un pH fecal alto puede ser
un factor de riesgo de cncer colon rectal Los azcares son rpidamente absorbidos por la
porcin superior del intestino delgado. Sin embargo, pueden permanecer en el intestino y causar
diarreas, ocasionadas por la presin osmtica de los azcares no absorbidos en el intestino,
enviando los lquidos y los electrolitos al intestino. La malabsorcin de carbohidratos es una de
las mayores causas de diarrea lquida y de desequilibrio electroltico observado en pacientes
con sndrome de intestino delgado corto. Como resultado de la fermentacin bacteriana, las
heces pueden llegar a ser cidas con una alta concentracin de cido lctico. La medicin del
pH demuestra ste proceso. Los azcares no absorbidos son determinados como sustancias
reductoras. Clsicamente las heces de pacientes con deficiencia de disacaridasa son lquidas,
cidas y de apariencia espumosa.
PROCEDIMIENTO:
La muestra no debe tardar en llegar al laboratorio ms de 20 minutos, ya que las
bacterias desdoblan los azucares, lo primero que se debe hacer, es identificarla correctamente.
La primera condicin para proceder a realizar los AZUCARES REDUCTORES es que
el paciente tenga diarrea, por consiguiente deber de usarse la parte lquida de las evacuaciones,
ya que si se usa slo la parte slida los resultados sern siempre negativos.
Procedemos a preparar una suspensin de heces en agua destilada (aprox 1 gr de heces
+ 3 cc de agua destilada, si las heces estn lquidas aprox 0,5 ml + 3 cc de agua) y centrifugamos
por 5 min a 3000 rpm.
El primer azcar a determinar son los polisacridos (ALMIDN), si estos dan positivos
no se contina con la prueba.
El segundo es la GLUCOSA y por ltimo los disacridos (LACTOSA y SACAROSA)
DETERMINACIN DE POLISACRIDOS (ALMIDN):
En un tubo de ensayo aadimos aprox 2 ml de solucin de Lugol (la misma utilizada
para el examen directo) y aprox 1 gr de heces. Mezclamos y facilitamos al Bioanalista para su
interpretacin.
Christian Gallegos Palermo
[13]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Si extendemos la muestra con la solucin de lugol entre lmina y laminilla, tambin
podemos observar la presencia de POLISACARIDOS.
Tiene mayor sensibilidad la observacin microscpica, por lo tanto es conveniente que
una alcuota de la prueba en tubo se coloque entre porta y cubreobjeto.
Falsos Positivos: el empleo de talcos, almidones etc.
DETERMINACIN DE MONOSACRIDOS (Glucosa):
BENEDICT: Esta prueba se trata de una reaccin cualitativa, el cual es una disolucin
alcalina de ion cprico. (Deteccin de glucosa)
5 gotas de Heces (liquido); 1 gramo de heces (pastoso).
2.5 ml. de Benedict.
Hervir aproximadamente 5 min. Moviendo el tubo lentamente.
Dejar en reposo y evaluar en cruces.
o Azul verdoso: vestigio o trazas.
o Amarillo verdoso: (+).
o Amarillo intenso: (++).
o Naranja ladrillo: (+++).
Christian Gallegos Palermo
[14]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
DETERMINACION DE AZUCARES NO REDUCTORES:
En vista de que la SACAROSA no es un azcar reductor procedemos a hidrolizarla para
descomponerla en molculas de glucosa y fructuosa que si son reductores. Y esto lo hacemos
utilizando el test de Anderson de la siguiente manera:
1. En un tubo de ensayo agregamos porcin liquida de la muestra o de la suspensin preparada
(aprox. 1ml o 15 gota)
2. Aadimos 1 o 2 gotas de HCl concentrado y calentamos hasta hervir
3. Procedemos a realizar la prueba por el mtodo de Benedict o Clinitest igual que para la
determinacin de azucares reductores y comparamos el resultado en la escala de colores.
Si vamos a realizar la tcnica por el MTODO DE CLINITEST:
1. Preparamos una suspensin de heces en agua destilada
2. Agregamos 1 pastilla de Clinitest a aprox. 1 ml del sobrenadante (aprox. 15 gotas).
3. Sin mover esperamos que termine la ebullicin y listo para observar.
Falsos positivos: La misma consideracin que para el mtodo de Benedict ya que estas
sustancias reducen las sales de cobre y el fundamento de ambas pruebas es el mismo.
Christian Gallegos Palermo
[15]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
IDENTIFICACIN DEL DISACRIDO
LACTOSA
(Reductor)
(Sin HCL)
(Con HCL)
SACAROSA
(No reductor)
(Sin HCL)
(Con HCL)
RESULTADO DE LOS AZCARES REDUCTORES - ESCALA DE COLORES:
Negativo:
0 gr/dl
trazas
1+:
2++:
3+++:
4++++:
0.25 grdl
0.50 gr/dl
0.75 gr/dl
1 gr/dl
2 gr/dl
Azul
Verde transparente
Verde turbio
Verde-amarillo
Amarillo ladrillo.
Anaranjado
PARMETROS IMPORTANTES PARA LA CLASIFICACION DE LAS DIARREAS
INFLAMATORIAS Y SECRETORAS
PARAMETRO
DIARREA INFLAMATORIA DIARREA SECRETORA
pH
Azcares reductores
Acido o alcalino
Ausentes
Acido
Presentes
Localizacin del agente causal
Mecanismo de accin del agente
Intestino grueso
Invasivo
Intestino delgado
Osmtico
Christian Gallegos Palermo
[16]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
i) TEST DE SUDAM III: Es un colorante soluble en grasa (liposoluble), y al ponerse en
contacto con las mismas las colorea de rojo escarlata.
PRESENCIA DE GRASA: Las molculas de grasa son una importante fuente de energa
para el cuerpo. Los cidos biliares producidos por el hgado disuelven las grasas en el
contenido acuoso intestinal, permitiendo que las enzimas transformen sus grandes
molculas en otras ms pequeas como son los cidos grasos y el colesterol. Los cidos
biliares se unen a estas molculas ms pequeas y las ayudan a pasar al interior de las clulas
de la mucosa, donde vuelven a formar molculas grandes, las cuales llegan a los vasos
linfticos cercanos al intestino, pasan a la sangre y son transportadas hacia los lugares de
depsitos en distintas partes del cuerpo.
El aumento de grasa en las heces fecales se debe a:
Malabsorcin, (espre, rotavirus, giardiasis crnica etc.)
Enteritis y patologa pancretica con ausencia de lipasa (ejemplo: pancreatitis crnica),
extirpacin quirrgica de una parte del intestino.
El exceso de grasa en la materia fecal se denomina Esteatorrea.
Macroscpicamente, la materia fecal con grasa abundante, tiene un aspecto cremoso
brillante. La evacuacin tpica es espumosa, grasosa (brillante), blanda y ftida.
PRUEBA DEL SUDN III:
TCNICA: en lmina portaobjeto se agregan 2 o 3 gotas de la solucin de Sudn III, con un
aplicador colocamos una porcin de muestra, mezclamos y colocamos una laminilla
cubreobjetos. (Si calentamos la preparacin, logramos una mejor coloracin de las gotas de
grasas).
Christian Gallegos Palermo
[17]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
INTERPRETACIN DE LOS RESULTADOS:
En nios y adultos la presencia de 5 gotas o ms por campo microscpico de 40X, se
considera patolgico.
En nios lactantes es positivo con ms de 20 gotas por campo microscpico, esto es debido
a que ellos presentan un menor coeficiente de absorcin de grasas.
Para la determinacin de las grasas fecales debemos tener en cuenta los falsos positivos:
Grasa proveniente de las manos del auxiliar.
Lminas o laminillas, mal lavadas o contaminadas con grasas.
Supositorios o cremas grasosas (vaselina) en el perin.
Ingesta de aceite Castor o aceite mineral.
Ingesta de mayonesa diettica baja en caloras.
Dieta con fibra abundante.
Solucin de contraste radiogrfico.
No es adecuado realizar una sola muestra de materia fecal.
ASPECTO MICROSCOPICO
j) EXAMEN DIRECTO:
PROCEDIMIENTO: Colocar en un extremo de la lmina portaobjeto una gota de
suero fisiolgico y, con ayuda de un aplicador, agregar 1 a 2 mg de materia fecal emulsionarla.
Colocar en el otro extremo de la lmina portaobjeto, una gota de lugol y proceder a la aplicacin
de la muestra fecal como en el prrafo anterior.
OBSERVACIN:
Observar al microscopio a 10X o 40X.
Recorrer la lmina siguiendo un sentido direccional, ejemplo: de derecha a izquierda, o de
arriba a abajo.
Buscar parsitos, leucocitos, hemates, etc.
LEUCOCITOS: Con una abatalengua se hace un extendido delgado en la lmina
portaobjeto, luego se colorea con azul de metileno / wrigth, nos ayuda a diferenciar:
Eosinfilos: Estas clulas, generalmente redondeadas, tienen un dimetro similar al de
los PMNS, y se caracterizan en las tinciones, por la presencia de grandes grnulos rojo
prpura, adems que suelen presentar su ncleo segmentado.
Christian Gallegos Palermo
[18]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Neutrfilos Polimorfonucleares (PMNS): Bacteriana.
No Segmentados: Viral
Mononucleares: Disenteria, infeccin de bacterias.
No se Observan en Diarrea Secundaria: a Parsitos, Toxinas y Virus.
Informar los leucocitos en % tanto PMN y MN.
Negativo: 0 por campo.
Dudoso: 1 a 20 por campo.
Positivo: +20 por campo. (+10 PMN por campo)
POSITIVO: Salmonella, Shiguella, Campylo-bacter, Yersinia, E. Coli, etc.
NEGATIVO: Toxinas (estafilococos, Vibrio cholerae, diarrea por parsitos, virus, colitis
ulcerosa, etc.
HEMATIES: Los glbulos rojos tienen un dimetro de 7,5 m. Su presencia en las heces
puede indicar ulceracin a nivel del tacto intestinal u otro problema hemorrgico. Los
eritrocitos son discos bicncavos y pueden parecer tener un cuerpo central con un margen
perifrico de citoplasma o grnulos por consiguiente.
PIOCITOS: Se presenta en pequeas cantidades en la enteritis y colitis de cualquier
etiologa. Pero la presencia brusca de pus abundante es indicio de la evacuacin a la luz
intestinal de un absceso prximo (perirrectales, prostticos, pioslpinx, etc.).
ALMIDON: La cantidad de grasa detectada puede indicar si la absorcin de nutrientes en
el intestino est alterada, segn sea la concentracin de almidn en las heces. Una gran
cantidad de almidn suele indicar mal funcionamiento del pncreas.
Para su investigacin se aade a la gota de emulsin fecal una gota de lugol. Los grnulos
de almidn tomarn un u otro dependiendo del grado de digestin. Tambin podrn estar
dentro de clulas o aislados:
a) No digeridos: Azul oscuro, casi negro.
b) Parcialmente digeridos: Rojo o rosa.
c) Digeridos: Amarillos o color arenilla.
Christian Gallegos Palermo
[19]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
El tejido muscular, al aadir almidn a la preparacin toma un color rojo-caoba. La
presencia de almidn no digerido en las heces se llama AMILORREA.
CRISTALES:
Indican una excesiva irritabilidad.
Presentan el mismo aspecto que en el sedimento urinario.
Origen alimentario (oxalato de calcio).
Endgeno (Oxalato calcio, fosfato amnico-magnsico).
Hay unos, caractersticos del parasitismo intestinal, llamados cristales de CharcotLeyden, presentando una forma tpica de agujas de brjula.
Medicamentos.
CELULAS EPITELIALES: Mucosa intestinal. Indican una excesiva irritabilidad.
Las clulas epiteliales o clulas escamosas pueden estar presente en las heces.
El tamao de estas clulas son semejantes al de las amebas, la coloracin es verde plido
con apariencia uniforme no granular cuando se les colorea con Trichome-Gomori.
BACTERIAS: Carecen de significacin clnica.
Las bacterias pueden infectar cualquier parte del cuerpo, pero frecuentemente ocasionan
diarrea al invadir el tracto digestivo.
HONGOS LEVADURAS: Clulas ovoides de 4 a 6 m y que pueden encontrarse en
forma de levaduras o hifas.
Son altamente hepatotxicos y lesionan la mucosa gastrointestinal (agravando el problema
de hiperpermeabilidad).
Junto con los hongos, erradican al resto de la flora.
Christian Gallegos Palermo
[20]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICAS COPROPARASITOLOGICAS Y RECOLECCIN
DE PRODUCTOS BIOLGICOS.
RECOLECCION Y CONSERVACION DE MUESTRAS DE MATERIA FECAL.
Una evaluacin normal consta casi exclusivamente de heces, pero cuando hay afeccin
se puede encontrar tambin moco, sangre y cantidades considerables de tejidos desprendidos.
A veces en esas porciones se encuentran datos de infeccin parasitaria en
casos de en qu el examen de heces ha sido negativo. Asimismo puede ser expulsado Ascaris,
Enterobius y progltidos de Taenia y Dipylidium sin la presencia de huevos en la porcin fecal
de la muestra. Por lo tanto, es esencial que el material remitido para examen sea suficiente para
hacer un buen diagnstico. El examen macroscpico de una muestra debe preceder siempre al
estudio microscpico.
Al paciente adulto se le indicar que deber colectar de su defecacin aproximadamente
de 3 - 6 gramos. En un recipiente adecuado para este tipo de muestra, evitando mezclarla con
orina o cualquier otra sustancia. La muestra a recolectar no necesariamente debe ser la primera.
La muestra debe estar libre de gotas de aceite, magnesio, sales de aluminio en polvo,
bario o bismuto.
El tipo de recipiente que se utiliza para estos casos es un frasco de vidrio limpio, seco y
de boca ancha, de 2 onzas (56.7 ml) de capacidad, con tapn de rosca de aluminio o de plstico.
Tambin se puede optar por recipientes de plstico transparentes de la misma capacidad, ya que
presentan la ventaja de ser eliminados e incinerados despus de ser usados, pero nunca se deben
utilizar recipientes opacos ni de material poroso (cartn o papel) ya que tornan difcil el examen
macroscpico de las heces.
Las heces duras, sin seas de gran putrefaccin, pueden a veces dejarse durante la noche
a la temperatura del laboratorio, sin que se pierdan las caractersticas diagnsticas de los
parsitos que pueda haber en ellas; sin embargo, es preferible guardarlas en el refrigerador.
Las heces duras conservadas en refrigeracin pueden durar dos o tres das para ser
analizadas. En refrigeracin a 4 C los huevos de helmintos y los quistes de protozoarios se
conservan durante varios das, incluso semanas para su posterior identificacin.
El caso de las heces lquidas o semilquidas deber examinarse en un plazo no mayor de
una hora y nunca debern refrigerarse, ya que en este tipo de muestras encontramos a las formas
activas de los protozoarios (trofozotos de amibas o flagelados) y uno que otro helminto.
Christian Gallegos Palermo
[21]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Para conservar las muestras por tiempo prolongado, sin que los parsitos contenidos en
ellas se deformen o se destruyan, se podr recurrir a sustancias preservadoras. Para estos
propsitos y con ello el acceso a un buen diagnstico suelen necesitar varias soluciones que
adems de preservadoras tambin actan como colorantes y son:
Solucin de Schaudin.
Menthiolate-yodo-formaldehdo (MYF).
Fenol-alcohol-formaldehido (PAF).
Alcohol polivinlico (PVA).
Solucin de formol al 5 y 10%.
Solucin glicerinada al 5%.
Lactofenol de Amman.
Para la preservacin de las muestras, estas soluciones se adicionan en proporcin de 2 a
3 volmenes por cada uno de materia fecal, procurando lograr una homogeneizacin completa.
Christian Gallegos Palermo
[22]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
EXMENES CUALITATIVOS.
TECNICA MACROSCPICA DIRECTA.
OBJETIVO.
Identificacin de fases adultas de helmintos o segmentos de sus cuerpos, en el caso de
los cestodos, deteccin de nematodos o algunos artrpodos o sus fases larvarias.
FUNDAMENTOS.
Al hacer la dilucin de una gran cantidad de materia fecal y colocarla sobre un fondo
negro, se permitir contrastar el color del cuerpo de los parsitos, y por lo tanto su
identificacin.
MATERIAL Y REACTIVOS.
Charola de fondo oscuro
Vaso de precipitado de 1000 ml
Cuchara
Aguja de diseccin
Caja de Petri
Agua tibia
Etanol al 70%
DESARROLLO.
En el vaso de precipitado colocar la totalidad de la muestra, (se recomienda que sea
materia fecal de 24 hrs.) adicionar agua suficiente y homogeneizar la muestra ayudndose con
una cuchara, se deja sedimentar 15 minutos aproximadamente, se decanta dejando solo el
sedimento, se lava cuantas veces sea necesario hasta que el sobrenadante quede claro. El
sedimento se coloca en una charola, y por la coloracin del parsito contrastara en el fondo de
la charola. Los parsitos o fragmentos encontrados se sacan inmediatamente y se colocan en
cajas de petri para ser fijadas con etanol al 70% (a emisin de vapores). En caso de estar
impregnados de materia fecal, se lavan con solucin salina fisiolgica.
INTERPRETACIN.
Siendo tcnica de tipo cualitativo, slo se reportan los parsitos encontrados y su
diagnstico como positivo o negativo.
Christian Gallegos Palermo
[23]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
VENTAJAS.
Tcnica til para comprobacin de tratamientos antiparasitarios.
Tcnica til para la identificacin y coleccin de progltidos y esclex de Taenia spp. y
adultos de otros helmintos.
DESVENTAJAS.
Observacin slo de tipo macroscpico
Uso limitado por ser una tcnica especial
Nota: Debe tenerse precaucin y trabajar con guantes por que se corre el riesgo de provocar
cisticercosis en el caso de presentar Taenia solium.
TCNICA MICROSCPICA DIRECTA.
OBJETIVO.
Deteccin de trofozotos y quistes de protozoarios as como huevos de helmintos.
FUNDAMENTO.
Se basa en la dilucin de una pequea cantidad de materia fecal en solucin salina
fisiolgica, la cual permite la supervivencia de trofozotos y un colorante que favorece el
contraste de las estructuras parasitarias.
MATERIAL Y EQUIPO.
Porta objetos
Cubre objetos
Aplicadores de madera o palillos
Microscopio compuesto.
REACTIVOS.
Solucin salina fisiolgica
Lugol parasitolgico
DESARROLLO.
En uno de los extremos de un porta objetos se coloca una gota de solucin salina
fisiolgica y en el otro extremo una gota de lugol, con un aplicador de madera se agrega a cada
Christian Gallegos Palermo
[24]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
gota una pequea muestra de heces, se homogeneiza cada preparacin, se retira la mayor
cantidad de materia gruesa posible, se coloca un cubre objetos y se revisa al microscopio a 10X
y 40X.
RESULTADOS.
Siendo tcnica de tipo cualitativo, slo se reportan los parsitos encontrados positivo o
negativo.
Negativo: Informar que no se observan huevos, quistes, trofozotos, ni larvas de parsitos.
Positivo: El informe debe de contener el nombre del paciente, los agentes observados y su
estadio o forma evolutiva: quistes (q), ooquistes (o), trofozotos (t), esporas (e), huevos (h)
o larvas (l).
La intensidad parasitaria puede expresarse cualitativamente o semicuantitativamente.
Cualitativamente: Escaso, Regular, abundante, segn sea el grado de facilidad o dificultad
para ubicarlos.
Semicuantitativamente: contando las formas parasitarias.
Si se observan 1 o 2 elementos en toda la lmina, escribir el nombre del agente y su
estado evolutivo.
(+) si se observan de 2 a 5 elementos por campo microscpico 10X o 40X.
(++) si se observan de 6 a 10 elementos por campo microscpico 10X o 40X.
(+++) si se observan >10 elementos por campo microscpico 10X o 40X.
VENTAJAS.
Rpida de realizar.
Fcil de realizar.
Barata (requiere poco material).
La nica que detecta trofozotos y quistes.
DESVENTAJAS.
En preparaciones muy sucias es difcil la visin.
La cantidad de muestra no es representativa del volumen total.
Christian Gallegos Palermo
[25]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
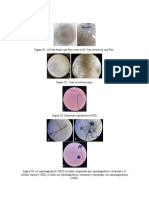
Movilidad
(Trofozotos)
Christian Gallegos Palermo
Tincin
Vacuolas
Ncleos
[26]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MTODOS DE CONCENTRACIN
Los trofozotos, quistes, ooquistes, larvas y huevos, pueden concentrarse por diversos
procedimientos, lo cual permite corroborar el hallazgo del mtodo directo y conocer la
intensidad del enteroparasitismo.
Estos procedimientos de concentracin pueden ser: flotacin, sedimentacin, o por
combinacin de ambos mtodos. La eleccin de cada procedimiento depender de las
facilidades del laboratorio, el adiestramiento del personal, la procedencia de la muestra (zona
geogrfica), el conocimiento de la prevalencia de los parsitos (zona costea, andina y selvtica
o rea rural o urbana), y la especie del parsito que se desea investigar.
MTODOS DE CONCENTRACIN POR SEDIMENTACIN.
TCNICA DE LA SEDIMENTACIN ESPONTNEA EN TUBO (TCNICA DE
CONCENTRACIN POR SEDIMENTACIN, SIN CENTRIFUGACIN):
FUNDAMENTO.
Se basa en la gravidez que presentan todas las formas parasitarias para sedimentar
espontneamente en un medio menos denso y adecuado como la solucin fisiolgica. En este
mtodo es posible la deteccin de quistes, trofozotos de protozoarios, huevos y larvas de
helmintos.
MATERIALES.
Tubos de vidrio o plstico de 13 x 100, 16 x 150, o tubos de 50 mL de capacidad que
terminen en forma cnica.
Lminas portaobjetos.
Laminillas de celofn recortadas adecuadamente (22 x 22 mm 22 x 30 mm.).
Solucin fisiolgica.
Pipetas de vidrio o plstico.
Agua destilada, hervida o de lluvia.
Gasa recortada en piezas de 9 x 9 cm.
Christian Gallegos Palermo
[27]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
PROCEDIMIENTO.
Tomar una porcin de heces (1 - 2 g) y homogeneizar con suero fisiolgico en un tubo
limpio o en el mismo recipiente en que se encuentra la muestra.
Colocar una gasa, hundindola en la abertura del tubo y sujetndola con una liga alrededor
de ella.
Filtrar el homogeneizado a travs de la gasa, llenando el tubo hasta la cuarta parte de su
contenido.
Agregar suero fisiolgico hasta 1 cm por debajo del borde del tubo.
Ocluir la abertura del tubo con una tapa, parafilm o celofn.
Agitar enrgicamente el tubo por 15 segundos aproximadamente.
Dejar en reposo de 30 a 45 minutos. En caso que el sobrenadante est muy turbio, eliminarlo
y repetir la misma operacin con solucin fisiolgica o agua filtrada.
Aspirar la parte media del tubo con una pipeta y colocar 1 2 gotas en una lmina
portaobjeto.
Aspirar el fondo del sedimento con una pipeta y depositar 1 2 gotas del aspirado en los
extremos de la otra lmina portaobjeto.
Agregar 1 o 2 gotas de solucin lugol a una de las preparaciones.
Cubrir ambas preparaciones con las laminillas de celofn y observar al microscopio
OBSERVACIN.
Examinar primero la preparacin con solucin fisiolgica para observar formas mviles
y de menor peso especfico (trofozotos, quistes y larvas) y luego la preparacin con lugol para
observar sus estructuras internas, de estos y de otros parsitos de mayor peso especfico
(huevos, larvas).
RESULTADO.
Informar la presencia de las formas evolutivas de los parsitos segn el mtodo directo.
Christian Gallegos Palermo
[28]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
CENTRIFUGACIN CON AGUA O SOLUCIN SALINA FISIOLGICA
Este es un mtodo de concentracin por centrifugacin
MATERIALES Y REACTIVOS:
Agua o Solucin salina fisiolgica, Gasa, Embudo, Tubo de centrifuga, lminas porta y
cubreobjetos.
TECNICA:
1. Mezclamos 1 a 2 gr. de heces con 10 a 20 veces su volumen de agua o SSF, la mezcla se
pasa a travs de una gasa doble o de un colador de malla fina, colocado sobre un embudo,
recogiendo el producto del filtrado en uno o dos tubos de centrfuga
2. Centrifugamos los tubos a 2.500 rpm durante 3 a 5 minutos.
3. Decantamos el lquido que sobre nada y colocamos una porcin del sedimento entre cubre
y portaobjeto.
4. Listo para ser observado por el Bioanalista
RESULTADO: Con este mtodo se enriquecen los quistes de protozoarios, los huevos de
Fasciola heptica e infecundos de scaris lumbricoides .Utilizando solucin salina isotnica de
cloruro de sodio los trofozotos de amiba se concentran en estado vivo de 15 a 40 veces.
Christian Gallegos Palermo
[29]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MTODO DE SEDIMENTACIN RPIDA (TSR, MSR) (CONCENTRACIN POR
SEDIMENTACIN SIN CENTRIFUGACIN) (LUMBRERAS Y COL. 1962):
FUNDAMENTO.
Se basa en la gravidez de los huevos que, por su tamao y peso sedimentan rpidamente
cuando se suspenden en agua.
MATERIALES Y REACTIVOS:
Copa o vaso de vidrio o plstico, cnico de 150 a 200 mL.
Coladera de malla metlica o plstico.
Placas Petri o lunas de reloj.
Aplicador de madera (1/3 de abatalengua).
Pipeta Pasteur.
Gasa.
Agua corriente filtrada.
Microscopio.
PROCEDIMIENTO
1. Homogeneizamos 3 a 6 g de heces con unos 10 a 20 mL de Solucin de lavado.
Christian Gallegos Palermo
[30]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
2. Colocamos el colador y dos capas de gasa en la abertura del vaso y a travs de ella, filtramos
la muestra.
3. Retiramos el colador y llenamos la copa con solucin de lavado hasta 1 cm. debajo del
borde, esto es 15 a 20 veces el volumen de la muestra. Dejamos sedimentar la muestra
durante 30 minutos. Decantamos las 2/3 partes del contenido del vaso y agregamos
nuevamente solucin de lavado agua. Repetimos los pasos anteriores cada 5 a 10 minutos
por 3 a 4 veces, hasta que el sobrenadante quede limpio.
4. Transferimos uno o dos gotas del sedimento a una lmina portaobjetos con ayuda de una
pipeta Pasteur o de un gotero y proporcionamos el preparado al Bioanalista para su
observacin.
OBSERVACIN: Observar la presencia de huevos. Este mtodo es especialmente til para la
bsqueda de Fasciola heptica, Paragonimus sp., y nematodos como scaris lumbricoides
(huevo fecundo o infecundo), Trichuris trichiura, Hymenolepis nana, Diphyllobothrium, etc.
RESULTADO.
Informar la presencia de las formas evolutivas de los parsitos segn el mtodo directo.
Christian Gallegos Palermo
[31]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICA DE FAUST.
OBJETIVOS.
Determinacin de la presencia de quistes de protozoarios y huevos de nematodos y
cestodos.
FUNDAMENTO
Uso de sustancias de densidad alta que al ponerse en contacto con estructuras
parasitarias las hace flotar por diferencia de densidad.
MATERIAL Y EQUIPO.
Tubos de centrfuga
Varilla de vidrio
Coladera
Recipiente de plstico o vidrio
Cuchara
Porta objetos y cubre objetos
Asa bacteriolgica
Centrfuga
Microscopio compuesto.
SOLUCIONES Y REACTIVOS
Solucin saturada de Sulfato de Zinc al 33% con una densidad de 1.18
Lugol parasitolgico
Agua destilada.
DESARROLLO
Se colocan 2 o 3 gramos de materia fecal en el recipiente, se adicionan 10 veces su
volumen de agua y se homogeneiza, posteriormente se cuela al otro recipiente y se deposita en
un tubo de centrifuga. A continuacin se centrfuga a 2000 rpm. Durante un minuto y se decanta
el sobrenadante, re suspendemos nuevamente con agua y volvemos a centrifugar tirando el
sobrenadante, esta operacin se repite hasta que el sobrenadante quede transparente, cuando se
logr esto se reconstituye la pastilla con la solucin saturada de Sulfato Zinc centrifugando
nuevamente, terminando el tiempo de centrifugacin se adiciona al tubo solucin saturada hasta
llenarlo y formar un menisco en la superficie y se deja reposar el tubo por un lapso de 10 min.,
Christian Gallegos Palermo
[32]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
despus del cual se toma una muestra con el asa o se le coloca encima del menisco un cubre
objetos o porta objetos de tal manera que se coloque la totalidad de la muestra superficial, se le
agrega despus lugol y se observa al microscopio.
INTERPRETACIN
Se reportan los parsitos encontrados como positivo o negativo. Deben tomarse 3
muestras de distintos das para obtener el ms alto porcentaje de posibilidad de deteccin.
VENTAJAS
El Sulfato de Zinc elimina la grasa y podemos observar con mayor facilidad la muestra
Esta tcnica es la ms comnmente utilizada en el laboratorio de diagnstico.
DESVENTAJAS
No es eficiente en la deteccin de huevos de Tremtodos, Taenia spp. y scaris, aunque
espordicamente se pueden detectar estos dos ltimos.
Christian Gallegos Palermo
[33]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
METODOS DE CONCENTRACIN POR FLOTACIN
MTODO DE SHEATHER SUGAR:
(MTODO DE CONCENTRACIN POR FLOTACIN CON CENTRIFUGACIN
EN UNA SOLUCIN DE AZCAR)
FUNDAMENTO.
Se basa en la flotacin de quistes, ooquistes y huevos de parsitos en una solucin de
azcar que posee mayor densidad que ellos. Esta tcnica es til para la concentracin de quistes
y ooquistes de protozoos y huevos de helmintos y se usa como mtodo preferencial en el
diagnstico de los coccidios: Cryptosporidium, Cyclospora, Isospora, etc.
MATERIALES Y REACTIVOS:
Tubos de ensayo 13 x 100, Lminas portaobjetos y cubreobjetos, Aplicadores, Solucin
saturada de azcar, Asa de platino o pipetas Pasteur, Suero fisiolgico, Embudo de vidrio, Gasa.
PROCEDIMIENTO.
1. Homogeneizamos 1 a 2 g de materia fecal en Solucin salina fisiolgica.
2. Colocamos un embudo de vidrio con una gasa doblada en la abertura del tubo de ensayo y
filtramos el material homogeneizado.
3. Centrifugamos el tubo con el material homogeneizado a 1 500 rpm. durante 2 a 5 minutos.
4. Eliminamos el sobrenadante, y agregamos la solucin de azcar hasta 1 cm. del borde del
tubo, agitando hasta disolver el sedimento, centrifugamos como en el paso anterior,
completamos con la solucin de azcar hasta el borde y esperamos de 2 a 5 minutos.
5. Con la ayuda de un asa de platino o de una pipeta de Pasteur, tomamos una muestra de la
superficie del menisco y la colocamos en una lmina portaobjeto, (tambin podemos colocar
la laminilla o la lmina sobre el menisco) cubrimos con una laminilla.
6. Facilitar la preparacin al Bioanalista para su observacin. (Podemos agregar lugol)
RESULTADO.
Informar la presencia de las formas evolutivas de los parsitos segn el mtodo directo.
Christian Gallegos Palermo
[34]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MTODO DE PARODI Y ALCARAZ.
(MTODO DE CONCENTRACIN POR FLOTACIN SIN CENTRIFUGACIN,
EN SOLUCIN SOBRESATURADA DE AZCAR):
FUNDAMENTO.
Se basa en la propiedad que tienen los quistes y/o huevos de flotar en la superficie de
una solucin saturada de azcar, debido a su menor densidad. El mtodo es til para la deteccin
de quistes de protozoarios y huevos de helmintos
MATERIALES Y REACTIVOS:
Agua, Gasa, Tubo de ensayo, Solucin azucarada de Parody y Alcaraz, lminas porta y
cubreobjetos, abatalengua o palillos.
PREPARACIN ORIGINAL DE LA SOLUCIN AZUCARADA DE PARODY Y
ALCARAZ
Azcar
900 gr.
Agua
1.100 cc.
cido actico
10 cc.
Fenol
10 cc.
Christian Gallegos Palermo
[35]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Actualmente, se ha modificado, el fenol se ha sustituido por formol, no se le agrega
cido actico y el azcar utilizado es el azcar morena (prieta o tambin llamada rubia).
TCNICA:
1. Colocamos 1 gr. de materia fecal en un tubo de ensayo que contenga 10 a 15 cc. de solucin
azucarada; tapamos el tubo y agitamos fuertemente durante uno a dos minutos.
2. Pasamos este lquido a travs de gasa fina doblada varias veces y recogemos el lquido
filtrado en pequeos recipientes, ms o menos de 15 cc. de capacidad.
3. Agregamos la mezcla de fenol-azucarada hasta alcanzar los bordes del recipiente y dejamos
en reposo durante 20 a 30 minutos
4. Colocamos un cubre-objetos sobre la superficie lquida. Retiramos el cubre que lleva
adheridas algunas gotas del lquido y lo colocamos sobre un porta-objeto.
5. Listo para que el Bioanalista proceda a examinar.(se le puede agregar una gota de lugol a la
preparacin)
RESULTADO.
Informar la presencia de las formas evolutivas de los parsitos segn el mtodo directo.
Christian Gallegos Palermo
[36]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICA DE RITCHIE.
OBJETIVO.
Deteccin de huevos de helmintos de peso elevado (Ascaris lumbricoides, Fasciola
heptica y Taenia spp.).
FUNDAMENTO
Dilucin de una muestra de materia fecal en soluciones cuya baja densidad permite a las
estructuras de mayor peso, sedimentar el recipiente que las contenga. Esta sedimentacin se ve
favorecida por centrifugacin.
MATERIAL Y EQUIPO.
Vasos de precipitado.
Coladera.
Varilla de vidrio.
Cuchara.
Tubos de centrifuga.
Pipeta Pasteur.
Porta objetos y cubre objetos.
Centrifuga.
Microscopio compuesto.
SOLUCIONES Y REACTIVOS.
Solucin salina fisiolgica (SSF).
Formaldehdo 10%.
ter etlico.
Lugol parasitolgico.
DESARROLLO.
En un vaso se colocan 2-3 gramos de materia fecal, se le agrega SSF y se homogeneiza,
se cuela y el producto se deposita en tubos de centrifuga y s centrfuga la muestra a 2000 rpm
durante 1 minuto. Se decanta y el sedimento se recupera en solucin salina fisiolgica, se
centrfuga la muestra por segunda vez, eliminando el sobrenadante nuevamente, sta operacin
se repite hasta obtener un sobrenadante transparente. El sedimento se re suspende en 10 ml de
Christian Gallegos Palermo
[37]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
formaldehdo se agita y se deja reposar por 10 minutos, y despus se agregan 5 ml de ter, se
agita y centrfuga 2 minutos a 2000 rpm. El contenido del tubo presentar 4 capas:
1. La capa superior corresponde a ter.
2. La capa media superior corresponde a restos fecales y grasa.
3. La capa media inferior corresponde al formaldehdo.
4. La capa inferior contiene estructuras parasitarias y rastros fecales.
Con la pipeta Pasteur se toma una muestra de sedimento, colocndolo sobre un porta
objetos, a esta muestra se agrega una gota de lugol y se coloca encima el cubre objetos, por
ltimo se observa la muestra al microscopio.
INTERPRETACION
Se reportan los parsitos encontrados como positivo, o negativo en caso de ausencia de
los mismos. Igual que el examen directo.
VENTAJAS
Eficiencia en deteccin de estructuras parasitarias de peso elevado (huevos de Tremtodos,
Taenia spp. y Ascaris).
DESVENTAJAS.
Observacin sucia.
Difcil deteccin de protozoarios.
Christian Gallegos Palermo
[38]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICA DE BAERMAN
OBJETIVO
Recolectar larvas, rabditoides y filariformes.
FUNDAMENTO.
Es una tcnica de concentracin por termotropismo o hidrotropismo. Se basa en crear
condiciones que favorezcan la migracin de larvas, de la materia fecal que los contiene, al tubo
ltex en el aparato de Baerman.
En esta tcnica se aprovecha el comportamiento de las larvas de nematodos, de migrar
a los lugares con mayor humedad (hidrotropismo), o temperatura adecuada (termotropismo),
menor iluminacin (fototropismo inverso) y a la fuerza de gravedad que las concentra en la
parte baja.
MATERIAL Y EQUIPO.
Aparato de Baermann (soporte universal, embudo de plstico o vidrio, tubo de hule ltex,
pinza de Mohr, coladera de plstico y vidrio de reloj).
Cuadro de gasa (10 x 10 cm.).
Aguja de diseccin.
Pipeta Pasteur.
Porta objetos y cubre objetos.
Microscopio compuesto y estereoscpico.
REACTIVOS
Lugol parasitolgico.
Agua destilada.
DESARROLLO.
-
Montar el aparato de Baerman.
Colocar aproximadamente 3 gramos de materia fecal en el cuadro de gasa, se envuelve
en ella y se forma una especie de saco.
Colocar el saco sobre la coladera en el aparato de Baerman.
Agregar agua tibia por un lado del embudo sin dejarla caer sobre la materia fecal. El agua
tiene que cubrir dos tercios de la muestra.
Dejar reposar durante 24 horas.
Christian Gallegos Palermo
[39]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Obtener las primeras gotas del lquido en el vidrio de reloj, regulando su salida con las
pinzas de Mohr.
Observar al microscopio estereoscpico el lquido obtenido. En caso de ser positivo, el
movimiento serpenteante denuncia la presencia de larvas.
Colocar las larvas en el porta objetos con la pipeta Pasteur.
Agregar una gota de lugol, para inmovilizar y matar las larvas.
Colocar el cubre objetos sobre la muestra.
Observar y diferenciar las larvas al microscopio compuesto.
INTERPRETACION.
Siendo esta una prueba cualitativa se reporta como positiva o negativa, mencionando el
gnero que se detect en caso de resultar positiva.
VENTAJAS.
Es una de las pocas pruebas efectivas para detectar larvas de nematodos pulmonares
adems es importante complemento para la tcnica de cultivo larvario.
DESVENTAJAS.
Resulta difcil procesar varias muestras al mismo tiempo por el material y espacio fsico
que se ocupa para la tcnica.
Christian Gallegos Palermo
[40]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MTODOS DE CHARLES Y BARTHELEMY.
Es un mtodo de concentracin por centrifugacin
MATERIALES Y REACTIVOS:
Gasa, Embudo, Tubo de centrifuga, Solucin salina fisiolgica formolada al 10%,
solucin ctrica formolada, ter, lminas porta y cubreobjetos.
Preparacin de: SSF formolada al 10 %
Solucin salina fisiolgica
90 cc.
Formol
10 cc.
Solucin ctrica formolada
cido ctrico
120 gr
Formol
20 cc.
Agua destilada c.s.p. 100 cc
1. Colocamos en un tubo de ensayo unos 15 cc de solucin fisiolgica formolada al 10 % con
aprox. dos gramos de material fecal y mezclamos bien, hasta que el material quede
totalmente diluido.
2. Filtramos a travs de un trozo de gasa doblada en cuatro partes, colocada en un embudo de
vidrio y recogemos el filtrado en un tubo de centrifugacin. Centrifugamos durante 5
minutos a 1.800 rpm. Decantamos el lquido sobrenadante
3. Diluimos el sedimento en el mismo tubo con 15 cc. de solucin ctrica formolada y
agregamos 2 a 3 cc. de ter. Agitamos el tubo vigorosamente y centrifugamos durante 2 a 3
minutos. Las grasas disueltas por el ter, los detritus vegetal y fecaloides ms livianos, se
acumulan en la superficie formando un tapn, que debemos descartar. Centrifugamos de
nuevo durante 2 a 3 minutos. Se forma en el tubo otro tapn superficial, por debajo del cual
hay una capa de lquido y en el fondo un pequeo sedimento que habr que examinar.
4. Descartamos el lquido sobrenadante y el tapn y colocamos unas gotas del sedimento entre
porta y cubreobjeto para que el Bioanalista proceda a su examen microscpico.
NOTA: Da buenos resultados para huevos de helmintos Y quistes de protozoarios.
Christian Gallegos Palermo
[41]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MTODO DE TELEMAN RIVAS.
Es un mtodo de concentracin por centrifugacin con ter.
MATERIALES Y REACTIVOS:
cido Actico al 5%, Gasa, Tubo de centrifuga, ter, lminas porta y cubreobjetos.
TECNICA:
1. Colocamos aproximadamente 1 o 2 gramos de heces en un tubo de ensayo Agregamos 5 cc.
de una solucin de cido actico al 5% (pudiendo ser HCl al 5%, 10 cc). Tapamos la boca
del tubo con un tapn y agitamos enrgicamente hasta homogeneizar lo ms posible su
contenido.
2. Dejamos reposar la dilucin durante 5 minutos para que se sedimenten las partculas ms
gruesas y el lquido que sobrenada se filtra a travs de dos capas de gasa fina, recogiendo
el producto del filtrado en un tubo de centrfuga.
3. Agregamos un volumen igual de ter, puede ser ter sulfrico, agitamos para emulsionar
bien y centrifugamos durante 2 a 3 minutos.
4. La masa se reparte en 4 partes distintas:
a) Hacia arriba el ter que ha disuelto las grasas y materiales colorantes.
b) Por debajo una capa gruesa formada por fino detritus fecal.
Christian Gallegos Palermo
[42]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
c) Una capa liquida cida y coloreada.
d) El depsito del sedimento que contiene partes pesadas restos de vegetales quistes de
protozoarios, huevos de helmintos
Decantamos las tres capas superiores, quedando el sedimento, en el fondo del tubo de
centrfuga, de donde retiramos una porcin que colocamos entre porta y cubreobjeto, para ser
examinada por el Bioanalista. Puede colocarse con Lugol etc.
RESULTADO:
Este mtodo enriquece bastante los huevos de helmintos. Tiene el inconveniente que
desfigura los quistes de protozoarios.
TCNICA DE WILLIS
OBJETIVO.
Detectar la presencia de quistes de protozoarios y huevos de nematodos y cestodos.
FUNDAMENTO.
Por medio de diferencia de densidades, inducir la flotacin de estructuras parasitarias.
MATERIAL Y EQUIPO.
Vaso de plstico
Cuchara o abatelengua
Asa bacteriolgica
Christian Gallegos Palermo
[43]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Porta objetos
Cubre objetos
Microscopio compuesto.
SOLUCIONES Y REACTIVOS
Solucin saturada de cloruro de sodio al 40% densidad 1.18
Lugol parasitolgico
DESARROLLO
Se colocan 2 o 3 gramos de materia fecal en un vaso y se adicionan 50-60 ml de solucin
saturada de NaCl homogeneizando la muestra, una vez logrado esto se cuela a otro recipiente
dejando reposar por un lapso de 15 min., pasando este lapso se toma de la superficie una muestra
con el asa de platino colocndola sobre un porta objetos, le adicionamos una gota de lugol, se
coloca un cubre objetos y se observa al microscopio.
Existen modificaciones a la tcnica aplicando centrifugacin a la muestra para acelerar
la flotacin de la misma, incluso siguiendo un procedimiento semejante al de la tcnica de
Faust, sustituyendo la solucin.
INTERPRETACIN
Se reportan los parsitos encontrados, como positivo o negativo. No se detectan huevos
de Trematodos, de Taenia, ocasionalmente de scaris.
VENTAJAS
Se requiere poco equipo
Tcnica ms representativa
DESVENTAJAS
La grasa puede dificultar la observacin
Riesgo de trabajar materia fecal.
Nota: El asa de platino debe ser usada doblando la porcin circular para que quede horizontal
y se puedan tomar las muestras.
Christian Gallegos Palermo
[44]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
EXMENES CUANTITATIVOS.
TCNICA DE KATO Y MIURA.
OBJETIVO.
Cuantificacin de huevos y quistes de parsitos.
FUNDAMENTO.
Examen de una cantidad conocida de materia fecal auxilindose con la accin de
sustancias aclarantes y colorantes.
MATERIAL Y EQUIPO
Cuadros de papel celofn (20 x 40) o (22 x 30 mm).
Porta objetos.
Papel filtro.
Aplicador de madera.
Christian Gallegos Palermo
[45]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Microscopio compuesto.
Estufa bacteriolgica (opcional).
REACTIVOS.
Solucin glicerinada de Verde de Malaquita al 1 %
Glicerina 20 %.
DESARROLLO.
Se pesan 50 mg de materia fecal y se coloca en un porta objetos, se cubre con un cuadro
de papel celofn que previamente ha sido sumergido en la solucin de Verde de MalaquitaGlicerina (por 24 horas), con el papel filtro se presiona el cuadro de papel celofn para extender
la muestra y retirar el exceso de colorante, a continuacin, se deja en reposo la preparacin por
un lapso de una hora a temperatura ambiente o 30 minutos a 37C en estufa bacteriolgica.
Despus de pasado ese tiempo se examina al microscopio la totalidad de la muestra.
INTERPRETACION.
Se cuentan todas las estructuras parasitarias multiplicndolas posteriormente por 20
(factor fijo), el resultado se da en estructuras por gramo de materia fecal.
VENTAJAS.
Es til para la observacin y cuantificacin de huevos de helmintos.
DESVENTAJAS.
No es satisfactorio para los quistes de protozoarios.
Si se excede del tiempo se dificulta la observacin.
Nota:
La tcnica se utiliza como complemento de procedimientos cualitativos, no es comn
su uso en el laboratorio.
Christian Gallegos Palermo
[46]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TECNICA DE STOLL.
OBJETIVO.
Cuantificar la presencia de huevos y quistes de parsitos.
FUNDAMENTO.
Tcnica en la que por la utilizacin de ciertas sustancias se produce la saponificacin,
homogeneizacin y aclaramiento de la muestra, permitiendo contrastar las estructuras
parasitarias.
MATERIAL Y EQUIPO.
Probeta de Stoll o probeta graduada de 100 ml
Tapn de hule.
Pipeta graduada de 1 ml
Varilla de vidrio.
Perlas de vidrio de 5 mm de dimetro.
Porta objetos de 40 por 20 mm.
Contador de teclas.
Microscopio compuesto.
Christian Gallegos Palermo
[47]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
SOLUCIN Y REACTIVOS.
Solucin de hidrxido de sodio 0.1 N.
DESARROLLO.
Pesar e introducir a la probeta cuatro gramos o cuatro mililitros de heces con la ayuda
de una varilla de vidrio, agregar la solucin dcimo normal de hidrxido de sodio hasta la
graduacin de 60 mililitros. Poner de 15 a 20 perlas de vidrio en la probeta, taparla y agitarla
para homogeneizar la suspensin. Colocar 0.15 ml de la totalidad del lquido recogido sobre un
porta objetos, poner encima un cubre objetos. Contar todos los huevos contenidos en la
preparacin utilizando el contador recorriendo toda la superficie del cubre objetos con ayuda
de la platina mvil.
INTERPRETACIN.
Para determinar el nmero de huevos por gramo de heces es suficiente multiplicar por
100 el nmero de huevos contados en la preparacin donde:
n = Nmero de huevos contados en la muestra de 0.15 ml.
n x 60 = n x 60 = n x 100
0.15 x 4 =
0.60
100 - Materia fecal compacte.
200 - Materia fecal pastosa.
400 - Materia fecal lquida.
N x 100 = Nmero de huevos contenidos en los 60 ml de la dilucin (es decir en 4 g de
heces).
El nmero total de huevos liberados en 24 horas, se obtiene multiplicando el nmero de
huevos por gramo de heces por el peso de la materia fecal emitida durante ese tiempo.
VENTAJAS.
Mtodo rpido, pero con observacin lenta.
La muestra obtenida es muy limpia.
Christian Gallegos Palermo
[48]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
CULTIVO LARVARIO
OBJETIVO
Favorecer el desarrollo de larvas de helmintos y establecer el diagnstico diferencial de
las mismas.
FUNDAMENTO
Las bases de los cultivos larvarios ms que fsicas son biolgicas, dado que se utilizan
diferentes tactismos de las larvas para lograr su concentracin; entre stos se encuentran el
termotropismo e hidrotropismo.
METODO DE HARADA-MORI
MATERIAL Y EQUIPO.
Tubos de ensayo de 25 x 175 mm.
Tiras de papel filtro de 2 cm de ancho x 17 cm de largo.
Cuadros de papel celofn de 6 x 6 cm de largo.
Gradilla.
Abatelenguas.
Porta objetos de 76 x 26 mm.
Cubre objetos de 22 x 22 mm.
Pipeta Pasteur.
Microscopio estereoscpico y compuesto.
Estufa de cultivo.
DESARROLLO
Colocar en un tubo de ensayo 5 ml de agua destilada.
Extender un frotis delgado (1-2 mm) de heces con el abatelenguas o con un aplicador de
madera, en el tercio medio del papel filtro de un slo lado, respetando as los extremos.
Introducir la tira de papel filtro en un tubo.
Tapar el tubo con los cuadros de papel celofn, asegurndolo con una liga.
El cultivo se guarda en la estufa a la temperatura de 28 a 30C durante 5-7 das.
A partir del 5 da se inicia la revisin de los tubos, de la siguiente forma:
Christian Gallegos Palermo
[49]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Mediante el microscopio estereoscpico, observar el fondo del tubo para confirmar la
presencia de larvas, si no se logra observar nada se vuelve a incubar el tubo durante dos o tres
das ms y se vuelve a hacer la observacin, s sta es positiva, se aspira con la pipeta Pasteur
una muestra del fondo del tubo. Colocar una gota en cada extremo del porta objetos agregando
una gota de lugol a cada una de ellas. Colocar un cubre objetos y observar al microscopio.
Nota: Despus de observar los tubos con el microscopio estereoscpico, los tubos se pueden
calentar a 50C en bao mara, ya que de esta manera se asegura que al manipular los tubos no
se corra riesgo de contaminacin, pues las larvas que se desarrollan son infectantes y penetran
por piel intacta.
METODO DE CORTICELLY - LAY
MATERIAL Y EQUIPO
Cajas de petri de 15 y 10 cm de dimetro.
Abatelenguas.
Pipeta Pasteur.
Tubos de centrifuga.
Porta objetos de 76 x 26 mm.
Cubre objetos de 22 x 22 mm.
Centrifuga con camisas para tubo de centrifuga.
Christian Gallegos Palermo
[50]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Estufa de cultivo.
Microscopio compuesto y estereoscpico.
SOLUCIONES Y REACTIVOS.
Agua destilada.
Solucin de lugol parasitolgico.
Aserrn estril.
DESARROLLO.
Hacer una mezcla pastosa de heces con aserrn estril (2 partes de heces o de tierra y 3 partes
de aserrn estril).
Homogeneizar con agua. Colocar esta mezcla en la caja de petri de 10 cm de dimetro y
llenar con agua a manera de que se cubra la mitad de la caja chica.
Tapar la caja grande e incubar de 5 a 7 das de 28 a 30C.
Pasando este tiempo voltear la caja que contiene la mezcla para que penetre el agua y se
distribuyan las larvas hacia los lugares hmedos. Incubar un da ms. Sacar las cajas y quitar
la caja de menor dimetro. Observar la otra caja al microscopio estereoscpico para verificar
si hay larvas. S las hay el lquido se recolectar en los tubos de centrifuga para concentrarlas,
una vez centrifugados tomar una muestra con la pipeta Pasteur, colocarla sobre un porta
objetos y si se desea con una gota de lugol, ponerle un cubre objetos y observar con el
microscopio compuesto.
MTODO DE ASERRN ESTRIL
MATERIAL Y EQUIPO
Caja de petri de 10 cm de dimetro.
Abatelenguas.
Vidrio de reloj.
Varilla de vidrio.
Todo el material que se utiliza para el aparato de Baermann.
Porta objetos de 76 x 26 mm.
Cubre objetos de 22 x 22 mm.
Microscopio compuesto y estereoscpico.
Estufa de cultivo.
Christian Gallegos Palermo
[51]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
SOLUCIONES Y REACTIVOS.
Agua destilada.
Lugol.
Aserrn estril.
DESARROLLO.
Hacer una mezcla pastosa en la caja de petri colocando dos partes de heces o tierra y tres
partes de aserrn estril. Homogeneizar con agua e incubar de 5-7 das a una temperatura de
28-30C.
Mezclar la muestra cada tercer da con la varilla de vidrio para oxigenar.
Pasado este tiempo se recolecta la muestra y se coloca en el aparato de Baerman y se sigue
la tcnica que se describi anteriormente para este mtodo.
VENTAJAS.
Con todos estos mtodos se puede diferenciar el gnero y especie de las larvas encontradas.
Se puede utilizar polvo de carbn vegetal ya que permite desodorizar el cultivo y favorecer
la purificacin del mismo.
DESVENTAJAS.
Son mtodos lentos y laboriosos pero sus resultados son excelentes.
Son mtodos que requieren de mucho tiempo ya que la incubacin puede ser de 48 horas
hasta los 15 das.
Christian Gallegos Palermo
[52]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICAS DE GRAHAM O DE RASPADO PERIANAL
OBJETIVO.
Detectar la presencia de huevos de Enterobius vermiculares mejor conocido como
"oxiuro" o "gusano alfiler".
FUNDAMENTO
La hembra adulta de Enterobius vermiculares no deposita huevos en el intestino, sino
que migra durante la noche hacia los mrgenes del ano, depositando huevos en los pliegues
perianales, por lo tanto, el fundamento es la recoleccin y concentracin de huevos por medio
de un material adhesivo.
MATERIAL Y EQUIPO.
Cinta de celulosa transparente adhesiva de 12 mm de ancho.
Abatelenguas.
Porta objetos.
Microscopio compuesto.
REACTIVOS.
Tolueno o Xilol.
DESARROLLO.
La toma de muestras se har por la maana, sin que el paciente haya defecado, efectuando su
limpieza personal o cambiando de ropa interior. Se coloca al paciente en posicin genupectoral,
exponiendo el esfnter anal.
Un fragmento de cinta de celulosa transparente (diurex), de 8 cm de longitud por 12 mm de
ancho, se fija al abatelenguas o tubo sujetndolo con los dedos pulgar e ndice, que quede
adherente hacia afuera. Se presiona la superficie sobre la regin perianal hacia un lado y otro
para frotar y desprender partculas superficiales.
Colocar la cinta sobre un porta objetos limpio y desengrasado con alcohol-ter (7 partes de
alcohol por 3 de ter). Presionar fuertemente para lograr adherencia perfecta y eliminar las
burbujas de aire. Se recomienda colocar una gota de tolueno o xilol entre la superficie
adhesiva y el porta objetos para eliminar las burbujas, adems permite aclarar las clulas
epiteliales y hacer visibles los huevos. Examinar la muestra con el objetivo seco dbil.
Christian Gallegos Palermo
[53]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
INTERPRETACION
Se reporta como negativo o positivo al hallazgo de huevos de Enterobius vermiculares o
cualquier otro huevo.
VENTAJAS
til en la bsqueda de huevos de Enterobius.
DESVENTAJAS
Tcnica muy especializada, es complementaria de las usuales.
Christian Gallegos Palermo
[54]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
EXAMEN DE ORINA
Se realiza principalmente para buscar Trichomonas vaginalis, huevos de Schistosoma
haematobium. Raras veces se encontrarn trofozotos de Entamoeba histolytica, presentes en la
orina de personas con lceras amebianas en los genitales.
RECOLECCIN.
Existen dos formas segn el propsito buscado:
1. Para Trichomona vaginalis, recoger el primer chorro de la orina matinal en un frasco
perfectamente limpio.
2. Para los huevos de Schistosoma haematobium hay dos posibilidades: recoger la orina final
de la miccin despus de un esfuerzo moderado, (saltos, subir escaleras, etc.), o bien la orina
de 24 horas, siendo esto lo ms recomendable, (aunque este parsito es extico en nuestro
pas).
El mtodo usado para la bsqueda de estos parsitos es el de centrifugacin, que permite
la sedimentacin de las estructuras parasitarias junto con eritrocitos y piocitos.
MATERIAL.
Tubos de centrifuga con capacidad de 25 ml
Ampollas de decantacin en forma de pera de 250 500 ml
Centrifuga con camisas para tubo de centrifuga de 25 ml
Nota: Durante la miccin la muestra puede ser contaminada por elementos de origen pubiano o
preorificial como piojos, huevos de Enterobius vermiculares y otros.
Si la orina de 24 horas es recogida en recipientes mal lavados o mal cerrados pueden
encontrarse en los sedimentos urinarios contaminados, caros adultos o sus huevos.
DESARROLLO.
Centrifugar la muestra de orina durante 5 minutos a 3500 rpm, se desecha el lquido
sobrenadante, se vuelve a suspender el precipitado en las gotas de orina que permanecen en
el tubo, golpeando ligeramente ste con el dedo lateralmente y se pone una gota de esta
suspensin entre un porta y un cubre objetos.
Examinar al microscopio con el objetivo 10X y 40X.
Christian Gallegos Palermo
[55]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
INTERPRETACIN.
Se reporta los parsitos encontrados en los sedimentos de orina, despus de la centrifugacin,
se pueden encontrar:
Protozoarios flagelados Trichomonas vaginalis.
Microfilarias Wuchereria bancrofti y otras.
Espiroquetas como Leptospira icterohaemorrhagiae.
CONSERVACIN.
Si se retrasa el examen de orina, agregue a cada 100 ml:
1 ml de cido clorhdrico (20 gotas).
2 ml de leja comercial (40 gotas).
De esta manera la orina se podr mantener a la temperatura ambiente por tiempo indefinido.
EXAMEN DE EXUDADO URETRAL Y VAGINAL.
La investigacin, tanto de la secrecin purulenta de la uretra masculina, al igual que las
muestras vaginales, nos permite encontrar parsitos como: Trichomonas vaginalis y en
ocasiones Enterobius vermiculares, ya que la enterobiosis vaginal es muy frecuente en las nias.
En el caso de Trichomona vaginalis el exudado es claro y blanquecino, o puede ser gris
verdusco y espumoso.
TOMA DE MUESTRA DE EXUDADO URETRAL.
MATERIAL Y EQUIPO
Asa de platino o hisopo estril.
Algodn estril.
Porta objetos de 76 x 26 mm.
Cubre objetos de 22 x 22 mm.
Tubos de ensayo de 13 x 100 mm.
SOLUCIONES.
Solucin salina fisiolgica al 0.85 %.
Christian Gallegos Palermo
[56]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
DESARROLLO.
Se limpia el rea alrededor del meato urinario con un algodn estril, se exprime la uretra
haciendo presin a travs de los tejidos en todo el trayecto de la uretra hacia el meato
urinario, desde la parte ms distante posible; se toma directamente la muestra con dos
hisopos o con una asa de platino y se le imprime movimiento rotatorio suave.
Si la observacin de esta muestra no se hace inmediatamente, se introduce el hisopo en un
tubo de ensayo con 1 o 2 ml de solucin salina fisiolgica, que se usar para hacer una
preparacin en fresco y un frotis.
TOMA DE MUESTRA DE EXUDADO VAGINAL
MATERIAL Y EQUIPO.
Espejos vaginales (espculos vaginales).
Esptula de madera o escobillones montados en soportes de madera.
Mesa ginecolgica.
Tubos de ensayo de 13 x 100 mm.
Porta objetos y cubre objetos.
Microscopio compuesto.
SOLUCIONES Y REACTIVOS
Solucin salina fisiolgica al 0.85 %.
Colorantes de Gram, May-Grunwald-Giemsa o para el papanicolau.
DESARROLLO.
Se coloca a la paciente en posicin ginecolgica sobre la mesa, la paciente no habr
efectuado ningn aseo interno ni habr tenido relaciones sexuales durante las 48 horas que
preceden al examen.
Posteriormente se introduce el espejo vaginal y se toma la muestra ya sea con la esptula de
madera o con los hisopos humedecidos con solucin salina estril al 0.85%, del fondo del
saco vaginal posterior y del meato urinario.
Con las muestras obtenidas, tanto uretrales como vaginales, podemos realizar los siguientes
estudios:
Christian Gallegos Palermo
[57]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
1. Examen directo en fresco: Se realiza depositando una gota de la secrecin en un porta
objetos, poner un cubre objetos, y observar al microscopio con objetivos de 10 y 40X
respectivamente, buscar posibles parsitos.
Si es necesario diluir la muestra con solucin salina estril para evitar que la densidad de la
leucorrea enlentezca los movimientos del parsito.
2. Examen directo despus de la coloracin: Si no se encuentra nada en la gota que se ha
examinado, entre el porta objetos y el cubre objetos, se puede aplicar una tincin de Gram,
de May-Grunwald-Giemsa o con la tcnica citolgica (Papanicolau), y por ltimo se observa
al microscopio con el objetivo de inmersin.
Con la tincin de Gram T. vaginalis, es de color uniformemente rosado con los flagelos bien
visibles.
Con la tincin de May-Grunwald-Giemsa, T. vaginalis va a presentar su citoplasma de color
azul, el ncleo de color rojo violceo y los flagelos de color rojo.
Con la tincin citolgica T. vaginalis presenta el aspecto de glbulos verdosos con el ncleo
granuloso.
TINCIN DE GRAM
MATERIAL Y EQUIPO.
Cajas de petri.
Varillas de vidrio en forma de V.
Cuenta gotas.
Microscopio compuesto.
SOLUCIN Y REACTIVOS.
Solucin de cristal violeta.
Lugol.
Alcohol-Acetona.
Solucin de safranina.
DESARROLLO.
Realizar un frotis de la muestra a analizar sobre el porta objetos.
Christian Gallegos Palermo
[58]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Fijar el frotis con calor ligero.
Cubrirlo con cristal violeta y dejarlo reposar un minuto.
Lavar con agua destilada.
Decolorar de 10 a 30 segundos los frotis con alcohol-acetona.
Lavar con agua estilada.
Cubrirlos con safranina y dejarlos reposar durante 30 segundos.
Lavar con agua destilada.
Dejar secar a temperatura ambiente y observar los frotis al microscopio con el objetivo de
inmersin.
EXAMEN DE BIOPSIAS DE PIEL.
Para diagnosticar algunas enfermedades de los rganos, el mdico extrae un fragmento de
tejido con una pinza o un trocar. A esta pieza de tejido se le llama biopsia. Se examina al
microscopio despus de cortar una porcin delgada y tratarla con una tincin especial.
La biopsia es til a menudo en el diagnstico de infecciones parasitarias cutneas,
Leishmaniasis cutnea, microfilariasis de Onchocerca, Triquinelosis, etc.
TOMA DE MUESTRA DE BIOPSIA DE PIEL O EXUDADO DRMICO.
Este tipo de muestra se emplea para diagnosticar microfilarias de Onchocerca, amibiasis
cutnea y Leishmaniasis cutnea.
MATERIAL Y EQUIPO.
Lancetas, pinzas de Pean, Bistur, tijeras.
Porta objetos y cubre objetos.
Tubo de hemlisis.
Termmetro.
Estufa.
Microscopio compuesto.
SOLUCIN Y REACTIVOS.
Suero fisiolgico.
Solucin fijadora de Zenker.
Christian Gallegos Palermo
[59]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Colorante de Hematoxilina-Eosina.
DESARROLLO.
Para la amibiasis o leishmaniasis cutnea, se extirpa con el bistur una porcin
representativa de la lesin, colocarla sobre un porta objetos y fijarla con la solucin de Zenker.
Posteriormente hacer cortes y teirlos con el colorante de Hematoxilina-Eosina, y observar al
microscopio.
Para microfilarias se pueden hacer varias cosas:
1. Con una lanceta se practican de 4-5 escarificaciones prximas entre s y poco profundas y
se deja rezumar el jugo drmico, la compresin de la piel con los dedos pulgar e ndice
acelera la salida del jugo drmico. Recoger sobre un porta objetos desengrasado, la serosidad
sangrante (lquido serohemtico) y ponerle un cubre objetos para realizar el examen
microscpico. Si se desea teir, dejar secar al aire. La primera gota es la ms rica en
microfilarias. Ocasionalmente, el examen drmico est mezclas con sangre y la muestra
puede contener otro tipo de microfilarias que se deben diferenciar de las de Onchocerca.
2. Tomar fuertemente con una pinza de Pean una pequea parte de superficie cutnea. Cortar
con un bistur o tijeras el fragmento pinzado, colocndolo en un tubo de hemlisis
conteniendo un poco de suero fisiolgico. Colocar este tubo 15 minutos a 37C y examinar
el sedimento en que se renen las microfilarias que se desprenden del fragmento cutneo.
3. Puncionar un oncocercoma lo cual nos permite encontrar microfilarias cuando la muestra de
exudado drmico es negativa.
TOMA DE MUESTRA DE BIOPSIA RECTAL.
Este tipo de biopsia nos permite confirmar la sospecha de colitis amebiana, demostrar la
presencia de huevos de Schistosoma mansoni, S. japonicum y S. haematobium, y el diagnstico
de la Bilharziosis, que no son poco frecuentes en nuestro pas.
MATERIAL Y EQUIPO
Dedales de goma.
Pinzas para biopsia rectal.
Porta objetos y cubre objetos.
Christian Gallegos Palermo
[60]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Escobillones de 50 cm de largo.
Microscopio compuesto.
SOLUCIONES Y REACTIVOS.
Solucin salina fisiolgica al 0.9 %.
Solucin de cloral-lactofenol.
Vaselina.
DESARROLLO.
El paciente debe recibir un enema la noche anterior y la maana del da del examen. Un tacto
rectal debe preceder siempre a la anoscopa ser realizado con un mnimo de vaselina.
Cuando se trata de un enfermo de Bilharziosis, al palpar la cara anterior de la parte baja de
la ampolla rectal es posible, a veces, encontrar pequeas granulaciones induradas
submucosas.
Algunos de los grnulos palpados en el tacto rectal, presentan en su superficie una erosin
puntiforme con ms o menos relieve, de color rojo vivo, resultando sobre la mucosa normal,
se deben a una Bilharziosis por S. haematobium. La rectosigmoidoscopa permite constatar
en estos casos la integridad del resto de la ampolla rectal y del sigmoides. Por el contrario,
en caso de infestacin por S. mansoni y S. japonicum las alteraciones de la mucosa
rectoclica no tienen localizacin precisa. Se extendern las muestras con la pinza de biopsia
al nivel de las lesiones o, en ausencia, al nivel de la vlvula de Houston y a 10 cm por encima
de sta, tomando un fragmento de mucosa y de submucosa.
Si hay restos de materia fecal que molesten para el examen, se har una limpieza con el
escobilln. El fragmento obtenido ser puesto entre dos porta objetos sostenidos con la ayuda
de unas pinzas, con una gota de solucin salina que impedir la desecacin.
Observar la presentacin al microscopio para detectar huevos de Bilharzia.
Cuando la abundancia de hemates y el espesor del fragmento impiden la observacin, puede
procederse a un lavado con agua destilada y a un aclaramiento con cloral-lactofenol.
TOMA DE MUESTRA DE MSCULO.
Se utiliza para demostrar larvas de Trichinella y, a veces para buscar cisticercos de Taenia
solium.
Christian Gallegos Palermo
[61]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MATERIAL Y EQUIPO.
Bistur.
Termmetro.
Tubos de centrifuga.
Agujas de diseccin.
Porta objetos y cubre objetos.
Centrfuga.
Microscopio compuesto.
SOLUCION Y REACTIVOS.
Jugo gstrico artificial.
DESARROLLO.
Con el bistur se extrae una porcin grande del msculo afectado. Una parte del material se
comprime entre dos porta objetos con ayuda de unas pinzas, para examinarse directamente
en busca de larvas de Trichinella.
La parte restante de las muestras se debe digerir en jugo gstrico artificial a 37 C.
Posteriormente concentrar las larvas por centrifugacin (si la muestra es adecuada, una
porcin se da a comer a una rata de laboratorio con el fin de comprobar la viabilidad de las
larvas).
Si en la muestra se encuentra una larva de cisticerco, se debe disecar cuidadosamente de su
cpsula, romper con la aguja de diseccin y comprimir entre porta y cubre objetos para
demostrar el esclex caracterstico con cuatro ventosas y una doble hilera de ganchos.
METODOS PARA EXAMEN SNGUINEO.
FROTIS SNGUINEO.
Despus de las heces, la sangre es el medio en que con mayor frecuencia se recuperan
parsitos en diferentes estadios de desarrollo.
Es una fuente para el diagnstico rutinario de Paludismo, Tripanosomiasis africana, la mayor
parte de las Filariosis, con menos frecuencia la Enfermedad de Chagas y, raramente
Toxoplasmosis y Khala-azar. Adems sirve de indicador de los efectos nocivos de la
quimioterapia y radioterapia.
Christian Gallegos Palermo
[62]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
MTODO DE EXTRACCIN DE SANGRE: La sangre para las pruebas de laboratorio
puede ser capilar o perifrica y venosa.
CAPILAR PERIFRICA: Puede obtenerse del lbulo de la oreja, del pulpejo de un
dedo. En el caso de los nios, del pulpejo del dedo gordo del pie o del taln.
MATERIAL.
Torundas humedecidas con alcohol.
Lancetas, agujas desechables o bistur.
TCNICA DE LA PUNCIN:
Se frota bien el sitio elegido para la puncin con una torunda humedecida en alcohol para
remover la suciedad, el detritus epitelial y para aumentar la cantidad de sangre en este sitio.
Cuando la piel este seca y se haya reanudado la circulacin, hacer una puncin de 2-3 mm.
de profundidad con la lanceta. Si se saca del lbulo de la oreja, la puncin se har en el borde
libre del lbulo y no en la superficie.
La primera gota de sangre que salga se desecha por tener lquido hstico, la segunda se
colecta para el examen. La sangre no debe exprimirse para que no se diluya con el lquido
de los tejidos, se puede hacer un poco de presin a distancia del pinchazo.
Una vez extrada la sangre necesaria, aplicar en el lugar del pinchazo una torunda,
mantenindola ah hasta que cese el sangrado.
SANGRE VENOSA: Es de importancia por ser una fuente para el anlisis de sangre y como
va de introduccin de diversos agentes teraputicos, entre ellos la sangre misma.
MATERIAL.
Jeringa de plstico desechable de 5 ml
Aguja calibre 21 o 22.
Ligadura.
Torundas humedecidas con alcohol.
Anticoagulantes (puede ser EDTA, oxalatos, citratos o heparina).
Christian Gallegos Palermo
[63]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICA DE PUNCIN:
Utilizar un torniquete de goma para aumentar la presin venosa y para hacer resaltar las
venas, facilitando la puncin. Evitar que esta presin no se mantenga ms de lo necesario.
Despus de limpiar la piel con una torunda, humedecida con alcohol, se deja secar. Es
conveniente aplicar el torniquete mientras se est secando el alcohol.
Se fija en posicin la vena, esto se realiza sosteniendo el brazo del paciente con la mano
mientras se estiran y comprimen con el dedo pulgar los tejidos blandos situados debajo del
sitio elegido para la puncin. El dedo ndice deber descansar sobre el casquillo de la aguja,
que adems servir de gua.
Si la vena es prominente, pinchar con un slo golpe directo sobre la piel y vena, resulta
menos doloroso.
Cuando es difcil encontrar las venas se realiza en dos tiempos:
1. Primero se pincha la piel cerca de la vena y luego la vena misma, si se ha acertado, aparecer
la sangre en la jeringa.
2. A continuacin se puede aflojar un poco el torniquete si la sangre fluye libremente, de no
ser as, se dejar como estaba hasta obtener la cantidad de sangre necesaria (5 ml
aproximadamente). Se suelta el torniquete, se retira la aguja y se oprime ligeramente el sitio
del pinchazo con una torunda.
La sangre obtenida se transfiere rpidamente a tubos con anticoagulante y se homogeneiza
perfectamente. Si la sangre no se utiliza deber refrigerarse a 4C.
ANTICOAGULANTES.
Los ms usados son:
1. Mezcla de oxalato de amonio (6 partes) y potsico (4 partes), a una concentracin de 2 mg/ml
de sangre.
2. Citrato trisdico en solucin acuosa al 3.8 % mezclado en porcin de 1:9 con sangre.
3. EDTA (sal disdica o dipotsica de tetracetato de etilendiamina) a dosis de 1 a 2 mg/ml de
sangre.
Christian Gallegos Palermo
[64]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
OBTENCIN Y PROCESAMIENTO DE MUESTRAS DE
SANGRE EN EL LABORATORIO DE PARASITOLOGA.
La sangre en el laboratorio de parasitologa es un producto biolgico de utilidad para la
deteccin de diversos tipos de parsitos, ya sea porque sus estructuras pueden ser observadas
directamente o bien se muestran en forma indirecta al detectarse anticuerpos en el suero
mediante un examen inmunolgico.
La sangre se obtiene regularmente mediante puncin venosa siendo la vena radial la ms
comnmente utilizada para tal efecto, si el volumen requerido es de vario mililitros podemos
usar jeringas o tubos al vaco, recomendndose el uso de agujas del 20 o 21. Los tubos en que
se colecte la sangre debern adicionarse con un anticoagulante para poder procesar
adecuadamente la muestra, se puede utilizar cualquiera de los de uso comn (heparina, citratos,
u oxalato de amonio), el de uso ms comn es el EDTA y se usa en proporcin de 2 mg/ml de
sangre, debiendo agitarse cuidadosamente los tubos despus de depositar en ellos la muestra de
sangre y se recomienda que las muestras sean procesadas con la mayor brevedad dado que la
estabilidad de las mismas as como de los parsitos que pudiera contener es muy breve. En
algunos casos la cantidad de sangre que se requiere es mnima por lo que puede bastar con hacer
una puncin superficial en un dedo o en el lbulo de la oreja, siendo necesario en este caso el
procesamiento inmediato.
Como ya se sabe si el objeto es obtener una muestra de suero no deber adicionarse a la
muestra anticoagulante y ser necesario, despus de un momento, separar el suero para evitar
que la hemlisis del coagulo afecte su aspecto y propiedades. Cuando esto se requiera, en primer
lugar se recomienda que despus de depositar la sangre en el tubo, dicho tubo se mantenga
inclinado, Posteriormente deber colocarse en bao mara a 37C ya que esto favorece la
concentracin del coagulo y la separacin de una mayor cantidad de suero, el cual despus de 5
minutos puede ser extrado mediante una pipeta, el suero se puede mantener en condiciones de
congelacin por tiempo indefinido.
La sangre completa se puede preservar por algunas horas en refrigeracin (mximo 1 da).
En el laboratorio de parasitologa, el procesamiento depende del parsito que se busca,
siendo el procedimiento ms comn la extensin de sangre (frotis sanguneo) para observar las
estructuras parasitarias, existen varios procedimientos para hacer dichas extensiones.
Christian Gallegos Palermo
[65]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
PROCEDIMIENTOS PARA LA ELABORACIN DE EXTENSIONES DE SANGRE.
a) TCNICA DE LOS PORTA OBJETOS. Para poder utilizar dichos porta objetos se
requiere que de preferencia sean nuevos y que hayan sido sometidos al proceso de
desengrasado el cual se puede lograr depositndolos en una mezcla de alcohol ter (7 partes
de alcohol etlico por 3 parte de ter).
Los porta objetos se secan comprobando que no tengan ningn residuo en la superficie. A
continuacin se deposita una gota pequea de sangre en el extremo de un porta objetos y de
inmediato se coloca el borde de otro por delante de la gota de sangre acercndolo para que haga
contacto y que por capilaridad se extienda entre las dos superficies (para una adecuada extensin
el segundo porta objetos debe formar un ngulo de 45 con respecto del otro), una vez que se
logra esto se desliza el porta objetos con un impulso firme y continuo procediendo de inmediato
a secar la extensin la cual debe quedar homogneamente realizada y delgada (los bordes de los
porta objetos deben estar melladas ya que afectan la extensin).
Existe otra forma colocando la muestra en el centro de uno de los porta objetos, colocando
encima el otro porta objetos y jalndolo para dejar la extensin en el canto de los porta objetos.
b) TCNICA CON CUBRE OBJETOS: En esta tcnica se utilizan cubre objetos cuadrados
colocando en uno de ellos la gota de sangre y haciendo contactar con otro, permitiendo de
este modo que por capilaridad se distribuya entre los cubre objetos la sangre, una vez que
ocurre esto se separan jalando lateralmente imprimiendo un impulso firme, una vez que se
separan los cubre objetos se secan lo ms rpidamente posible al aire (un secado lento puede
modificar la forma de las clulas sanguneas). El frotis se deben fijar tambin en forma
inmediata, y el fijador adecuado es el alcohol metlico absoluto, el cual se deposita sobre el
frotis y debe permanecer uno a tres minutos en contacto con l.
c) TCNICA DE LOS DOS PORTA OBJETOS (FROTIS GRUESO). Este mtodo sirve
para obtener una densidad parasitaria superior. En esta tcnica se deposita una gota de sangre
en el extremo de un porta objetos y hacer una extensin uniforme con la ayuda de otro porta
objetos de ngulos redondeados o con un cubre objetos formado con ambos un ngulo de
60 aproximadamente. Secar el frotis y teirlo.
Christian Gallegos Palermo
[66]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TCNICA DE LA GOTA GRUESA.
Tcnica til para la identificacin de hemoparsitos, cuando escasean los parsitos o los
frotis delgados son negativos, aunque su lectura es ms tardado y la interpretacin delicada.
Se colocan 3 gotas de sangre, de similar tamao a la usada para hacer una extensin delgada,
cerca una de la otra en un extremo del porta objetos.
Con la esquina de otro porta objetos, se mezclan las tres gotas, en una zona de 2 cm de
dimetro. Se contina el movimiento por 30 segundos para evitar la formacin de redes de
fibrina. Dejar secar el frotis y teirlo.
FIJACIN DE FROTIS SANGUINEOS.
La fijacin de frotis se realiza antes de teir los frotis sanguneos. Los colorantes que se
disuelven el alcohol metlico, como el colorante de Wright, fija y tie a la vez. Con los colorantes
acuosos hay que emplear agentes qumicos o calor antes de aplicar el colorante.
FIJACIN QUMICA.
Sumergir el frotis en cualquiera de estos compuestos:
Metanol puro o etanol, durante uno o dos minutos.
Partes iguales de alcohol absoluto y ter, por 15 minutos.
Solucin al 1 % de cloruro mercrico o formalina en alcohol por 1 minuto.
Despus de la fijacin con cloruro mercrico hay que lavar bien el frotis con agua destilada.
TCNICAS DE TINCIN DE EXTENSIONES DE SANGRE.
1. TCNICA DE WRIGHT: Esta tcnica es utilizada para demostrar la presencia de las
diversas fases de los protozoarios y helmintos presentes en la sangre las cuales se diferencian
por el contraste que se logra y por la diferencia de apetencia a los colorantes en las clulas
de estructuras parasitarias.
MATERIA
Frotis fijado o sin fijar.
Colorante de Wright (ver anexo de reactivos).
Solucin amortiguadora.
Christian Gallegos Palermo
[67]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
DESARROLLO.
En esta tcnica debido a que se utiliza como vehculo al alcohol metlico no se requiere
de la fijacin previa si los frotis son recientes, por lo que al mismo tiempo que se tien se fijan.
Los frotis se cubren con el colorante el cual debe de permanecer por un lapso de 3 a 6 minutos
en contacto, despus de lo cual se cubre con una solucin amortiguadora en una cantidad
semejante a la del colorante, se lava a chorro de agua y se seca a temperatura ambiente.
Las preparaciones se observan al microscopio con el objetivo de inmersin.
2. TINCIN DE GIEMSA. Coloracin til para detectar protozoarios y microfilarias en la
sangre.
MATERIAL Y REACTIVOS.
Cajas de petri.
varillas de vidrio en forma de V.
Colorante diluido de Giemsa.
Alcohol metlico absoluto o alcohol etlico.
Agua destilada.
Solucin de Tritn X-1000 al 0.1 y 0.01 %
Aceite de inmersin.
Microscopio compuesto.
DESARROLLO.
Colocar los frotis sobre la varilla de vidrio en una caja de petri, fijarlos con alcohol metlico
o etlico por 2 3 minutos para evitar la deshemoglobinizacin, sumergir el frotis ya fijado por
un tiempo de 10 a 30 minutos en el colorante, se lava con agua destilada y se seca al aire o con
papel absorbente que no deja pelusa y observamos al microscopio con el objetivo de inmersin.
NOTA: Los frotis de gota gruesa no necesitan de ser fijadas por lo que no requieren la
deshemoglobinizacin.
Christian Gallegos Palermo
[68]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Para obtener mejores detalles morfolgicos, adicionar al colorante de Giemsa una
solucin al 0.01% de Tritn X-100 para frotis delgado; y para frotis de gota gruesa la misma
solucin a una concentracin del 0.1%.
3. TINCIN DE MAY-GRUNWALD-GIEMSA. Esta tincin tie poco los ncleos y es
menos efectiva que la tincin de Wright para la identificacin de Plasmodium por lo que no
produce la llamada coloracin de Romanowsky.
MATERIAL Y REACTIVOS.
Cajas de petri.
Varillas de vidrio en forma de "V".
Cuentagotas.
Colorante de Jenner (May-Grunwald).
Colorante de Giemsa.
Agua destilada.
DESARROLLO.
Se coloca el frotis seco y sin fijar sobre la varilla en una caja de petri y se cubren totalmente
con el colorante de May-Grunwald usando el cuentagotas, dejarlo durante un minuto, quitar el
lquido y teir durante 15 minutos con solucin de Giemsa diluida, lavar con agua destilada
hasta quitar totalmente el colorante, secar rpidamente y observar al microscopio con el objetivo
de inmersin.
Christian Gallegos Palermo
[69]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
APNDICE.
PREPARACIN DE REACTIVOS DE USO COMN EN EL
LABORATORIO DE PARASITOLOGIA
1. SOLUCIN DECOLORANTE DE CIDO ACTICO
Etanol al 95%
cido actico glacial (CH 3 COOH)
Agua destilada
600 ml
4 ml
350 ml
Verter el etanol al 95% dentro de una probeta de 1000 ml. Adicionar agua destilada hasta
hacer un total de 950 ml. Verter en un matraz de 1000 ml. Adicionar el cido actico glacial y
mezclar.
Etiquetar el matraz: ALCOHOL ACIDO DECOLORANTE y escribir la fecha.
Almacenar dentro de una caja o en un gabinete especial. Esta solucin durar un ao o ms.
PRECAUCIN: El cido actico glacial es altamente corrosivo.
2. SOLUCIN DE AZUL DE METILENO AMORTIGUADA.
Solucin A (solucin de cido actico)
cido actico glacial (CH 3 COOH)
Agua destilada
1.2 ml
98.8 ml
Medir 98.8 ml de agua destilada en una probeta, agregar 1.2 ml de cido actico glacial
y mezclar bien. Almacenar en un matraz limpio.
PRECAUCIN: El cido actico glacial es altamente corrosivo.
Solucin B (solucin de acetato de sodio)
Acetato de sodio (CH 3 COONa)
1.6 g
Si se usa acetato de sodio trihidratado (CH 3 COONa.3H 2 O)
2.6 g
Agua destilada
Christian Gallegos Palermo
100 ml
[70]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Medir los 100 ml de agua destilada en una probeta. Pesar 1.6 g de acetato de sodio (o 2.6
g de acetato de sodio trihidratado) y disolver en el agua, mezclar por completo. Guardar en un
matraz limpio.
Solucin de trabajo (para tincin)
Solucin A (solucin de cido actico)
46.3 ml
Solucin B (solucin de acetato de sodio)
3.7 ml
Colorante de Azul de Metileno
0.5 ml
Agua destilada
50 ml
Verter los 50 ml de agua destilada dentro de un frasco de aproximadamente 150 o 200
ml de capacidad. Agregar las soluciones A y B y mezclar bien. Agregar 0.5 g, de colorante de
azul de metileno y agitar hasta que el colorante se haya disuelto. Si el colorante no se disuelve
en 15 minutos, la solucin debe filtrarse. Verter o filtrar dentro de un matraz limpio con tapn y
etiquetar la solucin: Solucin de Azul de Metileno Amortiguada. Escribir la fecha en la
etiqueta. Esta solucin se puede mantener indefinidamente. Si se precipita el colorante y se
depositan las partculas en el fondo del matraz, se debe filtrar. Alicuotar una pequea cantidad
(20 ml) dentro de un frasco gotero para uso diario. El frasco gotero debe tener una pipeta con
bulbo de hule.
NOTA: Un pH de 3.6 de la solucin amortiguadora de acetato es ms ideal para este colorante.
3. SOLUCIN AMORTIGUADORA PARA TINCIN DE GIEMSA.
Una solucin amortiguadora de fosfatos con un pH balanceado de 7.2 es esencial para la
tincin de Giemsa de parsitos de malaria.
Preparacin de la solucin para uso diario
Disolver 1.0 g, de fosfato de sodio (Na 2 HPO 4 ) y 0.7 g fosfato de potasio (KH 2 PO 4 ) en un
litro de agua desionizada.
Checar el pH con un potencimetro o con papel indicador.
Si el pH est por debajo de 7.2 agregar pequeas cantidades de solucin al 2% de Na 2 HPO 4
y si est por arriba de 7.2 de sodio (o 2.6 g de acetato de sodio trihidratado) y disolver en el
agua, mezclar por completo. Guardar en un matraz limpio.
Christian Gallegos Palermo
[71]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Cuando el pH quede ajustado a 7.2, almacenar en un frasco con tapn, preferiblemente de
color mbar y colocarlo en un lugar fro y alejarlo de los rayos del sol.
Esta solucin permanecer en buen estado por algunas semanas. Es necesario revisar la
solucin regularmente en busca de contaminantes o precipitacin de cristales. Esto ltimo
se puede evitar agitando la solucin.
Preparacin de la solucin madre concentrada (til para trabajo de campo o para envo a
laboratorios o unidades de salud perifricas).
Disolver 3.0 g Na 2 HPO 4 anhidro y 2.1 g de KH 2 PO 4 en 25 ml de agua desionizada.
Ajustar el pH a 7.2 como se describe en el punto 3 de la solucin anterior.
Almacenar en un frasco mbar lejos de los rayos del sol. La solucin permanecer en buen
estado por unas semanas.
Para hacer la solucin de trabajo diluya a 1 ml del concentrado con 20 ml de agua
desionizada.
Preparacin de paquetitos prepesados.
Las dos sales de fosfato pueden ser prepesadas y ponerse juntas en un tubo limpio y
etiquetado o en una bolsa de plstico bien sellada. Para hacer la solucin agregar el contenido
de los paquetitos a un litro de agua y ajustar el pH a 7.2.
4. SOLUCIN CARBOL-FUCSINA.
Fucsina bsica
10 g
Etanol absoluto
100 ml
Fenol (carbol)
50 g
Agua destilada
1 lt
Preparacin.
Pesar la Fucsina bsica y verter en una botella de 1.5 lt.
Adicionar 100 ml de Etanol absoluto y disolver el colorante por completo.
Adicionar la solucin acuosa de Fenol a la solucin del colorante y mezclar bien.
Agregar el resto del agua, mezclar bien y etiquetar la botella. La solucin permanecer
estable indefinidamente.
NOTA: El etanol es inflamable y el fenol es txico y corrosivo.
Christian Gallegos Palermo
[72]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
5. SOLUCIN CARBOL-XILENO.
Nota: Esta debe prepararse en un laboratorio a nivel intermedio ya que el reactivo
involucrado es peligroso. Quitar la tapa del frasco de cristales de Fenol (cido carbnico)
y colocar el frasco en bao de agua. NO CALENTAR LOS CRISTALES DE FENOL
DIRECTAMENTE SOBRE LA FLAMA, SIEMPRE COLOCAR EL FRASCO DEL
FENOL DENTRO DE UN BAO DE AGUA.
Fenol lquido
200 ml
Xileno
600 ml
Medir el Fenol lquido y verterlo dentro de una botella de vidrio de 1000 ml con tapn.
Agregar el Xileno. Usar de preferencia una botella de Xileno que no haya sido destapado.
Mezclar agitando la botella.
Etiquetar la botella: CARBOL-XILENO y escribir la fecha. Almacene en una gaveta o
en algn sitio alejado de la luz directa.
Esta solucin permanecer en buen estado por un ao o ms pero la botella deber estar
bien tapada. Puede usarse cinta adhesiva para evitar que penetre la humedad. Si la humedad
penetra, la solucin no ser satisfactoria.
PRECAUCIN: El fenol es ligeramente corrosivo y venenoso.
6. COLORANTE DE HEMATOXILINA DE DELAFIELD.
Cristales de Hematoxilina
1g
Etanol absoluto
10 ml
Solucin saturada de sulfato de amonio de
aluminio (NH 4 Al(SO 4 ) 2 ) en agua destilada
100 ml
Glicerol ( C 3 H 5 (OH) 3
25 ml
Metanol absoluto
25 ml
Disolver los cristales de Hematoxilina en el Etanol absoluto. Agregar unas cuantas gotas
de la solucin saturada de sulfato de amonio de aluminio. Dejar sta solucin expuesta
Christian Gallegos Palermo
[73]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
directamente a la luz solar o en una incubadora a 37 C por tres o cuatro meses hasta oxidar la
Hematoxilina a Hemateina.
Tapar y etiquetar la botella: HEMATOXILINA DE DELAFIELD y escribir la fecha.
Antes de utilizarse filtrar de nuevo y agregarse el glicerol y el alcohol metlico. Mantener tapada
la botella para evitar la evaporacin. Este colorante permanecer en buen estado hasta por 18
meses.
7. ETANOL al 70 %.
Etanol al 95 %
726 ml
Agua destilada
274 ml
Verter el Etanol en una probeta graduada de 100 ml. Agregar el agua destilada hasta
hacer un total de 1000 ml. Verter a una botella de vidrio. Etiquetar la botella: ALCOHOL AL
70% y escribir la fecha. Esta solucin permanece en buen estado indefinidamente pero mantenga
la botella bien cerrada. Almacene en una gaveta o en algn lugar seguro.
PRECAUCIN: el Etanol es inflamable.
8. FIJADOR ALCOHOL-TER.
ter
20 ml
Etanol al 95 %
20 ml
Agregar el ter al alcohol en una probeta graduada y mezclar. Verter en un frasco con tapn
de rosca o tapn de seguridad.
Precaucin: El ter el altamente inflamable y potencialmente explosivo.
9. COLORANTE DE FIELD.
Colorante A de Field.
Preparacin a partir de cristales:
Cristales A de Field
5.9 g
Agua destilada caliente
600 ml
Christian Gallegos Palermo
[74]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Mezclar hasta disolver. Filtrar cuando se encuentra fra la solucin.
Preparacin a partir de colorantes originales y qumicos.
Azul de Metileno (medicinal)
1.6 g
Azur I
1.0 g
Fosfato de sodio dibsico anhidro (Na 2 HPO 4 )
10.0 g
Fosfato de potasio monobsico (KH 2 PO 4 )
12.5 g
Agua destilada
1000 ml
Disolver las dos sales en agua. Verter cerca de la mitad de la solucin de Fosfato dentro
de una botella de un litro, que contenga perlas de vidrio. Agregar el colorante en cristales y
mezclar bien. Agregar el resto de la solucin de fosfato. Mezclar bien y filtrar.
Colorante B de Field.
Preparacin a partir de cristales:
Cristales B de Field
4.8 g
Agua destilada caliente
600 ml
Mezclar hasta disolver y filtrar cuando se enfre.
Preparacin a partir de colorantes originales y qumicos.
Eosina (soluble en agua, color amarillo)
Fosfato de sodio dibsico anhidro (Na 2 HPO 4 )
10.0 g
Fosfato de potasio monobsico (KH 2 PO 4 )
12.5 g
Agua destilada
2.0 g
1000 ml
Disolver las dos sales en agua. Verter en una botella de un litro. Agregar la Eosina.
Mezclar hasta disolver y filtrar.
10. SOLUCIONES DE FORMOL.
Solucin de Formol al 10 % para preservar materia fecal.
Formalina (Formaldehdo neutral al 37 %)
100 ml
Agua destilada
900 ml
Christian Gallegos Palermo
[75]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Medir la solucin de Formol acuosa en una probeta graduada y verter en una botella con
tapn de vidrio o de rosca. Agregar el agua destilada a la botella y mezclar.
Etiquetar la botella: FORMALINA AL 10 % y escribir la fecha. Almacenar en una
gaveta. La solucin permanecer en buen estado por dos aos o ms.
Formol al 2 % (Mtodo de concentracin para microfilaria).
Formalina (Formaldehdo neutral al 37 %)
Agua destilada
20 ml
980 ml
Medir la solucin de Formalina acuosa en una probeta graduada de 1000 ml y verter en
una botella con tapn de vidrio o de rosca. Agregar agua destilada a la botella y mezclar.
Etiquetar la botella: FORMALINA AL 2 % y escribir la fecha. Almacenar en una gaveta. La
solucin permanecer en buen estado por dos aos o ms.
PRECAUCIN: La Formalina es corrosiva y venenosa.
11. COLORANTE DE GIEMSA (SOLUCIN MADRE).
El colorante de Giemsa es el ms usado en las rutinas de tincin de sangre para el
diagnstico de malaria. Sin embargo, la calidad de este colorante, en la forma de solucin o de
cristales vara de acuerdo a la fuente y se puede obtener de cualquier fabricante con buena
reputacin. Por lo tanto es necesario establecer la calidad de cada lote recibido y peridicamente
durante su uso revisarlo.
Cristales de Giemsa
0.75 g
Metanol
65.00 ml
Glicerol
35.00 ml
Para almacenar la solucin hay que usar un frasco mbar perfectamente limpio y seco, de vidrio
grueso o polietileno.
Colocar perlas de vidrio de 5 ml de dimetro en la botella, verter la cantidad medida de
Metanol y agregar los cristales de colorante.
Christian Gallegos Palermo
[76]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Cerrar la botella. Permitir que los cristales de colorante se derramen suavemente en el
Metanol hasta que se depositen en el fondo, luego agitar la botella en forma circular, de 3 a
4 minutos.
Agregar la cantidad medida de Glicerol y repetir el proceso de agitacin. Contine agitando
por 2 o 3 minutos a intervalos hasta de media hora, 6 veces.
Dejar la botella por 3 o 4 das. Agitar la botella 3 o 4 veces cada da hasta que el colorante
este completamente mezclado.
Mantener la solucin madre en una pequea botella cubierta con papel para mantenerla
sin luz. Cada preparacin nueva del colorante debe etiquetarse adecuadamente, incluyendo la
fecha de preparacin y debe examinarse la dilucin ptima del colorante, as como el tiempo de
tincin. Mantener siempre la botella tapada, en un lugar fro y alejado de la luz solar. Cubrir la
botella con un papel oscuro para mantenerla cubierta contra la luz.
12. SOLUCIN GLICEROL VERDE DE MALAQUITA O GLICEROL AZUL DE
METILENO.
Glicerol
Solucin acuosa de Verde de Malaquita
Azul de Metileno al 3 %
Agua destilada
100 ml
1 ml
100 ml
Para preparar la solucin: verter 1 ml de solucin acuosa al 3% en una botella de 250 ml.
Agregar 100 ml de Glicerol y 100 ml de agua destilada, y selle la botella; mezclar antes de
usarse.
13. SOLUCIN CIDO CLORHDRICO-ETANOL.
cido Clorhdrico (concentrado)
Etanol al 95 %
1 ml
100 ml
Poner los 100 ml de Etanol al 95 % en un frasco de 250 ml con tapn de vidrio. Agregar
un ml de cido clorhdrico y mezclar.
PRECAUCIN: El cido clorhdrico es altamente corrosivo. El Etanol es inflamable.
Christian Gallegos Palermo
[77]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
14. SOLUCIN CIDO CLORHDRICO-METANOL.
cido clorhdrico (concentrado)
3 ml
Metanol absoluto
100 ml
Poner los 100 ml de Metanol absoluto en un frasco de 250 ml con tapn de vidrio.
Agregar 3 ml del cido clorhdrico y mezclar.
PRECAUCIN: El cido clorhdrico es altamente corrosivo. El Metanol es inflamable.
15. SOLUCIN CIDO CLORHDRICO-DECOLORANTE.
cido clorhdrico (concentrado)
Agua destilada
0.5 ml
100 ml
Medir la cantidad de agua destilada y verter en una botella de 1000 ml con tapn de
vidrio. Agregar cido clorhdrico. Mezclar completamente. Etiquetar la botella: 0.5 % y escribir
la fecha.
PRECAUCIN: El cido clorhdrico es altamente corrosivo.
16. SOLUCIN ALCOHOL YODADO.
Etanol al 70 %
Cristales de Yodo, unos cuantos.
40 ml
Verter el Etanol al 70 % en un pequeo frasco. Usar dos aplicadores de madera, recoja
con stos los cristales de Iodo y agregarlos al alcohol. Agitar la mezcla y agregar ms Yodo, si
es necesario hasta que la solucin tenga un color T oscuro. El color es importante.
El propsito de la solucin de alcohol-yodado es quitar el cloruro mercrico de la
fijacin. Y debe ser lo suficientemente fuerte para hacerlo, en caso contrario los residuos de
cloruro mercrico en la preparacin interferir con el examen. Si la solucin es excesivamente
fuerte, el Yodo penetra en el protozoario y no se puede teir con la solucin tricrmica.
Etiquetar la botella: SOLUCIN DE ALCOHOL-YODADO, y escribir la fecha. La solucin
de alcohol-yodado debe prepararse cada tres semanas para estar fresca.
Christian Gallegos Palermo
[78]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
17. LUGOL (SOLUCIN MADRE AL 5%).
Yodo
5 g
Yoduro de potasio (KI)
10 g
Agua destilada
ms de 100 ml
Pesar el Yodo en un mortero o un vidrio de reloj. Moler el Yodo y el cloruro de potasio
en un mortero. Agregar unos pocos mililitros de agua al mismo tiempo que se muele hasta
disolver por completo. Poner la solucin en un frasco mbar con el agua destilada que sobre.
ALTERNATIVO: Disolver el yoduro de potasio en cerca de 30 ml de agua. Agregar el yodo y
mezclar bien hasta disolver. Adicionar otros 70 ml de agua y mezclar bien. Almacenar en un
frasco mbar.
18. LUGOL (SOLUCIN AL 1 % PREPARACIN EN FRESCO)
La solucin madre de lugol es muy fuerte para las preparaciones en fresco de la materia
fecal, aglutinacin de la materia fecal y los organismos quedan atrapados y se pierden. Por lo
tanto, la solucin madre debe diluirse.
Lugol (solucin madre al 5%) (No. 17)
5 ml
Solucin salina isotnica (No. 24)
20 ml
Medir la solucin salina isotnica dentro de un frasco gotero. Agregar la solucin madre
al 5%. Mezclar completamente. Esto dar como resultado una solucin al 1% lo cual ser
satisfactorio para teir los quistes.
Etiquetar la botella: LUGOL y escribir la fecha. La solucin al 1% debe prepararse cada 14
das.
19. SOLUCIN AZUL DE METILENO-FOSFATO
Cristales de Azul de metileno
Fosfato de sodio dibsico (Na 2 HPO 4 )
3g
Fosfato de potasio monobsico (KH 2 PO 4 )
1g
Agua destilada
Christian Gallegos Palermo
1g
[79]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Pesar el azul de metileno y colocarlo en un mortero limpio.
Agregar el fosfato de sodio y el fosfato de potasio. Macerar el colorante con el pistilo, mezclar
con las sales. Pesar porciones de 1 g de la mezcla molida, envasar en viales y taparlos bien.
Etiquetar los viales: Azul de metileno-fosfato y escribir la fecha.
La mezcla seca se conservar por mucho tiempo si los viales estn bien sellados. Poner una cinta
adhesiva alrededor del tapn para sellar bien el vial y mantenerlo sin humedad.
Para preparar la solucin
Poner un gramo de la mezcla en un matraz de 500 ml. Agregar agua destilada y agitar el
frasco hasta disolver la mezcla seca-sales. Filtrar con un papel filtro a una botella de 500 ml seca
y limpia con tapn de vidrio. Etiquetar la solucin azul de metileno-fosfatos y escribir la fecha,
guardar en una gaveta.
20. SOLUCIN SALINA-AZUL DE METILENO.
Azul de metileno
1g
Solucin salina isotnica
100 ml
Pesar el azul de metileno y transferirlo a un frasco limpio. Agregar la solucin salina y
mezclar los cristales de colorante hasta que estn completamente disueltos.
Para usar: Filtrar una pequea cantidad de la solucin colorante en un frasco gotero.
21. SOLUCIN IODURO DE POTASIO AL 10%
Ioduro de potasio
100 g
Agua destilada
1000 ml
Pesar el Ioduro de potasio. Poner el agua destilada en una botella limpia con tapn de
vidrio. Disolver el Ioduro de potasio en el agua.
Etiquetar la botella: IODURO DE POTASIO y escribir la fecha. (Poner un pedazo de papel en
la botella para prevenir el depsito de cristales en el tapn. Almacenar en una gaveta o en un
Christian Gallegos Palermo
[80]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
lugar que lo proteja de la luz. Con el tiempo la solucin se colorea ligeramente, de amarillo, pero
esto no interfiere con su uso.
22. PVA - PREPARACIN DE FIJADOR.
NOTA: Esta solucin debe prepararse en un laboratorio a nivel intermediario, porque los
reactivos involucrados son peligrosos.
FIJADOR MODIFICADO DE SCHAUDINN.
Cristales de cloruro mercrico (HgCl 2 )
Etanol al 95 %
31.0 ml
cido actico glacial
5.0 ml
1.5 g
Disolver El cloruro mercrico en el etanol en un matraz con tapn (50 o 125 ml) agitando
a diferentes intervalos. Agregar el cido actico, tapar y mezclar inmediatamente.
PRECAUCIN: El cloruro mercrico es altamente venenoso. El cido actico glacial es
altamente corrosivo.
MEZCLA DE PVA
Glicerol
1.5 ml
Cristales de alcohol polivinlico (PVA)
5g
Agua destilada
62.5 ml
Con una pequea esptula en cuchara, agregar el glicerol a los cristales de PVA y mezclar
con una varilla de vidrio hasta cubrir todas las partculas con el glicerol. Escoger la mezcla en
un frasco de 125 ml. Agregar agua destilada, tapar y dejar a temperatura ambiente por dos horas
o toda la noche. Invertir la mezcla ocasionalmente para mezclar.
Los cristales de PVA y la solucin fijadora de PVA estn disponibles en diferentes
fuentes comerciales. Hay muchos grados de pureza del polvo de PVA, aquellos con alta
Christian Gallegos Palermo
[81]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
hidrlisis y baja o media viscosidad son los ms indicados para preparar la mezcla de fijador
PVA para los protozoarios.
PVA - Solucin fijadora de trabajo
Poner en bao de agua o en bao mara a 70 75 C. Ajustar el calor para mantener la
temperatura en este rango.
Poner el frasco que contiene la mezcla de PVA en el bao por cerca de 10 minutos, con el
tapn flojo agitando frecuentemente.
Cuando los cristales de PVA estn completamente disueltos verter en la solucin modificada
de Schaudinn. Tapar nuevamente y agitar la mezcla.
Contine agitando la mezcla en el bao por 2 3 minutos para disolver el PVA remanente,
para eliminar las burbujas y aclarar la solucin.
Quitar el frasco del bao y dejar enfriar. Almacenar la solucin de PVA en una botella con
tapn de vidrio.
Etiquetar: FIJADOR DE PVA y escribir la fecha. El fijador se conservar de 6 a 12 meses.
Para mezclar bien la solucin de fijador es ideal contar con un agitador de alta velocidad.
23. SOLUCIN DE SAFRANINA.
Solucin madre
Safranina O
2.5 g
Etanol al 95 %
100 ml
Pesar los cristales secos y disolver en 100 ml de Etanol. Almacenar en un frasco etiquetado.
Solucin de trabajo.
Solucin madre
10 ml
Agua destilada
90 ml
24. SOLUCIN SALINA ISOTNICA.
Cloruro de sodio (NaCl)
Christian Gallegos Palermo
8.5 g
[82]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Agua destilada
1000 ml
Pesar el Cloruro de sodio. Medir la cantidad de agua destilada en un frasco limpio con
tapn de vidrio. Disolver el Cloruro de sodio en el agua y mezclar completamente. Poner una
pieza de cuerda o papel entre el cuello de la botella y el tapn de vidrio para evitar el depsito
de cristales.
Etiquetar la botella: SOLUCION SALINA ISOTNICA y escribir la fecha. Almacenar en una
gaveta. Verter un poco de solucin salina en un frasco gotero para el uso cotidiano. Escribir la
fecha en la etiqueta. El frasco debe tener una pipeta con frasco de goma.
25. FIJADOR DE SCHAUDINN.
NOTA: Esto debe prepararse en un laboratorio a nivel intermedio, ya que los reactivos
involucrados son peligrosos.
Solucin madre
Solucin saturada de cloruro mercrico (HgCl 2 )
Etanol al 95 %
600 ml
300 ml
Medir la cantidad de solucin saturada de Cloruro mercrico en un frasco con tapn de vidrio
de 1 Lt. Agregar El Etanol al 95 % y mezclar agitando el frasco.
Etiquetar el frasco: FIJADOR MADRE DE SCHAUDINN y escribir la fecha. La solucin
madre permanecer en buen estado indefinidamente (1 ao o ms).
Solucin de trabajo para tincin
Solucin madre fijadora de Schaudinn
cido actico glacial (CH 3 COOH)
100 ml
5 ml
Medir la solucin madre fijadora de Schaudinn y verter en un matraz de 250 ml. Agregar
el cido actico glacial y mezclar agitando el matraz.
Christian Gallegos Palermo
[83]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Etiquetar el matraz: FIJADOR DE SCHAUDINN CON ACIDO ACTICO y escribir la fecha.
Esta solucin permanecer en buen estado por 2 3 meses.
Precaucin: El cloruro mercrico es muy venenoso. El cido actico glacial es muy corrosivo.
El alcohol Etlico es muy inflamable.
26. SOLUCIN DE CITRATO DE SODIO AL 2%.
Cristales de citrato de sodio (C 6 H 5 O 7 Na 3 .2H 2 O)
Agua destilada
20 g
1000 ml
Medir la cantidad de agua destilada y verter en un frasco limpio con tapn de vidrio.
Pesar el citrato de sodio y agregar el agua. Agregar agua hasta disolver.
Etiquetar el frasco: SOLUCION DE CITRATO DE SODIO AL 2% y escribir la fecha.
Almacenar en una gaveta. La solucin permanecer en buen estado por un ao o ms.
27. SOLUCIN COLORANTE TRICRMICO.
Cromotrope 2R
6.0 g
Verde luz SF
1.5 g
Verde rpido FCF
1.5 g
Cristales de cido fosfotngstico (H 3 [PO 4 (W 12 O 36 )].5H 2 O).
cido actico glacial (CH 3 COOH)
10 ml
Agua destilada
1000 ml
7.0 g
Pesar cada colorante separadamente. Juntar los colorantes en un matraz de un litro. Medir
la cantidad de cido actico glacial y verter en el matraz. Agitar hasta que el cido actico moje
los colorantes. Dejar reposar 30 minutos. Agregar agua destilada y mezclar. Verter el colorante
en un frasco de un litro con tapn de vidrio.
Etiquetar el frasco: COLORANTE TRICRMICO y escribir la fecha. Almacenar en una
gaveta o en algn lugar que lo cubra de la luz. Un buen colorante de Tricrmico da un color
prpura oscuro. El colorante se mantendr en buen estado por un ao o ms.
Christian Gallegos Palermo
[84]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Precaucin: El cido actico glacial es altamente corrosivo.
28. JUGO GSTRICO ARTIFICIAL
Se mezclan pepsina al 1% y cido clorhdrico al 0.5% esta solucin se emplea para digerir
tejidos usando 100 ml del jugo por cada 10 g de tejido que se pretenda digerir, los tejidos se
depositan en gasa y la digestin se desarrolla al menos por 24 horas.
29. MTODO ORIGINAL DE HEIDENHAIN
1. Los frotis, convenientemente fijados y tratados por el alcohol a 96%, pasan a alcohol a 70%,
al que se le ha aadido yodo hasta darle color de vino de Oporto, durante 30 minutos.
2. Alcohol a 70%, puro, 30 minutos.
3. Alcohol a 50%, 30 minutos.
4. Alcohol a 30 %, 30 minutos.
5. Lavar en agua destilada.
6. Pasar al mordente, que es una solucin de alumbre de hierro (sulfato doble de aluminio y de
hierro, en cristales de color violeta) al 4% en agua destilada, 12 horas.
7. Lavado rpido en agua destilada.
8. Tratar por el colorante, que es una solucin al 1 por 100 de hematoxilina, preparada
mezclando 10 c.c de solucin al 10 por 100 de hematoxilina en alcohol de 90 con 90 c.c de
agua destilada y que se ha dejado madurar durante algunos das. En el colorante
permanecern las preparaciones por 12 horas.
9. Lavar rpidamente en agua destilada
10. Diferenciar pasando las preparaciones, que habrn tomado un color negro, al diferenciador,
solucin de alumbre de hierro al 2%. Vigilar al microscopio.
11. Obtenida la diferenciacin deseada, pasar las preparaciones por una serie de alcoholes de
gradacin ascendente, 30 , 50, 70, 90, 5 minutos en cada uno.
12. Terminar la deshidratacin pasando por alcohol absoluto, 5 minutos.
13. Aclarar pasando a Xilol. Montar un blsamo.
30. MTODO DE MANN.
1. Frotis fijados en Schaudinn, Tratados por alcohol a 90 y pasados por alcohol a 70 con
Yodo, se hacen pasar a travs de alcoholes de gradacin descendente hasta el agua destilada,
en la que se dejarn 10 minutos.
Christian Gallegos Palermo
[85]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
2. Pasar a la solucin colorante de Mann (Solucin acuosa de azul de metilo-no de metileno -,
al 1 %, 35 c.c; solucin acuosa de Eosina, al 1 %, 45 c.c; agua destilada, 100 c.c) en la que
se dejarn de 4 12 horas.
3. Lavar ampliamente en agua destilada.
4. Diferenciar pasando por alcohol a 70 con Orange G (unas gotas de solucin saturada de
Orange G en 100 c.c a 70). La diferenciacin ser seguida al microscopio.
5. Lavar en agua destilada.
6. Pasar por alcoholes a 30, 50, 70 y 90, 5 minutos en cada uno.
7. Deshidratar pasando a alcohol absoluto por 10 minutos.
8. Aclarar en Xilol. Montar en blsamo.
31. PVA MODIFICADA
SOLUCION DE SULFATO DE COBRE
CuSo 4 . 5H 2 O
20.0 g
Agua destilada
1000 ml
Agregar el sulfato de cobre a 1000 ml de agua destilada calentada a 100 C y mezclar
hasta disolver.
FIJADOR PVA MODIFICADA (SOLUCION STOCK)
Solucin de Sulfato de Cobre
600 ml
Alcohol Etlico 95 %
300 ml
Agregar inmediatamente antes de usar 5 ml de cido actico glacial por cada 100 ml de
la solucin stock.
32. S.S.F
SOLUCION SALINA FISIOLOGICA (0.85% NaCl)
NaCl
0.85 g
Agua destilada
100 ml
Christian Gallegos Palermo
[86]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
1. Disolver el Cloruro de Sodio en agua destilada en un frasco o un vaso de precipitado
utilizando un agitador magntico.
2. Colocar la solucin resultante en un recipiente bien tapado, rotular como NaCl al 0.85%
con una fecha de expiracin de un ao.
3. Esterilizar con autoclave a 121C durante 15 minutos.
4. Conservar a 4C.
33. AZUL DE METILENO DE NAIR
SOLUCION A BUFFER DE ACETATO (0.2 M) (SOLUCION STOCK)
cido actico (CH 3 COOH)
Agua destilada
11.55 ml
1000 ml
SOLUCION B BUFFER DE ACETATO (0.2 M) (SOLUCION STOCK)
Acetato de Sodio (NaC 2 H 3 O 2 )
16.4 g
Acetato de Sodio Hidratado (NaC 2 H 3 O 2 .3H 2 O)
Agua destilada
27.2 g
1000 ml
Mezclar la cantidad indicada de las soluciones stock A y B y diluirlas con agua destilada a un
total de 1000 ml como se indica a continuacin.
34. TINCIN YODADA TRICRMICA PARA SEDIMENTO
LUGOL YODADO
Potasio yodado
10 g
Cristales de yodo pulverizados
5g
Agua destilada
100 ml
1. Agregar potasio yodado seguido de los cristales de yodo al agua destilada y mezclar hasta
disolver.
2. Diluir una porcin1:5 con agua destilada para su uso rutinario (solucin de trabajo).
Christian Gallegos Palermo
[87]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
3. Almacenar la solucin de trabajo en un frasco mbar, usualmente se puede conservar de 10
a 14 das.
PROCEDIMIENTO:
1. Colocar 4 gotas de la solucin de Lugol yodada en un tubo para pruebas.
2. Colocar 4 gotas de concentrado fecal en el mismo tubo y mezclar bien.
3. Colocar 2 gotas de la mezcla del concentrado fecal - solucin de Lugol yodada en un
portaobjetos.
4. Adicionar una gota de tincin tricrmica. Mezclar con un aplicador y colocar un
cubreobjetos (22 x 22 mm).
5. Examinar al microscopio la preparacin entera a baja potencia (con el objetivo de 10 X) y
ms tarde observar un tercio del rea de la preparacin con el objetivo seco fuerte (40 X).
35. SULFATO DE ZINC (SOLUCIN ACUOSA AL 33%)
Sulfato de Zinc
Agua destilada
330 g
670 ml
1. Disolver el Sulfato de Zinc en el agua destilada en un frasco apropiado y agitar utilizando
un agitador magntico.
2. Ajustar la gravedad especfica a 1.20 por la adicin de Sulfato de Zinc o agua destilada segn
sea el caso. Usar con una gravedad especifica de 1.18 con heces frescas (no formalizadas).
3. Almacenar en un frasco bien tapado, la solucin tiene una fecha de expiracin de 12 meses.
36. TINCIN TRICRMICA
Cromotrope 2R
0.6 g
Verde Claro SF
0.3 g
cido fosfotngstico
0.7 g
cido Actico Glacial
1 ml
Agua destilada
100 ml
1. Preparar la tincin agregando 1 ml de cido actico glacial a los componentes secos mezclar
por 15 a 30 minutos a temperatura ambiente.
2. Agregar 100 ml de agua destilada. Propiamente la tincin preparada sera prpura.
Christian Gallegos Palermo
[88]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
3. Colocar en un vaso o botella de plstico y conservar a temperatura ambiente, su tiempo de
vida es de 24 meses.
37. HEMATOXILINA FRRICA
SOLUCION 1
Hematoxilina (cristales o polvo)
Etanol absoluto
10 g
1000 ml
Colocar la solucin en un frasco limpio y seco, almacenar en un cuarto iluminado por
una semana a temperatura ambiente.
SOLUCION 2
Sulfato ferroso de amonio [Fe(NH 4 ) 2 (SO 4 ) 2 . 6 H 2 O]
10 g
Sulfato frrico de amonio [Fe(NH 4 )(SO 4 ) 2 . 12 H 2 O]
10 g
cido clorhdrico concentrado
Agua destilada
10 ml
1000 ml
SOLUCIN DE TRABAJO
1. Mezclar cantidades iguales de las soluciones 1 y 2. La solucin de trabajo debe mantenerse
fresca cada semana.
38. MIF: El conservador MIF se prepara a partir de dos soluciones stock, almacenados por
separados y mezcladas inmediatamente antes de ser usada.
SOLUCIN 1 (almacenado en un frasco mbar).
Agua destilada.
50 ml
Formaldehdo (USP).
5 ml
Timerosal (tintura de menthiolate, 1:1000).
40 ml
Glicerina.
1 ml
SOLUCIN 2 (solucin lugol) (se conserva durante 10 semanas en un frasco bien tapado).
Agua destilada.
Christian Gallegos Palermo
100 ml
[89]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Cristales de potasio yodado (KI).
Cristales de yodo (agregar despus de disolver yoduro de potasio).
10 g
Combinar 9.4 ml de la solucin 1 con 0.6 ml de la solucin 2 justo antes de utilizar.
39. TINCIN MODIFICADA DE HEMATIXILINA FRRICA (INCORPORANDO
CARBOL FUCSINA).
ALBMINA DE MEYER.
Agregar una cantidad igual de Glicerina a un huevo blanco fresco. Mezclar suave y
minuciosamente. Almacenar a 4 C e indicar la fecha de expiracin de 3 meses. La Albmina
de Meyer comercial puede ser almacenada a 25 C por un ao.
Solucin stock para tincin de hematoxilina (sustancia A).
Hematoxilina en polvo
Etanol (95 o 100 %)
10 g
1000 ml.
1. Mezclar bien hasta disolver.
2. Almacenar en un frasco limpio en rea iluminada.
3. Dejar reposar por 14 das antes de usar.
4. Almacenar a temperatura de cuarto con una fecha de expiracin de 1 ao.
Sustancia B.
Sulfato ferroso de amonio [ Fe (NH 4 ) 2 (SO 4 ) 2 . 6 H 2 O]
10 g
Sulfato frrico de amonio [ Fe (NH 4 ) (SO 4 ) 2 . 12 H 2 O]
10 g
cido clorhdrico (Concentrado).
Agua destilada
10 ml
necesaria para
1000 ml
Solucin de trabajo para tincin de Hematoxilina.
1. Mezclar cantidades iguales de la sustancia A y la sustancia B.
2. Dejar enfriar la mezcla minuciosamente antes de su uso (preparar mnimo dos horas antes
de su uso). La solucin de trabajo debe estar fresca toda la semana.
Christian Gallegos Palermo
[90]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
ANEXOS
Christian Gallegos Palermo
[91]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[92]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[93]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[94]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[95]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
TAMAO RELATIVO DE HUEVOS DE HELMINTOS
Christian Gallegos Palermo
[96]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[97]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[98]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
Christian Gallegos Palermo
[99]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
BIBLIOGRAFA.
Ash R. L., Orihel Th. C., A Guide to Laboratory Procedures and Identification, ASCP Press,
American Society of clinican Pathologists, 1987.
Annimo, Manual de tcnicas de parasitologa Veterinaria, Laboratorio Central Veterinario,
Weibridge Gran Bretaa, Editorial Acribia, Aragoza (Espaa), 1971.
Beaver P. Ch., Jung C.R., Wayne C.E., Parasitologa clnica, Compaia Editorial Salvat,
1988.
Burguess N.R.H. and Cowan G.O., A color Atlas of Medical Entomology, Campa and Hall
Medical, 1993.
Cheng Th., Parasitologa General, Editorial A.C. Madrid Espaa, 1984.
Davies R.G., Introduccin a la Entomologa, Ediciones Mundi-Prensa, 1991.
Katz M., Dickson D., Despomier D., Guag R. Parasitic Diseases, Springer Verlag, 1989.
Gonzlez F. Y., Manual de laboratorio de Parasitologa Humana, Tesis de licenciatura
Qumico Farmacutico Biologo, FES-Cuautitln UNAM, 1984.
Macy W. R. and Bertzen A.K., Laboratory Guide To Parasitology, With introduction to
Experimental Methods, Charles C. Thomas Publisher, Springfield Illinios, USA, 1971.
Melhorn H., Parasitology in Focus, Springer Verlag, 1988.
Pritchard A., The collection and Preservation of Animal Parasites, Thecnical Bulletin No 1,
The Harold W. Manter Laboratory, 1982.
Ross H., Ross Ch., Ross J., A Texbook of Entomology, Krieger Publishing Company,
Malabar Florida, 1991.
Schmidt D. G., Handbook of Tapeworm Identification, CRC Press, 1986.
Manual de Procedimientos de Laboratorio para el diagnstico de los parsitos intestinales
del hombre. Serie de Normas Tcnicas N 37 Lima 2003.
Procedimientos de Laboratorio. Laboratorios Intermedios, Laboratorios Loccales, Instituto
Nacional del Per 2013.
Manual de Tcnicas Bsicas para un Laboratorio de Salud. Organizacin Panamericana de
la Salud 1980.
Christian Gallegos Palermo
[100]
MANUAL DE PROCEDIMIENTOS PARASITOLOGICOS PARA TOMA DE MUESTRAS Y TECNICAS PARASITOLOGICAS
NDICE.
CONTENIDO
INTRODUCCIN
HECES
ANALISIS COPROLOGICO FUNCIONAL
RECOLECCIN Y CONSERVACIN DE MUESTRAS DE MATERIA FECAL.
EXAMENES CUALITATIVOS.
Examen macroscpico directo
Examen microscpico directo
Examen de concentracin por sedimentacin
Tcnica de la sedimentacin espontanea en tubo
Tcnica de centrifugacin con agua o solucin salina fisiolgica
Mtodo de sedimentacin rpida
Examen de concentracin por flotacin. Tcnica de Faust.
Mtodo de Sheather Sugar
Mtodo de Parodi y Alcaraz
Examen de concentracin por sedimentacin. Tcnica de Ritchie.
Examen de concentracin por termotropismo. Tcnica de Baerman.
Mtodo de Charles y Barthelemy
Mtodo de Teleman y Rivas
Tcnica de Willis
EXAMENES CUANTITATIVOS.
Exmenes por aclaramiento: Kato-Miura.
Examen por dilucin. Tcnica de Stoll.
EXAMENES DE CULTIVO DE LARVAS DE NEMATODO.
Mtodo de Harada mori.
Mtodo de Corticelly Lay
Mtodo de Aserrn estril.
TECNICAS DE GRAHAM O DE RASPADO PERIANAL.
EXAMEN DE ORINA.
EXAMEN DE EXUDADO URETRAL Y VAGINAL.
TINCIN DE GRAM TOMA DE MUESTRA DE BIOPSIA DE PIEL O
EXUDADO DERMICO.
TOMA DE MUESTRA DE BIOPSIA RECTAL.
TOMA DE MUESTRA DE BIOPSIA DE MUSCULO.
METODOS PARA EXAMEN SANGUINEO.
ANTICOAGULANTES.
OBTENCION Y PROCESAMIENTO DE MUESTRAS DE SANGRE EN EL
LABORATORIO DE PARASITOLOGIA.
PROCEDIMIENTOS PARA LA ELABORACION DE EXTENSIONES DE
SANGRE.
FIJACION DE FROTIS SANGUINEOS.
TECNICAS DE TINCION DE EXTENSIONES DE SANGRE.
Apndice
Anexos
Christian Gallegos Palermo
PAGINAS
03
04
05 - 20
21
23
23
24
27
27
29
30
32
34
35
37
39
41
42
43
45
45
47
49
49
50
51
53
55
56
58
60
61
62
64
65
66
67
67
70
91
[101]
Das könnte Ihnen auch gefallen
- Quiz de Infectología para ENAM 2021 con menos deDokument37 SeitenQuiz de Infectología para ENAM 2021 con menos deOskar Alberto Andia HuaranccaNoch keine Bewertungen
- PROTOCOLOS de Andreas KalckerDokument18 SeitenPROTOCOLOS de Andreas KalckerDavidMarcosPerezMuñozNoch keine Bewertungen
- Pae HospitalarioDokument39 SeitenPae HospitalarioNESSKENSS PEDRO100% (6)
- PROYECTO FINAL Completo Planta Deshidratadora de FrutaDokument80 SeitenPROYECTO FINAL Completo Planta Deshidratadora de FrutaEdith Llanos Zeballos100% (2)
- Banco - de - Preguntas de AnatominaDokument60 SeitenBanco - de - Preguntas de Anatominajulio cesarNoch keine Bewertungen
- 2015 Validación Básica de MétodoDokument340 Seiten2015 Validación Básica de MétodoJacs DenavNoch keine Bewertungen
- Reacción InflamatoriaDokument42 SeitenReacción InflamatoriaChristian Gallegos Palermo100% (5)
- TincionesDokument52 SeitenTincionesmarta hdezNoch keine Bewertungen
- Lipidosis Hepatica AnimalesDokument8 SeitenLipidosis Hepatica AnimalesKrlÖz Ändrz Hërëdîa ÖpzNoch keine Bewertungen
- Levantamiento de CadaverDokument220 SeitenLevantamiento de CadaverChristianGallegosPalermoNoch keine Bewertungen
- Historia MicologíaDokument35 SeitenHistoria Micologíafreddy samuel bailon lavadoNoch keine Bewertungen
- Monografia - Muestras de OrineDokument28 SeitenMonografia - Muestras de OrineANDREA EDITH PACHECO VASQUEZNoch keine Bewertungen
- 001 - Presentacion Haemonetics - Teg 5000 Teoria CelularDokument83 Seiten001 - Presentacion Haemonetics - Teg 5000 Teoria CelularChristianGallegosPalermoNoch keine Bewertungen
- Manual de procedimientos parasitológicosDokument102 SeitenManual de procedimientos parasitológicosJose JoseNoch keine Bewertungen
- Informe Parasitologia Practica N°4Dokument29 SeitenInforme Parasitologia Practica N°4Bertha DávilaNoch keine Bewertungen
- Conceptos de Patología GeriátricaDokument10 SeitenConceptos de Patología GeriátricaArmando Barbosa RodriguezNoch keine Bewertungen
- Almacenamiento de Muestras Biolã GicasDokument12 SeitenAlmacenamiento de Muestras Biolã GicasConstanza Thompson100% (1)
- Parasitología ResumenDokument6 SeitenParasitología Resumenvalentina inzunzaNoch keine Bewertungen
- Mico BacteriasDokument53 SeitenMico BacteriasNataly V.Noch keine Bewertungen
- Nematodos - DiapositivasDokument41 SeitenNematodos - DiapositivasBRAYANNoch keine Bewertungen
- Enzimologa Clnica.Dokument13 SeitenEnzimologa Clnica.Andrea ChinisNoch keine Bewertungen
- Babesia: parásitos intraeritrocíticos causantes de babesiosisDokument1 SeiteBabesia: parásitos intraeritrocíticos causantes de babesiosisManavyyibeli MartinezNoch keine Bewertungen
- Toma de Muestra Parasitologica - Enfermería 2016Dokument3 SeitenToma de Muestra Parasitologica - Enfermería 2016PieroJ.PartigianiNoch keine Bewertungen
- Lavado y descontaminación de materiales médicosDokument6 SeitenLavado y descontaminación de materiales médicosVivi BautistaNoch keine Bewertungen
- Manual Parasitología LaboratoriosDokument124 SeitenManual Parasitología LaboratoriosGuellity MarcelNoch keine Bewertungen
- Nutrición bacteriana: macronutrientes y metabolismoDokument44 SeitenNutrición bacteriana: macronutrientes y metabolismoOscar Loreño Jiménez0% (1)
- Re 10 Lab 035 001 Microbiologia IIDokument49 SeitenRe 10 Lab 035 001 Microbiologia IIJoseph QuispeNoch keine Bewertungen
- RIZOPODOS InvestigacionDokument5 SeitenRIZOPODOS InvestigacionYeca Ponce0% (1)
- Taenia SoliumDokument10 SeitenTaenia Soliumjlopez97% (35)
- Definición y Generalidades de ParasitologíaDokument44 SeitenDefinición y Generalidades de ParasitologíaLuciana Sossiré Vásquez Regalado100% (1)
- EntomologiaDokument2 SeitenEntomologiajacki orozco100% (1)
- Ancyklostomideos y Strongyloides ImprimibleDokument14 SeitenAncyklostomideos y Strongyloides Imprimiblejeanniffer_lozadavNoch keine Bewertungen
- Estandarización Del Procesamiento de Muestras de OrinaDokument11 SeitenEstandarización Del Procesamiento de Muestras de OrinaÁlvaro CarbajalNoch keine Bewertungen
- ++alcaligenaceae y PseudomodanaceaeDokument6 Seiten++alcaligenaceae y Pseudomodanaceaecirobv19Noch keine Bewertungen
- Histoparasitos TERMINADOOODokument20 SeitenHistoparasitos TERMINADOOOFlaavia Vilugrón MedinaNoch keine Bewertungen
- Proyecto de Micro EnterobacteriasDokument18 SeitenProyecto de Micro EnterobacteriasfiorelaNoch keine Bewertungen
- 1 El Origen de Las Enfermedades HumanasDokument20 Seiten1 El Origen de Las Enfermedades HumanasDavid HoyosNoch keine Bewertungen
- Micosis SuperficialesDokument17 SeitenMicosis SuperficialesIvan Vargas GragedaNoch keine Bewertungen
- Modelos ExperimentalesDokument24 SeitenModelos ExperimentalesEstefa ValenciaNoch keine Bewertungen
- Helmintos 1Dokument32 SeitenHelmintos 1Aquiles Vilchez MaraviNoch keine Bewertungen
- Instrucciones para La Toma de HecesDokument4 SeitenInstrucciones para La Toma de HecesYxNoch keine Bewertungen
- Muestra de ParacitosDokument12 SeitenMuestra de ParacitosCristianNoch keine Bewertungen
- Texto Micologia 2013Dokument100 SeitenTexto Micologia 2013Eva Nelvi GuzmanNoch keine Bewertungen
- Hisopado FaringeoDokument2 SeitenHisopado FaringeoDixie LeonNoch keine Bewertungen
- Reduvidae (Triatoma - Cimex)Dokument5 SeitenReduvidae (Triatoma - Cimex)jenny gutierrez aparcanaNoch keine Bewertungen
- 31 Urocultivo y CoprocultivoDokument43 Seiten31 Urocultivo y CoprocultivoLuz LlanosNoch keine Bewertungen
- Informe 7. HONGOSDokument4 SeitenInforme 7. HONGOSValentina EscobarNoch keine Bewertungen
- Silabo Microbiologia GeneralDokument8 SeitenSilabo Microbiologia Generaljuancarlos0323Noch keine Bewertungen
- Trabajo Practico #2Dokument6 SeitenTrabajo Practico #2NadyaLizzyAstorgaNoch keine Bewertungen
- Protozoarios ParacitosDokument3 SeitenProtozoarios ParacitosWalter Junior Capuñay BravoNoch keine Bewertungen
- Virología USMPDokument40 SeitenVirología USMPmariajoseNoch keine Bewertungen
- Fundamento Teórico de La Realización Del Hisopado Faríngeo y La Tinción de GramDokument14 SeitenFundamento Teórico de La Realización Del Hisopado Faríngeo y La Tinción de GramChiara RodriguezNoch keine Bewertungen
- Neisseria PDFDokument45 SeitenNeisseria PDFDhamarys EstevesNoch keine Bewertungen
- Test de GrahamDokument8 SeitenTest de GrahamJosé Roberto ContrerasNoch keine Bewertungen
- PlatelmintosDokument60 SeitenPlatelmintosBrenda Leticia Castillo GutiérrezNoch keine Bewertungen
- Trichomona, Coccideos y CiliadosDokument37 SeitenTrichomona, Coccideos y CiliadosPABLO FERNANDO FERREIRA LEITE MAFFININoch keine Bewertungen
- Ascariasis, sintomas y tratamientoDokument5 SeitenAscariasis, sintomas y tratamientoLopez Garcia MariusNoch keine Bewertungen
- Informe de OrinaDokument17 SeitenInforme de Orinaapi-259248355Noch keine Bewertungen
- PCR para Identificar Parasito Toxoplasma GondiiDokument15 SeitenPCR para Identificar Parasito Toxoplasma GondiiMónica Hernández UmañaNoch keine Bewertungen
- Exudado VaginalDokument5 SeitenExudado VaginalKAMELIXNoch keine Bewertungen
- Flora Normal PDFDokument34 SeitenFlora Normal PDFelyzabettalcalaNoch keine Bewertungen
- Protozoarios y MetazoariosDokument55 SeitenProtozoarios y MetazoariosEstebanNoch keine Bewertungen
- Informe Parasitologia 3 Carlos Chura PDFDokument5 SeitenInforme Parasitologia 3 Carlos Chura PDFCarlos Daniel Quispe ChuraNoch keine Bewertungen
- HECESDokument18 SeitenHECESRous Vazquez SaucedoNoch keine Bewertungen
- Laboratorio No 1 PARASITOLOGIADokument6 SeitenLaboratorio No 1 PARASITOLOGIAKaty ALvarezNoch keine Bewertungen
- T5 HecesDokument18 SeitenT5 HecesJuanjo MedinaNoch keine Bewertungen
- Muestras BiologicasDokument22 SeitenMuestras BiologicasLourdes Milla AlegreNoch keine Bewertungen
- COPROANALISISDokument31 SeitenCOPROANALISISMaria Fernanda Perez ColmenaresNoch keine Bewertungen
- Bitácora 5 - Examen CoprológicoDokument6 SeitenBitácora 5 - Examen CoprológicoRosa Laura ParedesNoch keine Bewertungen
- Gimnasia RITMICADokument9 SeitenGimnasia RITMICAChristianGallegosPalermoNoch keine Bewertungen
- Ficha de investigación epidemiológica de caso de gestante con VIH y niño expuestoDokument4 SeitenFicha de investigación epidemiológica de caso de gestante con VIH y niño expuestoChristianGallegosPalermoNoch keine Bewertungen
- Fichas Epidemiologica de Tetanos Poblacion GeneralDokument1 SeiteFichas Epidemiologica de Tetanos Poblacion GeneralChristianGallegosPalermoNoch keine Bewertungen
- Plantilla de Red de Soporte Por NivelesDokument8 SeitenPlantilla de Red de Soporte Por NivelesChristianGallegosPalermoNoch keine Bewertungen
- Fichas Epidemiologica de Paralisis Flacida AgudaDokument2 SeitenFichas Epidemiologica de Paralisis Flacida AgudaChristianGallegosPalermoNoch keine Bewertungen
- Tipos de Donantes de SangreDokument2 SeitenTipos de Donantes de SangreChristianGallegosPalermo0% (1)
- Fichas Epidemiologica de Tos FerinaDokument2 SeitenFichas Epidemiologica de Tos FerinaChristianGallegosPalermoNoch keine Bewertungen
- Accidentes de Tránsito PDFDokument1 SeiteAccidentes de Tránsito PDFRicardo VelásquezNoch keine Bewertungen
- Ficha de notificación e investigación de morbilidad materna extremaDokument2 SeitenFicha de notificación e investigación de morbilidad materna extremaChristianGallegosPalermoNoch keine Bewertungen
- Fichas Epidemiologica de VaricelaDokument1 SeiteFichas Epidemiologica de VaricelaChristianGallegosPalermoNoch keine Bewertungen
- v5 - Ficha de Notificacion Sarampion y RubeolaDokument3 Seitenv5 - Ficha de Notificacion Sarampion y RubeolaNuñez NiloNoch keine Bewertungen
- Ficha Epidemiologica de Fiebre AmarillaDokument2 SeitenFicha Epidemiologica de Fiebre AmarillaChristianGallegosPalermoNoch keine Bewertungen
- Examen Interno Del CadáverDokument14 SeitenExamen Interno Del CadáverChristianGallegosPalermoNoch keine Bewertungen
- 4 PlaquetasDokument18 Seiten4 PlaquetasChristianGallegosPalermoNoch keine Bewertungen
- Proceso de QuimiolunminiscenciaDokument24 SeitenProceso de QuimiolunminiscenciaChristianGallegosPalermoNoch keine Bewertungen
- Anexo 2. Presentación Pueba de ELISA PDFDokument60 SeitenAnexo 2. Presentación Pueba de ELISA PDFChristianGallegosPalermoNoch keine Bewertungen
- Graficos Control CalidadDokument8 SeitenGraficos Control CalidadPaola RoblesNoch keine Bewertungen
- Manual 1Dokument174 SeitenManual 1ChristianGallegosPalermoNoch keine Bewertungen
- Fascitis NecrosanteDokument3 SeitenFascitis NecrosanteChristianGallegosPalermoNoch keine Bewertungen
- MANUAL DE TECNICAS EN INMUNOLOGIA ActualizadoDokument156 SeitenMANUAL DE TECNICAS EN INMUNOLOGIA ActualizadoChristianGallegosPalermo0% (1)
- Método de Inclusión ParafinaDokument35 SeitenMétodo de Inclusión ParafinaChristianGallegosPalermoNoch keine Bewertungen
- ELISASDokument7 SeitenELISASChristianGallegosPalermoNoch keine Bewertungen
- Modelo de Informe 2019Dokument76 SeitenModelo de Informe 2019ChristianGallegosPalermoNoch keine Bewertungen
- 6 8lipidosDokument64 Seiten6 8lipidoswilliam66Noch keine Bewertungen
- Guia de Talleres Escuela para PadresDokument121 SeitenGuia de Talleres Escuela para Padresperfectfreesoul100% (1)
- Manual de Criminalistica PDFDokument362 SeitenManual de Criminalistica PDFhundal_yoNoch keine Bewertungen
- Acido Sulfosalicilico PDFDokument1 SeiteAcido Sulfosalicilico PDFJimmy Espinoza BenavidesNoch keine Bewertungen
- Ups GT001740Dokument152 SeitenUps GT001740luis ProañoNoch keine Bewertungen
- Test Infecciosas PDFDokument12 SeitenTest Infecciosas PDFJoséduardo Lopez ContrerasNoch keine Bewertungen
- E 20 F2 - Pediatría - OnlineDokument31 SeitenE 20 F2 - Pediatría - OnlineNaysha Torrejón HilarioNoch keine Bewertungen
- Enfermedades Virales en El Ganado BovinoDokument6 SeitenEnfermedades Virales en El Ganado BovinoVICTOR MANUEL CELLERI FIERRONoch keine Bewertungen
- Compendio de Parasitología Médica: Entamoeba histolyticaDokument204 SeitenCompendio de Parasitología Médica: Entamoeba histolyticaxstella0850% (2)
- TB-Falcón ADokument28 SeitenTB-Falcón Abege.comprasNoch keine Bewertungen
- Higiene y manipulación de alimentos: Conceptos básicos y enfermedades transmitidas por alimentosDokument3 SeitenHigiene y manipulación de alimentos: Conceptos básicos y enfermedades transmitidas por alimentosStephania Corcho GarciaNoch keine Bewertungen
- Ovo Product OsDokument34 SeitenOvo Product OsIsabel Guerrero⃝⃤Noch keine Bewertungen
- Agua y Saneamiento - Caso Practico y PlantillaDokument66 SeitenAgua y Saneamiento - Caso Practico y Plantillaandrear33100% (1)
- Protocolo CDS y MMSDokument22 SeitenProtocolo CDS y MMStordynakaNoch keine Bewertungen
- Enfermedades Mas Comunes en GuatemalaDokument8 SeitenEnfermedades Mas Comunes en GuatemalaYuliana Saraí Santiago VásquezNoch keine Bewertungen
- Clases CompletasDokument374 SeitenClases CompletasErick BarraganNoch keine Bewertungen
- P E D I A T R I A: Valeria Aylee Resendez CordovaDokument29 SeitenP E D I A T R I A: Valeria Aylee Resendez CordovaAÿlee ResendezNoch keine Bewertungen
- Universidad Autónoma de Santo DomingoDokument7 SeitenUniversidad Autónoma de Santo DomingoJose Rafael de LunaNoch keine Bewertungen
- Preguntas Abdomen SemiologiaDokument9 SeitenPreguntas Abdomen SemiologiaLinna LetoNoch keine Bewertungen
- Parasitosis Intestinal-2Dokument8 SeitenParasitosis Intestinal-2Juana Antonieta Chacaj AjúNoch keine Bewertungen
- Caso Clinico 08-01-2018 Terapia IntermediaDokument11 SeitenCaso Clinico 08-01-2018 Terapia IntermediaJorge Alexis Aceves OchoaNoch keine Bewertungen
- Coccidiosis BovinaDokument7 SeitenCoccidiosis BovinaAlejandro Padilla BarbaNoch keine Bewertungen
- Cobayosvenezuela 140904160902 Phpapp02 PDFDokument73 SeitenCobayosvenezuela 140904160902 Phpapp02 PDFKaterine Rocio Osores RiveraNoch keine Bewertungen
- Efectos Adversos de Los Farmacos en BovinosDokument8 SeitenEfectos Adversos de Los Farmacos en BovinosOmar Enrique Jibaja CruzNoch keine Bewertungen
- Propiedades y beneficios del carbonato de magnesioDokument10 SeitenPropiedades y beneficios del carbonato de magnesioalecep35Noch keine Bewertungen
- Cambios en Los Patrones Nutricionales-1Dokument3 SeitenCambios en Los Patrones Nutricionales-1mariana plataNoch keine Bewertungen
- PLACE DiarreaDokument1 SeitePLACE DiarreaYoanna TeránNoch keine Bewertungen
- Como Tomar o MMS em Casos de Câncer (Espanhol)Dokument8 SeitenComo Tomar o MMS em Casos de Câncer (Espanhol)Bruno AraújoNoch keine Bewertungen