Beruflich Dokumente
Kultur Dokumente
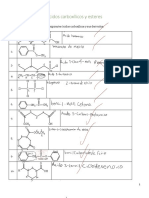
Constantes de Disociacion (PKa) de Los Acidos
Hochgeladen von
sofipalaceOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Constantes de Disociacion (PKa) de Los Acidos
Hochgeladen von
sofipalaceCopyright:
Verfügbare Formate
~-----
\_
~i
TABLA 1.8- .
Constantes de disociaci6n (pKa) de los acloos (continuaci6n)
.
Acido
Acido carbonico
Sulfuro de hidr6geno
pKa
Formula
Base conjugada
6.4
7.0
H2C03
H2S
HC03HS-
2,4-Pentanodiona
Cianuro de hidrogeno
Ion amenia
9
9.1
9.3
19.9
15.13
II
II
11- II
CH3CCH2CCH3
HCN
NH4+
CH3CCHCCH3
CN- ..
18.1
NH3
1.14j f2.4
o
Glicina
Fenol
Ion hidr6geno carbonato
Metanotiol
Jon dimetilamonio
Acetoacetato de etilo
Malonato de dietilo
Metanol
9.6
10
10.2
10.7
10.7
11
13
15.2
II
II
H2NCH2COC6H50C032CH3S(CH3hNH
H3NCH2COC6H50H
HC03CH3SH+
(CH3hNH2
o
II
II
Ciclopentadieno
15.5
15.7
16
16
Alcohol ter-butilico
17
18
II
II
19
o
(CH3)2CHCH
H20
11- II
CH3CH20C~HCOCH2CH3
CH30-
21.8
1.15
18.1
1.15
1.15
(CH3hCCH
HO..
CH3CH20-
CH3CH20H
H):JH
H1:fH
11.21
(CH3hCHOH
H
(CH3)zCHO-
1.15
(CH3hCOH
(CH3hCO-
1.15
CH3CCH3
CH3C~H2
II
-II
11-
24
CH3COCH2CH3
Acetileno
26
HC=CH
Amoniaco
36
Diisopropilamina
36
NH3
[(CH3hCH]zNH
H
H*H
H
_18.1
43
21.1
o
_II
Acetate de eti 10
Benceno
CH3CH20CCH2COCH2CH3
CH30H
II
Acetone
CH3C~HCOCH2CH3
CH3CCH2COCH2CH3
H H
Alcohol isopropilico
27.3
1.16; 24.4
19.9
15.13
22.4
11- II
II
2-MetiJpropanal
Agua*
Etanol
Se expone en la secci6n
H2~COCH2CH3
HC=C:
21.1
H2N-
1.15
[(CH3)zCH]zN-
18.1
9.5
H
14.5
H~'-
Etileno
45
H2C=CH2
H2C=CH
9.4j 9.5
Metano
60
CH4
1.15; 14.5
Etano
62
CH3CH3
:CH~
CH3CH2
14.5
"Para las reacciones acido-base en que el agua es el disolvente, la pK. del H30+ es cero y la pK. del H20 es 14.
Las colecciones de la web de datos de pKa incluyen las de H. Reich (Universidad de Wisconsin) en http://www.chem.wisc.edulareasireich/pkatablelkaconthtmy
la
de D. Ripin y D.A. Evans (Harvard) en http://daecrl.harvarci.edulpkalpka.html.
___
~7
~
Compuesto
pKa
CH3CH2C02H
4.8
(CH3)3CC02H
5.0
CH3COCH2N02
5.1
Compuesto
HODOH
((OH
aCH2SH
oOH
OH
a
((OH
CH3COCH2COCH3
5.3
pKa
Compuesto-
pK.
9.0
OCH2OH
15.4
CH30H
15.5
H2C=CHCH2OH
15.5
CH3CH2OH
16.0
CH3CH2CH2OH
16.1
CH3COCH2Br
16.1
9.3; 11.1
9.3; 12.6
OH
0
02NCH2C02CH3
5.8
0:
5.8
CHO
9.4
I 0
9.9; 11.5
HO
CI
CI-Q-OH
6.2
I
CI
OSH
2
CH3COCH2SOCH3
6.6
7.1
HC03H
N0
7.2
((
OH
7.7
(CH3)2CHN02
CI-Q-OH
7.8
CI
CH3C03H
((OH
8.2
8.5
CI
CH3CH2N02
F,CVOH
8.5
8.7
9.9
10.0
CH3
10.3
CH3SH
10.3
CH3COCH2C02CH3
10.6
CH3COCHO
11.0
CH2(CN)2
11.2
CCI3CH2OH
12.2
Glucosa
12.3
(CH3hC=NOH
12.4
CH2(C02CH3)2
12.9
CHCI2CH2OH
12.9
CH2(OH)2
13.3
HOCH2CH(OH)CH2OH
14.1
CH2CICH2OH
14.3
15.0
CH3CHO
17
(CH3)2CHCHO
17
(CH3)2CHOH
17.1
(CH3)3COH
18.0
CH3COCH3
19.3
O=D
I
10.3
CH3N02
16.7
CH3C02CH2CH3
25
HC=CH
25
CH3CN
2S
CH3S02CH3
28
(CsH5)3CH
32
(CSH5hCH2
34
CH3SOCH3
3S
NH3
36
CH3CH2NH2
36
(CH3CH2)2NH
CH
40
a '
41
0
H2C=CH2
CH4
mas
23
Se ha publicado una !ista de acidez que cubre a
de 5000 compuestos organtcos: E.P. Serjeant y B. Dempsey (eds.), "Ionization
Organic Adds in Aqueous Solution, IUPAC Chemical Data Series No. 23, Pergamon Press, Oxford, 1979.
43
44
-60
Constants
of
A-9
\,~~--------------------------------~
-_
-~-
-1.8
CH3S03H
0.1
CH(N02)3
NOz
CH2CIC02H
2.8
H02CCH2COzH
2.8;5.6
a
a
2.9
CH2BrC02H
C02
0.3
02.-Q-0"
CI
O-
3.8
C0
2"
;
.~
3.0
"
'.~
.-r:
2
CO "
3.0
CCI3C02H
0.5
CF3C02H
0.5
CBr3C02H
0.7
CH2IC02H
3.2
H02CC=CC02H
1.2; 2.5
CHOCOzH
3.2
HQ2CC02H
1.2;3.7
02N-o-C02H
3.4
CHCI2C02H
1.3
CH2(N02)C02H.
1.3
HC=CC02H
1.9
1.9; 6.3
Z H02CCH=CHC02H
C0
2"
N02
CH3COC02H
2.4
"
2.4
-:.t~
,.~
4.0
CI-o-C02"
CI
N02
---.
2N
O-
CO,"
3.5
3.5; 10.2
CH2(N02)2
3.6
CH3OCH2C02H
3.6
4.1
::::::.....
OH
'Y)
.t
~
~
.,
i!.~fJ.
~i
~:~
C02
..;l~
<.,_.
"
4.2
..~.(l
-,
..-1
.1i
H2C=CHC02H
4.2
H02CCH2CH2C02H
4.2;5.i!~
H02CCH2CH2CH2C02H
4.3;5.4 ~~
CI
HSCH2C02H
~}
02N'ON02
OH
02N
4.0
CH2BrCH2C02H
',J:
CI
:~
/t.
~:~
.'if
4.5
CI-UOH
'"1
~~1'
CI
Cl
NCCH2C02H
2.5
CH3COCH2C02H
3.6
CH3C=CC02H
2.6
HOCH2C02H
3.7
H2C=C(CH3}C02H
4.7
CH2FC02H
2.7
HC02H
3.7
CH3C02H
4.8
;\
J:;:
~/
----~---------j
-- .... -
..__ .... JO_ .......
--
_ ...... _ ....
-0-
....
--
.._- ..., ---
--.----
...--
--
-_
....
--_
.........
_J
..._-
---
-_
.....
J-
gadas. La lista es mas exrensa de 10 que se necesita hasta este punto, pero se regresara a ella
de manera repetida a 10 largo del texto, conforme se introduzcan aspectos nuevos del comportamiento acido-base. La tabla esta organizada de modo que la fuerza del acido disminuye de
arriba hacia abajo. Por el contrario, la fuerza de la base conjugada aumenta de arriba hacia abajo. Por tanto, cuanto mds fuerte es el dcido, mas debit es la base conjugada. Cuanto mas fuerte es la base, mas debit es SLl acido conjugado.
TABLA 1.8
Constantes de disociaciorr (pKa) de los acidos
Acido
Yoduro de hiorogeno
8romuro de hidrogeno
Acido sulturico
Cloruro de hidr6geno
Ion hidronio"
Acido nltrico
Ion hidr6geno sulfato
Fluoruro de hidrogeno
Ion anilinio
pKa
-10.4
-5.8
-4.8
Formula
t
18rHOS02OCIH2O
-ON02
-OS020F-
1.15
1.15
1.16
1.15
1.16
1.15
1.16
1.15
22.4
-1.7
-1.4
2.0
3.1
HI
H8r
HOS02OH
HCI
H30+
HON02
HOSO?OHF
. 4.6
C6HSNH3
C6HSNH2
-3.9
II
II
Acido acetico
4.7
CH3COH
CH3CO-
1.15; 19.4. ..
Ion piridinio
5.2
0
I
1.14; 22.4
-,
~~-------------------
.. ~
-----~/
Das könnte Ihnen auch gefallen
- Balance de materia orientado a procesosVon EverandBalance de materia orientado a procesosNoch keine Bewertungen
- Problemas resueltos de Hidráulica de CanalesVon EverandProblemas resueltos de Hidráulica de CanalesBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Organica 32396Dokument19 SeitenOrganica 32396CARMONA RIVERA MAGDA XIMENANoch keine Bewertungen
- Serie 3 Mezclas de Gases (Modelo Ideal)Dokument9 SeitenSerie 3 Mezclas de Gases (Modelo Ideal)fachemestry62% (13)
- Serie 7 Segunda Ley y Tercera Ley de La Termodinámica (Entropía)Dokument10 SeitenSerie 7 Segunda Ley y Tercera Ley de La Termodinámica (Entropía)fachemestry0% (1)
- Informe de Lab Medidas de PH y SolucionesDokument13 SeitenInforme de Lab Medidas de PH y SolucionesSergio CastañedaNoch keine Bewertungen
- Compuestos Organicos de Impacto Economico, Industrial, Ambiental yDokument4 SeitenCompuestos Organicos de Impacto Economico, Industrial, Ambiental yFernando Tomás Martínez Martínez100% (1)
- Ejercicios Aldehídos y Cetonas-2023-1Dokument2 SeitenEjercicios Aldehídos y Cetonas-2023-1oscar jimenez c.Noch keine Bewertungen
- Mas Ejercicios de Organica PDFDokument9 SeitenMas Ejercicios de Organica PDFElsa Rodriguez JimenezNoch keine Bewertungen
- Vernolepin PrototypeDokument14 SeitenVernolepin PrototypeIsabel MonrealNoch keine Bewertungen
- Quimica 2 Solucionario de Los FinalesDokument21 SeitenQuimica 2 Solucionario de Los FinalesRenato ProleonNoch keine Bewertungen
- Química Orgánica Estructura y Reactividad T1 PDFDokument729 SeitenQuímica Orgánica Estructura y Reactividad T1 PDFCarlos PomalazaNoch keine Bewertungen
- Quimica Organica SelectividadDokument5 SeitenQuimica Organica SelectividadAMYNNXXXXNoch keine Bewertungen
- Ej-2bq. Formulacion OrganicaDokument1 SeiteEj-2bq. Formulacion Organicapepepinto36Noch keine Bewertungen
- Función ÉsterDokument1 SeiteFunción ÉsterSamantha CarreñoNoch keine Bewertungen
- Taller Aldehidos y CetonasDokument7 SeitenTaller Aldehidos y CetonasPaulita GonzalezNoch keine Bewertungen
- Ejercicios de Oxigenados-NitrogenadosDokument5 SeitenEjercicios de Oxigenados-NitrogenadossaulotejadaNoch keine Bewertungen
- Compuestos PolifuncionalesDokument3 SeitenCompuestos PolifuncionalesNelly ZuñigaNoch keine Bewertungen
- Hibridación EjerciciosDokument5 SeitenHibridación EjerciciosDenisse GuevaraNoch keine Bewertungen
- Ejerciciosde OrganicasDokument2 SeitenEjerciciosde OrganicasMonica Ramos CruzNoch keine Bewertungen
- Ejercicios Acidos Carboxílicos-2023-1Dokument2 SeitenEjercicios Acidos Carboxílicos-2023-1oscar jimenez c.Noch keine Bewertungen
- Practica de GTLDokument12 SeitenPractica de GTLJoel NinaviaNoch keine Bewertungen
- Solucionario de Examen ParcialDokument9 SeitenSolucionario de Examen ParcialEsthefany UcañanNoch keine Bewertungen
- T 1acidosDokument7 SeitenT 1acidosnekroespectralNoch keine Bewertungen
- Ejercicios de Grupos FuncionalesDokument3 SeitenEjercicios de Grupos FuncionalesLeo LoyolaNoch keine Bewertungen
- Ex Formulación OrgánicaDokument3 SeitenEx Formulación OrgánicahousegrjNoch keine Bewertungen
- Ejer Cici Os de Organic AsDokument2 SeitenEjer Cici Os de Organic AsNayareth Torres MuenaNoch keine Bewertungen
- Ejercicios Alcoholes Eteres 2023 1Dokument4 SeitenEjercicios Alcoholes Eteres 2023 1Saúl LunaNoch keine Bewertungen
- FORMULACION Problemas 15Dokument6 SeitenFORMULACION Problemas 15SaraNoch keine Bewertungen
- Taller de Quimica Alquenos y AlquinosDokument7 SeitenTaller de Quimica Alquenos y AlquinosEliana CarpioNoch keine Bewertungen
- Guia de Ejercicios 530.025 Acido-Base PDFDokument6 SeitenGuia de Ejercicios 530.025 Acido-Base PDFjavierNoch keine Bewertungen
- Mejia N LourdesDokument6 SeitenMejia N LourdesLourdes MejíaNoch keine Bewertungen
- Soluciones Ejercicios Formulacion ApuntesDokument5 SeitenSoluciones Ejercicios Formulacion ApuntesNieves Herranz MacíasNoch keine Bewertungen
- Ajuste Reacciones QuímicasDokument2 SeitenAjuste Reacciones QuímicasIsabel RodríguezNoch keine Bewertungen
- PRÁCTICAS de Química OrgánicaDokument19 SeitenPRÁCTICAS de Química OrgánicaLimbert Pari CoelaNoch keine Bewertungen
- Ureta Medina Cristhia Eutemio Solucion de Parcial MasgoDokument10 SeitenUreta Medina Cristhia Eutemio Solucion de Parcial MasgoRaichu UM100% (1)
- HidrocarburosDokument26 SeitenHidrocarburosHILMER ELIT MU�OZ BRICE�ONoch keine Bewertungen
- Tablas TermoquimicasDokument2 SeitenTablas TermoquimicasMelissa MartinezNoch keine Bewertungen
- Taller Acidos CarboxilicosDokument6 SeitenTaller Acidos CarboxilicosLaura MercadoNoch keine Bewertungen
- Constantes de EquilibriosDokument11 SeitenConstantes de EquilibriosEstherNoch keine Bewertungen
- Guia de Acidos y Derivados QoDokument7 SeitenGuia de Acidos y Derivados QoFelipe Ortiz MorenoNoch keine Bewertungen
- tr2 QuimicaDokument16 Seitentr2 QuimicaEDWIN EDWARD CAPCHA TINOCONoch keine Bewertungen
- Constantes Acido BaseDokument8 SeitenConstantes Acido BasekennygirlupNoch keine Bewertungen
- Función AldehídoDokument2 SeitenFunción AldehídoSamantha CarreñoNoch keine Bewertungen
- Química OrgánicaDokument3 SeitenQuímica OrgánicaWaddy GrandónNoch keine Bewertungen
- Analisis de Resultados Practica Redox Determinacion de Etanol Enjuague BucalDokument8 SeitenAnalisis de Resultados Practica Redox Determinacion de Etanol Enjuague Bucalrikudou_14100% (1)
- PRACTICO 1 - Acidos Carboxílicos y DerivadosDokument3 SeitenPRACTICO 1 - Acidos Carboxílicos y DerivadosYuleny0% (1)
- Quimica de LipidosDokument53 SeitenQuimica de LipidosCesar Roque BordaNoch keine Bewertungen
- Ejercicios - 2Dokument7 SeitenEjercicios - 2Samantha Garcia NovoaNoch keine Bewertungen
- Alcohol EsDokument22 SeitenAlcohol EsESPAÑOLNoch keine Bewertungen
- Taller de Quimica OrganicaDokument10 SeitenTaller de Quimica OrganicaDioselina Stefanny Orozco ZuletaNoch keine Bewertungen
- Actividad 6Dokument5 SeitenActividad 6Xarol Mora HernandezNoch keine Bewertungen
- Guia quimicaII TVDokument2 SeitenGuia quimicaII TVSergioNoch keine Bewertungen
- Reacciones Quimicas Ajustar 3 EsoDokument6 SeitenReacciones Quimicas Ajustar 3 EsoIspano GarciaNoch keine Bewertungen
- Guia 2Dokument4 SeitenGuia 2Jessica HernandezNoch keine Bewertungen
- 14-15-16 - 6tos. Éteres-Aldehídos-CetonasDokument40 Seiten14-15-16 - 6tos. Éteres-Aldehídos-CetonasAlberto Paredes SanchezNoch keine Bewertungen
- Cdea 7 B 24 C 9 A 48 B 04 DB 49 B 20 CDokument9 SeitenCdea 7 B 24 C 9 A 48 B 04 DB 49 B 20 CJose Leonardo GomezNoch keine Bewertungen
- Reactor Tubular PFR para Cracking de NaftasDokument5 SeitenReactor Tubular PFR para Cracking de NaftasGabriel Alonso Alagón MartínezNoch keine Bewertungen
- AldehidosDokument7 SeitenAldehidosBryan MachucaNoch keine Bewertungen
- TAREA N°2 ACIDO BASE - Pazmiño Alexander - BF3-P1Dokument5 SeitenTAREA N°2 ACIDO BASE - Pazmiño Alexander - BF3-P1Alexander PazmiñoNoch keine Bewertungen
- Avila Quezada - Orlando JavierDokument6 SeitenAvila Quezada - Orlando JavierjomiNoch keine Bewertungen
- Qca Formulacion Organica Resumen Cuadro PDFDokument3 SeitenQca Formulacion Organica Resumen Cuadro PDFjfgchemNoch keine Bewertungen
- CromatografiaDokument19 SeitenCromatografiasofipalaceNoch keine Bewertungen
- ParacetamolDokument7 SeitenParacetamolsofipalaceNoch keine Bewertungen
- DiabetesDokument36 SeitenDiabetessofipalace100% (1)
- Guia Laboratorio F-Tecnia Gelantibacterial 1Dokument3 SeitenGuia Laboratorio F-Tecnia Gelantibacterial 1maopacificNoch keine Bewertungen
- Deber de QuimicaDokument3 SeitenDeber de QuimicagmsoftNoch keine Bewertungen
- Guia de Problemas de Qa 2021Dokument93 SeitenGuia de Problemas de Qa 2021Facundo DieguezNoch keine Bewertungen
- Compuestos TernariosDokument7 SeitenCompuestos TernariosCesar Rozas FormandoyNoch keine Bewertungen
- Quimica Compuestos OrganicosDokument12 SeitenQuimica Compuestos OrganicosmirnaNoch keine Bewertungen
- Compuestos Ionicos BinariosDokument13 SeitenCompuestos Ionicos BinariosClaudio Osvaldo Vargas FarfanNoch keine Bewertungen
- Informe de Laboratorio N°2 Reacciones de Identificación de Grupos Funcionales OrgánicosDokument10 SeitenInforme de Laboratorio N°2 Reacciones de Identificación de Grupos Funcionales OrgánicospipeponciomonNoch keine Bewertungen
- Universidad Nacional de CajamarcaDokument7 SeitenUniversidad Nacional de CajamarcaCarlos Jhonatan Guevara BautistaNoch keine Bewertungen
- Informe 13Dokument13 SeitenInforme 13Estefany Quispe RamirezNoch keine Bewertungen
- Sustitución Electrofilica AromaticaDokument6 SeitenSustitución Electrofilica AromaticaCamilo CardozoNoch keine Bewertungen
- Práctica 2Dokument5 SeitenPráctica 2Alvi TrashNoch keine Bewertungen
- 4 Química Descriptiva 2018Dokument29 Seiten4 Química Descriptiva 2018Martin GonzalezNoch keine Bewertungen
- Guia Laboratorios de Compuestos Organicos PDFDokument36 SeitenGuia Laboratorios de Compuestos Organicos PDFGlendy Guevara AlvaNoch keine Bewertungen
- Ejercicios Sobre SolucionDokument10 SeitenEjercicios Sobre SolucionEmi Guerra100% (1)
- 3sec Función ÓxidosDokument6 Seiten3sec Función ÓxidosElizabeth LionesNoch keine Bewertungen
- Laboratorio de Bioquímica 4Dokument15 SeitenLaboratorio de Bioquímica 4MelissaRodriguezPinoNoch keine Bewertungen
- POLÍMEROSDokument20 SeitenPOLÍMEROSSinai RiveraNoch keine Bewertungen
- Principales Materiales Organicos Utilizados en La IndustriaDokument7 SeitenPrincipales Materiales Organicos Utilizados en La IndustriaLaura CovarrubiasNoch keine Bewertungen
- Recuperación 1Dokument1 SeiteRecuperación 1Ener Somar100% (1)
- Compuestos Orgánicos Del S, P y SiDokument39 SeitenCompuestos Orgánicos Del S, P y SiDoloritasNoch keine Bewertungen
- Informe Práctica 8 Carbono y SilicioDokument13 SeitenInforme Práctica 8 Carbono y Siliciopooolcito0% (1)
- Formulación y Nomenclatura Orgánica 1 ParteDokument18 SeitenFormulación y Nomenclatura Orgánica 1 Partejesus royoNoch keine Bewertungen
- Biologia Celular - Clase 01Dokument71 SeitenBiologia Celular - Clase 01api-3701781100% (1)
- Qui MicaDokument20 SeitenQui Micaanon_614392175Noch keine Bewertungen
- Trabajo - en - Grupo - Tarea2 - Hidrocarburos Aromáticos, Alcoholes y Aminas - 100416 - 15 PDFDokument18 SeitenTrabajo - en - Grupo - Tarea2 - Hidrocarburos Aromáticos, Alcoholes y Aminas - 100416 - 15 PDFMarithza ArroyaveNoch keine Bewertungen
- Informe 13 QuimicaDokument14 SeitenInforme 13 QuimicaEvelyn Carolina Incacutipa LaymeNoch keine Bewertungen
- Proceso de Halogenación 1Dokument27 SeitenProceso de Halogenación 1MelissaMaraviAlvarado0% (1)
- Informe PsDokument28 SeitenInforme PsHugo Abdel Oblitas HuayapoNoch keine Bewertungen