Beruflich Dokumente
Kultur Dokumente
Calor de Dilución
Hochgeladen von
CarlosLanz0%(1)0% fanden dieses Dokument nützlich (1 Abstimmung)
4K Ansichten3 SeitenTemas de termodinamica
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenTemas de termodinamica
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0%(1)0% fanden dieses Dokument nützlich (1 Abstimmung)
4K Ansichten3 SeitenCalor de Dilución
Hochgeladen von
CarlosLanzTemas de termodinamica
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 3
Calor de dilucin
Cuando se le adiciona ms disolvente a una solucin, para disminuir la concentracin
del soluto, es comn que se libere o absorba calor adicional. El calor de dilucin es el
cambio de calor asociado al proceso de dilucin.
Cuando un proceso de disolucin es endotrmico (absorbe calor) y a dicha solucin se
le diluye, posteriormente la misma disolucin absorbe ms calor de los alrededores.
Caso contrario es cuando un proceso de disolucin es exotrmico, pues al adicionar
disolvente, liberar ms calor a los alrededores.
Un ejemplo de ello es el cido Sulfrico concentrado, que si se intenta diluir
adicionando agua el recipiente estallar. La forma recomendada es al envase con agua
agregar gota a gota el H2SO4 agitando para que se disipe el calor.
http://zona-quimica.blogspot.mx/2010/06/calor-de-dilucion.html
Ley de Kirchhoff.
Se refiere al efecto de la temperatura sobre el calor de reaccin. El calor de reaccin es
la diferencia entre la suma de entalpas de los reactivos y de los productos de la
reaccin, pero como unos y otros difieren en el color que absorben al variar de
temperatura, por ser distinta su capacidad calorfica, el calor de reaccin vara con la
temperatura. Si la capacidad calorfica de los reactivos es mayor que la de los productos,
el calor de reaccin ser mayor a temperatura ms elevada y, a la inversa, si es mayor la
de los productos, el calor de reaccin disminuir al elevar la temperatura. La ley de
Kirchhoff dice que: la variacin de la cantidad de calor producida en una reaccin
qumica, por cada grado que se eleva la temperatura, es igual a la diferencia entre la
suma de las capacidades calorficas molares de los reactivos y de los productos de la
reaccin.
http://html.rincondelvago.com/termoquimica_2.html
Influencia de la temperatura en las entalpas de reaccin
Muchas reacciones no ocurren a 298 K, por lo que debe analizarse como adaptar los
datos tabulados a otras condiciones.
Efecto de la temperatura en la entalpia de reaccin
https://es.scribd.com/doc/47189519/kirchoff
Ley de Hess:
Hess enuncio una ley muy importante aplicada a la termoqumica. La variacin de
Entalpa en una reaccin qumica va ser la misma si esta se produce en una sola etapa o
en varias etapas. Es decir, que la suma de los H de cada etapa de la reaccin nos dar
un valor igual al H de la reaccin cuando se verifica en una sola etapa. Esta ley ha sido
muy utilizada para la resolucin de problemas que a veces causan muchas dificultades
para los alumnos pero en realidad veremos que es sencilla.
http://www.quimicayalgomas.com/quimica-general/termoquimica-ytermodinamica/termoquimica-ley-de-hess/
En termodinmica, la ley de Hess, propuesta por Germain Henri Hess en 1840,
establece que: si una serie de reactivos ampara a dar una serie de productos, el calor de
reaccin liberado o absorbido es independiente de si la reaccin se lleva a cabo en una,
dos o ms etapas, esto es, que los cambios de entalpa son aditivos: Hneta = Hr.
Equivalentemente, se puede decir que el calor de reaccin slo depende de los reactivos
y los productos, o que el calor de reaccin es una funcin de estado; en este sentido la
ley de Hess es la aplicacin a las reacciones qumicas del primer principio de la
termodinmica; debido a que fue enunciada unos diez aos antes que sta, conserva su
nombre histrico.
La ley de Hess se utiliza para deducir el cambio de entalpa en una reaccin Hr, si se
puede escribir esta reaccin como un paso intermedio de una reaccin ms compleja,
siempre que se conozcan los cambios de entalpa de la reaccin global y de otros pasos.
En este procedimiento, la suma de ecuaciones qumicas parciales lleva a la ecuacin de
la reaccin global. Si la energa se incluye para cada ecuacin y es sumada, el resultado
ser la energa para la ecuacin global. Este procedimiento se apoya en que ya han sido
tabulados los calores de reaccin para un gran nmero de reacciones, incluyendo la
formacin a partir de sus elementos constituyentes de buena parte de las sustancias
qumicas conocidas.
http://prepa8.unam.mx/academia/colegios/quimica/infocab/unidad116.html
La entalpa de formacin (Hf0) es la variacin de energa calorfica en la reaccin de
formacin de un mol de un compuesto a partir de sus elementos en sus fases estndar en
condiciones de presin y temperatura estndar ambientales (TPEA), que son
temperatura de 298 K (25 C) y presin de 100 kPa ( 1 atm.).
http://quimica-explicada.blogspot.mx/2010/12/la-entalpia.html
Se designa como entalpa estndar de formacin o "calor estndar de formacin" de un
compuesto a la variacin de entalpa que acompaa la formacin de 1 mol de una
sustancia en su estado estndar a partir de sus elementos constituyentes en su estado
estndar (la forma ms estable de un elemento a 1 atmsfera de presin y una
determinada temperatura, que suele ser 298 K 25 C). Se denota por Hfo.
La variacin de entalpa estndar de formacin se mide en unidades de energa por
cantidad de sustancia. Se suelen dar en kilojulios por mol (kJ mol-1), pero puede venir
dada en cualquier unidad con las mismas dimensiones. Todos los elementos en sus
estados estndares (oxgeno gas, carbono slido en forma de grafito, etc.) tienen una
entalpa estndar de formacin de cero, dado que su formacin no supone ningn
proceso.
https://es.wikipedia.org/wiki/Variaci%C3%B3n_de_la_entalp%C3%ADa_est
%C3%A1ndar_de_formaci%C3%B3n
Das könnte Ihnen auch gefallen
- Formulario Fisicoquimica. 2Dokument2 SeitenFormulario Fisicoquimica. 2Leiva Medina Eder100% (1)
- Ejercicio Gabriela CardenasDokument2 SeitenEjercicio Gabriela CardenasBrayan AriasNoch keine Bewertungen
- Problemario 1 de Cinetica QuimicaDokument5 SeitenProblemario 1 de Cinetica QuimicaEdwin CastañedaNoch keine Bewertungen
- Influencia de Un Soluto en El Punto de CongelaciónDokument2 SeitenInfluencia de Un Soluto en El Punto de CongelaciónEnriqueMuñiz100% (1)
- Entalpia de Hidratación y SolvataciónDokument2 SeitenEntalpia de Hidratación y Solvataciónbryanmono14Noch keine Bewertungen
- Problemas Resueltos SEM7Dokument9 SeitenProblemas Resueltos SEM7ESTHIVEN KIM CRUZ AYTENoch keine Bewertungen
- Informe Ebulloscopia y Crioscopia Grupo1Dokument12 SeitenInforme Ebulloscopia y Crioscopia Grupo1Cristian Stalin100% (1)
- Tra BajitoDokument3 SeitenTra BajitoAnonymous R7DsqUMkNoch keine Bewertungen
- Constante CrioscopicaDokument3 SeitenConstante CrioscopicaAlexa BedoyaNoch keine Bewertungen
- Termofisica y TermoquimicaDokument2 SeitenTermofisica y TermoquimicaYahaira Tuz0% (1)
- Presentación Unidad 4 Sánchez Angulo LeonardoDokument10 SeitenPresentación Unidad 4 Sánchez Angulo LeonardoFELIPE DE JESÚS SÁNCHEZ HERNÁNDEZ100% (1)
- Enzimas: Estudio Cinético de La CatalasaDokument8 SeitenEnzimas: Estudio Cinético de La CatalasaNicolNoch keine Bewertungen
- PRÁCTICA 3. Calor de FusiónDokument3 SeitenPRÁCTICA 3. Calor de FusiónIsrael José MendozaNoch keine Bewertungen
- Practica 9 Ley de HessDokument10 SeitenPractica 9 Ley de Hessaida13012002Noch keine Bewertungen
- Practica 6 Capacidades CalorificasDokument5 SeitenPractica 6 Capacidades CalorificasDomingo GuerraNoch keine Bewertungen
- NOc Si Sea Lo CorrectoDokument3 SeitenNOc Si Sea Lo CorrectoBujanosNoch keine Bewertungen
- A Que Se Denomina Actividad en TermodinamicaDokument2 SeitenA Que Se Denomina Actividad en TermodinamicaLuisa Dora50% (8)
- Práctica 6. Predicciòn de La Espontaniedad de Las Reacciones RedoxDokument3 SeitenPráctica 6. Predicciòn de La Espontaniedad de Las Reacciones RedoxIrving GarciaNoch keine Bewertungen
- Calor de Dilución, de Disolucion. DiferenciaDokument1 SeiteCalor de Dilución, de Disolucion. DiferenciaChristi Torres20% (5)
- Problema Con Reacción Química - Lucia MoralesDokument2 SeitenProblema Con Reacción Química - Lucia MoralesLucía Morales100% (1)
- Influencia de PH en RedoxDokument16 SeitenInfluencia de PH en RedoxAragón RicardoNoch keine Bewertungen
- Ley de RaoultDokument19 SeitenLey de RaoultVictor NievesNoch keine Bewertungen
- PRACTICA 5 TermoquimicaDokument10 SeitenPRACTICA 5 TermoquimicaValeria Serrano CruzNoch keine Bewertungen
- WDokument22 SeitenWJakelin PerezNoch keine Bewertungen
- Fisicoquimica 2 Unidad 3 SelectividadDokument17 SeitenFisicoquimica 2 Unidad 3 SelectividadDaniel AlcalaNoch keine Bewertungen
- Entalpia de Formación Del MgODokument3 SeitenEntalpia de Formación Del MgOJulián Gómez100% (1)
- Cine TicaDokument6 SeitenCine TicaMel RamosNoch keine Bewertungen
- TermofísicaDokument5 SeitenTermofísicaqueerdramaNoch keine Bewertungen
- Ejercicios Cinetica 1-14Dokument9 SeitenEjercicios Cinetica 1-14Alvaro Cabrera Diaz100% (1)
- Equilibrio Quimico FicoDokument9 SeitenEquilibrio Quimico FicoSherlin Almanza Obregon0% (1)
- Tarea Fases. Equilibrios Multicomponentes.Dokument2 SeitenTarea Fases. Equilibrios Multicomponentes.Juan David Velez EsquivelNoch keine Bewertungen
- Efecto de La Concentracion Sobre La Fem de La CeldaDokument8 SeitenEfecto de La Concentracion Sobre La Fem de La CeldaAlberto perez william0% (2)
- Práctica 11 Química Analítica-Díaz Ruiz Luis Fernando 4FM1Dokument4 SeitenPráctica 11 Química Analítica-Díaz Ruiz Luis Fernando 4FM1Fernando diaz ruizNoch keine Bewertungen
- Torre de BurbujeoDokument12 SeitenTorre de Burbujeovivanco alorNoch keine Bewertungen
- Practica 6 - Capacidades CalorificasDokument11 SeitenPractica 6 - Capacidades CalorificasYoali Asiain LeconaNoch keine Bewertungen
- DocxDokument24 SeitenDocxDiana PrietoNoch keine Bewertungen
- Titulaciones Redox PDFDokument35 SeitenTitulaciones Redox PDFVaniia Lomeli CruzNoch keine Bewertungen
- Unidad 5 Termofisica y TermoquimicaDokument13 SeitenUnidad 5 Termofisica y TermoquimicaChristian Paul Fausto Ruiz100% (1)
- FASESDokument4 SeitenFASESmariana gil0% (2)
- Practica 8. - Presion de VaporDokument11 SeitenPractica 8. - Presion de VaporJohn Víctor33% (3)
- Informe Ley de HessDokument5 SeitenInforme Ley de Hessyelina meza50% (2)
- Segunda Tarea Cinética FormalDokument1 SeiteSegunda Tarea Cinética FormalEdward AlexanderNoch keine Bewertungen
- 7.6 Punto Triple So2Dokument3 Seiten7.6 Punto Triple So2Rive Rosky33% (3)
- Cinética de Las Reacciones HomogéneasDokument10 SeitenCinética de Las Reacciones HomogéneasMichellt LópezNoch keine Bewertungen
- Práctica 4: Estimación de La Kps Del ZN (OH) 2.Dokument15 SeitenPráctica 4: Estimación de La Kps Del ZN (OH) 2.Enrique DelgadoNoch keine Bewertungen
- Calor de Formación, Entropía y Energía Libre de Gibbs.Dokument4 SeitenCalor de Formación, Entropía y Energía Libre de Gibbs.MaryjoseLeónNoch keine Bewertungen
- Constante de Equilibrio A Partir de Propiedades TermodinámicasDokument2 SeitenConstante de Equilibrio A Partir de Propiedades TermodinámicasKaren DaysNoch keine Bewertungen
- Balance de Energia Sin Reaccion QuimicaDokument8 SeitenBalance de Energia Sin Reaccion QuimicaKarelysRodríguez0% (1)
- Problemas Resueltos de FisicoquímicaDokument17 SeitenProblemas Resueltos de FisicoquímicaERICK GUSTAVO QUINTANILLA GARCIA100% (1)
- Practica 3 Lab II Líquidos Parcialmente Miscibles Sistema Fenol - AguaDokument10 SeitenPractica 3 Lab II Líquidos Parcialmente Miscibles Sistema Fenol - Aguagabriel0% (1)
- Inf CURVAS DE CALIBRACIÓN (1) - KarenDokument11 SeitenInf CURVAS DE CALIBRACIÓN (1) - KarenTatiana GuashpaNoch keine Bewertungen
- Cuestiones para Discutir Capítulo 1Dokument6 SeitenCuestiones para Discutir Capítulo 1Isaac Pineda Carbajal100% (4)
- Calor de NeutralizacionDokument7 SeitenCalor de NeutralizacionAlán López0% (3)
- Nuevas Tecnologías ExtraccionDokument4 SeitenNuevas Tecnologías ExtraccionDaniel AparicioNoch keine Bewertungen
- Independencia Del Cambio de Entalpia de La Reaccion.Dokument5 SeitenIndependencia Del Cambio de Entalpia de La Reaccion.Diana Carolina Buitrago TorresNoch keine Bewertungen
- Cuestionario TermoqiomicaDokument3 SeitenCuestionario TermoqiomicaPaola RiinaNoch keine Bewertungen
- Ley de HessDokument6 SeitenLey de HessEdwin EnriqueNoch keine Bewertungen
- Definición de TermoquímicaDokument11 SeitenDefinición de Termoquímicacuat_007Noch keine Bewertungen
- CALOR DE REACCIÓN InformeDokument4 SeitenCALOR DE REACCIÓN InformeTATIANA MARCELA BERMEJO ARAUJONoch keine Bewertungen
- TERMOQUÍMICADokument26 SeitenTERMOQUÍMICAFredy López MedinaNoch keine Bewertungen
- Hermeneutica IDokument2 SeitenHermeneutica ICarlosLanzNoch keine Bewertungen
- Formulas Interesantes para Productos de Limpieza TORRES PDFDokument24 SeitenFormulas Interesantes para Productos de Limpieza TORRES PDFCarlosLanz100% (1)
- Evidencias CristianasDokument54 SeitenEvidencias CristianasCarlosLanzNoch keine Bewertungen
- Analisis Comparativo de Ladrillos SustentablesDokument16 SeitenAnalisis Comparativo de Ladrillos SustentablesCarlosLanzNoch keine Bewertungen
- Analisis Comparativo de Ladrillos SustentablesDokument16 SeitenAnalisis Comparativo de Ladrillos SustentablesCarlosLanzNoch keine Bewertungen
- ApagallamasDokument47 SeitenApagallamasCarlosLanzNoch keine Bewertungen
- Leccion 11-Jesus Sana A Un CiegoDokument3 SeitenLeccion 11-Jesus Sana A Un CiegoCarlosLanzNoch keine Bewertungen
- Equipos Utilizados para La Extracción SolidoDokument7 SeitenEquipos Utilizados para La Extracción SolidoCarlosLanzNoch keine Bewertungen
- Los 10 MandamientosDokument2 SeitenLos 10 MandamientosCarlosLanzNoch keine Bewertungen
- Ecuacion de Antoine. Base de DatosDokument13 SeitenEcuacion de Antoine. Base de DatosDurvelito Chulo Guapo0% (2)
- ECONOMIADokument20 SeitenECONOMIACarlosLanzNoch keine Bewertungen
- Sanson ActividadesDokument1 SeiteSanson ActividadesCarlosLanzNoch keine Bewertungen
- Dinamica NavidadDokument3 SeitenDinamica NavidadCarlosLanzNoch keine Bewertungen
- Respuestas de La Actividad Practica Cap 2 Cisco Ccna 3Dokument5 SeitenRespuestas de La Actividad Practica Cap 2 Cisco Ccna 3Barbara Sanchez0% (1)
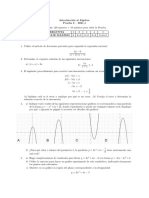
- Intro Algebra Prueba 2 - 2021 - 1Dokument1 SeiteIntro Algebra Prueba 2 - 2021 - 1Javier UrmenetaNoch keine Bewertungen
- Organismos Internacionales A Los Que Pertenece VenezuelaDokument5 SeitenOrganismos Internacionales A Los Que Pertenece VenezuelaM̦̻̙i͓͙̝t̡͎̺c͔͜h͙̫͎e̻̘͕l͍̝͇l̡͚͉ S͛aͣlaͣzaͣrͬ100% (1)
- Putas, Activistas y PeriodistasDokument201 SeitenPutas, Activistas y PeriodistasCaco MixtleNoch keine Bewertungen
- El Valor y Otras CaracteristicasDokument8 SeitenEl Valor y Otras CaracteristicasLisbethGarciaRamosNoch keine Bewertungen
- 2° Parcial-Preguntero ECONOMIA 2 - Junio-2021 - 210721 - 011932Dokument15 Seiten2° Parcial-Preguntero ECONOMIA 2 - Junio-2021 - 210721 - 011932ElisaNoch keine Bewertungen
- Guía de Retroalimentación en La Educacióna A DistanciaDokument26 SeitenGuía de Retroalimentación en La Educacióna A Distanciamiguel cuadros rijasNoch keine Bewertungen
- Album Textos FuncionalesDokument7 SeitenAlbum Textos FuncionalesElizabeth ZunigaNoch keine Bewertungen
- RESUMEN - Mario Rapoport y Noemi Brenta - Las Grandes Crisis Del Capitalismo ContémporaneoDokument6 SeitenRESUMEN - Mario Rapoport y Noemi Brenta - Las Grandes Crisis Del Capitalismo ContémporaneoLuis Acosta100% (1)
- Formato de Solicitud de Referencias LaboralesDokument2 SeitenFormato de Solicitud de Referencias LaboralesEylin Villatoro74% (38)
- Alpina (1) AbcDokument4 SeitenAlpina (1) AbcDaniel Valencia100% (1)
- Casos Clínicos de Psiquiatria. DR Erwin RonerDokument7 SeitenCasos Clínicos de Psiquiatria. DR Erwin Ronerfnbr9p65gfNoch keine Bewertungen
- Practica No 2 Estadistica 223 Jesus Lopez de La CruzDokument6 SeitenPractica No 2 Estadistica 223 Jesus Lopez de La CruzJesus LopezNoch keine Bewertungen
- El Sistema Solar Por Oscar TejedaDokument10 SeitenEl Sistema Solar Por Oscar TejedaOscar TejedaNoch keine Bewertungen
- Derecho Civil 3 Silabo 5Dokument5 SeitenDerecho Civil 3 Silabo 5Benjamín GuzmánNoch keine Bewertungen
- El Cuerpo Humano Parte 2Dokument39 SeitenEl Cuerpo Humano Parte 2Alex GutiNoch keine Bewertungen
- Apendice Caso ClinicoDokument38 SeitenApendice Caso ClinicoSofia CVNoch keine Bewertungen
- Géneros Periodísticos - Resumen de TEORÍADokument8 SeitenGéneros Periodísticos - Resumen de TEORÍAGina GutierrezNoch keine Bewertungen
- Hoja de Vida Rafael Dionisio Vélez Ramos 2013-04-13Dokument4 SeitenHoja de Vida Rafael Dionisio Vélez Ramos 2013-04-13Carlos Oliver van ArcherNoch keine Bewertungen
- 240 Derecho Procesal Administrativo PDFDokument6 Seiten240 Derecho Procesal Administrativo PDFFrancisco KestlerNoch keine Bewertungen
- Resumen de Modulo 7Dokument7 SeitenResumen de Modulo 7scarlett perezNoch keine Bewertungen
- Examen 5 de TeresaDokument38 SeitenExamen 5 de Teresabrigitte-capella100% (1)
- CEPER 3 TLP PDFDokument6 SeitenCEPER 3 TLP PDFjuanjoprelaboral50% (2)
- NIVELES de TRANSTEXTUALIDAD Lectoescritura. Trabajo FinalDokument7 SeitenNIVELES de TRANSTEXTUALIDAD Lectoescritura. Trabajo Finaljacqueline bacaNoch keine Bewertungen
- AA2nEvidencia ItemsDokument6 SeitenAA2nEvidencia ItemsJOSE VICENTE RUIZ PEÑANoch keine Bewertungen
- 6 Modulacion PasaBandaDokument180 Seiten6 Modulacion PasaBandaJiannmarcos Córdova PérezNoch keine Bewertungen
- Autoevaluacion 1 ErparcialDokument4 SeitenAutoevaluacion 1 ErparcialGabriela BernedoNoch keine Bewertungen
- Comparar y Contrastar La Política Exterior de Hitler y Mussolini Hasta El Estallido de La Segunda Guerra MundialDokument1 SeiteComparar y Contrastar La Política Exterior de Hitler y Mussolini Hasta El Estallido de La Segunda Guerra MundialBryan Locotronic Toala100% (1)
- Grado Sexto ReligionDokument9 SeitenGrado Sexto ReligionEVERT ACHAGUANoch keine Bewertungen
- Creatividad PsicologiaDokument16 SeitenCreatividad PsicologiaDaniel RiosNoch keine Bewertungen