Beruflich Dokumente
Kultur Dokumente
Capitulo 16 Raymond Chang
Hochgeladen von
SantiagoAlcantaraOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Capitulo 16 Raymond Chang
Hochgeladen von
SantiagoAlcantaraCopyright:
Verfügbare Formate
Continuaremos con el estudio de las propiedades y reacciones entre cidos y bases
que se comenz en el captulo 15, pero aqu consideraremos el efecto de los iones
comunes sobre el grado de ionizacin de un cido y, en consecuencia, sobre el pH
de la disolucin. (16.2)
Despus, ampliaremos el anlisis para abarcar las disoluciones amortiguadoras, cuyo
pH permanece inalterable cuando se les agregan pequeas cantidades de cidos y
bases. (16.3)
El estudio de la qumica de cidos y bases lo concluiremos con el examen ms
detallado de la valoracin cido-base. Aprenderemos a calcular el pH durante cualqui
er
etapa de la valoracin en la que tomen parte cidos y bases fuertes, dbiles,
o ambas. Adems, veremos cmo se utilizan los indicadores cido-base para determinar
el punto i nal de una valoracin. (16.4 y 16.5)
Luego exploraremos un tipo de equilibrio heterogneo, el cual trata con la solubil
idad
de sustancias escasamente solubles. Aprenderemos a expresar la solubilidad de
estas sustancias en trminos del producto de solubilidad. Observaremos que los
diferentes tipos de iones metlicos se pueden separar ei cazmente mediante la adic
in
de un anin adecuado dependiendo de sus distintos productos de solubilidad.
(16.6 y 16.7)
Tambin veremos cmo ayuda el principio de Le Chtelier a explicar los efectos del
ion comn y del pH en la solubilidad. (16.8 y 16.9)
Aprenderemos cmo la formacin de iones complejos, que es un tipo de reaccin
cido-base de Lewis, puede mejorar la solubilidad de un compuesto insoluble.
(16.10)
Por ltimo, aplicaremos el principio de producto de solubilidad al anlisis cualitat
ivo,
el cual consiste en la identii cacin de los iones en disolucin. (16.11)
En el presente captulo continuaremos con el estudio de las reacciones de los cidos
y las bases,
el anlisis de las valoraciones cido-base y la accin de las disoluciones amortiguado
ras.
Tambin estudiaremos otro tipo de equilibrio acuoso, el que se establece entre un
compuesto ligeramente
soluble y sus respectivos iones en disolucin.
16.1 Comparacin entre los equilibrios homogneo
y heterogneo en disolucin
En el captulo 15 pudimos observar que los cidos dbiles y las bases dbiles nunca se
ionizan por completo en el agua. Por ejemplo, una disolucin de un cido dbil en el
equilibrio contiene tanto el cido no ionizado como los iones H y la base conjugad
a. No
obstante, todas estas especies estn disueltas, por lo que el sistema es un ejempl
o de
equilibrio homogneo (vea el captulo 14).
Existe otro tipo de reaccin en equilibrio, que consideraremos en la segunda mitad
de este captulo, en la que se disuelven y precipitan sustancias ligeramente solub
les. Tales
procesos son ejemplos de equilibrios heterogneos , es decir, los componentes de l
a reaccin
estn presentes en ms de una fase.
16.2 Efecto del ion comn
Nuestro estudio de los procesos de ionizacin cido-base e hidrlisis de sales, consid
erados
en el captulo 15, se restringi a disoluciones que contienen un solo soluto. Aqu
analizaremos las propiedades cido-base de disoluciones de dos solutos que contien
en el
mismo ion (catin o anin), denominado ion comn.
La presencia de un ion comn suprime la ionizacin de un cido dbil o de una base
dbil. Por ejemplo, cuando el acetato de sodio y el cido actico se disuelven en la m
isma
disolucin, se disocian e ionizan formando iones CH3COO:
El CH3COONa es un electrlito fuerte, por lo que se disocia por completo en la dis
olucin,
en tanto que el CH3COOH es un cido dbil, y se ioniza slo en parte. De acuerdo con
el principio de Le Chtelier, la adicin de iones CH3COO2 provenientes del CH3COONa
a una disolucin de CH3COOH suprime la ionizacin del cido (es decir, desplaza el
equilibrio hacia la izquierda), por lo que disminuye la concentracin de iones hid
rgeno.
En consecuencia, una disolucin que contenga CH3COOH y CH3COONa ser menos cida
que aquella que slo contenga CH3COOH a la misma concentracin. El desplazamiento
del equilibrio de ionizacin del cido actico se debe a los iones acetato de la sal.
El
CH3COO2 es el ion comn porque lo aportan tanto el CH3COOH como el CH3COONa.
El efecto del ion comn es el desplazamiento del equilibrio causado por la adicin
de un compuesto que tiene un ion comn con la sustancia disuelta. Este efecto tien
e una
funcin importante en la determinacin del pH de una disolucin y en la solubilidad de
una sal poco soluble (que analizaremos despus en este captulo). En este apartado e
studiaremos
el efecto del ion comn y su relacin con el pH de una disolucin . Conviene
tener en cuenta que, a pesar de su nombre particular, el efecto del ion comn es sl
o un
caso especial del principio de Le Chtelier .
Disoluciones amortiguadoras
Una disolucin amortiguadora , buffer o tampn es una disolucin de 1) un cido dbil
o una base dbil y 2) su sal; es decir, ambos componentes deben estar presentes. L
a disolucin
tiene la capacidad de resistir los cambios del pH cuando se agregan pequeas
cantidades de cido o de base. Las disoluciones amortiguadoras son muy importantes
en
los sistemas qumicos y biolgicos. El pH en el cuerpo humano vara mucho de un fluido
.
a otro; por ejemplo, el pH de la sangre est alrededor de 7.4, en tanto que el del
jugo
gstrico humano puede ser de 1.5. En gran parte, estos valores del pH, que son muy
importantes
para el funcionamiento adecuado de las enzimas y del balance de la presin
osmtica, se mantienen por accin de los sistemas amortiguadores .
Una disolucin amortiguadora debe contener una concentracin relativamente grande
de cido para reaccionar con los iones OH2 que se le aadan; y tambin debe contener
una concentracin semejante de base para neutralizar los iones H1 que se le agregu
en.
Adems, los componentes cidos y bsicos del amortiguador no deben consumirse el uno
al otro en una reaccin de neutralizacin . Estos requerimientos se satisfacen con u
n par
conjugado cido-base , por ejemplo, un cido dbil y su base conjugada (suministrada p
or
una sal) o una base dbil y su cido conjugado (suministrado por una sal).
Una disolucin amortiguadora simple se puede preparar al mezclar cantidades molare
s
semejantes de cido actico (CH3COOH) y de su sal acetato de sodio (CH3COONa)
en medio acuoso. Se supone que las concentraciones en el equilibrio del cido y la
base
conjugada (que proviene del CH3COONa) son iguales a las concentraciones iniciale
s (vea
la pgina 724). Una disolucin que contenga estas dos sustancias tiene la capacidad
de
neutralizar un cido o una base que se le agregue. El acetato de sodio, un electrli
to
fuerte, se disocia por completo en agua.
16.4 Valoraciones cido-base
Una vez estudiadas las disoluciones amortiguadoras, es posible revisar ahora con
mayor
detalle los aspectos cuantitativos de las valoraciones cido-base que se describie
ron en la
seccin 4.6. Consideraremos tres tipos de reacciones: 1) valoraciones que incluyen
un
cido fuerte y una base fuerte, 2) valoraciones que incluyen un cido dbil y una base
fuerte y 3) valoraciones que incluyen un cido fuerte y una base dbil. Las valoraci
ones
en las que participan un cido y una base dbiles son ms complicadas porque hay hidrli
sis
tanto del catin como del anin de la sal formada. Por esta razn, estas valoraciones
no las abordaremos aqu. En la i gura 16.3 se muestra el equipo necesario para med
ir el
pH durante el transcurso de una valoracin.
16.5 Indicadores cido-base
Como hemos visto, el punto de equivalencia es el punto en el que el nmero de mole
s de
iones OH2 aadidos a una disolucin es igual al nmero de moles de iones H1 presentes
inicialmente. Para determinar el punto de equivalencia en una valoracin , debemos
conocer
con exactitud cunto volumen de base se ha aadido desde una bureta a un cido
contenido en un matraz. Una forma de lograrlo consiste en aadir unas pocas gotas
de un
indicador cido-base a la disolucin cida al principio de la valoracin. Debe recordar,
del
captulo 4, que un indicador es, por lo general, un cido orgnico o una base orgnica
dbil que presenta colores diferentes en sus formas ionizada y no ionizada. Estas
dos
formas se relacionan con el pH de la disolucin en la que se disuelva el indicador
. El
punto i nal de una valoracin se alcanza cuando el indicador cambia de color. Sin
embargo,
no todos los indicadores cambian de color al mismo pH, as que la eleccin de un
indicador para una valoracin en particular depende de la naturaleza del cido y la
base
utilizados (es decir, si son fuertes o dbiles). Al elegir el indicador apropiado,
utilizamos
el punto i nal de la valoracin para determinar el punto de equivalencia, como ver
emos a
continuacin.
Muchos indicadores cido-base son colorantes vegetales. Por ejemplo, al hervir en
agua col morada cortada se pueden extraer pigmentos que presentan colores muy di
stintos
a diferentes valores del pH (i gura 16.8). En la tabla 16.1 se presenta un lista
do de los
indicadores que ms se utilizan en las valoraciones cido-base. La eleccin del indica
dor
depender de la fuerza del cido y la base que se utilizan en una valoracin particula
r.
16.6 Equilibrios de solubilidad
Las reacciones de precipitacin son importantes en la industria, la medicina y la
vida
diaria. Por ejemplo, la preparacin de muchos productos qumicos industriales esenci
ales
como el carbonato de sodio (Na2CO3) se basa en reacciones de precipitacin. Cuando
el
esmalte de los dientes, que est formado principalmente por hidroxiapatita [Ca5(PO
4)3OH] ,
se disuelve en un medio cido, se producen caries. El sulfato de bario (BaSO4) , u
n compuesto
insoluble opaco a los rayos X, se utiliza para el diagnstico de trastornos del
tracto digestivo. Las estalactitas y estalagmitas, que estn constituidas de carbo
nato de
calcio (CaCO3) , son producto de una reaccin de precipitacin, al igual que muchos
alimentos,
como el dulce de chocolate.
Las reglas generales para predecir la solubilidad de los compuestos inicos en agu
a
se describieron en la seccin 4.2. Aunque estas reglas son tiles, no nos permiten h
acer
predicciones cuantitativas de la cantidad de un compuesto inico determinado que s
e disolver
en agua. Para desarrollar un enfoque cuantitativo partimos de lo que conocemos
acerca del equilibrio qumico . A menos que se seale otra cosa, se sobreentiende qu
e el
disolvente es agua y la temperatura es de 25C para los procesos de solubilidad qu
e a
continuacin se describen.
Solubilidad molar y solubilidad
Hay dos formas de expresar la solubilidad de una sustancia : como solubilidad mo
lar, que
es el nmero de moles de soluto en un litro de una disolucin saturada (mol entre L)
, y como
solubilidad, que es el nmero de gramos de soluto en un litro de una disolucin satu
rada
(gramo entre L). Observe que ambas expresiones se rei eren a la concentracin en d
isoluciones saturadas
a una temperatura determinada (que suele ser de 25C).
Tanto la solubilidad molar como la solubilidad son cantidades apropiadas para el
trabajo del laboratorio, y se utilizan para determinar los valores de Kps median
te los pasos
sealados en la i gura 16.9a).
Cuando efectuamos clculos de solubilidad, del producto de solubilidad, o de ambos
,
deben recordarse los siguientes puntos importantes:
1. La solubilidad es la cantidad de sustancia que se disuelve en una cantidad de
terminada
de agua para producir una disolucin saturada. En los clculos de equilibrio de
solubilidad por lo general sta se expresa como gramos de soluto por litro de diso
lucin
. La solubilidad molar es el nmero de moles de soluto por litro de disolucin .
2. El producto de solubilidad es una constante de equilibrio.
3. La solubilidad molar, la solubilidad y el producto de solubilidad se rei eren
todos a
una disolucin saturada.
Prediccin de las reacciones de precipitacin
A partir del conocimiento de las reglas de solubilidad (vea la seccin 4.2) y de l
os productos
de solubilidad , incluidos en la tabla 16.2, podemos predecir si se formar un pre
cipitado
cuando mezclamos dos disoluciones o agregamos un compuesto soluble a una
disolucin. Esta experiencia tiene con frecuencia gran valor prctico. Con el i n de
obtener
un compuesto dado (en forma de precipitado) en las preparaciones industriales y
de laboratorio
podemos ajustar las concentraciones de los iones hasta que el producto inico
exceda el valor de Kps. La capacidad para predecir las reacciones de precipitacin
tambin
es muy til en medicina. Por ejemplo, los clculos renales, que a menudo resultan mu
y
dolorosos, estn constituidos casi por completo de oxalato de calcio, CaC2O4 (Kps
igual 2.3
por 10 a las menos 9). La concentracin i siolgica normal de los iones calcio en el
plasma sanguneo
es alrededor de 5 mM (1 mM igual 1 por 10a la menos 9 3 M). Los iones oxalato (C
2O422) , que provienen
del cido oxlico, que se encuentra en muchos vegetales como el ruibarbo y la espina
ca,
reaccionan con los iones calcio y forman oxalato de calcio insoluble, que con el
tiempo
se acumula en los riones. Una dieta balanceada ayudar al paciente a disminuir la f
ormacin
de este precipitado. El ejemplo 16.10 muestra los pasos implicados en la predicc
in
de las reacciones de precipitacin.
16.7 Separacin de iones por precipitacin fraccionada
En el anlisis qumico, en ocasiones conviene separar por precipitacin un tipo de ion
es
de una disolucin y dejar disueltos los dems. Por ejemplo, cuando se agregan iones
sulfato a una disolucin que contenga iones bario y iones potasio, se forma un pre
cipitado
de BaSO4, con lo que se separa la mayora de los iones Ba21 de la disolucin. El
otro producto , K2SO4, es soluble y permanecer disuelto. El precipitado de BaSO4 se
puede separar de la disolucin por i ltracin.
Aunque ambos productos fueran insolubles, podemos lograr cierto grado de separac
in
utilizando el reactivo apropiado para llevar a cabo la precipitacin. Considere un
a
disolucin que contiene iones Cl, Br y I. Estos iones se pueden separar al convert
irlos
en halogenuros de plata insolubles. Como indican sus valores de Kps que se muest
ran al
margen, la solubilidad de estos halogenuros disminuye del AgCl al AgI. De modo q
ue,
cuando un compuesto soluble como el nitrato de plata se aade lentamente a esta di
solucin,
el Ag precipita primero, seguido por el AgBr y por ltimo, el AgCl.
En el ejemplo 16.11 se describe la separacin de slo dos de estos iones (Cl y Br),
pero este procedimiento se puede aplicar a una disolucin que contenga ms de dos ti
pos
diferentes de iones, con la condicin de que se formen precipitados que tengan dis
tinta
solubilidad.
16.10 Los equilibrios de iones complejos y la solubilidad
Las reacciones entre cidos y bases de Lewis, en las que se combina un catin metlico
con una base de Lewis, llevan a formar iones complejos. As, un ion complejo se de
i ne
como un ion que contiene un catin metlico central enlazado a una o ms molculas o
iones. Los iones complejos son fundamentales para muchos procesos qumicos y biolgi
cos.
En esta seccin estudiaremos el efecto que tiene la formacin de un ion complejo en
la solubilidad. En el captulo 23 estudiaremos con ms detalle las propiedades qumica
s
de los iones complejos.
Los metales de transicin tienen una tendencia particular a formar iones complejos
porque poseen ms de un estado de oxidacin. Esta propiedad les permite comportarse
en
forma efectiva como cidos de Lewis , cuando reaccionan con varios tipos de molcula
s o
iones que sirven como donadores de electrones, o bases de Lewis .
Aplicacin del principio del producto
de solubilidad al anlisis cualitativo
En la seccin 4.6 revisamos el principio del anlisis gravimtrico , mediante el cual
se
mide la cantidad de un ion en una muestra desconocida. Aqu describiremos de maner
a
breve el anlisis cualitativo , que se basa en la determinacin de los tipos de ione
s presentes
en una disolucin. Centraremos la descripcin sobre todo en los cationes.
Hay unos 20 cationes comunes que se pueden analizar rpidamente en disolucin
acuosa. Estos cationes se dividen en cinco grupos de acuerdo con los productos d
e solubilidad
de sus sales insolubles (tabla 16.5). Como una disolucin desconocida puede conten
er
desde uno hasta los 20 iones, todo anlisis se debe hacer en forma sistemtica, del
grupo 1 al grupo 5. El procedimiento general para separar estos 20 iones compren
de la
adicin de reactivos precipitantes a una disolucin desconocida.
Cationes del grupo 1 . Cuando se agrega HCl diluido a la disolucin desconocida,
slo precipitan los iones Ag1, Hg1 y Pb1 como cloruros insolubles. Todos los dems
iones, cuyos cloruros son solubles, quedan en la disolucin.
Cationes del grupo 2 . Despus de que los precipitados de cloruro se han separado
por i ltracin, se hace reaccionar sulfuro de hidrgeno con la disolucin desconocida
acidii cada. En estas condiciones, la concentracin de los iones S22 que quedan di
sueltos
es insignificante.
Cationes del grupo 3 . En esta etapa se agrega hidrxido de sodio a la disolucin
para hacerla bsica. Esto hace que el equilibrio anterior se desplace hacia la der
echa.
Por lo tanto, ahora precipitarn los sulfuros ms solubles (CoS, FeS, MnS, NiS, ZnS)
.
Observe que los iones Al31 y Cr31 en realidad precipitan como hidrxidos, Al(OH)3
y Cr(OH)3 y no como sulfuros, ya que los hidrxidos son menos solubles. Enseguida
se i ltra la disolucin para separar los sulfuros y los hidrxidos insolubles.
Cationes del grupo 4 . Despus de que los cationes de los grupos 1, 2 y 3 se hayan
eliminado de la disolucin, se agrega carbonato de sodio a la disolucin bsica para
precipitar los iones Ba21, Ca21 y Sr21 como BaCO3, CaCO3 y SrCO3. Estos precipit
ados
tambin se separan de la disolucin por filtracin.
Cationes del grupo 5 . En esta etapa, los nicos cationes que posiblemente queden
en la disolucin son Na1, K1 y NH4
1. La presencia del NH4
1 se puede verii car aadiendo
hidrxido de sodio.
Es posible detectar el amoniaco gaseoso por su olor caracterstico o por el cambio
de
color rojo a azul del papel tornasol hmedo cuando se coloca encima (no en contact
o)
de la disolucin. Para coni rmar la presencia de los iones Na1 y K1, por lo genera
l
se emplea la prueba o ensaye a la l ama . Se humedece una porcin de alambre de
platino (elegido ste por ser inerte) con la disolucin y se quema a la l ama de un
mechero de Bunsen. Cada tipo de ion metlico produce un color caracterstico cuando
se calienta de esta manera. Por ejemplo, los iones Na1 emiten un color amarillo,
el color de los iones K1 es violeta y el de los iones Cu21 es verde (i gura 16.1
3).
El diagrama de l ujo que muestra la i gura 16.14 resume este procedimiento para
separar
los iones metlicos.
Deben mencionarse dos puntos relacionados con el anlisis cualitativo. Primero, la
separacin de los cationes en grupos debe ser lo ms selectiva posible. Esto signii
ca que
hay que elegir los aniones que se agreguen como reactivos de tal forma que preci
pite el
menor nmero de tipos de cationes. Por ejemplo, todos los cationes del grupo 1 tam
bin
forman sulfuros insolubles, de manera que si el H2S se hiciera reaccionar desde
el principio
con la disolucin, podran precipitar hasta siete sulfuros diferentes (los sulfuros
de
los grupos 1 y 2), lo cual no es deseable. En segundo lugar, la separacin de los
cationes
en cada etapa debe ser tan completa como sea posible. Por ejemplo, si no se agre
ga sui -
ciente HCl a la disolucin desconocida para separar todos los cationes del grupo 1
, stos
precipitarn con los cationes del grupo 2 como sulfuros insolubles. Esto interi er
e con el
anlisis qumico ulterior y lleva a conclusiones errneas.
resumen de capitulo
1. El efecto del ion comn tiende a suprimir la ionizacin de
un cido dbil o una base dbil. Esta accin puede explicarse
mediante el principio de Le Chtelier.
2. Una disolucin amortiguadora es una combinacin de un
cido dbil y su base conjugada dbil (provista por una sal)
o una base dbil y su cido conjugado dbil (provisto por
una sal); la disolucin reacciona con pequeas cantidades
de cido o base que se le agregan, de tal forma que el pH de
la disolucin permanece casi constante. Los sistemas
amortiguadores tienen una funcin vital en el mantenimiento
del pH de los l uidos corporales.
3. El pH en el punto de equivalencia de una valoracin cidobase
depende de la hidrlisis de la sal formada en la reaccin
de neutralizacin. Para las valoraciones cido
fuerte-base fuerte, el pH en el punto de equivalencia es 7;
para las valoraciones cido dbil-base fuerte, el pH en el
punto de equivalencia es mayor a 7; para las valoraciones
cido fuerte-base dbil, el pH en el punto de equivalencia
es menor a 7.
4. Los indicadores cido-base son cidos o bases orgnicos
dbiles que cambian de color cerca del punto de equivalencia
en una reaccin de neutralizacin cido-base.
5. El producto de solubilidad Kps expresa el equilibrio entre
un slido y sus iones en disolucin. La solubilidad se puede
encontrar a partir de Kps y viceversa.
6. La presencia de un ion comn disminuye la solubilidad de
una sal ligeramente soluble.
7. La solubilidad de las sales ligeramente solubles que contienen
aniones bsicos se incrementa a medida que la concentracin
del ion hidrgeno aumenta. La solubilidad de las
sales con aniones derivados de cidos fuertes no se ve afectada
por el pH.
8. Los iones complejos se forman en disolucin mediante la
combinacin de un catin metlico con una base de Lewis.
La constante de formacin Kf mide la tendencia para la
formacin de un ion complejo especi co. La formacin del
ion complejo puede incrementar la solubilidad de una sustancia
insoluble.
9. El anlisis cualitativo es la identii cacin de cationes y
aniones en disolucin.
Das könnte Ihnen auch gefallen
- Soluciones Amortiguadoras de PH y PohDokument22 SeitenSoluciones Amortiguadoras de PH y PohRichard Silva TrianaNoch keine Bewertungen
- 2.1 Constante de Equilibrio Quimico en Sistemas HomogeneosDokument15 Seiten2.1 Constante de Equilibrio Quimico en Sistemas HomogeneosJORDINoch keine Bewertungen
- Presentacion SolubilidadDokument36 SeitenPresentacion Solubilidadyho nnyNoch keine Bewertungen
- Ejercicios AnaliticaDokument2 SeitenEjercicios AnaliticaAle SalazarNoch keine Bewertungen
- Volumetría Ácido-Base - Cuantificación de Fosfatos de Una Muestra ProblemaDokument5 SeitenVolumetría Ácido-Base - Cuantificación de Fosfatos de Una Muestra ProblemaDavid OcampoNoch keine Bewertungen
- Informe 7 Sintesis de Williamson 1Dokument7 SeitenInforme 7 Sintesis de Williamson 1Humberto Flores LealNoch keine Bewertungen
- Anteproyecto Titulación Ácido-Base Método de Pesadas y DisolucionesDokument18 SeitenAnteproyecto Titulación Ácido-Base Método de Pesadas y DisolucionesAbraham SánchezNoch keine Bewertungen
- Informe II Cristalización SimpleDokument3 SeitenInforme II Cristalización SimpleChristopher Hurtado CarmonaNoch keine Bewertungen
- Marco Teoric1Dokument20 SeitenMarco Teoric1Kevin Mamani0% (1)
- Taller de Enlaces Químicos Geometría Resonancia PolaridadDokument2 SeitenTaller de Enlaces Químicos Geometría Resonancia PolaridadLili OliverosNoch keine Bewertungen
- Reporte Fisico QuimicaDokument8 SeitenReporte Fisico QuimicaFelipe VilchesNoch keine Bewertungen
- Lab 6Dokument17 SeitenLab 6Ayrton Jimenez InfantesNoch keine Bewertungen
- Seminario 5 Halogenuros de AlquiloDokument4 SeitenSeminario 5 Halogenuros de AlquiloRaúl Nicolás Caicedo VidalNoch keine Bewertungen
- Antecedentes Alcoholes PrimariosDokument5 SeitenAntecedentes Alcoholes PrimariosHumberto Flores LealNoch keine Bewertungen
- ISOMERIA GEOMÉTRICA COMPLEJOS Cu (Reparado)Dokument8 SeitenISOMERIA GEOMÉTRICA COMPLEJOS Cu (Reparado)Memo GranadosNoch keine Bewertungen
- Ejercicios Efecto Ión Común y AmortiguadoresDokument1 SeiteEjercicios Efecto Ión Común y AmortiguadoresJorge Alejandro Vargas Alvarez100% (1)
- Práctica #7 - Propiedades Químicas de Aldehídos y CetonasDokument6 SeitenPráctica #7 - Propiedades Químicas de Aldehídos y CetonasJUAN ANDRES CARVAJAL MEDINANoch keine Bewertungen
- Lab NeutralizacionDokument19 SeitenLab Neutralizacionapi-3802357100% (7)
- Equilibrio Resueltos2Dokument7 SeitenEquilibrio Resueltos2LEODAN BLADIMIR MAMANI ZAPANANoch keine Bewertungen
- Volumetría Por Formación de Precipitados (Ramos)Dokument5 SeitenVolumetría Por Formación de Precipitados (Ramos)Alex LumbardoNoch keine Bewertungen
- Informe 1 Inorgánica - Compuestos de CoordinaciónDokument13 SeitenInforme 1 Inorgánica - Compuestos de Coordinaciónandrea yuilanaNoch keine Bewertungen
- Ley Periódica (Informe)Dokument10 SeitenLey Periódica (Informe)Hiroaki DarkNoch keine Bewertungen
- Reporte Experimental QuelatoDokument9 SeitenReporte Experimental QuelatoEdgar ArmandoNoch keine Bewertungen
- Práctica 4Dokument8 SeitenPráctica 4Ioskani EstradaNoch keine Bewertungen
- Práctica L-Reacciones de AdiciónDokument14 SeitenPráctica L-Reacciones de AdiciónAndy AldamaNoch keine Bewertungen
- Ejercicios Resueltos - Unidad 11Dokument31 SeitenEjercicios Resueltos - Unidad 11Ximena AraujoNoch keine Bewertungen
- Guia Ejercicios 1 AB 531324 1S 2019 Con Resolucion de Algunos EjDokument15 SeitenGuia Ejercicios 1 AB 531324 1S 2019 Con Resolucion de Algunos EjKristofer BonillaNoch keine Bewertungen
- Practica 7Dokument9 SeitenPractica 7Gabo LiceaNoch keine Bewertungen
- Famaring EjerciciosDokument3 SeitenFamaring EjerciciosCamila CanoNoch keine Bewertungen
- Gravimetría Ejercicios SKOOGDokument10 SeitenGravimetría Ejercicios SKOOGSol MarinaNoch keine Bewertungen
- Informe Acidos CarboxilicosDokument6 SeitenInforme Acidos CarboxilicosCami ChavezNoch keine Bewertungen
- Introducción: Química Analítica Cualitativa Se Centra en Identificar LaDokument76 SeitenIntroducción: Química Analítica Cualitativa Se Centra en Identificar LaJhonatan FloresNoch keine Bewertungen
- Sexta Actividad de Teoria IonizacionDokument2 SeitenSexta Actividad de Teoria IonizacionSuny StylesNoch keine Bewertungen
- Determinación de La Constante de EquilibrioDokument2 SeitenDeterminación de La Constante de EquilibrioChiran Alexis0% (1)
- XDDDDokument8 SeitenXDDDBrandon EspinozaNoch keine Bewertungen
- Ruptura Oxidativa de AlquenosDokument2 SeitenRuptura Oxidativa de AlquenosEsteban Lopez67% (3)
- Ejercicios RedoxDokument2 SeitenEjercicios RedoxVictor Lecca60% (5)
- Cuestionario IV Ácido Carboxilicos-Sebastian RamírezDokument7 SeitenCuestionario IV Ácido Carboxilicos-Sebastian RamírezSebastian Ramirez AreizaNoch keine Bewertungen
- Teoría Ácidos y Bases Blandos y DurosDokument2 SeitenTeoría Ácidos y Bases Blandos y Durosfama_20Noch keine Bewertungen
- Reportes Practica 5Dokument6 SeitenReportes Practica 5MARTIN BRYAN LEON BERNALNoch keine Bewertungen
- CUESTIONARIODokument3 SeitenCUESTIONARIOJuan Miguel VelezNoch keine Bewertungen
- Taller 6 EquilibrioDokument3 SeitenTaller 6 Equilibrioliz100% (1)
- Unidad 4 ConductividadDokument35 SeitenUnidad 4 Conductividadfamilia ApazaNoch keine Bewertungen
- 2.21 Cálculos EstequiometricosDokument4 Seiten2.21 Cálculos EstequiometricosDaniel QuirozNoch keine Bewertungen
- Reporte Efecto QuelatoDokument11 SeitenReporte Efecto QuelatoMarco Antonio MenesesNoch keine Bewertungen
- Practica 4 Complejos - de - CuDokument6 SeitenPractica 4 Complejos - de - CuJoan GarcíaNoch keine Bewertungen
- Taller 1. PH y AmortiguadoresDokument2 SeitenTaller 1. PH y AmortiguadoresCamilo HernandezNoch keine Bewertungen
- Analisis Quimico - Tercera SemanaDokument18 SeitenAnalisis Quimico - Tercera SemanaYudithMontalvoRamirezNoch keine Bewertungen
- Taller SolubilidadDokument10 SeitenTaller SolubilidadXiomara SanchezNoch keine Bewertungen
- Reloj Yodo Practica 3Dokument4 SeitenReloj Yodo Practica 3Edwin Jhovany Alzate RodríguezNoch keine Bewertungen
- Banco de Preguntas. ElectroquímicaDokument8 SeitenBanco de Preguntas. ElectroquímicaDanny Josué100% (1)
- Práctica 2 QA1Dokument7 SeitenPráctica 2 QA1Jazmin ArellanoNoch keine Bewertungen
- Derivados de Acidos CarboxilicosDokument6 SeitenDerivados de Acidos CarboxilicossiriusdarkNoch keine Bewertungen
- Sesiã N 11 - UIII - Coeficiente de RepartoDokument24 SeitenSesiã N 11 - UIII - Coeficiente de RepartoMiyaray LecarosNoch keine Bewertungen
- 11va SemanaDokument34 Seiten11va SemanaJoaquín GarcíaNoch keine Bewertungen
- Informe de Laboratorio N6Dokument14 SeitenInforme de Laboratorio N6Alex QuentaNoch keine Bewertungen
- Soluciones 1-2013 1TDokument2 SeitenSoluciones 1-2013 1TLuis VacaNoch keine Bewertungen
- Cap-8 Descusion InorganicaDokument12 SeitenCap-8 Descusion InorganicaOrlando Luna100% (1)
- VOLUMETRÍADokument38 SeitenVOLUMETRÍASaul oswaldo Ramirez cobianNoch keine Bewertungen
- Clase 15Dokument2 SeitenClase 15Daiana AlessiNoch keine Bewertungen
- Titulacion Af BFDokument28 SeitenTitulacion Af BFJose GonzalesNoch keine Bewertungen
- Informe de Fico Labo 3Dokument19 SeitenInforme de Fico Labo 3Anonymous SCHs0jNNNoch keine Bewertungen
- Laboratorio Nº1Dokument10 SeitenLaboratorio Nº1Francisco ValenzuelaNoch keine Bewertungen
- Acidos y Bases, PH AmortiguadoresDokument4 SeitenAcidos y Bases, PH AmortiguadoresCésarÑañez100% (1)
- Caída de Presión y Pérdida de CargaDokument4 SeitenCaída de Presión y Pérdida de CargaSantiagoAlcantaraNoch keine Bewertungen
- Ejercicios Metodos Numericos FinalDokument21 SeitenEjercicios Metodos Numericos FinalSantiagoAlcantaraNoch keine Bewertungen
- Presentacion Metodos NumericosDokument9 SeitenPresentacion Metodos NumericosSantiagoAlcantaraNoch keine Bewertungen
- Adsorción ResumenDokument4 SeitenAdsorción ResumenSantiagoAlcantaraNoch keine Bewertungen
- Analisis Vectorial y TensorialDokument22 SeitenAnalisis Vectorial y TensorialSantiagoAlcantaraNoch keine Bewertungen
- Calificaciones de Ingenieria QuimicaDokument5 SeitenCalificaciones de Ingenieria QuimicaSantiagoAlcantaraNoch keine Bewertungen
- Trabajo Final Piña Colada en Polvo InstantaneaDokument29 SeitenTrabajo Final Piña Colada en Polvo InstantaneaSantiagoAlcantaraNoch keine Bewertungen
- El Señor Esta AquiDokument3 SeitenEl Señor Esta AquiSantiagoAlcantaraNoch keine Bewertungen
- Todos Los Verbosen Ingles Letra GDokument18 SeitenTodos Los Verbosen Ingles Letra GSantiagoAlcantaraNoch keine Bewertungen
- Justificacion Mercadeo y VentasDokument1 SeiteJustificacion Mercadeo y VentasSantiagoAlcantaraNoch keine Bewertungen
- Hay Angeles en Este LugarDokument2 SeitenHay Angeles en Este LugarSantiagoAlcantaraNoch keine Bewertungen
- PRACTICAS PRESCRITAS de QUIMICADokument1 SeitePRACTICAS PRESCRITAS de QUIMICAjhean carlo chavez garciaNoch keine Bewertungen
- Guia de LaboratorioDokument3 SeitenGuia de LaboratorioJuan Manuel GilNoch keine Bewertungen
- Determinación Del Pka de Un Indicador Acido-Base Por EspectrofotometríaDokument16 SeitenDeterminación Del Pka de Un Indicador Acido-Base Por EspectrofotometríaingrossNoch keine Bewertungen
- Reporte Práctica 6 Química AnalíticaDokument4 SeitenReporte Práctica 6 Química AnalíticaAidan Jes SavageNoch keine Bewertungen
- Informe 8Dokument7 SeitenInforme 8Eumarielys EspinozaNoch keine Bewertungen
- 6.4 CAP 6 p4 - Equilibrio Ionico 2-2021 PARTE 4Dokument35 Seiten6.4 CAP 6 p4 - Equilibrio Ionico 2-2021 PARTE 4Grover F. Quispe CallizayaNoch keine Bewertungen
- Informe 7 .2013Dokument14 SeitenInforme 7 .2013Roy Cardenas ChaicoNoch keine Bewertungen
- Reacciones de NeutralizaciónDokument20 SeitenReacciones de NeutralizaciónNeider RojasNoch keine Bewertungen
- Analitica de VinagreDokument14 SeitenAnalitica de VinagreJudith Alexa Chamoli FigueroaNoch keine Bewertungen
- Clase 6 Volumetría Ácido Base (I) GeneralidadesDokument26 SeitenClase 6 Volumetría Ácido Base (I) GeneralidadesJorge Marcelo Mena Rojas100% (1)
- Guia de Problemas 5 - Volumetría Ácido BaseDokument5 SeitenGuia de Problemas 5 - Volumetría Ácido BaseSol PolitanoNoch keine Bewertungen
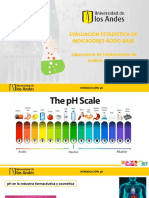
- Presentación Evaluación Estadística de IndicadoresDokument25 SeitenPresentación Evaluación Estadística de IndicadoresGabrielaNoch keine Bewertungen
- Taller 4 (2022.11.11)Dokument11 SeitenTaller 4 (2022.11.11)Valeria MedinaNoch keine Bewertungen
- Preguntas Informe 4Dokument3 SeitenPreguntas Informe 4Nicolh Enríquez0% (1)
- Practica 5 Acido AceticoDokument9 SeitenPractica 5 Acido AceticoClaudia BautistaNoch keine Bewertungen
- Práctica 7Dokument13 SeitenPráctica 7Milagros Alejandra Silva ChávezNoch keine Bewertungen
- CuestionarioDokument13 SeitenCuestionarioRodrigo Dalence100% (1)
- Pracatica 3. Analitica ExperimentalDokument1 SeitePracatica 3. Analitica ExperimentalXIMENA YAMILE NOGUEZ ALVAREZNoch keine Bewertungen
- Valoracion de VinagreDokument2 SeitenValoracion de VinagrenickNoch keine Bewertungen
- Informe QuimicaDokument27 SeitenInforme QuimicaDaves SanjurNoch keine Bewertungen
- 4 Bloque de Ejercicios Maq IDokument3 Seiten4 Bloque de Ejercicios Maq ILaura BrandNoch keine Bewertungen
- 03-22B Laboratorio Valoracion ConductimetricaDokument22 Seiten03-22B Laboratorio Valoracion ConductimetricaSILVIA MILAGROS SOTO CATASINoch keine Bewertungen
- Metodos Oficiales de Analisis EnologiaDokument89 SeitenMetodos Oficiales de Analisis EnologiaTeo SuazoNoch keine Bewertungen
- Informe N°5 Q RemasterizadoDokument10 SeitenInforme N°5 Q RemasterizadoJefferson Manuel Canales QuintanillaNoch keine Bewertungen