Beruflich Dokumente
Kultur Dokumente
Exo 54 - Dosage Acide Benzoique C
Hochgeladen von
Anis DahnenOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Exo 54 - Dosage Acide Benzoique C
Hochgeladen von
Anis DahnenCopyright:
Verfügbare Formate
PARTIE 1 : Etude par dosage pHmtrique
1- schma du montage
2- on ajoute de leau distille dans le bcher
Cet ajout deau distille permet llectrode du pHmtre dtre totalement immerge. Cet ajout modifiera trs
lgrement le pH du dbut du dosage mais ne modifiera en rien lquivalence.
3- Equation du dosage.
- -
C6H5CO2H(aq) + HO (aq) = C6H5CO2 (aq) + H2O(l)
4- Ajout dhydroxyde de sodium
Calculons le quotient de raction :
Qr =
[C H CO ]
6 5
=
[C H CO ]
2 eq
[H O ]= K 6 5
2 eq 3
+
A
=
10 pKa 104,2
= =6,.10
9
cette valeur est
[C H CO H ] [HO ] [C H CO H ] [HO ] [H O ] K
6 5 2 eq
eq 6 5 2 eq
eq
3
+
e Ke 1014
4
suprieure 10 donc la transformation est totale. La raction du dosage doit tre totale donc lajout
dhydroxyde de sodium permet de doser lacide benzoque.
-
5- quantit dion HO qui reste dans le bcher. Cela confirme-t-il la rponse la question 4- ?
+ -pH -4,5 -5
Pour VB = 8mL, le pH = 4,5 donc [H3O ] = 10 =10 = 3,2.10
Ke = 10
14
- -10 -1
Concentration en ion hydroxyde : [HO ] =
[H3O+ ] 3,2.105 =3,1.10 mol.L
- -10 -3 -12
Quantit dion hydroxyde qui reste : nB = [HO ]VB = 3,1.10 8,0.10 = 2,5.10 mol.
La quantit de matire est trs faible cela prouve bien que la transformation est totale.
6- Dfinir lquivalence.
A lquivalence les quantits de ractifs sont entirement consomms cest dire quils on t introduits dans
les proportions stoechiomtriques.
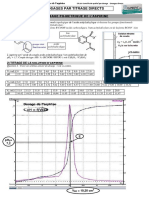
7- coordonnes du point E quivalent (VBE, pHE) .
A laide de la courbe dpH/ dVB , on trouve facilement le VBE = 12,5 mL car il reprsente labscisse du
maximum de dpH / dVB.
A laide de la mthode des tangentes : on trouve le pHE = 8 et on retrouve aussi la valeur de VBE = 12,5 mL.
Donc les coordonnes du point E sont (12,5 mL ; 8)
8- concentration molaire puis massique
A lquivalence nAdos = nBvers lquivalence do : CAVA = CBVBE
Donc CA =
CBVBE = 0,01012,5 = 5,0.10-3 mol.L-1 = concentration molaire
VA 25
Or concentration massique Cm = m = nM =C M =5,0.103122 =6,1.10-1g.L-1 = concentration massique
A
VA VA
9- valeur du pKA
lorsque VB = VBE /2 on note lordonne : pH1/2 = 4,2.
La moiti de lacide est consomm donc nA = nbase conjugue donc [acide] = [base conjugue]
Or pH = pKA +
[ ]
log base
[ ]
log base = 0 donc pH1/2 = pKA = 4,2
[acide] [acide]
10- le meilleur indicateur color pour ce dosage
Puisque le pHE = 8 il faut un indicateur color dont sa zone de virage contienne la valeur du pHE. Lindicateur
color est donc le rouge de crsol.
PARTIE 2 : La solubilit de lacide benzoque
1- Tout lacide benzoque se dissout-il dans leau
Calculons la concentration massique : Cm = m = 0,50 =1,0 g.mol-1 cette valeur est infrieure la
VA 500.103
solubilit donc lacide va entirement se dissoudre.
2- concentration molaire
C= n = m = Cm = 1,0 =8,2.10-3mol.L-1
V M V M 122
3- Equation de la raction de lacide benzoque avec leau.
- +
C6H5CO2H(aq) + H2O(l) = C6H5CO2 (aq) + H3O (aq)
4- Le pH de la solution (S) est de 3,2. Quelle est la forme prdominante du couple acide benzoque / ion
benzoate dans la solution (S) ?
pH est infrieur au pKA donc cest la forme acide qui prdomine.
5- tableau davancement de la raction de lacide benzoque avec leau.
- +
C6H5CO2H(aq) + H2O(l) = C6H5CO2 (aq) + H3O (aq)
Etat initial x=0 CV excs 0 0
Etat intermdiaire x CV x excs x x
Etat final xf CV-xf excs xf xf
6- avancement final et constante dacidit KA
xf = [H O ] V =10
3
+
f
pH
V = 10-3,2500.10-3 = 3,2.10-4 mol.
[C H CO ] [H O ] Vx Vx
6 5
2 f 3
+
f
f f
x2f (3,2.104 )
2
K = = = = =5,4.10-5
V(CV x f ) 500.103(8,2.103500.1033,2.104 )
A
[C H CO H ]
6 5 CV x
2 f f
V V
7- pKA.
-5
pKA = -log KA = - log (5,4.10 ) = 4,3 Cette valeur correspond au KA du premier paragraphe.
8- taux davancement final
xf xf 3,2.104 -2
= = = =7,8.10 = 7,8 % La raction est limite.
xmax CV 8 , 2 .103500.103
Das könnte Ihnen auch gefallen
- TD2 ChimieDokument3 SeitenTD2 ChimieSAMIA AQNOUCHNoch keine Bewertungen
- SA-Exos - 1 - 1112 Acido Basique ExocorrigéDokument12 SeitenSA-Exos - 1 - 1112 Acido Basique ExocorrigéLarbii BadrourNoch keine Bewertungen
- Exercice 1 (6 Points) Cinétique D'une Réaction D'estérificationDokument7 SeitenExercice 1 (6 Points) Cinétique D'une Réaction D'estérificationAli RammalNoch keine Bewertungen
- C Ex17 Cin CaDokument3 SeitenC Ex17 Cin CaHasan RajawiNoch keine Bewertungen
- Ouvrir SA Chap1 ConductimétrieDokument44 SeitenOuvrir SA Chap1 ConductimétrieLo Ana100% (1)
- Chimie TP7 Prof PDFDokument3 SeitenChimie TP7 Prof PDFمنير علي هباطي100% (1)
- Titrages Acido-Basiques PDFDokument4 SeitenTitrages Acido-Basiques PDFtarikNoch keine Bewertungen
- Fluides ViscoplastiqueDokument6 SeitenFluides ViscoplastiqueKadiri SaddikNoch keine Bewertungen
- TD RedoxDokument3 SeitenTD RedoxBamonNoch keine Bewertungen
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDokument3 Seiten2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucineNoch keine Bewertungen
- Mélange en SocieteDokument28 SeitenMélange en SocieteBill644Noch keine Bewertungen
- BAC Physique-Chimie-Specialite 2009 SDokument11 SeitenBAC Physique-Chimie-Specialite 2009 SLetudiant.fr100% (7)
- Chimie TP1 ProfDokument2 SeitenChimie TP1 ProfKheira RajaaNoch keine Bewertungen
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDokument5 SeitenAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- CAP Concentration ExoDokument2 SeitenCAP Concentration ExoAmdjed BahaaNoch keine Bewertungen
- Exercice Corrigé CinétiqueDokument13 SeitenExercice Corrigé Cinétiquejakobslimani02Noch keine Bewertungen
- Serie N°1 Médecine 2022-2023Dokument3 SeitenSerie N°1 Médecine 2022-2023Racha Ben AhmedNoch keine Bewertungen
- Wa0018 PDFDokument44 SeitenWa0018 PDFfadoua lakouissiNoch keine Bewertungen
- TP-PH-métrie ElectrochimieDokument14 SeitenTP-PH-métrie ElectrochimieAya DgmNoch keine Bewertungen
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDokument5 SeitenTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinaneNoch keine Bewertungen
- 11.les Dosages Redox 1Dokument6 Seiten11.les Dosages Redox 1Souad MahiNoch keine Bewertungen
- 08.neutralisation Acide BaseDokument6 Seiten08.neutralisation Acide BaseSifo GuendouzNoch keine Bewertungen
- S2 - Equilibres Acido-Basiques en Solution AqueuseDokument4 SeitenS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirNoch keine Bewertungen
- Corrigé Série N°2: Acides Et Bases: Département de La Formation Préparatoire - 2ème Année 2020 - 2021Dokument19 SeitenCorrigé Série N°2: Acides Et Bases: Département de La Formation Préparatoire - 2ème Année 2020 - 2021Nesrine Himrane100% (1)
- TP Chimie 1 (TP2)Dokument4 SeitenTP Chimie 1 (TP2)mohredNoch keine Bewertungen
- Série D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiDokument0 SeitenSérie D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiMouf55Noch keine Bewertungen
- Les Dosages Ou Titrages Directs Exercices Corriges 1 3Dokument6 SeitenLes Dosages Ou Titrages Directs Exercices Corriges 1 3rihabNoch keine Bewertungen
- Chimie Analytique (CH1)Dokument43 SeitenChimie Analytique (CH1)Jaafar ChirigNoch keine Bewertungen
- FICHE Dosage WebDokument4 SeitenFICHE Dosage Webفيديو بالعربيNoch keine Bewertungen
- Cinetique 01Dokument3 SeitenCinetique 01badreNoch keine Bewertungen
- TP D'éléctrochimieDokument7 SeitenTP D'éléctrochimieHanou BouNoch keine Bewertungen
- CH Gene TP Produit de SolubiliteDokument18 SeitenCH Gene TP Produit de SolubiliteMøhãmēd SøüríNoch keine Bewertungen
- Corrige Serie3 PDFDokument5 SeitenCorrige Serie3 PDFMohamedDokse0% (1)
- Serie de Tdi Biophysique 2021-2022Dokument3 SeitenSerie de Tdi Biophysique 2021-2022Fatïma ZohraNoch keine Bewertungen
- Reactiviter Chim CourDokument251 SeitenReactiviter Chim CourYounesse Saad EddineNoch keine Bewertungen
- 2 Année CP Chimie 3: Réactions de PrécipitationDokument14 Seiten2 Année CP Chimie 3: Réactions de Précipitationdjamaldjeddou1Noch keine Bewertungen
- PDF JavelDokument3 SeitenPDF JavelMahran BchatniaNoch keine Bewertungen
- Exo TDDokument8 SeitenExo TDBassirou YacoubaNoch keine Bewertungen
- TP2 Chimie MineralDokument7 SeitenTP2 Chimie MineralNà ZimNoch keine Bewertungen
- DM 1 Potentiel Chimique Diagrammes BinairesDokument3 SeitenDM 1 Potentiel Chimique Diagrammes BinairesDonguiNoch keine Bewertungen
- TP Chimie Compte Rendu Preparation Dune SolutionDokument6 SeitenTP Chimie Compte Rendu Preparation Dune SolutionAbdellah BerrouachdiNoch keine Bewertungen
- Yyy Suppexos cm4 cm5 Chimie Acides Bases PDFDokument16 SeitenYyy Suppexos cm4 cm5 Chimie Acides Bases PDFKurosaki AimarNoch keine Bewertungen
- Fonctions Usuelles PDFDokument29 SeitenFonctions Usuelles PDFchanezNoch keine Bewertungen
- Exercices ConductivitéDokument4 SeitenExercices ConductivitéAya AyaaaNoch keine Bewertungen
- TD tc7 DosagesDokument11 SeitenTD tc7 Dosagescours importantNoch keine Bewertungen
- Exo 54 - Dosage Acide Benzoique EDokument2 SeitenExo 54 - Dosage Acide Benzoique EislameilhamiNoch keine Bewertungen
- Avancement D - Une RéactionDokument2 SeitenAvancement D - Une RéactionchebbisNoch keine Bewertungen
- Vert de Bromocrésol 2008-2009Dokument3 SeitenVert de Bromocrésol 2008-2009Daniela Dinica100% (1)
- Devoir de Synthèse N°2 2011 2012 (Mtarrab Badr) (Elahd Eljadid Douz)Dokument3 SeitenDevoir de Synthèse N°2 2011 2012 (Mtarrab Badr) (Elahd Eljadid Douz)Moufida ZouaghiNoch keine Bewertungen
- VolumetrieDokument9 SeitenVolumetriebounegabNoch keine Bewertungen
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDokument8 SeitenExercice 1 (7 Points) Cinétique de La Décomposition de L'eau Oxygénéeأمال بلقاسم100% (1)
- TP Dosage Complexometrie3Dokument3 SeitenTP Dosage Complexometrie3Sellam AnisNoch keine Bewertungen
- Noyaux - Masse Et Énergie-Réactions NucléairesDokument4 SeitenNoyaux - Masse Et Énergie-Réactions NucléairesAmine AlaoUii AlaouiNoch keine Bewertungen
- SV1 Chimie1Dokument49 SeitenSV1 Chimie1Yassine ElkaNoch keine Bewertungen
- Physique Nucléaire TD Corr 01Dokument5 SeitenPhysique Nucléaire TD Corr 01bouzerarNoch keine Bewertungen
- CF 15 Juin 2017 Ch. SolDokument2 SeitenCF 15 Juin 2017 Ch. SolAbdelwahed El OuafiNoch keine Bewertungen
- Applications de la spectrophotomérie en phytochimie: sciencesVon EverandApplications de la spectrophotomérie en phytochimie: sciencesNoch keine Bewertungen
- Corr Exo 2 Ds 2010Dokument4 SeitenCorr Exo 2 Ds 2010natsuki-kunNoch keine Bewertungen
- Correction Des Exercices Acides-Bases PDFDokument4 SeitenCorrection Des Exercices Acides-Bases PDFbenkrimaNoch keine Bewertungen
- Equilibre Acido-BasiqueDokument2 SeitenEquilibre Acido-Basiquetiennou.lololNoch keine Bewertungen
- Correction Ds1 Bac SC 2018Dokument3 SeitenCorrection Ds1 Bac SC 2018Anis DahnenNoch keine Bewertungen
- Dc3 Sadiki 2012 MathsDokument5 SeitenDc3 Sadiki 2012 MathsAnis DahnenNoch keine Bewertungen
- Correction Dc2 2017Dokument5 SeitenCorrection Dc2 2017Hiba Ep EzouNoch keine Bewertungen
- ds1 Bac SC 2018Dokument5 Seitends1 Bac SC 2018Anis Dahnen0% (1)
- Revision BacDokument9 SeitenRevision BacAnis Dahnen0% (1)
- Chap. #05 Radioactivité Et Réactions Nucléaires PDFDokument16 SeitenChap. #05 Radioactivité Et Réactions Nucléaires PDFAnis DahnenNoch keine Bewertungen
- TP-PH Solution AqDokument2 SeitenTP-PH Solution AqAnis DahnenNoch keine Bewertungen
- TD Radioacivite 2013 Lsll-WahabDiopDokument4 SeitenTD Radioacivite 2013 Lsll-WahabDiopAnis DahnenNoch keine Bewertungen
- Chap. #05 Radioactivité Et Réactions Nucléaires PDFDokument16 SeitenChap. #05 Radioactivité Et Réactions Nucléaires PDFAnis DahnenNoch keine Bewertungen
- Acide BaseDokument10 SeitenAcide BaseAmeni Slimen100% (1)
- Modulation D'amplitudeDokument3 SeitenModulation D'amplitudeAnis DahnenNoch keine Bewertungen
- Devoir Corrigé de Synthèse N°3 - Sciences Physiques - Bac Informatique (2013-2014) MR ZGUED HICHEM PDFDokument3 SeitenDevoir Corrigé de Synthèse N°3 - Sciences Physiques - Bac Informatique (2013-2014) MR ZGUED HICHEM PDFAnis DahnenNoch keine Bewertungen
- 3sc-Synthèse N°2Dokument2 Seiten3sc-Synthèse N°2Anis DahnenNoch keine Bewertungen
- Dipôles RL - RC - RLC - 2012 - LSLL PDFDokument7 SeitenDipôles RL - RC - RLC - 2012 - LSLL PDFAnis DahnenNoch keine Bewertungen
- Controle #05 Bis, Terminale S, ÉnoncéDokument3 SeitenControle #05 Bis, Terminale S, ÉnoncéAnis DahnenNoch keine Bewertungen
- Détermination de La Constante D'aciditéDokument3 SeitenDétermination de La Constante D'aciditéAnis Dahnen100% (2)
- Contrôle #05 Sciences Physiques, Correction, Année 2000, Terminale SDokument4 SeitenContrôle #05 Sciences Physiques, Correction, Année 2000, Terminale SAnis DahnenNoch keine Bewertungen
- P17 Reactions Nucléaires-WahabDiopDokument8 SeitenP17 Reactions Nucléaires-WahabDiopAnis Dahnen0% (2)
- Contrôle #05 Sciences Physiques, Énoncé, Année 2000 Terminale SDokument2 SeitenContrôle #05 Sciences Physiques, Énoncé, Année 2000 Terminale SAnis DahnenNoch keine Bewertungen
- Datation Au Carbone 14 - Bac Blanc Janvier 2003Dokument6 SeitenDatation Au Carbone 14 - Bac Blanc Janvier 2003Anis DahnenNoch keine Bewertungen
- Correction Dev c2 n2 Bac 2017Dokument3 SeitenCorrection Dev c2 n2 Bac 2017Anis DahnenNoch keine Bewertungen
- Acide Base ExercicesDokument36 SeitenAcide Base Exerciceschaari abdelouahadNoch keine Bewertungen
- 3-Évol Systèmes ÉlectriquesDokument14 Seiten3-Évol Systèmes ÉlectriquesAnis DahnenNoch keine Bewertungen
- 2-Cinetique ChimiqueDokument5 Seiten2-Cinetique ChimiqueAnis Dahnen0% (1)
- Condensateur - Dipôle RCDokument14 SeitenCondensateur - Dipôle RCAnis DahnenNoch keine Bewertungen
- TD 1 & 2 (Ex & Sol)Dokument32 SeitenTD 1 & 2 (Ex & Sol)SLïmàñ ŢaziaNoch keine Bewertungen
- Cours Economie de Projet Tl-2017Dokument124 SeitenCours Economie de Projet Tl-2017jesusatecaoNoch keine Bewertungen
- Hour Mohamed PresentationDokument34 SeitenHour Mohamed PresentationHamza IBAARARENNoch keine Bewertungen
- Leçon III Analyse TechniqueDokument21 SeitenLeçon III Analyse TechniqueOuerghi KarimNoch keine Bewertungen
- TD Andre JelicicDokument59 SeitenTD Andre JelicicTôha MaïgaNoch keine Bewertungen
- IMFCS01Dokument39 SeitenIMFCS01Dang JinlongNoch keine Bewertungen
- Feuille D'excercices N 1 Analyse Num EriqueDokument2 SeitenFeuille D'excercices N 1 Analyse Num Eriquedouo100% (1)
- Cours Mecanique AutoDokument78 SeitenCours Mecanique AutoAkram Ferchichi100% (36)
- Messagerie Esprit - (1ALINFO) - Programme de La Formation 2022 - 2023Dokument4 SeitenMessagerie Esprit - (1ALINFO) - Programme de La Formation 2022 - 2023Safwen SokerNoch keine Bewertungen
- Hydraulique Generale 107-139Dokument33 SeitenHydraulique Generale 107-139Soufiane OuassouNoch keine Bewertungen
- Droit+de+préemption FranceDokument3 SeitenDroit+de+préemption FranceoliviacarenekNoch keine Bewertungen
- Revue Juridque de Madame Hind MajdoubiDokument16 SeitenRevue Juridque de Madame Hind MajdoubizaynabboukhliqNoch keine Bewertungen
- EDO EDP m1-td5-2020Dokument4 SeitenEDO EDP m1-td5-2020Marc TentiNoch keine Bewertungen
- Echtd-TD12 Filtrage LineaireDokument16 SeitenEchtd-TD12 Filtrage LineaireAmine El messrarNoch keine Bewertungen
- 1.4.2 Representation Des Nombres Au Complement Restreint Ou Logique B-1Dokument5 Seiten1.4.2 Representation Des Nombres Au Complement Restreint Ou Logique B-1DialloNoch keine Bewertungen
- Etude Situation Pme MarocDokument8 SeitenEtude Situation Pme MarocRobertoRafsanjani100% (2)
- Developpement SensorielleDokument7 SeitenDeveloppement Sensoriellezoheir ouffroukhNoch keine Bewertungen
- Liste Agréé ContrôleDokument6 SeitenListe Agréé ContrôleMohammed MAAROUFNoch keine Bewertungen
- Les Éolienne Et Leur ÉtymologieDokument4 SeitenLes Éolienne Et Leur ÉtymologieAlex YaddadenNoch keine Bewertungen
- 5b37261d3d9b3 PDFDokument116 Seiten5b37261d3d9b3 PDFIssa KABORENoch keine Bewertungen
- Rapport de PfeDokument122 SeitenRapport de PfeFiras Chaabene100% (3)
- Securite Sociale Destinataire: A Fournir Au Plus Tard Le: Même Avec La Mention NéantDokument2 SeitenSecurite Sociale Destinataire: A Fournir Au Plus Tard Le: Même Avec La Mention Néantrabah hibouchNoch keine Bewertungen
- Inventaire de La Ferme AubergeDokument2 SeitenInventaire de La Ferme AubergeAli SaadNoch keine Bewertungen
- D4.13.Ch3.Exoconduction2 CorrigeDokument7 SeitenD4.13.Ch3.Exoconduction2 Corrigehicham0% (1)
- 141 Ec1vent3aDokument11 Seiten141 Ec1vent3afatma addemiNoch keine Bewertungen
- HD 701s ISO B DC00713Dokument2 SeitenHD 701s ISO B DC00713tazjuan1Noch keine Bewertungen
- Matériaux IfpDokument64 SeitenMatériaux Ifpsinou.25100% (1)
- La Gestion de L'absentéisme Des ÉlèvesDokument79 SeitenLa Gestion de L'absentéisme Des ÉlèvesAnonymous 529Z5GW8Y100% (1)
- TransmissionDokument156 SeitenTransmissionolivierh6580% (5)
- Projet Urbain A NWDokument20 SeitenProjet Urbain A NWwassima mebrekNoch keine Bewertungen